Thymom – možnosti diagnostiky
Thymoma – diagnostics options
Various types of tumors (either benign or malignant) can be found in mediastinum. Early diagnosis and treatment may help to improve survival and quality if life in these patients. Compared to direct mediastinoscopy, used for obtaining a specimen for histological analysis in previous decades, modern imaging methods, specifically the CT navigated biopsy, represent an effective and less invasive approach to the diagnosis. In our publication, we present a patient with thymoma, rather rare type of anterior mediastinum tumor.
Keywords:
mediastinum – CT navigated biopsy – incidentaloma – thymoma
Authors:
Petr Konvička 1; Dan Marek 1; Jiří Habermann 2; Peter Jevík 3; Josef Chudáček 4; Filip Čtvrtlík 5; Jaroslav Michálek 6
Authors‘ workplace:
Interní oddělení nemocnice Přerov
1; Neurologické oddělení nemocnice Přerov
2; Radiologické oddělení nemocnice Přerov
3; I. chirurgická klinika LF UP a FN Olomouc
4; Radiologická klinika LF UP a FN Olomouc
5; Ústav klinické a molekulární patologie LF UP a FN Olomouc
6
Published in:
Vnitř Lék 2020; 66(2): 53-57
Category:
Overview
Tumory předního mediastina zahrnují pestrou škálu maligních i benigních nálezů a jejich včasné došetření může vést ke zlepšení přežití a kvality života pacientů. V naší kazuistice se snažíme prezentovat posun v možnostech diagnostiky tumorů předního mediastina za použití CT navigovaných biopsií s citlivým odběrem materiálu k histologické verifikaci, ve srovnání s přímou mediastinoskopií užívanou v minulých dekádách. Thymom je relativně vzácný nádor předního mediastina.
Klíčová slova:
CT navigovaná biopsie – incidentalom – mediastinum – thymom
Kazuistika
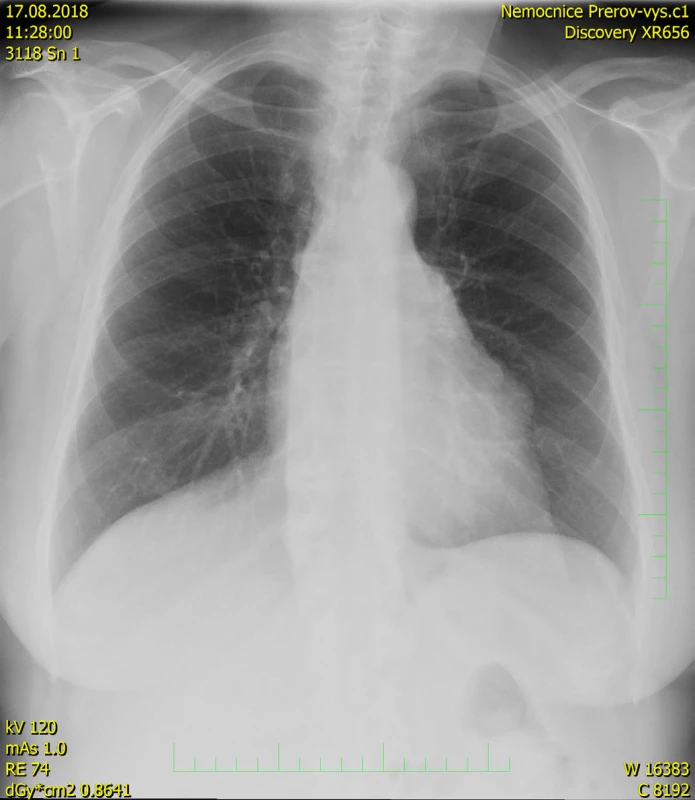
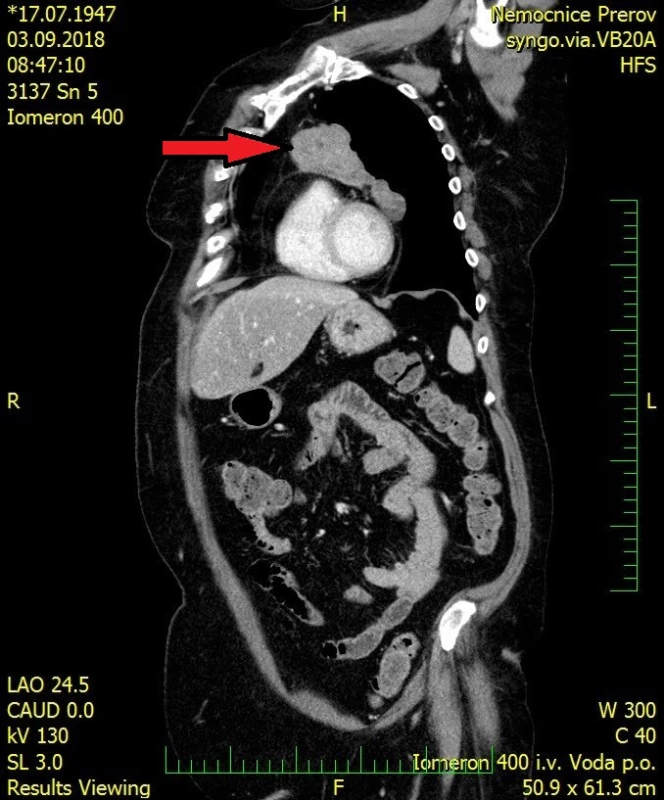
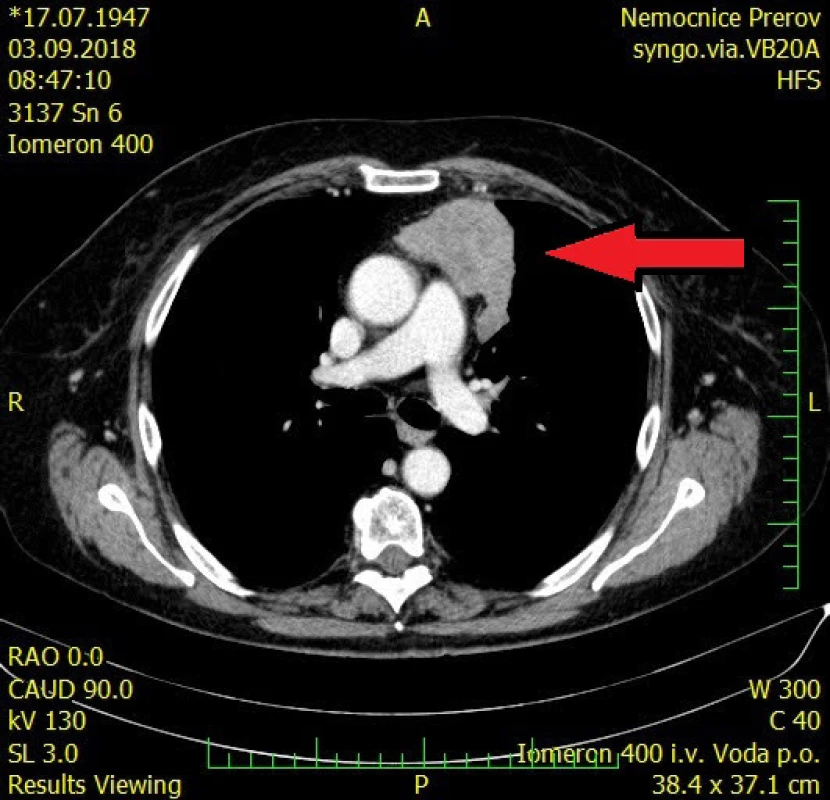
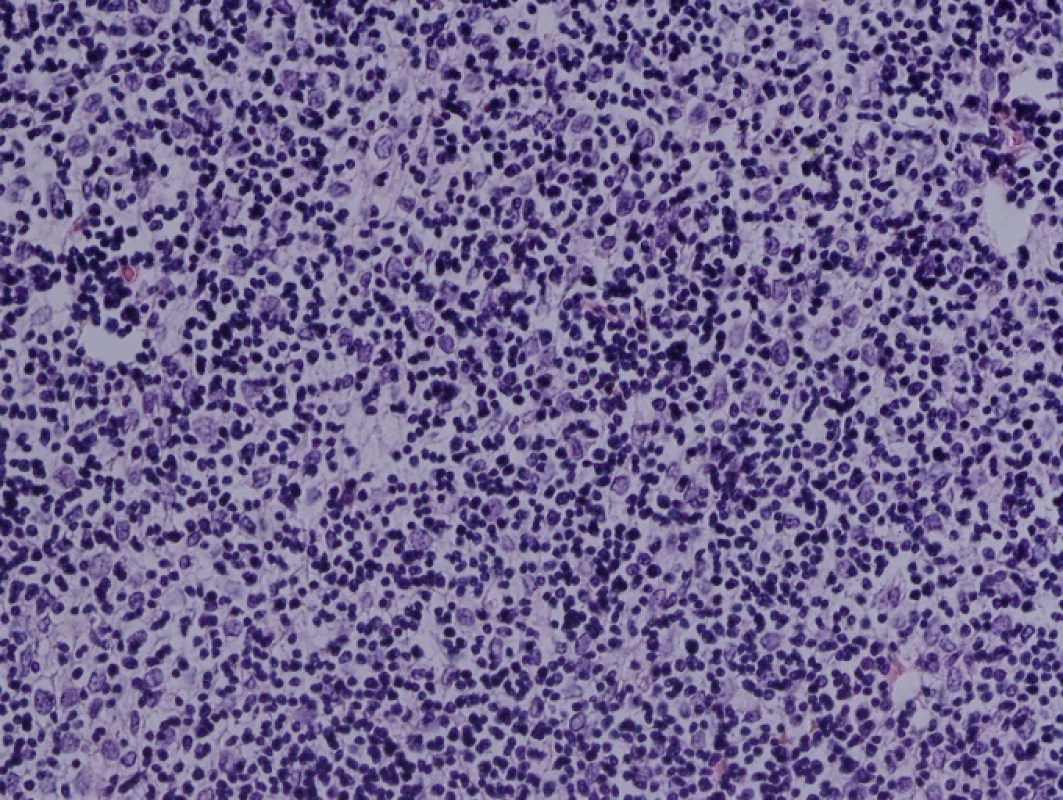
71letá pacientka byla odeslána na interní ambulanci k došetření nejasné hepatopatie a nespecifické dyspepsie. Pacientka je dlouhodobě léčena s diabetem 2. typu, trvale medikuje metformin a glimepirid, v minulosti prodělala cholecystektomii, jinak osobní ani rodinná anamnéza bez pozoruhodností. Fyziologický nález chudý, u pacientky jen lehká nadváha, v odběrech dominuje elevace gamaglutamyltransferázy (GMT) 12,12 μkat/l, alkalické fosfatázy (ALP) 3,02 μkat/l, alaninaminotransferázy (ALT) 6,52 μkat/l a aspartátaminotransferázy (AST) 7,75 μkat/l, jaterní funkce však zachovány, hodnoty bilirubinu, albuminu i koagulačních faktorů v normě. Ostatní biochemická vyšetření v normě, krevní obraz bez patologie ve všech řadách krevních elementů. Doplněna sonografie břišní dutiny, kde obraz suspektní steatózy jater, bez patologie žlučovodů, u pacientky horší přehlednost jater. V rámci vstupního vyšetření proveden i RTG snímek hrudníku, kde zřetelné atypické vyklenutí levé kontury srdečního stínu. Stav pracovně uzavřen jako nealkoholická steatohepatitida, nasazena hepatoprotektiva, dietní režim, proveden screening na virové a autoimunitní hepatitidy, který byl negativní. K vyloučení chronického abúzu alkoholu doplněn odběr karbohydrát deficientního transferinu (CDT), který taktéž negativní. Při kontrolách došlo k postupné regresi hepatopatie. Pro horší sonografickou přehlednost a nejasný nález na RTG snímku hrudníku indikováno vyšetření počítačovou tomografií (CT). Při vyšetření vyloučeny ložiskové změny jater a ostatních orgánů dutiny břišní, ale zjištěna objemná nehomogenní expanze v předním mediastinu v úrovni truncus pulmonalis až parakardiálně vlevo, intimně naléhající na perikard. Pacientka klinicky asymptomatická, není přítomna dušnost, oprese na hrudi, známky útlaku cévních struktur ani chrapot či dysfonie. Cestou I. chirurgické kliniky FN Olomouc provedena nekomplikovaná CT navigovaná biopsie předního mediastina. Histologicky punkční vzorky z mediastina odpovídají thymomu, tvořenému četnými nezralými T-lymfocyty (vykazují pozitivitu TdT, CD1a, CD3, vysoký proliferační index Ki-67 asi 90%), s disperzní až ložiskově splývající epitelovou komponentou (AE1/3 pozitivní), bez nápadnějších cytologických atypií. Místy jsou patrny perivaskulární prostory, s řídkou lymfocytární celulizací. Kolem lymfoepitelových ložisek jsou části fibrózní tkáně, vzhledu fibrózního pouzdra/sept. Imunohistochemicky bez známek pozitivity c-kit, pacientka indikována k operačnímu řešení. Cestou spádové neurologické ambulance provedeno vyšetření k vyloučení myasthenia gravis, elektromyografie neprokázala patologický nález, provedeno vyšetření protilátek proti acetylcholinovému receptoru (Anti-AChR), které bylo negativní. Přistoupeno k operačnímu řešení v celkové anestezii, z podélné mediální sternotomie provedena thymektomie s resekcí části perikardu, extraanatomickou resekcí z horního laloku levé plíce a resekcí n. phrenicus při prorůstání tumoru. Dosaženo resekce R0. Pooperační průběh byl klidný. V definitivní histologii verifikován thymom B1, zaklasifikováno jako pT3, pNx, pMx. Pacientka předána do péče Onkologické kliniky FNOlomouc, kde naplánována radioterapie.
Odborná část
Epidemiologie
Thymomy jsou relativně vzácné nádory, představují pouze 0,2–1,5% ze všech zhoubných nádorových onemocnění, z nádorů mediastina pak tvoří zhruba 20–25%, z nádorů předního mediastina pak 50%, incidence je 0,25–0,32/100 000 (1). Obvyklý věk pro diagnózu je 40–60 let, výskyt u obou pohlaví je přibližně stejný. Nebyly prokázány zevní faktory či endogenní vlivy vedoucí ke vzniku thymomu, nádor vzniká maligní transformací epiteliálních buněk thymu (2).
Klinické projevy
Klinické projevy jsou obvykle způsobeny růstem tumoru, mohou se objevit oprese na hrudi, dušnost, kašel, polykací obtíže, paréza frenického nervu či syndrom horní duté žíly. Thymomy jsou až v 70% spojeny s autoimunitními onemocněními, nejčastější je asociace s myasthenia gravis, která se vyskytuje u 50% procent pacientů s thymomem. U pacientů s myasthenia gravis se pak vyskytuje thymom v 15% případů. U pacientů s thymomem jsou pak častější i další onkologická onemocnění, jmenovitě Kaposiho sarkom, akutní leukemie, mnohočetný myelom, non-hodginský lymfom, sarkomy a jiné karcinomy (kolorektální, plicní). Onemocnění může být provázeno i paraneoplastickými projevy. Mohou být zjištěny hematologické poruchy, jako pancytopenie, aplastická anémie, hemolytická a perniciózní anémie, agranulocytóza, hypogamaglobulinemie (Goodův syndrom) a dysglobulinemie. Další projevy paraneoplastického syndromu jsou vzácnější a zahrnují systémový lupus erythematodes, pemphigus vulgaris, revmatoidní artritidu, Sjögrenův syndrom, ulcerózní kolitidu, polymyozitidu, sklerodermii, senzomotorickou radikulopatii, myokarditidu, nefrotický syndrom, akutní perikarditidu a rovněž endokrinní projevy – tyreoiditidu, panhypopituitarismus, Addisonovu nemoc a Cushingův syndrom (3).
Klinický staging dle Masaoka-Koga (1994) (4)
Stadium I – zcela opouzdřený nádor, bez mikroskopické kapsulární invaze.
Stadium IIa – mikroskopická kapsulární invaze.
Stadium IIb – makroskopická invaze do thymu nebo mediastinální tukové tkáně či pevně přirostlá, ale neprostupující struktura naléhající na mediastinální pleuru či perikard.
Stadium III – makroskopická invaze do okolních orgánů (perikard, velké cévy, plíce).
Stadium IVa – rozsev na pleuru nebo perikard.
Stadium IVb – přítomnost lymfogenních nebo hematogenních metastáz.
International Thymic Malignancy Interest Group (2011)
Stadium I – invaze do, ale nikoliv skrz kapsuli, bez invaze do okolních struktur v případě chybění kapsule.
Stadium IIa – mikroskopická transkapsulární invaze (<3mm).
Stadium IIb – makroskopická invaze do thymu nebo mediastinální tukové tkáně, adherence k pleuře či perikardu s mikroskopicky verifikovanou perithymickou invazí.
Stadium III – mikroskopická invaze do pleury (buď parciální či zcela penetrující), mikroskopická invaze do perikardu (buď parciální do fibrózní vrstvy nebo penetrující do serózní vrstvy), mikroskopická penetrace do vnější vrstvy viscerální pleury či plicního parenchymu, mikroskopicky potvrzená invaze do n. phrenicus či vagus, mikroskopicky potvrzená invaze nebo penetrace do velkých cévních struktur, mikroskopicky potvrzená adherence plic nebo přilehlých orgánů.
Stadium Iva – mikroskopicky potvrzený rozsev na viscerální či parietální pleuru nebo perikard nebo epikardiální struktury.
Stadium IVb – přítomnost lymfogenních nebo hematogenních metastáz.
Histopatologická klasifikace maligních thymomů dle WHO (5)
A – složený z epiteliálních vřetenovitých nádorových buněk bez atypií.
AB – podobný typu A, místy s ohnisky nádorových lymfocytů.
B1 – vzhled normálního kortexu thymu s oblastmi připomínajícími dřeň.
B2 – rozsev epiteliálních nádorových buněk s vezikulárními jádry.
B3 – složený především z epiteliálních buněk s mírnou atypií.
C – thymický karcinom.
Zobrazovací metody
Thymom je často objeven jako náhodný nález při RTG vyšetření hrudníku, na snímku může být zřetelné rozšíření mediastina nebo vyklenutí srdeční kontury. V případě postižení frenického nervu může být na RTG snímku patrná elevace bránice na postižené straně. Doplňující informace poskytne počítačová tomografie, která je schopna přesně posoudit rozsah thymomu, jeho invazi do sousedních orgánů a šíření do okolních cév, event. i metastázy postihující perikard, pohrudnici a plicní parenchym. Magnetická rezonance ještě lépe dokáže vizualizovat event. intimní kontakt či již infiltraci nádoru thymu do aortálního oblouku. U menších thymomů je obtížné odlišení od benigní hyperplazie thymu, který může přetrvávat zejména u adolescentů. Hyperplastický thymus si obvykle zachovává původní tvar brzlíku a má hladké okraje. Thymom se na CT vykresluje jako masa o průměru 1–10 cm, okraje mohou být hladké, ale často bývá laločnatý okraj vycházející z jednoho laloku thymu, i když postižení může být i oboustranné. Masa může být homogenní, ale při nekróze, cystické degeneraci nebo prokrvácení může být obraz nehomogenní. Magnetická rezonance dovede posoudit i pouzdro thymu, jehož kompaktnost je známkou menší agresivity tumoru. K vyloučení vzácného hematogenního rozsevu se užívá sonografie břišní dutiny a scintigrafie skeletu s eventuálním doplněním pozitronové emisní tomografie (PET-CT) (6).
Histologická verifikace
Při nálezu inoperabilního či neresekabilního tumoru předního mediastina, nebo klinickém podezření na lymfom či seminom, je obvykle vyžadována histologizace nálezu, která umožní správnou volbu léčby. V případě příznivé lokalizace je dnes metodou volby CT navigovaná biopsie předního mediastina, je však nezbytné provést odběr silnou jehlou (core needle), zatímco tenkojehlová biopsie se nedoporučuje. Vzhledem k frekventně velmi pestré patologii mediastinálních expanzí je zapotřebí reprezentativní a vícečetná biopsie, někdy však ani opakovaná jehlová biopsie nevede ke konkluzivním závěrům a v tomto případě je v souladu s mezinárodními doporučenými postupy indikována invazivnější metoda, v předním mediastinu obvykle parasternální mediastinotomie, někdy i za pomoci videomediastinoskopie, která je však preferenčně užívána k biopsií expanzí ve středním mediastinu. Toraskopický přístup je oproti mediastinoskopii více zatěžující a hrozí rozsev nádoru na pleuru. Pokud je nález v předním mediastinu dobře ohraničený, snadno resekovatelný a operabilní s přiměřenými riziky, je možné provést histologizaci perioperačně nebo odstranit nádorovou masu a histologizace provést až následně.
Laboratorní vyšetření
Základem je klasické biochemické vyšetření krve v rámci předoperační přípravy, vyšetření krevního obrazu včetně diferenciálního rozpočtu. Při podezření na myasthenia gravis je indikováno vyšetření protilátek proti acetylcholinovému receptoru (Anti-AChR). Při úvaze nad jinými typy hormonálně aktivních nádorů (feochromocytom, neuroblastom, karcinoid, karcinom štítné žlázy aj.) může být přínosné vyšetření hormonální aktivity (7).
Radionuklidová vyšetření
Vyšetření za pomocí radionuklidů může být užitečné v některých případech. Thymom je detekovatelný pomocí thalium chloridu, technecia Tc99m sestamibi (využívané zejména dříve), nyní je preferován izotop 2-(fluorine-18)fluoro -2-deoxy-D-glukóza (FDG), tento poslední izotop je používán při vyšetření pozitronovou emisní tomografií (PET). Slabou aktivitu při PET vyšetření má i benigní hyperplazie thymu, vyšetření nicméně může být přínosné v přítomnosti metastáz ve skeletu či plicích (8).
Diferenciální diagnostika
Diferenciální diagnostika procesů v předním mediastinu zahrnuje jednak onkologické procesy, mezi něž patří thymomy, lymfomy, metastatické karcinomy, benigní či maligní mezenchymální nádory, nádory štítné žlázy či jiné endokrinní nádory, neurogenní nádory, teratom, dále pak nenádorové procesy, jako cysty, hernie, aneuryzmata aorty, sarkoidózu, granulomatózu a zánětlivé lymfadenopatie (9). Diagnózu thymomu podporuje současné koexistence autoimunitní choroby, zejména pak myasthenie gravis. Pokud jsou z klinického obrazu zřejmé B symptomy, tedy teploty, noční poty a nevysvětlitelná ztráta hmotnosti, či pokud je přítomna lymfadenopatie a nebo je elevována laktátdehydrogenáza v séru, je třeba zvažovat možnost lymfomu. Teratom má obvykle heterogenní CT obraz zahrnující cystické a tukové okrsky tkáně. Seminomy mají obvykle velké rozměry a fulminantní nástup obtíží, laboratorně bývá elevace lidského beta choriogonadotropinu u typického seminomu či α-fetoproteinu u neseminomových zárodečných tumorů. Obtížné je odlišení hyperplazie thymu a thymu perzistujícího v dospělém věku. Na možnost hyperplazie thymu je vhodné myslet v případě symetrické expanze s nízkou denzitou v CT obraze a při známkách tukových struktur thymu (10).
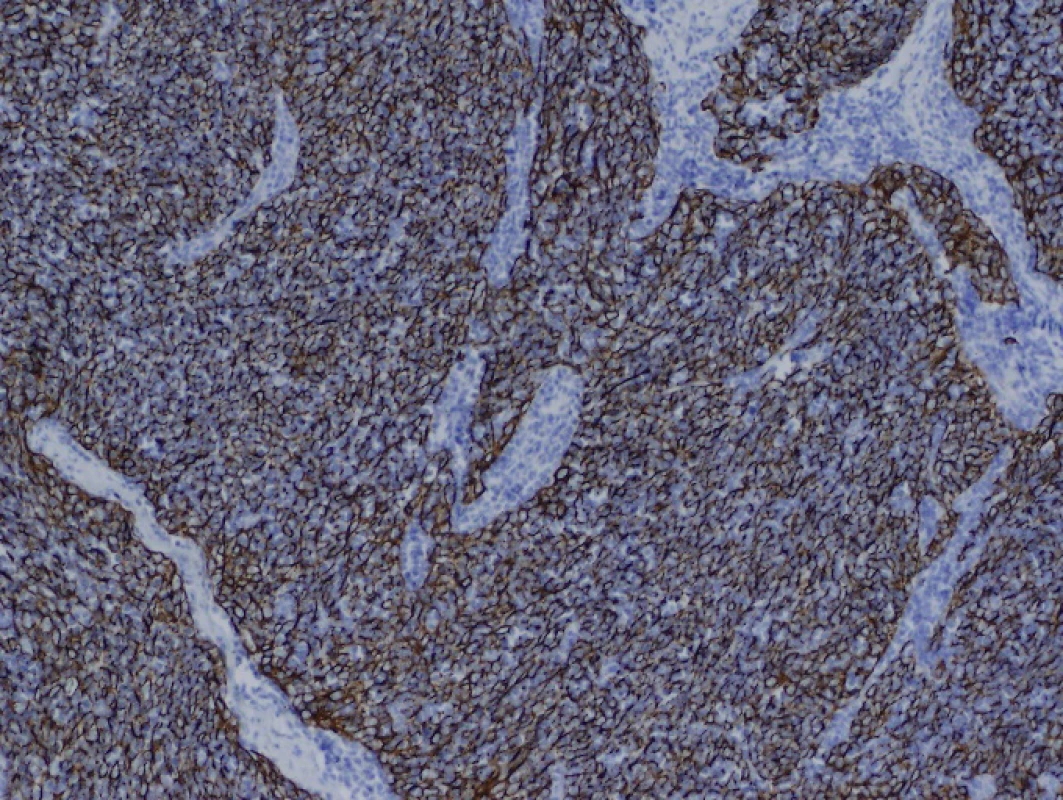
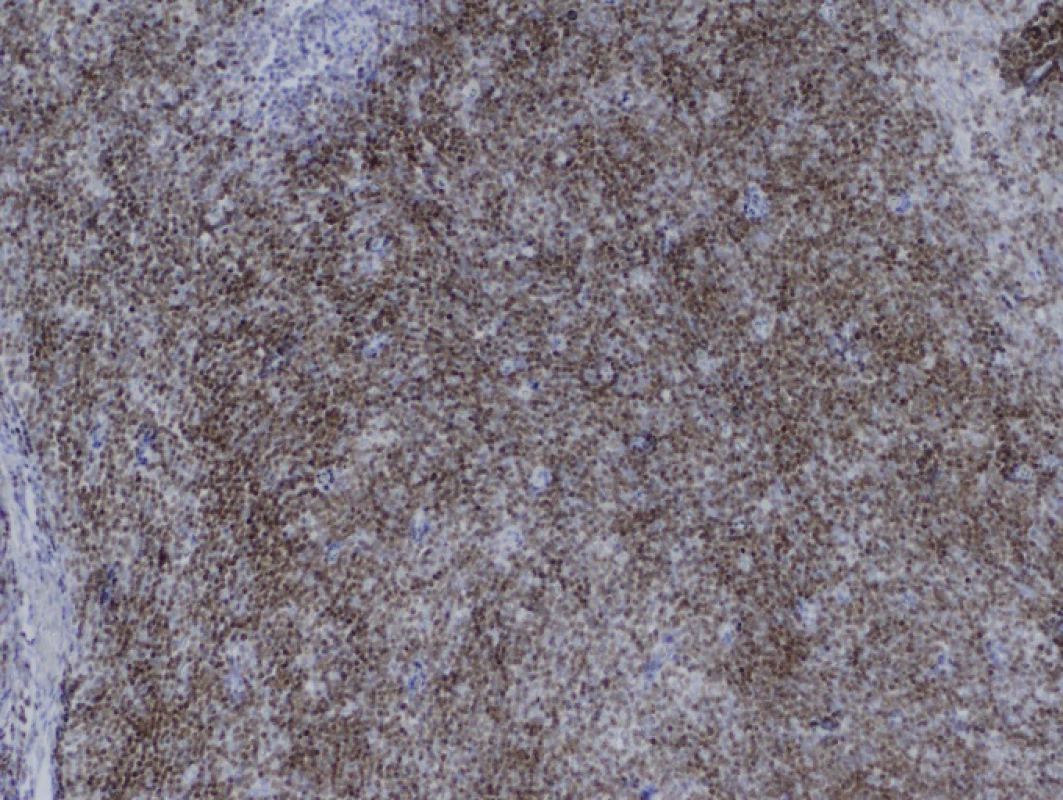
Léčba
Pro prognózu pacienta je zásadní kompletní chirurgická resekce thymomu. Podle dosažené kompletnosti je resekce hodnocena jako kompletní resekce (R0), resekce s mikroskopickým reziduálním onemocněním (R1) a makroskopické reziduální onemocnění (R2). Tuto radikální léčbu je možno indikovat ve stadiu I a II. U nemocných, kde bylo dosaženo kompletní resekce nádoru, přežívá deset let 81–98 %. Peroperačně by mělo být posouzeno šíření tumoru do okolí (11).
U nemocných s myasthenia gravis s prokázaným thymomem je indikováno chirurgické odstranění celého brzlíku. U pacientů s vážnou formou onemocnění, u nichž thymom nebyl prokázán a léčba nevede ke zvládnutí onemocnění nebo jsou těžké projevy onemocnění, vede thymektomie ve velké většině ke zlepšení příznaků onemocnění. Proto je thymektomie indikována u všech nemocných s myastenií (12). Tito pacienti jsou ale rizikovější stran perioperačních komplikací, kdy může dojít k život ohrožujícím komplikacím v důsledku insuficience dechového svalstva, proto je důležité dosažení co nejlepší kontroly myasthenických příznaků a zajištění kvalitní respirační podpory v pooperačním období (13).
Nejednoznačné jsou výsledky chirurgického řešení lokálně pokročilých thymomů ve stadiu III a IV, v těchto stadiích je metodou volby chemoterapie (stadia IVa, IVb), ale i v kombinaci s radioterapií v rámci předoperační neoadjuvantní léčby u lokalizovaného, ale lokoregionálně pokročilého onemocnění (stadium III) (14).
Thymom je relativně radiosenzitivní nádor, ozařováním lze docílit podstatného zmenšení tumorózní masy, nikoliv však plné eradikace. Za standard je považována adjuvantní (pooperační) radioterapie u kompletně či nekompletně resekovaných thymomů stadia III nebo IV (15).
Prognóza
Za jeden z nejdůležitějších nezávislých prognostických faktorů dlouhodobého přežití a rizika recidivy je považováno stadium nemoci. Pětileté přežití v závislosti na stadiu je > 90 % pro stadium I, 86 % pro stadium II, 70 % pro stadium III a 50 % pro stadium IV. Samostatným prognostickým faktorem může být i histologický typ thymomu a operabilita pacienta se snahou o dosažení R0 resekce. Další prognózu také ovlivňují přidružená autoimunitní a systémová onemocnění (16).
Závěr
Naše kazuistika poukazuje na důležitost interpretace a došetřování asymptomatických vedlejších nálezů při rutinním skiagrafickém vyšetření hrudníku. Na případu této pacientky dokumentujeme miniinvazivní možnosti diagnostiky tumorů předního mediastina. Ve starší literatuře byly jako metody volby při průkazu tumorózní masy předního mediastina uváděny mediastinoskopie nebo mediastinotomie (17). Tyto metody přinášely poměrně velkou zátěž pro pacienty a jejich indikace byly předmětem důkladného zvažování rizik a přínosu pro pacienta. Na případu naší pacientky se snažíme poukázat na přínos méně invazivních metod, které vedly k průkazu thymomu. Díky správně vedené diagnostice a následné radikální léčbě lze počítat s dobrou prognózou v dalším pooperačním období. S ohledem na povahu a možnosti léčby jednotlivých onemocnění předního mediastina vidíme v CT navigované biopsii výrazný přínos v diagnostice těchto procesů.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Petr Konvička, Ph.D.,
Interní oddělení nemocnice Přerov
Dvořákova 75,
751 52 Přerov
Cit. zkr: Vnitř Lék 2020; 66(E-2): e19–e23
Článek přijat redakcí: 7. 2. 2019
Článek přijat k publikaci: 20. 10. 2019
Sources
1. www.svod.cz
2. Klener P, Petruželka L. Nádory thymu. In: Klener P Klinická onkologie. Praha: Galén 2002, 392–394.
3. Jakubíková L, Merta Z. Thymom. In: Skřičková J, Kolek V Základy moderní pneumoonkologie. Praha: Maxdorf Jessenius 2012; 383–389.
4. https://www.itmig.org/sites/default/files/ITMIG%20Standards-English.pdf
5. Rosai J, Sobin L. Histological typing of tumours of the thymus, 2nd edition. In: Health Organization, International Histological Classification of tumours. New York, Berlin: Springer 1999 : 9–14.
6. Sonobe S, Miyamoto H, Izumi H, et al. Clinical usefulness of the WHO histological classification of thymoma. Ann Thorac Carciovasc Surg 2005; 11 : 367–373.
7. Detterbeck FC, Nicholson AG, Kondo K, et al. The Masaoka-Koga stage classification for thymic malignancies: clarification and definition of terms. J Thorac Oncol 2011; 6: (7 Suppl. 3): S1710–S1716.
8. Marcelo FK, Benveniste ML, et al. Role of Imaging in the Diagnosis, Staging, and Treatment of Thymoma. Radio Graphics 2011; 31 : 1847–1861.
9. Klener P Klinická onkologie. 1. vydání. Praha: Galén 2002, 391–395.
10. https://www.esmo.org/Guidelines/Lung-and-Chest-Tumours/Thymic-Epithelial-Tumours
11. NCCN. Clinical Practice Guidelines in Oncology: Thymoma and Thymic Carcinoma. V 2. 2011. Available at http://www.nccn.org/professionals/physician_gls/pdf/ thymic. pdf
12. Huang J, Riely GJ, Rosenzweig KE, et al. Multimodality therapy for locally advanced thymomas: state of the art or investigational therapy Ann Thorac Surg 2008; 85 : 365–367.
13. Wright CD, Kessler KA. Surgical treatment of thymic tumors. Semin Thorac Cardiovasc Surg 2005; 17 : 20–26.
14. Sperling B, Marshall J, Kennedy R, et al. Thymoma: a review of the clinical and pathological findings in 65 cases. Can J Surg 2003; 46 : 37–42.
15. Čoupek P, Slávik M. Nádory mediastina. In: Hynková L, Šlampa P et al. Radiační onkologie - učební texty. Brno 2009, 242.
16. Kim HK, Choi YS, Kim J, et al. Type B thymoma: Is prognosis predicted only by World Health Organization classification? J Thorac Cardiovasc Surg 2010; 139 : 1431–1435.
17. Klener P. Vnitřní lékařství. 4. přepracované a doplněné vydání. Praha: Galén, 1999, 2001, 2006, 2011, 420.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2020 Issue 2
-
All articles in this issue
- Incretin-based treatment of diabetes and cardiovascular complications
- The position of SGLT2 inhibitors in current medicine
- Obesity and cardiovascular disease
- Diabetic foot
- Diosmin/hesperidin: a cooperating tandem, or is diosmin crucial and hesperidin an inactive ingredient only?
- Blood vessel ageing and vascular memory
- Clinical aspects of epicardial fat deposition
- Adipocytokines and thyreopathies
- Thymoma – diagnostics options
- Clostridium difficile Infection: an update on treatment and prevention
- Hypoxemia/hypoxia and new concepts of oxygen therapy in intensive care
- Celiac disease in adults
- Cushing’s syndrome and acromegaly based on picoadenoma of the pituitary gland
- Inherited C2-complement deficiency: variable clinical manifestation (case reports and review)
- Differential diagnosis of hypoglycemia
- What is new for internists in ESC guidelines on diabetes?
- Diabetes a kardiovaskulární onemocnění
- Epidemiologie infekcí vyvolaných Clostridium difficile (CDI) v České republice
- Extraintestinální projevy celiakie
- RECENZE KNIHY ÚVOD DO VNITŘNÍHO LÉKAŘSTVÍ – doc. MUDr. Jitka Mlíková Seidlerová, Ph.D., a kol.
- Pioglitazone
- Relation between testosterone levels and body composition, physical functioning and selected biochemical parameters in adult males
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Differential diagnosis of hypoglycemia
- Hypoxemia/hypoxia and new concepts of oxygen therapy in intensive care
- Thymoma – diagnostics options
- Diosmin/hesperidin: a cooperating tandem, or is diosmin crucial and hesperidin an inactive ingredient only?
