Etiologie a management dyslipidemie u pacientů s chronickým onemocněním ledvin
Dyslipidemia in patients with chronic kidney disease: etiology and management
The worldwide population is burdened with chronic kidney disease (CKD) from 10–13 %. Patients with CKD subsequently die to cardiovascular disease (CVD) and their complications. In the Czech population, in 2016, the number of patients with end stage renal disease (ESRD) on regular dialytic treatment was 6 739, or 674/1 000 000 inhabitants. Overall mortality in regular dialysis treatment patients was 18.4 % in 2016, of which 43 % died of cardiovascular complications. In view of this fact, a number of expert groups are concerned, among other things, with the problems of lipid metabolism disorders, with the aim of finding a common predictive marker (preferably also therapeutically qualifiable) to stratify patients dialyzed or potentially indicating hypolipidemic therapy. The aim of possible interventions is to minimize cardiovascular risk and subsequent complications resulting from cardiovascular disease (CVD), thus improving the quality of life of regular dialysis treatment patients.
Keywords:
dyslipidemia – chronic kidney disease – hypolipidemic therapy – regular dialysis treatment
Authors:
Magdaléna Dušejovská 1,2; Marek Vecka 2; Ivan Rychlík 3; Aleš Žák 2
Authors‘ workplace:
Dialyzační středisko Fresenius Medical Care Praha 10 – Královské Vinohrady
1; IV. interní klinika 1. LF UK a VFN Praha
2; I. interní klinika 3. LF UK a FN Královské Vinohrady Praha
3
Published in:
Vnitř Lék 2020; 66(5): 275-281
Category:
Overview
Celosvětová populace je zatížena chronickým onemocněním ledvin (chronic kidney disease – CKD) z 10–13 %. Pacienti s CKD následně ve zvýšené míře umírají na kardiovaskulární onemocnění (cardiovascular disease – CVD) a jejich komplikace. V České republice v roce 2016 dosáhl počet pacientů s terminálním renálním selháním (end stage renal disease – ESRD) závislých na pravidelné dialyzační léčbě (PDL) 6 739, což představuje 674/1 000 000 obyvatel. Celková mortalita pacientů v PDL byla v roce 2016 18,4 %, z toho 43 % pacientů zemřelo na kardiovaskulární komplikace. Vzhledem k této skutečnosti se řada odborných skupin zabývá mimo jiné i problematikou poruch metabolismu lipidů s cílem najít společný prediktivní marker (nejlépe i terapeuticky ovlivnitelný), který by dialyzované pacienty stratifikoval, event. indikoval k hypolipidemické terapii. Cílem možných intervencí je, co nejvíce snížit kardiovaskulární riziko a následné komplikace vyplývající z kardiovaskulárních onemocnění (CVD) a zlepšit tak kvalitu života pacientů v PDL.
Klíčová slova:
dyslipidemie – hypolipidemická terapie – chronické onemocnění ledvin – pravidelná dialyzační léčba
Úvod
Pacienti s terminálním selháním ledvin (end stage renal disease – ESRD) jsou dependentní na náhradě funkce ledvin, mezi které patří hemodialýza (HD), peritoneální dialýza (PD) a transplantace ledviny (TxL). Pacienti závislí na určitém typu hemoeliminační metody mají již v rámci konzervativní terapie vyčerpaná režimová opatření (dieta s restrikcí draslíku, fosforu, mnohdy i diabetická), fyzická aktivita u mnohých pacientů není možná vzhledem ke kardiovaskulárním (ICHS, ICHDK a dalším), ortopedickým (artropatie) či jiným přidruženým chorobám nebo stavům (postdialyzační hypotenze). Naše pozornost se tudíž obrací k možné farmakoterapii dyslipidemie. Pro tuto v současné době platí doporučení pracovní skupiny Lipid Work Group KDIGO iniciativy (Kidney disease: Improving Global Outcomes) z roku 2013, která doporučují lékařům pečujícím o pacienty s pokročilou CKD ve stadiu G3–5 terapii statiny nebo kombinační terapii statin/ezetimib zachovat. U pacientů v PDL navrhují hypolipidemickou terapii nezahajovat, pokud však tato byla zahájena v méně pokročilých stadiích CKD, tuto pak nevysazovat (1).
Etiopatogeneze dyslipidemie u pacientů s chronickým onemocněním ledvin
Hemodialýza je intermitentní hemoeliminační metoda, která z velké části nahrazuje exkreční funkci ledvin u pacientů s ESRD. Při této proceduře dochází k odstraňování uremických toxinů, β2-mikroglobulinu a dalších látek pomocí semipermeabilní membrány (2). Hemodialýza je pro pacienty s ESRD životně nezbytná, nicméně zároveň přispívá k rozvoji řady patofyziologických dějů, které vedou ke zvýšení oxidačního stresu, chronické zánětlivé odpovědi a progresi aterosklerotických změn. Tyto změny přispívají k rozvoji a manifestaci kardiovaskulárních komplikací, které se ve značné míře podílí na předčasném úmrtí pacientů v pravidelném dialyzačním léčení (PDL). Progrese aterosklerotických změn u pacientů s CKD je ovlivněná jak konvenčními (Framinghamskými), tak novými rizikovými faktory (Tab. 1) a jejich vzájemnou kombinací.
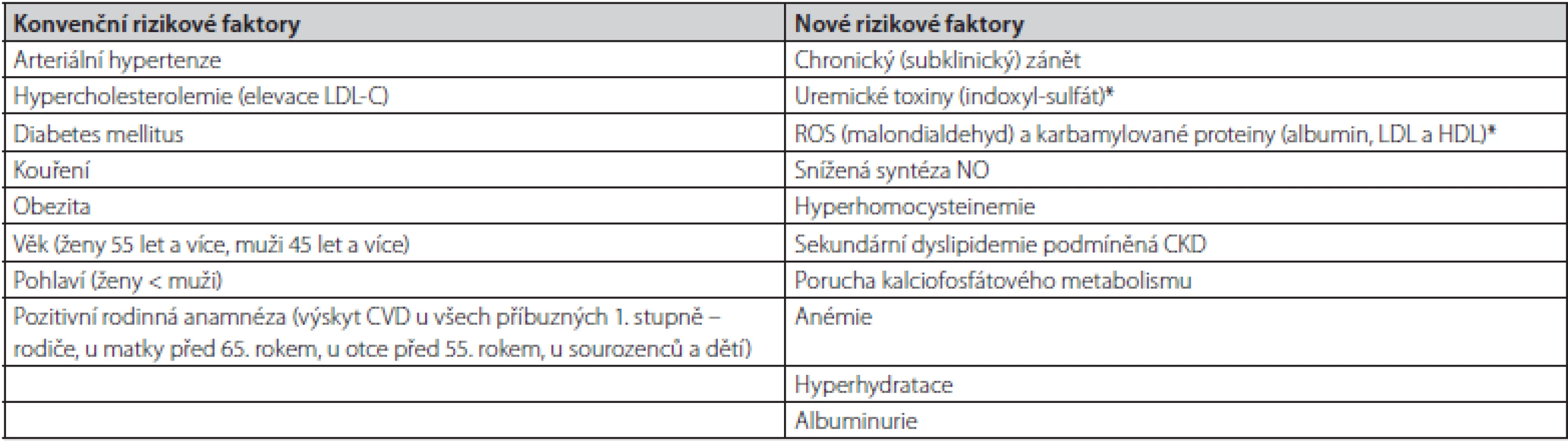
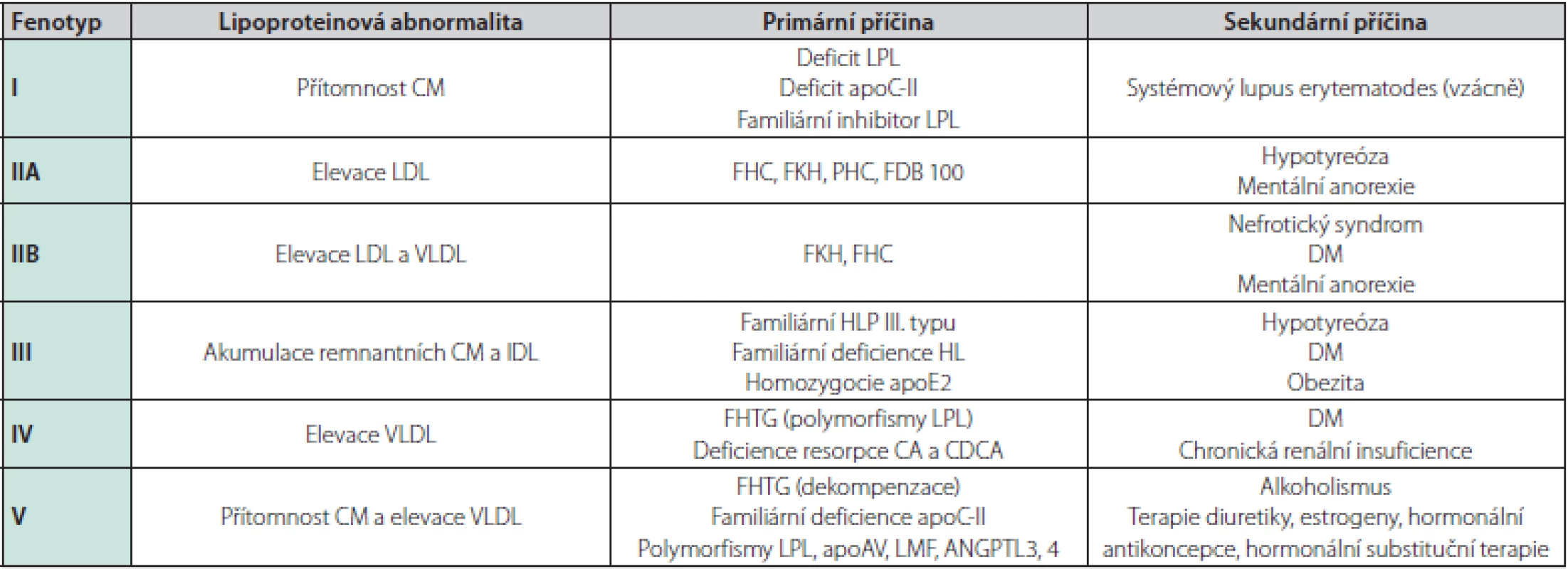
Obecně se poruchy metabolismu lipoproteinů rozdělují na primární a sekundární (Tab. 2). Ve skupině pacientů s ESRD se vyskytují pacienti, jak s fenotypy primárních poruch metabolismu lipoproteinů (autozomálně dominantní hypercholesterolemie), tak sekundárními, jež jsou u pacientů s CKD častější. Další dělení, které je možné v klinické praxi využít, je dle převažujícího lipoproteinového fenotypu – hypercholesterolemie, hypertriglyceridemie a smíšené dyslipidemie.
Změny lipidového metabolismu pacientů v pravidelném hemodialyzačním programu
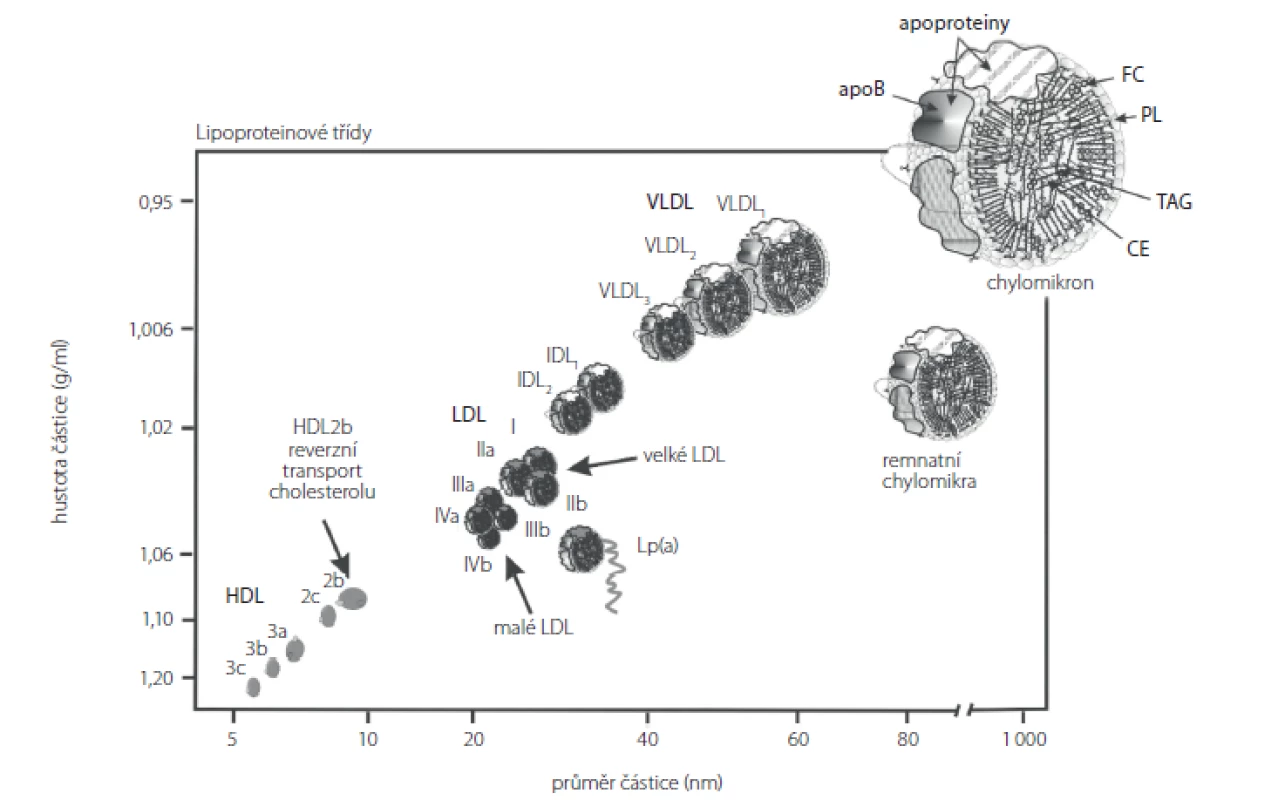
Pacienti v chronickém HD programu mají typický lipidogram charakterizovaný zvýšením koncentrace VLDL a IDL. Ve frakci VLDL je přítomen apoB-48, což svědčí pro přítomnost remnantních chylomikronů. Vzestup koncentrací triacylglycerolů (TAG) je spojen s poklesem koncentrací HDL‑cholesterolu (HDL‑C); částice HDL jsou zároveň bohatší na TAG než u zdravých jedinců. Hladiny LDL‑cholesterolu (LDL‑C) mívají tito pacienti často ve fyziologickém rozmezí nebo snížené s převahou malých denzních LDL (sd‑LDL) (Obr. 1). Malé denzní LDL (sd‑LDL) jsou schopny proniknout do cévní stěny, kde ve zvýšené míře podléhají oxidační modifikaci (7–9). Malé denzní LDL jsou odpovědné za narušení endotelu. Po jeho poškození se váží na proteoglykany extracelulární matrix v arteriální intimě (10).
Koncentrace apoC‑II klesají, koncentrace apoC‑III mají opačný trend. Další změnou v lipoproteinovém metabolismu patrnou u dialyzovaných jsou vyšší koncentrace lipoproteinů(a) (Lp(a)) (11). Jedná se o modifikovanou částici LDL, která obsahuje apo(a) vázané disulfidickým můstkem na apoB100. Zvýšené koncentrace malých isoforem Lp(a) jsou považovány za rizikový faktor pro CVD a zároveň jsou obtížně terapeuticky ovlivnitelné (12). Zvýšené koncentrace Lp(a) u pacientů s CKD jsou pravděpodobně zapříčiněny jeho zpomaleným katabolismem, který probíhá v ledvinách, a při jejich zhoršené funkci je zpomalen (11). Po úspěšné transplantaci štěpu ledviny se koncentrace Lp(a) snižuji (13). Zvýšené plazmatické koncentrace Lp(a) u pacientů v HD programu korelují s parametry chronického zánětu – vysoce senzitivního CRP (hs‑CRP) a interleukinu 6 (IL6) (14).
Mezi další změny lipoproteinového metabolismu u pacientů v PDL patří modifikace HDL částic. HDL částice jsou v populaci pacientů bez CKD považovány za kardioprotektivní. Mají pleiotropní působení. Primárně hrají důležitou funkci v reverzním transportu cholesterolu, dále působí protizánětlivě, antitrombogenně a antioxidačně. Reverzní transport cholesterolu je proces odpovědný za přenos cholesterolu z periferních tkání (včetně arteriální stěny) do jater, a je považován za jeden z nejvýznamnějších kardioprotektivních mechanismů HDL částic. V organismu je zajišťována cholesterolová homeostáza. Toto se děje tak, že influx cholesterolu je vyvážen jeho efluxem. Oxidativně modifikované LDL (obsahující oxidované lipidy) jsou vychytávány scavengerovými receptory. Cholesterolový eflux probíhá několika dráhami. Během zpětného transportu cholesterolu dochází k přesunu přebytku cholesterolu z periferních pěnových buněk (makrofágy obsahující lipidy) nacházejících se v aterosklerotickém plaku, do plazmy a odtud do jater, ze kterých jsou přeneseny do střeva a vyloučeny stolicí jako steroly nebo po metabolické konverzi jako žlučové kyseliny (15). U pacientů v PDL jsou všechny tyto funkce narušené. HDL částice obsahují akumulované oxidované lipidy, které následně vedou k inhibici antioxidačních enzymů lokalizovaných na HDL (zejména paraoxonázy 1), mění strukturu apo AI a tím snižuji či vyřazuji hlavní funkci HDL (reverzní transport cholesterolu přes ABCA 1transportér). Tyto přispívají k tvorbě oxidovaně modifikovaných LDL a vaskulárnímu zánětu (16). Snížení aktivit enzymů – paraoxonázy 1 (PON)1, syntázy oxidu dusnatého (NO) a lecitin‑cholesterol‑acyltransferázy (LCAT) prohlubuje další dysfunkci HDL částic u pacientů s CKD. Tyto dysfunkční HDL jsou ve zvýšené míře odpovědné za oxidaci fosfolipidů, akumulaci sérového amyloidu A (SAA) a CRP s následnou indukcí produkce cytokinů monocyty a dendritickými buňkami. Současně dojde v HDL k výměně apoAI za SAA; volný apoAI je katabolizován ledvinami. Částice HDL ochuzené o apoAI mají nižší schopnost vázat cholesterol v periferních tkáních, čímž je ochromena počáteční fáze reverzního transportu cholesterolu (17–19).
U dialyzovaných pacientů neplatí obecně známý předpoklad, že vyšší koncentrace HDL ‑ C jsou asociovány s nižším rizikem rozvoje CVD, protizánětlivým a antikoagulačním působením, rovněž jejich antioxidační funkce je alterována (15, 20, 21). Kromě výše popsaných změn se u pacientů s CKD uplatňuje „cholesterolový paradox“; u běžné populace koreluje kardiovaskulární mortalita pozitivně s hladinami celkového cholesterolu (TC), zatímco u pacientů s ESRD je tento vztah opačný. Tento inverzní vztah je dáván do souvislosti s chronickým zánětem ve spojení s malnutricí (syndrom MIA – malnutrition, inflammation, anorexia). Podstatná část dialyzovaných pacientů má syndrom MIA spojený s vaskulárními kalcifikacemi (syndrom MIAC – malnutrition, inflammation, anorexia, calcification) (22). Chronický zánět je důsledkem oxidačního stresu. Na něm se podílí nejen poruchy antioxidačních enzymů, ale i působení uremických toxinů a sekundární dyslipoproteinemie. Modifikované lipoproteinové částice změnou koncentrace či dysfunkci přispívají k prohloubení chronického zánětů. Dále se na alteraci antioxidačního potenciálu podílí nedostatek stopových prvků (selen, zinek, měď) jako kofaktorů antioxidačních enzymů; významným zdrojem reaktivních forem kyslíku a dusíku je i kontakt krevních elementů s hemodialyzační membránou.
Algoritmus vyšetření
Ambulantní management nemocných s CKD by měl zahrnovat mimo pravidelnou nefrologickou péči také důslednou prevenci rizikových faktorů CVD včetně poruch metabolismu lipidů. To znamená spolupráci nefrologa s lipidologem. Lipidolog se uplatňuje při diagnostice primární, sekundární poruchy metabolismu lipidů i detekci subklinického CVD (Dopplerovské ultrazvukové vyšetření magistrálních tepen, včetně intimomediální vrstvy). Následně doplní pomocná laboratorní vyšetření (stanovení apolipoproteinů, ELFO lipoproteinů, molekulárně‑genetické vyšetření ve spolupráci s genetikem). Rovněž má širší možnosti hypolipidemické terapie v návaznosti na úhradu z veřejného zdravotního pojištění (kombinační terapie, biologická terapie), řešení statinové intolerance (doporučení vhodných potravinových doplňků – ω-3-mastných kyselin a dalších doplňků), ve specializovaných centrech pak může případně indikovat a provést LDL aferézu zejména u pacientů s autozomálně dominantní hypercholesterolemií, jež např. netolerují statiny nebo mají kontraindikaci pro jejich podání (závažné hepatopatie).
Režimová opatření
Režimová opatření stran dyslipidemie jsou u pacientů s pokročilým CKD značně omezená. Většina pacientů má v predialyzačním stadiu dietu s omezením bílkovin. V dialyzačním stadiu se doporučuje pokračovat v dietě s omezením draslíku, fosforu a tekutin. Speciální doporučení se týkají nemocných s CKD a přítomným diabetes mellitus (DM). Řada pacientů má v rámci diabetické diety restrikci sacharidů. Tudíž dieta s omezením cholesterolu se dostává do pozadí. Fyzická aktivita je možná jen u pacientů, kteří jsou v dobré fyzické kondici. Většina pacientů v pokročilé fázi renálního onemocnění má řadu komorbidit a z nich vyplývajících symptomů, které jim fyzickou aktivitu znemožňuji (dušnost, slabost, křeče, bolesti kloubů a další).
Farmakoterapie
Statiny (dle účinnosti rosuvastatin, atorvastatin, simvastatin, lovastatin, fluvastatin)
Jsou heterogenní skupinou látek, které kompetitivně inhibují 3-hydroxy - 3-metylglutaryl‑CoA (HMG‑CoA) reduktázu. Snížení intracelulární koncentrace cholesterolu v játrech zvyšuje expresi LDLR, která ústí ve zvýšené vychytávání LDL a dalších LP obsahujících apoB (IDL, malé VLDL). Statiny jsou indikovány u všech typů DLP se zvýšenými koncentracemi LDL ‑ C (LDL ‑ C 3,40 mmol/l), tj. u izolované hypercholesterolemie a smíšené hyperlipidemie. U smíšené hyperlipidemie je předpokladem vhodnosti statinu jako léku první volby koncentrace TAG < 5,17 mmol/l. Statiny se liší farmakokinetikou (absorpce, biologická dostupnost, vazba na bílkoviny, jaterní biotransformace cestou cytochromu P450). Mezi nežádoucí účinky patří myopatie (u 5–10 % léčených), elevace jaterních testů (< 2 %) a zvýšené riziko DM (10 %). Prospěch z léčby statiny na globální KV riziko je zhruba 9× vyšší než KV riziko asociované s DM. Cílem léčby statiny je dosažení cílové koncentrace LDL‑C, podle kategorie rizika pro CVD, nebo alespoň 50% pokles LDL‑C při podávání maximálně tolerovatelné dávky. V kardiovaskulární prevenci mají významnou úlohu i pleiotropní účinky statinů – pozitivní ovlivnění endoteliální dysfunkce, antioxidační, antiinflamatorní, antiproliferační a antitrombogenní působení.
Pokud jde o typy statinů a renální funkce, zdá se, že atorvastatin je výhodnější než rosuvastatin (23, 24). Crouse v randomizované kontrolní studii (METEOR) popisuje, že větev pacientů s rosuvastatinem měla větší redukci lipidového profilu a současně vykazovala signifikantní snížení odhadované glomerulární filtrace (estimated glomerular filtration rate – eGFR), ve srovnání se skupinou pacientů zařazených do větve s atorvastatinem (23). V jiné studii byla redukce eGFR u skupiny léčené atorvastatinem menší než u skupiny léčené rosuvastatinem (23). S tímto faktem je tedy nutné u pacientů s CKD počítat a v hypocholesterolemické léčbě preferovat atorvastatin. Pokud je nutné použít rosuvastatin, je třeba začít terapii nízkými dávkami. U pacientů s pokročilým poklesem eGFR pod 30 ml/min/1,73 m² (CKD ≥ 4) rosuvastatin není doporučen vůbec. Su a Zhang provedli v roce 2016 metaanalýzu 54 studií, ve kterých byl podáván statin pacientům s různými stadii CKD. Závěrem této práce bylo shrnutí, že léčba statinem nezhoršuje riziko výskytu selhání ledvin u dospělých s CKD, kteří nejsou dependentní na PDL. Mohou mírně snížit proteinurii a rychlost progrese CKD. Kromě toho léčba statinem významně snížila riziko kardiovaskulárních příhod o 31 % u pacientů s CKD (25). Fluvastatin je preferenčně využíván v případech, kdy primární renální diagnóza vyžaduje použití imunosupresiv. Fluvastatin je metabolizován přes cytochromy CYP 2C9, 3A4, 2D6, 2C8. Je nejméně účinný stran CVD prevence, nicméně v této indikaci má své opodstatnění vzhledem k minimálním lékovým interakcím (imunosuprese, antibiotická a antimykotická terapie). V současné době zatím platí pro hypolipidemickou terapii doporučení pracovní skupiny Lipid Work Group KDIGO iniciativy (Kidney disease: Improving Global Outcomes) z roku 2013, která doporučují lékařům pečujícím o pacienty s CKD G3–5 terapii statiny nebo kombinační terapii statin/ezetimib zachovat. U pacientů v PDL navrhují hypolipidemickou terapii nezahajovat. Pokud však léčba byla zahájena v méně pokročilých stádiích CKD, doporučuje se v léčbě pokračovat (1).
Fibráty (fenofibrát, ciprofibrát)
Jsou lékem první volby u nemocných s TAG > 5,20 mmol/l. Snižují koncentrace TAG o 20–50 %, zvyšují koncentrace HDL ‑ C a mají variabilní účinek na hladinu LDL‑C. Jsou agonisté nukleárních receptorů metabolismus. Jejich hypolipidemický účinek je důsledkem urychleného katabolizmu lipoproteinů bohatých TAG (TRL) (v důsledku aktivace LPL a snížené exprese apoC ‑ III) v kombinaci s potlačením syntézy TAG. Podávání fibrátů příznivě ovlivňuje lačnou i postprandiální HTAG, zvyšuje HDL ‑ C a snižuje zastoupení sd‑LDL. V primárně a sekundárně preventivních studiích měly největší prospěch z podávání fibrátů osoby s HTG, poklesem HDL ‑ C a poměrem LDL‑C/ HDL‑C > 5,0, včetně nemocných s aterogenní dyslipidemií. U pacientů s CKD měla terapie fenofibrátem za následek zvýšení hladin kreatininu v séru a sníženou rychlost glomerulární filtrace v primární prevenci (26). Proto je nutno během podávání fibrátu pravidelné sledování renálních funkcí. Existuje několik hypotéz týkajících se mechanismů, na nichž je založena nefrotoxicita spojená s fenofibrátem. Fenofibrát může zhoršit tvorbu vazodilatačních prostaglandinů, což vede k hemodynamickým změnám. Výsledkem je snížení intraglomerulárního tlaku a pokles glomerulární filtrace (27–29). Alternativně může fenofibrát kompetitivně inhibovat sekreci kreatininu v proximálním tubulárním lumenu (30–32) nebo zvýšit produkci endogenního kreatininu (33). Ukazuje se, že podávání fibrátů oddaluje u DLP vývoj IGT a vznik DM2T. Fenofibrát snižuje albuminurii u DM2T a brání rozvoji diabetické retinopatie. Mezi nežádoucí účinky fibrátů se řadí dyspepsie (< 5 %), zarudnutí kůže (< 2 %), myopatie, zvláště u nemocných s CKD (< 5,5 %) a cholelitiáza. Z laboratorních ukazatelů je s léčbou fibráty spojena elevace kreatininu a homocysteinu (34). Terapie fenofibrátem není vhodná u pacientů s CKD G 4,5.
Ezetimib
Je selektivním inhibitorem absorpce cholesterolu v tenkém střevě. V kartáčovém lemu enterocytů blokuje transportní protein Niemann‑Pick C1-like protein 1 (NPC1L1), blokádou dochází ke sníženému vstřebávání cholesterolu do enterohepatální cirkulace. Na pokles cholesterolu v portální krvi, reaguje hepatocyt zvýšenou expresí LDL receptoru následovanou poklesem LDL‑C. Ezetimib není vhodný v monoterapii hypercholesterolemie, neboť zpětnovazebnými mechanizmy je akcentována intracelulární syntéza cholesterolu. Rovněž není vhodný pro těhotné a děti, neboť je v 95 % vstřebáván z enterocytu do enterohepatální cirkulace. Pro pacienty s CKD je vhodný do kombinační terapie (simvastatin/ezetimib); studie SHARP potvrdila významné snížení velkých aterosklerotických kardiovaskulárních příhod o 17 %.
Pryskyřice (sekvestranty žlučových kyselin)
Ve střevním lumen pryskyřice vážou žlučové kyseliny, které nejsou reabsorbovány v terminálním ileu a jsou naopak ve zvýšené míře vylučovány stolicí. Rovněž dochází k omezenému vstřebávání cholesterolu z potravy, neboť při omezeném množství žlučových kyselin nedochází k tvorbě micel s tuky přijatých potravou. Pokles koncentrace cholesterolu v hepatocytu vede ke zvýšené expresi LDL receptoru, s následným zvýšením clearance LDL částic z plazmy. V České republice je z této skupiny léků dostupný pouze cholestyramin.
Obecně je velmi málo používán, u pacientů s CKD bylo jeho použití spojeno pouze v experimentální práci k omezení pruritu, který se může vyskytovat u uremických pacientů (35).
Nová hypolipidemika – PCSK9 inhibitory (alirocumab, evolucomab)
Proprotein konvertázy subtilisin/kexin typu 9 (proprotein convertase subtilisin/ kexin type 9) PCSK9 patří do skupiny serinových proteáz. Exprimuje v hepatocytech, enterocytech, ledvinách, mozečku. PCSK9 vytváří komplex s LDL receptorem, který po navázání LDL částice vede k internalizaci komplexu do cytosolu buňky, v lysozomu je následně degradován celý komplex (LDL receptor – LDL částice – PCSK9). LDL receptor již dále není recyklován a zpětně exprimován na membráně buněk. Aktuálně jsou od přelomu roku 2018 v České republice k dispozici 2 preparáty – alirocumab a evolucomab. Pro pacienty s CKD jsou prozatím indikovány do stadia 3 A, pokud nedosahují cílových hodnot LDL‑C na maximální tolerované terapii statinem či kombinační terapii (statin/ezetimib) (36).
LDL aferéza
LDL aferéza je extrakorporální eliminační metoda, při které dochází k odstranění LDL ‑ C z cirkulující krve za použití imunoadsorpční kapiláry. Indikace k LDL aferéze – homozygotní FH, heterozygotní FH refrakterní ke standardní terapii nebo statinová intolerance (37). Procedura se provádí pravidelně 1× týdně s event. úpravou dle aktuálního poklesu a následné elevace LDL‑C. Pro proceduru je nutné mít zajištěný vhodný cévní přístup (permanentní katétr, arteriovenózní fistuli). Toto je možné s výhodou využít pro hemodialyzované pacienty s FH intolerantní k léčbě statiny či kombinační terapii. Zatím jsou tyto zkušenosti experimentální a chybí mortalitní data.
Závěr
Chronické onemocnění ledvin je jeden z hlavních rizikových faktorů aterosklerotického CVD. V počátečních stadiích CKD pacienti umírají spíše na CVD a jejich komplikace, než na primární nefrologické onemocnění, které vedlo k progresi do ESRD (38). Pacienti s CKD jsou kategorizováni do skupiny s velmi vysokým kardiovaskulárním rizikem a jejich hypolipidemická léčba má svá specifika. V ambulantní praxi od časných stádií CKD by tedy měla být mimo jiné snaha o důslednou prevenci progrese rizikových faktorů CVD, včetně spolupráce nefrologa s lipidologem. Dohoda o maximálně účinné hypolipidemické terapii (včetně kombinační léčby, či indikace PCSK9 inhibitorů) by měla být vedena s cílem v co největší míře snížit riziko komplikací vyplývajících z CVD, a tak zlepšit kvalitu života pacientů s CKD.
Práce byla podpořená výzkumnými záměry MZ ČR – RVO VFN64165, Progres‑Q25/ LF1/2.
Zkratky
- AVF – arteriovenózní fistule
- CKD – chronické onemocnění ledvin
- Cu/Zn‑SOD – cytoplazmatická superoxiddismutáza
- CVD – kardiovaskulární choroby
- eGFR – odhadovaná glomerulární filtrace (estimated glomerular filtration)
- ESRD – end stage renal disease (terminální selhání ledvin)
- HD – hemodialýza
- HDL – high density lipoprotein
- HMG‑CoA - reduktáza – hydroxmethylglutaryl‑CoA‑reduktáza
- IDL – intermediate density lipoprotein
- ICHDK – ischemická choroba dolních končetin
- KDIGO – Kidney disease: Imporving Global Outcomes
- LDL – low density lipoprotein
- Lp(a) – lipoprotein(a)
- MDA – malondialdehyd
- MIA syndrom – malnutrition, inflammation, atherosclerosis syndrom
- MIAC syndrom – malnutrition, inflammation, atherosclerosis, calcification syndrome
- NADPH – nikotinaadenindinukleotidfosfát
- NPC1L1 – Niemann‑Pick C1 - like protein 1 Ox‑LDL – oxidované LDL
- PCSK9 – proprotein konvertázy subtilisin/kexin typu 9 (proprotein convertase subtilisin/kexin type 9)
- PD – peritoneální dialýza
- PON – paraoxonáza
- sd‑LDL – small density lipoprotein
- TC – celkový cholesterol
- TxL – transplantace ledviny
- VLDL – very low density lipoprotein
Sources
1. Wanner C, Tonelli M. Kidney Disease: Improving Global Outcomes (KDIGO) Lipid Work Group. KDIGO Clinical Practice Guideline for Lipid Management in Chronic Kidney Disease. Kidney Int 2014; 85 : 1303–1309.
2. Vostalová J, Galandaková A, Štrebl P, et al. Oxidační stres u pacientů s náhradou funkce ledvin hemodialýzou a peritoneální dialýzou. Vnitř Lék 2012; 58 : 466–472.
3. Ellis RJ, Small DM, Ng KL, et al. Indoxyl Sulfate Induces Apoptosis and Hypertrophy in Human Kidney Proximal Tubular Cells. Toxicol Pathol 2018; 46 : 449–459.
4. Atamer A, Kocyigit Y, Ecder SA, et al. Effect of oxidative stress on antioxidant enzyme activities, homocysteine and lipoproteins in chronic kidney disease. J Nephrol 2008; 21 : 924–930.
5. Tribble DL, Rizzo M, Chait A, et al. Enhanced oxidative susceptibility and reduced antioxidant content of metabolic precursors of small, dense low‑density lipoproteins. Am J Med 2001; 110 : 103–110.
6. Kwiterovich jr. PO. Clinical relevance of the biochemical, metabolic, and genetic factors that influence low‑density lipoprotein heterogeneity. Am J Cardiol 2002; 90 : 30i–47i.
7. Chait A, Brazg RL, Tribble DL, et al. Susceptibility of small, dense, low‑density lipoproteins to oxidative modification in subjects with the atherogenic lipoprotein phenotype, pattern B. Am J Med 1993; 94 : 350–356.
8. Kotani K, Tsuzaki K, Traniguchi N, et al. LDL particle size and reactive oxygen metabolities in dyslipidemic patients. Int J Prev Med 2012; 3 : 160–166.
9. Gardner CD, Fortmann SP, Krauss RM. Association of small low‑density lipoprotein particles with the incidence of coronary artery disease in men and women. JAMA 1996; 276 : 875–881.
10. Galeano NF, Al‑Haideri M, Keyserman F, et al. Small dense low density lipoprotein has increased affinity for LDL receptor‑independent cell surface binding sites: a potential mechanism for increased atherogenicity. J Lipid Res 1998; 39 : 1263–1273.
11. Milionis HJ, Elisaf MS, Tselepis A, et al. Apolipoprotein(a) phenotypes and lipoprotein( a) concentrations in patients with renal failure. Am J Kidney Dis 1999; 33 : 1100–1106.
12. Loscalzo J. Lipoprotein(a): a unique risk factor for atherothrombotic disease. Arteriosclerosis 1990; 10 : 672–679.
13. Kronenberg F, Kuen E, Ritz E, et al. Lipoprotein(a) serum concentrations and apolipoprotein( a) phenotypes in mild and moderate renal failure. J Am Soc Nephrol 2000; 11 : 105–115.
14. Žák A, Zeman M. Sekundární dyslipidémie. In: Svačina Š (ed.) Poruchy metabolismu a výživy. Praha: Galén 2010, 271–288.
15. Fielding CJ, Fielding PE. Molecular physiology of reverse cholesterol transport. J Lipid Res 1995; 36 : 211–228.
16. Dodani S, Grice DG, Joshi S. Is HDL function as important as HDL quantity in the coronary artery disease risk assessment? J Clin Lipidol 2009; 3 : 70–77.
17. Dantoine TF, Debord J, Charmes JP, et al. Decrease of serum paraoxonase activity in chronic renal failure. J Am Soc Nephrol 1998; 9 : 2082–2088.
18. Weichhart T, Kopecky C, Kubicek M, et al. Serum amyloid A in uremic HDL promotes inflammation. J Am Soc Nephrol 2012; 23 : 934–947.
19. Dušejovská M, Staňková B, Vecka M, et al. Lipid Metabolism in Patients with End‑Stage Renal Disease: A Five‑Year Follow‑up Study. Curr Vasc Pharmacol 2018; 16 : 298–305.
20. Movva R, Rader DJ. Laboratory assement of HDL heterogenity and function. Clin Chem 2008; 54 : 788–800.
21. Feig JE, Shamir R, Fisher EA. Atheroprotective effects of HDL: beyond reverse cholesterol transport. Curr Drug Targets 2008; 9 : 196–203.
22. Tesař V Metabolické aspekty nemoci ledvin. In: Svačina Š (ed.) Poruchy metabolismu a výživy. Praha: Galén 2010, 137–150.
23. de Zeeuw D, Anzalone DA, Cain VA, et al. Renal effects of atorvastatin and rosuvastatin in patients with diabetes who have progressive renal disease (PLANET I): a randomised clinical trial. Lancet Diabetes Endocrinol 2015; 3 : 181–190.
24. Crouse JR, Raichlen JS, Riley WA, et al. Effect of rosuvastatin on progression of carotid intima‑media thickness in low‑risk individuals with subclinical atherosclerosis: the METEOR trial. JAMA 2007; 297 : 1344–1353.
25. Su X, Zhang L, Lv J, et al. Effect of Statins on Kidney Disease Outcomes: A Systematic Review and Meta‑analysis. Am J Kidney Dis 2016; 67 : 881–892.
26. Kim S, Ko K, Park S, et al. Effect of Fenofibrate Medication on Renal Function. Korean J Fam Med 2017; 38 : 192–198.
27. Broeders N, Knoop C, Antoine M, et al. Fibrate‑induced increase in blood urea and creatinine: is gemfibrozil the only innocuous agent. Nephrol Dial Transplant 2000; 15 : 1993–1999.
28. Paul S, Mohan V. Fenofibrate can increase serum creatinine levels in renal insufficiency. J Assoc Physicians India 2006; 54 : 337.
29. McQuade CR, Griego J, Anderson J, et al. Elevated serum creatinine levels associated with fenofibrate therapy. Am J Health Syst Pharm 2008; 65 : 138–141.
30. Lipscombe J, Lewis GF, Cattran D, et al. Deterioration in renal function associated with fibrate therapy. Clin Nephrol 2001; 55 : 39–44.
31. Ritter JL, Nabulsi S. Fenofibrate ‑ induced elevation in serum creatinine. Pharmacotherapy 2001; 21 : 1145–1149.
32. Ansquer JC, Dalton RN, Caussé E, et al. Effect of fenofibrate on kidney function: a 6-week randomized crossover trial in healthy people. Am J Kidney Dis 2008; 51 : 904–913.
33. Hottelart C, El Esper N, Rose F, et al. Fenofibrate increases creatininemia by increasing metabolic production of creatinine. Nephron 2002; 92 : 536–541.
34. Zeman M, Žák A, Vecka M, et al. Treatment of hypertriglyceridemia with fenofibrate, fatty acid composition of plasma and LDL, and their relations to parameters of lipoperoxidation of LDL. Ann N Y Acad Sci 2002; 967 : 336–341.
35. Kremer AE, Mettang T. Pruritus in systemic diseases: Common and rare etiologies. Hautarzt 2016; 67 : 606–614.
36. Toth PP, Dwyer JP, Cannon CP, et al. Efficacy and safety of lipid lowering by alirocumab in chronic kidney disease. Kidney Int 2018; 93 : 1397–1408.
37. Bláha V, Bláha M, Lánská M, et al. LDL‑aferéza v léčbě familiárních hyperlipoproteinemií. Vnitř Lék 2014; 60 : 970–976.
38. Coresh J, Selvin E, Stevens LA, et al. Prevalence of chronic kidney disease in the United States. JAMA 2007; 298 : 2038–2047.
39. Dron JS, Hegele RA. Genetics and lipoprotein Disorders and Traits. Curr. Genet. Med. Rep. 2016; 4 : 130–141.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2020 Issue 5
-
All articles in this issue
- Etiologie a management dyslipidemie u pacientů s chronickým onemocněním ledvin
- Katetrizační implantace aortální chlopně – co víme v roce 2020
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
- Ropeginterferon alfa-2 b v léčbě pacientů s pravou polycytémií
- Onemocnění jater související s alkoholem (ALD)
- Diabetes mellitus a nelegální drogy
- Pulmo‑renální syndrom
- Srovnání různých přístupů k určení prevalence diabetu 2. typu v ČR
- Terapie dušnosti zdrojem svízelné diagnózy neurologického onemocnění
- Náhodne zistený feochromocytóm u 33-ročného pacienta s Lynchovým syndrómom
- Transplantace jater jako potenciální kurativní metoda těžké hemofilie A: popis případu a literární přehled
- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Praluent (alirokumab)
- Konfokální laserová endomikroskopie v diagnostice onemocnění jícnu: pilotní studie
- Akútna končatinová ischémia v dôsledku paradoxnej embolizácie liečená systémovou trombolýzou
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Onemocnění jater související s alkoholem (ALD)
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
