Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
Osteolytic bone lesions, hypercalcemia and paraprotein, but not a myeloma: case report and review of literature
In June 2018, 77-year-old man was referred to The Department of Haematooncology, University Hospital Ostrava, for suspicion of multiple myeloma. This was supported by laboratory findings of hypercalcemia, paraprotein IgA κ in serum and by the presence of multiple osteolytic skeletal lesions. Low number of plasma cells in bone marrow sample - cytologically (3.6 %) as well as in flow cytometry (less than 95 % clonal plasma cells out of total bone marrow plasma cells) - pointed at the direction of monoclonal gammopathy of undetermined significance (MGUS). In the course of differential diagnosis of hypercalcemia, elevated level of parathormone had been found which led to the performance of 99mTc-MIBI scintigraphy where parathyroid adenoma was discovered and later histologically verified. The final diagnosis was determined as a coincidence of MGUS and primary hyperparathyroidism. This case report also contains brief differential diagnosis of hypercalcemia and osteolytic skeletal lesions and suggestions for their diagnostic algorithms.
Keywords:
Multiple myeloma – primary hyperparathyroidism – hypercalcemia – MGUS – osteolytic lesions
Authors:
Katarína Hradská 1; Tomáš Jelínek 1; Juraj Ďuraš 1; Jana Mihályová 1; Tereza Popková 1; Jakub Cvek 2; Kamil Bukovanský 3; Martin Havel 3; Veronika Spáčilová 4; Roman Hájek 1
Authors‘ workplace:
Klinika hematoonkologie LF OU a FN Ostrava
1; Klinika onkologická LF OU a FN Ostrava
2; Klinika nukleární medicíny LF OU a FN Ostrava
3; Interní klinika LF OU a FN Ostrava
4
Published in:
Vnitř Lék 2020; 66(5): 90-95
Category:
Differential Diagnosis Column or What You Can Be Asked at a Postgraduate Certification Exam
Overview
V červnu roku 2018 byl na Kliniku hematoonkologie LF OU a FN Ostrava referován 77letý muž pro suspektní mnohočetný myelom. Podezření bylo vysloveno na základě laboratorního nálezu hyperkalcemie, paraproteinu IgA κ v séru a přítomnosti mnohočetných osteolytických ložisek skeletu. Cytologicky (3,6 %) i imunofenotypizačně (méně než 95 % klonálních plazmocytů z celkového počtu plazmocytů) nízké zastoupení plazmocytů v kostní dřeni odpovídalo spíše postižení monoklonální gamapatií nejasného významu (MGUS). V rámci pokračování v diferenciální diagnostice hyperkalcemie byla pro nález zvýšené hladiny parathormonu indikována 99mTc‑MIBI scintigrafie, díky které byl následně objektivizován a později při operaci i histologicky verifikován adenom příštítného tělíska. Diagnóza byla uzavřena jako MGUS a současný výskyt primární hyperparatyreózy. Tato kazuistika obsahuje i stručnou diferenciální diagnostiku hyperkalcemie a osteolytického postižení skeletu a návrhy algoritmů při jejich došetření.
Klíčová slova:
hyperkalcemie – MGUS – mnohočetný myelom – osteolytická ložiska – primární hyperparatyreóza
Úvod
Mnohočetný myelom je druhým nejčastějším krevním nádorovým onemocněním s roční incidencí asi 6 případů na 100 000 obyvatel a celkově představuje asi 1 % všech zhoubných onemocnění (1, 2). Jedná se o geneticky heterogenní klonální onemocnění plazmatických buněk, které proliferují v kostní dřeni a produkují monoklonální imunoglobulin (paraprotein), který je detekovatelný v séru a/nebo v moči. Mnohočetnému myelomu virtuálně vždy předchází asymptomatické premaligní stadium zvané monoklonální gamapatie nejasného významu (MGUS) (1, 3). Diagnostická kritéria MGUS zahrnují hladinu monoklonálního imunoglobulinu do 30 g/l, infiltraci do 10 % klonálních plazmatických buněk v kostní dřeni a nepřítomnost orgánového postižení způsobeného myelomem (4). Pravděpodobnost progrese v symptomatické onemocnění je asi 0,5–1 % ročně (1, 5). Mnohočetný myelom je, dle doporučení International Myeloma Working Group (IMWG) z roku 2014, definován nejen charakteristickými CRAB kritérii (hyperkalcemie, renální insuficience, anémie, jedno nebo více osteolytických ložisek skeletu), ale i rizikovými faktory, a to nálezem klonálních plazmatických buněk v kostní dřeni > 60 %, poměrem postižených/nepostižených volných lehkých řetězců v séru ≥ 100 a více než jedním ložiskem skeletu > 5 mm při vyšetření magnetickou rezonancí (MR) (4). Vstupně je postižení skeletu přítomno asi u 80 % pacientů, v průběhu léčby se toto číslo zvýší na 90 % (6, 7). Mezistupeň mezi MGUS a mnohočetným myelomem je známý jako doutnající (smoldering) myelom, u kterého je pravděpodobnost progrese do symptomatického onemocnění asi 10 % ročně prvních 5 let, poté se snižuje (1, 8).
Koincidence osteolytického postižení skeletu a hyperkalcemie nemusí vždy provázet jenom výše uvedenou hematologickou malignitu. Mnohočetný myelom může v tomto ohledu napodobovat i primární hyperparatyreóza. Hyperparatyreóza je obecně na 3. místě mezi nejčastějšími endokrinními poruchami, je definována jako zvýšená hladina parathormonu (PTH) v krvi při zvýšené aktivitě příštítných tělísek a etiologicky se dělí na 3 typy. Primární hyperparatyreóza je nejčastější s prevalencí 24 případů na 100 000 obyvatel, vzniká v důsledku zvýšené tvorby PTH (nejčastěji při adenomu, hyperplazii nebo karcinomu příštítných tělísek), vyskytuje se zejména u žen ve věku 40–60 let a může být součástí syndromu mnohočetné endokrinní neoplazie (např. MEN1, MEN2). Sekundární hyperparatyreózu charakterizuje elevace PTH při snížení hladiny kalcia, např. při malabsorpci, jaterním selhání, deficitu vitaminu D nebo chronickém onemocnění ledvin. Při dlouhodobé sekundární hyperparatyreóze (zejména při chronickém renálním onemocnění) může dojít k autonomizaci sekrece parathormonu, která je definována jako terciární hyperparatyreóza (9–11).
Jak zrádné může být prolínání těchto klinicky někdy velmi podobných diagnóz, je prezentováno v následující kazuistice. Další část textu je zaměřena na diferenciální diagnostiku osteolytických ložisek skeletu a hyperkalcemie.
Kazuistika
Muž ve věku 77 let byl odeslán z regionálního hematologického pracoviště s podezřením na mnohočetný myelom. Hlavními faktory, které svědčily pro tuto diagnózu, byla přítomnost paraproteinu IgA κ 5,4 g/l, osteolytická ložiska kalvy dle počítačové tomografie (CT) a hyperkalcemie 3,23 mmol/l, dále lehká anémie (Hb 125 g/l) a počínající renální insuficience (kreatinin 133 μmol/l). Pacient subjektivně udával bolesti hlavy, tinnitus, dyspeptické potíže. Anamnesticky byl dispenzarizován pro hypertenzní nemoc a dnu. Na ultrasonografii (USG) břicha před 2 lety byly popsány kalcifikace pravé ledviny.
Po přijetí byla zahájena intenzivní parenterální hydratace (obrat 4 l tekutin/den) bez efektu poklesu hyperkalcemie. Dále byla provedena standardní stagingová vyšetření u suspektní nové diagnózy mnohočetného myelomu s následujícími výsledky:
- v kostní dřeni cytologicky 3,6 % plazmatických buněk (PCs),
- dle flow cytometrie 0,21 % PCs (93 % klonálních s fenotypem cyt κ+ CD38+ CD138+ CD45 - CD19 - CD56+ CD27low CD81het (40 % pozit) CD117+),
- dle low dose CT skeletu mnohočetná osteolytická ložiska nejen na kalvě, ale i na ostatním skeletu lebky, obratlech Th9, Th10, Th11, L2 a v lopatách kyčelních kostí bilaterálně (Obr. 1).
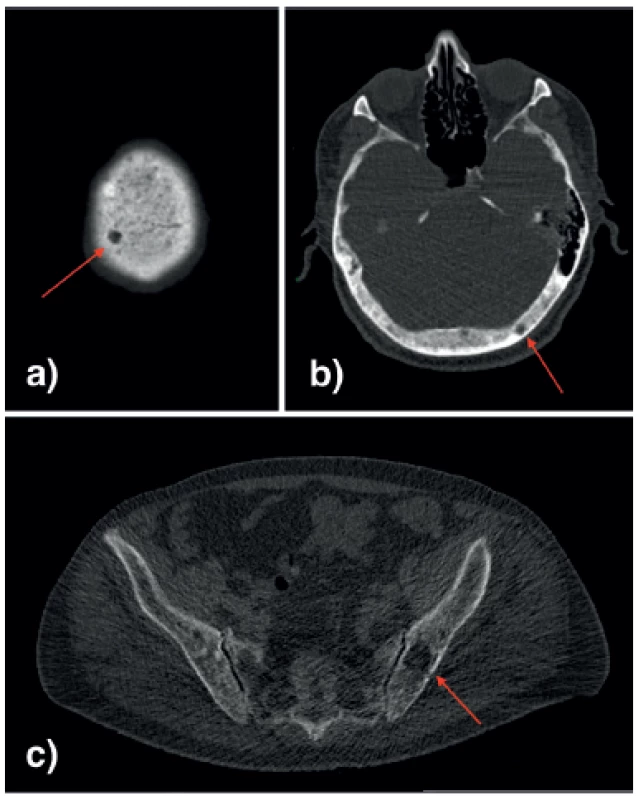
I přes několikadenní intenzivní hydrataci přetrvávala hyperkalcemie (3,09–3,41 mmol/l), následně byl aplikován klodronát 900 mg, rovněž bez efektu. Vzhledem k velmi nízké infiltraci kostní dřeně plazmatickými buňkami, které měly navíc typický tzv. MGUS‑like fenotyp (méně než 95 % klonálních PCs z celkového počtu PCs), a vzhledem k atypicky přetrvávající hyperkalcemii přes podanou léčbu, bylo pátráno po dalších možných příčinách vzniku osteolytických ložisek.
Byl doplněn screening nádorových markerů (v našem případě PSA – prostatický specifický antigen, CEA – karcino‑embryonální antigen) v rámci pátraní po metastazujícím solidním tumoru a také hladina PTH. Zásadním indikátorem, že by se nemuselo jednat o mnohočetný myelom ani jiný diseminovaný karcinom, byla zvýšená hladina parathormonu 68,6 pmol/l (norma laboratoře FN Ostrava 1,95–8,49 pmol/l), onkomarkery byly negativní. V diferenciální diagnostice byla zvažována současná přítomnost MGUS a suspektní primární hyperparatyreózy. K dalšímu ozřejmění diagnózy bylo provedeno scintigrafické vyšetření po aplikaci 99mTc‑MIBI s lehce modifikovaným protokolem (celotělová scintigrafie a dvoufázový SPECT/CT – jednofotonová emisní počítačová tomografie/CT), jednak ke zhodnocení event. metabolicky aktivních myelomových ložisek ve skeletu, ale také k verifikaci hyperplazie či adenomu příštítného tělíska. Vyšetření prokázalo ložisko vyšší depozice MIBI za dolním okrajem pravého laloku štítné žlázy, kdy jeho chování na dvoufázovém vyšetření bylo charakteristické pro přítomnost adenomu/hyperplazie příštítného tělíska (Obr. 2 a 3). Zároveň bylo přistoupeno k biopsii osteolytického ložiska lopaty kyčelní kosti vlevo pod CT kontrolou. Histologicky bez průkazu klonálních plazmatických buněk – struktury myelomu nebyly přítomny. Z hematologického hlediska byl případ uzavřen jako MGUS a pacient byl předán do péče Interní kliniky k dořešení hyperparatyreózy.
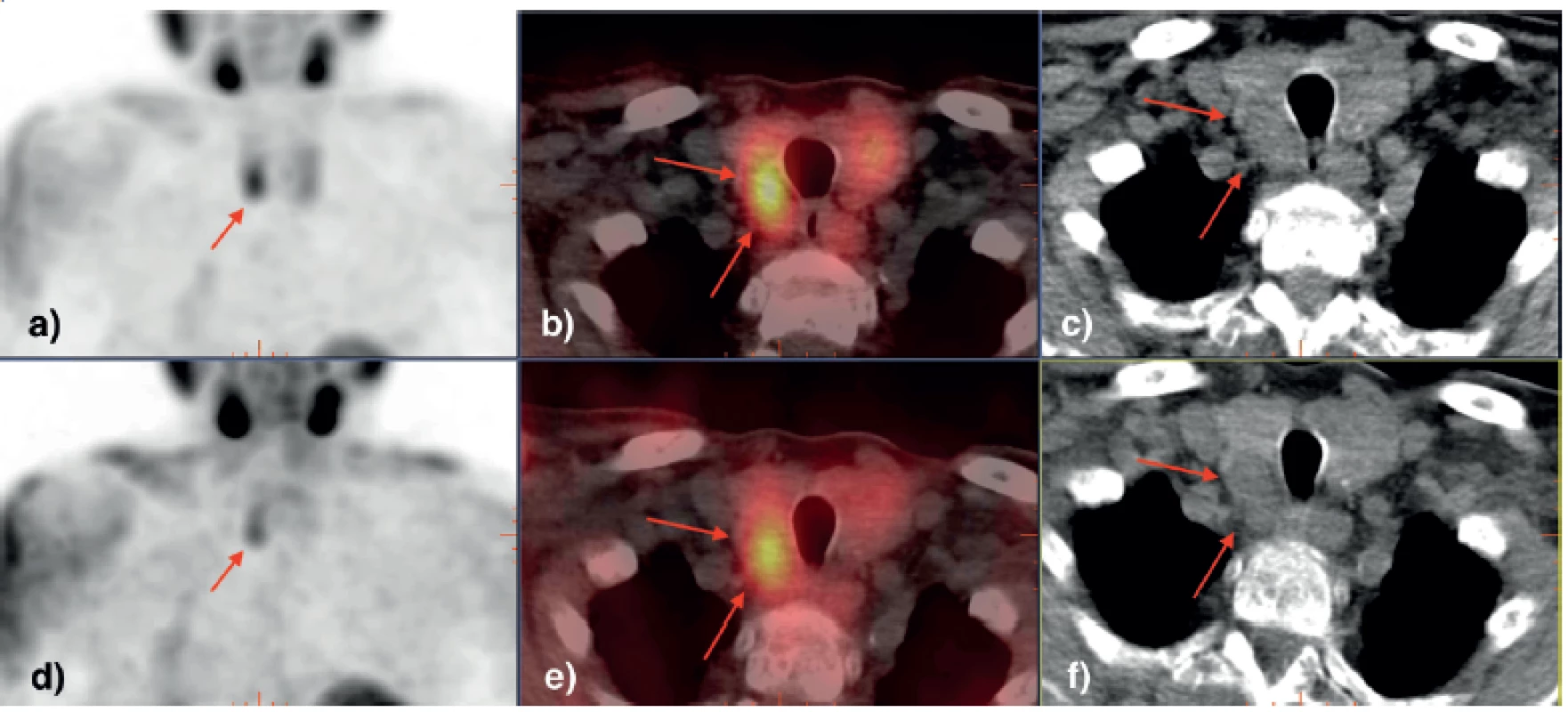
Zde byl pro přetrvávající hyperkalcemii do medikace přidán cinacalcet (kalcimimetikum) s postupným poklesem kalcemie. Vzhledem ke kostním komplikacím a renální insuficienci ve stadiu 3 dle KDIGO (Kidney Disease Improving Global Outcomes) byla indikována radiačně navigovaná paratyreoidektomie, při které byl odstraněn a následně i histologicky verifikován adenom pravého dolního příštítného tělíska o velikosti 4,5 × 3 × 1,2 cm a hmotnosti 9 g.
Diferenciální diagnostika osteolytických ložisek skeletu
Za fyziologických podmínek jsou kostní resorpce a kostní formace úzce spjaty, přičemž novotvorba kosti probíhá v diskrétních okrscích předešlé kostní resorpce. Tato „spolupráce“ je z velké části závislá na komunikaci mezi osteoklasty a osteoblasty cestou obousměrné signální dráhy, kde je podstatou negativní zpětná vazba. V určitých situacích může být tato rovnováha narušena a vede k ložiskovému postižení skeletu, které může být buď osteolytické, osteoplastické nebo smíšené (12). Ložiskově nejčastěji postihuje skelet mnohočetný myelom (v době diagnózy 80 %) a metastázy solidních malignit (v době diagnózy: tumor plic 7,2–7,6 %, tumor močového měchýře 6,3 %, tumor ledvin 5,2 %, tumor prostaty 1,7 %, tumor prsu 0,5–1,5 %, tumor štítné žlázy 0,6 %) (6, 12–18).
Osteoplastické metastázy jsou pozorovány nejčastěji u karcinomu prostaty, na zobrazovacích metodách (RTG, CT) mají osteosklerotický charakter a vznikají při zvýšené stimulaci osteoblastů. Vykazují také zvýšenou akumulaci osteotropních radiofarmak (např. 99mTc‑HDP), čehož je využíváno při scintigrafické diagnostice (19). V případě, že je naopak rovnováha mezi odbouráváním a novotvorbou kosti narušena ve prospěch osteoklastů, vznikají v skeletu ložiska osteolytická (12, 20). U nádorů hraje roli v jejich rozvoji signální dráha RANKL (receptor activator of nuclear factor κ‑B ligand)/RANK (receptor activator of nuclear factor κ‑B)/ OPG (osteoprotegerin). Nádorové buňky cestou svého působení na osteoblasty snižují expresi OPG a zvyšují expresi RANKL. RANKL se váže na RANK receptory progenitorových buněk kostní tkáně a osteoklastů, což má za následek stimulaci aktivity a vůbec vzniku osteoklastů a tím podporuje tvorbu lytických ložisek. OPG brání navázání RANKL na RANK. Osteolytická ložiska se vyskytují nejčastěji u mnohočetného myelomu, karcinomu ledviny, štítné žlázy a močového měchýře (6, 21, 22). U některých kostních metastáz mohou být přítomny obě složky – lytické i plastické, proto jsou nazývány smíšené (nejčastěji u karcinomu prsu a plic) (20).
Pro primární hyperparatyreózu je typické variabilní postižení skeletu. Jednou z forem kostního postižení je osteitis fibrosa cystica, známá také jako hnědý tumor nebo osteoklastom. Dochází zde k lokální osteolytické a expanzivní destrukci kosti včetně kortikalis. Destrukce je způsobena náhradou kosti vaskularizovanou fibrózní tkání, která obsahuje obrovskobuněčnou tkáň a vytváří cystické a nekrotizující osteolytické expanze (23). Prokrvácení a depozita hemosiderinu způsobují typickou hnědou barvu ložisek (24). Etiologicky je rovněž klíčovou signální dráha RANKL/RANK/OPG, kdy elevace PTH zvyšuje expresi RANKL a snižuje expresi OPG (viz výše) (25).
Hlavní diagnostickou metodou k zobrazení adenomu příštítného tělíska je po klasickém ultrazvuku krku výše uvedené 99mTc‑MIBI scintigrafické vyšetření. Při nejasném nálezu lze zvážit provedení senzitivnějšího 18 F‑fluorocholinového nebo 11C‑cholinového PET/CT nebo PET/MR (26, 27).
Vzácně se mohou osteolytická ložiska objevit u některých jiných krevních nádorových onemocnění (zejména non‑hodgkinské lymfomy – high grade více než low grade) (28–30). Typicky se postižením skeletu může projevit např. systémová mastocytóza, Erdheim‑Chesterova nemoc nebo Gaucherova nemoc (31, 32). V ojedinělých neonkologických a nehematologických případech se může jednat o tuberkulózu kostí, sarkoidózu nebo osteomyelitidu (33–36).
Osteolytická ložiska se mohou projevit vznikem patologické fraktury, syndromy komprese míšního kanálu, poruchami metabolismu kalcia a fosforu nebo výraznou bolestivostí kostí při nádorovém postižení (12). V jiných případech bývají zachyceny i jako náhodný nález při zobrazovacích vyšetřeních z úplně jiných příčin a jsou asymptomatická. Diferenciální diagnostika příčiny skeletálního postižení patrně není jednoduchá. Správným směrem nás může navést podrobná anamnéza, z odběrů základní biochemie, krevní obraz s diferenciálním rozpočtem bílé krevní řady a základní zobrazovací metody, jako je RTG hrudníku a USG břicha. V nejasných případech můžeme postupovat dle schématu 1.

Diferenciální diagnostika hyperkalcemie
V lidském těle je 99 % kalcia vázáno ve skeletu ve formě hydroxyapatitu, zbylé 1 % se nachází v intracelulární a extracelulární tekutině a je nezbytně nutné pro správnou funkci např. extracelulární a intracelulární signalizace, přenos nervových vzruchů a svalové kontrakce. Homeostázu kalciového metabolismu ovlivňují 3 základní hormony:
- PTH,
- kalcitriol (biologicky aktivní metabolit vitaminu D),
- kalcitonin.
PTH je produkován hlavními buňkami příštítných tělísek při poklesu hladiny Ca2+ v extracelulární tekutině, který je zaznamenán receptorem pro kalcium (CaSR – calcium sensing receptor) na jejich povrchu. PTH působí zvýšenou reabsorpci Ca v distálním tubulu ledvin a stimuluje aktivitu osteoklastů, které odbourávají Ca z kostí. Při delší elevaci PTH dochází k stimulaci produkce kalcitriolu v ledvinách. Kalcitriol zvyšuje absorpci kalcia ve střevě, snižuje sekreci PTH z příštítných tělísek a stimuluje resorpci kosti. Kalcitonin je tvořen parafolikulárními buňkami štítné žlázy, které mají rovněž na povrchu CaSR. Kalcitonin jako jediný kalcemii snižuje, a to inhibicí aktivity osteoklastů (čímž snižuje resorpci kostí) a zvýšením exkrece Ca ledvinami. Všechny výše uvedené mechanismy fungují na bázi negativní zpětné vazby (10, 11, 37–39).
Jako hyperkalcemie je označován vzestup sérové koncentrace vápníku nad horní hranici normálního rozmezí, tedy nad 2,65 mmol/l (pozn. lab. FNO), a bývá obvykle způsobena vzestupem ionizovaného vápníku (nad 1,33 mmol/l – pozn. lab. FNO). Hladina sérového kalcia je neoddělitelně spjata s hladinou albuminu, protože na albumin je vázáno asi 40–45 % sérového kalcia (11, 37, 39, 40). Při poklesu albuminu je tedy nutno zjistit hodnotu korigovaného kalcia, aby nedošlo ke zbytečné substituci, nebo naopak přehlédnutí hyperkalcemie. Doporučený vzorec pro výpočet korigovaného kalcia je následovný: Cakorig = Cacelk + 0,02 × (41,3 – alb) (41). Z toho vyplývá, že při poklesu albuminu o 10 g/l (pod 41,3 g/l) je potřeba přičíst k aktuální hodnotě kalcia 0,2 mmol/l, abychom získali pravou hodnotu kalcemie. Naopak při dehydrataci, kdy dojde k vzestupu hladiny sérového albuminu, dochází i k pseudohyperkalcemii, kterou musíme brát v potaz, a měření proto zopakovat po rehydrataci pacienta (37).
Elevace sérové hladiny vápníku může mít řadu různých příčin – zvýšená absorpce kalcia z potravy střevní sliznicí, zvýšená kostní resorpce, snížené vylučování vápníku močí, případně kombinace těchto faktorů (37). Nejčastějšími diagnózami, které se za daným stavem skrývají, jsou primární hyperparatyreóza a zhoubné nádorové onemocnění (v asi 90 % všech případů) (37, 39, 40). Je to dáno zejména narušením fyziologického kostního metabolismu ve prospěch osteolýzy cestou ovlivnění signální dráhy RANKL/RANK/OPG. Některé maligní buňky mají rovněž schopnost produkovat peptid zvaný parathyroid hormone‑related peptide (PTHrP), který má podobnou stavbu i biologické vlastnosti jako PTH, ale neaktivuje produkci kalcitriolu. Paraneoplastická hyperkalcemie nejčastěji provází dlaždicobuněčné tumory plic, jícnu, nádory hlavy a krku, gynekologické malignity, karcinom prsu a ledvin (10, 11). Vyšetření PTHrP není běžně dostupné, proto je ve schématu 2 v závorce. Z dalších hematologických malignit (kromě mnohočetného myelomu) může být elevace Ca součástí obrazu zejména maligních lymfomů – při postižení skeletu nebo jako důsledek zvýšené přeměny vitaminu D na aktivní formu lymfomovými buňkami (10, 11, 37, 39).

Dále v diferenciální diagnostice musíme myslet na chronická granulomatózní onemocnění, zejména na sarkoidózu, u které se hyperkalcemie vyskytuje v 2–10 % případů, na hyperkalcemii v rámci imobilizačního syndromu, na možnou polékovou etiologii (thiazidová diuretika, lithium, teriparid, intoxikace vitaminem D nebo A), případně na hereditární příčinu při familiární hypokalciurické hyperkalcemii (10, 11, 25, 37, 39, 40).
Zatímco při maligním onemocnění dochází k rozvoji hyperkalcemie v krátkém časovém intervalu, nejčastěji v řádu týdnů a vedoucími příznaky jsou těžká polyurie, polydipsie, dehydratace, zpomalení až zástava pasáže gastrointestinálním traktem, sekundární renální insuficience, změny na elektrokardiogramu (EKG, zkrácení QT intervalu) s rizikem vzniku arytmií, letargie, zmatenost až kóma, pro primární hyperparatyreózu je typičtější dlouhodobý, měsíce až roky trvající asymptomatický či oligosymptomatický průběh s postupným nárůstem hladiny kalcia v séru. U některých pacientů dochází k diagnostice primární hyperparatyreózy při náhodném zjištění hyperkalcemie v rámci rutinních odběrů, jiní pacienti jsou diagnostikováni v rámci došetřování příčiny urolitiázy, kostního postižení, v rámci diferenciální diagnostiky etiologie akutní pankreatitidy, vředové choroby gastroduodena či chondrokalcinózy a hypertenze. Na vyšetření hladiny kalcia by se nemělo zapomínat ani u pacientů s nejasnými poruchami nálady či zhoršováním kognitivních funkcí (11, 37, 39, 42).
Hyperkalcemie je zcela jistě multioborovou záležitostí, proto je při primozáchytu důležité provedení důkladné diferenciální diagnostiky a nasměrování pacienta k odborníkovi, který dokáže vyřešit kauzální příčinu daného stavu, protože samotná hyperkalcemie není diagnózou, nýbrž příznakem. Pro představu je uveden diferenciálně diagnostický postup ve schématu 2.
Závěr
Nález osteolytického postižení skeletu, zvýšení hladiny sérového kalcia, a detekce paraproteinu v naprosté většině případů odpovídá diagnóze mnohočetného myelomu. Nicméně, jak bylo ukázáno v této kazuistice, při pochybnostech je vždy důležité vyloučit i méně pravděpodobné příčiny a i možnost, že jednotlivé nálezy spolu nesouvisí. Osteolytická ložiska jsou v době diagnózy typická pro mnohočetný myelom (až v 80 % případů), naopak kostní metastázy solidních nádorů se v úvodu nemoci objevují relativně vzácně (v 2–7 % případů). Vyloučení mnohočetného myelomu je v principu velmi jednoduché, a to stanovením elektroforézy séra a/nebo moči (viz schéma 1), jež patří mezi základní, široce dostupná a levná vyšetření, které je pozitivní u 97 % nově diagnostikovaných pacientů s mnohočetným myelomem (zbylé 3 % jsou oligosekreční formy) (43). V případě nejasné příčiny postižení skeletu (samozřejmě až po vyloučení mnohočetného myelomu) se jako metoda volby jeví biopsie ložiska pod CT kontrolou, která může mít velkou výpovědní hodnotu i u raritních onemocnění. Jak bylo v textu výše uvedeno, diferenciální diagnostika hyperkalcemie je rovněž široká, ale v první řadě je nutno myslet na endokrinní nebo maligní příčinu (spolu asi v 90 % případů). V rámci časné diagnostiky zmíněných příčin hyperkalcemie by mělo být vyšetření sérového vápníku součástí rutinního vyšetření mineralogramu.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Katarína Hradská, katarina.hradska@fno.cz
Klinika hematoonkologie LF OU a FN, Tř. 17. listopadu 1790, 708 52 Ostrava-Poruba
Článek přijat redakcí: 11. 7. 2019
Článek přijat po recenzích k publikaci: 5. 11. 2019
Sources
1. Kazandjian D. Multiple myeloma epidemiology and survival: A unique malignancy. Semin Oncol 2016; 43 : 676–681.
2. Maluskova D, Svobodová I, Kucerova M, et al. Epidemiology of Multiple Myeloma in the Czech Republic. Klin Onkol Cas Ceske Slov Onkol Spolecnosti 2017; 30 : 35–42.
3. Jelínek T, Mihályová J, Hájek R. CD38 targeted treatment for multiple myeloma. Vnitř Lék 2018; 64 : 939–948.
4. Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15: e538-e548.
5. Kyle RA, Therneau TM, Rajkumar SV, et al. A long‑term study of prognosis in monoclonal gammopathy of undetermined significance. N Engl J Med 2002; 346 : 564–569.
6. Jelinek T, Hajek R - Monoclonal antibodies – A new era in the treatment of multiple myeloma. Blood Rev 2016; 30 : 101–110.
7. Terpos E, Ntanasis‑Stathopoulos I, Dimopoulos MA. Myeloma bone disease: from biology findings to treatment approaches. Blood 2019; 133 : 1534–1539.
8. Kyle RA, Remstein ED, Therneau TM, et al. Clinical course and prognosis of smoldering (asymptomatic) multiple myeloma. N Engl J Med 2007; 356 : 2582–2590.
9. Fraser WD. Hyperparathyroidism. Lancet Lond Engl 2009; 374 : 145–158.
10. Adam Z, Starý K, Kubinyi J, et al. Hyperkalcemie, příznaky, diferenciální diagnostika a léčba aneb důležitost vyšetřování kalcia. Vnitř Lék 2016; 62 : 370–383.
11. Adam Z, Starý K, Zajíčková K, et al. Zvýšená hladina kalcia může být prvním příznakem mnohočetného myelomu, ale může mít i jiné příčiny. Transfuze Hematol Dnes 2018; 24 : 238–252.
12. David Roodman G, Silbermann R. Mechanisms of osteolytic and osteoblastic skeletal lesions. BoneKEy Rep 2015; 4 : 753.
13. Hernandez RK, Wade SW, Reich A, et al. Incidence of bone metastases in patients with solid tumors: analysis of oncology electronic medical records in the United States. BMC Cancer 2018; 52 : 18.
14. Jensen A, Jacobsen JB, Nørgaard, et al. Incidence of bone metastases and skeletal‑related events in breast cancer patients: A population‑based cohort study in Denmark. BMC Cancer 2011; 11 : 29.
15. Califano I, Deutsch S, Löwenstein A, et al. Outcomes of patients with bone metastases from differentiated thyroid cancer. Arch Endocrinol Metab 2018; 62 : 14–20.
16. Silva GT, Silva LM, Bergmann A, et al. Bone metastases and skeletal‑related events: incidence and prognosis according to histological subtype of lung cancer. Future Oncol Lond Engl 2019; 15 : 485–494.
17. Chandrasekar T, Klaassen Z, Goldberg H, et al. Metastatic renal cell carcinoma: Patterns and predictors of metastases‑A contemporary population‑based series. Urol Oncol 2017; 35 : 661.
18. Tsuda Y, Nakagawa T, Shinoda Y, et al. Skeletal‑related events and prognosis in urothelial cancer patients with bone metastasis. Int J Clin Oncol 2017; 22 : 548–553.
19. Arvola S, Jambor I, Kuisma A, et al. Comparison of standardized uptake values between 99mTc‑HDP SPECT/CT and 18 F‑NaF PET/CT in bone metastases of breast and prostate cancer. EJNMMI Res 2019; 9 : 6.
20. Reddington JA, Mendez GA, Ching A, et al. Imaging characteristic analysis of metastatic spine lesions from breast, prostate, lung, and renal cell carcinomas for surgical planning: Osteolytic versus osteoblastic. Surg Neurol Int 2016; 7: S361-S365.
21. Paulíková S, Petera J, Paulík A. Metastatické postižení kostí. Postgrad Med 2011; 13 : 753–759.
22. Štěpán J, Zima T, Petruželka L. Výpověď biochemických markerů remodelace kosti při nádorovém postižení skeletu. Čas Lék Čes 2008; 147 : 7–18.
23. Brunová J, Bruna J. Klinická endokrinologie a zobrazovací diagnostika endokrinopatií. Praha: Maxdorf 2009.
24. Agnihotri M, Kothari K, Naik L. Ω Brown tumor of hyperparathyroidism. Diagn Cytopathol 2017; 45 : 43–44.
25. Zanocco KA, Yeh MW. Primary Hyperparathyroidism: Effects on Bone Health. Endocrinol Metab Clin North Am 2017; 46 : 87–104.
26. Boccalatte LA, Higuera F, Gómez NL, et al. Usefulness of 18 F‑Fluorocholine Positron Emission Tomography‑Computed Tomography in Locating Lesions in Hyperparathyroidism: A Systematic Review. JAMA Otolaryngol – Head Neck Surg 2019.
27. Noltes ME, Kruijff S, Noordzij W, et al. Optimization of parathyroid 11C ‑ choline PET protocol for localization of parathyroid adenomas in patients with primary hyperparathyroidism. EJNMMI Res 2019; 9.
28. Rossi JF, Bataille R, Chappard D, et al. B cell malignancies presenting with unusual bone involvement and mimicking multiple myeloma. Study of nine cases. Am J Med 1987; 83 : 10–16.
29. Alhaj Moustafa M, Seningen JL, Jouni H. Hypercalcemia, Renal Failure, and Skull Lytic Lesions. J Investig Med High Impact Case Rep 2013; 1.
30. Mandal SK, Ganguly J, Sil K, et al. Diagnostic dilemma in a case of osteolytic lesions. BMJ Case Rep 2014; 2014.
31. WHO classification of tumours of haematopoietic and lymphoid tissues. Revised 4th edition. Lyon: International Agency for Research on Cancer; 2017.
32. Teefe E, Kim J, Lopez G, et al. Bilateral femoral osteolytic lesions in a patient with type 3 Gaucher disease. Mol Genet Metab Rep 2015; 5 : 107–109.
33. Wu M, Su J, Yan F, et al. Skipped multifocal extensive spinal tuberculosis involving the whole spine. Medicine (Baltimore) 2018; 97.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2020 Issue 5
-
All articles in this issue
- Etiologie a management dyslipidemie u pacientů s chronickým onemocněním ledvin
- Katetrizační implantace aortální chlopně – co víme v roce 2020
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
- Ropeginterferon alfa-2 b v léčbě pacientů s pravou polycytémií
- Onemocnění jater související s alkoholem (ALD)
- Diabetes mellitus a nelegální drogy
- Pulmo‑renální syndrom
- Srovnání různých přístupů k určení prevalence diabetu 2. typu v ČR
- Terapie dušnosti zdrojem svízelné diagnózy neurologického onemocnění
- Náhodne zistený feochromocytóm u 33-ročného pacienta s Lynchovým syndrómom
- Transplantace jater jako potenciální kurativní metoda těžké hemofilie A: popis případu a literární přehled
- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Praluent (alirokumab)
- Konfokální laserová endomikroskopie v diagnostice onemocnění jícnu: pilotní studie
- Akútna končatinová ischémia v dôsledku paradoxnej embolizácie liečená systémovou trombolýzou
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Onemocnění jater související s alkoholem (ALD)
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
