Ropeginterferon alfa-2 b v léčbě pacientů s pravou polycytémií
Ropeginterferon alfa-2 b for the therapy of polycythemia vera
Interferon alfa (IFN‑α) has been used in the treatment of myeloproliferative disorders for more than 30 years. IFN‑α has been shown to induce clinical, hematological, molecular, and histopathological remission, but its toxicity has remained a limitation of its more widespread use. The development of pegylated forms with a better tolerance has brought new options for patients. Phase III clinical trials, ropeginterferon‑α versus hydroxyurea: PROUD-PV and CONTINUATION-PV, have shown long-term superiority in the efficacy and safety when comparing ropeginterferon alfa-2 b with hydroxyurea. Therapeutic use of interferons is a necessary part of the treatment regimen in younger at-risk patients in the first line, but until now, no SPC of a non-pegylated or pegylated interferon included treatment of patients with polycythemia vera. Ropeginterferon alfa-2 b (Besremi®) is the first and only one to have obtained registration and is available in the European Union as well as the Czech Republic for the treatment of patients with polycythemia vera without symptomatic splenomegaly.
Keywords:
ropeginterferon alfa-2 b – myeloproliferative neoplasms – PROUD-PV – CONTINUATION-PV
Authors:
Libor Červinek
Authors‘ workplace:
Interní hematologická a onkologická klinika LF MU a FN Brno
Published in:
Vnitř Lék 2020; 66(5): 309-313
Category:
Overview
Interferon alfa (IFN‑α) je používán přes 30 let v léčbě myeloproliferativních onemocnění. IFN‑α prokázal schopnost indukovat klinickou, hematologickou, molekulární a histopatologickou remisi, ale jeho toxicita zůstala limitací jeho širšího užití. Vývoj pegylovaných forem s lepší tolerancí přináší pacientům nové možnosti. Klinické studie fáze 3, ropeginterferon‑α versus hydroxyurea: PROUD-PV a CONTINUATION-PV, prokázaly dlouhodobou superioritu v efektivitě a bezpečnosti ve srovnání ropeginterferonu alfa-2 b s hydroxyureou. Léčebné použití interferonů je nutnou součástí léčebného schématu u mladších rizikových pacientů v 1. linii, ale do současnosti žádný nepegylovaný i pegylovaný interferon neměl v SPC léčbu pacientů s pravou polycytémií. Jako první a jediný získal registraci Ropeginterferon alfa-2 b (Besremi®) a je dostupný v Evropské unii i v ČR pro léčbu pacientů s pravou polycytémií bez symptomatické splenomegalie.
Klíčová slova:
ropeginterferon alfa-2 b – myeloproliferativní onemocnění – PROUD-PV – CONTINUATION-PV
Doporučené léčebné postupy pro pacienty s pravou polycytémií (PV) byly v posledních letech revidovány na základě výsledků publikovaných klinických studií, nových poznatků o molekulárně genetické patofyziologii onemocnění, a i v souvislosti s novými léky (1, 2). Pacienti s nízce rizikovým onemocněním jsou léčeni pomocí léčebných venepunkcí a preventivním podáním antiagregačních léků. Naším cílem je udržet hladinu hematokritu pod 45 %. Venepunkce jsou jistě účinnou a bezpečnou léčebnou modalitou, ale mnoho pacientů z této léčby přechází na medikamentózní terapii, nejčastěji podáním cytoreduktivních léků. Problém může být intolerance venepunkce ze strany pacientů, dále rozvoj deficitu železa a také opakované venepunkce naráží na problém s venózním vstupem. Pacienti s vysoce aktivním onemocněním, kteří mají progresivní splenomegalii, leukocytózu, kardiovaskulární rizikové faktory nebo s onemocněním asociované symptomy, jako je svědění, hubnutí či noční pocení, jsou indikováni k cytoreduktivní terapii. Jako vhodná léčba u těchto pacientů se jeví podání interferonu alfa.
Pacienty s vysoce rizikovým onemocněním stratifikujeme dle věku a přítomnosti závažných komorbidit. Pacienti do 70 let věku bez závažných komorbidit léčíme v první linii podáním pegylovaného interferonu alfa, pokud pacienti na tuto léčbu neodpovídají, je v další linii indikována cytoredukční léčba hydroxyureou či podáváním JAK1/2 inhibitoru.
Pro pacienty se závažnými komorbiditami či věkem nad 70 let je v první linii léčba hydroxyureou či pegylovaným interferonem alfa, v druhé linii poté JAK1/2 inhibitor. V klinické praxi se snažíme především u mladších pacientů preferenčně podávat interferon s přihlédnutím k možnému leukemogennímu vlivu hydroxyurey při dlouhodobém užití. Pacientky, které plánují těhotenství a potřebují cytoreduktivní terapii, by měly být preferenčně léčeny interferonem z důvodu potenciální teratogenity hydroxyurey či busulfanu.
Použití inhibitorů JAK1/JAK2 tyrozinkinázy v druhé linii léčby pravé polycytémie je limitováno chybějící úhradou preparátu ze strany plátců zdravotní péče. Ruxolitinib prokázal v klinických studiích u pacientů s pravou polycytémií účinnost stran jak redukce velikosti sleziny, tak i udržení cílového hematokritu.
Již přibližně 30 let je v léčbě myeloproliferativních onemocnění používán interferon alfa. Používání interferonu alfa v oblasti chronické myeloidní leukémie bylo vytlačeno selektivními inhibitory BCR‑ABL fúzního genu. V oblasti Ph negativních (Onemocnění bez filadelfského chromozomu) myeloproliferací zůstalo použití interferonu jednou z doporučených léčebných možností s účinností limitovanou množstvím nežádoucích účinků. Jednou z limitujících vlastností léčby interferonem alfa je nutnost časté parenterální aplikace preparátu a mnohé celkové nežádoucí účinky (flu‑like syndrom, účinky na psychiku, hematologická toxicita, manifestace autoimunitních onemocnění, jaterní toxicita, oční komplikace) (3). V klinické praxi byly v rámci léčby pacientů s polycytemia vera používány standardní preparáty interferon alfa-2 b a interferon alfa-2 a oba tyto preparáty nejsou již v České republice dostupné ke komerčnímu použití. V rámci výzkumu byly vyvinuty pegylované formy interferonu, jež umožnují snížení frekvence podání i četnosti výskytu nežádoucích účinků. V současnosti je na některých pracovištích používán pegylovaný interferon alfa-2 a (Pegasys). Preparát nemá v SPC léčbu pravé polycytemie a jeho výroba bude v následujících měsících z rozhodnutí výrobce ukončena. Inovativním preparátem ze skupiny interferonů je ropeginterferon alfa-2 b, což je preparát obsahující jednu izoformu interferonu, což se projevuje zvýšením snášenlivosti přípravku a pegylační úpravu umožňující snížení frekvenci aplikace na jednou za 2 týdny, v dlouhodobém podání i aplikaci jednou za 3 až 4 týdny.
Srovnání ropeginterferonu alfa-2 b versus standardní léčba pravé polycytemie bylo ověřeno v otevřené multicentrické randomizované klinické studii fáze III PROUD‑PV a v následné extenzi studie CONTINUATION‑PV (4).
V rámci studie bylo zúčastněno 48 center v Evropě a ve studii bylo v obou větvích léčeno celkově 254 dospělých pacientů s PV. Jedním z center bylo i naše pracoviště s celkovým počtem 10 léčených pacientů, tudíž s tímto preparátem máme vlastní 6leté zkušenosti, 5 pacientů z našeho souboru dosud pokračuje v rámci studie CONTINUATION‑PV.
Jelikož se jedná o dosud jedinou publikovanou randomizovanou multicentrickou studii fáze III přímo srovnávající léčbu hydroxyureou s ropeginterferonem alfa-2 b, mohou výsledky ovlivnit léčebná doporučení pro léčbu pacientů s pravou polycytémií.
V rámci klinické studie PROUD‑PV byli zařazení pacienti náhodně rozděleni do dvou ramen v poměru 1 : 1, a to jedné skupiny léčené ropeginterferonem alfa-2 b a do druhé skupiny léčené hydroxyureou, v rámci studie nebylo umožněno pacientům přejít mezi oběma rameny. Primárním cílem klinické studie byla non‑inferiorita ropeginterferonu alfa-2 b vůči hydroxyuree. Hlavní vstupní kritéria pro zařazení do klinické studie byl věk více či rovno 18 let a diagnóza pravé polycytémie dle kritérií WHO z roku 2008, včetně mutace JAK2. Bylo vyžadováno, aby dosud neléčení pacienti byli indikováni k zahájení medikamentózní léčby. Vstup do studie byl umožněn i pacientům dosud léčeným hydroxyureou, pokud byla doba léčby kratší než 3 roky a pokud na této léčbě nebyli pacienti v kompletní remisi nemoci, nebo k léčbě hydroxyureou vykazovali rezistenci či intoleranci dle ELN (Evropská leukemická síť) kritérií. Pokud pacienti dokončili studii PROUD‑PV, byla jim nabídnuta účast v následné extenzivní studii CONTINUATION‑PV. Pacienti, kteří byli v studii PROUD‑PV ve větvi s ropeginterferonem alfa-2 b, pokračovali v této léčbě, pacienti v standardní léčbě pokračovali v užívání hydroxyurey nebo konvenčními nestudiovými interferony, inhibitory JAK2 či podáním anagrelidu, fosforu - 32 či busulfanu (dle rozhodnutí zkoušejícího lékaře).
Randomizace pacientů do jednotlivých ramen studie byla na základě věku, předléčenosti hydroxyureou a historie tromboembolických komplikací. V rámci 12 měsíců trvání klinické studie PROUD‑PV byli pacienti léčeni podkožní aplikací ropeginterferonu alfa-2 b každé 2 týdny. Zahajovací dávka ropeginterferonu alfa-2 b byla 100 μg. Pacienti, již byli dosud léčeni hydroxyureou, začínali léčbu ropeginterferonem v dávce 50 μg. Zahajovací dávka hydroxyurey byla 500 mg/den. Léčebná dávka obou preparátů byla navyšována až do dosažení cílových hodnot hematokritu menšího než 45 % (bez nutnosti venepunkce) a normalizace hladiny trombocytů a leukocytů. Všichni pacienti užívali antiagregační terapii kyselinou acetylsalicylovou či jinou antikoagulační léčbu. V 3měsíčních intervalech byli pacienti v rámci rozšířených vizit vyšetřováni stran kompletního krevního obrazu, laboratorních biochemických a imunologických parametrů, ultrazvukového vyšetření sleziny a srdce a v neposlední řadě i pomocí dotazníků na kvalitu života. Zvláště obezřetně byly sledovány možné tromboembolické příhody, ať již makro - či mikrovaskulární, a specifické projevy nemoci, jako svědění a bolesti hlavy. Po skončení PROUD‑PV studie byli pacienti vyšetřeni stran velikosti sleziny na CT či MR přístroji.
Každých 6 měsíců byla centrálně stanovena alelická nálož mutace JAK2. Primárním složeným cílem studie PROUD‑PV byla hematologická odpověď a normalizace velikosti sleziny. Sekundárními cíli studie bylo stanovení nálože JAK2 mutace, doba do léčebné odpovědi, trvání léčebné odpovědi, potřeba provedení venepunkcí, změna s onemocněním spojených symptomů, změna kvality života dle metodiky (EQ-5D-3L) a nežádoucí příhody dle metodiky GCP (Správná klinická praxe). Primárním cílem klinické studie CONTINUATION‑PV bylo dlouhodobé hodnocení efektivity a bezpečnosti podávání ropeginterferonu alfa-2 b. Složeným primárním cílem byl počet pacientů, kteří dosáhli kompletní hematologické odpovědi a normalizace velikosti sleziny, dále byly hodnoceny s onemocněním spojené příznaky, jako porucha mikrocirkulace, svědění či bolesti hlavy. Sekundárními cíli studie byla změna alelické nálože JAK2, změna hematologických parametrů a velikosti sleziny od zahájení léčby, doba do léčebné odpovědi a trvání léčebné odpovědi, nutnost venepunkcí, změna kvality života a nežádoucí příhody.
Výsledky
V klinické studii PROUD‑PV bylo od 17. září 2013 do 13. března 2015 sledováno 306 pacientů, randomizováno bylo 257 pacientů, z toho 127 pacientů do ramene ropeginterferon alfa-2 b a 130 pacientů do ramene s hydroxyureou (3 pacienti z této větve po randomizace ze studie odstoupili). Viz tabulka 1.
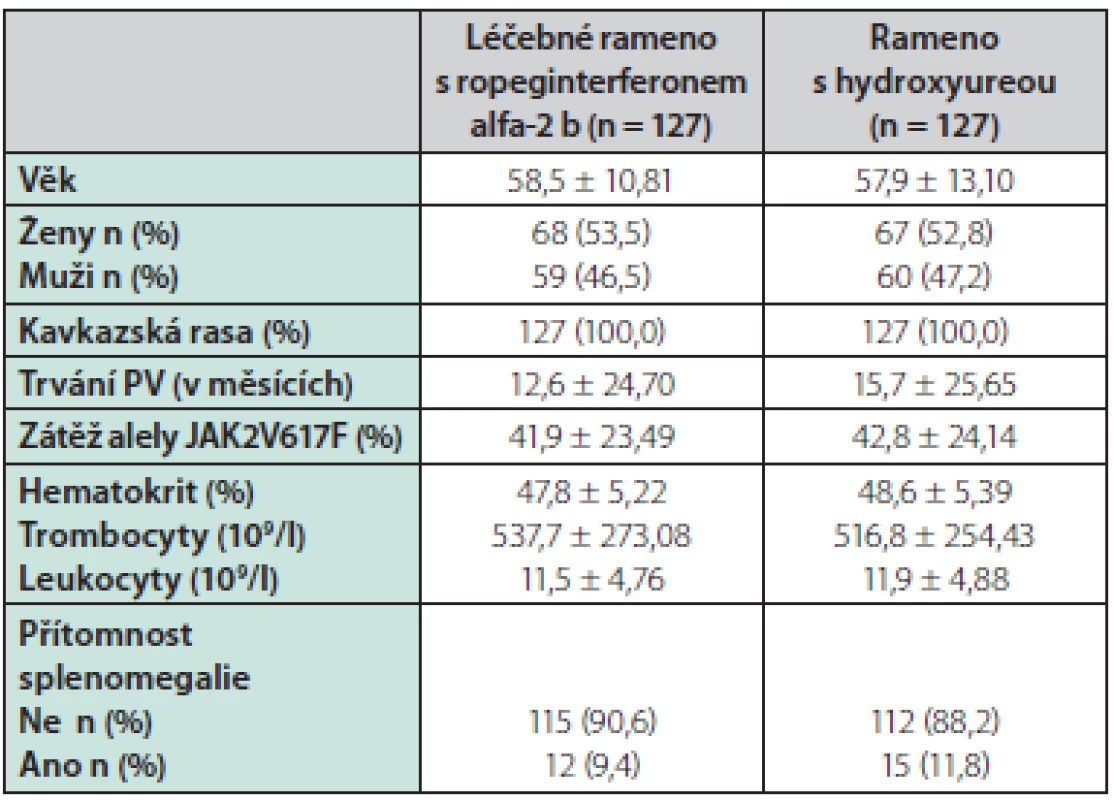
21 pacientů (17 %) ze 127 pacientů léčených ropeginterferonem alfa-2 b a 16 pacientů (13 %) v rameni s hydroxyureou předčasně léčbu ukončilo. 217 pacientů studii PROUD‑PV dokončilo a 171 pacientů pokračovalo do studie CONTINUATION‑PV. Z těchto 95 pacientů (75 %) pokračovalo v léčbě ropeginterferonem alfa-2 b a 76 (60 %) pokračovalo v léčbě běžně dostupnými preparáty. V době statistické analýzy 17 (18 %) pacientů léčených ropeginterferonem a 7 (9 %) léčených standardní studii ukončilo. Medián doby sledování v prvním roce léčby byl v obou větvích 52 týdnů. Medián celkového sledování byl 182,1 týdne (166,3–201,7) v rameni s ropeginterferonem a 164,5 týdne (144,4–159,3) ve větvi s hydroxyureou. Střední efektivní dávky léku bylo dosaženo za přibližně 3,7 měsíce ve větvi s ropeginterferonem a 2,6 měsíce ve větvi s hydroxyureou. V 36. měsíci byl medián dávky ropeginterferonu 425 μg a 1000 mg pro hydroxyureu.
V klinické studii PROUD‑PV 26 (21 %) z 122 pacientů v rameni s ropeginterferonem a 34 (28 %) z 123 pacientů v rameni s hydroxyureou splnilo primární cíl studie kompletní hematologické odpovědi a normalizace velikosti sleziny v 12 měsících léčby. 95% interval spolehlivosti rozdílu v odpovědi byl -17,23 do 4,09, což nesplňovalo kritérium non inferiority (p= 0,23). Kompletní hematologická odpověď bez zahrnutí velikosti sleziny ve 12 měsících – odpovědi byly v obou ramenech obdobné, předléčení hydroxyureou nemělo na dosažení kompletní hematologické odpovědi signifikantní dopad.
V klinické studii CONTINUATION‑PV bylo zastoupení pacientů s kompletní hematologickou odpovědí signifikantně vyšší v rameni s ropeginterferonem alfa-2 b než ve skupině léčených hydroxyureou. Zastoupení pacientů s kompletní hematologickou odpovědí narůstalo od 24. měsíce a bylo nejvyšší v 36. měsíci studie. Rozdíl mezi oběma rameny v dosažení léčebné odpovědi byl v 36. měsíci signifikantní. Kompletní hematologická odpověď včetně normalizace velikosti sleziny u pacientů léčených ropeginterferonem alfa-2 b se s časem navyšovala z 27 (30 %) z 91 pacientů v 12. měsíci na 38 (42 %) z 90 pacientů ve 36. měsíci. Během 36měsíčního léčebného období byl podíl pacientů, kteří vykazovali léčenou odpověď, významně vyšší ve skupině alfa-2 b ropeginterferonu ve srovnání s hydroxyureou (37 [39 %] z 95 pacientů oproti 11 [15 %] z 76 pacientů, p = 0,0011; 28 [30 %] z 95 vs. 11 [15 %] 76, p = 0,025). Viz tabulka 2.

Molekulární odpovědi na léčbu nebyly ve studii PROUD‑PV ve 12 měsících signifikantně odlišné (42 [34 %] ze 123 v ropeginterferonu alfa-2 b skupiny vs. 52 [42 %] ze 123 ve skupině hydroxyurey, p = 0,19). V obou skupinách došlo po 12 měsících léčby ke snížení průměrné hodnoty zátěže alely JAK2 (z 41,9 % [SD 23,49] na 30,7 % [SD 22,66] v rameni ropeginterferonu alfa-2 b a z 42,8 % [SD 24,14] na 25,9 % [SD 21,49] ve skupině hydroxyurey).
V studii CONTINUATION‑PV byl počet pacientů s molekulární odezvou významně vyšší ve skupině alfa-2 b ropeginterferonu než ve skupině hydroxyureou. Pacienti léčení ropeginterferonem alfa-2 b vykázali v 36. měsíci pokles střední nálože alely JAK2 na méně než polovinu vstupní hladiny z 42,8 % [SD 23,4] na 19,7 % [SD 21,3], zatímco ve skupině hydroxyurey byl pokles alelické zátěže přechodný a v 36. měsíci došlo k návratu k původní hladině (42,9% [SD 23,0] při vstupu a 39,3% [SD 25,91]). Viz tabulka 3.
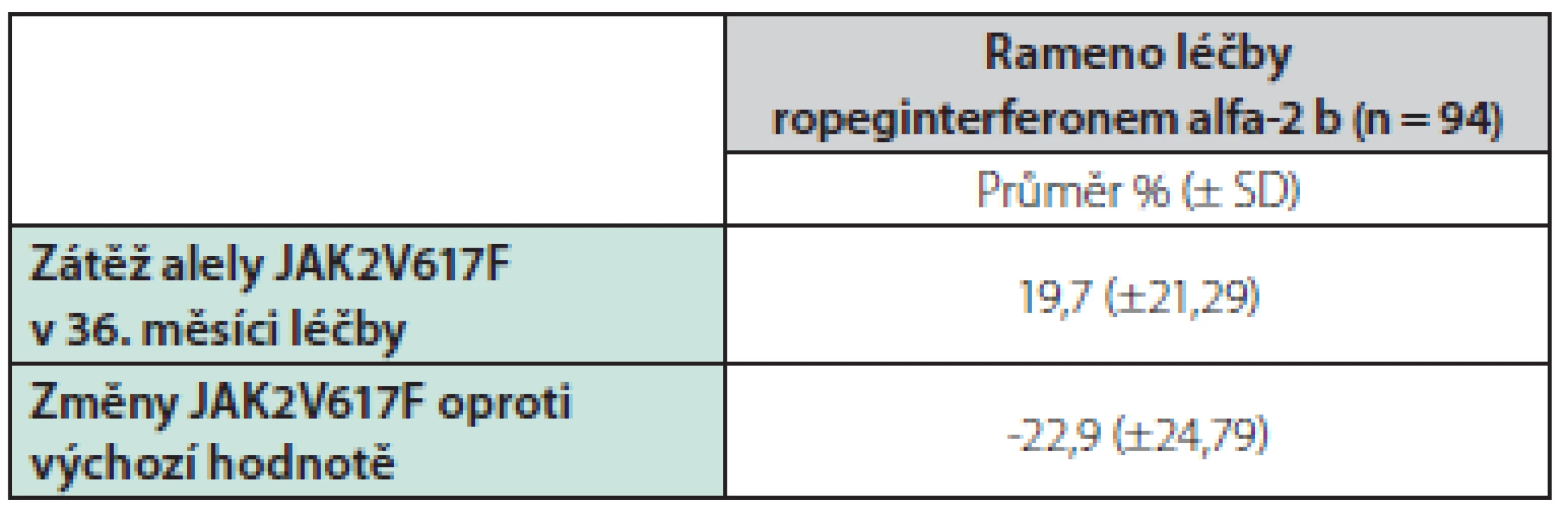
V post‑hoc analýze snížení alelické zátěže JAK2 korelovalo s úplnou hematologickou odpovědí ve 12, 24 a 36 měsících ve skupině s ropeginterferonem alfa-2 b (Pearsonova korelace -0,45 [p <0,0001], -0,24 [p = 0,037] a -0,31 [p = 0,009]). Údaje o kvalitě života hodnocené pomocí EQ-5D-3L dotazníku neprokázaly mezi jednotlivými skupinami v 36. měsíci signifikantní rozdíly.
Nežádoucí účinky v rámci klinické studie vyžadovaly snížení dávky u 51 (40 %) ze 127 pacientů ve skupině alfa-2 b ropeginterferonu a 74 (58 %) ze 127 pacientů ve standardní léčebné skupině a přerušení dávky u 29 (23 %) ze 127 pacientů a 23 (18 %) ze 127 pacientů, resp. 11 pacientů (8 %) ze 127 pacientů ve větvi s ropeginterferonem alfa-2 b ukončilo studii předčasně kvůli toxicitě léčby, ve skupině s hydroxyureou pět (4 %) ze 127 pacientů přerušilo léčbu z důvodu toxicity.
Nejčastěji hlášené nežádoucí účinky (> 10 % pacientů) u 127 pacientů ve skupině ropeginterferonu alfa-2 b byly trombocytopenie (28 [22 %]), leukopenie (25 [20 %]), zvýšená y‑glutamyltransferáza (24 [19 %]), únava (17 [13 %]), zvýšená alaninaminotransferáza (17 [13 %]), anémie (16 [13 %]), zvýšená aspartátaminotransferáza (13 [10 %]), bolesti hlavy (15 [12 %]), artralgie (15 [12 %]) a závratě (14 [11 %]). Nejčastěji hlášené nežádoucí účinky u 127 pacientů ve standardní terapeutické skupině byly trombocytopenie (37 [29 %]), anémie (32 [25 %]), leukopenie (29 [23 %]), únava (18 [14 %]), bolesti hlavy (16 [13 %]), nevolnost (15 [12 %]), průjem (14 [11 %]) a nazofaryngitida (13 [10 %]). Nežádoucí události, které byly investigátory hodnoceny jako s léčbou asociované, byly hlášeny u 95 (75 %) ze 127 pacientů ve skupině ropeginterferonu alfa-2 b a u 100 (79 %) ze 127 pacientů ve standardní terapeutické skupině. Počet závažných nežádoucích událostí stupně tři nebo vyšší byly podobné v obou léčebných skupinách. Závažné nežádoucí účinky se vyskytly u tří (2 %) ze 127 pacientů ve skupině s ropeginterferonem alfa-2 b skupina a pěti (4 %) ze 127 pacientů na hydroxyurey. Byl hlášen jeden případ akutní leukémie v souvislosti léčbou s hydroxyureou. Byla zaznamenána další tři úmrtí, všechna nesouvisející s léčbou.
Kardiovaskulární nežádoucí účinky, jež jsou v souvislosti se základním onemocněním, byly hlášeny v obou ramenech studie, u ropeginterferonu alfa-2 b (16 událostí u 13 [10 %] ze 127 pacientů) a ve standardní terapeutické skupině (25 událostí u osmi [6 %] ze 127 pacientů). Frekvence závažných tromboembolických nežádoucích účinků – události byly mezi ropeginterferonem alfa-2 b podobné se skupinou standardní terapie.
Nejčastěji hlášeným nežádoucím účinkem 3. a 4. stupně v souvislosti s léčbou byla zvýšená y‑glutamyltransferáza (sedm [6 %] ze 127 pacientů) a zvýšená alaninaminotransferáza (čtyři [3 %] ze 127 pacientů) ve skupině ropeginterferon alfa-2 b a leukopenie (šest [5 %] ze 127 pacientů) a trombocytopenie (pět [4 %] ze 127 pacientů) ve standardní terapeutické skupině. Frekvence hlášených novotvarů byla podobná ve skupině ropeginterferonu alfa-2 b (devět [7 %] ze 127) a ve standardní léčbě hydroxyureou (deset [8 %] ze 127). Ve skupině pacientů léčených hydroxyureou byla hlášena leukémie u dvou [2 %] ze 127 pacientů a rakovina kůže v souvislosti s léčbou u 3 [2 %] ze 127 pacientů.
Diskuze
Publikovaná randomizovaná multicentrická studie fáze III přímo srovnávající léčbu hydroxyureou s ropeginterferonem alfa 2-b přináší několik velmi důležitých výsledků. Studie prokázala signifikantně lepší výsledky užití ropeginterferonu vůči hydroxyuree v 36. měsíci léčby, a to jak ve smyslu dosažení kompletní hematologické remise onemocnění, tak i ve snížení mutační zátěže alely JAK2. Interferon alfa má inhibiční účinek na proliferaci hematopoetických buněk a progenitorových buněk fibroblastů kostní dřeně a antagonizuje působení růstových faktorů a dalších cytokinů. V rámci studie byl zřetelně dokumentován pomalejší nástup léčebného účinku ropeginterferonu ve srovnání s hydroxyureou. Nová aplikační forma Ropeginterferon alfa 2-b umožnila oproti konvenčním i ostatním pegylovaným interferonům snížení frekvence aplikace léku a tím nižší výskyt s aplikací asociovaných nežádoucích účinků interferonu. Srovnání s hydroxyureou prokázalo vysokou účinnost a bezpečnost ropeginterferonu, velkou výhodou interferonu je to, že preparát nemá potenciální rizika stran leukemogeneze.
Publikovaná studie zahrnovala především pacienty s časnou diagnózou pravé polycytémie, a to jak pacienty dosud bez léčby či do 3 let léčby hydroxyureou. Jelikož bylo do studie zařazeno vstupně poměrně málo pacientů s manifestní splenomegalií, bylo by vhodné efekt ropeginterferonu v této skupině pacientů porovnat s podáním inhibitorů JAK1/JAK2 tyrozinkinázy, a to v kombinaci či v přímém srovnání preparátů.
Závěr
Výsledky prezentovaných klinických studií u pacientů s pravou polycytémií dokumentují v dlouhodobém horizontu lepší účinnost a bezpečnost ropeginterferonu alfa-2 b v porovnání s hydroxyureou. Léčebné použití interferonů je nutnou součástí léčebného schématu u mladších rizikových pacientů v 1. linii, ale žádný do současnosti dostupný interferon nemá v SPC léčbu pacientů s pravou polycytémií. Ropeginterferon alfa-2 b (Besremi®) získal jako jediný interferon registraci v rámci Evropské unie pro léčbu pacientů s pravou polycytémií bez symptomatické splenomegalie. Díky tomu, že ropeginterferon alfa-2 b (Besremi®) prokázal účinnost a bezpečnost u mladších pacientů s PV ve vysokém riziku v klinických studií v první linii léčby, patří mu toto místo i v léčbě našich pacientů s PV.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Libor Červinek, Ph.D., Cervinek.libor@fnbrno.cz
Interní hematologická a onkologická klinika FN Brno a LF MU
Článek přijat redakcí: 28. 5. 2020
Článek přijat po recenzích k publikaci: 11. 6. 2020
Sources
1. Barbui T, Tefferi A, Vannuchi AM, et al. Philadelphia chromoseme‑negative classical myeloproliferative neoplasm: revised management recommendations from European Leu‑kemia Net Leukemia 2018 May; 32(5): 1057–1069.
2. Hatalova A, Schwarz J, Gotic M, et al. Recommendations for the diagnosis and tre‑atment of patients with polycythaemia vera Eur J Haematol 2018; 101(5): 654–664.
3. Kissova J. Interferon‑alfa v léčbě myeloproliferativních onemocnění Vnitř. Lék 2019; 65 (11): 699–704.
4. Gisslinger H, Klade C, Georgiev P, Mayer J, et al. Ropeginterferon alfa-2 b versus stan‑dard therapy for poly cythaemia vera (PROUD‑PV and CONTINUATION‑PV): a randomised, non inferiority, phase 3 trial and its extension study. Lancet Haematol 2020 Mar; 7(3): e196–e208.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2020 Issue 5
-
All articles in this issue
- Etiologie a management dyslipidemie u pacientů s chronickým onemocněním ledvin
- Katetrizační implantace aortální chlopně – co víme v roce 2020
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
- Ropeginterferon alfa-2 b v léčbě pacientů s pravou polycytémií
- Onemocnění jater související s alkoholem (ALD)
- Diabetes mellitus a nelegální drogy
- Pulmo‑renální syndrom
- Srovnání různých přístupů k určení prevalence diabetu 2. typu v ČR
- Terapie dušnosti zdrojem svízelné diagnózy neurologického onemocnění
- Náhodne zistený feochromocytóm u 33-ročného pacienta s Lynchovým syndrómom
- Transplantace jater jako potenciální kurativní metoda těžké hemofilie A: popis případu a literární přehled
- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Praluent (alirokumab)
- Konfokální laserová endomikroskopie v diagnostice onemocnění jícnu: pilotní studie
- Akútna končatinová ischémia v dôsledku paradoxnej embolizácie liečená systémovou trombolýzou
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Onemocnění jater související s alkoholem (ALD)
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
