Katetrizační implantace aortální chlopně – co víme v roce 2020
Transcatheter aortic valve implantation – what do we know in 2020
stenosis is the most common acquired valve disease in adults and the prevalence of this disease is increasing with the aging population. Transcatheter aortic valve implantation (TAVI) became fully established method for treating this disease. The aim of this review is to present the current view of the performance technique, to summarize the data on the outcome of patients from recently published randomized studies and registries and to simply describe patient care after the procedure.
Keywords:
aortic stenosis – patient´s outcome – transcatheter implantation
Authors:
Petr Toušek 1; Viktor Kočka 1; Petr Mašek 2
Authors‘ workplace:
III. interní – kardiologická klinika 3. LF UK a FN Královské Vinohrady Praha
1; Medtronic Czechia, s. r. o. (partner v projektu INTERCARDIS)
2
Published in:
Vnitř Lék 2020; 66(5): 282-286
Category:
Overview
Aortální stenóza je nejčastější získanou chlopenní vadou v dospělosti a se stárnutím populace se prevalence tohoto onemocnění stále zvyšuje. Katetrizační implantace aortální chlopně (TAVI) je již plně zavedenou metodou v léčbě tohoto onemocnění. Tento přehledový článek si klade za cíl představit aktuální pohled na techniku výkonu, shrnout data o osudu nemocných z recentně publikovaných randomizovaných studií i registrů a jednoduše popsat péči o pacienty po výkonu.
Klíčová slova:
aortální stenóza – katetrizační implantace – osud nemocných
Úvod
Aortální stenóza je nejčastější získanou chlopenní vadou v dospělosti a se stárnutím populace se prevalence tohoto onemocnění stále zvyšuje. Prevalence významné aortální stenózy u osob starších 65 let je okolo 1 %, u osob starších 75 let mezi 3–4 % (1, 2). Od roku 1960 byla jedinou metodou léčby pacientů s významnou symptomatickou aortální stenózou chirurgická náhrada aortální chlopně. Zhruba třetina nemocných však byla k chirurgickému výkonu kontraindikována vzhledem nepřiměřeně vysokému operačnímu riziku. V roce 2002 byla poprvé provedena katetrizační implantace aortální chlopně (transcatheter aortic valve implantation – TAVI), která se od roku 2007 velmi rychle rozšířila do klinické praxe (3). Do jisté míry se jedná o revoluci v léčbě aortální stenózy. Metoda dala šanci na prodloužení života pacientům kontraindikovaným k chirurgické náhradě a stala se více než vhodnou alternativou chirurgické náhrady u pacientů s vyšším operačním rizikem. V průběhu posledních 10 let se díky zkušenostem pracovišť a technologickému zdokonalování dále zmenšuje počet komplikací při TAVI a posouvají se indikační kritéria. Na kongresu Americké kardiologické společnosti (ACC 2019) byly publikovány 2 studie, které navíc ukázaly excelentní krátkodobé výsledky TAVI i u pacientů s nízkým operačním rizikem. Počet výkonů tak celosvětově strmě stoupá. Katetrizační implantace aortální chlopně již byla provedena u více než 300 000 osob (4). Tento přehledový článek si klade za cíl představit současný pohled na tuto metodu i v kontextu více než 10leté zkušenosti autorů tohoto článku s metodou.
Technika výkonu
V současné době již existuje několik druhů katetrizačně implantovatelných protéz. Existují ale pouze 2 způsoby vlastní implantace do aortální anulu:
- protéza se sama rozvine po vysunutí ze zaváděcího katétru – samoexpandabilní protéza (před konečným uvolněním lze znovu zavinout do katétru a následně měnit pozici) nebo
- je rozvinuta pomocí nafouknutí balónu, na kterém je nasazena – „balónexpandabilní“ protéza.
Na Obr. 1 je znázorněn v současnosti nejčastěji používaný typ samoexpandabilní protézy Evolut R (Medtronic, Minneapolis, Minnesota, USA) a balónexpandabilní protézy Sapien 3 (Edwards Lifesciences, Irvine, CA, USA). Vedle způsobu implantace se liší i použitým materiálem kovového rámu a původem chlopenních cípů (Nitinolol a prasečí perikard u protézy Evolut R, chrom‑cobalt a hovězí perikard u protézy Sapien 3). Osud nemocných při použití obou typů chlopenních protéz v krátkodobém i střednědobém horizontu je podobný (5–11). Katetrizační implantaci aortální chlopně s odstupem předchází provedení koronarografie s případnou intervencí významných stenóz na věnčitých tepnách a kvalitní analýza aortálního kořene a přístupových cest pomocí CT.
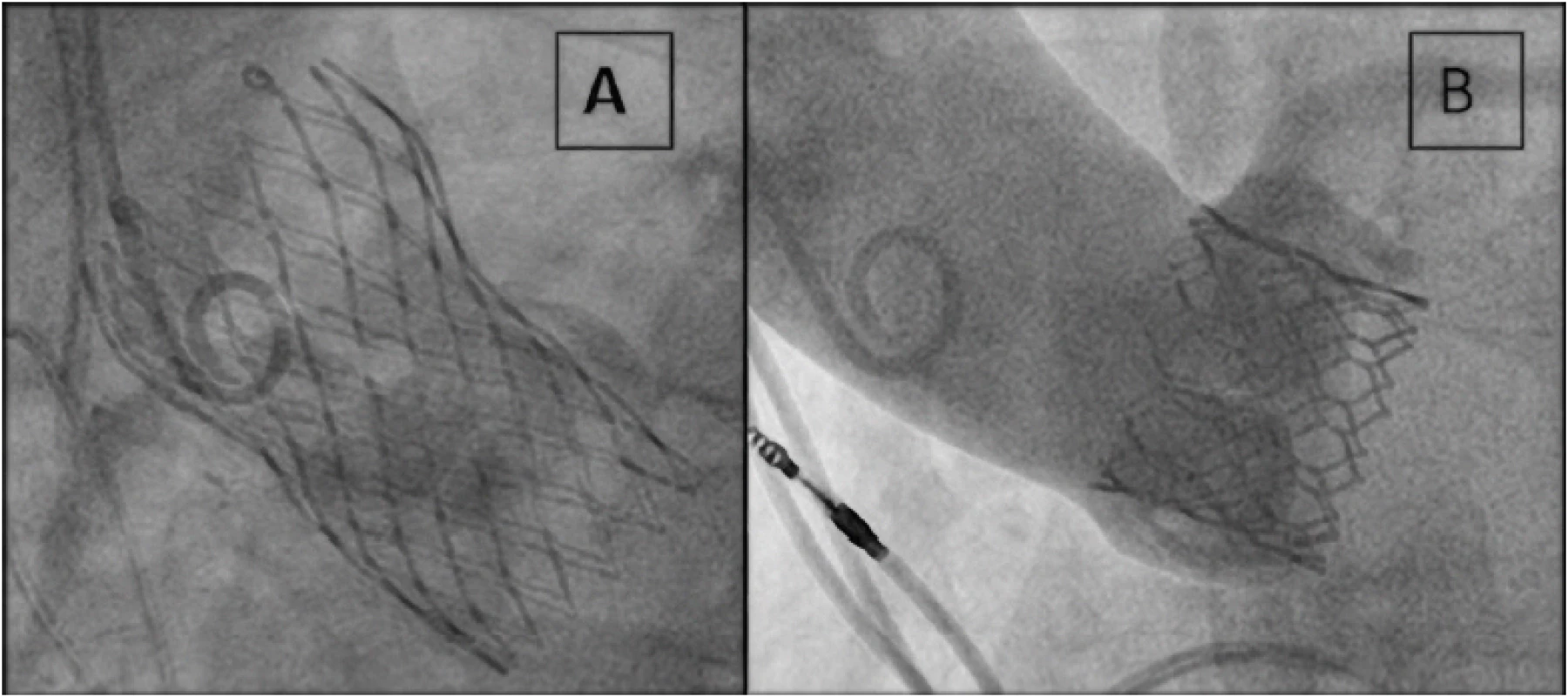
Jednoznačným trendem je provádění výkonů s co nejmenším zatížením pacienta bez celkové anestezie a s použitím femorální tepny jako přístupu do cévního řečiště. Provádění výkonů v analgosedaci nebo v lokální anestezii je spojeno s lepším 30denním přežíváním nemocných a zkrácením doby hospitalizace (12). Díky zmenšení profilu zaváděcího instrumentaria (14 F) lze v současné době provést převážnou většinu cestou femorálního přístupu s následným ošetřením tepny perkutánně zavedeným stehem. Požadavkem na minimální průměr femorální tepny je 5–5,5 mm dle typu zaváděné protézy. Při nemožnosti použití femorálního přístupu lze alternativně použít ve spolupráci s cévním chirurgem přístup subklaviální (ideálně levostranný), případně ve spolupráci s kardiochirurgem přístup transapikální nebo přímý aortální. Na našem pracovišti jsme byli schopni provést TAVI cestou femorálního přístupu u 97 % pacientů. Použití femorálního přístupu je jednoznačně spojeno s lepší prognózou nemocných a kratší dobou hospitalizace v porovnání s transapikálním nebo přímým aortálním přístupem (13, 14). Již byla publikována práce, která ukazuje, že po použití femorálního přístupu lze propustit bezpečně pacienty následující den po TAVI, pokud jsou splněny nastavené podmínky (15).
Osud nemocných po TAVI
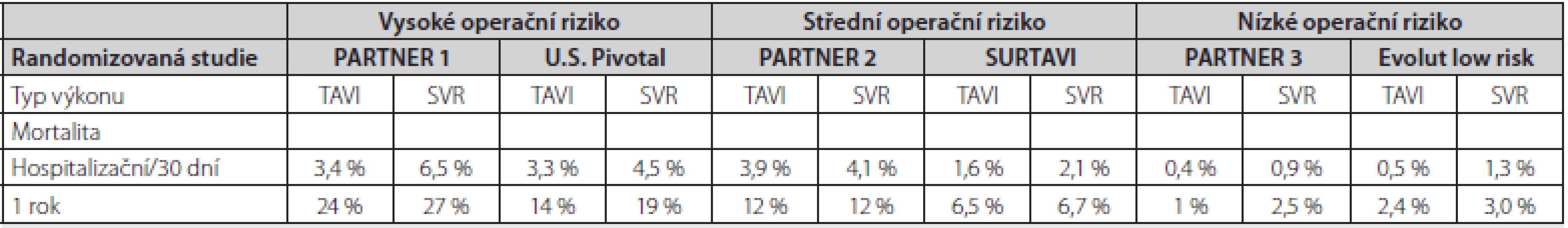
S přibývajícím počtem výkonů, zkušenostmi operatérů a díky technologickému pokroku se významně snižuje krátkodobá mortalita po TAVI i počet komplikací spojených s výkonem. Hospitalizační mortalita pacientů po TAVI s použitím 1. generace katetrizačně implantovatelných chlopní se pohybovala ve velkých registrech okolo 5 % (16, 17). Poslední data z velkých registrů ve Velké Británii (UK TAVI registr) a z Německa (GARY) ukazují, že nemocniční mortalita se snížila až na 1,8 % a 2,5 %, respektive (17, 18). Také na našem pracovišti se snížila 30denní mortalita z 5,1 % (období let 2009–2015, 176 pacientů) na 2,6 % (období let 2016 – 2019, 160 pacientů). Významně se také snižuje počet periprocedurálních komplikací. Četnost dále uvedených periprocedurálních komplikací je čerpána z GARY registru, který patří k největšímu světovému registru a shromažďuje informace o všech pacientech, kteří podstupují TAVI v Německu (18). Mezi nejčastější komplikace patří převodní porucha s nutností implantace trvalého kardiostimulátoru (11,4 %) častější u samoexpandibilních protéz) a vaskulární komplikace v místě přístupu do cévního řečiště (7,4 %). Cévní mozková příhoda vznikla u 2,2 % pacientů, závažné renální selhání s nutností hemodialýzy u 3 % a nutná revize kardiochirurgem u 1,6 % pacientů. Jednoroční mortalita pacientů, u kterých byla implantována poslední generace chlopenních protéz, se v běžné klinické praxi u pacientů s vyšším operačním rizikem pohybuje okolo 10 % (10, 11). V nedávno publikovaných pracích hodnotících krátkodobý osud nemocných s nízkým operačním rizikem byla jednoroční mortalita po TAVI dokonce 1–2,4 % a byla statisticky významně nižší než u pacientů po chirurgické náhradě aortální chlopně. Krátkodobou a střednědobou mortalitu v důležitých randomizovaných studiích dle rizika pacientů ukazuje Tab. 2.
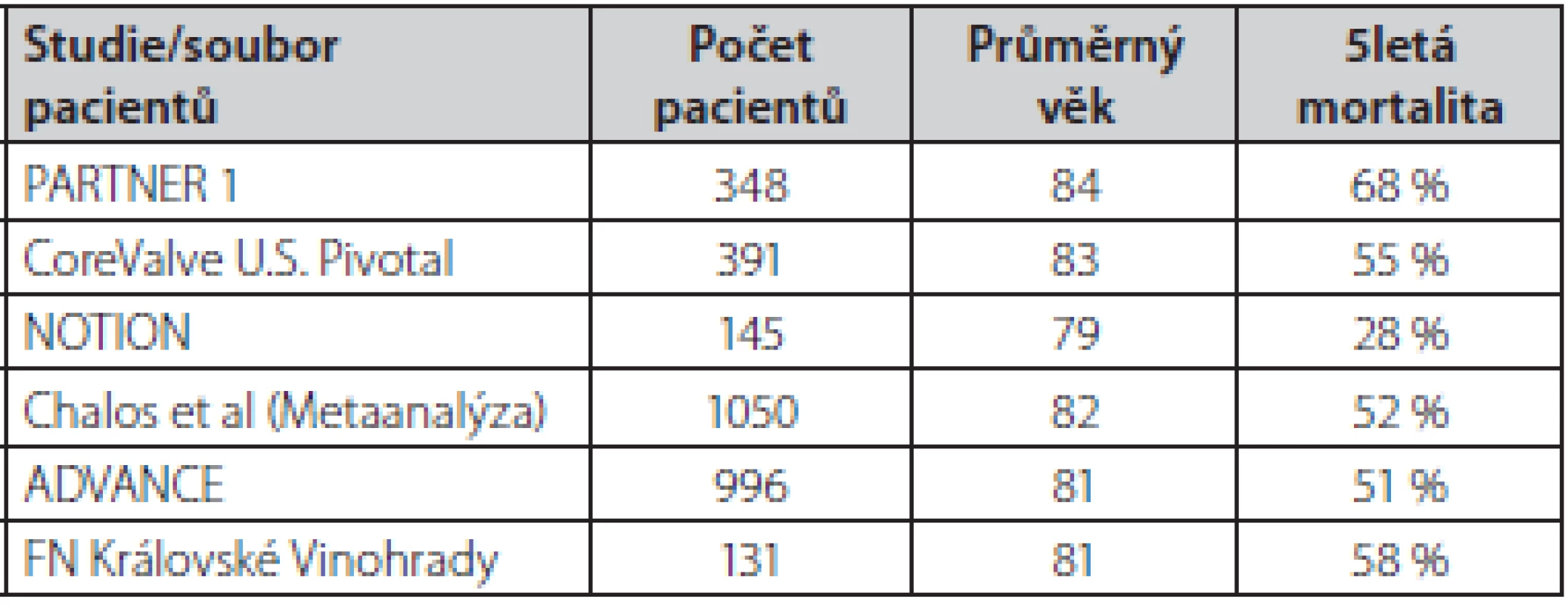
Zatím ale existuje poměrně málo dat ohledně dlouhodobého (5 let a více) osudu nemocných po TAVI. V dostupných pracích se 5letá mortalita nemocných po TAVI pohybuje mezi 50–60 % (Tab. 2.) (19–21). Výjimkou je nižší 5letá mortalita (28 %) pacientů v malé randomizované studii NOTION, kam však byli zařazeni mladší a málo rizikoví pacienti (22). Dlouhodobá mortalita v ostatních pracích odráží základní charakteristiku nemocných (průměrný věk přes 80 let s řadou přidružených chorob). V našem souboru pacientů po TAVI je 5letá mortalita 58 % (průměrný věk nemocných 81 let). Příčina úmrtí byla v 70 % kardiovaskulární. Z doposud publikovaných prací je zřejmé, že dlouhodobý osud nemocných po TAVI je srovnatelný s osudem pacientů po chirurgické náhradě aortální chlopně (19, 21). Další práce také velmi názorně ukázaly, že dlouhodobá mortalita obecné populace nad 80 let se liší jen velmi málo v porovnání s pacienty po TAVI (17, 20).
Indikační kritéria
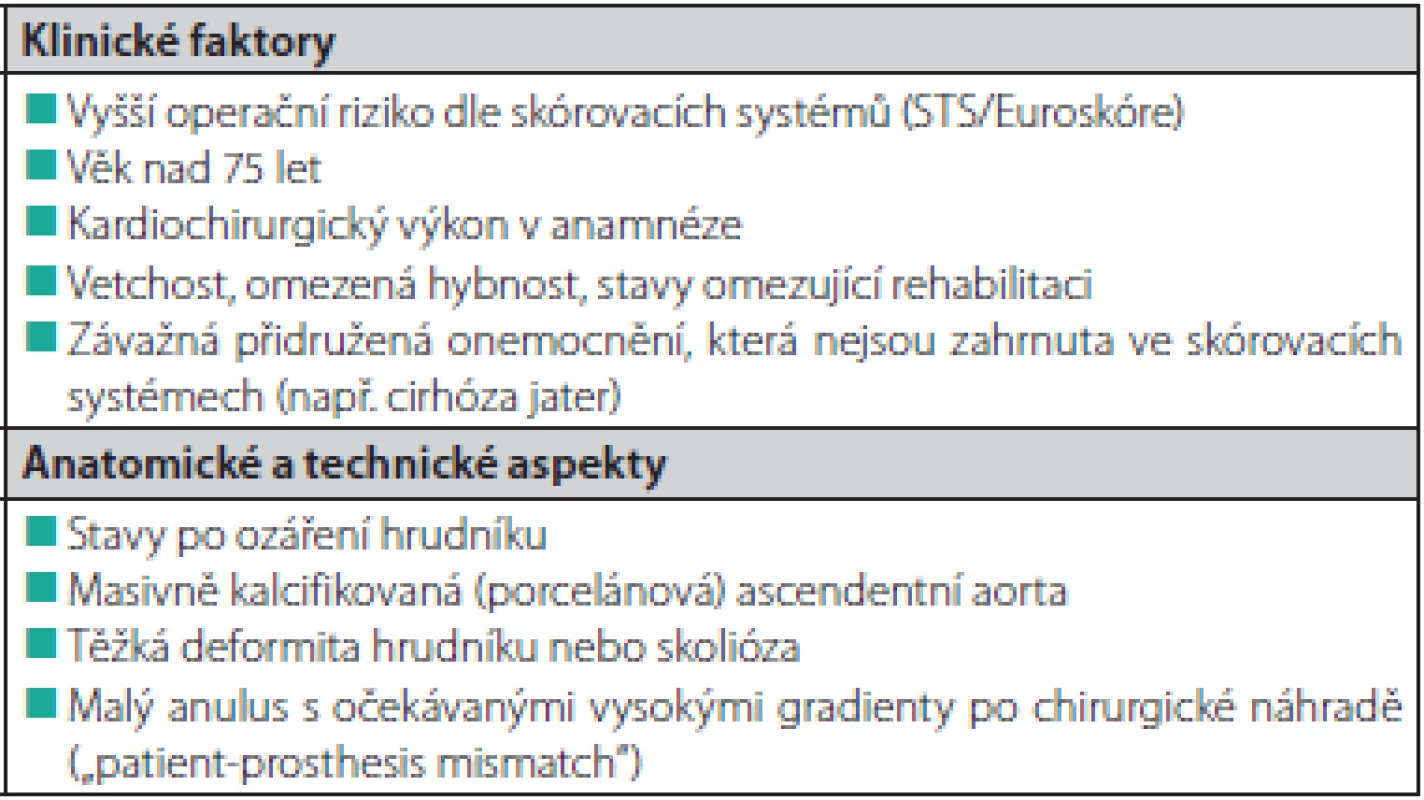
Základem indikace intervence (katetrizační nebo chirurgické) u pacientů s aortální stenózou je klinický stav pacienta, echokardiografické vyšetření s potvrzením významné aortální stenózy a společné rozhodnutí o typu výkonu kardiotýmem kardiocentra (za přítomnosti kardiochirurga). U pacientů indikovaných k TAVI je důležitá anatomická vhodnost (především závisí na velikosti aortálního anulu a Valsalvových sinů). V Tab. 3. jsou uvedeny faktory, které by při indikacích podle posledních doporučení Evropské kardiologické společnosti měly přispívat k rozhodnutí o výběru katetrizační náhrady aortální chlopně. V přítomnosti závažného koronárního postižení s nutností revaskularizace, indikace výkonu na dalších chlopních, významné dilataci ascendentní aorty nebo podezření na infekční endokarditidu by měla být provedena kardiochirurgická operace (23). Katetrizačně implantovatelné protézy lze také úspěšně použít u pacientů s degenerací chirurgických bioprotéz v aortální i mitrální pozici (24–26). V případě degenerace bioprotézy v mitrální pozici je nutné použít pouze balónexpandibilní protézu transseptálním nebo transapikálním přístupem.
Další významné posunutí indikačních kritérií (především do nízce rizikových skupin nemocných) ve prospěch TAVI lze očekávat až při znalosti dobré dlouhodobé funkce katetrizačně implantovatelných protéz. Doposud publikované práce ohledně vzniku degenerativních změn katetrizačně implantovatelných protéz jsou velmi nadějné (27, 28).
Péče o pacienta po TAVI
Péče o pacienta po TAVI v ambulantní sféře by se měla zaměřit především na prevenci tromboembolických příhod, prevenci vzniku infekční endokarditidy a hodnocení funkce protézy v dlouhodobém horizontu. V současné době probíhá několik velkých randomizovaných studií ke zjištění optimální antitrombotické léčby u pacientů po TAVI. Zatím se v prvních 3–6 měsících po TAVI doporučuje duální protidestičková léčba (kyselina acetylsalicylová + klopidogrel). U pacientů s indikací k antikoagulační léčbě (např. fibrilace síní) se v současné době doporučuje ponechat pouze antikoagulační léčbu bez protidestičkové léčby (31). Prevence infekční endokarditidy u pacientů po TAVI je stejná jako u pacientů po chirurgické náhradě. Antibiotická profylaxe se požaduje především v případě rozsáhlejších stomatologických výkonů (manipulace s dásní, periapikální oblasti zubu). Echokardiografické zhodnocení funkce katetrizačně implantované chlopně by mělo být provedeno za 30 dní po výkonu a následně každý rok od výkonu. Při hodnocení funkce protézy by se měl lékař zaměřit na posouzení vzestupu gradientu na protéze a rozvoji nové regurgitace.
Závěr
Katetrizační náhrada aortální chlopně je již plně zavedenou léčebnou metodou v léčbě pacientů s významnou aortální stenózou. Vzhledem ke stárnutí populace a s tím spojené vyšší incidenci tohoto onemocnění se bude nadále zvyšovat počet výkonů. Významné navýšení počtu výkonů lze očekávat dále po potvrzení dlouhodobé účinnosti katetrizačně implantovatelných protéz. S pacienty se tak budou v následujících letech kromě kardiologů setkávat i další ošetřující lékaři, kteří by měli mít základní přehled o metodě a péči o pacienta po výkonu.
Práce podpořena programem Univerzitní výzkumná centra Univerzity Karlovy č. UNCE/MED/002 a z OP VVV projektem Intervenční léčba život ohrožujících kardiovaskulárních onemocnění – INTERCARDIS, reg. č. CZ.02.1.01/0.0/0.0/16_026/0008388.
Sources
1. Durko AP, Osnabrugge RL, Van Mieghem NM, et al. Annual number of candidates for transcatheter aortic valve implantation per country: current estimates and future projections. Eur Heart J 2018; 39 : 2635–2642.
2. Osnabrugge RL, Mylotte D, Head SJ, et al. Aortic stenosis in the elderly: disease prevalence and number of candidates for transcatheter aortic valve replacement: a meta-analysis and modeling study. J Am Coll Cardiol 2013; 62 : 1002–1012.
3. Cribier A, Eltchaninoff H, Bash A, et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation 2002; 106 : 3006–3008.
4. Cahill TJ, Chen M, Hayashida K, et al. Transcatheter aortic valve implantation: current status and future perspectives. Eur Heart J 2018; 39 : 2625–2634.
5. Abdel-Wahab M, Mehilli J, Frerker C, et al. Comparison of balloon-expandable vs self ‑ -expandable valves in patients undergoing transcatheter aortic valve replacement: the CHOICE randomized clinical trial. JAMA 2014; 311 : 1503–1514.
6. Adams DH, Popma JJ, Reardon MJ et al. Transcatheter aortic-valve replacement with a self-expanding prosthesis. N Engl J Med 2014; 370 : 1790–1798.
7. Gerckens U, Tamburino C, Bleiziffer S et al. Final 5-year clinical and echocardiographic results for treatment of severe aortic stenosis with a self-expanding bioprosthesis from the ADVANCE Study. Eur Heart J 2017; 38 : 2729–2738.
8. Kodali SK, Williams MR, Smith CR, et al. Two-year outcomes after transcatheter or surgical aortic-valve replacement. N Engl J Med 2012; 366 : 1686–1695.
9. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med 2016; 374 : 1609–1620.
10. Wendler O, Schymik G, Treede H, et al. SOURCE 3 : 1-year outcomes post-transcatheter aortic valve implantation using the latest generation of the balloon-expandable transcatheter heart valve. Eur Heart J 2017; 38 : 2717–2726.
11. Manoharan G, Van Mieghem NM, Windecker S et al. 1-Year Outcomes With the Evolut R Self-Expanding Transcatheter Aortic Valve: From the International FORWARD Study. JACC Cardiovasc Interv 2018; 11 : 2326–2334.
12. Attizzani GF, Patel SM, Dangas GD, et al. Comparison of Local Versus General Anesthesia Following Transfemoral Transcatheter Self-Expanding Aortic Valve Implantation (from the Transcatheter Valve Therapeutics Registry). Am J Cardiol 2019; 123 : 419–425.
13. Biancari F, Rosato S, D’Errigo P, et al. Immediate and Intermediate Outcome After Transapical Versus Transfemoral Transcatheter Aortic Valve Replacement. Am J Cardiol 2016; 117 : 245–251.
14. Cocchieri R, Petzina R, Romano M, et al. Outcomes after transaortic transcatheter aortic valve implantation: long-term findings from the European ROUTE. Eur J Cardiothorac Surg 2019; 55 : 737–743
15. Wood DA, Lauck SB, Cairns JA, et al. The Vancouver 3M (Multidisciplinary, Multimodality, But Minimalist) Clinical Pathway Facilitates Safe Next-Day Discharge Home at Low-, Medium-, and High-Volume Transfemoral Transcatheter Aortic Valve Replacement Centers: The 3M TAVR Study. JACC Cardiovasc Interv 2019; 12 : 459–469.
16. Walther T, Hamm CW, Schuler G, et al. Perioperative Results and Complications in 15,964 Transcatheter Aortic Valve Replacements: Prospective Data From the GARY Registry. J Am Coll Cardiol 2015; 65 : 2173–2180.
17. Ludman PF. UK TAVI registry. Heart 2019; 105: (Suppl. 2): s2–s5.
18. Gaede L, Blumenstein J, Liebetrau C, et al. Outcome after transvascular transcatheter aortic valve implantation in 2016. Eur Heart J 2018; 39 : 667–675.
19. Mack MJ, Leon MB, Smith CR, et al. 5-year outcomes of transcatheter aortic valve replacement or surgical aortic valve replacement for high surgical risk patients with aortic stenosis (PARTNER 1): a randomised controlled trial. Lancet 2015; 385 : 2477–2484.
20. Chakos A, Wilson-Smith A, Arora S, et al. Long term outcomes of transcatheter aortic valve implantation (TAVI): a systematic review of 5-year survival and beyond. Ann Cardiothorac Surg 2017; 6 : 432–443.
21. Gleason TG, Reardon MD, Popma JJ, et al. 5-Year Outcomes of Self-Expanding Transcatheter Versus Surgical Aortic Valve Replacement in High-Risk Patients. J Am Coll Cardiol 2018; 72 : 2687–2696.
22. Thyregod HGH, Ihlemann N, Jorgensen TH, et al. Five-Year Clinical and Echocardiographic Outcomes from the Nordic Aortic Valve Intervention (NOTION) Randomized Clinical Trial in Lower Surgical Risk Patients. Circulation 2019. E pub ahead of print.
23. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38 : 2739–2791.
24. Deeb GM, Chetcuti SJ, Reardon MJ, et al. 1-Year Results in Patients Undergoing Transcatheter Aortic Valve Replacement With Failed Surgical Bioprostheses. JACC Cardiovasc Interv 2017; 10 : 1034–1044.
25. Webb JG, Mack MJ, White JM, et al. Transcatheter Aortic Valve Implantation Within Degenerated Aortic Surgical Bioprostheses: PARTNER 2 Valve-in-Valve Registry. J Am Coll Cardiol 2017; 69 : 2253–2262.
26. Yoon SH, Whisenant BK, Bleiziffer S, et al. Outcomes of transcatheter mitral valve replacement for degenerated bioprostheses, failed annuloplasty rings, and mitral annular calcification. Eur Heart J 2019; 40 : 441–451.
27. Sondergaard L, Ihlemann N, Capodanno D, et al., Durability of Transcatheter and Surgical Bioprosthetic Aortic Valves in Patients at Lower Surgical Risk. J Am Coll Cardiol 2019; 73 : 546–553.
28. Sulzenko J, Tousek P, Kocka V, et al. Transcatheter aortic valve implantation: long-term clinical outcome and valve durability. Expert Rev Med Devices 2015; 12 : 529–535.
29. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med 2011; 364 : 2187–2198.
30. Reardon MJ, Van Mieghem NM, Popma JJ, et al. Surgical or Transcatheter Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med 2017; 376 : 1321–1331.
31. Nijenhuis VJ, Brouwer J, Delewi R, et al. Anticoagulation with or without Clopidogrel after Transcatheter Aortic-Valve Implantation. N Engl J Med. 2020 Apr 30; 382(18): 1696–1707.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2020 Issue 5
-
All articles in this issue
- Etiologie a management dyslipidemie u pacientů s chronickým onemocněním ledvin
- Katetrizační implantace aortální chlopně – co víme v roce 2020
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
- Ropeginterferon alfa-2 b v léčbě pacientů s pravou polycytémií
- Onemocnění jater související s alkoholem (ALD)
- Diabetes mellitus a nelegální drogy
- Pulmo‑renální syndrom
- Srovnání různých přístupů k určení prevalence diabetu 2. typu v ČR
- Terapie dušnosti zdrojem svízelné diagnózy neurologického onemocnění
- Náhodne zistený feochromocytóm u 33-ročného pacienta s Lynchovým syndrómom
- Transplantace jater jako potenciální kurativní metoda těžké hemofilie A: popis případu a literární přehled
- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Praluent (alirokumab)
- Konfokální laserová endomikroskopie v diagnostice onemocnění jícnu: pilotní studie
- Akútna končatinová ischémia v dôsledku paradoxnej embolizácie liečená systémovou trombolýzou
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Osteolytická ložiska, hyperkalcemie a paraprotein, ale myelom to není
- Onemocnění jater související s alkoholem (ALD)
- Chronické cholestatické jaterní choroby, primární biliární cholangitida a primární sklerozující cholangitida
- Doporučená očkování pro diabetiky
