Lokalizované formy plicní amyloidózy
Localised forms of pulmonary amyloidosis
Amyloidosis is a rare disorder caused by amyloid deposits in various organs and tissues resulting in vital organ dysfunction, eventually death. There are two forms of amyloidosis – systemic, characterized by multiple organs affected, and localized (focal). Localized forms of amyloidosis usually affect urinary bladder, skin and lungs. Pulmonary amyloidosis may be localized or systemic such as diffuse alveolo-septal pulmonary amyloidosis which usually accompanies systemic AL amyloidosis. Other two forms of pulmonary amyloidosis are tracheobronchial and nodular. All three forms are usually detected by accident when patients undergo chest examination for different reasons as most cases of pulmonary amyloidosis are asymptomatic. The prognosis of localized amyloidosis is good with 5-year overall survival being 90,6 %. In our case report we present three patients diagnosed with localized pulmonary amyloidosis at our center. In all cases the diagnoses were made following the resection of affected lung segments with no further treatment needed.
Keywords:
Amyloidosis – alveolo-septal amyloidosis – localized amyloidosis – nodular pulmonary amyloidosis – tracheobronchial amyloidosis
Authors:
Eva Mnacakanová 1; Lenka Henzlová 2; MUDr. Pavla Flodrová, Ph.D. 3; Tomáš Pika 1
Authors‘ workplace:
Hemato-onkologická klinika Lékařské fakulty Univerzity Palackého v Olomouci a Fakultní nemocnice Olomouc
1; Klinika nukleární medicíny Lékařské fakulty Univerzity Palackého v Olomouci a Fakultní nemocnice Olomouc
2; Ústav klinické a molekulární patologie Lékařské fakulty Univerzity Palackého v Olomouci
3
Published in:
Vnitř Lék 2021; 67(6): 357-364
Category:
Case reports
Overview
Amyloidózy patří mezi vzácná onemocnění spojená s ukládáním depozit amyloidu ve tkáních a orgánech vedoucí k jejich dysfunkci, eventuálně selhání. Rozlišují se dvě formy tohoto onemocnění – systémová, vyznačující se postižením více orgánů a tkání, a lokalizovaná (fokální). Lokalizované formy amyloidózy nejčastěji postihují močový měchýř, kůži a plíce. Plicní amyloidózy mohou mít buď lokalizovanou podobu, nebo se jedná o postižení při systémové amyloidóze, nejčastěji AL amyloidóze, jako je tomu u difuzního alveolo-septálního plicního postižení. Další dvě formy plicní amyloidózy jsou tracheobronchiální a nodulární. Všechny tři formy bývají často detekovány náhodně, a to při provedení zobrazovacích vyšetřovacích metod z jiných příčin. Jejich prognóza je oproti systémovým amyloidózám příznivější, 5leté celkové přežití činí 90,6 %. V naší kazuistice popisujeme tři pacienty, u kterých byly diagnostikovány plicní formy amyloidózy. Ve všech případech byla diagnóza stanovena po resekci postižené části plic, po které již nebyla nutná další terapie, a u pacientů nedošlo k recidivě onemocnění.
Klíčová slova:
amyloidóza – alveolo-septální amyloidóza – lokalizovaná amyloidóza – nodulární plicní amyloidóza – tracheobronchiální amyloidóza
Úvod
Amyloidózy představují heterogenní skupinu onemocnění, která jsou charakterizována tvorbou patologické bílkoviny fibrilárního charakteru a jejím ukládáním ve tkáních a orgánech (1). Tato depozita se pozitivně barví Kongo červení, a to bez závislosti na typu amyloidu. V polarizovaném světle pak vykazují žlutozelenou barvu (dichroismus) a dvojlom (birefringence) (2). Rozlišují se dvě formy tohoto onemocnění – fokální a systémová, která se vyskytuje častěji. Dále se amyloidózy dělí podle příčiny vzniku na hereditární a získané. Každé dva roky vypracovává International Society od Amyloidosis klasifikaci udávající počet amyloidogenních prekurzorů, která z nejnovějšího přehledu z roku 2020 zahrnuje 18 proteinů asociovaných se vznikem systémové formy amyloidózy, 22 proteinů spojovaných s lokalizovanou formou a tři proteiny, které se mohou vyskytovat u obou forem amyloidózy (3).
Ze systémových amyloidóz se nejčastěji diagnostikuje AL amyloidóza, jejímž prekurzorem amyloidu jsou lehké řetězce monoklonálního imunoglobulinu či jejich fragmenty prokazatelné v séru a/nebo moči. Tvoří až 70 % případů všech amyloidóz, na rozdíl od její ložiskové formy představující 19 % případů (4). Její incidence je v USA odhadována na 10,8–15,2 nemocných na 1 milion obyvatel/rok. Prevalence výskytu AL amyloidózy se v roce 2015 zvýšila na 50,1 případů na 1 milion obyvatel/ rok oproti údajům z roku 2007, kdy činila 20,1 případů na 1 milion obyvatel/rok (5).
Po AL amyloidóze je druhou nejčastější systémovou amyloidózou AA amyloidóza, u které je prekurzorovým proteinem sérový amyloid A, reaktant akutní fáze, jenž je syntetizován v hepatocytech po stimulaci prozánětlivými cytokiny. AA amyloidóza je spojována s chronickými zánětlivými procesy, nejčastěji revmatickými onemocněními. Dalším představitelem systémových amyloidóz je transthyretinová amyloidóza (ATTR), která může být jak získaná (senilní, wild-type), tak i hereditární. Jedná se o nejčastější typ hereditární amyloidózy, autozomálně dominantně dědičné onemocnění, jejímž prekurzorovým proteinem je transthyretin tvořený v játrech a v plexus choroideus v mozku a v retině (1).
Z lokalizovaných forem amyloidóz se nejčastěji vyskytuje AL amyloidóza, popsány byly i případy AA amyloidózy nebo transthyretinové amyloidózy. Jedná se o onemocnění s fokální produkcí amyloidových fibril ve tkáních, monoklonální komponenta v plazmě typicky nebývá přítomna. Podle studie Mahmooda et al. bývá medián věku při diagnóze 59,5 let. Odhadované 5leté celkové přežití činí 90,6 %, 10leté celkové přežití pak 80,3 %. Progrese onemocnění do systémové formy amyloidózy je velmi vzácná. Nejčastější orgány postižené amyloidem jsou močový měchýř, hrtan, kůže a plíce, postiženy mohou být ovšem kterékoliv tkáně či orgány (6). V ložiscích bývají často přítomny kalcifikace, které zejména při postižení prsu mohou připomínat nádorový proces (7).
Lokalizovaná a systémová amyloidóza se liší jak symptomy, tak klinickým průběhem, prognózou a léčbou. Terapeutické možnosti lokalizované formy amyloidózy zahrnují watch-and-wait strategii, resekci ložiska, terapii laserem a radioterapii. Při diferenciální diagnostice je vždy důležité vyloučit přítomnost systémové amyloidózy, jejíž terapie převážně spočívá v chemoterapii s podporou autologní transplantace krvetvorných buněk (4). Etiologie fokálních forem amyloidózy je neznámá, roli mohou hrát chronická zánětlivá či infekční onemocnění (8).
Doposud byly publikovány tři rozsáhlé studie zabývající se lokalizovanou formou amyloidózy. National Amyloidosis Center (NAC) jako první publikovalo v roce 2015 studii hodnotící 606 pacientů, po které v roce 2017 následovala studie 413 pacientů z Mayo clinic. V roce 2020 byla prezentována studie zahrnující 293 pacientů s lokalizovanými formami amyloidózy z Heidelberg Amyloidosis Center, která hodnotila pacienty diagnostikované mezi léty 2000–2019. Z jejich souboru pacientů tvořily nejčastěji postižený orgán plíce, jednalo se zejména o multifokální postižení plic (62 %). Plíce byly častěji postiženy fokální formou amyloidózy u kuřáků (54 %). Oproti ostatním lokalizacím postižených amyloidem byli tito pacienti většinou asymptomatičtí (71 % vs. 23 %). U pacientů s postižením močového měchýře, kůže a gastrointestinálního traktu byla častější přítomnost lambda lehkých řetězců imunoglobulinu (> 75 %). U sedmi pacientů z celkového souboru byla přítomna koexistence B-buněčného lymfomu a ve 21 % případů (61 pacientů) bylo přítomno autoimunitní onemocnění. Medián 5letého celkového přežití byl 94 %, medián 10letého celkového přežití činil 92 %. Horší 5leté celkové přežití bylo zjištěno u pacientů s fokální plicní amyloidózou, které představovalo 79 %. Heidelberská studie se oproti předchozím dvěma studiím lišila ve výsledcích poměru volných lehkých řetězců kappa : lambda, který byl jak v případě NAC, tak i u Mayo clinic ve prospěch kappa lehkých řetězců. Heidelberg Amyloidosis Center ovšem zjistilo zvýšenou prevalenci lambda řetězců, a to v poměru kappa : lambda 1 : 3 (9).
Kazuistika 1
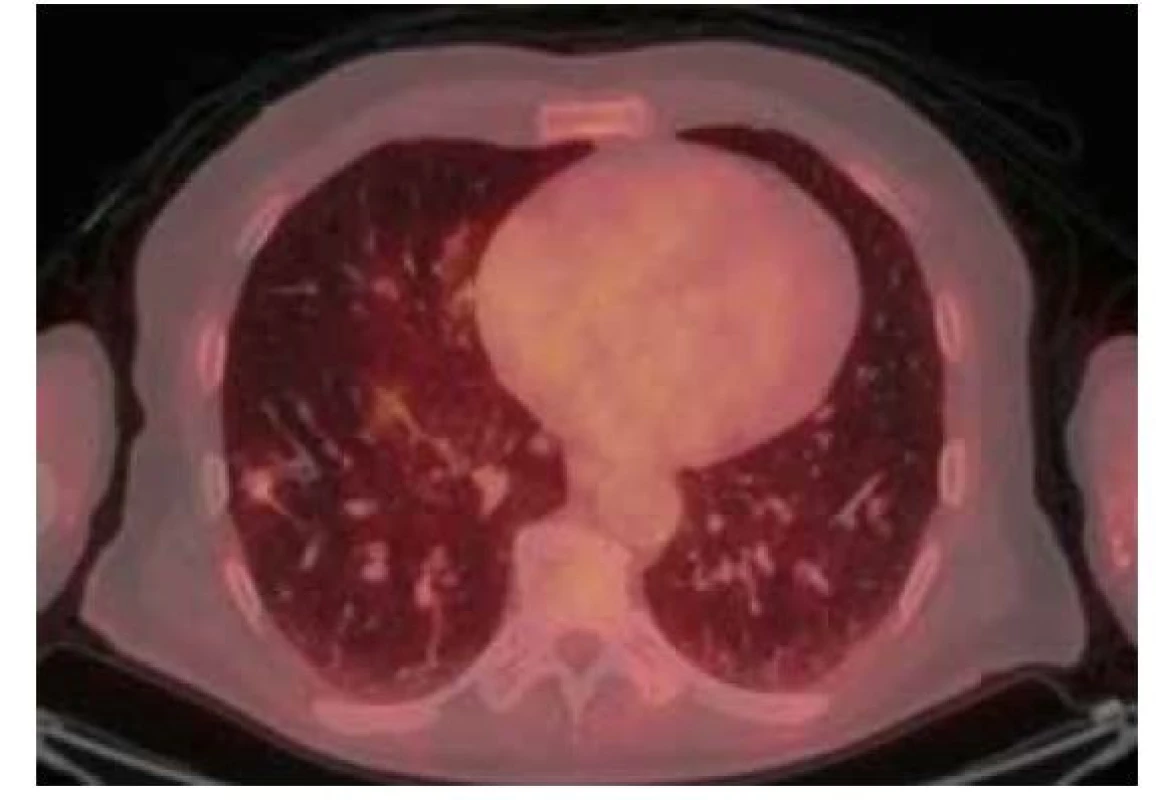
79letý muž, nekuřák, byl pro významnou aortální stenózu provázenou dlouhodobou námahovou dušností indikován k výměně aortální chlopně cestou kardiologické kliniky naší nemocnice. U pacienta nebyly subjektivně ani objektivně přítomny jiné známky kardiálních či respiračních symptomů. V rámci předoperačních vyšetřovacích metod bylo mimo jiné provedeno i vyšetření výpočetní tomografií (CT), a to CT angiografie plicnice, kde jako náhodný nález bylo popsáno cípaté ložisko ve středním laloku pravé plíce o velikosti 23 x 20 mm s bilaterálním fluidotoraxem (vpravo šíře 26 mm, vlevo šíře 17 mm). O dva měsíce později, při CT angiografii aorty, byl nález stacionární. Pro suspektní tumorózní ložisko byl pacient odeslán na plicní kliniku k dalšímu došetření. Ke zhodnocení ložiska bylo provedeno vyšetření pozitronovou emisní tomografií a počítačovou tomografií s použitím 2-[18F] fluoro-2-deoxy-D-glukózy (18F-FDG PET/CT), jež potvrdilo suspektní nález zvýšenou akumulací FDG v nepravidelném cípovitém ložisku pravé plíce v segmentu S4, velikosti 25 x 19 x 18 mm (SUVmax 5,2), provázené částečně opouzdřeným pravostranným fluidotoraxem šíře 28 mm (Obr. 1). Na základě tohoto výsledku byla posléze indikována resekce příslušné plicní tkáně k histologické verifikaci suspektního nádorového ložiska.
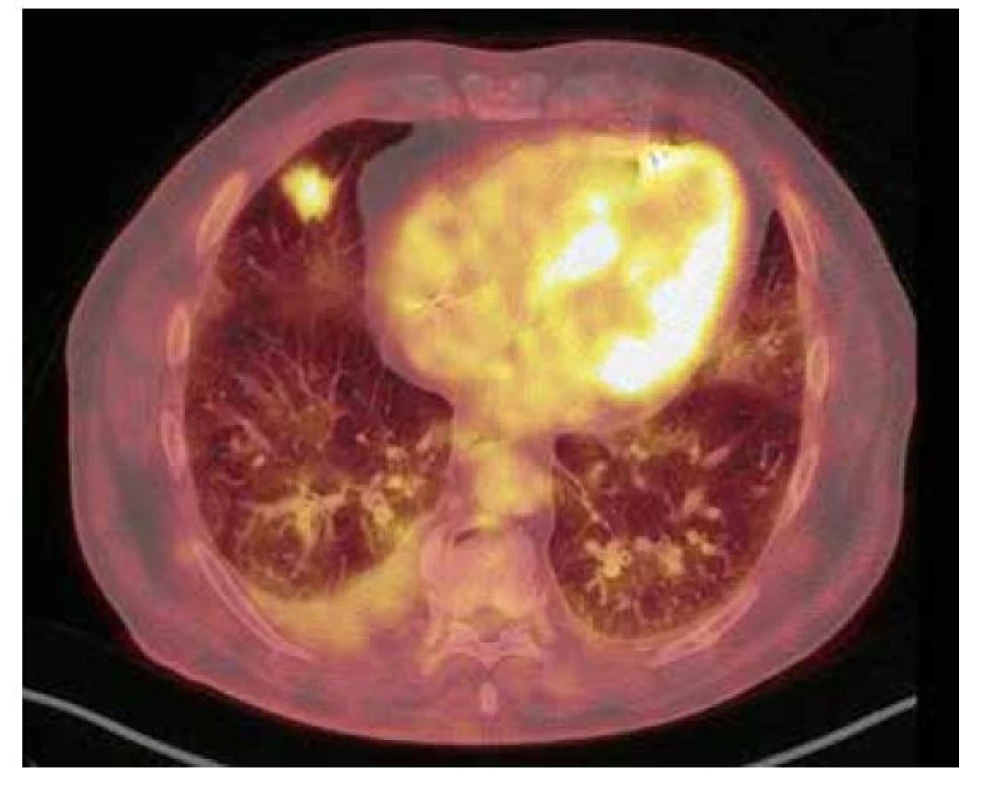
Morfologické zhodnocení tkáně přítomnost nádorového procesu vyloučilo. Prokázalo ovšem depozita amyloidu pozitivně se barvící Kongo červení vykazující dichroismus a birefringenci v polarizovaném světle, která byla přítomna i ve stěnách několika přilehlých cév. V okolí ložiska byla navíc patrná fibróza s metaplastickou osifikací a bronchiektáziemi. Proto byl pacient odeslán na naši kliniku k provedení dalších vyšetření. Subjektivně pacient udával ponámahovou dušnost, jiné potíže negoval. Vstupní fyzikální vyšetření neodhalilo žádný patologický nález. Pro konečné stanovení diagnózy bylo nutné znát typ amyloidogenních peptidů, zda se jednalo o AL-, AA-, nebo jiný typ amyloidu, proto bylo následně provedeno imunohistochemické vyšetření, které ovšem neprokázalo přesvědčivě přítomnost kappa nebo lambda lehkých řetězců, ani přesvědčivou pozitivitu transthyretinu či SAA. Volné lehké řetězce byly symetricky elevované při renální insuficienci. Bioptovaný materiál byl proto podroben zhodnocení pomocí hmotnostního spektrometru, kdy proteomickým vyšetřením metodou LMD-LC/MS (laser microdissection-liquid chromatography-tandem mass spectometry) byla zjištěna přítomnost proteinů IgA, IgG a Ig kappa.
Potvrzení amyloidového ložiska v plicích znamená nutnost dalšího kroku, a to sice určení, zda se jedná o lokalizovanou nebo systémovou formu amyloidózy – nejenom terapie, ale i prognóza těchto forem je odlišná. Přistoupili jsme tedy k provedení biopsie podkožního tuku, které však infiltraci amyloidem neprokázalo. Přítomnost monoklonálního imunoglobulinu v moči nebyla detekována. Postižení srdce nebylo možné echokardiograficky spolehlivě posoudit z důvodu pokročilé chlopenní vady. Stejně tak nebylo možné provést vyšetření magnetickou rezonancí (MRI) vzhledem k implantovanému MRI nekompatibilnímu pacemakeru. Jiné orgánové postižení nebylo rovněž pravděpodobné, proto byla diagnóza uzavřena jako fokální nodulární plicní AL amyloidóza s depozicí lehkých řetězců kappa.
Kazuistika 2
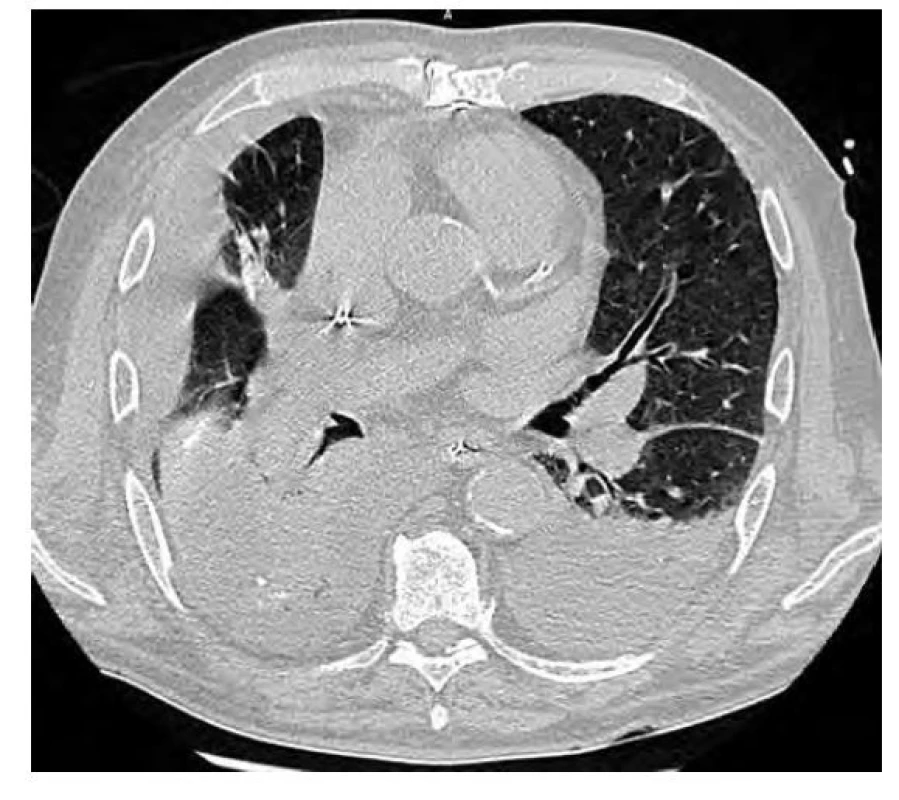
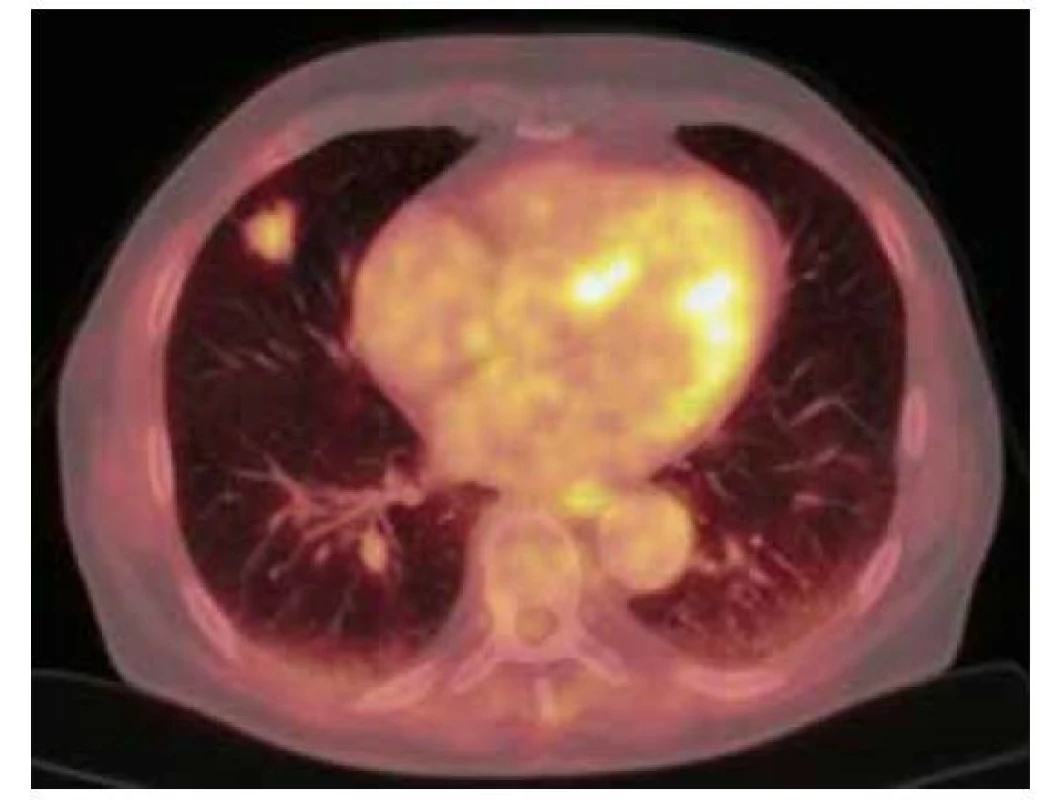
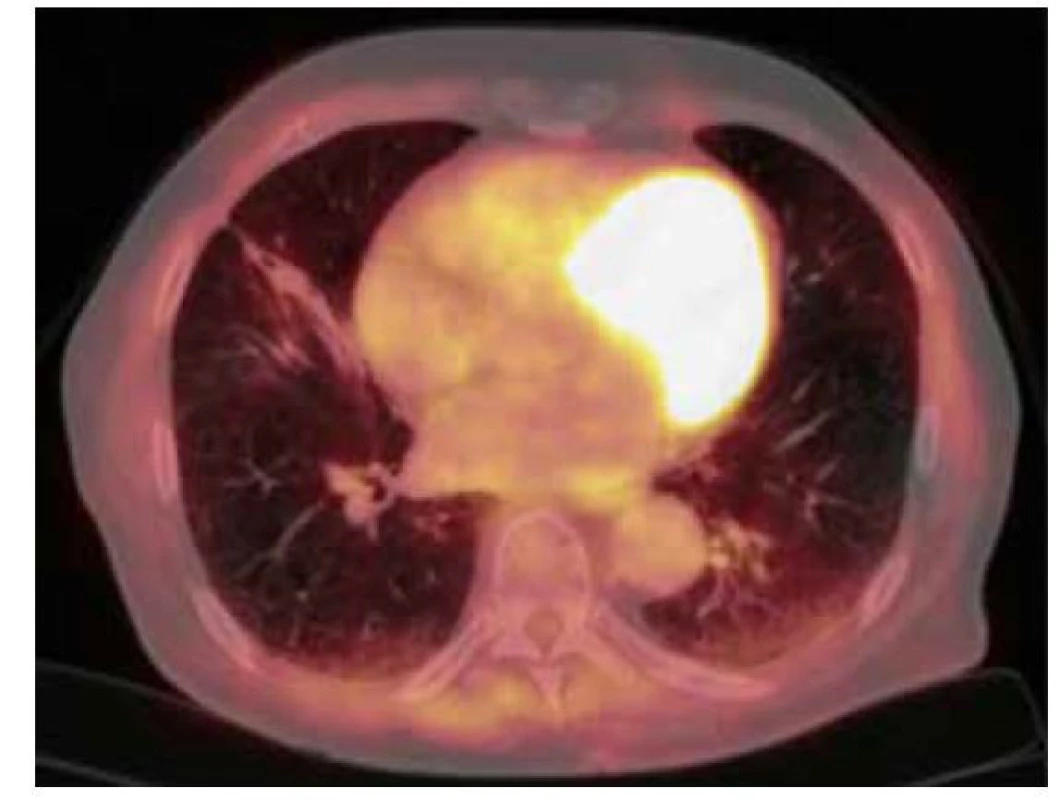
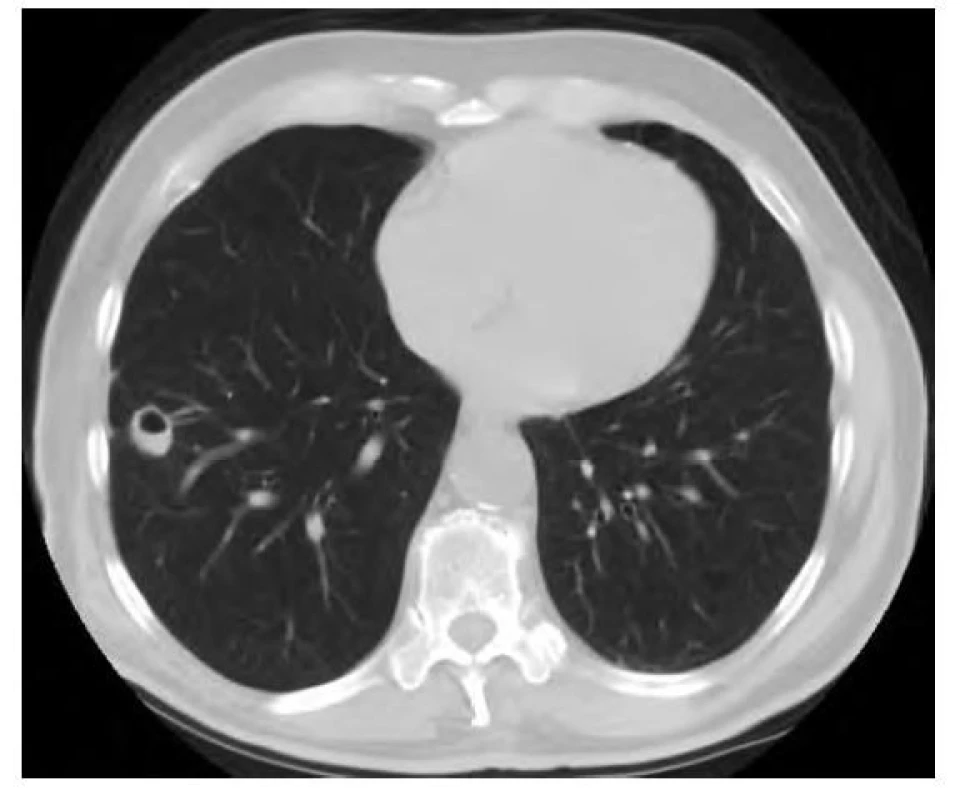
76letý muž, kuřák, dlouhodobě sledovaný pro chronickou obstrukční plicní nemoc (CHOPN), měl v okresní nemocnici z důvodu námahové dušnosti provedeno rentgenové vyšetření (RTG) hrudníku s nálezem ložiskového zastínění pravé plíce. V rámci diferenciální diagnostiky byla provedena bronchoskopie, která ovšem nebyla přínosná a byla tedy následována biopsií ložiska pod CT kontrolou. V punktátu byla zjištěna přítomnost amyloidu a z tohoto důvodu byl pacient odeslán na naše pracoviště. Vstupně pacient udával pouze námahovou dušnost. Klinické vyšetření neprokázalo patologický nález. Následovalo provedení PET/CT vyšetření trupu s nálezem akumulace FDG v ložisku pravé plíce v segmentu S4 o velikosti 19 x 20 x 17 mm (SUVmax 3,3) a dále tři drobné nodulace vel. do 6 mm pod PET rozlišením (Obr. 3). V rámci vyloučení systémové amyloidózy bylo provedeno ultrazvukové vyšetření břicha, na kterém ledviny nevykazovaly charakteristické postižení při amyloidóze. Dále byl zhodnocen trepanobioptický vzorek kostní dřeně, který přítomnost amyloidu neprokázal. Doplněna byla i echokardiografie s nálezem lehké koncentrické hypertrofie nedilatované levé komory. Následně byla provedena MRI srdce, která byla bez známek svědčících pro amyloidózu. Transparietální punkce ložiska pravé plíce poté prokázala depozita pozitivně se barvící Kongo červení vykazující dichroismus a birefringenci v polarizovaném světle svědčící pro depozici amyloidu, bez zastižení plazmocytární populace. Imunohistochemické vyšetření bioptického vzorku prokázalo pozitivitu lehkých řetězců lambda. Na základě těchto nálezů byl pacient indikován k excizi postižené části pravé plíce. Histologické vyšetření resekovaného ložiska prokázalo přítomnost amyloidu pozitivitou barvení Kongo červení, birefringencí a dichroismem v polarizovaném světle. V okolí struktur byly přítomny fibróza a zánětlivý infiltrát tvořený B a T lymfocyty, plazmocyty a histiocyty. Rozsáhle byla v okolí amyloidu zjištěna i granulomatózní reakce. Depozita amyloidu byla prokázána i ve stěnách okolních cév, imunohistochemické vyšetření neprokázalo jednoznačnou restrikci kappa či lambda lehkých řetězců imunoglobulinů. Histologické vyšetření bioptovaných materiálů bylo uzavřeno jako difuzní parenchymatózní amyloidóza. Po vyloučení systémové amyloidózy byla tedy diagnóza uzavřena jako fokální nodulární, ale i difuzní amyloidóza. S odstupem šesti měsíců od excize ložiska bylo provedeno kontrolní PET/ CT vyšetření trupu bez známek patologické akumulace radiofarmaka (Obr. 4). Následné PET/CT vyšetření po 18 měsících od stanovení diagnózy bylo stacionární. Při kontrolním vyšetření po třech letech od stanovení diagnózy byl pacient ve stabilním stavu, bez klinických a radiologických (CT) známek recidivy.
Kazuistika 3
68letý muž, kuřák, ze symptomů udávající pouze chronický kuřácký kašel, bez hemoptýzy, dušnosti či jiných dechových potíží, měl v rámci kontrolního vyšetření v okresní nemocnici provedeno RTG vyšetření hrudníku. Vzhledem k suspektnímu nálezu v pravé plíci bylo následně provedeno CT vyšetření plic. Na snímku byl přítomen emfyzém, v pravé plíci v segmentu S8 bylo přítomno ložisko maligního vzhledu, bilaterálně byly přítomny vícečetné nespecifikované noduly s mediastinální a hilovou lymfadenopatií. Na tomto základě následovalo bronchoskopické vyšetření s negativním cytologickým a histologickým nálezem. Spirometrické vyšetření a hladina nádorových markerů byly v mezích fyziologických hodnot. U pacienta byla indikována transparietální punkce ložiska, při pokusu o biopsii došlo ovšem k rozvoji pneumotoraxu. Následovalo tedy PET/CT vyšetření trupu, které prokázalo zvýšenou akumulaci FDG v uzlinách paratracheálně o velikosti 18 x11 mm, pod pravým bronchem o velikosti 17 x 12 mm a dále v uzlinách obou hilů, výrazněji vpravo do velikosti 15 x 13 mm. Mírný hypermetabolismus FDG vykazovalo ložisko v pravém dolním plicním laloku o velikosti 14 x13 x10 mm (SUVmax 1,2) a byla tedy naplánována bronchoskopie s endobronchiálním ultrazvukem (EBUS) v celkové anestezii a odběrem vzorků pro histologické zhodnocení (Obr. 5). Ty neprokázaly nález suspektních buněk. Histologické vyšetření mediastinálních uzlin neprokázalo žádnou patologii, proto následovala extraanatomická resekce postižené části plíce. Histologické vyšetření resekované tkáně prokázalo Kongo pozitivní materiál s dichroismem v polarizovaném světle a birefringencí, depozita amyloidu se nacházela i ve stěnách cév v okolí hlavního ložiska. V blízkosti depozit byl přítomen řídký lymfoplazmocytární infiltrát. Hmotnostní spektrometrií byl zjištěn abundantní protein Ig kappa. Proteiny Ig lambda a transthyretin byly přítomny v minoritním množství. Pacient byl tedy odeslán na naši kliniku k dalšímu došetření. Vstupně pacient neudával žádné potíže, objektivní vyšetření bylo bez patologického nálezu. Laboratorní vyšetření neprokázala přítomnost paraproteinu v séru či moči. Hladiny lehkých řetězců kappa byly nadhraniční s normálním indexem klonality. Následně byla provedena biopsie podkožního tuku, která neprokázala přítomnost depozit amyloidu. U pacienta byla vyloučena systémová forma amyloidózy, diagnóza byla uzavřena jako ložisková plicní AL amyloidóza. S odstupem šesti měsíců bylo provedeno kontrolní CT vyšetření hrudníku s nálezem oválné formace v místě původního ložiska o velikosti 20 x 16 x 14 mm, nově s kavitací a hladinkou tekutiny (Obr. 6). Biopsie patologického ložiska pod CT kontrolou prokázala přítomnost fibrózy, centrální nekrózy koagulačního typu bez kaseózní morfologie a obliterované cévy, bez jednoznačného zastižení depozice amyloidu. V několika úsecích byl nalezen cizorodý materiál. Ložiskový nález odpovídal změnám po aspiraci s defenzivní/reparativní reakcí. Dále byla u pacienta provedena aspirace podkožního tuku, a to bez přítomnosti depozit amyloidu.
Diskuze
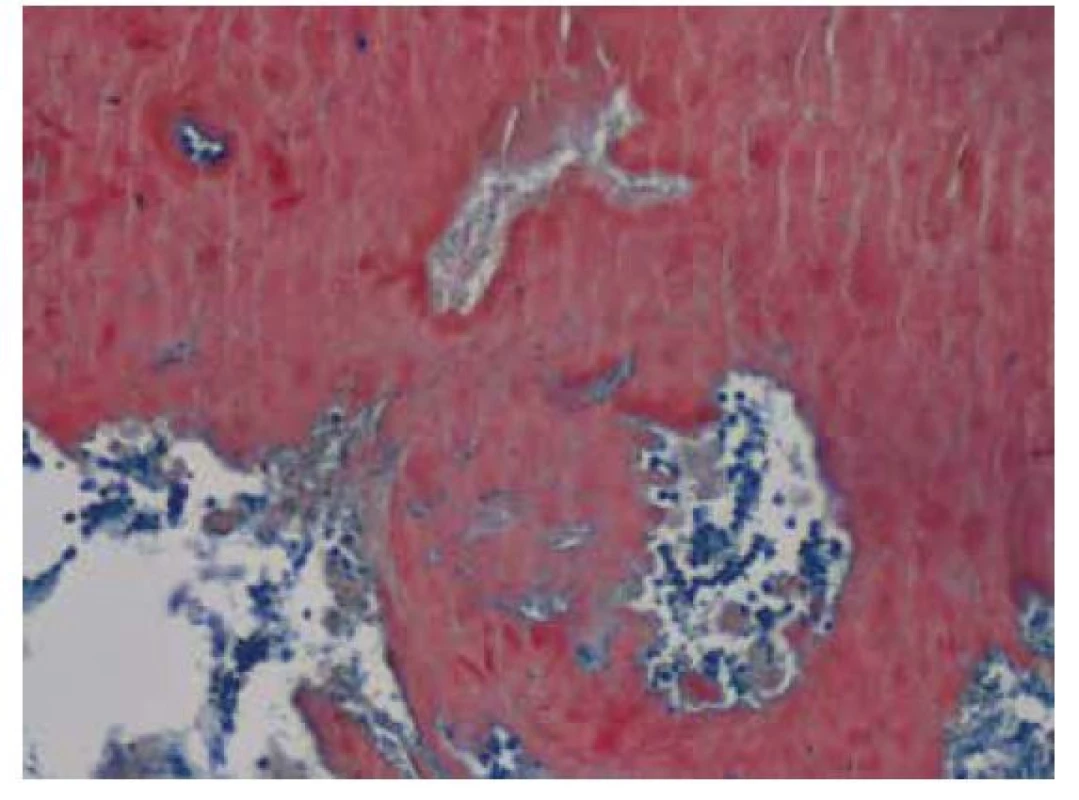
Plicní postižení amyloidem bylo poprvé popsáno v roce 1877 německým lékařem Adolfem Lesserem (10). V současnosti se rozděluje do tří forem: tracheobronchiální, nodulární a difuzní alveolo-septální plicní amyloidóza.

Tracheobronchiální amyloidóza
Tracheobronchiální amyloidóza je z plicních postižení amyloidem nejvzácnější. Medián věku při diagnóze činí 50–60 let. Symptomy provázející tuto formu plicní amyloidózy odpovídají lokalizaci postižení amyloidem (larynx, trachea, bronchy, bronchioly). Může se jednat o kašel, hemoptýzu, recidivující pneumonie, chrapot či stridor. Solitární ložiska mohou být zaměněna za endobronchiální neoplázii (11). Podle lokalizace submukózních multifokálních lézí se rozlišují 3 typy tracheobronchiální amyloidózy: postižení proximální, střední a distální části dýchacích cest. Depozita amyloidu jsou difuzní a typicky postihují zadní stěnu trachey. Při vyšetření plic výpočetní tomografií s vysokým prostorovým rozlišením (HRCT) bývají detekovány tumorózní noduly a zesílená stěna trachey či bronchů. Stenóza dýchacích cest může vést ke vzniku atelektáz, rekurentních infekcí, bronchiektázií nebo plicní hyperinflaci (12). Studie Brandelika et al., která v roce 2020 hodnotila patologické změny plicního postižení amyloidózou při CT vyšetření, popsala přítomnost tracheálních a/nebo bronchiálních kalcifikací na CT snímcích u všech pacientů s tracheobronchiální amyloidózou (13).
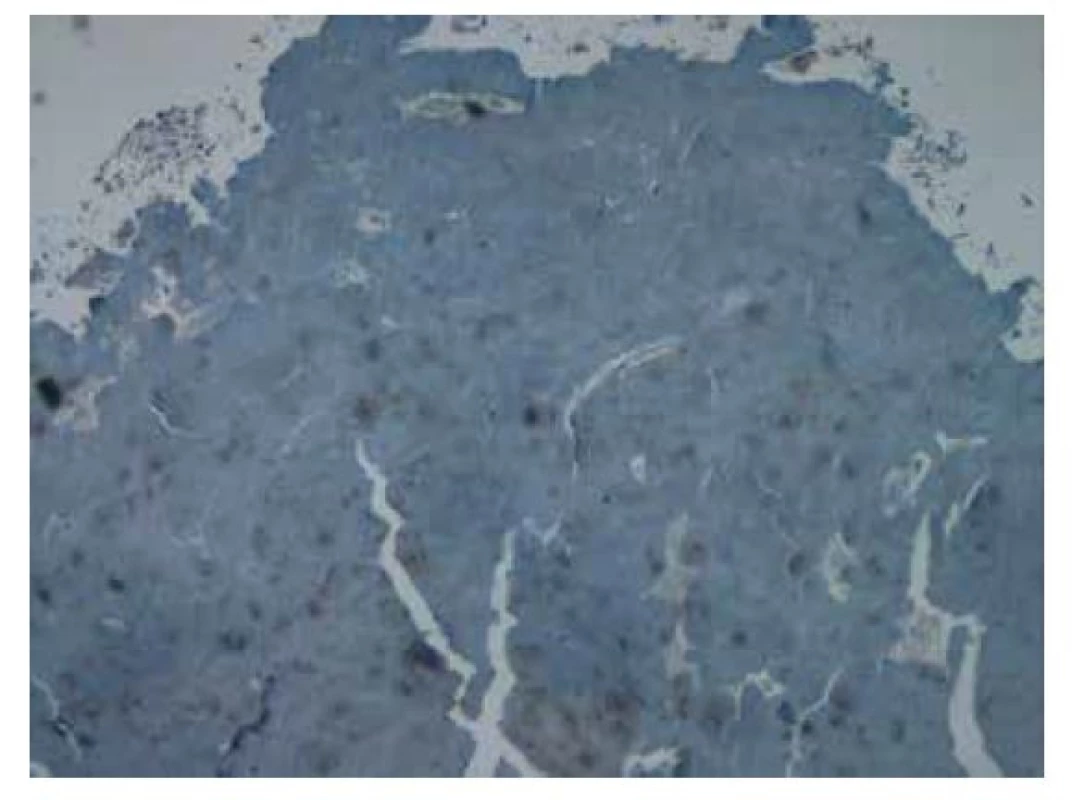
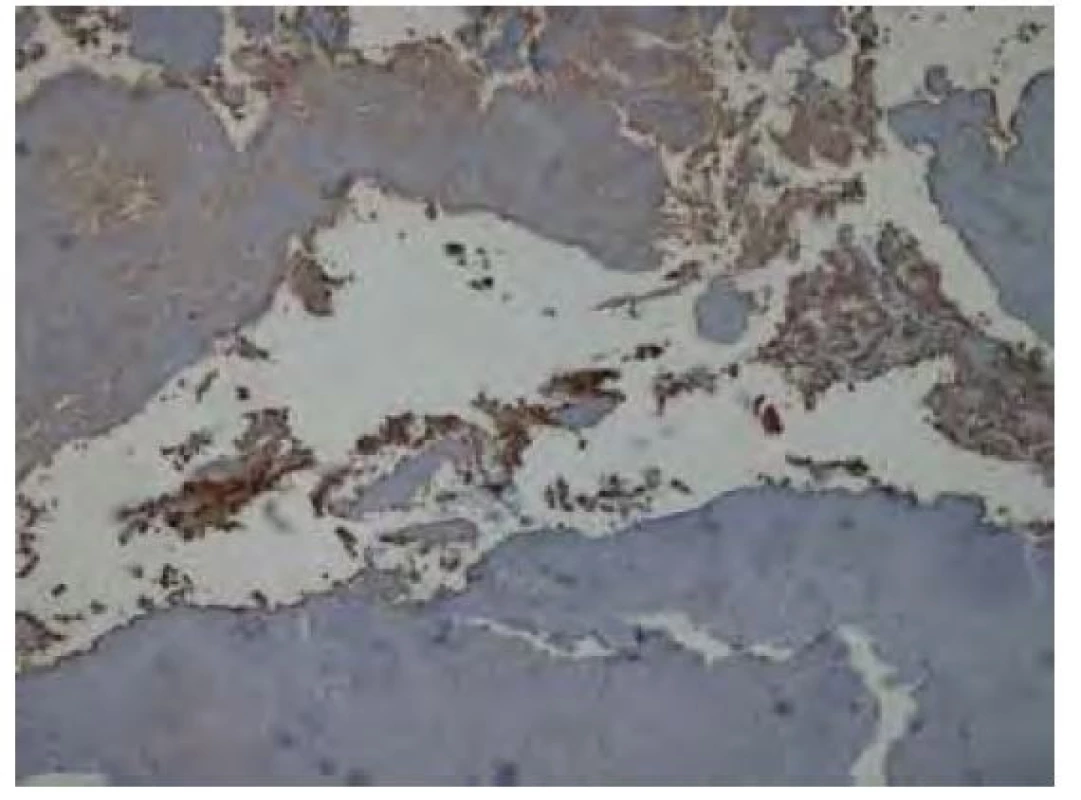
Diferenciální diagnostika zahrnuje granulomatózu s polyangiitidou (dříve Wegenerova granulomatóza), tracheobronchiální parakokcidioidomykózu, tuberkulózu, relabující polychondritidu či sarkoidózu (14, 15).
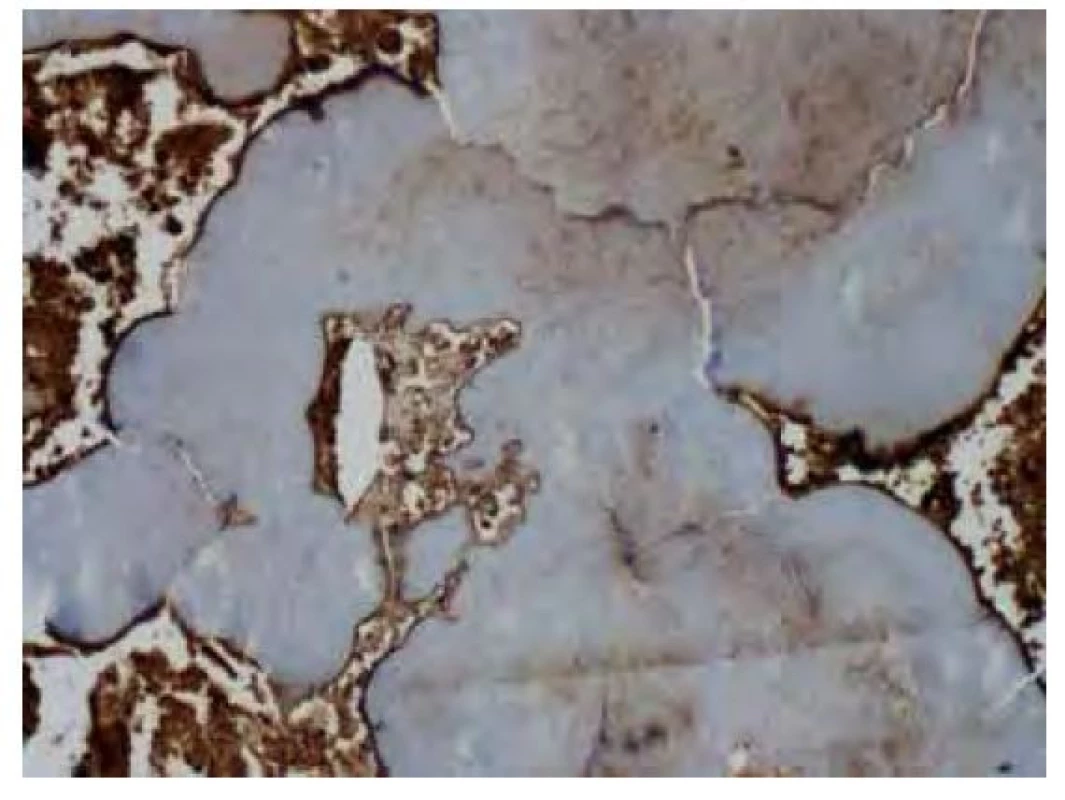
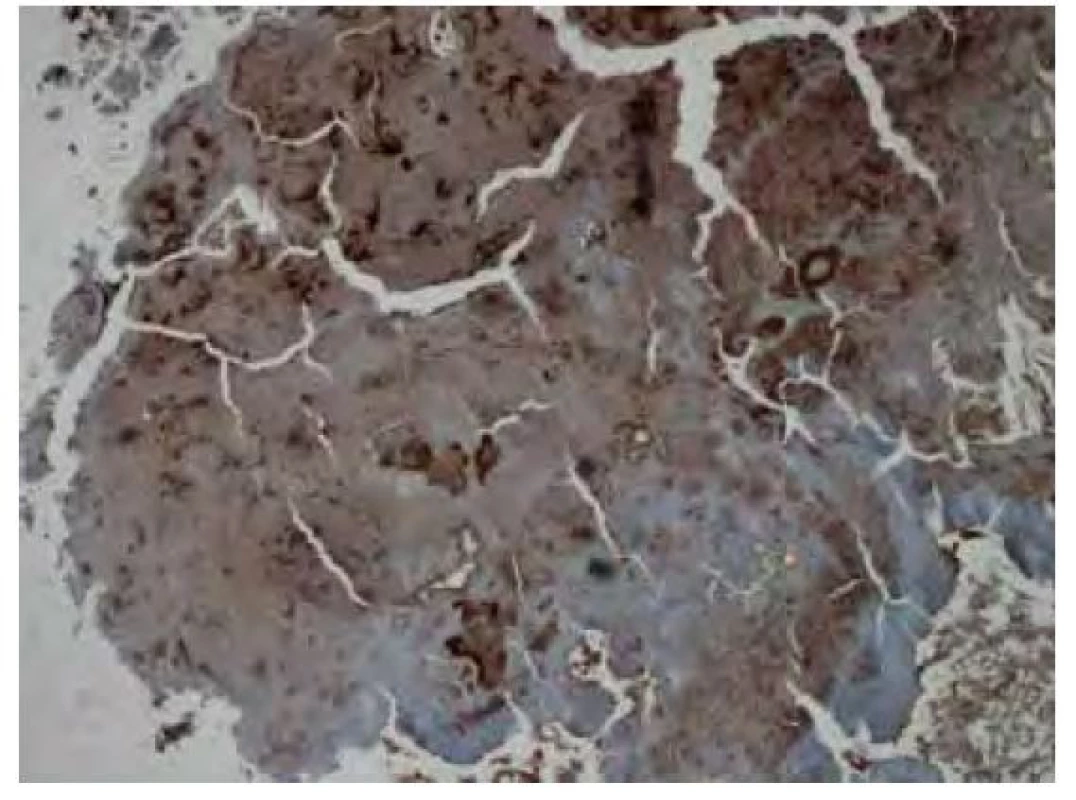
Jedinou možnost léčby představuje odstranění ložiska – bronchoskopickou nebo chirurgickou resekcí, laserovou ablací či radioterapií (16). Chirurgická resekce ložiska a terapie laserem bývají limitovány přístupem k lézím a jsou spojovány se zvýšeným rizikem krvácení (17). Ve studii Mayo clinic bylo sedm pacientů s tracheobronchiální amyloidózou léčeno zevní radioterapií (external beam radiotherapy, EBRT). Pacientům byly podány dávky 20 Gy (Gray) v 10 frakcích, po kterých bylo dosaženo příznivé léčebné odpovědi, a to v rozpětí od vymizení symptomů po objektivní zlepšení plicních funkcí. Subjektivní zlepšení nastalo v rozmezí jednoho měsíce až jednoho roku od podání terapie. Léčba byla pacienty dobře tolerovaná. U čtyř pacientů došlo k rozvoji ezofagitidy 1. stupně, u jednoho pacienta k ezofagitidě 2. stupně (18). Moore et al. se zaměřili na možnost využití endobronchiální brachyterapie (EBB). U dvou pacientů byla kombinována terapie EBRT s EBB, u jednoho pacienta se jednalo pouze o terapii EBB. Dávky u terapie EBB byly v rozmezí 7,5–10 Gy, dávky u terapie EBRT byly u jednoho pacienta 48 Gy ve 4 frakcích, u druhého pacienta 60 Gy, bez uvedeného počtu frakcí. U všech pacientů došlo k rychlému vymizení symptomů, terapeutický efekt byl potvrzen opakovanými bronchoskopiemi (17).
Difuzní alveolo-septální amyloidóza
Difuzní alveolo-septální amyloidóza bývá na rozdíl od ostatních dvou forem plicní amyloidózy nejčastěji diagnostikována u systémové AL amyloidózy. Depozita amyloidu bývají detekována v cévních stěnách, parenchymu a interlobulárních septech. Přítomny mohou být i mediastinální lymfadenopatie, pleurální výpotek nebo jsou depozita zjištěna ve viscerální pleuře. Často jsou postiženy všechny plicní laloky (16). Vzhledem k obvykle asymptomatickému průběhu bývá plicní postižení amyloidem nejčastěji diagnostikováno post mortem, kdy bylo popsáno u 18 pacientů z 20 (90 %) se systémovou AL amyloidózou a u osmi pacientů z 24 (33 %) se systémovou AA amyloidózou (19).
Nálezy na HRCT plic zahrnují opacity mléčného skla, mnohočetné drobné dobře ohraničené noduly velikosti 2–4 mm, subpleurální konsolidace, ztluštění interlobulárních sept a změny retikulárního charakteru (12).
Diagnostiku plicního postižení amyloidem by mohlo usnadnit využití [18F]florbetapiru při PET/CT vyšetření (20). [18F]florbetapir patří mezi radiofarmaka detekující depozita β-amyloidu, u kterého americký Úřad pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) v roce 2012 schválil využití při diagnostice Alzheimerovy choroby (21). Jeho využití bylo potvrzeno i při diagnostice kardiálního postižení při systémové AL amyloidóze (22). Studie Wagnera et al., která se zaměřila na extrakardiální využití [18F]florbetapiru u pacientů se systémovou AL amyloidózou, přinesla zajímavé výsledky týkající se možného využití při difuzním parenchymálním postižením plic amyloidem vzhledem k výraznému vychytávání radiofarmaka v plicích u pacientů s plicním postižením při systémové amyloidóze (23).
Terapie difuzní alveolo-septální amyloidózy spočívá v co nejrychlejším snížení koncentrace volných lehkých řetězců u AL amyloidózy. Při volbě terapeutického postupu je nutné brát v potaz plicní postižení, kdy u pacientů s méně než 50 % difuzní kapacity pro oxid uhelnatý není možné provést autologní transplantaci krvetvorných buněk (16).
Diferenciální diagnostika zahrnuje pneumonii, intersticiální plicní procesy a neoplázie (24).
Fokální nodulární amyloidóza
Fokální nodulární amyloidóza, která se vyskytuje nejčastěji z uvedených plicních amyloidóz, bývá spojována s dobrou prognózou. Medián věku při diagnóze je 67 let, častěji se vyskytuje u mužů (16). Histologicky se jedná o dobře ohraničené noduly tvořené amorfním eozinofilním amyloidem často provázeným zánětlivým infiltrátem v okolí, lymfoplazmocytárním infiltrátem, granulomatózní reakcí, kalcifikacemi a metaplastickou osifikací (8). Lehké řetězce u nodulární amyloidózy jsou tvořeny častěji kappa než lambda řetězci a to v poměru 3 : 1, na rozdíl od typicky se vyskytujících lambda řetězců u systémové AL amyloidózy. Nejčastěji se detekuje náhodně zobrazovacími metodami hrudníku jako jedno nebo více ložisek v plicích. Obvykle se jedná o AL nebo AL/ AH amyloidózu (smíšená přítomnost lehkých a těžkých řetězců imunoglobulinu) (25). Popsány byly i vzácné případy výskytu při systémové amyloidóze, fokální AA amyloidóze, fokální ATTR wild-type anebo fokální Aβ2M/AL amyloidóze (smíšená přítomnost β2-mikroglobulinu a lehkých řetězců imunoglobulinu) (26, 27, 28).
Nodulární plicní amyloidóza může vznikat v terénu lymfoproliferativního onemocnění, například MALT lymfomu (mucosa-associated lymphoid tissue lymphoma), u pacientů s autoimunitními onemocněními, jako je Sjögrenův syndrom, nebo při monoklonální gamapatii nejasného významu (MGUS) (19, 29). Studie Lim et al. prezentovala šest případů pacientů s plicní amyloidózou, u kterých byl potvrzen MALT lymfom. Ve všech případech se jednalo o ženy. U třech z nich byla prokázána depozita amyloidu z lehkých řetězců imunoglobulinu, které byly pravděpodobně produkovány nádorovými buňkami. Rozlišení nodulární plicní amyloidózy od primárního plicního lymfomu s depozity amyloidu spočívá v histologickém a imunohistochemickém vyšetření (19).
Milani et al. hodnotili mezi léty 2004–2016 49 pacientů s plicní nodulární AL amyloidózou. Medián věku byl 69 let, v 60 % se jednalo o muže. V 11 případech byla detekována přítomnost monoklonálního proteinu v séru či moči, u 13 pacientů byl přítomen abnormální poměr volných lehkých řetězců. U třech pacientů byl diagnostikován Sjögrenův syndrom a u dvou pacientů MALT lymfom.
Baumgart et al. v roce 2018 hodnotili 207 případů plicního postižení amyloidem. Medián věku při diagnóze byl 67 let, ve 117 případech (57,1 %) se jednalo o muže. U 100 pacientů (90,1 %) ze 111 případů AL amyloidózy se jednalo o lokalizovanou formu. U 10 pacientů (8,5 %) bylo přítomno lymfoproliferativní onemocnění. 10leté celkové přežití představovalo u systémové AL amyloidózy 45,7 %, u lokalizované formy AL amyloidózy činilo 79,5 % (20).
Při fokální nodulární amyloidóze je na HRCT plic možné prokázat charakteristické známky jako jsou periferní či subpleurální lokalizace ložisek, predominantně ve spodních lalocích plic, které jsou často bilaterální (30). Noduly mohou mít rozličné tvary a velikosti, nejčastěji od 0,5 do 15 cm, a bývají dobře ohraničené. Rostou pomalu, často několik let (31). Přítomny mohou být i kavitace (12). Brandelik et al. popsali souvislost mezi přítomností cyst na CT snímcích a autoimunitních onemocněních, kdy u pěti pacientů s nálezem cystických formací na CT ze 17 byl potvrzen Sjögrenův syndrom a u dalších dvou byl přítomen systémový lupus erythematodes. Stejně tak popsali i časté kalcifikace vyskytující se v plicních ložiscích, které byly přítomny u 17 pacientů ze 41 (13).
Diferenciální diagnostika zahrnuje primární nebo metastatické nádorové postižení plic. Dále je třeba vyloučit granulomatózní plicní onemocnění, tuberkulózu, histoplazmózu, kokcidiomykózu, blastomykózu a chondrom (24, 32). Mnohočetné plicní cysty a uzly mohou být přítomny i u Langerhansovy histiocytózy nebo lymfangioleiomyomatózy (33).
Terapii fokální nodulární plicní amyloidózy představuje nejčastěji excize ložiska (16).
Co se etiologie vzniku fokálních forem amyloidózy týče, profesor Per Westermark v roce 2012 prezentoval hypotézu určité schopnosti „sebevraždy“ lokalizovaných depozit amyloidu a to na základě toxicity lehkých řetězců imunoglobulinu vůči plazmatickým buňkám. Jeho hypotéza vzniku lokalizované formy AL amyloidózy spočívá v přítomnosti malého benigního klonu plazmatických buněk v určité lokalitě, vznikající pravděpodobně na základě antigenní stimulace. Klonální plazmatické buňky produkují lehké řetězce imunoglobulinu, které jsou amyloidogenní. Ke vzniku samotného amyloidomu dojde ovšem pouze pokud je klon plazmatických buněk schopen aktivovat makrofágy, které následně vytvoří obrovské mnohojaderné buňky (giant cells) a ty poté volné řetězce fagocytují. K agregaci volných řetězců může docházet jak uvnitř těchto buněk, tak i na jejich povrchu, kdy se tato hypotéza vzniku amyloidu jeví jako pravděpodobnější. To by vysvětlilo přítomnost amyloidových fibril v blízkosti giant cells což je rozdíl oproti depozitům u systémové AL amyloidózy. Ve fokálním depozitu amyloidu bývá přítomno pouze malé množství plazmatických buněk na základě čehož se může předpokládat toxické působení amyloidových fibril, které vede k jejich apoptóze (34).
Toto vyhasnutí amyloidotvorného procesu prezentovali i Adam et al., kteří se zaměřili na využití PET/CT vyšetření při rozhodování o léčbě lokalizované nodulární formy plicní AL amyloidózy. Ložiska amyloidu se při PET/CT vyšetření mohou zobrazit jako vysoce aktivní, podobně jako plicní metastázy. Při vyhasnutí amyloidotvorného procesu dochází k absenci akumulace fluorodeoxyglukózy v ložisku a jeho bezprostředním okolí, což autoři pozorovali i u jejich pacientky, u které po roce od stanovení diagnózy a provedení PET/CT vyšetření ustala metabolická aktivita buněk v okolí ložiska (35). Kazuistika Koukalové et al. prezentovala obdobný závěr u pacientky s polypem v pravé nosní dutině, u kterého bylo biopsií potvrzeno ložisko amyloidu. Vyšetření PET/CT potvrdilo metabolicky aktivní ložisko v dutině nosní. Po jeho resekci byla pacientka pravidelně sledovaná metodami magnetické rezonance (MRI) a PET/CT, opakovaně s negativními výsledky (36). Glaudeamus et al. ve své retrospektivní studii hodnotili výsledky PET/ CT vyšetření u 21 pacientů s histologicky prokázanou lokalizovanou nebo systémovou formou amyloidózy. Z 11 pacientů s lokalizovanou amyloidózou byla přítomna hyperakumulace FDG u 10 z nich, u jednoho pacienta se jednalo o slabou akumulaci FDG. U žádného z 10 pacientů se systémovou amyloidózou nebyla akumulace FDG detekována (37). V retrospektivní studii Mekinian et al. byla ovšem přítomna akumulace FDG i u pacientů se systémovou amyloidózou, konkrétně ve čtyřech případech ze šesti byla akumulace FDG popsána ve svalech, kostech, plicích a nosohltanu (38). Jednou z možných příčin tohoto závěru může být to, že Glaudeamus et al. hodnotili akumulaci FDG ve svalech a nosohltanu jako nespecifický nález. PET/CT tedy může pomoci v diferenciální diagnostice oproti jiným plicním lézím a rovněž i v odlišení systémové a ložiskové formy amyloidóz (37).
V případě našich třech pacientů se vždy jednalo o náhodnou detekci ložiskového procesu v plicích zjištěnou při vyšetření RTG hrudníku, po kterých následovalo provedení PET/CT.
Pro vyloučení nádorového procesu byly ve všech případech provedeny resekce ložisek, jejichž histologická zhodnocení vedla ke stanovení diagnóz fokálních forem amyloidóz bez nutnosti dalších terapeutických intervencí.
Podpořeno grantem IGA_LF_2021_001.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Eva Mnacakanová
Hemato-onkologická klinika Lékařské fakulty Univerzity Palackého v Olomouci a Fakultní nemocnice Olomouc I. P. Pavlova 6, 779 00 Olomouc
Cit. zkr: Vnitř Lék 2021; 67(6): 357–364
Článek přijat redakcí: 23. 6. 2021
Článek přijat po recenzích: 30. 8. 2021
Sources
1. Kufová Z, Pika T, Jelínek T et al. Hereditární amyloidózy – etiologie, klinický obraz a léčba. Transfuze Hematol. dnes. 2015; 21(4): 184–192.
2. Ryšavá R. Systémové amyloidózy a jejich léčba. Maxdorf: Praha 2013. ISBN 978–80 – 7345–341–1.
3. Benson MD, Buxbaum JN, Eisenberg DS et al. Amyloid nomenclature 2020: update and recommendations by the International Society of Amyloidosis (ISA) nomenclature committee. Amyloid. 2020; 27(4): 217–222.
4. Pika T, Hájek R et al. Diagnostika a léčba systémové AL amyloidózy: Doporučení vypracovaná Českou myelomovou skupinou (CMG) a Myelomovou sekcí České hematologické společnosti ČLS JEP. Transfuze Hematol. dnes. 2019; 25(Supplementum 1): 35–70.
5. Quock TP, Yan T, Chang E et al. Epidemiology of AL amyloidosis: a real-world study using US claims data. Blood Adv. 2018; 2(10): 1046–1053.
6. Mahmood S, Sachchithanantham S, Bridoux F et al. Risk Of Progression Of Localised Amyloidosis To Systemic Disease In 606 Patients Over 30 Years. Blood. 2013; 122 (21): 3143.
7. Krishnan J, Chu WS, Elrod JP et al. Tumoral presentation of amyloidosis (amyloidomas) in soft tissue. A report of 14 cases. Am J Clin Pathol. 1993;100(2):135–44.
8. Buadi F. Localized Amyloidosis. In: MA, Gertz a Rajkumar SV. Amyloidosis: Diagnosis and Treatment. Humana Press. 2010, s. 95–106. ISBN 978–1-61779–692–0.
9. Basset M, Hummedah K, Kimmich C et al. Localized immunoglobulin light chain amyloidosis: Novel insights including prognostic factors for local progression. Am J Hematol. 2020; 95 : 1158 – 1169.
10. Lesser A. Ein Fall von Enchondroma osteiodes mixtum der Lunge mit partieller amyloid Entotung. Virchows Arch (Pathol Anat) 1877; 69 : 404–408.
11. Clark JM, Weissler MC. Localized tracheobronchial amyloidosis: case report and review of the literature. Ear Nose Throat J. 2001; 80 : 635–636.
12. Chung MJ, Lee KS, Franquet T. et al. Metabolic lung disease: imaging and histopathologic findings. Eur J Radiol. 2005; 54(2): 233–45.
13. Brandelik SC, Heussel CP, Kauczor HU et al. CT features in amyloidosis of the respiratory system – Comprehensive analysis in a tertiary referral center cohort. Eur J Radiol. 2020; 129 : 109123.
14. Marchiori E, Escuissato DL, Souza AS Jr et al. Computed tomography findings in patients with tracheal paracoccidioidomycosis. J Comput Assist Tomogr. 2008; 32(5): 788–91.
15. Marchiori E, Pozes AS, Souza AS Jr et al. Diffuse abnormalities of the trachea: computed tomography findings. J Bras Pneumol. 2008; 34 : 47–54.
16. Milani P, Basset M, Russo F et al. The lung in amyloidosis. Eur Respir Rev. 2017; 26(145): 170046.
17. Moore A., Kramer MR, Silvern D et al. Endobronchial brachytherapy-A novel approach for the management of airway amyloidosis. Brachytherapy. 2018 Nov-Dec;17(6): 966–972.
18. Neben-Wittich MA, Foote RL, Kalra S. External beam radiation therapy for tracheobronchial amyloidosis. Chest. 2007 Jul;132(1): 262–7.
19. Lim JK, Lacy MQ, Kurtin PJ et al. Pulmonary margine zone lymphoma of MALT type as a cause of localised pulmonary amyloidosis. Journal of Clinical Pathology. 2001; 54 : 642–646.
20. Baumgart JV, Stuhlmann-Laeisz C, Hegenbart U et al. Local vs. systemic pulmonary amyloidosis-impact on diagnostics and clinical management. Virchows Arch. 2018; 473(5): 627–637.
21. Clark CM, Schneider JA, Bedell BJ et al. Use of Florbetapir-PET for Imaging β-Amyloid Pathology. JAMA. 2011; 305(3): 275–283.
22. Dorbala S, Vangala D, Semer J et al. Imaging cardiac amyloidosis: a pilot study using ¹⁸F-florbetapir positron emission tomography. Eur J Nucl Med Mol Imaging. 2014;41(9):1652 – 62.
23. Wagner T., Page J., Burniston M et al. Extracardiac 18F-florbetapir imaging in patients with systemic amyloidosis: more than hearts and minds. Eur J Nucl Med Mol Imaging. 2018;45(7):1129–1138.
24. Urban BA, Fishman EK, Goldman SM et al. CT evaluation of amyloidosis: spectrum of disease. Radiographics. 1993;13 : 1295–1308.
25. Kaplan B, Martin BM, Boykov O et al. Co-deposition of amyloidogenic imunoglobulin light and heavy chaos in localized pulmonary amyloidosis. Virchows Arch. 2005;447 : 754–761.
26. Calatayud J, Candelas G, Gómez A et al. Nodular pulmonary amyloidosis in a patient with rheumatoid arthritis. Clin Rheumatol. 2007; 26(10): 1797–8.
27. Yang MC, Blutreich A, Das K. Nodular pulmonary amyloidosis with an unusual protein composition diagnosed by fine-needle aspiration biopsy: a case report. Diagn Cytopathol. 2009; 37(4): 286–9.
28. Roden AC, Aubry MC, Zhang K et al. Nodular senile pulmonary amyloidosis: a unique case confirmed by immunohistochemistry, mass spectrometry, and genetic study. Hum Pathol. 2010; 41(7): 1040–5.
29. Ikeda SI, Hineno A, Yoshinaga T et al. Sjögren syndrome-related plasma cell disorder and multifocal nodular AL amyloidosis: clinical picture and pathological findings. Amyloid. 2019; 26(4): 225–233.
30. Gillmore JD, Hawkins PN. Amyloidosis and the respiratory tract. Thorax. 1999; 54 : 444–451.
31. Howard S, Jagannathan J, Krajewski K et al. Multimodality imaging in amyloidosis. Cancer Imaging. 2012;12 : 109–117.
32. Marchiori E, Souza AS Jr, Franquet T et al. Diffuse high-attenuation pulmonary abnormalities: a pattern-oriented diagnostic approach on high-resolution CT. Am J Roentgenol. 2005; 184 : 273–282.
33. Jeong YJ, Lee KS, Chung MP et al. Amyloidosis and lymphoproliferative disease in Sjögren syndrome: thin-section computed tomography findings and histopathologic comparisons. J Comput Assist Tomogr. 2004; 28 : 776–781.
34. Westermark P. Localized AL amyloidosis: a suicidal neoplasm? Ups J Med Sci. 2012; 117(2): 244–50.
35. Adam Z, Elleder M, Moulis M et al. Přínos PET-CT vyšetření pro rozhodování o léčbě lokalizované nodulární formy plicní AL-amyloidózy. Vnitř Lék 2012; 58(3): 241–252.
36. Koukalová R, Szturz P, Svobodová I et al. Ložisková amyloidóza v dutině nosní. Klin Onkol. 2016; 29(3): 216–9.
37. Glaudemans AW, Slart RH, Noordzij W et al. Utility of 18F-FDG PET(/CT) in patients with systemic and localized amyloidosis. Eur J Nucl Med Mol Imaging. 2013 Jul; 40(7): 1095–101.
38. Mekinian A, Jaccard A, Soussan M et al. 18F-FDG PET/CT in patients with amyloid light - chain amyloidosis: case-series and literature review. Amyloid. 2012 Jun;19(2): 94-8.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2021 Issue 6
-
All articles in this issue
- HLAVNÍ TÉMA – PNEUMOLOGIE
- Respiratory insufficiency, chronic hypercapnia and domiciliary non-invasive ventilation from the point of view of a pneumologist
- Inhaled glucocorticoids in treatment of covid-19
- Nintedanib in the treatment of systemic rheumatic disease-associated interstitial lung disease
- Anti-cancer therapy-induced metabolic syndrome
- Hereditary hemorrhagic telangiectasia (Osler-Weber-Rendu syndrome) Part I. Pathophysiology, clinical symptoms and recommend screening for vascular malformations
- High-rank technology in the medicine – the impact of continuous glucose monitoring system alarm settings values on glycemic control in type 1 diabetes patients: a systematic review
- Complete remission of necrobiotic xanthogranuloma after disappearance of monoclonal immunoglobulin induced by bortezomib, lenalidomid and dexamethasone
- Localised forms of pulmonary amyloidosis
- Screening for gestational diabetes mellitus
- Why we still don’t achieve blood pressure targets
- Aktuální témata kardiovaskulární prevence
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Localised forms of pulmonary amyloidosis
- Respiratory insufficiency, chronic hypercapnia and domiciliary non-invasive ventilation from the point of view of a pneumologist
- Hereditary hemorrhagic telangiectasia (Osler-Weber-Rendu syndrome) Part I. Pathophysiology, clinical symptoms and recommend screening for vascular malformations
- Screening for gestational diabetes mellitus
