Lokalizovaná (unicentrická) forma Castlemanovy nemoci. Klinické projevy, diagnostika a léčba
Unicentric Castleman’s disease. Symptoms, diagnostics and therapy
Castleman disease (CD) includes a group of rare and heterogeneous disorders with characteristic lymph node histopathological abnormalities. CD can occur in a single lymph node station, which is referred to as unicentric CD (UCD). CD can also involve multicentric lymphadenopathy and inflammatory symptoms – multicentric Castleman disease. The first-ever diagnostic and treatment guidelines were recently developed for UCD and published 2020. Complete surgical resection is often curative and is therefore the preferred first-line therapy, if possible. The management of unresectable UCD is more challenging. Existing evidence supports that asymptomatic unresectable UCD may be observed. The anti–interleukin-6 monoclonal antibody siltuximab should be considered for unresectable UCD patients with an inflammatory syndrome. Unresectable UCD that is symptomatic because of compression of vital neighbouring structures may be rendered amenable to resection by medical therapy (rituximab, steroids), radiotherapy, or embolization. In this article, we report about the symptoms of this disease and about the diagnostics recommendation published in the International, evidence-based consensus diagnostic criteria for HHV-8-negative/ idiopathic multicentric Castleman disease and about the therapeutic recommendation published in International evidence-based consensus diagnostic and treatment guidelines for unicentric Castleman disease published in the year 2020.
Keywords:
siltuximab – rituximab – Castleman’s disease
Authors:
Zdeněk Adam 1; Zdeněk Řehák 2; Zuzana Adamová 3; Renata Koukalová 2; Luděk Pour 1; Marta Krejčí 1; Ivanna Boichuk 1; Martin Krejčí 1; Martin Štork 1; Sabina Ševčíková 4; Zdeněk Král 1
Authors‘ workplace:
Interní hematologická a onkologická klinika LF MU a FN Brno
1; Oddělení nukleární medicíny, Masarykův onkologický ústav Brno
2; Chirurgické oddělení nemocnice Vsetín
3; Ústav patologické fyziologie LF MU Brno
4
Published in:
Vnitř Lék 2021; 67(8): 465-473
Category:
Review Articles
Overview
Castlemanova choroba (Castleman disease – CD) je zastřešující termín pro skupinu heterogenních nemocí s charakteristickými histomorfologickými změnami v postižené nebo v postižených lymfatických uzlinách. Castlemanova choroba může postihnout jen jednu lymfatickou uzlinu, pak ji nazýváme unicentrickou Castlemanovou chorobou (unicentric Castleman disease – UCD). Castlemanova choroba však může také postihovat lymfatické uzliny generalizovaně, a pro tento stav je vyhrazen termín multicentrická Castlemanova choroba (multicentric Castleman disease – MCD). První mezinárodní doporučení pro diagnostiku a léčbu UCD bylo zveřejněno v roce 2020. Dle tohoto doporučení zůstává léčbou volby kompletní chirurgická resekce, pokud je proveditelná. V případě, že ložisko není resekovatelné, nabízí toto doporučení více možných postupů. Pokud je asymptomatické, je možné jen sledování. Pokud ložisko komprimuje důležité orgány a způsobuje tak potíže nemocnému, tak léčbou volby je kombinovaná terapie obsahující rituximab, glukokortikoidy, radioterapii, cytostatika. Pokud lze, je možné použít léčbu embolizaci. Pokud toto chirurgicky neodstranitelné ložisko způsobuje intenzivní systémovou zánětlivou reakci a nepomohla předchozí léčba, je možné použít léčbu cílenou proti interleukinu-6 pomocí preparátu siltuximab. V tomto článku popisujeme symptomy, které může způsobit unicentrická Castlemanova choroby, diagnostické postupy a léčbu se zohledněním mezinárodního doporučení pro diagnostiku Castlemanovy choroba a pro léčbu unicentrické formy Castlemanovy choroby.
Klíčová slova:
rituximab – Castlemanova choroba – siltuximab
Úvod
Castlemanova choroba patří mezi velmi vzácné choroby, takže pokud se její léčba necentralizuje, každý lékař při setkání s touto diagnózou musí otevřít příslušnou odbornou literaturu a hledat, co s takovým pacientem. Informace nutné pro diagnostiku a léčbu bylo nutno získávat z popisů větších či menších souborů z jednotlivých pracovišť a z přehledových článků, dostupných v mezinárodní databázi PUBMED. První mezinárodní doporučení pro diagnostiku této nemoci bylo publikováno nedávno, v roce 2017 (1). Na ně pak navázalo mezinárodní doporučení pro diagnostiku a léčbu multicentrické formy Castlemanovy nemoci roce 2018 (2). V roce 2020 bylo zveřejněno mezinárodní doporučení pro diagnostiku a léčbu unicentrické formy této nemoci (3). Tato tři doporučení představují hlavní milníky pro diagnostiku a léčbu této nemoci, ale užitelné informace přinášejí i další publikace.
V tomto článku se autoři snaží podat přehled informací nutných k ošetřování pacientů s unicentrickou formou Castlemanovy nemoci.
Vývoj poznání Castlemanovy nemoci a její etiologie
Castlemanova choroba je označení pro poměrně heterogenní skupinu nemocí, které patří mezi velmi vzácné choroby. Dnes bychom měli vnímat, že jde o několik chorob řazených do skupiny se zastřešujícím názvem Castlemanova choroba (Castleman disease – CD), nikoliv o jednu chorobu.
Benjamin Castleman poprvé popsal v roce 1954 pacienta s poměrně velkou, ale nemaligní lymfatickou uzlinou v hrudníku. Jednalo se o první popis lokalizované angiofolikulární hyperplazie, umístěné v hrudníku, léčitelné operací (4).
A záhy nato popsal Castleman se spoluautory soubor 12 pacientů s lokalizovanou formou této nemoci (5). Šlo tedy o popis té formy, kterou bychom dnes označili jako unicentrická Castlemanova choroba (unicentric Castleman disease – UCD).
První podrobnější histologické hodnocení a rozlišení hyalinně‑vaskulárního a plazmocelulárního typu Castlemanovy choroby bylo zveřejněno ale až v roce 1972 (6).
V roce 1978 bylo poprvé popsáno mnohočetné postižení lymfatických uzlin angiofolikulární hyperplazií čili dle dnešní terminologie multicentrickou formou Castlemanovy nemoci (multicentric Castleman disease – MCD) (7).
Od roku 1985 je známa koincidence Castlemanovy nemoci s infekcí HIV. První popis souvislosti multicentrické formy Castlemanovy nemoci plazmablastického typu s humánním herpetickým virem typu 8 (virus Kaposiho sarkomu) popsal Soulier v roce 1995 a tato skutečnost byla posléze potvrzena dalšími autory (8, 9). Později se ukázalo, že téměř všichni HIV pozitivní pacienti s Castlemanovou chorobou mají přítomen virus Kaposiho sarkomu (HHV-8), ale že i u části pacientů s Castlemanovou chorobou, kteří nejsou infikováni virem HIV, je přítomen virus HHV-8. V případech HHV-8 asociované Castlemanovy nemoci indukuje virem produkovaný interleukin-6, homolog humánního interleukinu-6, zánětlivou reakci, klinické symptomy a laboratorní abnormality (anémie, hypoalbuminemie, zvýšená koncentrace CRP, polyklonální zmnožení imunoglobulinů).
V případech HHV-8 negativních pacientů s Castlemanovou nemocí, kterých je většina, je hlavním motorem humánní interleukin-6, anebo další cytokiny. Etiologie zvýšené produkce Il-6 či dalších cytokinů není známa, a protože není známa, tak HHV-8 negativní multicentrická Castlemanova choroba je nazývána idiopatickou multicentrickou Castlemanovou chorobou (idiopathic multicentric Castleman disease – iMCD).
Od roku 2000 je jasné, že příčinou jak Castlemanovy nemoci, tak i příbuzné nemoci, POEMS syndromu, je nadprodukce cytokinů a že tyto nemoci se mohou vyskytovat společně (10). V roce 2013 vyšel první popis nové varianty Castlemanovy nemoci, kterou japonští autoři nazvali TAFRO syndrom. Výskyt této nemoci byl posléze popsán i v Evropě, takže není limitována na zemi prvního popisu (11, 14).
Tyto jednotlivé diagnostické jednotky, které řadíme pod skupinové označení Castlemanova nemoc, zde musíme uvést, protože je nutno je brát v úvahu při diferenciální diagnóze. A tak termínem Castlemanova nemoc označujeme v roce 2021 heterogenní skupinu nemocí, jak dle klinického průběhu, tak i dle histologické struktury. Její klinická klasifikace se odvíjí od lokalizace.
Unicentrická forma (unicentric Castleman disease – UCD) postihuje pouze jednu uzlinu či tvoří jedno, obvykle větší, ložisko.
Naopak multicentrická forma (multicentric Castleman disease – MCD) postihuje generalizovaně lymfatické uzliny různých lokalizací a je spojena se systémovými zánětlivými příznaky, jako jsou horečky, úbytek hmotnosti, patologická únava. Tyto zánětlivé příznaky jsou způsobené vyšší hladinou interleukinu-6 (IL-6) a případně vyšší hladinou dalších cytokinů.
Multicentrická forma je pak členěna dále na MCD související s virem Kaposiho sarkomu (HHV-8 pozitivní MCD), dále na MCD související s POEMS (POEMS–MCD). Případy, kde žádná další souvislost není odhalena, se označují jako idiopatická MCD (iMCD). Současné členění zobrazuje schéma 1.

Typická UCD se vyvíjí indolentně a postižená lymfatická uzlina se zvětšuje zvolna. Diagnostikována je tato choroba v jakémkoliv věku (2–84 let) s mediánem věku stanovení diagnózy 34 let a mírnou převahou u žen (15).
Incidence UCD je v USA stanovena na 16–19 případů na 1 milion obyvatel. Pokud by tomu bylo podobně u nás, tak by v ČR ročně mělo být diagnostikováno 160–190 případů (16).
UCD je v naprosté většině případů HHV-8 negativní, ale vzácně byly popsány i HHV-8 pozitivní případy. K nim se doporučuje přistupovat stejně jako k HHV-8 negativním (17).
Příznaky a diagnostika
Rozpoznání je někdy náhodné, pokud je lymfadenopatie asymptomatická a je zjištěna při zobrazovacím vyšetření indikovaném z nějakého jiného důvodu. Při méně časté lokalizaci na povrchu těla si pacient může ložisko vyhmatat sám. Některé pacienty však přivedou k lékaři příznaky z komprese životně důležitých orgánů, jako jsou dýchací cesty, neurovaskulární svazky, uretery, střeva. A že je tomu tak i v ČR, je zřejmé z popisů případů v české a slovenské literatuře (18–26). Pouze u malé části pacientů s UCD se choroba projeví zánětlivou reakcí, podobně jako iMCD.
Ve velkém souboru 404 pacientů byly popsány následující nejčastější lokalizace UCD: mediastinum 29 %, krk 23 %, břicho 21 %, retroperitoneum 17 % (27). UCD se ale také může vyskytnout v axile, inguině, orbitě, nasofaryngu či ve střevě, prostě kdekoliv.
Histopatologické vyšetření postiženého ložiska (lymfatické uzliny) nejčastěji popíše hyalinně‑vaskulární typ, méně často pak typ smíšený anebo typ plazmocelulární. Podrobně se o histologických formách lze dočíst v publikaci věnující se diagnostice této nemoci od Fajgenbauma (1).
Hyalinně vaskulární forma však v případě UCD dominuje a tito pacienti obvykle nemají systémové příznaky způsobené nadprodukcí cytokinů. Četnost plazmocelulární formy UCD se odhaduje na 10 % až 20 % případů (3, 27).
Pacienti s plazmocelulární variantou UCD nebo smíšenou formou UCD mohou občas mít příznaky systémové zánětlivé reakce (noční pocení, subfebrilie až febrilie, nechuť k jídlu, úbytek hmotnosti) a mohou mít laboratorní známky zánětu. A pokud je UCD provázena známkami zánětu, může dojít k poškození ledvin depozity AA‑amyloidu nebo k jinému typu poškození ledvin (28).
Délku života UCD obvykle neovlivňuje, ale pacienti s UCD mají vyšší riziko rozvoje paraneoplastického pemphigu, bronchiolitis obliterans, AA‑amyloidózy, cévních neoplazií (angiosarkomů), sarkomů z folikulárních dendritických buněk a zřejmě i lymfomů (29–31).
Patogeneze je známa pouze částečně. Dle posledních výzkumů je zřejmé, že alespoň u části pacientů dochází ke klonální expanzi stromálních buněk lymfatických uzlin, a tato klonální proliferace stromálních buněk je za toto onemocnění zodpovědná (32–35).
Zvětšená lymfatická uzlina či jiné ložisko vždy vzbudí podezření na lymfom. Je proto vždy důvodem k biopsii a k histologické verifikaci. A proto je třeba vyjmutí reprezentativního vzorku, pokud se již nepřikročí k totální exstirpaci.
Histologicky je nutno vyloučit podobně se chovající afekce: thymom, folikulární lymfom, angioimunoblastický T lymfom. Také některé infekce (HIV) a autoimunitní nemoci mohou vytvořit lymfadenopatie podobné morfologické struktury, ale v těchto případech tyto struktury nejsou unicentrické. Choroby, které mohou morfologicky připomínat UCD a které je třeba diferenciální odlišit, jsou uvedeny v tabulce 1.
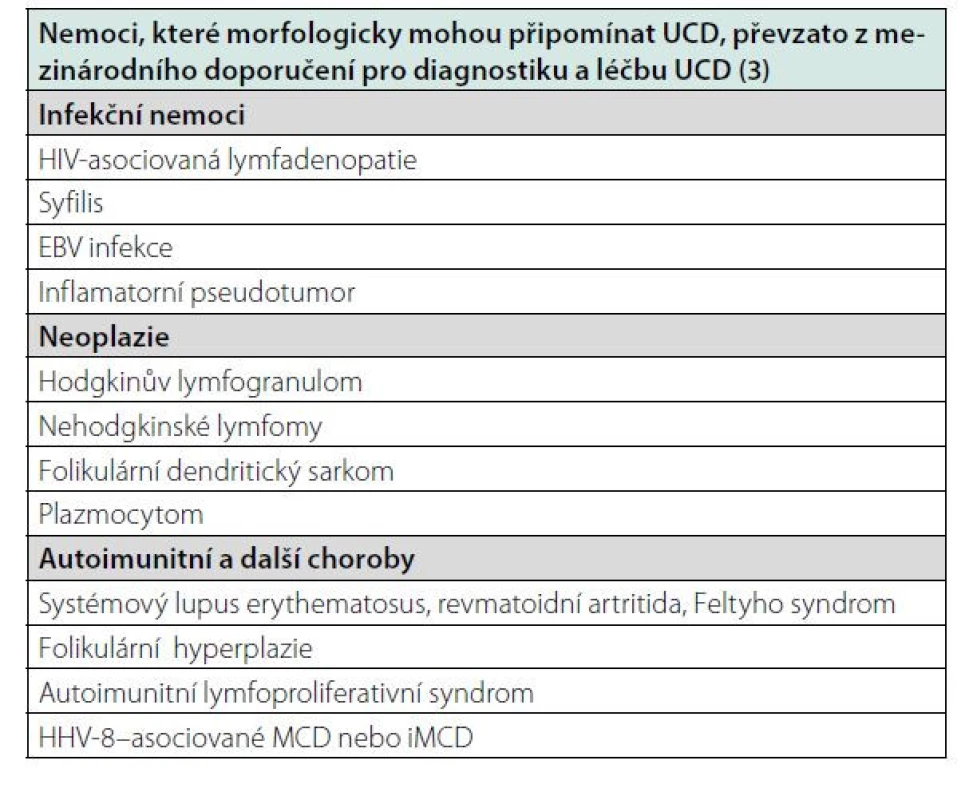
Po vyloučení jiných chorob a po potvrzení Castlemanovy choroby by měla následovat zobrazovací vyšetření s cílem určit, zda jde o solitární či o mnohočetný proces, tedy vyšetření podobné jako u lymfomů: CT zobrazení krku, hrudníku, břicha a pánve, anebo provedení FDG‑PET/ CT zobrazení. Cílem je rozlišení UCD od MCD a případná detekce jiných chorob. Podezření na UCD se zvyšuje v případě značného zvětšení jen jedné lymfatické uzliny nebo zvětšení více uzlin v jedné oblasti s mírným až intenzivním postkontrastním enhancementem při CT zobrazení.
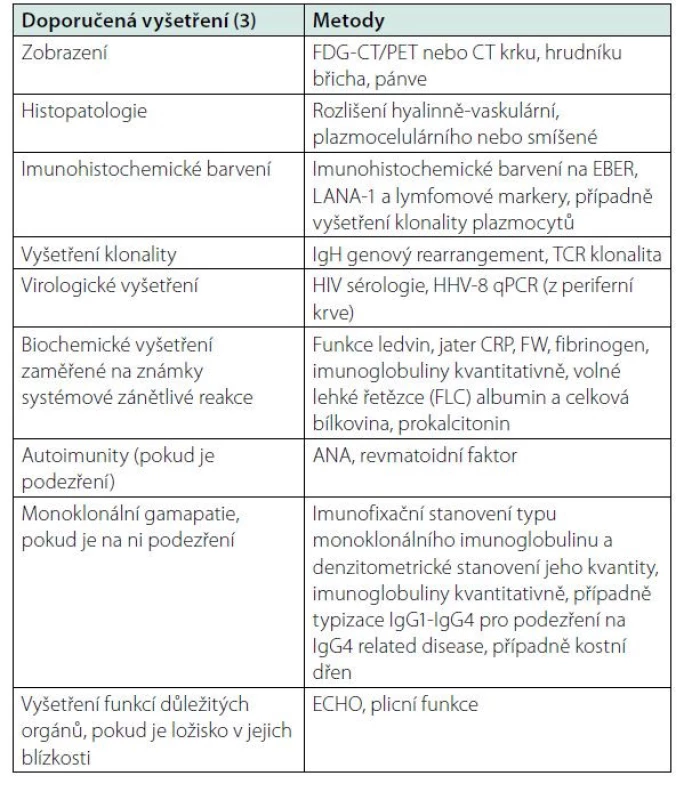
Přehled doporučených vyšetření po zjištění diagnózy lokalizovaná multicentrická Castlemanova choroba je uveden v tabulce 2. Vždy se doporučuje provést imunohistochemické vyšetření přítomnosti HHV-8 infekce, která i u lokalizované formy výjimečně může být. V histologickém vyšetření se detekuje latency‑associated nuclear antigen-1 (LANA-1) jako průkaz infekce a paralelně s tím PCR metodou detekce HHV-8, HIV a EB virémie. Klinické vyšetření se musí zaměřit na přítomnost příznaků systémové zánětlivé reakce a dále na retenci tekutiny (otoky DKK pleurální výpotky, ascites. Ve většině případů však jsou tato vyšetření negativní, protože onemocnění je asymptomatické.
Léčba unicentrické Castlemanovy nemoci (UCD)
Zásadní pro způsob léčby je zodpovězení otázky, zda je ložisko resekovatelné, nebo nikoliv. A to je vždy subjektivní hodnocení operujícího chirurga. Léčebný postup, který závisí na rozhodnutí chirurga, zda lze či nelze operovat, je uveden ve schématu 2.

Resekovatelná UCD
Již Castleman popsal kurativní operační léčbu a na tomto způsobu léčby se od dob prvních případů popsaných Castlemanem nic nezměnilo. Pokud se podaří kompletní resekce izolovaného ložiska, tak by měly vymizet veškeré patologické laboratorní abnormality, pokud vůbec byly přítomny, a případné symptomy. Dispenzieri s kolektivem publikovala 91 % 5leté přežití v sérii 53 operovaných pacientů (36).
Talat popsal podobné výsledky operační léčby, celkové přežití bylo > 90 % ve skupině 278 operovaných pacientů. V této práci již rozlišovali, zda předmětem resekce byla periferně nebo centrálně lokalizovaná lymfadenopatie.
Ze skupiny s periferně lokalizovanou lymfadenopatií zemřel pouze 1 pacient z 68 (1,5 %) v návaznosti na výkon, důvod nebyl udán. Ze skupiny s centrálně lokalizovanou lymfadenopatií, u nichž byla provedena resekce ložiska UCD, zemřelo 9 (6,1 %) ze 148 pacientů.
Pokud nebyly přítomny další symptomy, tak reziduální malé lymfatické uzliny v okolí resekovaného ložiska v průběhu sledování vymizely (37).
Neresekovatelná UCD
Neresekovatelná ložiska jsou obvykle umístěna v mediastinu v blízkosti bronchů a velkých cév. Rozhodnutí, jak dále postupovat, odvisí od toho, zda nelze operovat pro velký objem komprimující důležité struktury nebo pro systémovou zánětlivou odpověď (3).
Asymptomatická neresekovatelná UCD
Lymfadenopatie, která je nepříznaková a přitom není resekovatelná, může zůstat dlouho stabilní či růst jen pozvolna. Zde je možné přistoupit ke sledování za předpokladu, že laboratorní parametry jsou v normě, pacient je bez příznaků a není pravděpodobné, že v dohledné době vzniknou příznaky z komprese důležitých orgánů a struktur těla. A samozřejmě rozhodnutí závisí na očekávané dálce života konkrétního pacienta. V případě, že je pravděpodobné, že se brzy objeví příznaky z komprese, je nutno postupovat agresivněji, jako kdyby již komprese byla přítomna. Kontroly se zobrazovacími a laboratorními vyšetřeními se doporučuje provádět v ročních intervalech stejně jako další vyšetření (3).
Symptomatická neresekovatelná UCD s příznaky komprese
Parciální resekce je jistě jednou z možností. Ale pak musí následovat pečlivé sledování. Na základě popisů případů, kdy došlo ke zmenšení ložiska po podání rituximabu či rituximabu a kortikosteroidů, se doporučuje vyzkoušet tuto neoadjuvantní systémovou léčbu. Vyplývá to z předchozích případů i z poslední studie s 21 pacienty s neresekovatelnou UCD. Tito nemocní dostali steroidy, chemoterapii, rituximab, anebo tocilizumab. A u 7 z nich se podařila kurativní resekce (38).
Ale i z dalších publikací vyplývá přínos této předoperační medikamentózní léčby (39–41).
Dle mínění citovaného doporučení se považuje za léčbu volby v této adjuvantní indikaci rituximab v monoterapii nebo s kortikoidy. A při nedostatečném efektu je možné vyzkoušet další alternativní léky s popsanou účinností u multicentrické formy Castlemanovy nemoci. Předoperační léčba by měla zmenšit velikost UCD, ložiska a to by pak mělo být totálně resekováno.
Pokud tato léčba nezabere a pacienti jsou po ní hodnoceni jako asymptomatičtí, je možné je dále jen sledovat. Ti, kterým ložisko UCD stále způsobuje potíže (symptomy), jsou kandidáti na radioterapii anebo jinou medikamentózní léčbu.
Na našem pracovišti jsme se setkali s jedním případem, kdy by radikální chirurgické řešení vyžadovalo resekci duodena. V tomto případě jsme použili léčbu rituximabem s cyklofosfamidem a dexametazonem, stejný režim, jaký používáme pro léčbu Waldenströmovy makroglobulinemie, a infiltrace totálně vymizela, takže ani nebylo třeba použít radioterapii, o níž jsme uvažovali. Ostatní naši pacienti s UCD měli radikální operační odstranění ložiska a žádný z nich neměl jakékoliv komplikace anebo recidivu.
Symptomatická neresekovatelná UCD s příznaky systémové zánětlivé reakce
Případy, kdy unicentrická forma způsobuje systémové zánětlivé příznaky, jsou velmi vzácné, ale jsou v literatuře popsány. Tato systémová zánětlivá reakce je způsobena lokálně produkovaným Il-6 dle předchozích studií. Tento závěr vyplynul z případů, u nichž po totálním odstranění patologického ložiska UCD zcela vymizely zánětlivé příznaky. A protože léčba blokující účinek IL-6 má efekt u iMCD, tak se doporučuje i u pacientů s UCD se systémovou zánětlivou reakcí před provedením chirurgické i radioterapeutické léčby. Existují dva preparáty blokující účinek Il-6, tocilizumab a siltuximab. Pro léčbu Castlemanovy choroby však je registrován v ČR, v Evropě a v USA pouze siltuximab (42). Siltuximab dostal tuto registraci pro Castlemanovu chorobu na základě randomizované klinické studie, jak uvádíme v textu o multicentrické formě Castlemanovy choroby. S tocilizumabem neproběhly u této diagnózy registrační studie. Pokud léčba blokující Il-6 je efektní a pacient je bez symptomů, je možno přistoupit k operaci. A pokud by operace nebyla z nějakého důvodu možná, je třeba jej ponechat na léčbě blokující účinky Il-6. Pokud při medikamentózní léčbě přetrvávají problémy způsobené UCD, je na zvážení radioterapie, pokud jsou stále kontraindikace operace (3).
Symptomatická neresekovatelná UCD i po aplikaci rituximabu či jiné medikamentózní léčby
Pacienti, u nichž nepomohla žádná z výše uvedených modalit, jsou kandidáti na radioterapii.
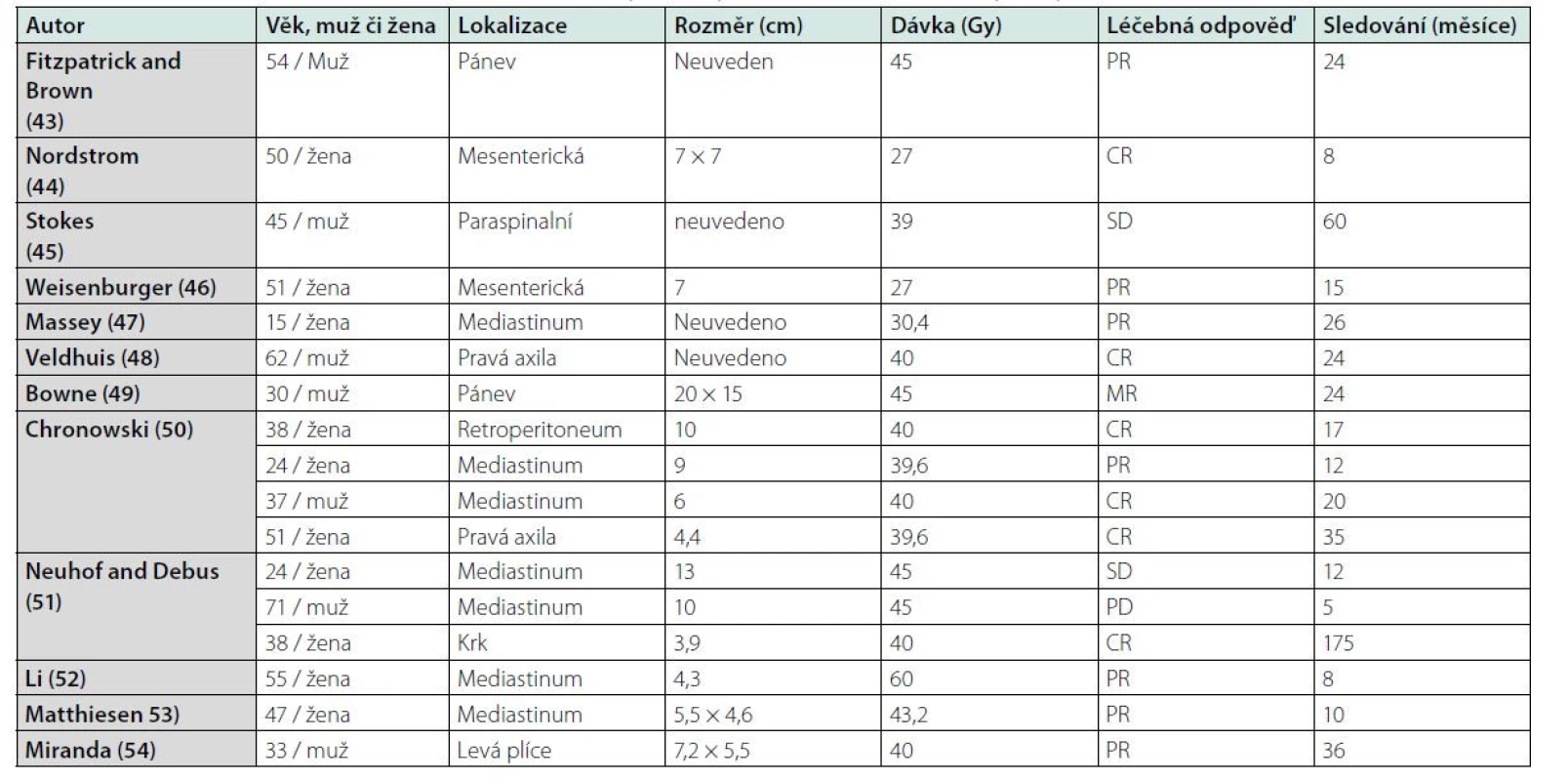
V tabulce 3 uvádíme přehled publikací, jejich autoři popisují vlastní zkušenost s léčbou unicentrické Castlemanovy choroby radioterapií, a použité dávky záření (43–54). Zde neexistuje žádná studie, takže je nutno se řídit těmito publikovanými zkušenostmi. V případě použití radioterapie je nutno myslet na pozdní následky, a proto zvláště u mladých lidí je nutno její indikaci pečlivě uvážit anebo vyzkoušet jiné alternativy, které měly popsán efekt v případě iMCD (kortikosteroidy, cyklosporin A, sirolimus, chemoterapie).
Přetrvávající symptomy po chirurgickém odstranění UCD
Tyto pacienty je třeba pečlivě vyšetřit, protože pravděpodobně je příčinou další paralelně probíhající onemocnění, jako je iMCD, autoimunitní choroby, endokrinopatie, deprese, chronická patologická únava (fatigue) či fibromyalgie. Je třeba provést odpovídající laboratorní testy pro tyto nemoci (3).
Intermediární forma CD
Intermediární forma je taková, která nesplňuje podmínky ani UCD ani iMCD. Pacienti s intermediární formou mají obvykle postiženy 2–3 sousedící lymfatické uzliny, ale obvykle nemají laboratorní abnormality. Tyto případy se popisují jako regionální či oligocentrická CD. Těchto případů je málo a ty, co byly popsány, klinicky a histopatologicky odpovídají UCD (55). Proto se v těchto případech doporučuje také operační odstranění nebo debulking operace. Pokud jsou však systémové příznaky po debulking operaci, doporučuje se léčba dle postupů pro iMCD.
Choroby, které jsou asociovány s UCD
Určité nemoci vznikají s vyšší pravděpodobností po ukončené léčbě UCD než v průměrné populaci. Jde o paraneoplastický pemphigus, Hodgkinův lymfogranulom, anebo nehodgkinské lymfomy a také sarkom z folikulárních dendritických buněk. Dle francouzského registru mělo 18 % pacientů po léčbě UCD některou z těchto komplikací (56). V případě paraneoplastického pemphigu je několik zpráv o regresi po totální resekci UCD. Fatální komplikací může být nemoc zvaná brochiolitis obliterans také častěji diagnostikovaná u pacientů s UCD (57, 58). Také sarkom z folikulárních dendritických buněk je asociován s unicentrickou Castlemanovou chorobou. V analýze 66 pacientů se sarkomem z folikulárních dendritických buněk mělo 6 pacientů UCD a u dvou pacientů s UCD byla diagnóza sarkomu z folikulárních buněk zjištěna až několik let po ukončené léčbě UCD (59).
Dále jsou popsány paralelní diagnózy UCD s Hodgkinovým lymfomem či s nehodgkinskými lymfomy (3). To vše jsou důvody, proč by pacienti měli být po léčbě dispenzarizováni.
Sledování po léčbě
Po ukončení léčby UCD se doporučuje první kontrolní vyšetření po 3 měsících a následujících 5 let by se mělo provádět 1x ročně zobrazovací vyšetření k vyloučení recidivy nemoci a zároveň s tím laboratorní a klinické vyšetření. V následujících letech pak jen klinické a laboratorní vyšetření, pokud nevznikne podezření na recidivu a tedy další indikace k zobrazovacímu vyšetření. Výše uvedené riziko pozdějšího výskytu dalších chorob, uvedených v přechozím odstavci, je důvodem pro nabídnutí dlouhodobé dispenzarizace pacientovi (3).
Článek vznikl v souvislosti s Institucionální podporou MOÚ: MZ ČR – RVO (MOÚ, 00209805)
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika, LF MU a FN Brno Jihlavská 20, 625 00 Brno
Cit. zkr: Vnitř Lék 2021; 67(8): 465–473
Článek přijat redakcí: 17. 9. 2021
Článek přijat po recenzích: 15. 11. 2021
Sources
1. Fajgenbaum DC, Uldrick TS, Bagg A, et al. International, evidence‑based consensus diagnostic criteria for HHV-8-negative/idiopathic multicentric Castleman disease. Blood 2017; 129 (12): 1646–1657.
2. van Rhee F, Voorhees P, Dispenzieri A, et al. International, evidence‑based consensus treatment guidelines for idiopathic multicentric Castleman disease. Blood. 2018;132(20): 2115–2124.
3. van Rhee F, Oksenhendler E, Srkalovic G, et al. International evidence‑based consensus diagnostic and treatment guidelines for unicentric Castleman disease. Blood Adv. 2020;4(23): 6039–6050.
4. Castleman B, Towe VW. Case report of the Massachusetts General Hospital weekly clinicopathological exercises, fouded by Richard C Cabot. N Engl. J. Med 1954; 251 (10) 396-400.
5. Castleman B, Iverson L, Menendez VP. Localized mediastinal lymphnode hyperplasia resembling thymoma.Cancer 1956; 9(4): 822–830.
6. Keller AR, Hochholzer L, Castleman B. Hyaline‑vascular and plasma‑cell types of giant lymph node hyperplasia of the mediastinum and other localisation. Cancer 1972; 29 : 670–683.
7. Gaba AR Stein RS Sweet DJ et al. Multicentric giant node hyperplasia. Amer J Clin Pathol 1978; 69 (1): 86–90.
8. Soulier J, Grollet L, Oksenhendler E, et al. Kaposi’s sarcoma‑associated herpesvirus‑like DNA sequences in multicentric Castleman’s disease. Blood 1995; 86 (4): 1276–1280.
9. Chadbum A, Cesarman E, Nador RG, et al. Kaposi’s sarcoma – associated herpesvirus sequences in benign lymphoid proliferations not associated with human immunodeficiency virus. Cancer 1997; 80 : 788–797.
10. Riu P, Noesl LH, Droz D, et al. Glomerular involvement in lymfoproliferative disorders with hyperproduction of cytokines (Castleman, POEMS) Adv Nephrol Necke Hosp 2000; 30 : 305–331.
11. Masaki Y, Nakajima A, Iwao H, et al. Japanese variant of multicentric castleman’s disease associated with serositis and thrombocytopenia- - a report of two cases: is TAFRO syndrome (Castleman - Kojima disease) a distinct clinicopathological entity? J Clin Exp Hematop 2013; 53 (1): 79–85.
12. Kawabata H, Takai K, Kojima M, et al. Castleman‑Kojima disease (TAFRO syndrome) : a novel systemic inflammatory disease characterized by a constellation of symptoms, namely, thrombocytopenia, ascites (anasarca), microcytic anemia, myelofibrosis, renal dysfunction, and organomegaly : J Clin Exp Hematop 2013; 53 (1): 57–61.
13. Inoue M, Ankou M, Hua J, et al. Complete resolution of TAFRO syndrome (thrombocytopenia, anasarca, fever, reticulin fibrosis and organomegaly) after immunosuppressive therapies using corticosteroids and cyclosporin A: A case report. J Clin Exp Hematop. 2013; 53 (1): 95–99.
14. Tedesco S, Postacchini L, Manfredi L, et al. Successful treatment of a Caucasian case of multifocal Castleman’s disease with TAFRO syndrome with pathophysiology targeted therapy - case report. Exp Hematol Oncol 2015; 4 (1): 3–10.
15. Talat N, Schulte KM. Castleman’s disease: systematic analysis of 416 patients from the literature.Oncologist. 2011;16(9): 1316–1324.
16. Munshi N, Mehra M. van de Velde H, Desai A, et al. Use of a claims database to characterize and estimate the incidence rate for Castleman disease. Leuk Lymphoma 2015; 56(5): 1252–1260.
17. Caselli E, Padovani D, Di Carlo R et al. Parotid localized Castleman’s disease and HHV-8 infection: a case report. Head Neck Surg. 2008;265(3): 377–380.
18. Tóthová E, Fričová M, Sokol L. Castlemanova choroba Hematológia & Transfuziológia. 1993; 3 (1): 19–26.
19. Fichtle J, Treška V, Šulc R, et al. Castlemanova choroba – neobvyklý nález při operaci tumoru retroperitonea u mladého nemocného Rozhledy v chirurgii. 2016; 95 (2): 91-94.
20. Škach J, Vytiska J Gaalová R, et al. Castlemanova choroba imitující tumor perikardu. Kazuistiky v alergologii, pneumologii a ORL. 2014;11 (1): 3–7.
21. Zaválová Š, Jirák P, Syrůček M, et al. Castlemanova choroba – Mimicking a malignant lymphoma. Otorinolaryngologie a foniatrie. 2014; 63 (4): 246–250.
22. Szturz P, Plank L Křístek J, et al. Castlemanova choroba v obrazech. Postgraduální medicína. 2014; 16 (1): 81–88.
23. Rovenský J, Lee B, Kozák I. Castlemanova choroba – multicentrická angiofolikulární lymfoidní hyperplazie Oftalmorevmatologie. První vydání. Praha : Galén, 2017. 2017, s. 221–226.
24. Penka L., Kala Z, Zetelová A, et al. Castleman’s disease - surgical treatment, case reports Rozhledy v chirurgii. 2016; 95 (12): 457–461.
25. Jakubec P, Kolek V, Jakubcová T, et al.Castlemanova nemoc - asymptomatický tumor mediastina Studia pneumologica et phtiseologica. 2005; 65 (4):166–171.
26. Smolár M, Šutiak L, Mikolajčík A, et al. Lymfóm žalúdka ako príčina masívneho krvácania u pacienta s Castlemanovou chorobou. Rozhledy v chirurgii. 2010; 89 (5): 320–324.
27. Talat N, Belgaumkar AP Schulte KM. Surgery in Castleman’s disease: a systematic review of 404 published cases Ann Surg. 2012; 255(4):677–684).
28. FayandA, Boutboul D, Galicier L, et al. Epidemiology of Castleman disease associated with AA amyloidosis: description of 2 new cases and literature review. Amyloid.2019;26(4):197–202.
29. Raza HA, Nokes BT, Rosenthal AC, et al. Unicentric castleman disease complicated by paraneoplastic bronchiolitis obliterans and pemphigus.Respir Med Case Rep. 2018; 25 : 129–132.
30. Ohzono A,Sogame R, Li X, et al. Clinical and immunological findings in 104 cases of paraneoplastic pemphigus. Br J Dermatol. 2015;173(6):1447–1452.
31. Gerald W, Kostianovsky M, Rosai J. Development of vascular neoplasia in Castleman’s disease. Report of seven cases. Am J Surg Pathol. 1990;14(7):603–614.
32. Chang KC, Wang YC, Hung LY, et al. Monoclonality and cytogenetic abnormalities in hyaline vascular Castleman disease.Mod Pathol. 2014; 27(6):823–831.
33. Cokelaere K, Debiec‑Rychter M, De Wolf‑Peeters C, et al. Hyaline vascular Castleman’s disease with HMGIC rearrangement in follicular dendritic cells: molecular evidence of mesenchymal tumorigenesis. Am J Surg Pathol.2002;26(5):662–669.
34. Pauwels P, Dal Cin P, Vlasveld LT, et al. A chromosomal abnormality in hyaline vascular Castleman’s disease: evidence for clonal proliferation of dysplastic stromal cells. Am J Surg Pathol. 2000;24(6):882–888.
35. Li Z, Lan X, Li C, et al. Recurrent PDGFRB mutations in unicentric Castleman disease. Leukemia. 2019; 33(4):1035–1038.
36. Dispenzieri A, Armitage JO, Loe MJ, et al. The clinical spectrum of Castleman’s disease. Am J Hematol. 2012; 87(11):997–1002.
37. Talat N; Belgaumkar AP, Schulte KM. Surgery in Castleman’s disease: a systematic review of 404 published cases.Ann Surg.2012; 255(4):677–684.
38. Boutboul D, Fadlallah J, Chawki S, et al. Treatment and outcome of unicentric Castleman disease: a retrospective analysis of 71 cases. Br J Haematol. 2019;186(2):269–273
39. Mohan M, Meek JC, Meek ME, et al. Combinatorial treatment for unresectable unicentric Castleman disease. Eur J Haematol. 2021 Jul 9. doi: 10.1111/ejh.13685.
40. Bandera B, Ainsworth C, Shikle J, et al. Treatment of unicentric Castleman disease with neoadjuvant rituximab. Chest. 2010;138(5):1239–1241.
41. Baek HJ, Kook H, Han DK, et al. Unicentric Castleman disease relapsed after rituximab‑CHOP chemotherapy or radiation therapy in an adolescent. J Pediatr Hematol Oncol. 2012; 34(5): e206–8.
42. Abid MB, Peck R, Abid MA, et al. Is tocilizumab a potential therapeutic option for refractory unicentric Castleman disease? Hematol Oncol. 2018;36(1):320–323.
43. Fitzpatrick PJ, Brown TC. Angiofollicular lymph node hyperplasia. Can Med Assoc J. 1968;99(25):1259–1262. [PMC free article] [PubMed].
44. Nordstrom DG, Tewfik HH, Latourette HB. Plasma cell giant lymph node hyperplasia responding to radiation therapy. AJR Am J Roentgenol. 1978;130(1):169–171.
45. Stokes SH, Griffith RC, Thomas PR. Angiofollicular lymph node hyperplasia (Castleman’s disease) associated with vertebral destruction. Cancer. 1985;56(4):876–879.
46. Weisenburger DD, DeGowin RL, Gibson P, Armitage JO. Remission of giant lymph node hyperplasia with anemia after radiotherapy. Cancer. 1979;44(2):457–462.
47. Massey GV, Kornstein MJ, Wahl D, Huang XL, McCrady CW, Carchman RA. Angiofollicular lymph node hyperplasia (Castleman’s disease) in an adolescent female. Clinical and immunologic findings. Cancer. 1991;68(6):1365–1372.
48. Veldhuis GJ, van der Leest AH, de Wolf JT, de Vries EG, Vellenga E. A case of localized Castleman’s disease with systemic involvement: treatment and pathogenetic aspects. Ann Hematol. 1996;73(1):47–50. [PubMed]
49. Bowne WB, Lewis JJ, Filippa DA, et al. The management of unicentric and multicentric Castleman’s disease: a report of 16 cases and a review of the literature. Cancer. 1999;85(3):706–717.
50. Chronowski G M, Ha C S, Wilder RB, et al. Treatment of unicentric and multicentric Castleman disease and the role of radiotherapy Cancer 2001;92 (3): 670–676.
51. Neuhof D, Debus J. Outcome and late complications of radiotherapy in patients with unicentric Castleman disease. Acta Oncol. 2006;45(8):1126–1131.
52. Li YM, Liu PH, Zhang YH, et al. Radiotherapy of unicentric mediastinal Castleman’s disease. Chin J Cancer. 2011;30(5): 351–356.
53. Matthiesen C, Ramgopol R, Seavey J, et al. Intensity modulated radiation therapy (IMRT) for the treatment of unicentric Castlemans disease: a case report and review of the use of radiotherapy in the literature. Radiol Oncol 2012;46(3):265–270.
54. Miranda FA, Faria VH, Arruda GV, Silva LG. Radiation therapy in the treatment of unicentric Castleman’s disease. J Bras Pneumol. 2013;39(1):116–118.
55. Oksenhendler E, Boutboul D, Fajgenbaum D, et al. The full spectrum of Castleman disease: 273 patients studied over 20 years. Br J Haematol. 2018;180(2):206–216.
56. Boutboul D, Fadlallah J, Chawki S, et al. Treatment and outcome of unicentric Castleman disease: a retrospective analysis of 71 cases. Br J Haematol. 2019;186(2):269–273
57. Maldonado F, Pittelkow MR, Ryu JH. Constrictive bronchiolitis associated with paraneoplastic autoimmune multi‑organ syndrome. Respirology. 2009;14(1):129–133.
58. Dong Y, Wang M, Nong L, et al. Clinical and laboratory characterization of 114 cases of Castleman disease patients from a single centre: paraneoplastic pemphigus is an unfavourable prognostic factor. Br J Haematol. 2015;169(6):834–842.
59. Jain P, Milgrom SA, Patel KP, et al. Characteristics, management, and outcomes of patients with follicular dendritic cell sarcoma. Br J Haematol. 2017;178(3):403–412.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2021 Issue 8
-
All articles in this issue
- Problematika antibiotické léčby u pacientů s covidem-19
- Aktivní vyhledávání a časná diagnostika HCV infikovaných osob
- Optimální hladina kalia u pacientů se srdečním selháním
- Lokalizovaná (unicentrická) forma Castlemanovy nemoci. Klinické projevy, diagnostika a léčba
- Glifloziny – nové léky pro pacienty se srdečním selháním?
- Renoparenchymatózní hypertenze – aktuality v diagnostice a léčbě
- Oboustranné vícečetné pneumatokély jako vzácná pozdní komplikace pneumonie covid-19
- Jaká jsou specifika syndromu diabetické nohy a proč potřebujeme mezioborová doporučení pro jeho diagnostiku a léčbu?
- Expertní konsenzus k významu deficitu železa a možnosti jeho korekce u pacientů se srdečním selháním
- Memorandum z jednání zástupců ČIS a ČPFS dne 6. 5. 2021 v Lékařském domě ČLS JEP v Praze
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Renoparenchymatózní hypertenze – aktuality v diagnostice a léčbě
- Glifloziny – nové léky pro pacienty se srdečním selháním?
- Optimální hladina kalia u pacientů se srdečním selháním
- Problematika antibiotické léčby u pacientů s covidem-19
