Reumatoidná artritída a poruchy metabolizmu
Rheumatoid arthritis and metabolic disorders
Rheumatoid arthritis is a chronic autoimmune inflammatory disease associated with multiple metabolic alterations and increased cardiovascular risk. It is supposed that visceral obesity seems to be a connection between rheumatoid arthritis and cardiovascular diseases. Obesity is not only associated with increased disease activity and worsened quality of life in this group of patients, but also determines the effectiveness of treatment. Biological therapy interferes with metabolic changes, too. Therefore, there is a tendency to select the right anticytokine preparation in the first line of treatment to reduce not only disease activity but also affect aspects of metabolic syndrome and comorbidites, thereby reducing cardiovascular risk and patient’s mortality. This work offers a basic overview of the associations between rheumatoid arthritis and metabolic disorders, describes the impact of biological therapy on individual components of the metabolic syndrome.
Keywords:
anticytokine treatment – cardiovascular risk – metabolic syndrome – rheumatoid arthritis
Authors:
Stela Kašperová 1; Lenka Tarabčáková 2; Barbora Kašperová 3; Emőke Šteňová 1
Authors‘ workplace:
I. interná klinika Lekárskej fakulty Univerzity Komenského v Bratislave a Univerzitnej nemocnice v Bratislave
1; Reumatologická ambulancia, Nemocnica Sv. Michala, Bratislava
2; Klinika onkohematológie LF UK a NOÚ, Bratislava
3
Published in:
Vnitř Lék 2021; 67(E-2): 18-24
Category:
Overview
Reumatoidná artritída je chronické autoimunitné zápalové ochorenie asociované s viacerými metabolickými poruchami a zvýšeným kardiovaskulárnym rizikom. Predpokladá sa, že viscerálna obezita je tzv. spojkou medzi reumatoidnou artritídou a kardiovaskulárnymi ochoreniami. Obezita je v tejto skupine pacientov asociovaná nielen so zvýšenou aktivitou choroby a zhoršenou kvalitou života, ale ovplyvňuje aj účinnosť terapie. Biologická liečba súčasne interferuje s metabolickými zmenami. Z týchto dôvodov prevláda snaha o voľbu správneho anticytokínového preparátu v prvej línii liečby s cieľom znížiť nielen aktivitu ochorenia, ale ovplyvniť aj aspekty metabolického syndrómu a komorbidity, a tým znížiť kardiovaskulárne riziko a mortalitu pacientov. Táto práca ponúka prehľad o súvislostiach medzi reumatoidnou artritídou a poruchami metabolizmu, popisuje vplyv biologickej liečby na jednotlivé komponenty metabolického syndrómu.
Klíčová slova:
anticytokínová liečba – kardiovaskulárne riziko – metabolický syndrom – reumatoidná artritída
Úvod
Reumatoidná artritída (RA) je autoimunitné ochorenie postihujúce primárne synoviálne kĺby, súčasne však predstavuje systémovú chorobu s postihnutím viacerých orgánov. Je asociovaná o. i. s komorbiditami a metabolickými alteráciami prejavujúcimi sa zmenami v telesnej kompozícii, lipidovom profile, inzulínovej senzitivite. Niektoré tieto parametre zahŕňa koncepcia metabolického syndrómu ako proinflamatórneho a proaterogénneho stavu. Pacienti s reumatoidnou artritídou majú zvýšené kardiovaskulárne (KV) riziko, ktoré je podobné ako u pacientov s diagnózou diabetes mellitus. Riziko vzniku infarktu myokardu je približne o 70 % vyššie ako v bežnej populácii a korešponduje s vekovou skupinou pacientov staršou o 10 rokov (1). KV ochorenia predstavujú tretiu najčastejšiu komorbiditu pacientov s RA po depresii a astme (2), a sú najčastejšou príčinou mortality ako prejav akcelerovanej aterosklerózy (3).
Patogenéza RA je nejasná. Predpokladá sa, že obezita hrá kľúčovú úlohu v patogenéze viacerých autoimunitných a zápalových ochorení. V prípade reumatoidnej artritídy je pravdepodobne viscerálna obezita tzv. spojkou medzi RA a KV ochoreniami. Viscerálne tukové tkanivo je najväčší endokrinný orgán tela a je zdrojom množstva metabolicky aktívnych látok. Produkuje hormóny, cytokíny, adipokíny, ktoré majú pleiotropné účinky, proinflamačné vlastnosti. Zatiaľ čo jednotlivé pro - cesy a mechanizmy nie sú úplne objasnené, je preukázaná rozdielna účinnosť liečebných preparátov v jednotlivých skupinách pacientov.
Typickými prejavmi porúch metabolizmu u pacientov s RA sú obezita, reumatoidná kachexia, inzulínová rezistencia, lipidový paradox, prítomnosť metabolického syndrómu.
Obezita a reumatoidná kachexia
Obezita je v súčasnosti závažným epidemiologickým problémom. Nie je len kumuláciou tukového tkaniva, ale je považovaná za chronické zápalové ochorenie s nízkou aktivitou. Má negatívny vplyv nielen na rozvoj autoimunitného ochorenia, jeho aktivitu, kvalitu života, ale ovplyvňuje aj odpoveď na liečbu. Tento efekt je výrazný práve u RA a psoriatickej artritídy (1). Problematika obezity je u týchto pacientov zložitá a je potrebné ju správne interpretovať.
U pacientov s malignitami, chronickými ochoreniami, či už autoimunitnými alebo inými chronickými zápalovými procesmi (napr. osteomyelitída, tuberkulóza), sú produkované mediátory zápalu, najmä tumor nekrotizujúci faktor-α (TNF-α) nazývaný aj kachektín a dochádza ku kachexii. Pod pojmom „klasická kachexia” rozumieme redukciu svalovej aj tukovej hmoty súčasne. U pacientov s RA dochádza k tzv. „reumatoidnej kachexii”, čiže k redukcii svalovej hmoty na vrub tukovej hmoty. Často majú títo pacienti normálny alebo ľahko zvýšený index telesnej hmotnosti (BMI – body mass index) a telesnú hmotnosť, ale zmenenú distribúciu tukovej hmoty. Hodnota BMI teda nedostatočne koreluje s viscerálnou obezitou a musí byť odlišne interpretovaná ako v bežnej populácii. Na presnejšie stanovenie jednotlivých zložiek telesnej hmoty a distribúcie tuku by bolo vhodnejšie využiť iné metódy, ako napr. celotelovú denzitometriu so softvérom „whole body composition“, ktorá sa však v bežnej klinickej praxi nevyužíva. Predpokladá sa, že viscerálna obezita je tzv. spojkou medzi RA, inzulínovou rezistenciou a KV ochoreniami.
Paradoxne u obéznych pacientov s RA bola preukázaná nižšia KV mortalita, čo sa označuje ako „obesity paradox” (4). RA v tejto skupine pacientov je tiež charakterizovaná pomalšou rádiologickou progresiou, menším počtom erózií, akoby vyššie BMI malo protektívny efekt na poškodenie kĺbov, hlavne u séropozitívnych pacientov (5). Možným vysvetlením sú adipokíny, aj keď molekulárne mechanizmy zatiaľ nie sú úplne objasnené. Kachexia je naopak spájaná s vyššou aktivitou choroby a zvýšenou KV mortalitou.
Úloha adipokínov
V roku 1994 bola s objavom prvého adipokínu leptínu formulovaná nová funkcia tukového tkaniva, a to produkcia molekúl s pleiotropným účinkom. Tukové tkanivo produkuje množstvo mediátorov, akými sú proinflamačné cytokíny, hormóny, adipokíny, adhezívne molekuly, molekuly imunitného systému. Adipokíny sú látky produkované iba tukovým tkanivom, adipocytokíny sa tvoria aj v iných tkanivách. Modulujú zápal viacerými cestami – autokrinnou, parakrinnou, endokrinnou. V patogenéze RA ovplyvňujú cieľové orgány a bunky chrupavky, synovie, kosti a ďalšie bunky imunitného systému. Súbor adipokínov ľudského proteómu sa nazýva adipokinóm (6). V súčasnosti poznáme asi 600 rôznych molekúl. Najviac prebádané adipokíny sú adiponektín, leptín, rezistín a visfatín. V tabuľke 1 je uvedený prehľad vplyvu adipokínov na cytokíny, hlavne interleukín 6 (IL-6) a interleukín 1β (IL-1β) a ich pôsobenie na bunky prostredníctvom receptorov a signálnych dráh.
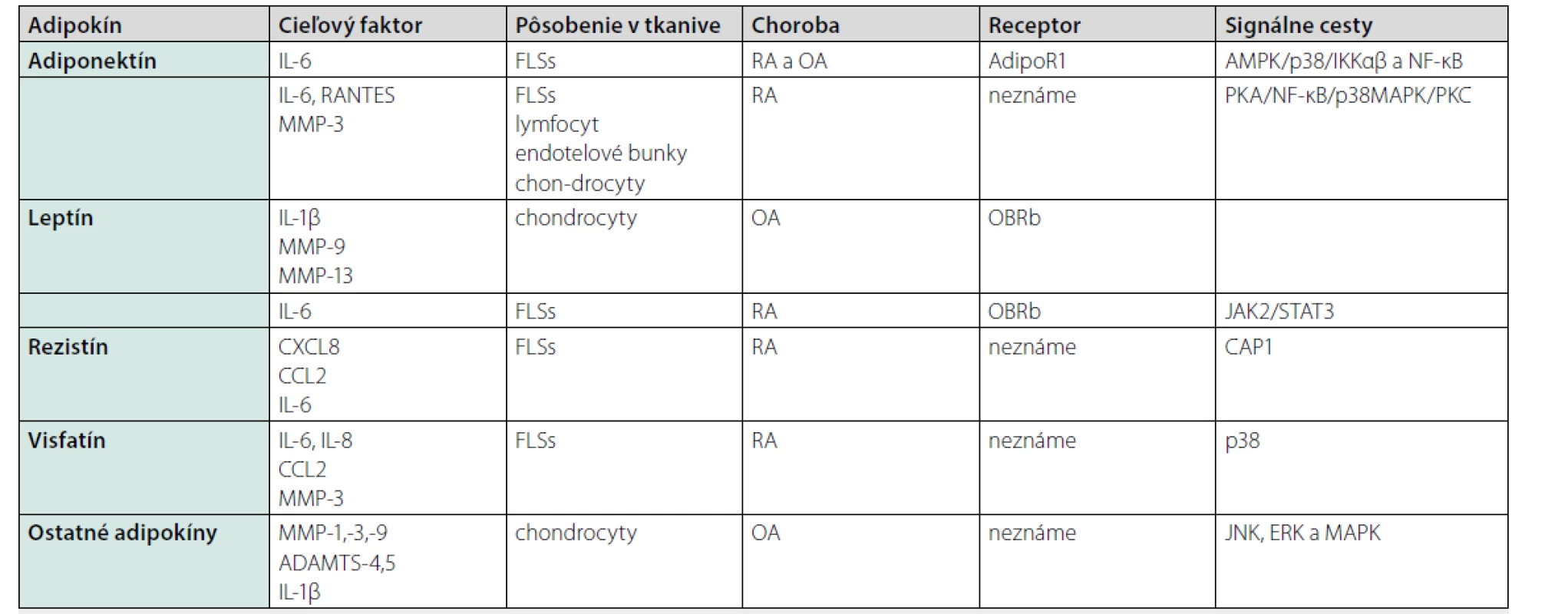
Adiponektín
V súčasnej literatúre pribúdajú dôkazy o jeho významnej úlohe v procesoch vrodenej a získanej imunity a následne v rozvoji chronických zápalových ochorení, hlavne ochorení KV systému, diabetes mellitus 2. typu, metabolického syndrómu, osteoartrózy, reumatoidnej artritídy. Adiponektín (ADP) má rôzne funkcie v rámci metabolizmu, pôsobí napr. na glukózový a lipidový metabolizmus, inzulínovú senzivitivitu, zápal, proces angiogenézy (6). Jeho funkcia závisí od jeho izoformy s nízkou alebo vysokou molekulovou hmotnosťou, môže mať proinflamatórne a antiinflamatórne vlastnosti v závislosti od podmienok. Pôsobí prostredníctvom receptorov AdipoR1 (adiponectin receptor 1) hlavne v kostrovom svalstve a AdipoR2 (adiponectin receptor 2) predovšetkým v pečeni. Nízka hodnota je asociovaná s hyperglykémiou, aterogénnou dyslipidémiou, metabolickým syndrómom a pravdepodobne zohráva úlohu v procese aterogenézy.
U pacientov s RA boli zistené zvýšené hodnoty ADP v sére a v synoviálnej tekutine. Na jednej strane dokáže tento adipokín suprimovať aktivitu prozápalových cytokínov TNF-α a IL-6 a stimulovať produkciu protizápalových cytokínov, napr. IL-10. Na druhej strane u pacientov s RA zvýšené hodnoty ADP stimulujú synoviálne fibroblasty k produkcii IL-6, zvyšujú produkciu vaskulárneho endotelového rastového faktora (VEGF – vascular endothelial growth factor) a matrixovej metaloproteinázy (MMP – matrix metalloproteinase) fibroblastami podobnými synoviocytom (FLS – fibroblast like synoviocytes) (6).
Zvýšená koncentrácia ADP u pacientov s RA koreluje s aktivitou ochorenia, rádiologickou progresiou a je prítomná u pacientov s nižším objemom viscerálneho tuku (4). Zvýšené hodnoty ADP boli tiež asociované s priaznivejším lipidovým profilom u pacientov s RA, ale nie u pacientov bez tohto ochorenia (priaznivejší pomer celkový cholesterol/ HDL-cholesterol a triacylglyceroly/HDL-cholesterol) (7). Sekrécia ADP je inhibovaná prozápalovými cytokínmi napr. TNF-α, IL-6 (8), čo predstavuje možnú asociáciu medzi prebiehajúcim zápalom a prítomnosťou inzulínovej rezistencie a obezity. Hypotéza, či zvýšená koncentrácia ADP pôsobí protektívne na vznik ochorení KV systému a obezity, ako aj celkovo jeho úloha zostáva kontroverzná a jej objasnenie vyžaduje ďalší vedecký výskum (6).
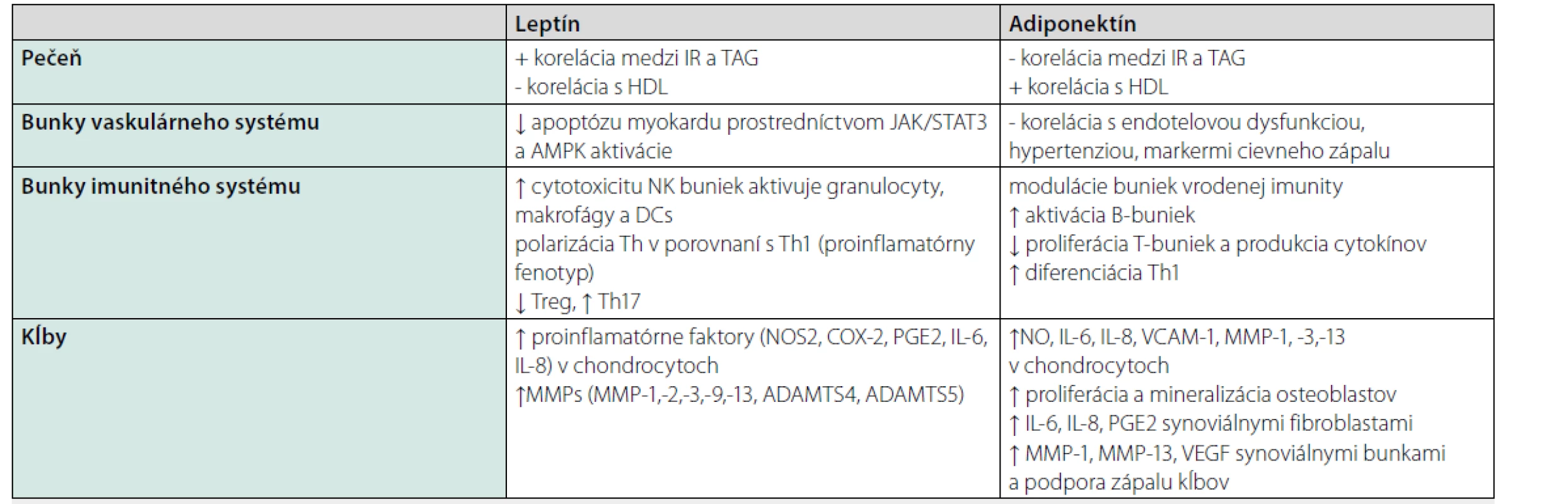
Leptín
Leptín, produkovaný hlavne bunkami bieleho tukového tkaniva, reguluje chuť do jedla a obezitu indukciou anorexigénnych faktorov a supresiou orexigénnych neuropeptidov (9). Všeobecne je považovaný za proinflamatórny adipokín. Z imunologického aspektu stimuluje aktiváciu T-buniek, produkciu cytokínov fibroblastmi, endotelovú dysfunkciu, zhoršuje inzulínovú rezistenciu. Okrem iného stimuluje produkciu IL-8, prostredníctvom ktorého aktivuje JAK2 (Janusova kináza 2) a signálnu cestu JAK2/STAT3, a tým aktivuje substrát inzulínového receptora. Tiež stimuluje produkciu IL-6, zvyšuje expresiu adhezívnych molekúl v chondrocytoch. Stimulujú ho proinflamatórne cytokíny (4).
Výsledky vedeckého výskumu zameraného na vzťah medzi leptínom a RA sú kontroverzné. Podľa niektorých prác zvýšená koncentrácia leptínu v sére a v synoviálnej tekutine koreluje s trvaním ochorenia, aktivitou choroby a rádiologickou progresiou (10). Iní autori však potvrdzujú vysoké hodnoty leptínu pri miernej štrukturálnej progresii vplyvom anabolického účinku leptínu na chrupavku a proteoglykány (4).
Vyššie hladiny leptínu súvisia so zvýšeným rizikom KV komplikácií a obezity u pacientov s RA. Avšak hladiny môžu byť u pacientov v norme, zvýšené alebo znížené, závisí od podávanej liečby, ktorá interferuje s produkciou adipokínov. Tabuľka 2 uvádza prehľad hlavných účinkov týchto adipokínov na jednotlivé orgány. Presné objasnenie funkcie adipokínov a mechanizmov pôsobenia môže predstavovať v budúcnosti cieľ liečby pacientov s RA.
Metabolický syndróm
S obezitou a najmä s viscerálnou obezitou úzko súvisí metabolický syndróm. Podľa IDF (International Diabetes Federation) je definovaný ako prítomnosť centrálnej obezity a ďalších aspoň dvoch kritérií (hypertriacylglycerolémia, nízke hodnoty HDL-cholesterolu, zvýšené hodnoty krvného tlaku alebo liečená hypertenzia, hyperglykémia alebo diagnostikovaný diabetes mellitus 2. typu). Vyskytuje sa asi u štvrtiny dospelej populácie, v závislosti od definície, počas života sa vyvinie u väčšiny populácie. Výskyt u pacientov s RA je približne o 40 % vyšší v porovnaní s bežnou populáciou. Metabolický syndróm predstavuje proinflamatórny a protrombotický stav vedúci k ateroskleróze a vaskulopatii. Každá komponenta metabolického syndrómu je nezávislým rizikovým faktorom KV ochorení. Či ho predstavuje aj samotný metabolický syndróm nie je úplne jasné (4). Podstatou je pravdepodobne inzulínová rezistencia a viscerálna obezita.
Inzulínová rezistencia
Inzulínová rezistencia je stav s relatívnym nedostatkom inzulínu. Môže vzniknúť na predreceptorovej, receptorovej alebo postreceptorovej úrovni (11). Pretrvávaním hyperglykémie dochádza k hyperinzulinémii, postupnému opotrebovaniu β-buniek pankreasu a následne k vzniku diabetes mellitus 2. typu. RA je asociovaná so zvýšenou inzulínovou rezistenciou, redukovaná aktivita β-buniek je popisovaná pri zvýšenej aktivite choroby. Tiež boli zaznamenané korelácie medzi inzulínovou rezistenciou a formáciou karotických plakov u pacientov s RA (4). Pravdepodobne IL-1β, IL-6 a TNF-α, ktoré hrajú dôležitú úlohu v patogenéze RA, sú kľúčové aj v rozvoji inzulínovej rezistencie.
Lipidový profil
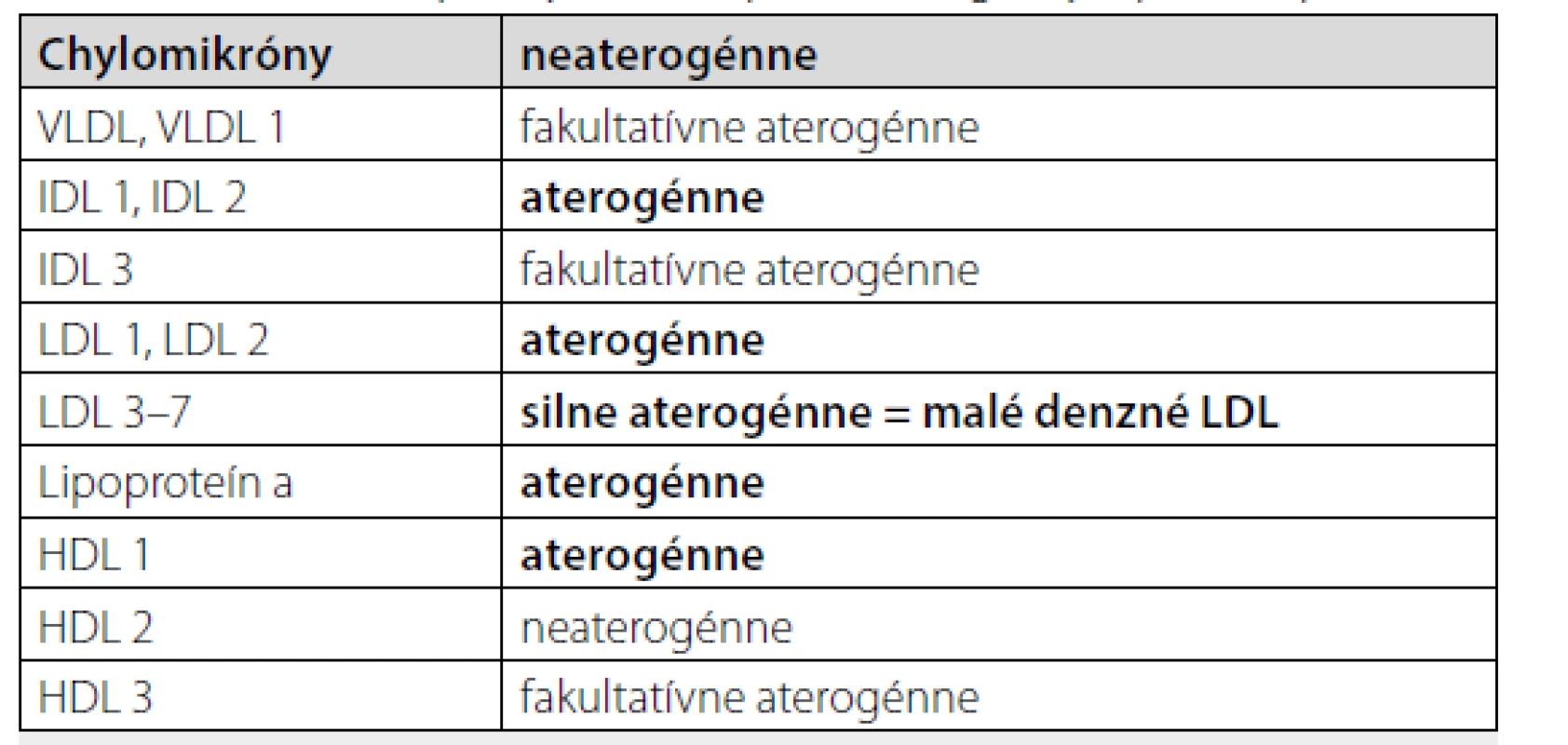
Prebiehajúci zápal, zvýšené hodnoty C - reaktívneho proteínu (CRP) a proinflamačných cytokínov ovplyvňujú hladiny lipidov, čo vedie k dezinterpretáciám a zmätočným informáciám pri hodnotení KV rizika pacientov s RA. Rozdelenie jednotlivých frakcií podľa aterogenity uvádza tabuľka 3. Pri reumatoidnej artritíde dochádza ku kvantitatívnym aj kvalitatívnym zmenám lipidov.
Kvalitatívne zmeny
Proaterogénna dyslipidémia bola identifikovaná vo všetkých štádiách RA (4). Malé denzné LDL častice ľahšie penetrujú do subintimálneho priestoru ciev, podliehajú oxidácii, čo vedie k zvýšenej väzbe na alternatívne LDL receptory. Lipoproteín „a“, teda LDL častica, ktorá sa viaže na apolipoproteín A je nezávislý rizikový faktor KV ochorení. HDL-cholesterol je súčasťou vrodenej imunity, hrá dôležitú úlohu v obrane voči hostiteľovi. Pri prebiehajúcom zápale sa mení jeho funkcia, čo následne zlepšuje obranu hostiteľa. V štádiách chronického zápalu, akým je aj metabolický syndróm, sú HDL molekuly vysoko dysfunkčné naviazaním napr. amyloidu A a ďalších proteínov, ktoré znižujú jeho antioxidačnú a antiinflamatórnu aktivitu (13). Komplexný účinok zvýšenej oxidácie LDL a zníženej protektívnej úlohy HDL a zápalom indukované zhoršenie profilu lipidových častíc prispievajú k proaterogénnemu procesu v rámci metabolického syndrómu a RA.
Kvantitatívne zmeny
Pacienti v predklinickej fáze a v skorých štádiách RA vykazujú lipidový profil podobný profilu pacientov s klasickým metabolickým syndrómom, tzn. hladiny celkového cholesterolu, LDL častíc sú v norme alebo ľahko elevované, triacylglyceroly a hodnota HDL sú znížené. V ďalšom priebehu RA sa hromadí viscerálny tuk na úkor svalovej hmoty a subkutánnej vrstvy tukového tkaniva, prebieha chronický zápal, ktorý je spojený so zníženými hodnotami celkového cholesterolu a LDL. Tento fenomén sa nazýva „lipidový paradox“, pretože pacienti aj napriek nízkym hodnotám lipidov majú zvýšené KV riziko. Na výpočet aterogénneho indexu sa používa pomer celkový cholesterol/HDL alebo LDL/HDL (4), čo však nemusí korelovať so skutočným KV rizikom u pacientov s RA.
Liečba reumatoidnej artritídy a jej vplyv na kardiovaskulárne riziko
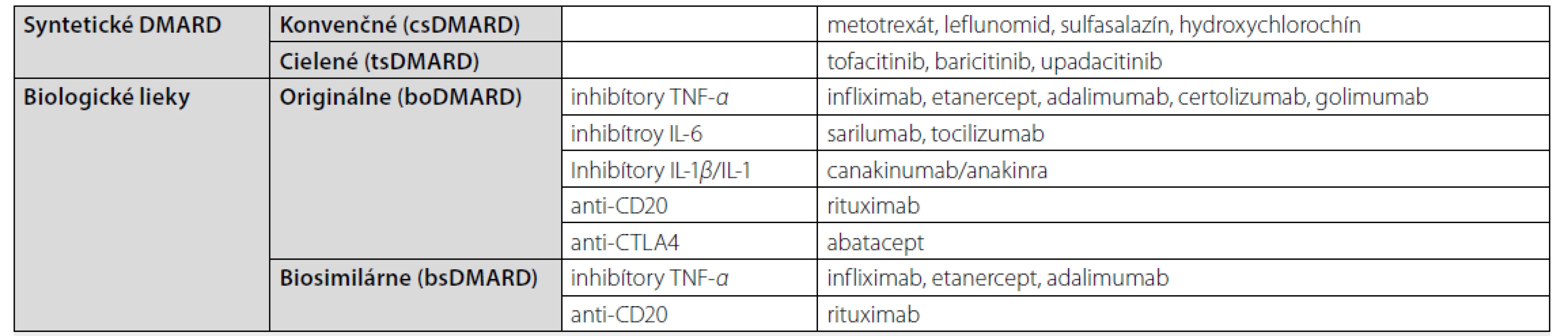
Cieľom liečby RA je potlačenie zápalovej aktivity a zabránenie progresie štrukturálnych zmien kĺbov. V liečbe sa využívajú rôzne konvenčné syntetické, biologické a cielené chorobu modifikujúce antireumatiká (csDMARDs – conventional synthetic disease modifying antirheumatic drugs, bDMARDs – biological DMARDs, tsDMARDs – targeted synthetic DMARDs), ktoré sú efektívne aj v redukcii KV rizika. Prehľad znázorňuje tabuľka 4.
Vplyv biologickej liečby RA na inzulínovú rezistenciu a diabetes mellitus
TNF-inhibítory (TNFi) zatiaľ nepreukázali dostatočný efekt na inzulínovú senzitivitu. Existujúce klinické štúdie však majú svoje limitácie, sú krátkodobé, zahrňajú malý počet pacientov, chýbajú dobre dizajnované štúdie a silnejšie dôkazy.
Inhibícia IL-1 receptoru (IL-1Ri) je ďalšou možnosťou ovplyvnenia aktivity RA. Preparát anakinra v porovnávacej klinickej štúdii s TNFi u pacientov s reumatoidnou artritídou s komorbiditou diabetes mellitus viedol k zníženiu hodnoty glykovaného hemoglobínu ako aj hladiny glukózy nalačno. Tento efekt pretrvával aj po ukončení biologickej liečby, čo môžeme interpretovať ako zlepšenie sekrečnej funkcie β-buniek Langerhansových ostrovčekov pankreasu IL-1Ri. TNFi nepreukázali signifikantný efekt na metabolizmus glukózy. Vplyv na základné reumatické ochorenie bol podobný pri oboch liečebných modalitách (14). Prekvapivý bol výsledok štúdie s ďalším preparátom z tejto skupiny liekov, canakinumabom, ktorý sa aplikoval pacientom s vysokým KV rizikom po prekonaní infarktu myokardu. Počas liečby došlo k signifi - kantnej redukcii KV rizika v závislosti od dávky (účinok sa preukázal len pri vyššom dávkovaní 300 mg subkutánne každé tri mesiace), avšak bez efektu na hladiny lipidov. Canakinumab síce redukoval hodnoty glykovaného hemoglobínu do 9 mesiacov u pacientov s prediabetom, ale bez efektu na redukciu vzniku diabetes mellitus po 48 mesiacoch (15). Z uvedeného vyplýva, že na vzniku diabetu sa pravdepodobne podieľajú aj iné signálne dráhy sprostredkované nielen IL-1β.
Blokátory IL-6 receptoru taktiež disponujú silným protizápalovým efektom pri liečbe RA. Účinok na zníženie glykovaného hemoglobínu bol preukázaný u sarilumabu v kombinácii s csDMARDs (u pacientov s RA alebo bez diagnózy diabetes mellitus). Taktiež tento preparát znižoval hodnotu glykémie nalačno u pacientov s RA a diabetes mellitus 2. typu (16). Pravdepodobne zvýšené hodnoty IL-6 úzko súvisia s rozvojom inzulínovej rezistencie u pacientov s diabetes mellitus 2. typu. Podobné výsledky boli preukázané s tocilizumabom, ktorý zlepšuje inzulínovú senzitivitu inhibíciou IL-6.
Vplyv biologickej liečby RA na lipidový profil
V predklinickom štádiu je lipidový profil u pacientov s RA normálny alebo sú mierne elevované hladiny celkového cholesterolu, LDL a triacylglycerolov, s nižšou koncentráciou HDL. Progresia ochorenia do klinicky manifestného stavu vedie k strate svalovej hmoty a podkožného tuku s nárastom objemu viscerálneho tuku. Pravdepodobne táto katabolická viscerálna obezita so zachovaným BMI vedie k poklesu týchto jednotlivých zložiek lipidov (obr. č. 1). Liečba RA a potlačenie zápalovej aktivity síce vedie k ich opätovnému nárastu, avšak bez zvýšenia KV rizika.
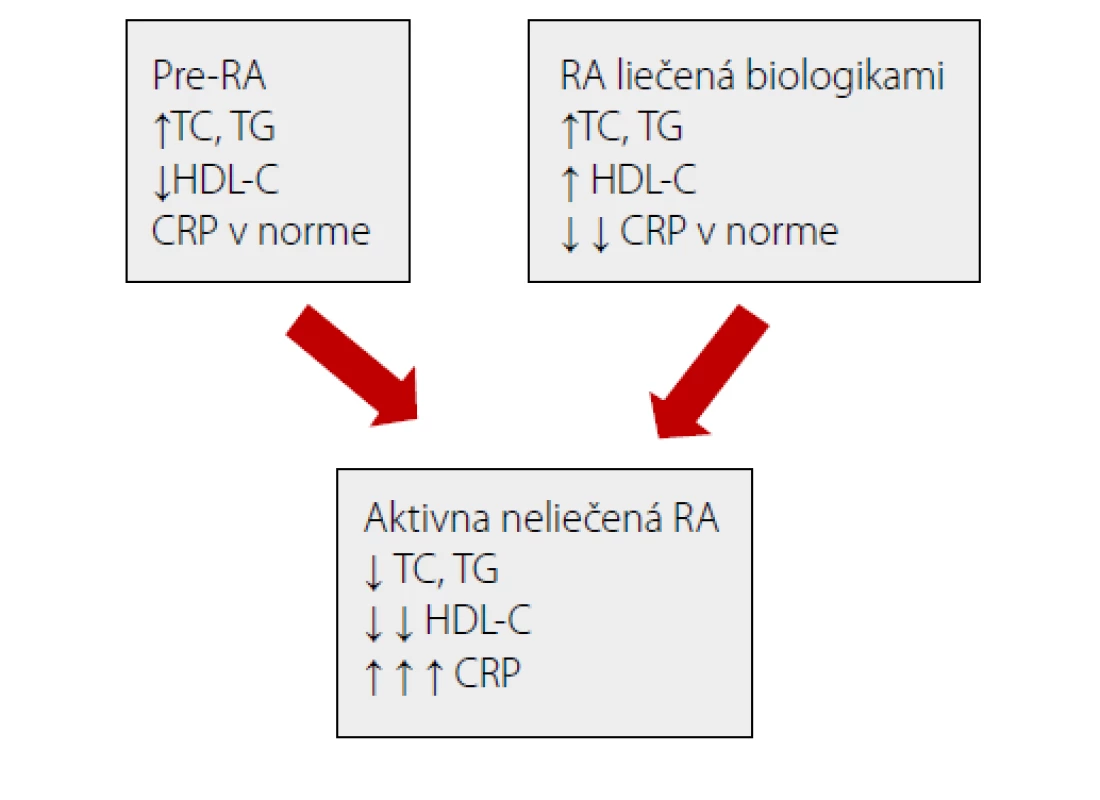
Liečba TNF inhibítormi je asociovaná so vzostupom hladín celkového cholesterolu, triacylglycerolov a HDL-cholesterolu, neovplyvňuje hodnoty LDL-cholesterolu a aterogénny index. V niektorých prácach bolo preukázané zníženie pomeru apolipoproteín B/A (18). Ďalšie štúdie popisujú pri liečbe TNF inhibítormi a csDMARDs (hlavne metotrexátom) zvýšenie jednotlivých lipidových komponentov, aj HDL-cholesterolu a zlepšenie pomeru celkový cholesterol/HDLcholesterol (1).
Po zahájení liečby blokátormi IL-6 receptoru (IL-6Ri) dochádza k poklesu CRP, ale aj k výraznému vzostupu lipidov (celkový cholesterol, HDL, LDL, triacylglyceroly), ktoré dobre reagujú na hypolipidemickú terapiu. Počas sledovania pacientov pomery LDL/HDL a celkový cholesterol/HDL boli stabilné, podobne aj pomer apolipoproteín B/A, ktorý je silným prediktorom KV rizika. Dlhodobé štúdie nepreukázali vyššie KV riziko u pacientov liečených tocilizumabom napriek vyšším hodnotám lipidov. Zatiaľ nie je úplne objasnené, akým mechanizmom blokáda IL-6 zasahuje do lipidového metabolizmu. McInnes a kol. tiež skúmali kvantitatívnu zmenu HDL častice, ktorá spočíva v jej priaznivej, antiinflamatórnej modifikácii pri tejto terapii. Signifikantné zníženie lipoproteínu „a“ ako nezávislého rizikového faktora KV ochorení však bolo preukázané aj po mesačnom trvaní liečby a toto zníženie pretrvávalo počas ďalšieho trvania terapie (19). Úloha týchto zmien v dopade na celkové KV riziko zostáva nejasná. Jednotlivé komponentny lipidového profilu by mali byť hodnotené podľa odporúčaní EULAR (European League Against Rheumatism), ak je choroba stabilná alebo v remisii (1).
Liečba reumatoidnej artritídy u obéznych pacientov
Obezita má priamy efekt na prebiehajúci zápal prostredníctvom produkcie adipokínov a proinflamatórnych cytokínov tukovým tkanivom, vplýva aj na efekt liečby ovplyvňovaním farmakokinetiky biologík. Keďže csDMARDs ako aj bDMARDs signifikantne redukujú KV riziko, je v súčasnosti snaha o voľbu správneho preparátu v prvej línii liečby a určenie tzv. prediktívnych faktorov účinnosti terapie. Podľa dostupných dát je nižšia pravdepodobnosť dosiahnutia remisie u obéznych pacientov pri terapii preparátmi csDMARD a TNFi, kým pri liečbe abataceptom, rituximabom a IL-6Ri sa nepozoroval rozdiel efektu liečby u pacientov podľa BMI. Tento efekt sa vysvetľuje tým, že vyššia telesná hmotnosť je asociovaná so zvýšeným klírens anti-TNF preparátov, čím dosahujú nižšie sérové koncentrácie a kratší polčas lieku. Tento fenomén sa označuje ako „antigenic sink“.
Vplyv biologickej liečby na kardiovaskulárne riziko
Reumatoidná artritída je ochorenie charakterizované vysokým systémovým zápalovým potenciálom, čo vo významnej miere prispieva ku KV riziku. Skríning KV rizika u pacientov s RA je súčasťou manažmentu ochorenia. Môžeme využiť rôzne nástroje (napr. SCORE – systemic coronary risk evaluation, Framingham Risk Score, Reynolds Risk Score, QRISK2 – cardiovascular disease risk score 2), ktoré použitím zadefinovaných rizikových faktorov (napr. vek, pohlavie, fajčenie, krvný tlak, lipidy) hodnotia u daného pacienta 10-ročné riziko KV príhody. Vzhľadom na prídatné riziko u pacientov s RA vyplývajúce hlavne zo systémového zápalu, EULAR odporúča znásobiť tento výsledok (okrem QRISK2) 1,5 krát v prípade prítomnosti dvoch z nasledujúcich rizikových faktorov: trvanie choroby viac ako 10 rokov, pozitivita reumatoidného faktora alebo anticitrulínových protilátok, extraartikulárna manifestácia RA. Odporúča sa v prvom rade používať skórovací systém mSCORE (modified SCORE). Kým mSCORE podhodnocuje, QRISK2 nadhodnocuje KV riziko.
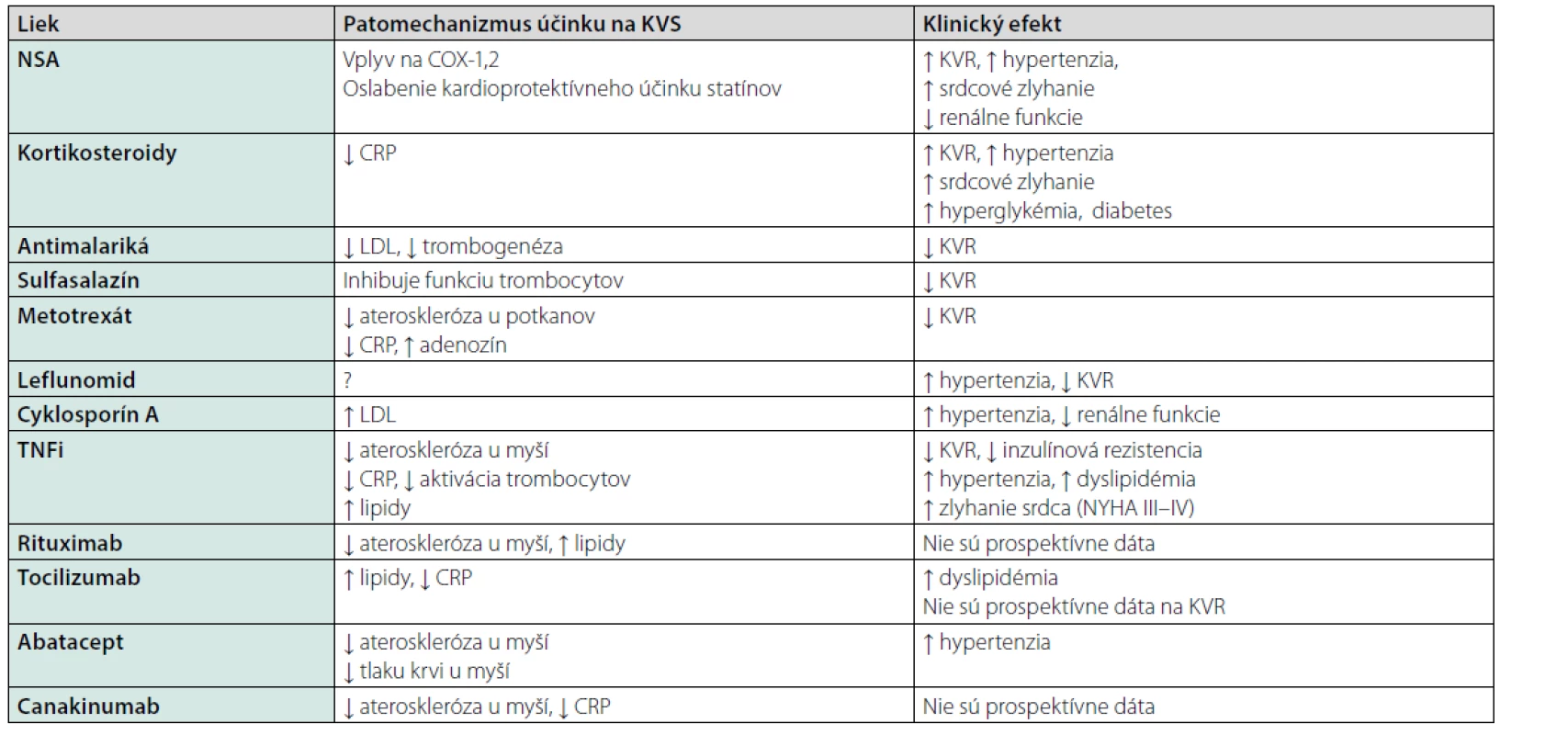
Vzhľadom na vysoké KV riziko pri RA podobné riziku pacientov s diabetom, sa kladie dôraz na jeho agresívny a cielený manažment. Prvoradou úlohou je však dosiahnuť remisiu alebo aspoň nízku aktivitu základného ochorenia. Máme k dispozícii široké portfólio liekov, avšak niektoré z nich sa vyznačujú negatívnym vplyvom na KV aparát. Efekt vybraných liekov a predpokladaný mechanizmus ich účinku na KV systém sa nachádza v tabuľke 5 (20).
Záver
Kardiovaskulárne ochorenia patria medzi najčastejšie komorbidity reumatoidnej artritídy. Závažnosť KV rizika je podobná riziku pacientov s diabetes mellitus 2. typu. Okrem tradičných rizikových faktorov zohráva pri vzniku akcelerovanej aterosklerózy dôležitú úlohu aj systémový zápal. Prozápalové zmeny sú hlavnou príčinou aj inzulínovej rezistencie a dyslipidémie. Paradoxná obezita (reumatoidná kachexia) a lipidový paradox sú špecifiká RA, ktoré sťažujú odhadnutie KV rizika. Dôsledný skríning, identifikácia rizikových faktorov, dosiahnutie remisie či nízkej aktivity základného ochorenia a správny multidisciplinárny manažment môže prispieť k zníženiu morbidity a mortality na KV komplikácie u pacientov s reumatoidnou artritídou.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Emőke Šteňová, PhD.
I. interná klinika LFUK a UN, Nemocnica Staré Mesto
Mickiewiczova 13, 813 69 Bratislava, Slovenská republika
Článek přijat redakcí: 13. 5. 2020
Článek přijat po recenzích k publikaci: 26. 1. 2021
Sources
1. Agca R, Heslinga SC, Rollefstad S, et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016 update. Annals of the Rheumatic Diseases 2017; 76(1): 17–28. Dostupné z DOI: http://dx.doi.org/10.1136/annrheumdis-2016-209775.
2. Dougados M, Soubrier M, Antunez A, et al. Prevalence of comorbidities in rheumatoid arthritis and evaluation of their monitoring: results of an international, cross-sectional study (COMORA). Annals of the Rheumatic Diseases 2014;73(1): 62-68. Dostupné z DOI: https:// 10.1136/annrheumdis-2013-204223.
3. Houge, Ingrid Sæther, et al. Mortality is increased in patients with rheumatoid arthritis or diabetes compared to the general population–the Nord-Trøndelag Health Study. Scientific reports, 2020; 10(1): 1–10. Dostupné z DOI: https://doi.org/10.1038/s41598 - 020-60621-2.
4. Kerekes, György, et al. Rheumatoid arthritis and metabolic syndrome. Nature Reviews Rheumatology, 2014; 10(11): 691. Dostupné z DOI: https://doi:10.1038/nrrheum. 2014.121.
5. Van Der Helm-Van Mil, A H M, et al. A high body mass index has a protective effect on the amount of joint destruction in small joints in early rheumatoid arthritis. Annals of the rheumatic diseases, 2008; 67(6): 769–774. Dostupné z DOI: https://doi:10.1136/ard.2007.078832.
6. MacDonald, Iona J, et al. Associations between adipokines in arthritic disease and implications for obesity. International journal of molecular sciences, 2019; 20(6): 1505. Dostupné z DOI: https://doi:10.3390/ijms20061505.
7. Dessein, Patrick H, et al. Rheumatoid arthritis impacts on the independent relationships between circulating adiponectin concentrations and cardiovascular metabolic risk. Mediators of inflammation, 2013, 2013. Dostupné z DOI: https://doi:10.1155/2013/461849.
8. Lago, Francisca, et al. The emerging role of adipokines as mediators of inflammation and immune responses. Cytokine & growth factor reviews, 2007; 18(3–4): 313–325. Dostupné z DOI: https://doi:10.1016/j.cytogfr.2007.04.007.
9. Francisco Vera, et al. Adipokines: Linking metabolic syndrome, the immune system, and arthritic diseases. Biochemical pharmacology, 2019. Dostupné z DOI: https://doi.org/ 10.1016/j.bcp.2019.03.030.
10. Olama, Shereen M; Senna, Mohammed K; Elarman Mohammed. Synovial/serum leptin ratio in rheumatoid arthritis: the association with activity and erosion. Rheumatology International, 2012; 32(3): 683–690. Dostupné z DOI: https://doi.org/10.1007/s00296-010-1698-5.
11. Tanti, Jean-François, et al. Implication of inflammatory signaling pathways in obesity - -induced insulin resistance. Frontiers in endocrinology, 2013; 3 : 181. Dostupné z DOI: https:// doi.org/10.3389/fendo.2012.00181.
12. Oravec S. Hyperlipoproteinémie, úvod do problematiky porúch metabolizmu lipoproteínov. Univerzita Komenského v Bratislave: 2012 : 47–50. ISBN 978-80-223-3290-3.
13. Charles-Schoeman, Christina, et al. Abnormal function of high – density lipoprotein is associated with poor disease control and an altered protein cargo in rheumatoid arthritis. Arthritis & Rheumatism: Official Journal of the American College of Rheumatology, 2009; 60(10): 2870–2879. Dostupné z DOI: https://doi.org/10.1002/art.24802.
14. Ruscitti, Piero, et al. Anti-interleukin-1 treatment in patients with rheumatoid arthritis and type 2 diabetes (TRACK): A multicentre, open-label, randomised controlled trial. PLoS medicine, 2019, 16(9). Dostupné z DOI: https://doi:10.1371/journal.pmed.1002901.
15. Everett, Brendan M, et al. Anti-inflammatory therapy with canakinumab for the prevention and management of diabetes. Journal of the American College of Cardiology, 2018; 71(21): 2392–2401. CANTOS. Dostupné z DOI: https://doi:10.1016/j.jacc.2018.03.002.
16. Genovese, Mark C, et al. Sarilumab plus methotrexate in patients with active rheumatoid arthritis and inadequate response to methotrexate: results of a phase III study. Arthritis & Rheumatology, 2015; 67(6): 1424–1437. Dostupné z DOI: https://doi.org/10.1002/ art.39093.
17. Choy E, Sattar N. Interpreting lipid levels in the context of high-grade inflammatory states with a focus on rheumatoid arthritis: a challenge to conventional cardiovascular risk actions. Annals of the rheumatic diseases, 2009; 68(4): 460–469. Dostupné z DOI: http:// dx.doi.org/10.1136/ard.2008.101964.
18. Daïen, Claire Immediato, et al. Effect of TNF inhibitors on lipid profile in rheumatoid arthritis: a systematic review with meta-analysis. Annals of the rheumatic diseases, 2012; 71(6): 862–868. Dostupné z DOI: http://dx.doi.org/10.1136/annrheumdis - 2011-201148.
19. Schultz O, et al. Effects of inhibition of interleukin-6 signalling on insulin sensitivity and lipoprotein (a) levels in human subjects with rheumatoid diseases. PloS one, 2010; 5(12). Dostupné z DOI: https://doi:10.1371/journal.pone.0014328.
20. Szekanecz Z, et al. Autoimmune atherosclerosis in 3D: how it develops, how to diagnose and what to do. Autoimmunity reviews, 2016; 15(7): 756–769. Dostupné z DOI: https:// doi.org/10.1016/j.autrev.2016.03.014.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2021 Issue E-2
-
All articles in this issue
- Serum butyrylcholinesterase/HDL-cholesterol ratio and atherogenic index of plasma in patients with fatty liver disease
- Comparison of LDL-C calculation by Martin, Sampson and old Friedewald methods in real data and synthetic data set
- Rheumatoid arthritis and metabolic disorders
- Non-pharmacological treatment of gout
- Application of surgical mask with high-flow nasal cannula (HFNC) leads to improved oxygenation in patients with COVID-19: a set of case reports
- Primary pneumococcal peritonitis with a fulminant course
- Screening for risk alcohol use in clinical settings
- RECENZE MONOGRAFIE SRDEČNÍ SELHÁNÍ
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Non-pharmacological treatment of gout
- Serum butyrylcholinesterase/HDL-cholesterol ratio and atherogenic index of plasma in patients with fatty liver disease
- Screening for risk alcohol use in clinical settings
- Rheumatoid arthritis and metabolic disorders
