Úskalí diagnostiky autoimunitní pankreatitidy
Pitfalls of diagnosing autoimmune pancreatitis
The diagnosis of the rare disease autoimmune pancreatitis (AIP) is demonstrated in the case of a patient who underwent a series of examinations that were unable to unequivocally prove the diagnosis of benignity. The disease as a form of chronic pancreatitis, and the most important and first objective of the examination is to exclude malignant disease of the pancreas and biliary tract. While imaging led to suspicion of malignancy, repeated histological examinations did not confirm it. After we were able to exclude suspected carcinoma according to the available diagnostic criteria, AIP was confirmed, and a diagnosis of type I was made, which belongs to the group of diseases characterized by high levels of immunoglobulin G4 (IgG4) in the blood serum. Successful treatment with glucocorticoids was initiated with induction of disease remission. However, AIP shows frequent relapses and this should also be borne in mind during treatment. Our case report also describes such a case.
Keywords:
Pancreatic cancer – autoimmune pancreatitis – IgG4 – obstructive icterus – choledochal stenosis
Authors:
Denisa Frajerová
Authors‘ workplace:
II. interní oddělení – Gastroenterologie, Krajská zdravotní, a. s., Nemocnice Teplice, o. z.
Published in:
Vnitř Lék 2021; 67(E-7): 24-27
Category:
Case reports
Overview
Diagnostika vzácného onemocnění autoimunitní pankreatitidou (AIP) je demonstrována na případu pacienta, který prošel řadou vyšetření, jež nebyla schopna diagnózu benigního charakteru jednoznačně prokázat. Nemoc je forma chronické pankreatitidy, přičemž nejdůležitějším a prvním cílem vyšetření je vyloučení maligního onemocnění slinivky a žlučových cest. Zatímco zobrazovací metody vedly k podezření na malignitu, opakovaná histologická vyšetření ji nepotvrzovala. Poté, co jsme podle dostupných diagnostických kritérií mohli podezření na karcinom vyloučit, bylo onemocnění AIP potvrzeno, stanovena diagnóza typu I, který patří do skupiny chorob s vysokou hladinou imunoglobulinu G4 (IgG4) v krevním séru. Byla zahájena úspěšná léčba glukokortikoidy s navozením remise onemocnění. AIP však vykazuje časté relapsy a rovněž na to je při léčbě třeba myslet. Naše kazuistika takový případ rovněž popisuje.
Klíčová slova:
karcinom pankreatu – autoimunitní pankreatitida – IgG4 – obstrukční ikterus – stenóza choledochu
Úvod
Na konkrétním případu pacienta s autoimunitní pankreatitidou (AIP) demonstrujeme úskalí diagnostiky relativně vzácného onemocnění slinivky břišní. V článku poukazujeme na složitost vyšetřovacích postupů ambulantních či nemocničních lékařů, kdy ani často opakované endoskopické a sérologické vyšetření, ani zobrazovací metody nevedou k jednoznačné diagnóze. Přitom zásadním úkolem je právě včasné vyloučení karcinomu pankreatu, u něhož se průměrné pětileté přežití pohybuje jen mezi 2–5 %. Infaustní prognóza je často mimo jiné i důsledkem pozdního rozpoznání tohoto onemocnění, které stále patří mezi nejobávanější onkologické diagnózy, a je tudíž naléhavým problémem onkologie i gastroenterologie. Autoimunitní pankreatitida (AIP) je vzácnou formou chronické pankreatitidy. Široce užívanými diagnostickými kritérii je v západních zemích systém HISORt (Histology, Imaging, Serology, Other organ involvement, and Response to steroid therapy). Konsenzus kombinuje japonsko‑korejská diagnostická kritéria, která jsou navržena k celosvětovému užití. Jde o 5 kritérií zahrnujících:
zobrazení pankreatu a pankreatického vývodu,
sérologii,
současné postižení jiných orgánů,
histologii,
odpověď na kortikoidní terapii (1).
Existují dva typy AIP (I a II), které kromě jiných znaků odlišujeme rozličnou hladinou IgG4, věkem pacientů, možným postižením dalších orgánů a koexistujícím IBD (Inflammatory Bowel Disease) onemocněním. Typ I patří do skupiny chorob, pro které je charakteristická vysoká hladina imunoglobulinu G4 v krevním séru. Tuto skupinu chorob označujeme jako IgG4 asociovaná onemocnění (IgG4-RD, IgG4-releated disease), přičemž AIP prvního typu je nejčastěji se vyskytující nemocí z této skupiny (1, 2). Jasné odlišení však poskytuje pouze histologie. Pouze u typu II jsou totiž přítomné GEL substance (granulocytární epitelové léze), které u typu I chybí (forma GEL negativní) (1, 3).
Zobrazovací metody při AIP umožňují dělit postižení pankreatu na difuzní a fokální (ložiskový) typ. Zvláště důležitá je diferenciální diagnostika u fokálního typu, kde je nesnadné odlišit AIP od karcinomu hlavy pankreatu (3, 4).
O prevalenci AIP máme poměrně málo studií s rozdílnými daty a rozdílnými diagnostickými kritérii (1). Na základě japonských studií z roku 2005 byla odhadována 0,82 na 100 000 osob, ale r. 2016 byla rovněž podle japonského zdroje (3) stanovena prevalence 10,1 na 100 000 obyvatel. Podle české studie v regionu jižní Moravy (4) tvoří AIP 4–6 % všech idiopatických chronických pankreatitid. AIP typu 1 má výrazně vyšší prevalenci než typ 2, přičemž nemoc častěji postihuje starší muže, podle (2) obvykle v pátém až sedmém deceniu, podle (1) v průměrném věku 66 let.
Popis případu
Na našem gastroenterologickém pracovišti jsme řešili případ devětapadesátiletého pacienta, u něhož klinické obtíže, laboratorní výsledky i zobrazovací metody poukazovaly na možnost nádorového onemocnění žlučových cest, případně pankreatu. Teprve po dalších vyšetřeních v horizontu několika měsíců jsme mu diagnostikovali AIP.
Pacient k nám byl odeslán praktickým lékařem pro vyšší jaterní testy (bilirubin 21,4, GGT 2,41, ALP 2,20, ALT 1,93, AST 1,04) v květnu 2012. V anamnéze měl dále arteriální hypertenzi a hyperlipidemii. Ultrasonografie (USG) břicha neprokázala patologické poměry. Pacient byl subjektivně bez obtíží, bez výrazné nadváhy, abúzus alkoholu popíral.
Cestou gastroenterologické poradny proběhla diferenciální diagnostika hepatopatie, přičemž kompletní imunologický panel neprokázal infekční či jinou metabolickou etiologii. Rovněž IgG4 v té době bylo v mezích normy.
Bylo doporučeno dodržovat dietní opatření, zvýšit fyzickou aktivitu a užívat hepatoprotektiva.
Při další kontrole byl pacient zcela bez obtíží, jaterní testy se postupně normalizovaly. Z provedených vyšetření bylo onemocnění uzavřeno jako hepatopatie při prosté steatóze (NAFLD‑Non Alcoholic Fatty Liver Disease) se zlepšením po úpravě životosprávy.
O pravidelných kontrolách v šestiměsíčních intervalech byl pacient beze změn a bez obtíží až do roku 2015.
Toho roku koncem prosince byl pacient na doporučení praktického lékaře hospitalizován na interním oddělení pro bolesti v epigastriu. Obtíže neměl a v mezidobí se lehce snížila hmotnost.
USG břicha zobrazilo rozšířený ductus hepatocholedochus s lehce nápadnými intrahepatickými žlučovými cestami, pankreatický vývod nedilatován. To spolu s laboratorním vyšetřením ukazovalo na obstrukční ikterus.
Na základě těchto vyšetření byla pacientovi indikována endoskopická retrográdní cholangiopankreatografie (ERCP), při ní mu byla diagnostikována stenóza střední části choledochu v délce 20 mm. Byla provedena papilotomie a k zajištění drenáže žlučových cest zaveden plastikový stent. Brush cytologie ze stenózy v tuto dobu provedena nebyla.
Pro nejasnou etiologii stenózy bylo provedeno CT břicha bez průkazu ložiskových změn svědčících pro neoplazii, rovněž hodnoty tumor markerů CEA, CA 19–9 byly v normě.
Vzhledem k ústupu ikteru, poklesu jaterních testů a dobrému klinickému stavu byl pacient propuštěn do ambulantní péče a zůstal nadále v dispenzarizaci gastroenterologické poradny.
Při kontrole v lednu 2016 přetrvávala v jaterních testech cholestáza. Byla nasazena kyselina ursodeoxycholová v tabletách v celkové dávce 750 mg denně.
Koncem ledna 2016 byl pacient akutně hospitalizován pro dyspeptické obtíže (nauzea, abdominalgie, subfebrilie). Kontrolní ERCP prokázalo dysfunkci stentu. Obturovaný stent byl proto extrahován a zavedeny dva nové plastikové stenty. Krátce poté jsme doplnili CT břicha, které potvrdilo správné uložení zavedených stentů ve žlučových cestách, obraz pankreatu bez tumorózních změn, ale nově byla zjištěna lymfadenopatie v hilu jater.
Vzhledem ke stále přítomné a neměnící se stenóze choledochu (zatím stále nejasné etiologie) byla provedena endoskopická ultrasonografie (EUS) horní části trávicího traktu. V nálezu dominovalo hypoechogenní ložisko v oblasti těla pankreatu (velikosti 1 x 1 cm, ostatní tkáň slinivky byla homogenní), infiltrace žlučovodu a mnohočetná lymfadenopatie podjaterní krajiny a okolí žlučovodu. Byla provedena biopsie FNAB (Fine Needle Aspiration Biopsy) uzliny a z infiltrace žlučovodu. Výše uvedená vyšetření vedla k podezření na tumor distálního choledochu a v diferenciální diagnóze se poprvé objevila možnost autoimunitní cholangiopatie. Histologie však vyšla bez průkazů nádorových struktur (mj. 15 krevnatých nátěrů s heterogenní lymfoidní populací, sliznice žlučovodu s hojnými rozpadajícími se polynukleáry v terénu tyčinkových a kokovitých bakteriálních kolonií).
Pacient byl dále objednán k MRCP (Magnetic Resonance Cholangio Pancreatography) a cholangioskopie SpyGlass (Role single‑operator cholangiskopie) v IKEM, k čemuž v tuto dobu nedošlo pro rozvoj cholangitidy s nutností pacienta v březnu 2016 znovu hospitalizovat na gastroenterologii. Během této hospitalizace byl pacient odeslán k cholangioskopii SpyGlass v IKEM, kde mu byly vyměněny plastikové stenty za jeden metalický biliární. Odebrána biopsie ze stenózy, histologie popsala sliznici žlučovodu s morfologií zánětlivých změn, dysplastické změny ani nádorové struktury nebyly nalezeny.
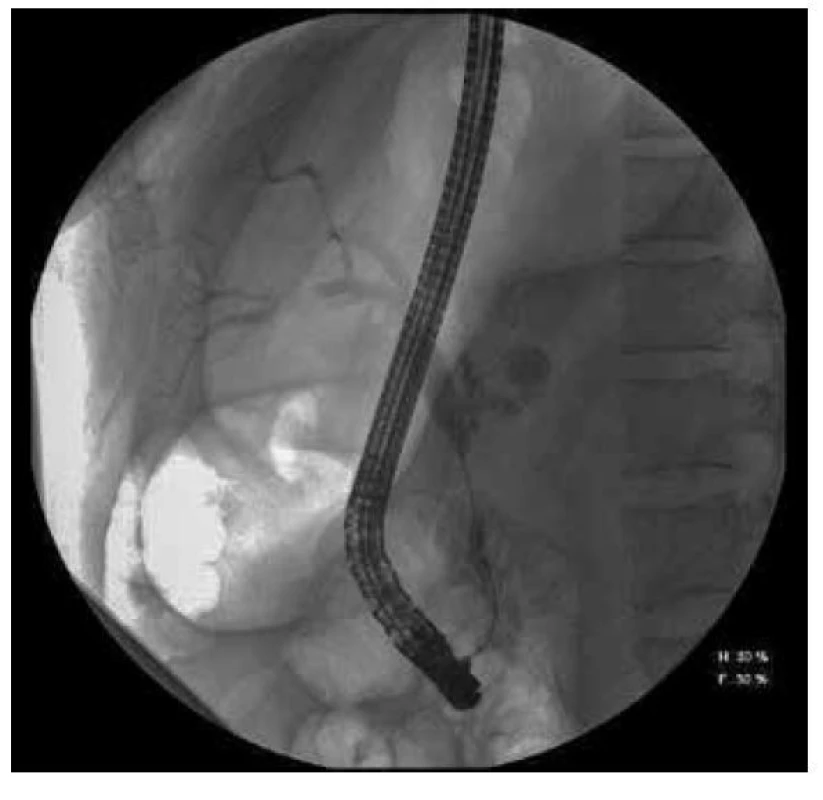
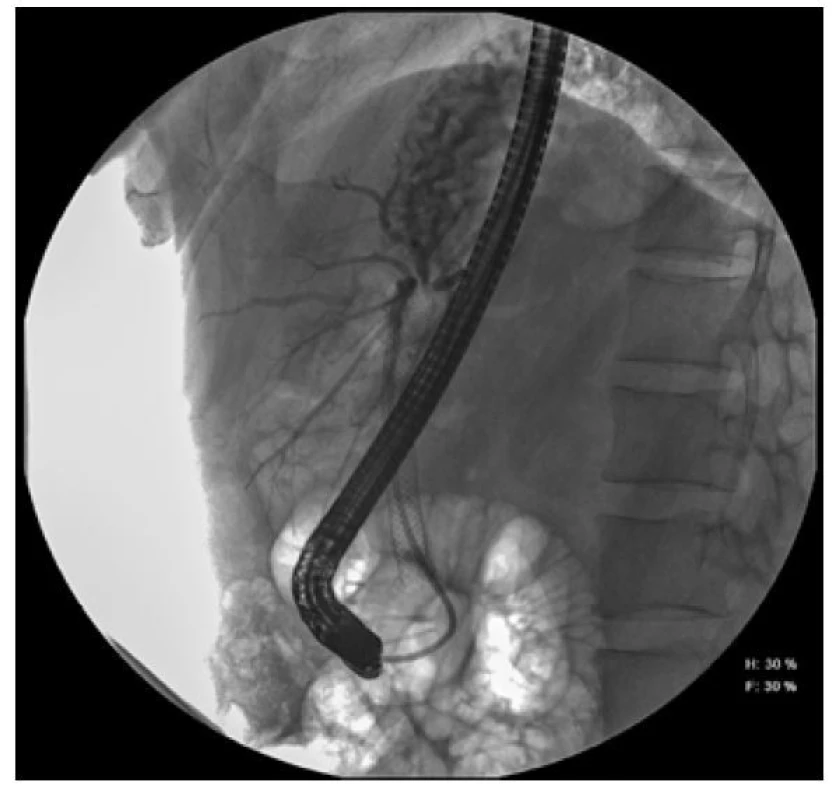
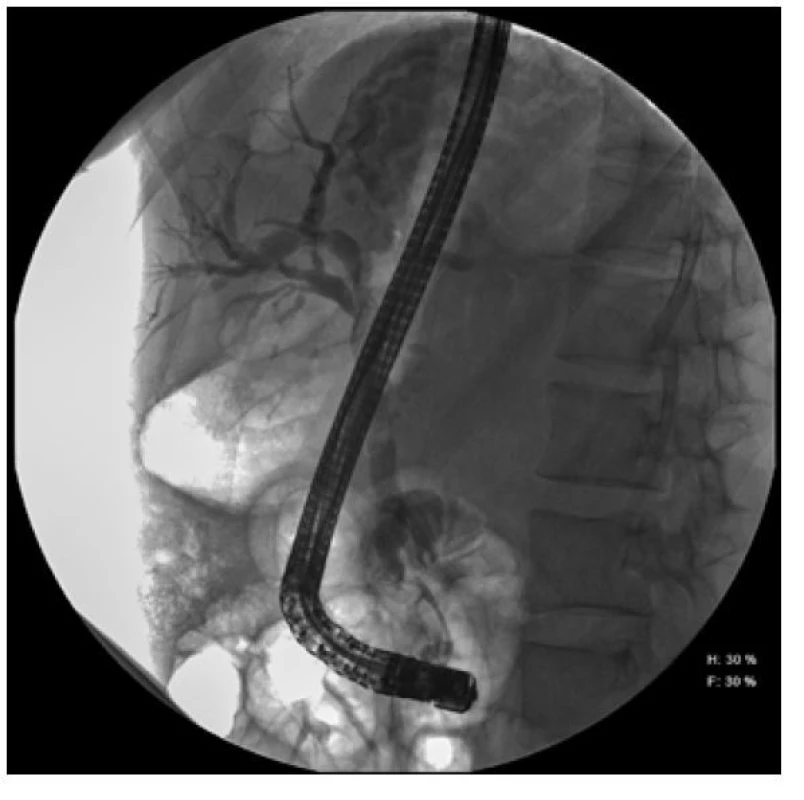
Na našem pracovišti bylo v dubnu 2016 znovu plánovaně provedeno vyšetření ERCP, které prokázalo migraci metalického stentu, a proto byl extrahován. Stenóza choledochu patrna nebyla. Z biopsie byl opět popsán chronický středně aktivní zánět a známky malignity opět nebyly prokázány. Nicméně po dalším vyšetření EUS pankreatu se stacionárním ložiskem těla slinivky a novým ložiskem v podjaterní krajině 2 x 3 cm přetrvávala suspekce na tumor podjaterní krajiny vycházející ze žlučovodu.
V květnu 2016 byl pacient odeslán k vyšetření PET CT (pozitronová emisní tomografie) trupu do Nemocnice Na Homolce. Zde vyšetření PET CT popsalo lymfadenopatii pod jaterním hilem, kolem choledochu a v okolí hlavy pankreatu s mírně zvýšeným metabolismem glukózy. I nadále přetrvávala suspekce na neoplazii. Možné maligní ložisko se jevilo i na okraji hlavy pankreatu a v kaudě.
Konziliární onkologické vyšetření zhodnotilo nález jako benigní s tím, že pokud by se mělo jednat o maligní onemocnění v oblasti pankreatu nebo žlučových cest, nezůstal by nález po dobu více než 3 měsíců vyšetřování bez progrese. Navíc dle ERCP došlo po zavedení metalického stentu k regresi stenózy.
Přesto nadále nebylo jednoznačně vyloučeno podezření na neoplazii, a proto byla znovu zopakována EUS s cílenou punkcí. Ani z této punkce jak ze žlučových cest, tak z uzliny v jaterním hilu nebylo nádorové bujení prokázáno. Vzhledem k délce vyšetřování, kdy se pacient opakovaně vracel do naší péče, zobrazovací metody nejevily výraznou progresi a rovněž tumor markery byly v normě bez vzestupné dynamiky, bylo podezření na malignitu definitivně vyvráceno.
Protože kontrolní imunologie na našem pracovišti v květnu 2016 poprvé prokázala zvýšenou hladinu IgG4, bylo možno podle výše zmíněných diagnostických kritérií nálezy přehodnotit a teprve nyní stanovit diagnózu AIP. Ta byla podle stejných kritérií potvrzena odpovědí na zavedenou léčbou glukokortikoidy v doporučeném dávkování, tedy 40 mg prednisonu na 4 týdny s následným postupným snižováním o 5 mg týdně.
Po několika týdnech léčby došlo k normalizaci jaterních testů a USG popsalo postupně i úplné vymizení stenózy choledochu a ložiska v oblasti pankreatu. Tím mohla být definitivně potvrzena diagnóza AIP, a to I. typu.
Vyplývá to z několika aspektů. Tento typ postihuje zpravidla starší muže (průměr 66 let) na rozdíl od druhého typu, který zasahuje populaci zhruba o desetiletí mladší. Významným faktorem odlišujícím první typ od druhého jsou zvýšené hodnoty IgG4, což se v našem případu prokázalo. Dalším potvrzením byl obstrukční ikterus a výrazný břišní dyskomfort, s nímž byl pacient přijat na naše pracoviště. Pacient neměl žádné koexistující onemocnění typu IBD onemocnění, která jsou naopak příznačná pro typ II.
Vzhledem k tomu, že léčba kosteroidy byla v našem případě úspěšná, nebylo nutno přistoupit k dalším terapeutickým možnostem, například indikovat terapii imunosupresivy, nebo dokonce biologickou léčbu (1), či přistoupit k chirurgické intervenci (14).
Diskuze
Světový vývoj k rozpoznání tohoto poměrně vzácného onemocnění se vyvíjel řadu desetiletí a potvrzoval nesnadnost stanovení této diagnózy.
První případ s příznaky zmíněného onemocnění (AIP) popsal roku 1961 Sarles (7), ale nestanovil ještě chorobu jako etiologickou jednotku. Diagnostická kritéria prošla delším vývojem v druhé polovině 20. století a zejména od 80.–90. let jim byla věnována větší pozornost v Japonsku, kde Yoshida 1995 navrhl klinická a morfologická kritéra (8), Japan Pancreas Society jako první na světě 2002 navrhla diagnostická kritéria a ta byla revidována roku 2006 (9). Kamisawa v r. 2003 stanovil pojmenování IgG4-related sclerosing autoimmune disease jako klinickopatologickou entitu ve spojení s jinými autoimunitními chorobami (10) a v r. 2008 při stanovení diagnostických kritérií zároveň upozornil na důležitost přednostní diferenciace od karcinomu pankreatu (9). Novější diagnostický konsenzus je pozdější, např. (3).
Histologicky se rozlišují dva typy AIP. Typ I známý jako lymfoplazmatická sklerotizující pankreatitida (LPSP), u které je typické postižení i dalších orgánů. Je považována za součást systémového IgG4 onemocnění. Typ II (IDCP – idiopatická duktocentrická pankreatitida) bývá diagnostikován současně s koexistujícím idiopatickým střevním zánětem (IBD). V tomto případě obvykle chybí zvýšené sérové hladiny IgG4 v séru oproti zmíněnému typu I. Typ I může být diagnostikován bez biopsie, typ II téměř vždy biopsii vyžaduje (1, 11).
Charakteristickými znaky typu I jsou vysoká hladina IgG4 v krevním séru (vyšší než dvojnásobek normy), masivní infiltrace žlázy plazmatickými buňkami s pozitivitou IgG4 a s fibrózou. Tento typ onemocnění je velmi často spojen s tzv. extrapankreatickými lézemi, není však spojen s přítomností ulcerózní kolitidy, která je typická u typu II. Postižená slinivka břišní je obvykle zvětšená. Téměř ve všech případech jsou u tohoto typu pozorovány vedle fibrózy periduktální či lobulární zánět, obliterativní flebitida. Vyskytuje se častěji u mužů než u žen v poměru 2 : 1, nejčastěji ve věku 50–60 let. Je provázen břišním dyskomfortem. Recidiva nastává u 30–50 % pacientů (12).
Typ II je méně častý než typ I a postihuje mladší pacienty, obvykle ve věku 40–50 let. Charakteristickými znaky jsou podstatně nižší počet IgG4 pozitivních plazmatických buněk, přítomnost tzv. GEL (granulocytární epiteliální léze) substance a nález periacinárních eozinofilních infiltrátů, koexistující IBD onemocnění (15–30 %), zejména Crohnova choroba a proktolitida. U tohoto typu jsou recidivy vzácné (12, 13).
Chronické pankreatitidy, mezi něž patří případy AIP, jsou onemocnění, jejichž incidence dlouhodobě vzrůstá, což podle (14) zřejmě souvisí se způsobem života v průmyslově vyspělých společnostech. Zároveň se ale zpřesňuje diagnostika, jejímž problémem ale stále zůstává její včasnost.
Závěr
Co ukázala kazuistika tohoto případu? Aniž bylo zanedbáno jakékoli potřebné vyšetření podle světově uznávaného konsenzu diagnostického systému HISORt a toto dokonce v průběhu času několikrát opakováno a ověřováno na různých pracovištích bez zbytečných odkladů a průtahů, trvalo poměrně dlouho, než mohlo být podezření na karcinom vyloučeno a mohlo se dospět k diagnóze AIP.
Jak bylo zmíněno, u části pacientů AIP dochází k relapsu. Procento výskytu se udává v obdobném rozmezí – 26–70 % po ukončení indukční léčby (2). To se bohužel potvrdilo i v popisovaném případu, který byl nadále sledován v naší gastroenterologické poradně. K relapsu AIP u konkrétního pacienta došlo poměrně pozdě – až po období cca 5 let. V době zpracování této kazuistiky byl pacient opět přijat do našeho zařízení pro ikterus a stenózu choledochu. Po několikaletém období se obstrukční žloutenka objevila znovu, čímž se případ stal znovu aktuálním. Naším dalším postupem bude znovuzahájení léčby prednisonem s doporučením vyšší než původní dávky a prodloužením léčby, čímž lze podle dostupných zdrojů dosáhnout remise až u 95 % pacientů (2, 15). Vzhledem k relativní vzácnosti výskytu onemocnění je jasné, že určení správné diagnózy podle světově uznávaných kritérií není krátkodobá záležitost, jak tento nesnadný případ dobře dokumentuje.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Denisa Frajerová
II. interní oddělení – Gastroenterologie, Krajská zdravotní, a. s., Nemocnice Teplice, o. z. Duchcovská 53, 415 29 Teplice
Cit. zkr: Vnitř Lék 2021; 67(7): E24–E27
Článek přijat redakcí: 30. 6. 2021
Článek přijat po recenzích: 29. 9. 2021
Sources
1. Blaho M, Dítě P, Kunovský L, Kianička B. Autoimmune pancreatitis – An ongoing challenge. Adv Med Sci 2020; 65(2): 403–408.
2. Mačinga P, Jarošová j, Špičák J a Hucl T. Imonoglobulin G4 asociované onemocnění v gastroenterologii. Vnitř Lék 2021; 67(2): 76–83.
3. Dítě P. Novotný I, Kianička B et al. Autoimunitní pankreatitida – diagnostický konsenzus. Vnitř Lék 2015; 61(2): 114–118.
4. Kunovský L, Dítě P, Blaho M, Dvořáčková J et al. Is autoimmune pancreatitis a risk factor for pancreatic adenocarcinoma? Vnitř Lék 2021; 67(1): e9–e13.
5. Masamune A, Kikuta K, Hamada S et al. Nationwide epidemiological survey of autoimmune pancreatitis in Japan in 2016. J Gastroenterol. 2020; 55(4): 462–470.
6. Dítě P, Ševčíková A et al. Automunitní pankreatitida v České republice – region jižní Morava. Čes a Slov Gastroent a Hepatol 2007; 61(2): 82–85.
7. Sarles H, Sarles J ‑ C et al. Chronic inflammatory sclerosis of the pancreas: an autonomous pancreatic disease? Am J Dig Dis 1961 Jul; 6 : 688–698.
8. Yoshida K, Toki F, Takeuchi T et al. Chronic pancreatitis caused by an autoimmune abnormality. Proposal of the concept of autoimmune pancreatitis. Dig Dis Sci 1995; 40(7): 1561–1568.
9. Kamisawa T, Okazaki K, Kawa S. Diagnostic criteria for autoimmune pancreatitis in Japan. World J Gastroenterol 2008; 14(32): 4992–4994.
10. Kamisawa T, Funata N, Hayashi Y et al. A new clinicopathological entity of IgG4-related autoimmune disease. J Gastroenterol 2003; 38(10): 982–984.
11. Novotný I, Dítě P, Lata J et al. Autoimmune pancreatitis – recent advances Dig Dis (Basel) 2010; 28(2): 334–338.
12. Feldman M et al. Sleisenger and Fortran’s Gastrointestinal and Liver Disease. Vol. 1. 10th Edition, 2016 : 1001.
13. Kupka T, Novotný I, Kunovský L et al. Idiopatický střevní zánět a 1. typ autoimunitní formy pankreatitidy: kazuistika. Vnitř Lék 2019; 65(7–8): 520–523.
14. Kunovský L, Dítě P, Bojková M et al. Diagnostika a terapie chronické pankreatitidy dle UEG guidelines. Vnitř Lék 2021; 67(2): 85–91.
15. Löhr J‑M, Beuers U, Vujasinovic M et al. European Guideline on IgG4-related digestive disease – UEG and SGF evidence‑based recommendations. United European Gastroenterology Journal 2020; 8(6): 637–666.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2021 Issue E-7
-
All articles in this issue
- Monitoring and analysis of fall risk factors in hospitalized patients
- Recommendations for safe collection of venous blood by a closed collection system
- Amanita phalloides intoxication: mechanism of toxicity, clinical manifestations and therapeutic approaches
- Amiodarone induced pulmonary toxicity
- Pitfalls of diagnosing autoimmune pancreatitis
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Amanita phalloides intoxication: mechanism of toxicity, clinical manifestations and therapeutic approaches
- Amiodarone induced pulmonary toxicity
- Recommendations for safe collection of venous blood by a closed collection system
- Pitfalls of diagnosing autoimmune pancreatitis
