Expertní stanovisko ke spolupráci diabetologů a internistů s nefrology v péči o nemocné s chronickým onemocněním ledvin
Expert opinion on the cooperation of diabetologists and internists with nephrologists in the care of patients with chronic kidney diseases
Chronic kidney disease (CKD) affects 10% of the population of developed countries and significantly affects the population health. In addition to the well-known renoprotection tools slowing down the progression of CKD, SGLT2 inhibitors have been newly introduced into clinical practice based on the results of extensive studies, both in diabetics and non-diabetics. This expert opinion discusses the classification of CKD, current renoprotection options, and the recent role of SGLT2 inhibitors in the care of patients with CKD.
Keywords:
SGLT2 inhibitors – gliflozins – chronic kidney disease – CKD progression – renoprotection
Authors:
Ondřej Viklický 1; Romana Ryšavá 2; Vladimír Tesař 2; Ivan Rychlík 3; Martin Prázný 4; Richard Češka 4; Martin Haluzík 5
Authors‘ workplace:
Klinika nefrologie, Transplantační centrum, IKEM, Praha
1; Klinika nefrologie, VFN a 1. LF UK, Praha
2; Interní klinika FNKV a 3. LF UK, Praha
3; III. interní klinika VFN a 1. LF UK, Praha
4; Centrum diabetologie, IKEM, Praha
5
Published in:
Vnitř Lék 2022; 68(7): 426-431
Category:
Main Topic
doi:
https://doi.org/10.36290/vnl.2022.090
Overview
Chronické onemocnění ledvin (CKD) postihuje 10 % populace vyspělých zemí a významným způsobem ovlivňuje zdravotní stav populace. Vedle známých nástrojů renoprotekce zpomalujících progresi CKD se do klinické praxe na základě výsledků rozsáhlých studií nově zavedly SGLT2 inhibitory, a to jak pro diabetiky, tak i pro nediabetiky. Tento materiál diskutuje klasifikaci CKD, současné možnosti renoprotekce a recentní roli SGLT2 inhibitorů v péči o nemocné s CKD.
Klíčová slova:
chronické onemocnění ledvin – glifloziny – SGLT2 inhibitory – progrese CKD – renoprotekce
Úvod
Chronické onemocnění ledvin (CKD, chronic kidney disease) představuje ve vyspělých zemích významný medicínský a socioekonomický problém. Důvodem je vysoký výskyt CKD v populaci, významný podíl CKD na zvýšení kardiovaskulárního rizika a rizika vzniku závažných komplikací u ostatních onemocnění, významné ekonomické náklady spojené s léčbou konečných stadií CKD včetně hospitalizační péče a v neposlední řadě podstatně zhoršená kvalita života nemocných s pokročilými stadii CKD.
Definice chronického onemocnění ledvin
CKD je definováno jako poškození struktury či funkce ledvin, které trvá 3 měsíce či déle, a má dopady na zdravotní stav (Tab. 1) (1).
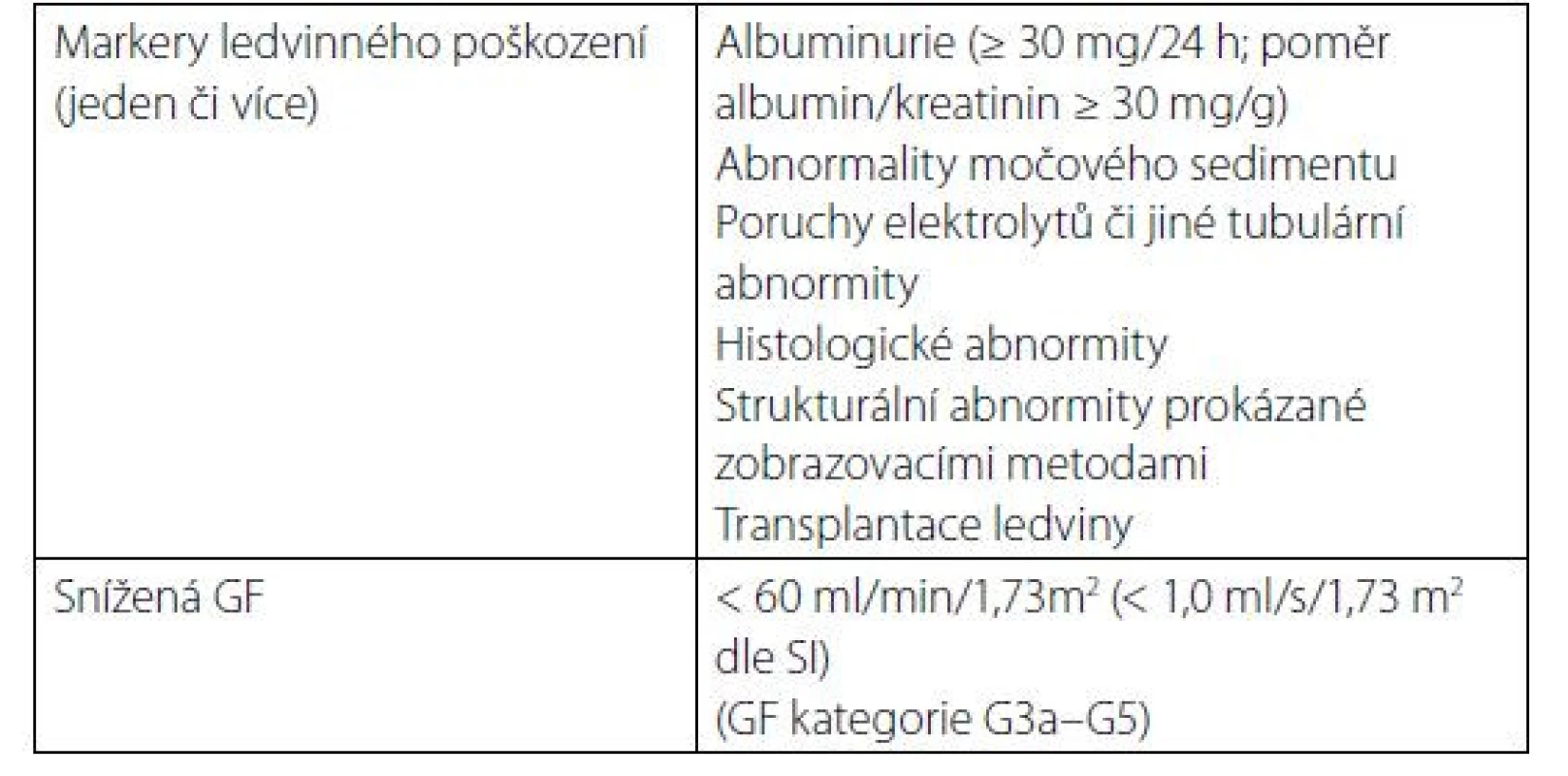
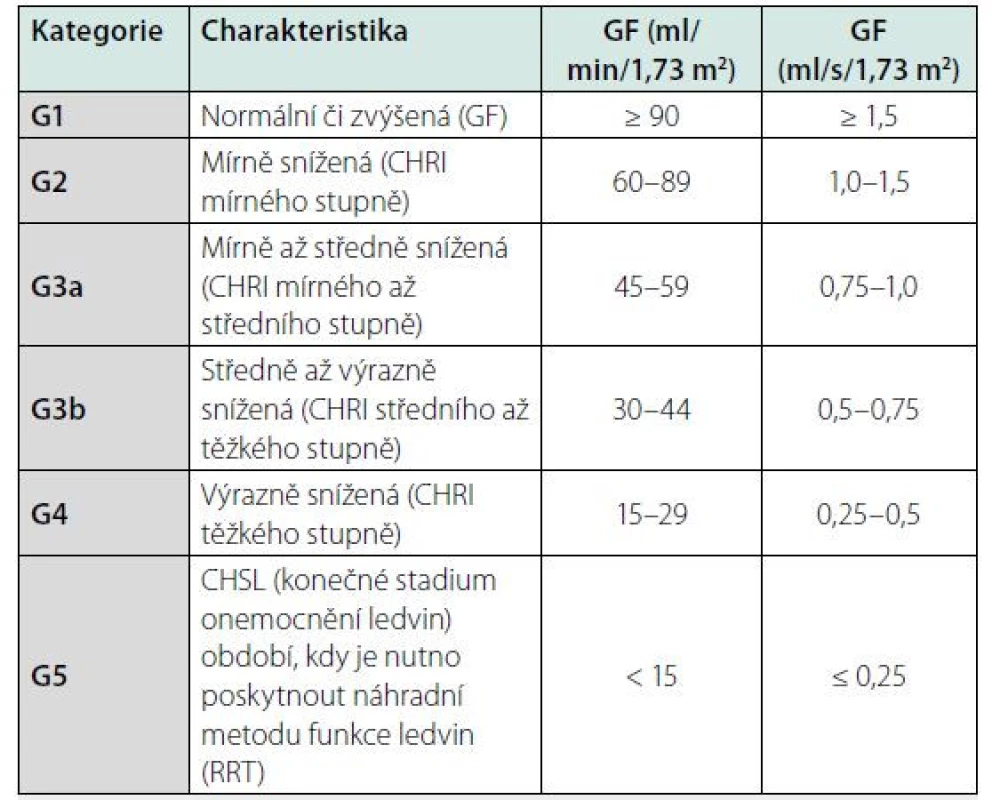
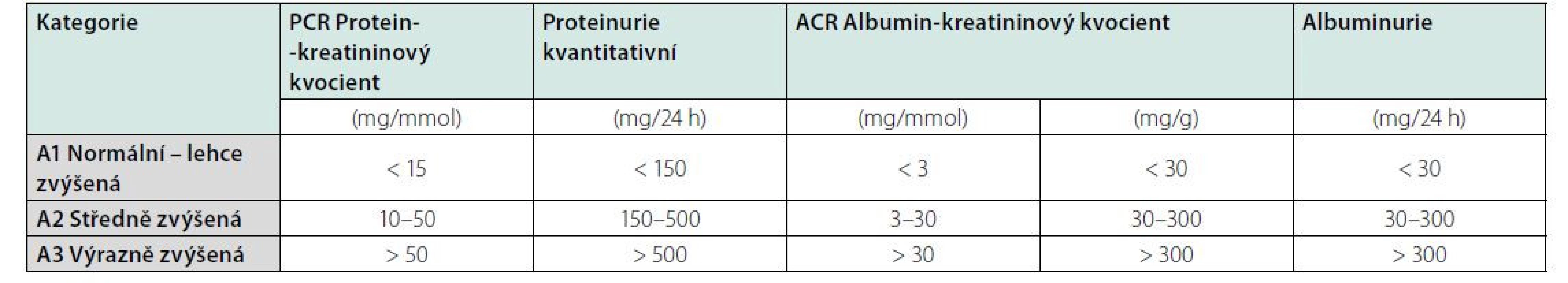
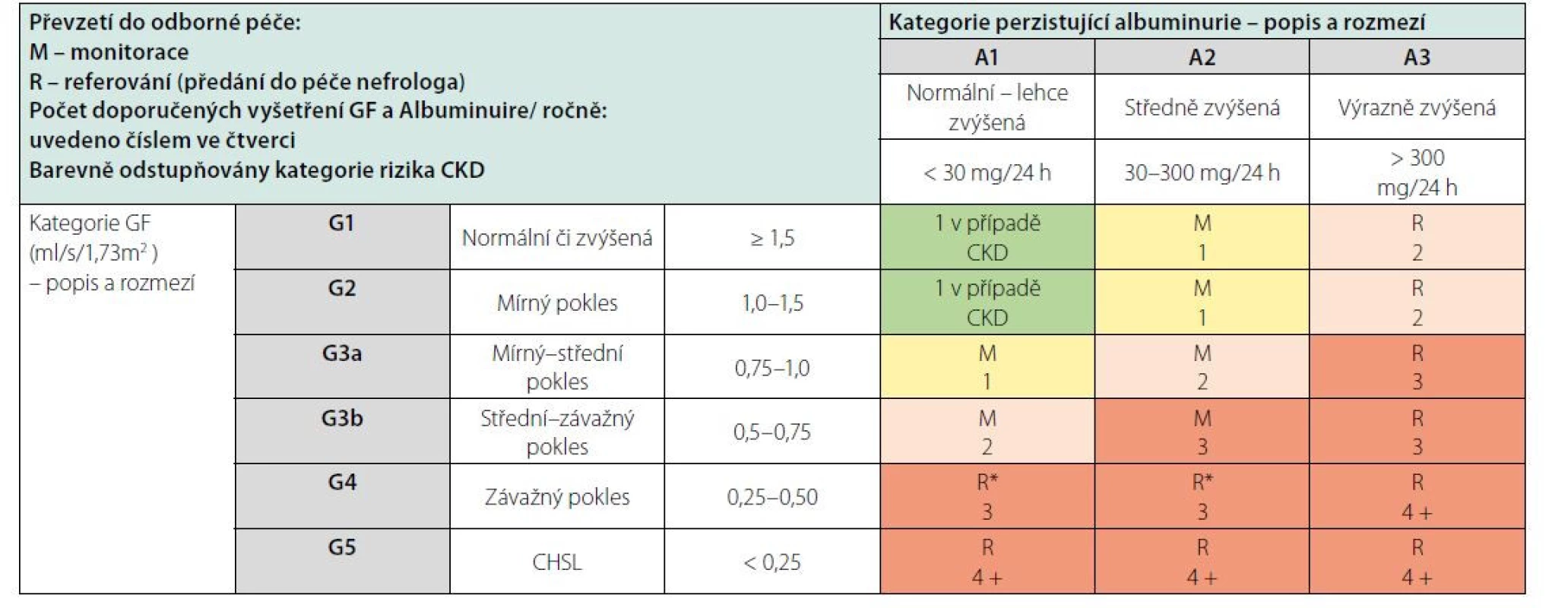
Klasifikační schéma CKD v minulosti prakticky zohledňovalo pouze hodnotu odhadované glomerulární filtrace (GF, GFR). Nyní definice obsahuje též kategorie příčina základního onemocnění ledvin a kategorie albuminurie. Klasifikace CKD je v současnosti založena na 3 parametrech: 1. příčina CKD (přítomnost/absence systémového onemocnění; určení typu onemocnění dle lokalizace patologických změn v ledvinách), 2. kategorie GF (kategorie G1–G5) (Tab. 2), 3. kategorie albuminurie (A1–A3) (Tab. 3).
CHSL: chronické selhání ledvin
GF: glomerulární filtrace
RRT: náhradní metoda funkce ledvin (z angl. renal replacement therapy)
Epidemiologie a příčiny chronického onemocnění ledvin
Prevalence CKD je vysoká a má tendenci k dalšímu vzestupu. Detailní informace o prevalenci CKD v české populaci chybí a lze je tak pouze odhadovat. Celosvětově se prevalence CKD všech kategorií (G1–G5) odhaduje na 13,4 %, z čehož jsou nejvíce zastoupeni pacienti s CKD kategorie G3 (7,6 %), a pouze v malé míře pacienti s nejzávažnějším stupněm poškození ledvin, G5 (0,1 %) (2). Je pravděpodobné, že se prevalence liší v jednotlivých regionech (3) a že tyto rozdíly nesouvisí pouze s výskytem hypertenze nebo diabetu, ale že je ovlivněna také socioekonomickými faktory a rovněž předpokládanou dobou dožití v populaci.
Samozřejmě lze dobře odhadnout prevalenci CKD G5, protože téměř všichni tito nemocní jsou vedeni a léčeni v dialyzačních střediscích a v transplantačních centrech. V ČR bylo k 31. 12. 2021 léčeno 11 613 pacientů metodami náhrady funkce ledvin, z toho bylo 51 % léčeno dialýzou, 46 % bylo po úspěšné transplantaci ledviny a jen 3 % byla léčena peritoneální dialýzou. V roce 2021 zahájilo nově hemodialyzační léčbu 2364 nemocných (18). Lze tedy předpokládat, že se každoročně u 2500–3000 nemocných vyvine progresivní chronické onemocnění ledvin do svého konečného stadia.
Věková skladba pacientů s CKD G5, u kterých je nově zahajována léčba RRT, se v poslední dekádě trvale posunuje do starších věkových skupin. Celková mortalita nemocných v CKD G5 léčených dialyzačními metodami je vysoká, v roce 2021 byla 19,8 % (18).
Příčiny a průběh CKD
Příčinami CKD jsou nejčastěji diabetes 2. typu a ischemická nefropatie (vaskulární nefroskleróza). Primární a sekundární glomerulonefritidy, stejně tak jako dědičná onemocnění ledvin, vedou častěji k progresi CKD do selhání ledvin. Vzhledem k počtu provedených transplantací ledvin je návrat do dialýzy po ukončení funkce transplantované ledviny možno považovat také za významnou příčinu selhání ledvin.
U většiny nemocných s CKD G3 (eGFR < 1,0 ml/s) může docházet k trvalé progresi onemocnění do selhání, u nemocných s CKD G4 (eGFR < 0,5 ml/s) se tomu děje prakticky vždy. Jako kritická mez se ukazuje být eGFR 0,75 ml/s, a proto se rozlišuje kategorie G3a a G3b (Tab. 4). Rychlost progrese se různí v závislosti na základním onemocnění ledvin a liší se také mezi jednotlivými nemocnými. Plynulá progrese CHRI může být narušena náhlým zhoršením, způsobeným akutně působícími vlivy. Může se jednat o akceleraci základního onemocnění ledvin či o vliv zevních faktorů (infekce, dehydratace, účinek kontrastní látky, NSIAD apod.). Mezi nejvýznamnější faktory renálního rizika (tj. progrese CKD) patří genetické predispozice (např. polycystóza), věk, pohlaví, rasa, proteinurie, hypertenze, metabolické faktory (hyperglykemie, obezita) a kouření. Některé z těchto faktorů lze významně ovlivnit preventivními či léčebnými zákroky.
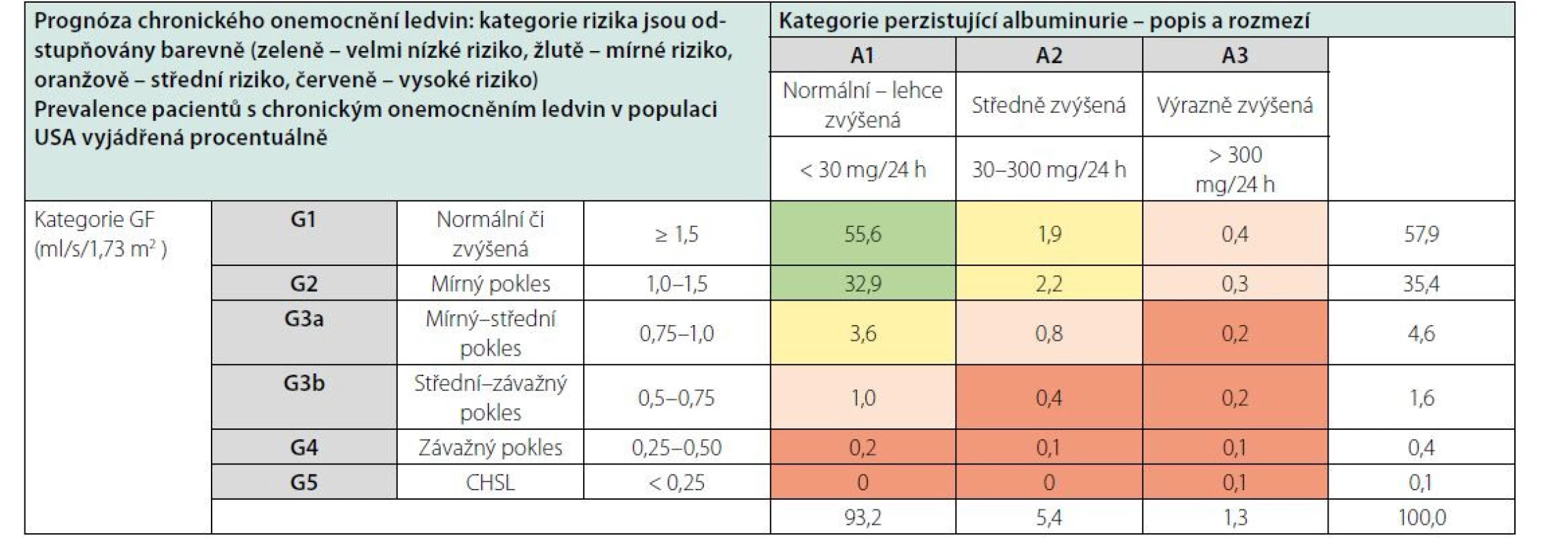
Typ základního onemocnění ledvin samozřejmě hraje významnou roli v prognóze CKD. Kromě toho však riziko progrese CKD závisí především na úrovni GF a tíži proteinurie, které jsou integrální součástí současné klasifikace CKD (Tab. 4). U nemocných s CKD se v závislosti na úrovni kategorií G a A zvyšuje nejen riziko progrese CKD, ale také celkové riziko mortality i kardiovaskulární mortality.
Monitorace funkce a poškození ledvin
Glomerulární filtrace
GF lze měřit pomocí clearance endogenního či exogenního markeru filtrace (např. clearance endogenního kreatininu, inulinu), limitací těchto metod ale je nutnost sběru moči. Proto se do klinické praxe zavedly odhady GF (eGFR, estimated glomerular filtration rate) vypočtené na podkladě sérové koncentrace kreatininu (případně cystatinu), bez nutnosti současného sběru moči. I když samotná hodnota sérového kreatininu může být významně ovlivněna množstvím svaloviny, věkem, pohlavím a některými dalšími vlivy, je pro stanovení eGFR dostačující. Dříve nejčastěji používaná MDRD rovnice se v současnosti nahrazuje CKD‑EPI rovnicí, která je proti MDRD rovnici přesnější, zvláště při normálních, či jen mírně snížených, hodnotách GFR (> 1,0 ml/s). Proměnnými rovnice CKD‑EPI jsou hodnota sérového kreatininu, věk, pohlaví a rasa – v přepočtu na ideální povrch těla (4). V současnosti byly vypracovány další rovnice, které nezahrnují rasu (17).
Albuminurie/proteinurie
Ke stanovení proteinurie lze nyní použít několika metod (Tab 3). Z důvodu menší časové zátěže a proveditelnosti se nyní opouští vyšetřování proteinurie či albuminurie/24 h, a nahrazuje se poměry albumin/ kreatininu (ACR) či protein/kreatininu (PCR) z jednorázového vzorku moči. K posouzení dynamiky změn je vhodné vyšetřovat moč ve stejnou denní dobu a za stejných podmínek; preferuje se provádění ACR. Vyšetření proteinurie/24 h je dnes prakticky vyhrazeno jenom pacientům sledovaným v nefrologických ambulancích s nefrotickým syndromem (1).
Dispenzarizace a sledování nemocných s CKD
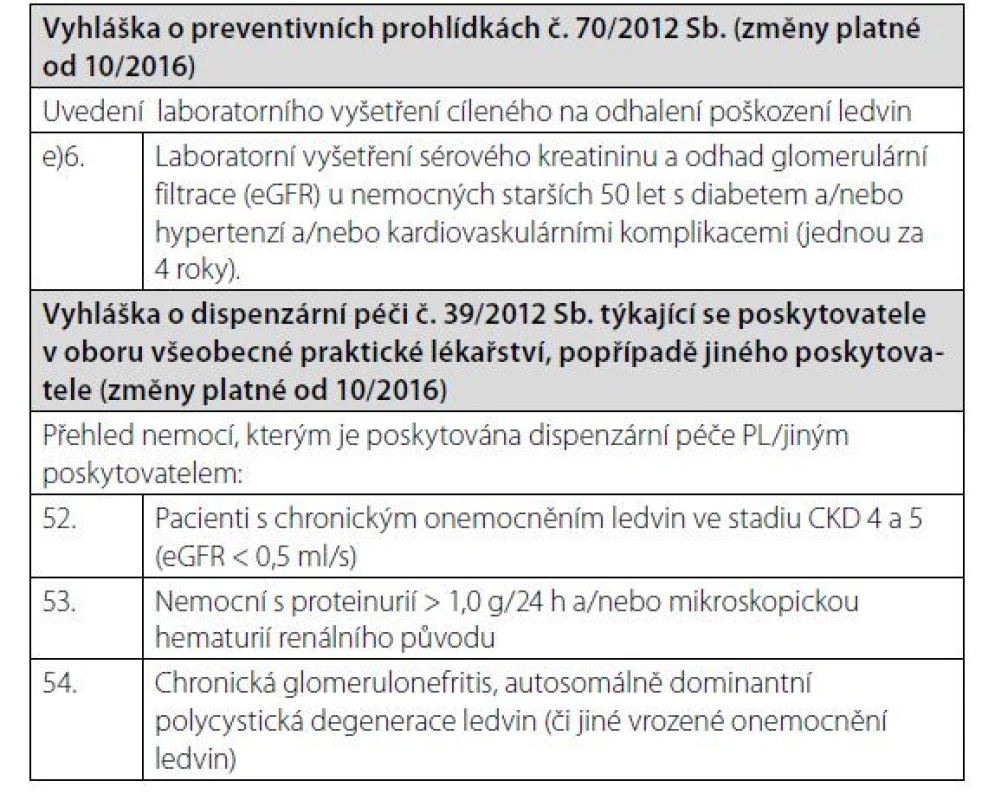
Vzhledem k vysokému výskytu CKD je jasné, že většina nemocných s CKD je sledována v jiných než nefrologických ambulancích. K záchytu CKD v případě rizikových nemocných má dojít ideálně při preventivní prohlídce u praktického lékaře anebo při vyšetření u specialistů, nejčastěji v diabetologických, interních a urologických ambulancích. Recentně upravená Vyhláška o preventivních prohlídkách a o dispenzární péči definuje podmínky pro skríningové testy v ambulancích praktických lékařů (Tab. 5). Kromě vyšetření hladin sérového kreatininu a odhadu eGFR by ve všech ambulancích specialistů, především diabetologů a internistů, měla být u všech nemocných v riziku CKD vyšetřována též albuminurie. U pacientů s CKD, kteří jsou včas předáni do specializované nefrologické péče, je prokazatelně nižší mortalita, morbidita i nutnost nemocničního pobytu v prvním roce po zahájení náhrady funkce ledvin. Tento přístup je také spojen s nižšími ekonomickými nároky, vyšší indikací preemptivních transplantací a peritoneální dialýzy, ale také je včas založen cévní přístupu k dialýze (5). KDIGO doporučují frekvenci vyšetření nemocných s CKD a definují eGFR 0,5 ml/s jako hranici, kdy je třeba nemocné s progresivní nefropatií předávat do nefrologické péče (Tab. 6). Všichni nemocní s CKD G4 tedy mají být vyšetřeni a eventuálně sledováni v ambulancích nefrologů s tím, že samozřejmě existují renální onemocnění, která sledují nefrologové ve všech stadiích CKD, jakými jsou glomerulonefritidy, vaskulitidy a další systémová onemocnění s postižením ledvin, vrozená a dědičná onemocnění (například polycystóza) apod. Je důležité, aby nefrolog vyšetřil pacienty s eGFR < 0,5 ml/s, protože lépe odhadne riziko progrese, upraví terapii a předepíše jemu vyhrazenou medikaci.
Ovlivnění progrese chronického onemocnění ledvin
Základním opatřením, jak lze zpomalit progresi CKD, je kompenzace hypertenze a snížení proteinurie < 0,5 g/den. S využitím gliflozinů lze zřejmě tohoto cíle alespoň u části pacientů dosáhnout. Současná doporučení pro léčbu nemocných s CKD KDIGO 2021 (6) pro léčbu hypertenze stanovila cílovou hodnotu systolického krevního tlaku pro všechny nemocné s CKD, kteří ještě nejsou léčeni dialýzou (diabetiky i nediabetiky), na 120 mm Hg při standardizovaném měření krevního tlaku v ambulanci. Cílová hodnota diastolického tlaku není v současné době přesně stanovena, především pro nedostatek důkazů z klinických studií. Je jasné, že cílové hodnoty systolického krevního tlaku nebude snadné dosáhnout především u starších nemocných. Proto doporučení hovoří o postupném snižování krevního tlaku na maximální tolerovatelnou mez. Cílové hodnoty krevního tlaku u nemocných léčených chronickou dialýzou stanoveny vůbec nejsou, po transplantaci ledviny jsou pak stanoveny na < 130/80 mm Hg.
Blokáda systému renin‑angiotensin‑aldosteron
Lékem volby u nemocných s CKD jsou blokátory systému renin‑angiotensin‑aldosteron (RAAS), ACEi nebo sartany, v maximální tolerované dávce. Mechanismus jejich renoprotektivního účinku spočívá ve snížení intraglomerulárního tlaku navozenou vazodilatací vas efferens glomerulu. Současně blokátory RAAS snižují trofické působení angiotensinu II a omezují glomerulární hypertrofii. Pro svůj renoprotektivní účinek by měly být blokátory RAAS podávány u nemocných s CKD i bez významnější hypertenze a bez ohledu na stupeň proteinurie. Léčba musí být zahájena u diabetiků dříve, pokud mají albuminurii 30–300 mg/den (kategorie CKD A2). U těchto nemocných je léčba blokátory RAAS indikována bez ohledu na výši krevního tlaku (1, 6).
Při léčbě blokátory RAAS je možným závažným nežádoucím účinkem hyperkalemie a iniciální pokles renální funkce po nasazení, zvláštní obezřetnosti je třeba v případech podezření na renovaskulární hypertenzi, respektive na stenózu renální tepny. Velkou pozornost je třeba věnovat léčbě starších nemocných, u kterých může léčba hypertenze způsobit ortostatickou hypotenzi, elektrolytové abnormality, akutní snížení renální funkce a další vedlejší účinky léčby antihypertenzivy. Nemocní, kteří při terapii ACEi kašlou, by měli být léčeni sartany. U nemocných vyššího věku je nutné přizpůsobit cílové hodnoty krevního tlaku stavu jejich cirkulace, komorbiditám a jejich schopnosti tolerovat léčbu. Nemocný by měl být motivován k domácímu měření krevního tlaku.
Mezi blokátory RAAS je dále možné zařadit nesteroidní inhibitory mineralokortikoidního receptoru, které na rozdíl od spironolaktonu podstatně méně zvyšují hladinu draslíku. Nedávno zveřejněné výsledky studie FIDELIO‑DKD (7) porovnávající efekt finerononu s placebem u pacientů s pokročilým diabetickým onemocněním ledvin prokázaly významné snížení albuminurie, zpomalení poklesu hodnot eGFR a menší výskyt kardiovaskulárních příhod.
Kompenzace diabetu
Uspokojivá kompenzace diabetu snižuje výskyt a progresi diabetického onemocnění ledvin jak u diabetiků 1., tak i 2. typu. Efekt klasických antidiabetik (metformin, deriváty sulfonylurey, pioglitazon, inzulin) je závislý prakticky výlučně na zlepšení kompenzace diabetu. Podobně není efekt nad rámec zlepšení kompenzace diabetu přítomen ani u novější lékové skupiny gliptinů. Ke zlepšení renálních endpointů částečně nezávislému na ovlivnění kompenzace diabetu tak vedou pouze GLP-1 agonisté a především pak glifloziny, jejichž efektům se podrobněji věnujeme níže. Glifloziny mají jako zatím jediná skupina antidiabetik důkazy o nefroprotektivitě přímo ze studií zaměřených primárně na renální endpointy.
Snížení renálního kompozitního endpointu bylo v rámci portfolia antidiabetik patrné také při léčbě dlouze působícími agonisty GLP-1 receptorů – liraglutidem (LEADER), injekčním semaglutidem (SUSTAIN-6) a dulaglutidem (REWIND), byť renoprotektivní efekt byl vázán zejména na nový vznik či progresi albuminurie a studie nebyly primárně postavené ke sledování renálních efektů těchto látek. Recentně probíhající studie FLOW zodpoví otázku renoprotekce v případě léčby injekčním semaglutidem.
Glifloziny
Glifloziny neboli SGLT2 inhibitory, donedávna používané výhradně jako antidiabetika, mají příznivý vliv na zpomalení progrese CKD, která je ze značné části nezávislá na zlepšení kompenzace diabetu. V intervenčních studiích bylo prokázáno, že léčba glifloziny zpomaluje progresi chronického onemocnění ledviny u diabetiků 2. typu. Empagliflozin redukoval ve srovnání s placebem ve studii EMPAREG‑OUTCOME riziko progrese renálního onemocnění (o 39 %) a nutnost náhrady funkce ledvin (o 55 %) (8). Podobný renoprotektivní efekt byl popsán u canagliflozinu (9) a dapagliflozinu (10). Z těchto dat je tak jasné, že glifloziny by měly být podávány všem pacientů s diabetem 2. typu a přítomným chronickým onemocněním ledvin.
Renoprotektivní efekty jsou nedávno ověřeny u dapagliflozinu i u nemocných bez diabetu a je tak jasné, že tyto efekty jsou nezávislé na hladině HbA1c a na stupni renální insuficience. Recentně publikovaná studie DAPA‑CKD (11) prokázala, že dapagliflozin v dávce 10 mg denně oproti placebu podávaný po dobu (medián) 2,4 roku redukoval cílový parametr studie (kompozitní cíl tvořený poklesem GFR o alespoň 50 %, konečné stadium selhání ledvin nebo úmrtí z kardiálních nebo renálních příčin) o 39 %. Efekt dapagliflozinu byl podobný jak u diabetiků, tak u nediabetiků. Subanalýza této studie zaměřená na 270 pacientů s IgA nefropatií jako základním renálním onemocněním rovněž prokázala, že dapagliflozin zpomalil progresi CKD u této nejčastější glomerulonefritidy (12). Primárního cíle dosáhlo pouze 6 (4 %) pacientů léčených dapagliflozinem oproti 20 (15 %) pacientům, kteří dostávali placebo. Zajímavým poznatkem bylo, že dapagliflozin snížil albuminurii o 26 % v porovnání s placebem. Ukazuje se tak, že na rozdíl od imunosupresivní terapie, která v léčbě IgA nefropatie přináší rozporuplné výsledky, především kvůli vedlejším účinkům, je léčba s dapagliflozinem daleko více bezpečná a pravděpodobně i účinná.
Po nasazení gliflozinů je napříč studiemi zaznamenán mírný, z větší části reverzibilní, akutní pokles GFR (3–4 ml/min). Sekundární analýza studie DAPA‑CKD prokázala, že mezi pacienty s CKD a albuminurií léčenými dapagliflozinem není akutní snížení GFR během prvních 2 týdnů léčby spojeno s rychlejší progresí CKD (13).
Mimo výše popsané renoprotektivní účinky je potřeba zdůraznit, že glifloziny významně snižují kardiovaskulární riziko a riziko srdečního selhání s redukovanou i zachovalou ejekční frakcí (14, 16).
Klinické studie tak jasně prokázaly, že glifloziny vykazují jasné renoprotektivní a kardioprotektivní účinky jak u diabetiků, tak i u nemocných bez diabetu. S přihlédnutím k výsledkům výše uvedených studií by léčba glifloziny měla být zvážena nezávisle na hladině HbA1c u všech nemocných s CKD, diabetiků 2. typu, stejně tak jako u ostatních nemocných s CKD bez diabetu. Indikační kritéria vychází z provedených studií u jednotlivých přípravků.
Další opatření
V rámci konzervativní léčby hraje důležitou roli řada dalších opatření, která by měla být vždy zvážena a uplatněna. Mezi nejdůležitější patří omezení příjmu bílkovin v potravě. V případě konzervativní léčby CKD G5 v predialyzačním období je vhodná dieta s omezením bílkovin 0,5 g/kg tělesné hmotnosti s přídavkem ketoanalog, v případě CKD G4 je vhodná dieta s omezením bílkovin 0,6–0,8 g/kg. Nízkobílkovinné diety je třeba považovat za doplněk renoprotekce a je nezbytné, aby pacient konzultoval svůj jídelníček s dietní sestrou nebo nutričním terapeutem. Možná důležitější než omezení bílkovin v dietě je omezení příjmu soli. Příjem soli u hypertoniků s CKD by neměl být vyšší než 5 g denně. Podobně důležitá je i léčba závislosti na tabáku a přerušení kuřáckého návyku (1).
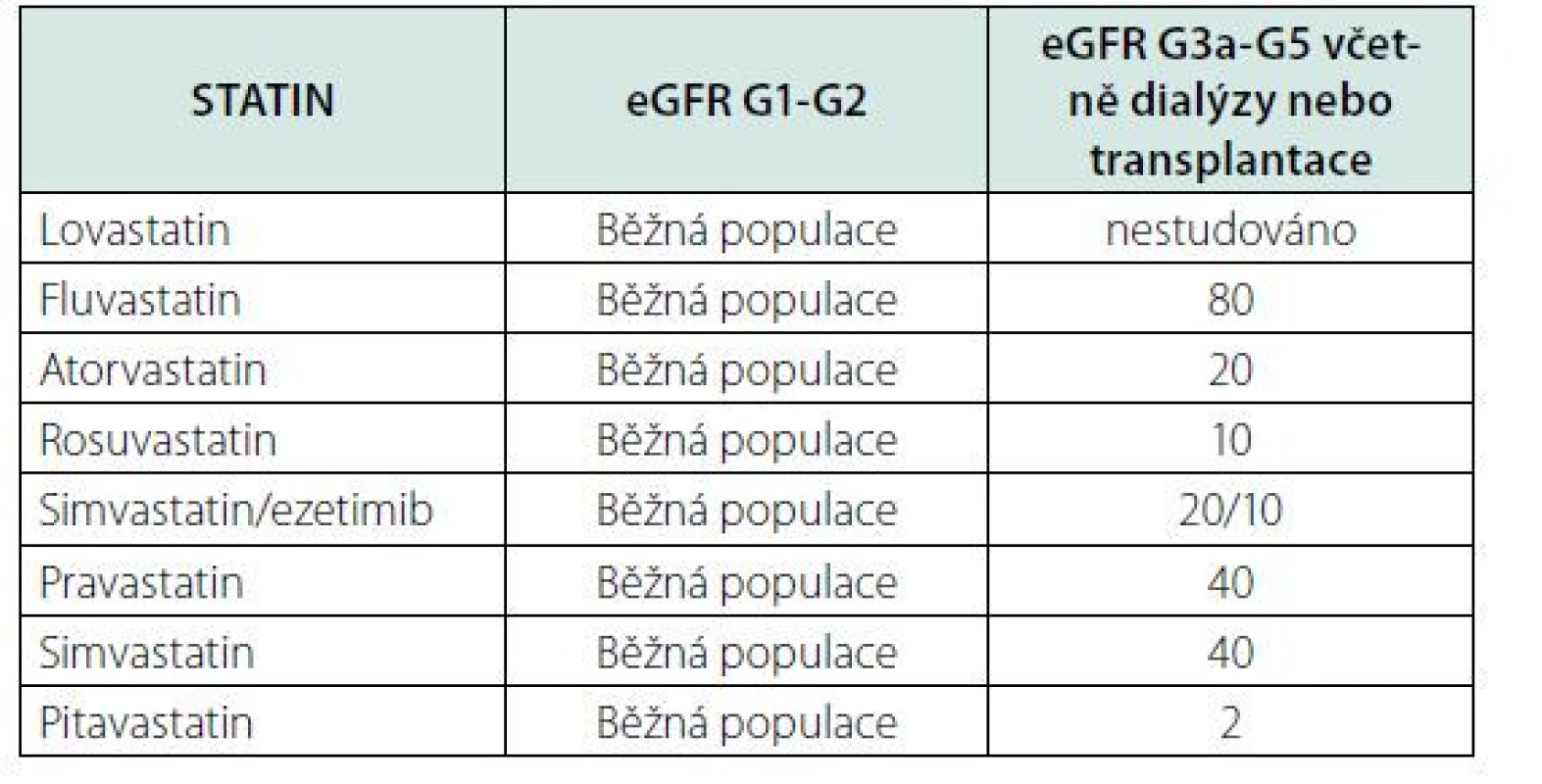
Hyperlipoproteinemie je u nemocných s CKD častá, ovšem studie, které byly provedeny s cílem ověřit renoprotektivní efekt hypolipidemické terapie nepotvrdily tato očekávání. Proto je hypolipidemická terapie, doporučována těm nemocným s CKD, u kterých je současně indikována v sekundární prevenci aterosklerotických komplikací (15). Na rozdíl od běžné populace je nemocným s CKD G3-5 doporučeno podávat nižší maximální dávky statinů než u běžné populace (Tab. 7), protože existuje vyšší riziko vedlejších účinků této terapie.
Pacienti s diabetem mají větší sklon k hyperkalemii při léčbě ACEi, a proto je potřeba léčbu pečlivě monitorovat. Při sklonu k významnější hyperkalemii je vhodná dieta s omezením draslíku, při kalemii nad 5,6 mmol/l ACEi/sartany redukovat nebo vysadit.
Léčba renální anemie, která se objevuje již u nemocných s CKD G4, zahrnuje substituci železem a léčbu erytropoezu stimulujícími léky, a podobně jako léčba poruch kalcio‑fosfátového metabolismu a hyperparathyreózy patří do rukou nefrologa.
Glifloziny v současné renoprotektivní terapii
Současné poznatky z klinických studií jasně svědčí pro významné renoprotektivní účinky dapagliflozinu u nemocných s CKD bez ohledu na přítomnost diabetu. Navíc se očekávají výsledky studií s dalšími glifloziny, například EMPA‑KIDNEY. Proto by měl být dapagliflozin součástí komplexní renoprotektivní terapie již nyní (Tab. 8). Protože data o pacientech s CKD G5 nejsou zatím k dispozici a lze očekávat určitý akutní pokles GFR po nasazení gliflozinů, není vhodné zahajovat tuto léčbu u nemocných s eGFR < 0,25 ml/s (< 15 ml/ min), stejně tak jako u nemocných na dialýze, kdy již nelze očekávat žádné výhody v renoprotekci a antidiabetický účinek bude rovněž minimální. Velké opatrnosti je třeba věnovat nemocným s pokročilým CKD G4 (eGFR 0,25–0,33 ml/s). Dosud provedené klinické studie s glifloziny nezahrnuly pacienty s polycystózou a pacienty s autoimunitami léčené imunosupresí. Podobně nebyly provedeny kontrolované studie v populaci nemocných po transplantaci ledviny. Je proto v těchto případech třeba postupovat uvážlivě a vážit rizika a výhody této terapie. U ostatních nemocných by měly být glifloziny nasazeny. Od 1. 8. 2022 je dapagliflozin hrazen v ČR v indikaci CKD bez ohledu na přítomnost diabetu. Canagliflozin lze v rámci indikace diabetes mellitus 2. typu využít k léčbě diabetického onemocnění ledvin (DKD). Úhradová omezení zohledňují stupeň GFR a přítomnou albuminurii. Pacientům je třeba vysvětlit výhody a vedlejší účinky této terapie, mezi které patří riziko genitálních mykóz (zejména u pacientů s diabetem) a edukovat je o potřebě zvýšené osobní hygieny a mírně vyššího příjmu tekutin. Při výskytu genitální mykotické infekce není třeba léčbu ihned přerušovat, lokální terapie antimykotiky je obvykle dostačující. U diabetiků zejména 1. typu a výrazně inzulin‑deficitních diabetiků 2. typu je třeba pamatovat na riziko euglykemické ketoacidózy u závažných infekcí, kdy je nezbytné léčbu s glifloziny přerušit.

Spolupráce při indikaci gliflozinů v terapii chronického onemocnění ledvin
Většina nemocných s CKD není léčena v ambulancích nefrologů, ale jsou sledováni u praktických lékařů, diabetologů, internistů, kardiologů či urologů. Společným cílem všech je zpomalení progrese CKD. Glifloziny mohou v současnosti v ČR předepsat diabetolog a internista v indikaci léčby diabetu 2. typu (dapagliflozin navíc i v indikaci CKD, canagliflozin lze využít v léčbě DKD), kardiolog a internista v indikaci léčby srdečního selhání se sníženou ejekční frakcí (dapagliflozin, empagliflozin) a nefrolog a internista mohou zatím předepsat dapagliflozin v indikaci CKD. Péče o největší množinu nemocných s CKD bude poskytována diabetology a internisty, a proto je nezbytné, aby v případech, kdy ještě není potřeba trvalé nefrologické péče, na indikaci gliflozinů mysleli. Společné mezioborové postgraduální aktivity v oblasti renoprotekce jsou optimální možností, jak rozšířit povědomí o výhodách gliflozinů mimo jejich antidiabetické a kardioprotektivní účinky. V případě nemocných s CKD G4 by k potížím docházet nemělo, protože všichni tito nemocní by alespoň jednou ročně měli být vyšetřeni nefrologem, který by měl zrevidovat terapeutický postup, a to včetně všech možností renoprotekce.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Ondřej Viklický, CSc.
Klinika nefrologie, Transplantační centrum, IKEM
Vídeňská 1958, 140 21 Praha
Cit. zkr: Vnitř Lék. 2022;68(7):426-431
Článek přijat redakcí: 20. 9. 2022
Článek přijat po recenzích: 28. 9. 2022
Sources
1. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney International 2013;Suppl 3 : 1-150.
2. Hill NR, Fatoba ST, Oke JL, Hirst JA, O‘Callaghan CA, Lasserson DS, Hobbs FD. Global Prevalence of Chronic Kidney Disease - A Systematic Review and Meta‑Analysis. PLoS One. 2016 Jul 6;11(7):e0158765.
3. Brück K, Stel VS, Gambaro G, Hallan S, Völzke H, Ärnlöv J, Kastarinen M, Guessous I, Vinhas J, Stengel B, Brenner H, Chudek J, Romundstad S, Tomson C, Gonzalez AO, Bello AK, Ferrieres J, Palmieri L, Browne G, Capuano V, Van Biesen W, Zoccali C, Gansevoort R, Navis G, Rothenbacher D, Ferraro PM, Nitsch D, Wanner C, Jager KJ; European CKD Burden Consortium. CKD Prevalence Varies across the European General Population. J Am Soc Nephrol. 2016 Jul;27(7):2135-47.
4. Zima T, Racek J, Tesař V, Viklický O, Teplan V, Schück O, Janda J, Friedecký B, Kubíček Z, Kratochvíla J, Rajdl D, Šálek T, Kalousová M and Granátová J. Doporučení České nefrologické společnosti a České společnosti klinické biochemie ČLS JEP 2014. Doporučení k diagnostice chronického onemocnění ledvin (odhad glomerulární filtrace a vyšetřování proteinurie) http://www.nefrol.cz/odbornici/doporucene‑postupy‑cns. 2014.
5. Smart NA, Dieberg G, Ladhani M, Titus T. Early referral to specialist nephrology services for preventing the progression to end‑stage kidney disease. Cochrane Database Syst Rev. 2014 Jun 18;(6):CD007333. doi: 10.1002/14651858.CD007333.pub2. PMID: 24938824.
6. Cheung AK, Chang TI, Cushman WC, Furth SL, Hou FF, Ix JH, Knoll GA, Muntner P, Pecoits‑Filho R, Sarnak MJ, Tobe SW, Tomson CRV, Lytvyn L, Craig JC, Tunnicliffe DJ, Howell M, Tonelli M, Cheung M, Earley A, Mann JFE. Executive summary of the KDIGO 2021 Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney Int. 2021 Mar;99(3):559-569.
7. Bakris GL, Agarwal R, Anker SD, Pitt B, Ruilope LM, Rossing P, Kolkhof P, Nowack C, Schloemer P, Joseph A, Filippatos G and Investigators F‑D. Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes. N Engl J Med. 2020;383 : 2219-2229.
8. Wanner C, Inzucchi SE, Lachin JM, Fitchett D, von Eynatten M, Mattheus M, Johansen OE, Woerle HJ, Broedl UC, Zinman B and Investigators E‑RO. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med. 2016;375 : 323-34.
9. Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N, Shaw W, Law G, Desai M, Matthews DR; CANVAS Program Collaborative Group. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med. 2017 Aug 17;377(7):644-657.
10. Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, Silverman MG, Zelniker TA, Kuder JF, Murphy SA, Bhatt DL, Leiter LA, McGuire DK, Wilding JPH, Ruff CT, Gause‑Nilsson IAM, Fredriksson M, Johansson PA, Langkilde AM, Sabatine MS and Investigators D‑T. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2019;380 : 347-357.
11. Heerspink HJL, Stefánsson BV, Correa‑Rotter R, Chertow GM, Greene T, Hou FF, Mann JFE, McMurray JJV, Lindberg M, Rossing P, Sjöström CD, Toto RD, Langkilde AM, Wheeler DC; DAPA‑CKD Trial Committees and Investigators. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2020 Oct 8;383(15):1436-1446.
12. Wheeler DC, Toto RD, Stefánsson BV, Jongs N, Chertow GM, Greene T, Hou FF, McMurray JJV, Pecoits‑Filho R, Correa‑Rotter R, Rossing P, Sjöström CD, Umanath K, Langkilde AM, Heerspink HJL; DAPA‑CKD Trial Committees and Investigators. A pre‑specified analysis of the DAPA‑CKD trial demonstrates the effects of dapagliflozin on major adverse kidney events in patients with IgA nephropathy. Kidney Int. 2021 Jul;100(1):215-224.
13. Jongs N, Chertow GM, Greene T, McMurray JJV, Langkilde AM, Correa‑Rotter R, Kashihara N, Rossing P, Sjöström CD, Stefánsson BV, Toto RD, Wheeler DC, Heerspink HJL; DAPA‑CKD Trial Committees and Investigators. Correlates and Consequences of an Acute Change in eGFR in Response to the SGLT2 Inhibitor Dapagliflozin in Patients with CKD. J Am Soc Nephrol. 2022 Aug 17:ASN.2022030306. doi: 10.1681/ASN.2022030306.
14. McMurray JJV, Solomon SD, Inzucchi SE, Kober L, Kosiborod MN, Martinez FA, Ponikowski P, Sabatine MS, Anand IS, Belohlavek J, Bohm M, Chiang CE, Chopra VK, de Boer RA, Desai AS, Diez M, Drozdz J, Dukat A, Ge J, Howlett JG, Katova T, Kitakaze M, Ljungman CEA, Merkely B, Nicolau JC, O‘Meara E, Petrie MC, Vinh PN, Schou M, Tereshchenko S, Verma S, Held C, DeMets DL, Docherty KF, Jhund PS, Bengtsson O, Sjostrand M, Langkilde AM, Committees D‑HT and Investigators. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019;381 : 1995-2008.
15. KDIGO 2013 (KDIGO Clinical Practice Guideline for Lipid Management in Chronic Kidney Disease, Kidney Int Suppl 2013;3(3).
16. Anker SD, Butler J, Filippatos G, Ferreira JP, Bocchi E, Böhm M, Brunner‑La Rocca HP, Choi DJ, Chopra V, Chuquiure‑Valenzuela E, Giannetti N, Gomez‑Mesa JE, Janssens S, Januzzi JL, Gonzalez‑Juanatey JR, Merkely B, Nicholls SJ, Perrone SV, Piña IL, Ponikowski P, Senni M, Sim D, Spinar J, Squire I, Taddei S, Tsutsui H, Verma S, Vinereanu D, Zhang J, Carson P, Lam CSP, Marx N, Zeller C, Sattar N, Jamal W, Schnaidt S, Schnee JM, Brueckmann M, Pocock SJ, Zannad F, Packer M; EMPEROR‑Preserved Trial Investigators. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med. 2021 Oct 14;385(16):1451-1461.
17. Inker LA, Eneanya ND, Coresh J, Tighiouart H, Wang D, Sang Y, Crews DC, Doria A, Estrella MM, Froissart M, Grams ME, Greene T, Grubb A, Gudnason V, Gutiérrez OM, Kalil R, Karger AB, Mauer M, Navis G, Nelson RG, Poggio ED, Rodby R, Rossing P, Rule AD, Selvin E, Seegmiller JC, Shlipak MG, Torres VE, Yang W, Ballew SH, Couture SJ, Powe NR, Levey AS; Chronic Kidney Disease Epidemiology Collaboration. New Creatinine - and Cystatin C‑Based Equations to Estimate GFR without Race. N Engl J Med. 2021 Nov 4;385(19):1737-1749.
18. Rychlík I, Francová L. Statistická ročenka dialyzační léčby v České republice v r. 2021. Česká nefrologická společnost 2022. https://www.nefrol.cz/odbornici/dialyzacni‑statistika
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2022 Issue 7
-
All articles in this issue
- Hlavní téma – Nefrologie
- Současné možnosti zpomalení progrese chronického onemocnění ledvin
- Expertní stanovisko ke spolupráci diabetologů a internistů s nefrology v péči o nemocné s chronickým onemocněním ledvin
- Glomerulonefritidy asociované s infekcemi
- Novinky v léčbě renální anémie – erytropoetin vs. inhibitory prolylhydroxylázy?
- Covid-19 u nemocných po transplantaci ledviny
- Reaktivní, infekční nebo postinfekční artritida?
- Účinek inhibitoru SGLT2 empagliflozinu na stabilizaci průběhu srdečního selhání s možností dalších intervencí u pacienta s HFrEF
- Nové technologie ve vývoji hypolipidemik. Inclisiran (LEQVIO®)
- Léčba hypertenze starších osob a její úskalí
- Incidentalomy štítné žlázy
- Můžeme novou léčbou ovlivnit dosavadní terapií neřešený zánět a fibrózu u pacientů s DM2 a CKD?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Reaktivní, infekční nebo postinfekční artritida?
- Incidentalomy štítné žlázy
- Novinky v léčbě renální anémie – erytropoetin vs. inhibitory prolylhydroxylázy?
- Současné možnosti zpomalení progrese chronického onemocnění ledvin
