Střednědobá úspěšnost single stage hybridní ablace perzistující a dlouhodobě perzistující fibrilace síní
Mid-term success rate of single stage hybrid ablation of persistent and long-term persistent atrial fibrillation
Introduction: Single stage thoracoscopic radiofrequency ablation (RFA) is a treatment method for persistent and long-term persistent atrial fibrillation (AF) offering the possibility for patients otherwise inconsolable by conventional catheter RFA. We present a pilot group of patients after the introduction of the new method at our clinical center.
Patients group: A total of 52 patients aged 61.82 ± 9.7 years underwent single stage hybrid ablation (thoracoscopic isolation of pulmonary veins and box lesion followed by catheter verification of the surgical procedure effectivness) for symptomatic persistent and long-term persistent AF with significantly dilated left atrium 57.9 ± 11.0mm in the period September 2016-March 2019.
Results: The median duration of the procedure was 232 minutes and the median duration of hospitalization was 10 days. At discharge, 52 patients (100%) had sinus rhythm. 48 of 52 patients (92.3%) had a 6-month follow-up. 41 of 48 (85.4%) and 38 of 44 (86.4%) of patients were AF free at 3-month and 6-month follow-up, respectively. Acute complications were: one left atrial perforation resolved successfully by suture and one transient ischaemic attack without permanent sequelae. Late complications involved one massive pulmonary embolization and an atrioesophageal fistula. There was no periprocedural myocardial infarction or stroke with permanent sequelae.
Conclusion: Hybrid thoracoscopic-catheter ablation performed during one procedure is an effective and relatively safe mini-invasive method of treatment for long-term persistent atrial fibrillation.
Keywords:
catheter ablation – persistent atrial fibrillation – thoracoscopic ablation – hybrid single stage ablation
Authors:
Martin Pešl 1,2,3; Tomáš Kulík 1,2; Tomáš Ostřížek 4; Vladimír Horváth 4; Filip Souček 1,2; Katarína Melajová 1; Katarína Doležalová 1; Daniela Žáková 4; Tomasz Jadczyk 2,5; František Lehar 1; Jiří Jež 1,2; Zdenek Stárek 1,2
Authors‘ workplace:
I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně, Lékařská fakulta Masarykovy univerzity, Brno
1; Mezinárodní centrum klinického výzkumu (ICRC), Fakultní nemocnice u sv. Anny v Brně
2; Biologický ústav, Lékařská fakulta Masarykovy univerzity, Brno
3; Centrum kardiovaskulární a transplantační chirurgie (CKTCH), Brno
4
Published in:
Vnitř Lék 2022; 68(E-5): 20-26
Category:
Original Contributions
doi:
https://doi.org/10.36290/vnl.2022.069
Overview
Úvod: Thorakoskopická radiofrekvenční ablace technikou „single stage“ je metodou léčby perzistující a dlouhodobě perzistující fibrilace síní (FS) nabízející možnost pro pacienty jinak neřešitelné konvenční katétrovou radiofrekvenční ablací. Prezentujeme úvodní soubor pacientů po zavedení nové metody na našem pracovišti.
Metody: Celkem 52 pacientů ve věku 61,82 ± 9,7 roku podstoupilo v období září 2016 – březen 2019 single stage hybridní ablaci (thorakoskopická izolace plicních žil a „box lesion“ následovaná katétrovým ověřením efektu chirurgické části výkonu) pro symptomatickou perzistující a dlouhodobě perzistující FS s výrazně dilatovanou levou síní 57,9 ± 11,0 mm.
Výsledky: Střední doba výkonu dosahovala 232 minut a střední doba hospitalizace byla 10 dnů. Při propuštění mělo 52 pacientů (100 %) sinusový rytmus. Šestiměsíční kontrolu absolvovalo 48 z 52 pacientů (92,3 %). Při první kontrole po třech měsících od výkonu bylo 41 ze 48 (85,4 %) pacientů bez záchytu FS, při druhé kontrole po 6 měsících bylo bez FS 38 ze 44 dále sledovaných pacientů (86,4). Akutní komplikace byla zaznamenána 1× perforace levé síně řešená úspěšně suturou a 1× tranzitorní ischemická ataka bez trvalých následků. Pozdní komplikace 1× masivní plicní embolizace, 1× atrioezofageální píštěl. Nebyl zaznamenán žádný periprocedurální infarkt myokardu ani cévní mozková příhoda s trvalými následky.
Závěr: Hybridní thorakoskopická a katétrová ablace v jednom sezení je účinná a relativně bezpečná miniinvazivní metoda léčby dlouhodobě perzistující fibrilace síní.
Klíčová slova:
perzistující fibrilace síní – katétrová ablace – thorakoskopická ablace – hybridní single stage ablace
Úvod
Poruchy srdečního rytmu postihují značnou část české i světové populace (1). Nejčastější setrvalou arytmií je fibrilace síní (FS) s narůstající incidencí i prevalencí (2, 3). Obdobně jako i u dalších arytmií je u FS dlouhodobá efektivita i nejúčinnějších antiarytmik, jako je amiodaron, nízká a závisí na typu arytmie a přidružených onemocněních. Ve studiích s nižší dávkou amiodaronu s nižším rizikem vedlejších účinků úspěšnost při udržení sinusového rytmu ukázala necelých 50 % (4, 5). Analýzou 812 pacientů z celkem šesti randomizovaných kontrolovaných studií s amiodaronem byla zjištěna průměrná účinnost na udržení sinusového rytmu 57,8 % (52,9–62,7 %) (6).
První nefarmakologickou možností léčby byly chirurgické zákroky v 80. letech 20. století. Wiliamsova izolace levé síně a Guiraudonova koridorová operace se však neprosadily (7, 8). Až koncem 80. let profesor Cox realizoval chirurgickými metodami komplexní systém lineárních a cirkulárních lézí v oblasti srdečních síní, tzv. „Maze‑procedure“ (maze = v angličtině bludiště, labyrint). Procedurou byly izolovány plicní žíly a přerušeny potenciální makro re‑entry okruhy a byl nastolen sinusový rytmus. Současně byla zachována kontraktilní funkce síní a normální převod vzruchu ze síní na komory (9). S dalšími modifikacemi v průběhu let dosahovala metoda trvalého sinusového rytmu u více než 80 % pacientů dle charakteru iniciální arytmie (10). Sama o sobě však vzhledem k technické i časové náročnosti a s nezanedbatelným rizikem extrakorporálního oběhu a pooperačního krvácení nedosáhla významného rozšíření, a to i vzhledem k rozvoji katétrové ablace (KA).
Od počátku devadesátých let se rychle rozvíjela KA, která spočívá v aplikaci radiofrekvenční energie (střídavého elektrického proudu o frekvenci 500–750 Hz) na hrot ablačního katétru vytvářející ablační léze na podkladě termálního poškození myokardu. FS je v současnosti nejčastěji ablovanou arytmií (11). Metodou volby je radiofrekvenční ablace (RFA) myokardu zejména levé síně (LS), kde umožňuje bezpečné vytvoření transmurálních, dobře ohraničených, dobře kontrolovatelných, přiměřeně velkých termálních ablačních lézí (12). Metoda je výrazně účinnější než farmakologické strategie a stala se metodou první volby v léčbě této arytmie (13–15). Postupně byla zapojena celá řada metod zvyšujících účinnost a bezpečnost RFA (16–21). KA byla následně doplněna dalšími technologiemi jako například kryoablace (22) či laserové ablace (23), které jsou obdobně jako RFA založené na termálním faktoru v tvorbě ablačních lézí. Recentně se do klinické praxe dostávají netermální ablační metody založené na efektu elektroporace (24–27).
Úspěšnost RFA u perzistující a zejména dlouhodobě perzistující FS však zůstává relativně nízká a pohybuje se mezi 50 až 73 % (17, 28–30, 31, 32). Často je však k trvalému nastolení sinusového rytmu nutno provést více než jeden výkon (33). Při relativní bezpečnosti katétrových ablací nelze pominout možné komplikace výkonu se zvyšujícím se rizikem u protrahovaných výkonů při léčbě perzistujících forem FS, z nichž nejzávažnější je cévní mozková příhoda (CMP) a vzácné, nicméně fatální poškození jícnu (atrioezofageální píštěl) (34). Nezanedbatelné je také procento „tichých“ cerebrálních lézí související s katétrovou ablací v levé síni (35, 36).
Propojením chirurgického a katetrizačního zákroku vzniká hybridní radiofrekvenční ablace kombinující výhody obou metod. Principem je epikardiální kardiochirurgické thorakoskopické vytvoření radiofrekvenčních ablačních lézí, jejichž efekt je následně zkontrolován během katétrové části výkonu. Sady lézí byly popsány řadou autorů (37–41). Jedná se o kombinaci epikardiálních a endokardiálních lézí, vedených cirkulárně a lineárně. K tvorbě lézí je využita radiofrekvenční, většinou bipolární epikardiální ablace thorakoskopickým přístupem při selektivní intubaci pacienta a střídavé ventilaci pouze jedné plíce. Katétrově (endokardiálně) probíhá následně kontrola a ev. doplnění lézí pomocí katétrové unipolární ablace. Sekvenční provedení obou výkonů během jednoho výkonu v jedné celkové anestezii se označuje jako „single stage procedure“. Jako „dual stage procedure“ je označován výkon, kdy je katétrová část provedena s odstupem 2–3 měsíců po chirurgické části ablace (42–44). Úspěšnost kombinovaných výkonů u perzistující a dlouhodobě perzistující FS je poměrně vysoká, nicméně vzhledem ke značné heterogenitě provedených studií jak co do techniky, tak do metodiky sledování referovaná úspěšnost značně kolísá (45, 39, 43, 46, 47). Dle metaanalýzy autorů Vroomen et al. z roku 2016 kolísá úspěšnost v rozmezí 61–87 % (45), recentní metaanalýza udává úspěšnost hybridních ablací 64–81 % (46). Některé práce prokazují i signifikantní zvýšení kvality života u pacientů po hybridní ablaci perzistující fibrilace síní (48). Vliv načasování obou částí hybridního výkonu na úspěšnost výkonu zůstává nejasný. Na základě retrospektivní analýzy některé práce uvádějí, že oba přístupy jsou rovnocenné (44–46). Recentní metaanalýza vyhodnotila double stage variantu výkonu jako úspěšnější než single stage hybridní ablace (úspěšnost 78 % (95 % CI, 67 % ± 88 %) versus 69 % (95 % CI, 53 % ± 83 %) (43). Práce Maesena et al. prokazuje 3letou úspěšnost single stage hybridní ablace dlouhodobě perzistující fibrilace síni v 79 % (49), nicméně definitivní potvrzení vyžaduje prospektivní, randomizované srovnání obou přístupů. O výhodách a nevýhodách obou přístupů by se dalo dlouze diskutovat, nicméně pravdou je, že v praxi se výrazně častěji uplatňuje dual stage varianta výkonu, a to z důvodů finančních (jedná se o dva samostatné výkony) a logistických (ne všude je k dispozici hybridní operační sál nutný pro single stage operaci). Cílem naší práce je popsat zkušenosti našeho pracoviště s pilotním souborem 50 pacientů s perzistující a dlouhodobě perzistující fibrilací síní řešených single stage hybridní ablací.
Metody
Do retrospektivního sledování byli zařazeni pacienti s perzistující, či dlouhodobě perzistující FS podstupující single stage hybridní ablaci na našem pracovišti. Jednalo se o pacienty se symptomatickou (EHRA 2+), perzistující fibrilací síní, po selhání alespoň jednoho antiarytmika. U všech pacientů proběhla v minulosti alespoň jedna elektrokardioverze (EKV) bez trvalého efektu.
Výkony probíhaly na hybridním sále Centra kardiovaskulární a transplantační chirurgie (CKTCH) Brno ve spolupráci s elektrofyziologickou skupinou I. interní kardio‑angiologické kliniky FNUSA v Brně. Komorbidity pacientů a jejich demografická data jsou uvedeny v tabulce 1. Užívaná antiarytmika a antikoagulace jsou vyznačena v tabulce 3.

Výkon nebyl indikován u pacientů s potenciálně reverzibilní fibrilací síní (např. thyreopatie). Kontraindikacemi výkonu byla nemožnost ventilace jednou plící (verifikováno spirometrií), extrémní nadváha (BMI +35), trombus v levé síni dle jícnového před výkonem či stav po předešlé operaci v oblasti perikardu či pleury (srůsty v perikardiální dutině).
Relativní kontraindikací výkonu byla ejekční frakce pod 30 %, věk nad 70 let, polymorbidita či extrémní dilatace LS (nad 75 mm). Další rizika plynoucí z komorbidit byla zvážena individuálně. U více než poloviny pacientů – 28 (53,8 %) – předcházela hybridnímu výkonu neúspěšná katétrová ablace (Tab. 1). Celkem 24 (46,2 %) pacientů mělo RFA de‑novo.
Chirurgická technika
Pro ablaci byl zaveden bilaterální totálně thorakoskopický přístup. Pomocí 3 portů vpravo zavedena kapnopleura, otevřen a vyvěšen perikard. Následně byla provedena izolace pravostranných plicních žil bipolárními RF kleštěmi (Atricure Synergy, Atricure, Ohio, USA), s opakováním 7–8krát. Pro stropní a inferiorní linie bylo využito buď pseudobipolární RF lineární pero „Atricure multifunctional linear pen“ (MLP), (Atricure, Ohio, USA) u 16/52 (30,8 %), nebo bipolární RF ablační systém Cobra Fusion 50 (Estech, Los Angeles, California, USA) u 36/52 pacientů (69,2 %). Obdobně z levostranných portů byla provedena izolace plicních žil vlevo, dokončeny a propojeny stropní a inferiorní linie. Vlevo též provedeno přerušení Marshallova ligamenta a následně byla provedena okluze ouška levé síně (Atriclip PRO 2, Atricure, Ohio, USA), a to pod kontrolou transezofageální echokardiografie (TEE).
K okluzi ouška levé síně bylo přistoupeno vzhledem k několika faktorům ovlivňujícím úspěšnost a rizika hybridní ablace. U pacientů po MAZE operaci s extrémně dilatovanou levou síní a často se vyskytující poruchou kontraktility levé síně při sinusovém rytmu snižuje uzávěr ouška riziko tromembolických příhod (50). Navíc uzávěr ouška levé síně zvyšuje šanci na udržení sinusového rytmu eliminací arytmií vycházejících ze svaloviny ouška, které nejsou zanedbatelné (51, 52). Chirurgická část výkonu byla prováděna v částečné heparinizaci s kontrolami ACT.
Katetrizační technika
Katétrová část výkonu přímo navazovala na fázi chirurgickou během jednoho výkonu a jedné celkové anestezie. Katétrová abace byla provedena za podpory 3D elektroanatomického mapovacího systému EnSite Precision (Abbott, Plymouth, Minnesota, USA) a v případě katétrové ablace byla tato provedena pomocí proplachového ablačního katétru TactiCath Quartz (Abbott, Plymouth, Minnesota, USA).
Sledování pacientů
Po propuštění byli pacienti sledováni arytmologickou ambulancí v běžném formátu kontrol po 3–6–12 měsících. Základem byla klinická ambulantní kontrola s výsledkem 24hodinového Holterova monitorování. Z kapacitních důvodů bylo prováděno 7denní monitorování smyčkovým EKG nahrávačem pouze u pacientů s podezřením na recidivu arytmie (53). Za recidivu FS bylo považováno zachycení fibrilace síní či postincisionální arytmie po dobu delší než 30 sekund jakýmkoliv způsobem (54, 55).
Výsledky
Padesát dva konsekutivních pacientů s perzistující či dlouhodobě perzistující FS podstoupilo single stage hybridní ablaci v období od 4/2016 do 3/2019.
Střední celkový čas výkonu byl 232 minut. Z toho střední čas chirurgické části výkonu byl 150 minut a čas EP části výkonu 82 minut. Výměna chirurgického týmu za tým katetrizační (včetně nezbytné výměny technického zázemí) trvala cca 30 minut. Střední doba hospitalizace byla 10 dnů.
Iniciální výkony (n = 26) chirurgické části měly střední dobu trvání 174 minut, katetrizační část 84 minut. U druhé poloviny pacientů (n = 26) z našeho souboru je doba chirurgické části výkonu 120 minut a katetrizační 80 minut. U většiny pacientů byla provedena okluze ouška levé síně (48/52 (92,3 %)). U čtyř pacientů okluze nebyla provedena z technických důvodů a v dalším průběhu nebyla okluze katetrizačním způsobem indikována. Další parametry výkonů viz tab. 2.

Katétrová část výkonu byla provedena u 50 pacientů, u dvou pacientů provedena nebyla. Důvodem byla u jednoho pacienta komplikace chirurgického výkonu (perforace síně s nutností přechodu do otevřené operace), u druhého pacienta byla příčinou porucha 3D mapovacího systému.
Dokončení chirurgické části katétrovým výkonem bylo nezbytné u 37 z 50 pacientů (71,15 %). Počet řešených gapů klesal s počtem předchozích katétrových ablací (tabulka 3).

Při katetrizaci podstoupilo EKV celkem 18 pacientů, u dalších 24 došlo k restituci SR již při chirurgické části, 10 pacientům spontánně restituoval sinusový rytmus při katétrové části.
Sledování pacientů po hybridní ablaci
První kontrola pacientů probíhala se středním časovým odstupem 61 dní po hybridní ablaci, druhá následovala s odstupem od výkonu 187 dnů.
Při první kontrole, realizované u 52 pacientů, prezentovalo SR 41 pacientů (85,4 %). Iniciální a poslední pacient odmítli sledování a docházeli pouze na extramurální kontroly. Dva pacienti do první kontroly zemřeli. Recidiva arytmie byla zachycena u sedmi pacientů, fibrilace síní byla zachycena u 4 pacientů, u dvou pacientů byla zachycena levosíňová postincizionální tachykardie – atypický flutter. U jednoho pacienta byl zachycen se zákrokem nesouvisející typický flutter, který byl řešen EKV a následně nerecidivoval.
Druhá kontrola proběhla u 44 pacientů, z toho trvající SR byl potvrzen u 38 (86,4 %). Další tři pacienti byli od první kontroly ztraceni ze sledování (dali přednost sledování v místě bydliště) a jeden pacient podstoupil reRFA. K datu druhé kontroly byla fibrilace síní zachycena celkem u 4 pacientů (u tří pacientů de‑novo) a atypický flutter u 2 pacientů (u jednoho pacienta de‑novo).
Celkově 8 pacientů bylo vyřazeno ze sledování (dvě úmrtí; u pěti pacientů nebyl získán souhlas ke sdílení dokumentace, současně nebyli sledováni cestou naší ambulance, s odkazem vzdálenosti od místa bydliště). Jeden pacient byl vyřazen z dalšího sledování po reRFA.
Celkově byla zaznamenána ve sledovaném období dvě úmrtí: u jednoho pacienta se jednalo o přímou komplikaci výkonu, u druhého o komplikaci na výkon navazující, avšak danou trombofilním stavem. Při půlroční kontrole byla většina pacientů pouze na betablokátorech, 2 pacienti zůstávali na propafenonu, tři pacienti na amiodaronu a jeden pacient měl digoxin. Dva ze sledovaných pacientů byli bez antiarytmik, všichni pacienti zůstali v šesti měsících i na antikoagulační terapii (Tabulka 4). Po dvanácti měsících zůstali na propafenonu a amiodaronu pouze dva, resp. tři pacienti. Majorita pacientů 34 z 44 zůstala pouze na betablokátorech. Devět pacientů bylo úplně bez antiarytmik.

Sledování komplikací po hybridní ablaci
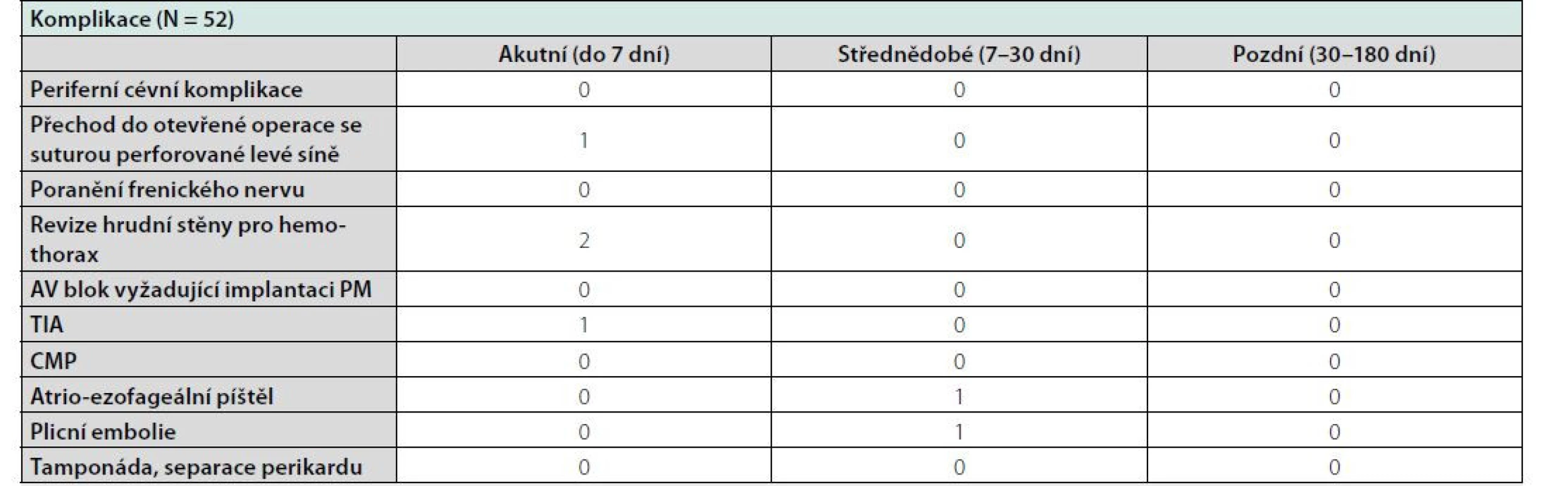
Vzhledem k charakteru výkonu je hybridní ablace zatížena akutními i pozdními komplikacemi. Za komplikaci nebyly považovány iniciální bolesti hrudníku, které udávala část pacientů z počátku projektu, a byly dány charakterem a velikostí instrumentária k podvazu ouška AtriClip (Atricure, Ohio, USA). Celkem 9 pacientů si stěžovalo na thorakalgie po 1. kontrole, u 6 z nich ustoupily po 1. kontrole, během druhé kontroly po 6 měsících u 3 pacientů trvaly thorakalgie až do 12 měsíců.
Tyto thorakalgie dobře reagovaly na běžná analgetika, s ústupem do šesti měsíců po výkonu. S úpravou instrumentária na AtriClip Pro (Atricure, Ohio, USA) se četnost thorakalgií výrazně snížila.
Jako komplikace byla hodnocena jednorázová perforace síně s nutností konvertovat thorakoskopický přístup do otevřené operace bez možnosti navazující katetrizace. Vzhledem k dlouhodobě stabilizovanému stavu bez arytmií nebyla původně plánovaná katetrizace s odstupem od chirurgické části provedena. Pacientka je dlouhodobě bez recidivy FS. Katetrizace k ověření optimálního výsledku chirurgické části nebyla indikována.
V jednom případě bylo třeba několik hodin po ukončení výkonu revidovat stěnu hrudní pro krvácení bez dalších komplikací.
V jednom případě proběhla za hospitalizace tranzitorní ischemická ataka s cerebelární symptomatologií s úplnou restitucí. Shodou okolností došlo k této komplikaci u pacienta s optimálním výsledkem chirurgické části výkonu bez nutnosti katétrové ablace. Od tohoto pacienta byla chirurgická část prováděna za plné heparinizace s kontrolami ACT. Celkem došlo ke dvěma úmrtím během sledování. V jednom případě došlo 7 dní po výkonu k masivní plicní embolii, s nejasným origem trombu, u pacienta s nerozpoznaným Leidenským syndromem, s fatálními následky 9 dní od proběhlé ablace. Od tohoto pacienta byli všichni pacienti striktně vyšetřováni na přítomnost Leidenské mutace a Leidenská mutace se stala kontraindikací hybridní ablace na našem pracovišti. V jednom případě se objevila 4 týdny po výkonu atrioezofageální píštěl s následným úmrtím pacienta, avšak již mimo 6měsíční období sledování (Tabulka 5).
Diskuze
Prezentovaná práce retrospektivně popisuje první soubor pacientů podstupujících hybridní ablaci pro perzistentní fibrilaci síní v jednom sezení provedenou v České republice. Soubor více než padesáti pacientů zařazuje tuto práci mezi středně velké studie. Většina studií se zabývala „dual stage“ hybridními ablacemi (největší studie mají kolem 100 pacientů) (37). V našem souboru se dosáhlo udržení SR u 86,4 % (n = 38/44). V obdobně velkých studiích byla popsána prakticky totožná úspěšnost např. 86 % v týmu prof. Pisona (40). Oproti dalším, i recentním studiím, bylo dosaženo lepší úspěšnosti (37, 44, 56, 57), ačkoliv demografické parametry studie odpovídají výše zmíněným pracím.
U některých studií zůstávají všichni pacienti po hybridní ablaci dlouhodobě na antiarytmicích (58), v dalších studiích je snaha o ukončení antiarytmik prezentována až u 90 % pacientů do 1 roku po provedení hybridní ablace (56, 59, 60). V našem souboru je na SR bez antiarytmik relativně malý počet 9 pacientů, kterým byla plně ukončena antiarytmika 20,5 % (9 ze 44), ev. při započítání pouze pacientů na SR 23,7 % (9 ze 38). A to zejména vzhledem k vysoké průměrné velikosti LS celkově 57,86 (± 11,03) mm, při relativně zachovalé průměrné EF LK 57 % (± 7,39). Tato čísla jsou stále významně optimističtější oproti procentům udržení SR u klasických endokardiálních výkonů pro perzistující FS, kde se pohybují mezi 45–80 % (30, 34, 61). Je však potřeba zmínit, že jmenovitě na propafenonu zůstali pouze dva pacienti a na amiodaronu tři. Zbývajících 34 pacientů má betablokátory, často i z indikace léčby hypertenze. Oproti dalším studiím byl zachycen obdobný počet FS, ačkoliv další práce prezentují převahu recidiv samotné FS (62). Počet postincizionálních arytmií byl oproti výše zmíněným studiím lehce nižší, což lze částečně přisoudit délce sledování.
V našem souboru jsme zaznamenali nižší celkový počet komplikací – celkově u 5 pacientů do sedmi dnů a jednoho pacienta mezi 7 a 30. dnem, procentuálně se jednalo o 11,5 %, což je více ve srovnání s pracemi jako Pison et al. (8 %), Gehi et al. (6 %), nicméně výrazně méně než např. ve srovnání s prací holandských autorů Boersma et al. ve studii FAST (34 % v chirurgické a 15 % v katétrové větvi studie) (63). Celkový počet komplikací byl srovnatelný s počty komplikací ve velkých studiích zaměřených na endokardiální ablace (Fire and ICE 10,1 % ve větvi radiofrekvenční ablace (64) a Cabana, kde bylo popsáno 7 % komplikací (65)). Nicméně naprostá většina komplikací u těchto studií byla klinicky nevýznamná.
Celkový počet komplikací a zejména thorakalgií byl vyšší než u prosté katétrové ablace či některých jiných prací zabývajících se hybridní ablací fibrilací síní. Nicméně s průběžnou optimalizací metodiky, vstupních a vylučovacích kritérií (např. testování na Leidenskou mutaci či heparinizace při chirurgické části výkonu) se riziko fatálních příhod dále výrazně snižuje.
Střední doba single stage hybridní ablace byla poměrně dlouhá 232 minut, což bylo dáno „learning curve“ zejména chirurgického týmu včetně výměny jednotlivých týmů a příslušné výměny technického vybavení, střední čas chirurgické části výkonu byl 150 minut.
Délka hospitalizace byla ve sledovaném souboru průměrně 10 dní, což odpovídá obdobným chirurgickým zákrokům.
U více než poloviny pacientů – 28 (53,8 %) předcházela hybridnímu výkonu neúspěšná katétrová ablace. Tuto skutečnost je potřeba vidět ve světle zkušeností s katetrizační ablací, kdy opakovaný výkon zvyšuje významně úspěšnost ablace u perzistující nebo dlouhodobě perzistující FS.
Důležitým aspektem limitujícím hybridní přístupy je vysoká efektivita nově zaváděných katetrizačních přístupů s pomocí stejnosměrného a střídavého pulzního pole (25, 27), s optimálními výsledky u nekomplikovaných paroxyzmálních arytmií. Několikaletá účinnost však u těchto přístupů nemá zatím odpovídající data.
Limitace práce
Jedná se o pilotní skupinu pěti desítek pacientů, což je počet odpovídající většině studií hybridních ablací, jde však stále o počet, na kterém lze komplexní dopady pouze omezeně zobecnit. Soubor pacientů byl poměrně nehomogenní, stran předešlých ablačních výkonů. V souboru bylo 28 pacientů po jedné či více předešlých ablacích, což může ovlivnit prezentované výsledky. Řada pacientů měla extrémně dilatovanou levou síň. 13 pacientů prezentovalo velikost LS nad 65 mm s nízkou očekávanou úspešností konvenčního katétrového přístupu. Maximální zachycený rozměr LS byl 80 mm. Při šestiměsíční kontrole se podařilo získat informace od 48 pacientů z celé kohorty 52 pacientů, další 4 pacienti vypadli ze sledování nebo nedokončili půlroční kontrolu. Další limitací je omezená dostupnost vícedenních smyčkových nahrávačů v době realizace studie, nelze tedy zachytit všechny případné paroxyzmy FS, které mohly u pacientů proběhnout. Thorakalgie časně navazující na zákrok se vyskytly u 12,5 % (6 ze 48) pacientů, obdobně při půlroční kontrole viz výše, avšak vzhledem k jejich absenci u druhé poloviny pacientů je lze obtížně hodnotit vzhledem k úpravám v instrumentáriu dodavatele.
Závěr
Hybridní RFA je účinná metoda v léčbě perzistující a dlouhodobě perzistující fibrilace síní se střednědobou úspěšností blížící se 90 %. Riziko komplikací a zejména závažných, život ohrožujících komplikací, je vyšší než u prosté katétrové ablace. Vyšší riziko kombinovaného výkonu je vyváženo vyšší úspěšností u pacientů s těmito jinak obtížně řešitelnými formami fibrilace síní. V současné době je tato metoda vyhrazena pro pacienty s perzistující a dlouhodobě perzistující FS vzhledem k dostatečné efektivitě prosté katétrové ablace u pacientů s paroxyzmální formou této arytmie. Postavení single stage a double stage varianty výkonu zatím není ujasněno a čeká se na randomizovanou prospektivní studii.
Podpořeno projektem Enoch, Evropského fondu pro regionální rozvoj (CZ.02. 1. 01/0.0/0.0/16_019/0000868) a projektem specifického výzkumu Lékařské fakulty Masarykovy univerzity „Nové zobrazovací, výpočetní a analytické metody v diagnostice a monitoraci kardiovaskulárních onemocnění“ (MUNI/A/1462/2021).
Autoři děkují klinickým týmům elektrofyziologie I. IKAK a CKTCH za podporu v přípravě zavedení nové metody a další realizaci.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Zdeněk Stárek, Ph.D.
I. interní kardioangiologická klinika, Fakultní nemocnice u sv. Anny v Brně
Pekařská 53, 656 91, Brno
Cit. zkr: Vnitř Lék. 2022;68(5):E20-E26
Článek přijat redakcí: 29. 4. 2022
Článek přijat po recenzích: 6. 6. 2022
Sources
1. Khurshid S, Choi SH, Weng LC, Wang EY, Trinquart L, Benjamin EJ et al. Frequency of Cardiac Rhythm Abnormalities in a Half Million Adults. Circ Arrhythm Electrophysiol. 2018;11(7):e006273.
2. Chugh SS, Havmoeller R, Narayanan K, Singh D, Rienstra M, Benjamin EJ et al. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation. 2014 Feb 25;129(8):837-47.
3. Colilla S, Crow A, Petkun W, Singer DE, Simon T, Liu X. Estimates of current and future incidence and prevalence of atrial fibrillation in the U.S. adult population. Am J Cardiol. 2013 Oct 15;112(8):1142-7.
4. Gosselink AT, Crijns HJ, Van Gelder IC, Hillige H, Wiesfeld AC, Lie KI. Low‑dose amiodarone for maintenance of sinus rhythm after cardioversion of atrial fibrillation or flutter. JAMA. 1992 Jun 24;267(24):3289-93.
5. Kerin NZ, Faitel K, Kerin IA, Quinones L, Stomel RJ. Efficacy of low‑dose amiodarone in the prevention of paroxysmal atrial fibrillation resistant to type IA antiarrhythmic drugs. Am J Ther. 2000 Aug;7(4):245-50.
6. Valembois L, Audureau E, Takeda A, Jarzebowski W, Belmin J, Lafuente‑Lafuente C. Antiarrhythmics for maintaining sinus rhythm after cardioversion of atrial fibrillation. Cochrane Database Syst Rev. 2019 Sep 4;9:CD005049.
7. Guiraudon GM, Klein GJ, Sharma AD, Yee R. Surgical alternatives for supraventricular tachycardias. Am J Cardiol. 1989 Dec 5;64(20):92 J-96J.
8. Williams JM, Ungerleider RM, Lofland GK, Cox JL. Left atrial isolation: new technique for the treatment of supraventricular arrhythmias. J Thorac Cardiovasc Surg. 1980 Sep;80(3):373-80.
9. Cox JL, Boineau JP, Schuessler RB, Ferguson TB, Cain ME, Lindsay BD et al. Operations for atrial fibrillation. Clin Cardiol. 1991 Oct;14(10):827-34.
10. Ad N, Henry L, Hunt S, Barnett S, Stone L. The Cox‑Maze III procedure success rate: comparison by electrocardiogram, 24-hour holter monitoring and long‑term monitoring. Ann Thorac Surg. 2009 Jul;88(1):101-5.
11. Calkins H, Hindricks G, Cappato R, Kim YH, Saad EB, Aguinaga L et al. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation: Executive summary. Eur Eur Pacing Arrhythm Card Electrophysiol J Work Groups Card Pacing Arrhythm Card Cell Electrophysiol Eur Soc Cardiol. 2018 01;20(1):157-208.
12. Nath S, DiMarco JP, Haines DE. Basic aspects of radiofrequency catheter ablation. J Cardiovasc Electrophysiol. 1994 Oct;5(10):863-76.
13. Calkins H, Kuck KH, Cappato R, Brugada J, Camm AJ, Chen SA et al. 2012 HRS/EHRA/ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for patient selection, procedural techniques, patient management and follow‑up, definitions, endpoints, and research trial design. J Interv Card Electrophysiol. 2012 Mar 1;33(2):171-257.
14. Jones DG, Haldar SK, Hussain W, Sharma R, Francis DP, Rahman‑Haley SL et al. A randomized trial to assess catheter ablation versus rate control in the management of persistent atrial fibrillation in heart failure. J Am Coll Cardiol. 2013 May 7;61(18):1894-903.
15. Wilber DJ, Pappone C, Neuzil P, De Paola A, Marchlinski F, Natale A et al. Comparison of antiarrhythmic drug therapy and radiofrequency catheter ablation in patients with paroxysmal atrial fibrillation: a randomized controlled trial. JAMA. 2010 Jan 27;303(4):333-40.
16. Haldar S, Jarman JWE, Panikker S, Jones DG, Salukhe T, Gupta D et al. Contact force sensing technology identifies sites of inadequate contact and reduces acute pulmonary vein reconnection: a prospective case control study. Int J Cardiol. 2013 Sep 30;168(2):1160-6.
17. Lehar F, Starek Z, Jez J, Novak M, Wolf J, Stepanova R et al. Comparison of clinical outcomes and safety of catheter ablation for atrial fibrillation supported by data from CT scan or three‑dimensional rotational angiogram of left atrium and pulmonary veins. Biomed Pap Med Fac Univ Palacky Olomouc Czechoslov. 2015 Dec;159(4):622-8.
18. Lin T, Ouyang F, Kuck KH, Tilz R. THERMOCOOL® SMARTTOUCH® CATHETER – The Evidence So Far for Contact Force Technology and the Role of VISITAGTM MODULE. Arrhythmia Electrophysiol Rev. 2014 květen;3(1):44-7.
19. Starek Z, Lehar F, Jez J, Scurek M, Wolf J, Kulik T et al. Esophageal positions relative to the left atrium; data from 293 patients before catheter ablation of atrial fibrillation. Indian Heart J. 2018 Feb;70(1):37-44.
20. Wolf J, Starek Z, Jez J, Lehar F, Lukasova M, Kulik T et al. Rotational angiography of left ventricle to guide ventricular tachycardia ablation. Int J Cardiovasc Imaging. 2015 Jun;31(5):899-904.
21. Jadczyk T, Wolf J, Pesl M, Soucek F, Lehar F, Jez J et al. Reduced Radiation Exposure Protocol during Computer Tomography of the Left Atrium Prior to Catheter Ablation in Patients with Atrial Fibrillation. Diagn Basel Switz. 2022 Mar 1;12(3):612.
22. Nölker G, Heintze J, Gutleben KJ, Muntean B, Pütz V, Yalda A et al. Cryoballoon Pulmonary Vein Isolation Supported by Intracardiac Echocardiography: Integration of a Nonfluoroscopic Imaging Technique in Atrial Fibrillation Ablation. J Cardiovasc Electrophysiol. 2010;21(12):1325-30.
23. Weber H, Sagerer‑Gerhardt M, Heinze A. Laser catheter ablation of long - lasting persistent atrial fibrillation: Longterm results. J Atr Fibrillation. 2017 Aug 31;10(2):1588.
24. Reddy VY, Koruth J, Jais P, Petru J, Timko F, Skalsky I et al. Ablation of Atrial Fibrillation With Pulsed Electric Fields: An Ultra‑Rapid, Tissue‑Selective Modality for Cardiac Ablation. JACC Clin Electrophysiol. 2018 Aug;4(8):987-95.
25. Wojtaszczyk A, Caluori G, Pešl M, Melajova K, Stárek Z. Irreversible electroporation ablation for atrial fibrillation. J Cardiovasc Electrophysiol. 2018 Apr;29(4):643-51.
26. Loh P, van Es R, Groen MHA, Neven K, Kassenberg W, Wittkampf FHM et al. Pulmonary Vein Isolation With Single Pulse Irreversible Electroporation: A First in Human Study in 10 Patients With Atrial Fibrillation. Circ Arrhythm Electrophysiol. 2020 Oct;13(10):e008192.
27. Kawamura I, Neuzil P, Shivamurthy P, Kuroki K, Lam J, Musikantow D et al. How does the level of pulmonary venous isolation compare between pulsed field ablation and thermal energy ablation (radiofrequency, cryo, or laser)? Eur Eur Pacing Arrhythm Card Electrophysiol J Work Groups Card Pacing Arrhythm Card Cell Electrophysiol Eur Soc Cardiol. 2021 Nov 8;23(11):1757-66.
28. Hummel J, Michaud G, Hoyt R, DeLurgio D, Rasekh A, Kusumoto F et al. Phased RF ablation in persistent atrial fibrillation. Heart Rhythm. 2014 Feb 1;11(2):202-9.
29. Mont L, Bisbal F, Hernández‑Madrid A, Pérez‑Castellano N, Viñolas X, Arenal A et al. Catheter ablation vs. antiarrhythmic drug treatment of persistent atrial fibrillation: a multicentre, randomized, controlled trial (SARA study). Eur Heart J. 2014 Feb;35(8):501-7.
30. Verma A, Jiang C yang, Betts TR, Chen J, Deisenhofer I, Mantovan R et al. Approaches to Catheter Ablation for Persistent Atrial Fibrillation. N Engl J Med. 2015 May 7;372(19):1812-22.
31. Scott PA, Silberbauer J, Murgatroyd FD. The impact of adjunctive complex fractionated atrial electrogram ablation and linear lesions on outcomes in persistent atrial fibrillation: a meta‑analysis. Eur Eur Pacing Arrhythm Card Electrophysiol J Work Groups Card Pacing Arrhythm Card Cell Electrophysiol Eur Soc Cardiol. 2016 Mar;18(3):359-67.
32. Jez J, Jadczyk T, Lehar F, Pesl M, Kulik T, Belaskova S et al. Comparison of atrial fibrillation ablation efficacy using remote magnetic navigation vs. manual navigation with contact‑force control. Biomed Pap Med Fac Univ Palacky Olomouc Czechoslov. 2019 Oct 10;
33. Calkins H, Reynolds MR, Spector P, Sondhi M, Xu Y, Martin A et al. Treatment of atrial fibrillation with antiarrhythmic drugs or radiofrequency ablation: two systematic literature reviews and meta‑analyses. Circ Arrhythm Electrophysiol. 2009 Aug;2(4):349-61.
34. Cappato R, Calkins H, Chen SA, Davies W, Iesaka Y, Kalman J et al. Updated worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circ Arrhythm Electrophysiol. 2010 Feb;3(1):32-8.
35. DeSimone CV, Madhavan E, Ebrille S, Rabinstein AA, Friedman PA, Asirvatham SJ. Atrial Fibrillation and Stroke – Increasing Stroke Risk With Intervention. J Atr Fibrillation. 2013 Dec;6(4):966.
36. Gaita F, Leclercq JF, Schumacher B, Scaglione M, Toso E, Halimi F et al. Incidence of silent cerebral thromboembolic lesions after atrial fibrillation ablation may change according to technology used: comparison of irrigated radiofrequency, multipolar nonirrigated catheter and cryoballoon. J Cardiovasc Electrophysiol. 2011 Sep;22(9):961-8.
37. Gehi AK, Mounsey JP, Pursell I, Landers M, Boyce K, Chung EH et al. Hybrid epicardial‑endocardial ablation using a pericardioscopic technique for the treatment of atrial fibrillation. Heart Rhythm. 2013 Jan;10(1):22-8.
38. Mahapatra S, LaPar DJ, Kamath S, Payne J, Bilchick KC, Mangrum JM et al. Initial experience of sequential surgical epicardial‑catheter endocardial ablation for persistent and long‑standing persistent atrial fibrillation with long‑term follow‑up. Ann Thorac Surg. 2011 Jun;91(6):1890-8.
39. Muneretto C, Bisleri G, Rosati F, Krakor R, Giroletti L, Di Bacco L et al. European prospective multicentre study of hybrid thoracoscopic and transcatheter ablation of persistent atrial fibrillation: the HISTORIC‑AF trial. Eur J Cardio‑Thorac Surg Off J Eur Assoc Cardio‑Thorac Surg. 2017 Oct 1;52(4):740-5.
40. Pison L, Gelsomino S, Lucà F, Parise O, Maessen JG, Crijns HJGM et al. Effectiveness and safety of simultaneous hybrid thoracoscopic and endocardial catheter ablation of lone atrial fibrillation. Ann Cardiothorac Surg. 2014 Jan;3(1):38-44.
41. Toplisek J, Pernat A, Ruzic N, Robic B, Sinkovec M, Cvijic M et al. Improvement of Atrial and Ventricular Remodeling with Low Atrial Fibrillation Burden after Hybrid Ablation of Persistent Atrial Fibrillation. Pacing Clin Electrophysiol PACE. 2016 Mar;39(3):216-24.
42. Kurfirst V, Mokraček A, Bulava A, Čanadyova J, Haniš J, Pešl L. Two‑staged hybrid treatment of persistent atrial fibrillation: short‑term single‑centre results. Interact Cardiovasc Thorac Surg. 2014 Apr;18(4):451-6.
43. Phan K, Pison L, Wang N, Kanagaratnam A, Yan TD, Maesen B et al. Effectiveness and safety of simultaneous hybrid thoracoscopic endocardial catheter ablation of atrial fibrillation in obese and non‑obese patients. J Thorac, DiS. 2017 z;9(9):3087-3096-3096.
44. Richardson TD, Shoemaker MB, Whalen SP, Hoff SJ, Ellis CR. Staged versus Simultaneous Thoracoscopic Hybrid Ablation for Persistent Atrial Fibrillation Does Not Affect Time to Recurrence of Atrial Arrhythmia. J Cardiovasc Electrophysiol. 2016 Apr;27(4):428-34.
45. Vroomen M, Pison L. Hybrid ablation for atrial fibrillation: a systematic review. J Interv Card Electrophysiol. 2016 Dec 1;47(3):265-74.
46. Jiang YQ, Tian Y, Zeng LJ, He SN, Zheng ZT, Shi L, et al. The safety and efficacy of hybrid ablation for the treatment of atrial fibrillation: A meta‑analysis. PloS One. 2018;13(1):e0190170.
47. Pojar M, Haman L, Parizek P, Myjavec A, Gofus J, Vojacek J. Midterm outcomes of mini‑invasive surgical and hybrid ablation of atrial fibrillation. Biomed Pap Med Fac Univ Palacky Olomouc Czechoslov. 2019 Sep;163(3):233-40.
48. Osmancik P, Budera P, Talavera D, Herman D, Vesela J, Prochazkova R et al. Improvement in the quality of life of patients with persistent or long‑standing persistent atrial fibrillation after hybrid ablation. J Interv Card Electrophysiol. 2020 Apr 1;57(3):435-42.
49. Maesen B, Pison L, Vroomen M, Luermans JG, Vernooy K, Maessen JG et al. Three‑year follow‑up of hybrid ablation for atrial fibrillation. Eur J Cardiothorac Surg. 2018 Apr 1;53(suppl_1):i26-32.
50. Buber J, Luria D, Sternik L, Raanani E, Feinberg MS, Goldenberg I et al. Left atrial contractile function following a successful modified Maze procedure at surgery and the risk for subsequent thromboembolic stroke. J Am Coll Cardiol. 2011 Oct 4;58(15):1614-21.
51. Di Biase L, Burkhardt JD, Mohanty P, Sanchez J, Mohanty S, Horton R et al. Left atrial appendage: an underrecognized trigger site of atrial fibrillation. Circulation. 2010 Jul 13;122(2):109-18.
52. Santangeli P, Zado ES, Hutchinson MD, Riley MP, Lin D, Frankel DS et al. Prevalence and distribution of focal triggers in persistent and long‑standing persistent atrial fibrillation. Heart Rhythm. 2016 Feb;13(2):374-82.
53. Chovančík J, Bulková V, Fiala M, Gandalovičová J, Královec S, Neuwirth R et al. [A comparison of two methods of long‑term external ECG telemonitoring in patients after ablation for atrial fibrillation]. Vnitr Lek. 2012 Sep;58(9):633-9.
54. Kirchhof P, Benussi S, Kotecha D, Ahlsson A, Atar D, Casadei B et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016 Oct 7;37(38):2893-962.
55. G H, T P, N D, E A, Jj B, C BL et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio‑Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J [Internet]. 2021 Jan 2 [cited 2021 Dec 9];42(5). Available from: https://pubmed.ncbi.nlm.nih.gov/32860505/
56. Zembala M, Filipiak K, Kowalski O, Boidol J, Sokal A, Lenarczyk R et al. Minimally invasive hybrid ablation procedure for the treatment of persistent atrial fibrillation: one year results. Kardiol Pol. 2012;70(8):819-28.
57. Gersak B, Pernat A, Robic B, Sinkovec M. Low rate of atrial fibrillation recurrence verified by implantable loop recorder monitoring following a convergent epicardial and endocardial ablation of atrial fibrillation. J Cardiovasc Electrophysiol. 2012 Oct;23(10):1059-66.
58. Bisleri G, Rosati F, Bontempi L, Curnis A, Muneretto C. Hybrid approach for the treatment of long‑standing persistent atrial fibrillation: electrophysiological findings and clinical results. Eur J Cardio‑Thorac Surg Off J Eur Assoc Cardio‑Thorac Surg. 2013 Nov;44(5):919-23.
59. Zembala M, Filipiak K, Kowalski O, Buchta P, Niklewski T, Nadziakiewicz P et al. Staged hybrid ablation for persistent and longstanding persistent atrial fibrillation effectively restores sinus rhythm in long‑term observation. Arch Med Sci AMS. 2017 Feb 1;13(1):109-17.
60. Krul SPJ, Driessen AHG, van Boven WJ, Linnenbank AC, Geuzebroek GSC, Jackman WM et al. Thoracoscopic video‑assisted pulmonary vein antrum isolation, ganglionated plexus ablation, and periprocedural confirmation of ablation lesions: first results of a hybrid surgical‑electrophysiological approach for atrial fibrillation. Circ Arrhythm Electrophysiol. 2011 Jun;4(3):262-70.
61. Tilz RR, Rillig A, Thum AM, Arya A, Wohlmuth P, Metzner A et al. Catheter Ablation of Long‑Standing Persistent Atrial Fibrillation: 5-Year Outcomes of the Hamburg Sequential Ablation Strategy. J Am Coll Cardiol. 2012 Nov 6;60(19):1921-9.
62. Al‑Jazairi MIH, Rienstra M, Klinkenberg TJ, Mariani MA, Van Gelder IC, Blaauw Y. Hybrid atrial fibrillation ablation in patients with persistent atrial fibrillation or failed catheter ablation. Neth Heart J Mon J Neth Soc Cardiol Neth Heart Found. 2019 Mar;27(3):142-51.
63. Boersma LVA, Castella M, van Boven W, Berruezo A, Yilmaz A, Nadal M et al. Atrial fibrillation catheter ablation versus surgical ablation treatment (FAST): a 2-center randomized clinical trial. Circulation. 2012 Jan 3;125(1):23-30.
64. Kuck KH, Brugada J, Fürnkranz A, Metzner A, Ouyang F, Chun KRJ et al. Cryoballoon or Radiofrequency Ablation for Paroxysmal Atrial Fibrillation. N Engl J Med. 2016 Jun 9;374(23):2235-45.
65. Packer DL, Mark DB, Robb RA, Monahan KH, Bahnson TD, Poole JE et al. Effect of Catheter Ablation vs Antiarrhythmic Drug Therapy on Mortality, Stroke, Bleeding, and Cardiac Arrest Among Patients With Atrial Fibrillation: The CABANA Randomized Clinical Trial. JAMA. 2019 02;321(13):1261-74.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2022 Issue E-5
-
All articles in this issue
- IgG4-related disease. Clinical manifestation differential diagnosis and recent International Diagnostic Criteria for IgG4-related disease
- Mid-term success rate of single stage hybrid ablation of persistent and long-term persistent atrial fibrillation
- Critical Appraisal of Guidelines in Internal Medicine Working Group
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- IgG4-related disease. Clinical manifestation differential diagnosis and recent International Diagnostic Criteria for IgG4-related disease
- Mid-term success rate of single stage hybrid ablation of persistent and long-term persistent atrial fibrillation
- Critical Appraisal of Guidelines in Internal Medicine Working Group
