Liddleův syndrom
Liddle syndrome
Liddle syndrome is an inherited form of arterial hypertension with autosomal dominant pattern of inheritance. It is caused by activating mutation of genes coding of the epithelial sodium channel in distal nephron. Mutation leads to excessive reabsorbtion of sodium ions and volume expansion resulting in arterial hypertension. Antoher typical laboratory findings are hypokalaemia, low levels of serum aldosteron and metabolic alkalosis. Phenotypic variability makes it difficult to identify patients with Liddle syndrome, often resulting in misdiagnosis and severe complications at early age. Genetic studies should be done to confirm the diagnosis. Therapy of Liddle syndrome is based on administration of epithelial sodium channel blocker amilorid.
Keywords:
Aldosterone – arterial hypertension – hypokalaemia – amilorid – epithelial sodium channel – Liddle syndrome – NEDD4
Authors:
Štěpán Mareš; Jan Filipovský
Authors‘ workplace:
II. interní klinika LF UK a FN Plzeň
Published in:
Vnitř Lék 2022; 68(E-8): 8-11
Category:
Review Articles
doi:
https://doi.org/10.36290/vnl.2022.115
Overview
Liddleův syndrom je dědičná forma arteriální hypertenze s autozomálně dominantním typem dědičnosti. Je způsoben aktivační mutací genů kódujících epiteliální sodíkový kanál v distálním nefronu. Důsledkem mutace kanálu je zvýšená resorpce sodíkových iontů a volumová expanze rezultující v arteriální hypertenzi. Dalším typickým nálezem je hypokalemie, nízká hladina aldosteronu a metabolická alkalóza. Interindividuální variabilita těchto projevů činí diagnostiku nemoci obtížnou a neadekvátní léčba hypertenze může vést k časným orgánovým komplikacím již v mladém věku. K definitivnímu potvrzení diagnózy je zapotřebí genetické vyšetření potvrzující mutaci. Terapie je založena na podávání blokátoru epiteliálního sodíkového kanálu amiloridu.
Klíčová slova:
arteriální hypertenze – hypokalémie – aldosteron – amilorid – epiteliální sodíkový kanál – Liddleův syndrom – NEDD4
Epidemiologie
Ačkoli je Liddleův syndrom považován za poměrně vzácné onemocnění, jeho přesná prevalence není známa. Vzhledem k nutnosti provedení genetického vyšetření k potvrzení diagnózy, které se však v praxi rutině neprovádí, lze očekávat, že prevalence je ve skutečnosti podhodnocena. Lze si představit, že většina pacientů s Liddleovým syndromem je vedena jako rezistentní hypertonici, aniž by se pomýšlelo na možnou dědičnou formu hypertenze. Důvodů může být několik. Rozvoj hypertenze až v dospělém věku nebudí takové podezření na možnou genetickou poruchu jako hypertenze manifestovaná v dětství a například těžká hypokalemie jako jeden z doprovodných projevů se zdaleka nevyskytuje u všech pacientů s LS. Hypokalemie v případě pacientů již užívajících diuretika může být navíc brána jako léčbou indukovaná.
Skutečná prevalence LS v populaci není známa. Bylo provedeno několik studií v čínské populaci hypertoniků s různou další mírou selekce vyšetřovaných jedinců (přítomnost hypokalemie, časná manifestace hypertenze atd.). Prevalence Liddleova syndromu se pohybovala kolem 1,5 %. Studie na bělošské populaci provedeny nebyly (1, 2).
Epiteliální sodíkový kanál (ENaC)
Epiteliální sodíkový kanál je vysoce selektivní pro sodné ionty. Nachází se na luminální straně epiteliálních buněk různých tkání (střevo, plíce, ledviny) a resorpcí natria ovlivňuje extracelulární volum. Například v ciliárních buňkách dýchacích cest je správná funkce kanálu nezbytná k tvorbě sekretu a mukociliární clearance. ENaC v ledvinách zajišťuje zpětnou resorpci natria z moči, čímž zvyšuje volum extracelulární tekutiny.
Kanál se skládá z 3 podjednotek – alfa, beta a gamma. Podjednotky spolu v poměru 1 : 1 : 1 tvoří heterotrimer a každá z nich se skládá z extracelulární smyčky, dvou transmembránových jednotek a cytoplazmatického C - a N - konce (3, 4) (Obr. 1).
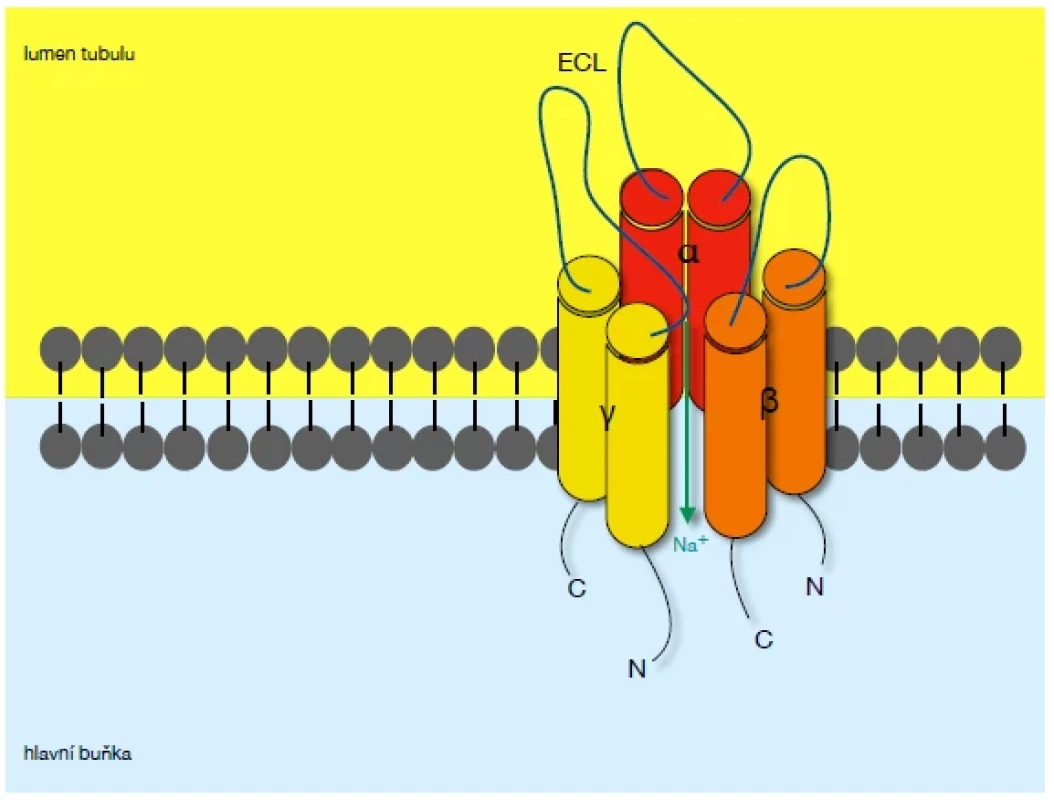
Sodíkové ionty jsou kanálem resorbovány z moči do hlavní buňky tubulu.
Patogeneze
V patogenezi LS hraje rozhodující úlohu funkce kanálu lokalizovaného v ledvinách. Nachází se na luminální straně hlavních tubulárních buněk v distálních částech nefronu a jeho funkcí je resorpce natria z moči. Exprese kanálu je regulována aldosteronem jakožto finálním efektorem osy renin‑angiotenzin‑aldosterton (RAAS). Fyziologická aktivace RAAS vede k udržení volumu a krevního tlaku. Aldosteron se váže na mineralokortikoidní jaderný receptor, což spouští kaskádu dějů vedoucí k inhibici ubikvitinázy NEDD4, která by za normálních okolností snižovala počet aktivních kanálů procesem ubikvitinace a následné internalizace. Tímto mechanismem aldosteron přispívá k vyššímu počtu aktivních kanálu na membráně vedoucí ke zvýšené resorpci natria (5, 6).
Naopak v případě, kdy není volumová expanze žádoucí, hladina aldosteronu klesá – nedochází k inhibici NEDD4 skrze aldosteron – kanál je ve zvýšené míře degradován a resorpce natria klesá.
Tato rovnováha fungující na základě zpětnovazebných mechanismů je typicky narušena u primárního aldosteronismu, kdy dochází k neregulované nadprodukci aldosteronu.
U LS však dochází k nadměrné aktivitě kanálu i bez přítomnosti vysokých hladin aldosteronu. Jak je to možné?
Mutovaný ENaC postrádá kritické sekvence aminokyselin podjednotek beta nebo gamma, na které by se ubikvitináza NEDD4 navázala. ENaC nemůže být označen k degradaci a je tak narušena jeho zpětnovazebná regulace. Výsledkem je vysoké množství aktivních kanálů na membráně i přes nízké hladiny aldosteronu. Dochází ke zvýšené resorpci sodíku z moči se všemi z toho plynoucími konsekvencemi podobně jako u hyperaldosteronismu. Proto je někdy LS nazýván pseudohyperaldosteronismem. Klinický obraz imituje primární hyperaldosteronismus, na rozdíl od něj jsou však u LS hladiny aldosteronu v krvi nízké (7).
Základní charakteristika LS je následující:
- zvýšenou resorpcí natria dochází k volumové expanzi a hypertenzi,
- zpětnovazebně dochází k supresi produkce reninu a aldosteronu,
- zvýšené vstřebávání natria favorizuje exkreci kalia a následně i protonů. Rozvíjí se hypokalemie a metabolická alkalóza.
Klinický obraz
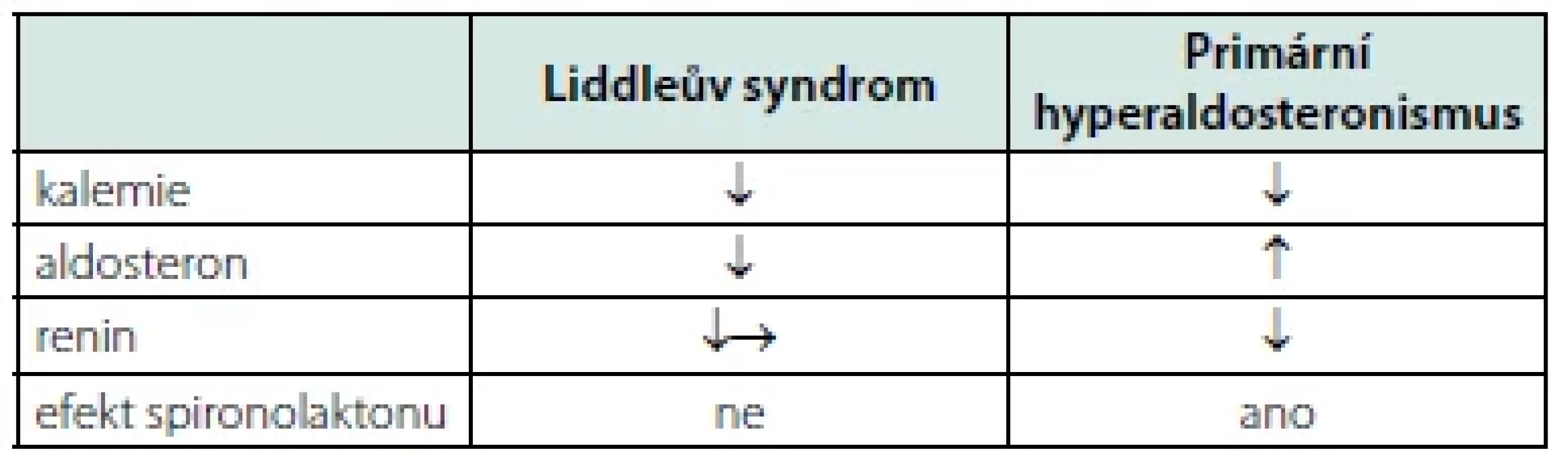
Typický pacient s Liddleovým syndromem je hypertonik s anamnézou vysokého krevního tlaku již od dětství či časné dospělosti. Hypertenze je u něj obtížně kontrolovaná navzdory kombinované antihypertenzní léčbě. V krvi bychom u něj nalezli různě vyjádřenou hypokalemii, snížený aldosteron a renin. Poměr aldosteron/renin (ARR) nebude na rozdíl od primárního aldosteronismu zvýšený. Při vyšetření ABR bychom zjistili metabolickou alkalózu. Vzhledem k tomu, že Liddleův syndrom je dědičné onemocnění, patrně by nám pacient při odebírání anamnézy prozradil, že jeden z rodičů má také dlouhá léta diagnostikovanou hypertenzi anebo hůře – již podlehl některé z komplikací dlouhodobě zvýšeného krevního tlaku, například iktu.
Jak tomu však bývá, pacienti stonají podle učebnice málokdy. A tak nacházíme různou variabilitu výskytu klinických a laboratorních abnormit u konkrétního jedince, tvořící různě závažný výsledný fenotyp nemoci: od mírného zvýšení TK u dospělého jedince po těžkou rezistentní hypertenzi s život ohrožující hypokalemií u dítěte.
Arteriální hypertenze
Arteriální hypertenze je nejčastější manifestací Liddleova syndromu a je přítomna u více než 90 % postižených jedinců (7). Manifestuje se většinou již v mladém věku. Je zajímavým faktem, že někteří pacienti s genotypem Liddleova syndromu vlastně nemají vyjádřený fenotyp, jehož hlavním projevem je vysoký krevní tlak. Bývají to osoby mladší, u kterých zřejmě převyšují regulační mechanismy proti rozvoji hypertenze. S přibývajícím věkem začnou převažovat prohypertenzní vlivy jako stárnutí tepen, progrese aterosklerózy aj., které jsou zodpovědné za rozvoj esenciální hypertenze. Na druhou stranu jsou známy případy těžké hypertenze u dětí v předškolním věku (8).
Pacienti s rozvinutou hypertenzí se dále významně liší v její tíži. Od lehké hypertenze s TK málo přes 140/90 mm Hg po těžké hypertoniky s TK přes 200/120 mm Hg a časnými orgánovými komplikacemi.
Nebyl prokázán vliv konkrétní mutace na výsledný fenotyp a rovněž platí, že existuje významná variabilita příznaků v rámci jedné rodiny nesoucí stejnou mutaci (9).
Hypokalemie a metabolická alkalóza (MAL)
Hypokalemie definovaná jako K < 3,5 mmol/l je popisována jako 2. nejčastější projev LS (7). Její výskyt je však znatelně vyšší v čínské populaci, u které je popisována většina literárních případů Liddleova syndromu. V evropské a americké populaci zdaleka tak častá není. Prevalence kolísá kolem 50–75 % případů (10). Hypokalemie se rozvíjí na podkladě zvýšené exkrece draselných iontů do moči. K té dochází kvůli zvyšující se elektronegativitě lumen vlivem resorpce Na+. Draselné ionty tímto mechanismem udržují elektroneutralitu moči za cenu rozvoje hypokalemie. Vylučování kalia je zprostředkováno kanály ROMK a BK. Spolu s K+ dochází i k exkreci H+ resultující v metabolickou alkalózu (11).
Nízká hladina aldosteronu a reninu
Až doposud jsou atributy Liddleova syndromu a nejčastější formy sekundární hypertenze, primárního aldosteronismu, podobné. Co je odlišuje, je hladina aldosteronu. Zatímco vysoká hladina aldosteronu, respektive ARR, jsou diagnostickým kritériem pro primární hyperaldosteronismus, u Liddleova syndromu nacházíme naopak hladiny aldosteronu nízké (Tab. 1). Suprese aldosteronu a reninu jsou výrazem negativní zpětné vazby spouštěné volumovou expanzí. Na rozdíl od čínské populace je nízký aldosteron konstantním nálezem u euroamerické populace pacientů s LS (12), vyskytující se ve více než 90 % případů, a tudíž je znakem senzitivnějším než hypokalemie (10). Dolní hranice normálu pro sérový aldosteron byla v popsaných případech stanovena na 0,17 nmol/l měřená v poloze vleže (7).
Genetické pozadí
Na rozdíl od polygenní dědičnosti esenciální arteriální hypertenze, kdy se na rozvoji nemoci podílí mix polymorfismů genů malého účinku a environmentální vlivy, je situace u monogenních forem hypertenze jednodušší. U těchto nemocí známe tzv. geny velkého účinku, jejichž specifické mutace jsou prokazatelně spojeny s konkrétní nemocí. Liddleův syndrom je způsoben mutacemi genů kódujících epiteliální sodíkový kanál. Každá podjednotka kanálu (alfa, beta, gamma) je kódována odlišným genem (SCNN1A, SCNN1B, SCNN1C).
Doposud bylo popsáno přes 30 různých mutací těchto podjednotek, které jsou spojeny s rozvojem nemoci. Většinou jde o nonsense mutace, které zařazením stop kodonu zkracují výsledný protein (podjednotku beta nebo gamma) a kanál tak přichází o své důležité regulační místo, kam se normálně váže NEDD4 (4, 13, 14). Nedávno byl popsán případ LS spojený s mutací alfa podjednotky, která se na samotné regulaci kanálu nepodílí. Tato mutace však způsobí změnu konformace kanálu, která několikanásobně zvyšuje jeho propustnost pro sodné ionty (15).
Terapie
Liddleův syndrom, respektive jeho projev, arteriální hypertenze, je léčitelný. Základem terapie jsou blokátory epiteliálního sodíkového kanálu amilorid a triamteren (16). Amilorid je v ČR používaný v kombinaci s chlortalidonem jako přípravek Amicloton 2,5/25 mg. Tato kombinace pro léčbu Liddleova syndromu není optimální vzhledem k možnému prohloubení hypokalemie účinkem chlortalidonu. Amilorid je v ČR nicméně dostupný i samostatně – připravovaný magistraliter. Dle zkušeností z publikovaných případů k normalizaci TK většinou postačují nízké dávky amiloridu, tj. od 2,5 do 10 mg/den. Stejnou zkušenost máme i na našem pracovišti.
Na rozdíl od ostatních skupin antihypertenziv amilorid v případě LS cílí přímo na patofyziologický podklad arteriální hypertenze u tohoto onemocnění. Ostatní skupiny antihypertenziv jsou ze své podstaty málo účinné. Typicky je pacient s LS léčen kombinací antihypertenziv včetně spironolaktonu s minimálním účinkem, zatímco po podání nízké dávky amiloridu dojde promptně k úpravě TK. Současně s krevním tlakem dochází i k normalizaci kalemie a případné MAL. V lehčích případech LS však může být běžná antihypertenzní terapie dostačující i bez užití amiloridu (10).
Pro léčbu hypertenze v těhotenství existuje nízká úroveň důkazů. Bezpečné je použití metyldopy a blokátorů kalciových kanálů (17). Doporučení pro skupinu diuretik se týkají pouze hydrochlorothiazidu. Ten není kontraindikován, nicméně terapie jím by měla být zahájena již před těhotenstvím. Iniciace léčby až v těhotenství je riziková z hlediska možného navození hypovolemie (18).
Data ohledně bezpečnosti léčby amiloridem v těhotenství existují pouze na úrovni kazuistických sdělení, nicméně jeho užívání se zdá být bezpečné. Obecně vzato pokud není antihypertenzivum kontraindikováno, mělo by být zváženo, pokud představuje pro nemocnou patrný benefit (19).
Závěr
Liddleův syndrom je dědičná forma hypertenze s variabilní tíhou fenotypu. Ačkoliv je prevalence stejně jako u jiných forem monogenních hypertenzí nízká, mělo by se na toto onemocnění v rámci diferenciální diagnostiky (sekundární) hypertenze myslet. Podezření by měl vzbudit pacient se současnou hypokalemií, metabolickou alkalózou a pozitivní rodinnou anamnézou arteriální hypertenze. Na rozdíl od primárního aldosteronismu nacházíme v krvi zpravidla nízké hladiny aldosteronu. Lékem volby je blokátor epiteliálního sodíkového kanálu amilorid.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Štěpán Mareš
maress@fnplzen.cz
II. interní klinika LF UK a FN Plzeň
Edvarda Beneše 13, 305 99 Plzeň
Cit. zkr: Vnitř Lék. 2022;68(8):E8-E11
Článek přijat redakcí: 31. 8. 2022
Článek přijat po recenzích: 24. 10. 2022
Sources
1. Wang LP, Yang KQ, Jiang XJ, Wu HY, Zhang HM, Zou YB et al. Prevalence of Liddle Syndrome Among Young Hypertension Patients of Undetermined Cause in a Chinese Population. J Clin Hypertens (Greenwich). 2015 Nov;17(11):902-7.
2. Liu K, Qin F, Sun X, Zhang Y, Wang J, Wu Y et al. Analysis of the genes involved in Mendelian forms of low‑renin hypertension in Chinese early‑onset hypertensive patients. J Hypertens. 2018 Mar;36(3):502-9.
3. Canessa CM, Schild L, Buell G, Thorens B, Gautschi I, Horisberger JD et al. Amiloride‑sensitive epithelial Na+ channel is made of three homologous subunits. Nature. 1994 Feb 3;367(6462):463-7.
4. Hanukoglu I, Hanukoglu A. Epithelial sodium channel (ENaC) family: Phylogeny, structure‑function, tissue distribution, and associated inherited diseases. Gene. 2016 Apr 1;579(2):95-132.
5. Ceccato F, Mantero F. Monogenic Forms of Hypertension. Endocrinol Metab Clin North Am. 2019 Dec;48(4):795-810.
6. Palmer BF, Alpern RJ. Liddle’s syndrome. Am J Med. 1998 Mar;104(3):301-9.
7. Tetti M, Monticone S, Burrello J, Matarazzo P, Veglio F, Pasini B et al. Liddle Syndrome: Review of the Literature and Description of a New Case. Int J Mol Sci. 2018 Mar 11;19(3).
8. Fan P, Pan XC, Zhang D, Yang KQ, Zhang Y, Tian T et al. Pediatric Liddle Syndrome Caused by a Novel SCNN1G Variant in a Chinese Family and Characterized by Early‑onset Hypertension. Am J Hypertens. 2020 Mar 12.
9. Gong L, Chen J, Shao L, Song W, Hui R, Wang Y. Phenotype‑genotype analysis in two Chinese families with Liddle syndrome. Mol Biol Rep. 2014 Mar;41(3):1569-75.
10. Mareš Š, Filipovský J, Vlková K, Pešta M, Černá V, Hrabák J et al. A novel nonsense mutation in the β‑subunit of the epithelial sodium channel causing Liddle syndrome. Blood Press. 2021 Oct;30(5):291-9.
11. Enslow BT, Stockand JD, Berman JM. Liddle’s syndrome mechanisms, diagnosis and management. Integr Blood Press Control. 2019;12 : 13-22.
12. Cui Y, Tong A, Jiang J, Wang F, Li C. Liddle syndrome: clinical and genetic profiles. J Clin Hypertens (Greenwich). 2017 May;19(5):524-9.
13. Yang KQ, Xiao Y, Tian T, Gao LG, Zhou XL. Molecular genetics of Liddle’s syndrome. Clin Chim Acta. 2014 Sep 25;436 : 202-6.
14. Schild L, Lu Y, Gautschi I, Schneeberger E, Lifton RP, Rossier Bc. Identification of a PY motif in the epithelial Na channel subunits as a target sequence for mutations causing channel activation found in Liddle syndrome. Embo j. 1996 May 15;15(10):2381-7.
15. Salih M, Gautschi I, van Bemmelen MX, Di Benedetto M, Brooks AS, Lugtenberg D, et al. A Missense Mutation in the Extracellular Domain of alphaENaC Causes Liddle Syndrome. J Am Soc Nephrol. 2017 Nov;28(11):3291-9.
16. Botero‑Velez M, Curtis JJ, Warnock DG. Brief report: Liddle’s syndrome revisited--a disorder of sodium reabsorption in the distal tubule. N Engl J Med. 1994 Jan 20;330(3):178-81.
17. Al Khaja KA, Sequeira RP, Alkhaja AK, Damanhori AH. Drug treatment of hypertension in pregnancy: a critical review of adult guideline recommendations. J Hypertens. 2014 Mar;32(3):454-63.
18. Podymow T, August P. Hypertension in pregnancy. Adv Chronic Kidney, DiS. 2007 Apr;14(2):178-90.
19. Caretto A, Primerano L, Novara F, Zuffardi O, Genovese S, Rondinell, M.A. Therapeutic Challenge: Liddle’s Syndrome Managed with Amiloride during Pregnancy. Case Rep Obstet Gynecol. 2014;2014 : 156250.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2022 Issue E-8
-
All articles in this issue
- Sklerotizace cystických uzlů štítné žlázy absolutním alkoholem v České republice
- Liddleův syndrom
- Jak přesvědčit pacienta odmítajícího kolonoskopické vyšetření – kvalitativní studie
- Vzácná příčina obstrukčního ikteru u mladého pacienta
- Diferenciální diagnostika hyponatremie a hypernatremie
- Životní jubileum prof. MUDr. Miroslava Součka, CSc.
- 70 let prof. MUDr. Štěpána Svačiny, DrSc., MBA
- Zemřel profesor MUDr. Zbyněk Píša, CSc.
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Diferenciální diagnostika hyponatremie a hypernatremie
- Jak přesvědčit pacienta odmítajícího kolonoskopické vyšetření – kvalitativní studie
- Liddleův syndrom
- Sklerotizace cystických uzlů štítné žlázy absolutním alkoholem v České republice
