Dávkování základní farmakoterapie a jeho vliv na prognózu pacientů hospitalizovaných pro srdeční selhání
Dosing of basic pharmacotherapy and its effect on the prognosis of patients hospitalized for heart failure
Background: We analyzed the prescription and dosage of essential pharmacotherapy in chronic heart failure (HF) at the time of discharge from the hospitalization for cardiac decompensation and how it may have influenced the prognosis of the patients.
Methods: We followed 4097 patients [mean age 70.7, 60.2% males] hospitalized for HF between 2010 and 2020. The vital status we ascertained from the population registry, other circumstances from the hospital information system.
Results: The prescription of beta-blockers (BB) was 77.5% (or only 60.8% of BB with evidence in HF), 79% of renin-angiotensin system (RAS) blockers, and 45.3% of mineralocorticoid receptor antagonists (MRA). Almost 87% of patients were treated with furosemide at the time of discharge, while only ≈53% of patients with ischemic etiology of HF took a statin. The highest target dose of BB was recommended in ≈11% of patients, RAS blockers in ≈ 24%, and MRA in ≈ 12% of patients. In patients with concomitant renal insufficiency, the prescription of BB and MRA was generally less frequent and on a significantly lower dosage. In contrast, the opposite was true for the RAS blocker (however statistically insignificant). In patients with EF ≤ 40%, the prescription of BB and RAS blockers were more frequent but in a significantly lower dosage. On the contrary, MRAs were recommended in these patients more often and in higher doses. In terms of mortality risk, patients treated only with a reduced dose of RAS blockers showed a 77% higher risk of death within one year (or 42% within five years). A significant relationship was also found between mortality and the recommended dose of furosemide.
Conclusions: The prescription and dosage of essential pharmacotherapy are far from optimal, and in the case of RAS blockers, this affected the patient‘s prognosis as well.
Keywords:
mortality – therapy – chronic heart failure – dose – cardiac decompensation
Authors:
Tomáš Krynský 1; Otto Mayer Jr. 1,2; Jan Bruthans 3; Simona Bílková 1; Josef Jirák 4
Authors‘ workplace:
II. interní klinika, Lékařská fakulta v Plzni, Univerzita Karlova a Fakultní nemocnice Plzeň
1; Biomedicínské centrum, Univerzita Karlova, Lékařská fakulta a Fakultní nemocnice, Plzeň
2; Centrum kardiovaskulární prevence, Thomayerova nemocnice a 1. lékařská fakulta Univerzity Karlovy, Praha
3; Správa informačního systému, Fakultní nemocnice, Plzeň
4
Published in:
Vnitř Lék 2023; 69(2): 109-118
Category:
Original Contributions
doi:
https://doi.org/10.36290/vnl.2023.018
Overview
Východisko: Analyzovali jsme preskripci a dávkování základní farmakoterapie u chronického srdečního selhání (CHSS) v době propuštění z hospitalizace pro kardiální dekompenzaci a nakolik mohly ovlivnit prognózu pacientů.
Metodika: Celkem bylo sledováno 4097 pacientů (průměrný věk 70,7 let, 60,2 % mužů) hospitalizovaných v letech 2010–2020 pro kardiální dekompenzaci. Vitální stav byl zjištěn na základě registrů ÚZIS, ostatní okolnosti z nemocničního informačního systému.
Výsledky: Preskripce betablokátorů (BB) činila 77,5 % (resp. jen 60,8 % pokud budeme počítat výhradně BB s důkazem u CHSS), blokátorů systému renin‑angiotenzin (RAS) 79 % a antagonistů mineralokortikoidního receptoru (MRA) 45,3 %. Takřka 87 % bylo v době propuštění léčeno furosemidem, ale jen asi 53 % pacientů s CHSS ischemické etiologie užívalo statin. Nejvyšší cílovou dávku BB mělo doporučenu ≈ 11 %, RAS blokátorů ≈ 24 %, zatímco MRA ≈ 12 % pacientů. U pacientů s konkomitantní renální insuficiencí byla preskripce BB a MRA obecně méně častá a se signifikantně nižším dávkováním, u RAS blokátoru tomu bylo naopak (jakkoliv statisticky nevýznamně). U pacientů s EF ≤ 40 % byla preskripce BB a RAS blokátorů častější, ale s významně nižším dávkováním. Naopak MRA byly doporučeny u těchto pacientů jak častěji, tak i ve vyšších dávkách. Z hlediska mortalitního rizika vykazovali pacienti léčení jen redukovanou dávkou RAS blokátorů asi o 77 % vyšší riziko úmrtí do 1 roku (resp. o 42 % v případě úmrtí do 5 let). Významný vztah byl nalezen rovněž mezi mortalitou a doporučenou dávkou furosemidu.
Závěry: Preskripce i dávkování základní farmakoterapie zdaleka nedosahují svého optima a v případě RAS blokátorů toto má zřejmě vliv i na prognózu pacientů.
Klíčová slova:
mortalita – léčba – dávka – chronické srdeční selhávání – kardiální dekompenzace
Úvod
Chronické srdeční selhání (CHSS) představuje prognosticky jednu z nejvýznamnějších komplikací většiny kardiovaskulárních chorob (1). Paradoxně zejména díky výraznému zlepšení v přežívání akutních forem ischemické choroby srdeční jeho celková prevalence setrvale narůstá, tudíž roste i populační dopad opatření, která mohou rozvoj CHSS alespoň zpomalit. Na druhé straně oproti situaci na konci minulého století již dnes máme k dispozici dokonce několik lékových skupin a dalších léčebných opatření, které prokazatelně zlepšují prognózu pacientů s CHSS (řada dalších je ve výzkumu). Základní pravidla pro péči o pacienty s CHSS nám také sumarizují pravidelně aktualizovaná Guidelines, ta poslední pocházejí z roku 2021 (2). Základním předpokladem úspěšnosti jakékoliv formulované léčebné strategie je její náležitá implementace do klinické praxe. Asi nejpřesnějším odrazem úspěšnosti této strategie je pak zase pokles mortality a rekurence příslušné choroby. V naší předchozí studii jsme analyzovali mortalitní trendy u pacientů hospitalizovaných pro kardiální dekompenzaci v posledních deseti letech a zjistili jsme, že mortalitní riziko klesá v čase jen velmi pozvolna; v plně adjustovaném modelu byl každý rok hospitalizace spojen vždy s asi 5% poklesem relativního rizika úmrtí do 1 roku. Naproti tomu absolutní jednoroční celková mortalita v celém souboru činila stále více než 20 %, zatímco ta pětiletá dokonce až 55 % (3).
Z hlediska farmakoterapie libovolné choroby představuje klíčový moment nejen fakt, že léčba byla vůbec zahájena, ale také zda byla náležitě dávkována. Akceptovaným pravidlem u farmakoterapie CHSS (a nejen tam) je, že základní lékové skupiny, které mají důkaz svého přínosu u této choroby, mají být podávány v maximální tolerované dávce. Jako míra tolerance se obvyklé používá krevní tlak, tepová frekvence, ale také třeba renální funkce pacienta a individuální subjektivní snášenlivost preparátu. Bohužel pacienti s CHSS z těchto hledisek představují velmi heterogenní skupinu a nelze zde tedy formulovat paušální doporučení dávky příslušného preparátu.
V naší studii jsme se pokusili analyzovat, jaké dávkování základní farmakoterapie bylo pacientům hospitalizovaným pro srdeční selhání v době propuštění doporučováno, které další okolnosti mohly toto rozhodnutí eventuálně ovlivnit a jaká byla prognóza pacientů ve skupinách podle použitého dávkování.
Metodika
Všechny studijní procedury byly prováděny v souladu s principy Správné klinické praxe ve smyslu Helsinské deklarace z roku 1984 a pozdějších dodatků. Studijní protokol byl schválen lokální Etickou komisí Fakultní nemocnice (FN) Plzeň, pacienti podepsali v úvodu hospitalizace informovaný souhlas. Se všemi získanými daty je nakládáno v souladu se Zákonem na ochranu osobních údajů a směrnicí GDPR Evropské komise.
Design a studovaný soubor
Analýza představuje deskriptivní survey a prospektivní studii pacientů hospitalizovaných pro převážně de‑novo manifestaci chronického srdečního selhávání (CHSS). Toto hlavní kvalifikující kritérium je založeno na klinickém dojmu ošetřujícího lékaře, formálně deklarovaném v propouštěcí zprávě pacienta jako hlavní diagnóza vedoucí k hospitalizaci. Všichni zařazení pacienti byli hospitalizováni ve FN Plzeň na jedné z pěti tamních klinik poskytujících internistickou péči, a to v období od 1. 1. 2010 do 29. 9. 2020. Celkem jsme na základě informačního systému takto identifikovali 9354 hospitalizací, což nám dalo iniciální soubor 5804 individuálních pacientů (3550 hospitalizací proběhlo u stejných osob jako rekurence srdečního selhání), u nichž nebyl v předcházejících 10 letech v systému žádný záznam ohledně předchozí hospitalizace pro srdeční selhání. Z tohoto iniciálního souboru dále 689 pacientů zemřelo během hospitalizace, 881 bylo starších než 85 let a dalších 137 osob bylo vyřazeno po zhodnocení jejich dokumentace, když bylo seznáno, že srdeční selhání nebyla pravděpodobně vedoucí příčina jejich hospitalizace. Finální soubor tedy představovalo 4097 pacientů s manifestním CHSS, kteří přežili úvodní hospitalizaci a byli odesláni s doporučením do ambulantní péče.
Sběr dat
S výjimkou vitálního statusu (viz dále) byla v této analýze použita výhradně data obsažená v nemocničním infomačním systému FN Plzeň. Zaměřili jsme se na následující informace: anamnézu kardiovaskulárních chorob, koronárních revaskularizací, diabetes mellitus, hypertenze, malignit (bez ohledu na jejich aktuální staging/grading) a udávanou anamnézu kouření. Primární etiologie CHSS byla kriticky zhodnocena na základě dostupných informací (zejména s ohledem, zda lze ischemickou etiologii či nikoliv). Hodnota ejekční frakce byla derivována z popisu echokardiografie realizované během hospitalizace (což byla většina případů) či z vyšetření co možná časově nejblíže hospitalizaci. Podobně přítomnost fibrilace síní či flutteru byla buď derivována z EKG realizovaného za hospitalizace, či pokud byla kdekoliv uvedena jako anamnestická okolnost. Velká pozornost byla věnována farmakoterapii doporučené pacientovi v propouštěcí zprávě, a to (u lékových skupin, které nás speciálně zajímaly) včetně dávkování.
Základní laboratorní screening byl proveden u všech pacientů jako součást jejich klinického managementu, a to v laboratořích Ústavu klinické biochemie a hematologie FN Plzeň. Všechny laboratorní metody jsou součástí systému pravidelné kontroly kvality, ke stanovení základních analytů, které nás zajímaly (tj. glykemie, lipidy, kreatinin a natriuretické peptidy) bylo použito komerčních kitů a chemikálií a vyšetření realizována na standardní analytické platformě (COBAS 8000, ROCHE Diagnostics, Basel, Švýcarsko).
Vitální status pacientů byl ověřen v režii Ústavu zdravotnické informace a statistiky. Pokud pacient zemřel v období od propuštění z hospitalizace do 30. 12. 2020, zajímalo nás především datum úmrtí, a dále pak i deklarovaná primární příčina úmrtí, kterou jsme pak ještě dále prověřovali na základě dostupných informací, např. v našem informačním systému (jakkoliv tento údaj nakonec nebyl pro potřeby této analýzy použit).
Zpracování dat
Pro potřeby deskriptivní i mortalitní analýzy byly zjištěné údaje definovány a dichotomizovány takto: Podle hodnoty EF byli pacienti rozděleni do tří obvyklých skupin, tj. ≤ 40 %, 41–50 % a ≥ 51 %. Primární etiologie CHSS byla odhadnuta tak, že všichni pacienti s anamnézou infarktu myokardu, koronární revaskularizace nebo angiograficky zjištěnou stenózou koronárního řečiště více než 50 % byli zařazeni do skupiny „Ischemická choroba srdeční (ICHS)“. Pokud byla v propouštěcí zprávě deklarována dilatační kardiomyopatie (KMP), valvulární choroba srdeční, post‑tachykardická KMP, pozánětlivá KMP či jiná zjevná příčina (alkohol, předchozí onkologická léčba…), byli tito pacienti zařazeni do skupiny „non‑ICHS“. Zbylí pacienti s hypertenzí a/nebo diabetem byli kategorizováni jako ICHS, zatímco ti bez těchto diagnóz jako „non‑ICHS“. Ostatní důležité komorbidity byly definovány následujícím způsobem: hypertenze, pokud tato diagnóza byla explicitně zmíněna v propouštěcí zprávě či anamnéze či pokud byli pacienti léčeni antihypertenzivy nad rámec těch užívaných v léčbě CHSS. Diabetes mellitus byl určen, pokud byl opět explicitně zmíněn v dokumentaci, pacient byl léčen antidiabetiky či vykazoval laboratorní známky této choroby (nejvyšší lačná glykemie během hospitalizace ≥ 7 či nejvyšší ne‑lačná ≥ 11,1 či Hba1c ≥ 52 mmol/mol). Hypercholesterolemie byla definována jako LDL‑cholesterol ≥ 1,8 mmol/l. Nejvyšší zaznamenaná hodnota kreatinu během hospitalizace byla použita pro kalkulaci glomeruální filtrace (eGFR) na základě rovnice CKD‑EPI 4 a pacienti rozděleni do tří skupin podle KDOQI (National Kidney Foundation’s Kidney Disease Outcomes Quality Initiative) gradingu, tj. > 60 ml/min, 30–59,9 ml/min a < 30 ml/min. Pro potřeby této analýzy rovněž kategorizovali přítomnost alespoň desetinásobně zvýšeného natriuretického peptidu (tj. BNP ≥ 1000 nebo N‑terminální proBNP ≥ 3000 ng/l).
Základní doporučená farmakoterapie při srdečním selhání (GDMT, „guidelines‑directed medical therapy“), tj. betablokátory (BB), blokátory systému renin‑angiotensin (RAS), antagonisté mineralokortikoidních receptorů (MRA), dále pak ještě statiny a furosemid, byla kategorizována do tří skupin podle svého dávkování (se zhruba ekvipotentním účinkem); detaily jsou uvedeny v tabulce 1. Doporučená dávka furosemidu byla rovněž kategorizována do třech skupin: ≤ 40, > 40 a < 125 mg a ≥ 125 mg. Pro potřeby mortalitní analýzy jsme za expozici („exposure“) považovali příslušnost do výše definované skupiny podle dávkování. Jako výstup („outcome“) byly použity jednoroční a pětiletá mortalita z jakékoliv příčiny. U pacientů s jen částečnou dobou sledování byla použita cenzorovaná doba přežití. Statistická analýza dat byla realizována pomocí software STATISTICA 8 (StatSoft Inc, Tulsa, OK, USA) a STATA 8 (STATA Corp LP, College Station, TX, USA), přičemž použity byly jen konvenční statistické metody (detaily jsou uvedeny v příslušných sekcích výsledků). Realizována byla rovněž analýza nezbytné velikosti vzorku (power calculation), která prokázala, že náš soubor je z hlediska očekávané incidence primárních výstupů dostatečně veliký. Výsledky Celkem bylo v této analýze hodnoceno 4097 pacientů (průměrný věk 70,7 (± SD 10,3), 60,2 % mužů) iniciálně hospitalizovaných pro dekompenzované srdeční selhání; medián doby hospitalizace činil 8 dní (IQR: 4–13). Základní parametry souboru jsou uvedeny v tabulce 2.

![Základní charakteristiky souboru [průměr (směrodatná odchylka)
nebo proporce faktoru]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/a95449a671793c65d544068e415707e7.png)
Deskriptivní analýza použitého dávkování základní farmakoterapie
Graf 1 udává proporci dávkování pro všech pět tříd farmakoterapie, které jsou zde analyzovány (a zvláště jsou uvedeny ještě BB s důkazem u CHSS, tj. bisoprolol, carvedilol metoprolol sukcinát a nebivolol). Více než 86 % pacientů bylo z hospitalizace propuštěno s doporučenou léčbou furosemidem. Na druhou stranu jen necelých 8 % užívalo v době propuštění dávku 125 mg a výše, a naopak takřka 41 % nevyžadovalo vyšší dávku než 40 mg furosemidu (z čehož asi 1/4 vystačila dokonce i s nižší dávkou než 40 mg). Z hlediska třech základních GDMT u CHSS (BB s důkazem, blokátory RAS a MRA) o něco více než jedna třetina pacientů doporučenou jen standardní dávku a jen cca 7–24 % pacientů byla doporučena maximální dávka (nejlepší situace byla v tomto směru u blokátorů RAS, nejhorší u BB s důkazem). Naopak až 40 % pacientů nebyl podáván BB (i když tento počet by eventuálně bylo možno snížit o ≈ 17 % pacienty, kterým byl doporučen jen BB bez důkazu) a takřka 55 % MRA. Až 53 % hodnocených pacientů vůbec neužívalo statin a jen ≈ 15 % mělo doporučenu nejvyšší možnou dávku (tj. 80 mg atorvastatinu či ekvivalent).

Tabulka 3 analyzuje dále základní farmakoterapii v podskupinách podle vybraných třech okolností, které by mohlo dále zvolené dávkování ovlivnit. Ischemická etiologií CHSS signifikantně ovlivnila dávkování BB, blokátorů RAS a především statinů. U pacientů s non‑ICHS etiologii byla tendence ke zvýšené preskripci nejvyšší dávky BB, zatímco u těch s ICHS byly doporučeny zase vyšší dávky blokátorů RAS a statinů. Kategorie ejekční frakce signifikantně ovlivnila preskripci všech sledovaných farmakologických tříd s výjimkou diuretik. Nejmarkantnější rozdíl byl pozorován u MRA, kde byla zřetelná tendence k vyššímu dávkování (a i preskripci obecně) u pacientů s dysfunkcí levé komory (EF ≤ 40 %). Z hlediska stratifikované glomerulární filtrace bylo celkem nepřekvapivě použito markantně vyšší dávkování furosemidu, a naopak nižší dávkování MRA u pacientů s renální insuficiencí.
![Dávkování základní farmakoterapie v některých speciálních podskupinách [%]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/fd24af8a0c12e3cbe1e9e7f2fe31aa6b.png)
Mortalitní analýza použitého dávkování základní farmakoterapie
V celém souboru v průběhu sledovaného období (dohromady 13 697 člověko‑let sledování) zemřelo 2207 osob, při střední době sledování 987 (IQR: 366–1868) dní. Třicetidenní mortalita činila 3,2 %, jednoroční 20,4 % zatímco pětiletá mortalita (u cca 50 % souboru, tj. 2010–2015) 55,4 %. V prvním kroku byla testována prediktivní síla jednotlivých kovariátů (uvedených tabulce 1) z hlediska mortalitního rizika. Při použití Coxova modelu jako závislé proměnné následující parametry významně zvyšovaly riziko úmrtí do 1 roku od příjmu k hospitalizaci [hazard ratio (95% interval spolehlivosti), p]: věková dekáda [1,27 (1,14–1,42), p < 0,0001]; mužské pohlaví [1,29 (1,05–1,59), p = 0,018]; anamnéza malignity [1,61 (1,23–2,09), p < 0,0001]; desetinásobně zvýšený natriuretický peptid [1,75 (1,41–2,18), p < 0,0001] a kategorie eGFR [1,17 (1,00–1,36), p = 0,047]. Jako protektivní faktory model identifikoval LDL ≥ 1,8 mmol/l [0,77 (0,63–0,94), p = 0,009] a implantovaný kardioverter‑defibrilátor [0,47 (0,28–0,79), p = 0,004]. Stejné proměnné vstoupily významně do regresního modelu, i pokud jsme použili jako závislou proměnnou pětiletou mortalitu. Navíc ale ještě zvyšovala riziko úmrtí délka hospitalizace ≥ 10 dní [1,25 (1,10–1,43), p = 0,001], a naopak snižoval rok hospitalizace [0,97 (0,95–0,99), p = 0,010].
Kaplan‑Meierovy křivky vztahu mezi použitým dávkováním základní farmakoterapie (BB s důkazem jsou opět uvedeny zvlášt) a přežíváním pacientů během sledování udává graf 2. Zřetelný vztah mezi dávkou v době propuštění z hospitalizace a přežívání vykazuje furosemid. Základní GDMT (tj. BB s důkazem, blokátory RAS a MRA) vykazují zhoršené přežívání v případě, že nebyly vůbec doporučeny, vztah mezi dávkou a mortalitou zde ale není přiliš přesvědčivý. Určitý náznak lepší prognózy byl pozorován u nejvyšší dávky BB a RAS blokátorů a očividně lepší přežívání vykazovali také pacienti léčení maximální dávkou statinu.

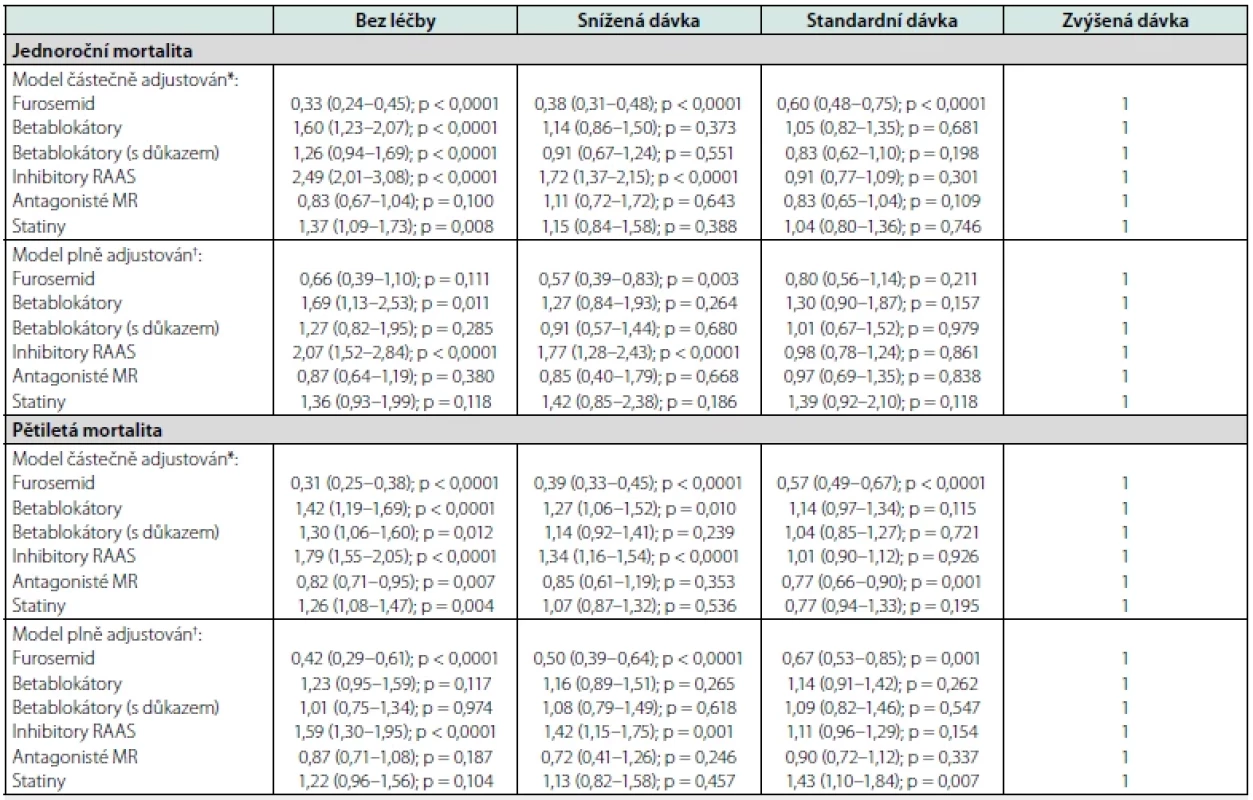
V poslední analýze (Tab. 4) jsme porovnali relativní riziko úmrtí podle doporučeného dávkování po adjustaci (ve dvou krocích, po jen bazální adjustaci na věk, pohlaví a kategorii EF a poté i na ostatní potenciální kovariáty). V zásadě přesvědčivý nezávislý vztah mezi dávkováním a prognózou jsme potvrdili pouze u furosemidu, kde byla zjištěna inverzní asociace mezi doporučenou dávkou a pětiletou mortalitou. Významně vyšší riziko úmrtí po roce či 5 letech vykazovali po plné adjustaci dále pacienti zcela bez léčby RAS blokátorem nebo užívající pouze redukovanou dávku. Pro ostatní lékové skupiny nebyl vztah mezi dávkováním a prognózou u pacientů s CHSS přesvědčivý.
Diskuze
V naší analýze jsme se pokusili analyzovat, nakolik doporučená farmakologie v době propuštění z hospitalizace pro kardiální dekompenzace odpovídá současným terapeutickým standardům u CHSS (2). Až 77,5 % pacientů mělo v době propuštění z hospitalizace doporučený BB (ale jen u 60,8 % to byl BB s důkazem u CHSS, tj. bisoprolol, carvedilol, metoprolol sukcinát nebo nebivolol), 79 % blokátor RAS a 45,3 % MRA. Máme například možnost tento výsledek porovnat s poměrně rozsáhlým registrem (organizovaným ESC) více než 12 400 pacientů s CHSS z 211 evropských center (5). Preskripce základní farmakoterapie v době propuštění z hospitalizace činila v tomto registru 71,87 % pro BB („s důkazem“), 77,0 % pro blokátory RAS a 55,3 % pro MRA. Asi první markantní rozdíl je v preskripci BB a jde bezpochyby na vrub faktu, že takřka 17 % pacientů obdrželo v době propuštění doporučení užívat BB, který nemá důkaz (a tudíž ani registrovanou indikaci) u srdečního selhání. Pro korektnost je nutno konstatovat, že v naší studii jsme nenalezli žádný rozdíl v prognóze pacientů, ať již byli léčeni BB „s důkazem“, či bez něj (hazard risk ratio pro léčbu BB „bez důkazu“ a pětiletou mortalitu činilo v našem souboru 0,88 (0,73–1,05), oproti léčbě BB „s důkazem“). Na druhé straně náležitě designované intervenční studie (což ta naše není) léčbu libovolným BB u srdečního selhání nepodporují. Především řada starších typů betablokátorů (zejména těch s nízkou kardioselektivitou či tzv. vnitřní sympatomimetickou aktivitou) vysloveně selhala v léčbě CHSS (6, 7). Konkrétně zdaleka nejčastěji předepisovaným BB „bez důkazu“ byl v našem souboru metoprolol‑tartarát (doporučen byl při propuštění takřka 14 % pacientům). Tento BB nejen že postrádá důkaz a indikaci u CHSS, ale dokonce ve studii COMET prokázal asi o 17 % vyšší riziko mortality než carvedilol (tj. BB „s důkazem“) (8). Co je však důležitější, že k dispozici máme novější generaci metoprololu (sukcinát), který důkaz (a tudíž i deklarovanou indikaci) u CHSS má (9). K preskripci BB „bez důkazu“ není ani žádný ekonomický důvod, tudíž jedinou limitací je důslednost předepisujícího lékaře v respektování tohoto jednoduchého pravidla.
Poměrně příznivá byla v našem souboru preskripce blokátorů RAS (tj. ACE inhibitorů nebo sartanů), která činila 79 % (což bylo dokonce o něco málo více než ve výše zmíněném celoevropském registru (5)). Asi nejčastější klinickou příčinou, proč není léčba RAS blokátorem u CHSS zahájena, je tendence k nízkému tlaku, která je u pacientů s dekompenzovaným srdečním selhání častější, než je tomu u těch stabilizovaných. Na druhé straně v našem souboru jsme identifikovali celkem 719 pacientů (tj. více než 17 % souboru) s anamnézou hypertenze, kteří přesto neužívali RAS blokátor (ačkoliv mnohdy užívali i třeba jiné antihypertenzivum) a kteří asi představují (přinejmenším zčásti) další nevyužitý potenciál ke zvýšení preskripce RAS blokátorů. Ve studii Špinarové a kolegů (10) byla u ambulantních pacientů s CHSS zjištěna asi 88% preskripce RAS blokátorů. Lze tedy důvodně předpokládat, že preskripce RAS blokátorů by mohla ještě v ambulantní péči u našich pacientů o něco málo narůst. Jen velmi malá byla v našem souboru preskripce sacubitril‑valsartanu (ENTRESTO®), který mělo v době propuštění předepsáno jen 37 pacientů, tj. 1,8 % pacientů s EF ≤ 40 %, kde můžeme tento preparát předepisovat a kde máme i důkaz jeho přínosu (11). Hlavním důvodem asi bylo, že tato relativně nová látka byla k dispozici až v poslední třetině období, které pokrývá naše studie, a v té době zde byla i limitující preskripční omezení (preparát nebyl hrazen pacientům ihned po primomanifestaci CHSS – což v současné době již neplatí). Poměrně významnou limitací preskripce tohoto preparát u je ale také jeho relativně silný antihypertenzní účinek, což v období bezprostředně po dekompenzaci CHSS asi hraje dosti významnou roli.
Jedním ze základních obecných principů farmakoterapie je kromě volby příslušného preparátu také náležité dávkování. Jak ale vyplývá z naší analýzy, jen poměrně malé množství pacientů obdrželo základní GDMT v maximální možné dávce. Nejvyšší uptitrovanou dávku BB obdrželo v naší studii jen asi 11,0 %, zatímco naopak redukovanou dávku mělo asi 17 % pacientů. Nemáme bohužel k dispozici žádnou informaci o tom, v jakém rozmezí se pohybovaly tepové frekvence pacientů v jednotlivých skupinách dávkování BB a nakolik byly činěny pokusy o jejich uptitraci. O něco málo lepší situace z hlediska dávkování byla pozorována u RAS blokátorů, kde bylo nejvyšší dávkování doporučeno necelé 1/4 pacientů. V tomto se naše výsledky lišily od již zmíněného jiného českého registru ambulantních pacientů s CHSS, kde preskripce RAS blokátorů v nejvyšší (cílové) dávce činila jen asi 13 % (10). Pozorovali jsme rovněž signifikantně vyšší mortalitu (o takřka 80 % v případě jednoroční, resp. 40 % v případě pětileté) u pacientů léčených pouze redukovanou dávkou RAS blokátoru oproti těm na nejvyšší dávce. Podobný efekt byl popisován i v meta‑analýze Khana a kolegů (12) realizované u asi 9100 pacientů s CHSS a redukovanou EF, jakkoliv rozdíl v prognóze zde byl daleko menší (mortalitní riziko bylo asi jen o 6 % nižší), než jsme pozorovali v naší studii. Samozřejmě lze namítnout, že nižší dávkování bylo pravděpodobně použito u pacientů se sklonem k nižšímu TK, což je jev typický pro pokročilejší stadia CHSS. Na druhé straně mortalitní rozdíl přetrvával i po plné adjustaci na faktory, které pokročilost CHSS do určité míry charakterizují (např. EF, délka hospitalizace, nejvyšší dosažená hodnota BNP…), tudíž můžeme spekulovat, že právě důslednost v preskripci RAS v cílové nejvyšší dávce by mohla být nevyužitým potenciálem ke zlepšení prognózy pacientů s CHSS.
Specifická situace byla pozorována v oblasti preskripce MRA, která v našem souboru činila jen asi 45 %. Prvním důvodem bude již jen fakt, že tato léková skupina byla dlouhá léta vnímaná jako indikovaná jen u CHSS s redukovanou EF (kde má také důkaz svého přínosu) (13, 14). Jak vidno z našich dat, toto již úplně neplatí, neboť MRA užívalo i asi 35 % pacientů s plně zachovanou EF (≥ 50 %). To je asi správně, neboť MRA také nejsou zcela bez důkazů ani u pacientů s EF nad 40 %. Výsledky post‑hoc analýzy studie TOPCAT naznačují možný přínos i u této podskupiny CHSS (15). Hlavním důvodem limitované preskripce MRA však bezpochyby bude (asi dosti důvodná) obava z nežádoucího účinku této léčby, především v podobě hyperkalemie. Ta se sice v intervenčních studiích s touto lékovou skupinou u CHSS (13, 14) vyskytla jen u 2,5–5,5 % léčených pacientů, v praxi asi bude daleko vyšší; záhy poté, co byly tyto studie publikovány, byl v běžné klinické praxi pozorován poměrně markantní (takřka pětinásobný) vzestup případů hyperkalemií (16). Celkem nepřekvapivě je riziko léčby MRA vnímáno více u pacientů s renální insuficiencí, což je patrno i v naší studii z použitého dávkování. Ochota uptitrovat MRA byla v naší analýze obecně velmi nízká a ještě dále klesala u pacientů s konkomitantní renální insuficiencí (což je asi správné). V praxi by mohlo přinést zlepšení preskripce MRA jednak spolupodávání vazačů kalia (např. patiromer (17)), ale v zásadnější přelom lze doufat až s nástupem novější generace MRA s nižším rizikem hyperkalemie (např. finerenon) (18).
Kontroverzní okolností je u CHSS léčba statiny. Je fakt, že dostupné důkazy nijak nepodporují paušální podávání statinů u CHSS, neboť provedené dvě intervenční studie (CORONA and GISSI‑HF) neukázaly žádný signifikantní přínos této léčby (19, 20). Jiná situace je ale u pacientů, kde je ICHS zřejmě hlavním etiologickým činitelem srdečního selhání (např. u pacientů s postinfarktovou remodelací levé komory) a kde je naopak léčba statinem mandatorní, a to navíc v nejvyšší dávce. Rozsáhlé meta‑analýzy intervenčních studii prokázaly u pacientů po infarktu myokardu lečených statinem nejen významně nižší riziko úmrtí, ale zároveň i incidence srdečního selhání (20, 21). Jak vidno za našich dat, nutnost léčby statiny byla u analyzovaných pacientů s ischemickou etiologií CHSS velmi často opomíjena (asi u 43 %), a pokud ne, použité dávkování bylo zcela nedostatečné.
V naší analýze jsme dále pozorovali celkem jednoznačný inverzní vztah mezi dávkou furosemidu při propuštění a prognózou pacienta (tj. čím vyšší byla dávka furosemidu, tím vyšší bylo také riziko mortality, a to i po plné adjustaci). Tento zdánlivý paradox byl pozorován i v řadě dalších studií, a to z hlediska použité dávky diuretika před, během i po hospitalizaci (23, 24). Neměl by se však asi ale interpretovat tak, že vysoká dávka furosemidu pacientům škodí (jakkoliv zcela to vyloučit nemůžeme), jako spíše že pacienti v pokročilejším stadiu CHSS (tudíž i s horší prognózou) také bohužel vyžadují i vyšší dávky diuretika.
Naše analýza vůbec nezahrnuje možná nejvíce průlomovou skupinu v léčbě CHSS z poslední doby, tj SGLT-2 (sodium‑glucose co‑transporter 2) inhibitory. Důvodem je, že preskripce těchto preparátů byla v době, kterou naše studie pokrývá (tj. do roku 2020), zcela marginální (v celém souboru jsme nalezli jen 28 pacientů, kterým byla tato léčba doporučena, a to bezpochyby v indikaci diabetu). Lze jen doufat, že v současné době bude situace v tomto směru již lepší.
Limitace studie
Analyzovaný soubor bezpochyby představoval velmi rizikovou skupinu subjektů, protože již sám fakt, že u pacientů došlo k hospitalizaci pro kardiální dekompenzaci, ukazuje, že CHSS těchto pacientů dosáhlo značně pokročilého stadia. Naše pozorování (zejména z hlediska rizika úmrtnosti) tedy pravděpodobně nejsou plně přenositelná na dlouhodobě stabilní pacienty s CHSS vyžadující pouze ambulantní péči. Pro naši analýzu jsme použili pouze první hospitalizaci a máme k dispozici 10letý pohled zpět (2001–2009) ohledně předchozí hospitalizace pro srdeční selhání v naší nemocnici. Většina hospitalizací pro srdeční selhání tedy pravděpodobně představuje první takovou událost. Na druhou stranu nemáme úplná data o hospitalizaci HF mimo naši nemocnici (která je však největší v regionu a pokrývá většinu kardiologické péče) a před rokem 2001. Vzhledem k nově přijatým pravidlům GDPR není v současné době také možné získat údaje z národního registru hospitalizací, naše studie proto nemohla analyzovat výskyt rehospitalizací pro kardiální dekompenzaci.
Rovněž nemáme žádné údaje ohledně úpravy dávkování v ambulantní péči pro propuštění, a jakkoliv právě realizujeme určitý průzkum v tomto směru, tento údaj bude i tak zjistitelný pouze u těch pacientů, co dlouhodobě CHSS přežívají.
Závěry pro praxi
Preskripce základní farmakoterapie celkem jistě v klinické praxi nedosahuje u pacientů s CHSS svého optima. Nezanedbatelná část pacientů v době propuštění z hospitalizace pro (primo)manifestaci neužívala některý ze základních preparátů v léčbě CHSS (cca 20 % v případě BB nebo RAS blokátorů, více než 40 % v případě MRA). Asi 17 % pacientů sice užívalo BB, ale nikoliv ten s indikací u CHSS. Rovněž tato farmakoterapie nebyla uptitrována k maximální tolerované dávce zdaleka u všech pacientů, kteří by asi toto tolerovali.
Z analýzy vyplynulo několik okolností, které by pravděpodobně mohly obecně vést ke zlepšení praxe v péči o tyto jistě extrémně rizikové pacienty. Tou nejsnazší je asi důsledná preskripce BB, které mají oporu v důkazu přínosu u CHSS („nevhodný“ BB mělo doporučeno v našem souboru až 17 % pacientů). Podobně i léčba RAS blokátory byla asi zbytečně „rozmanitá“ a mnohdy byly předepisovány zástupci, kteří mají i oficiální indikaci pouze v léčbě hypertenze (jakkoliv obecně předpokládáme u RAS blokátorů „class–effect“, asi k tomu není žádný racionální důvod). O něco složitější bude situace z hlediska dávkování. Ideální by asi bylo, kdyby k uptitraci základní farmakoterapie k maximální tolerované dávce (pokud možno) došlo již v době hospitalizace, kdy lze toto provést asi bezpečněji a jistě komfortněji. Pokud toto možné není, je vhodné nutnost up‑titrace alespoň jednoznačně formulovat v propouštěcí zprávě. Znovu je také třeba zmínit nutnost i v praxi respektovat nejrecentnější poznatky v léčbě CHSS (což se týká především preskripce SGLT-2 inhibitorů, ale i sacubitril‑vasaltanu a nejnověji i vericiguatu u pacientů s redukovanou EF).
Celkově lze tedy shrnout, že důslednější farmakoterapie podle doporučených principů v sobě jistě skrývá poměrně velký nevyužitý potenciál ke zlepšení prognózy pacientů s CHSS.
Poděkování
Předkládaná analýza byla realizována za grantové podpory fondu Specifického výzkumu Univerzity Karlovy [grant SVV 2020-2022, č. 260 537] a výzkumného fondu Univerzity Karlovy COOPERATIO. Chtěli bychom rovněž poděkovat všem pracovníkům Ústavu zdravotnické informace a statistiky a jmenovitě p. Adolfu Binderovi za laskavé stanovení vitálního statusu našich pacientů, bez čehož by tato analýza nebyla možná.
prof. MUDr. Otto Mayer jr., CSc.
II. interní klinika FN, Plzeň
mayero@fnplzen.cz
Cit. zkr: Vnitř Lék. 2023;69(2):109-118
Článek přijat redakcí: 5. 1. 2023
Článek přijat po recenzích: 6. 3. 2023
Sources
1. Bozkurt B, Coats AJS, Tsutsui H, et al. Universal definition and classification of heart failure: a report of the Heart Failure Society of America, Heart Failure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the Universal Definition of Heart Failure: Endorsed by the Canadian Heart Failure Society, Heart Failure Association of India, Cardiac Society of Australia and New Zealand, and Chinese Heart Failure Association, Eur J Heart Fail. 2021;23 : 352-380.
2. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure, Eur Heart J. 2021;42 : 3599-3726.
3. Mayer O, Bruthans J, Bilkova S, et al. The prognosis and therapeutic management of patients hospitalized for heart failure in 2010-2020, Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2022;166 : 312-321.
4. Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate, Ann Intern Med. 2009;150 : 604-612.
5. Maggioni AP, Anker SD, Dahlström U, et al. Are hospitalized or ambulatory patients with heart failure treated in accordance with European Society of Cardiology guidelines? Evidence from 12,440 patients of the ESC Heart Failure Long‑Term Registry, Eur J Heart Fail. 2013;15 : 1173-1184.
6. Bavishi C, Chatterjee S, Ather S, et al. Beta‑blockers in heart failure with preserved ejection fraction: a meta‑analysis, Heart Fail Rev. 2015;20 : 193-201.
7. Chatterjee S, Biondi‑Zoccai G, Abbate A, et al. Benefits of β blockers in patients with heart failure and reduced ejection fraction: network meta‑analysis, Bmj. 2013;346:f55.
8. Poole‑Wilson PA, Swedberg K, Cleland JG, et al. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomised controlled trial, Lancet. 2003;362 : 7-13.
9. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT‑HF), Lancet, 1999;353 : 2001-2007.
10. Špinarová M, Špinar J, Pařenica J, et al. Prescription and dosage of RAAS inhibitors in patients with chronic heart failure in the FAR NHL registry, Vnitr Lek. 2019;65 : 13-14.
11. McMurray JJ, Packer M, Desai AS, et al. Angiotensin‑neprilysin inhibition versus enalapril in heart failure, N Engl J Med. 2014;371 : 993-1004.
12. Khan MS, Fonarow GC, Ahmed A, et al. Dose of Angiotensin‑Converting Enzyme Inhibitors and Angiotensin Receptor Blockers and Outcomes in Heart Failure: A Meta‑Analysis, Circ Heart Fail. 2017;10.
13. Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators, N Engl J Med. 1999;341 : 709-717.
14. Pitt B, Remme W, Zannad F, et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction, N Engl J Med. 2003;348 : 1309-1321.
15. Pfeffer MA, Claggett B, Assmann SF, et al. Regional variation in patients and outcomes in the Treatment of Preserved Cardiac Function Heart Failure With an Aldosterone Antagonist (TOPCAT) trial, Circulation. 2015;131 : 34-42.
16. Juurlink DN, Mamdani, MM Lee DS, et al. Rates of hyperkalemia after publication of the Randomized Aldactone Evaluation Study, N Engl J Med. 2004;351 : 543-551.
17. Agarwal R, Rossignol P, Romero A, et al. Patiromer versus placebo to enable spironolactone use in patients with resistant hypertension and chronic kidney disease (AMBER): a phase 2, randomised, double‑blind, placebo‑controlled trial, Lancet. 2019;394 : 1540-1550.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2023 Issue 2
-
All articles in this issue
- Hlavní téma – kardiologie
- Kam kráčí preventivní kardiologie?
- Co je nového v léčbě chronického srdečního selhání?
- Novinky v diagnostice a léčbě kardiomyopatií
- Dopady nekontrolované hypertenze na CNS
- Dávkování základní farmakoterapie a jeho vliv na prognózu pacientů hospitalizovaných pro srdeční selhání
- Možnosti léčby bolesti u osteoartrózy
- Supresní terapie levothyroxinem v léčbě karcinomu štítné žlázy
- Novinky v imunologii
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Novinky v diagnostice a léčbě kardiomyopatií
- Co je nového v léčbě chronického srdečního selhání?
- Novinky v imunologii
- Supresní terapie levothyroxinem v léčbě karcinomu štítné žlázy
