Multimorbidní nemocný v intenzivní péči
Critical care for multimorbid patients
Multimorbidity – the simultaneous presence of several chronic diseases – is very common in the critically ill patients. Its prevalence is roughly 40–85 % and continues to increase further. Certain chronic diseases such as diabetes, obesity, chronic heart, pulmonary, liver or kidney disease and malignancy are associated with higher risk of developing serious acute complications and therefore the possible need for intensive care. This review summarizes and discusses selected specifics of critical care for multimorbid patients.
Keywords:
intensive care – organ dysfunction – chronic disease – multimorbidity
Authors:
Marcela Královcová 1; Thomas Karvunidis 1,2; Martin Matějovič 1,2
Authors‘ workplace:
Jednotka intenzivní péče, I. interní klinika, Lékařská fakulta v Plzni, Univerzita Karlova a Fakultní nemocnice Plzeň
1; Biomedicínské centrum, Lékařská fakulta v Plzni, Univerzita Karlova
2
Published in:
Vnitř Lék 2023; 69(3): 166-172
Category:
Main Topic
doi:
https://doi.org/10.36290/vnl.2023.029
Overview
Multimorbidita – současná přítomnost více chronických onemocnění – je u kriticky nemocných velmi častá. Její prevalence je zhruba 40–85 % a trendově se dále zvyšuje. Určitá chronická onemocnění, jako např. diabetes mellitus, obezita, chronické onemocnění srdce, plic, jater či ledvin a malignity, jsou asociovány s vyšším rizikem rozvoje závažných akutních komplikací a tedy i případné potřeby intenzivní péče. Tento přehledový článek shrnuje a diskutuje vybraná specifika péče o multimorbidní kriticky nemocné.
Klíčová slova:
intenzivní péče – multimorbidita – chronické onemocnění – orgánové dysfunkce
Úvod
Multimorbidita, resp. přítomnost dvou a více chronických onemocnění je u kriticky nemocných velmi častá. Dle vybrané populace pacientů se její prevalence pohybuje v širokém rozmezí 40–85 % (1–4), počet těchto nemocných se stále zvyšuje a tento trend lze jednoznačně očekávat i do budoucna. Navíc určitá chronická onemocnění, jako např. diabetes mellitus, chronické onemocnění srdce, plic, jater či ledvin, HIV a malignity, jsou asociována s vyšším rizikem rozvoje významné akutní deteriorace zdravotního stavu – kritického stonání – a tedy i případné potřeby intenzivní péče (5–8). Pojem multimorbidita používáme více v charakteristice chronického zdravotního stavu. Při jeho akutním zhoršení či nové komplikaci označujeme přítomná chronická onemocnění jako komorbidity.
Multimorbidita je heterogenní stav. Stále neexistuje žádný univerzální koncept, který by popisoval zátěž a dopad na jednotlivé pacienty a který by tak poskytoval užitečné a použitelné informace pro léčbu kriticky nemocných pacientů. Pouhý výčet a součet chronických onemocnění se v tomto ohledu zdá příliš zjednodušující a nepřesný. Je zcela zřejmé, že jedinec s dobře kontrolovanou hypertenzí a osteoporózou (což již naplňuje definici multimorbidity) nebude mít stejná rizika, průběh a výstup z intenzivní péče stejnou prognózu a nebude vyžadovat stejnou úroveň péče jako kriticky nemocný s pokročilým chronickým onemocněním ledvin a současnou chronickou obstrukční plicní nemocí dependentní na domácí oxygenoterapii (DDOT) (2, 9). Nicméně podrobný rozbor trajektorií nemocných v intenzivní péči (IP) naznačuje, že počet komorbidit přesto hraje určitou roli v predikci klinického průběhu vybraných specifických podskupin pacientů (2, 6, 7). Index (multimorbidity index, MMI) hodnotící významnost jednotlivých chronických onemocnění na přežití nemocných v IP se v retrospektivní studii na více než 442 000 pacientech dokonce ukázal lepším prediktorem krátkodobé i dlouhodobé celkové mortality než odhad odvozený z biomarkerů akutní fyziologie (APACHE) (10). Schopnost multimorbidních pacientů vypořádat se s těžkým stresorem, jakým je kritický stav, však není limitována jen mírou a závažností přidružených chronických chorob, ale významně i jejich křehkostí (frailty), která by měla být vždy vyhodnocena při zvažování přínosu léčby v podmínkách intenzivní péče (11, 12). Je tedy zřejmé, že jakákoliv prognostická rozvaha je vždy kompozitním procesem, zahrnujícím závažnost a reverzibilitu akutního stavu, závažnost a pokročilost chronických komorbidit, křehkost pacienta a jeho přání.
Přítomnost chronických onemocnění přímo ovlivňuje predispozice, průběh a výstup některých sekundárních orgánových komplikací (např. akutního poškození plic – ARDS). Pacienti s komorbiditami mají obecně také mnohem vyšší riziko časného i pozdějšího znovupřijetí do intenzivní péče v rámci jedné hospitalizace (13, 14).
Vybrané fyziologické aspekty multimorbidních pacientů
Fyziologické kompenzační mechanismy většiny multimorbidních pacientů jsou omezeny. V kardiovaskulárním systému jde zejména o omezenou chronotropní a inotropní rezervu jedinců s limitovanou systolickou funkcí; pacienti s diastolickou dysfunkcí jsou zase méně tolerantní k hypovolemii a normální preload je klíčový k udržení dostatečného srdečního výdeje. Omezené rezervy respiračního systému snadno vedou rychlému rozvoji hypoxemie a hyperkapnie a následné alveolární hypoventilace. Stav může vyústit v neočekávaně rychlou zástavu oběhu u pacientů se sníženou respirační a kardiovaskulární rezervou. Situace, kdy akutní problém způsobí dekompenzaci chronických onemocnění u starších a multimorbidních pacientů, je někdy označována jako „geriatrická kaskáda“ (15, 16).
Multimorbidita vystavuje pacienty i riziku kombinace různých typů šokových stavů. Septický šok se může časně komplikovat významnou kardiogenní komponentou (kardiogenním šokem; hypodynamickým fenotypem septického šoku) v důsledku současně probíhající akutní ischemie či špatné hemodynamické tolerance tachyarytmie. Typická pro multimorbidní pacienty je i snížená kognitivní rezerva, kdy zmatenost či delirantní stav jsou často prvními a vysoce varovnými projevy akutní deteriorace.
Prognostikace multimorbidních nemocných v intenzivní péči
Stanovení prognózy (krátkodobé i dlouhodobé) multimorbidních nemocných v IP je velmi obtížné. Obdobně jako v léčbě i zde postrádáme kvalitní vědecké podklady s doporučení. Vzhledem k tomu, že se skupina multimorbidních a starých nemocných ani zdaleka nemusí překrývat, nemusí pro tyto nemocné platit zavedené obecné prognostické modely či prognostikace založená na „křehkosti“ a „performance statu“ (PS) (17). Naopak, průběh stonání a jeho výsledek může být někdy i překvapující a na první pohled v rozporu s logickými očekáváními: např. nižší mortalita obézních septických nemocných ("obesity paradox") (18) nebo malý vliv aktivní malignity a její léčby na krátkodobou mortalitu v IP (19). Prognózu multimorbidních pacientů v IP ovlivňuje současně akutní onemocnění i vlastní chronické komorbidity.
Management multimorbidních nemocných v intenzivní péči – obecné poznámky a praktický přístup
Přijetí multimorbidního nemocného do IP respektuje obecná doporučení; multimorbidita není kontraindikací per se. Multimorbidní nemocní jsou zpravidla vždy vyřazováni z klinických studií. Dostupných informací a doporučení k této problematice je tedy velmi málo (20). Vzhledem k absenci robustních dat se jako nejlepší jeví komplexní a multidisciplinární péče vycházející z up‑to‑date znalostí léčby jednotlivých a v danou situaci zásadních komorbidit integrovaná s vysokým standardem intenzivní péče. Standardní a uniformní postup cílený pouze na jedno onemocnění či klinickou situaci velmi často selhává. Je nezbytné včas plánovat komplexní léčebnou strategii a rozsah léčby pro různé klinické scénáře průběhu stonání (agresivní léčba, zadržená léčba, paliativní léčba a „end‑of‑life care) (2). Cílem a prostředkem je individualizovná péče s ohledem na konkrétního jedince, okolnosti, preference a cíle jednotlivých pacientů (tzv. „patient‑centred“ a „quality‑of‑life (QoL)-centred care), včasné plánování léčebných strategií pro různé situace a vývoj stonání („advance care planning“) a stanovení realistických a smysluplných léčebných cílů zahrnující závažnost a reverzibilitu akutního stavu, závažnost a pokročilost chronických komorbidit, křehkost pacienta a jeho přání (2, 21, 22). Zcela nezbytná je dobrá komunikace s nemocným a rodinou/blízkými a samozřejmě i mezioborová spolupráce. Následující doporučení jsou obecná a vychází z dostupných doporučených postupů, recentních literárních zdrojů a postupů dobré klinické praxe.
Hemodynamika:
■ ideálně sonograficky kontrolovaná a spíše konzervativní tekutinová léčba (není‑li jiný důvod, např. krvácení)
■ promptní léčba hypotenze; opožděná korekce hypotenze výrazně zhoršuje mortalitu a morbiditu (nejen) multimorbidních pacientů (multiorgánové selhání, ireverzibilní delirium či redukce kognitivních funkcí)
■ důsledná kontrola nepřiměřené srdeční frekvence, zejména tachyfibrilace síní; aktivní léčba provokujících faktorů (horečka, bolest, infekce, hyperkapnie, acidóza, delirium, léky…)
Oxygenační a ventilační podpora:
■ „step‑up“ přístup, neurčuje‑li klinický kontext jinak: od oxygenoterapie nosními hroty a polomaskou, přes vysokoprůtokovou oxygenaci a neinvazivní ventilaci až po umělou plicní ventilaci
■ časné invazivní zajištění dýchacích cest (intubace) a zahájení umělé plicní ventilace ještě před významným vyčerpáním pacienta
■ permisivní hypoxie u nemocných s chronickým hypoxickým onemocněním plic (např. CHOPN na DDOT, intersticiální plicní onemocnění apod.)
■ permisivní hyperkapnie u nemocných s chronickým hyperkapnickým plicním onemocněním (např. CHOPN)
■ minimalizace analgosedace, preferenčně propofol/dexmedetomidin, ne benzodiazepiny
Podpora a náhrada funkce ledvin:
■ minimalizace nefrotoxických inzultů (neřešená hypotenze/hypoperfúze, NSAID, COX inhibitory, nefrotoxická antibiotika, opakovaná kontrastní vyšetření) s cílem maximálního zachování reziduální funkce ledvin u pacientů s chronickým onemocněním ledvin (chronic kidney disease, CKD)
■ indikace náhrady/podpory funkce ledvin (renal replacement/support therapy, RRT/RST), metoda (intermitentní, kontinuální), modalita (hemodialýza, hemofiltrace), dávka, antikoagulace respektuje obecné principy bez ohledu na přidružené chronické komorbidity (23, 24)
■ vyvarovat se kanylace podklíčkové žíly (případná perzistující trombóza asociovaná s katetrizací této žíly může v budoucnu znemožnit založení funkční arteriovenózní píštěle)
■ terapeutické monitorování hladin léků, kdykoliv je to dostupné
Výživa:
■ velmi často malnutrice, sarkopenie, riziko refeeding syndromu
■ adekvátní energetická a proteinová alimentace cílená, lépe na adjustovanou tělesnou hmotnost dle aktuálních doporučení (25, 26)
■ preference perorálního příjmu či enterální nutrice před parenterální výživou
■ dočasné přerušení léčby perorálními antidiabetiky (zejm. metformin); inzulinoterapie
■ minimalizace variability glykemie; permisivní mírná hyperglykemie (např. 7–10 mmol/l) a důsledná prevence hypoglykemií
Antimikrobiální léčba:
■ časná a adekvátní antimikrobiální léčba; čím závažnější je stav nemocných, tím důležitější je časné zahájení („hit early, hit hard“)
■ úprava dávkování při extrémech tělesné hmotnosti, orgánových dysfunkcích (ledviny, játra) a eliminačních podporách (dialýza)
■ co nejkratší potřebná doba antimikrobiální léčby s ohledem na klinický stav a případně i dynamiku biomarkerů
■ časná a cílená deeskalace ATB léčby dle výsledků mikrobiologických vyšetření
■ antimikrobiální profylaxe rizikových imunosuprimovaných nemocných
Preventivní a profylaktická léčba:
■ prevence „stresového“ poškození gastroduodenální sliznice – inhibitory protonové pumpy, časná perorální výživa či enterální nutrice
■ prevence hluboké žilní trombózy (CAVE: žilní katetry) – profylaktická antikoagulační léčba nízkomolekulárními hepariny nebo komprese/ bandáže dolních končetin
■ prevence dekubitů, prevence neuromyopatie kriticky nemocných – minimalizace sedace a nervosvalové relaxace, kvalitní ošetřovatelská péče, antidekubitární matrace, časná rehabilitace a mobilizace
■ terapeutické monitorování hladin léků, kdykoliv je to dostupné
■ racionální farmakoterapie – klinický farmakolog, vyvarovat se polypragmázie
Rehabilitace:
■ časná a intenzivní rehabilitace a mobilizace nemocných (i s orgánovými podporami)
■ spánkový režim, reorientace, naslouchátka, brýle (prevence a léčba deliria)
Kvalitní post‑ICU péče:
■ časné rozpoznání nozokomiálních infekcí
■ prevence rizik neuromyopatie kriticky nemocných – dekubity, hypoventilace, poruchy polykání
■ pokračující adekvátní výživa (energie a zejména protein), aktivní rehabilitace
Diabetes mellitus
Přestože bývá diabetes spojován s vyšší náchylností k infekčním onemocněním (27), není zcela jasné, zda a jak ovlivňuje průběh kritického stonání (28–30). Diabetici mají významně (2–3×) zvýšené riziko rozvoje sepse ve srovnání s běžnou populací. Infekce krevního řečiště, močových cest, kůže a měkkých tkání jsou u nich také častější (5, 29, 31). DM zřejmě sám o sobě není rizikovým faktorem pro vyšší mortalitu u nechirurgických kriticky nemocných (32, 33). Na druhou stranu jedinci s DM v IP mají vyšší morbiditu – vyšší výskyt orgánových poškození, dominantně poškození ledvin, zřejmě v důsledku chronických orgánových dysfunkcí patofyziologicky asociovaných přímo s DM (28, 29, 34).
Častými komplikacemi (nejen) diabetiků v IP jsou hypoglykemie, hyperglykemie a inzulinorezistence. Významná variabilita glykemie v průběhu kritického stonání, zejména sepse a septického šoku, je jedním z faktorů zvyšujících mortalitu (35–37). Zajímavým poznatkem je, že nemocní, kteří mají sice hyperglykemii, ale současně minimální variabilitu hodnot glykemie, mají mortalitu nižší (35). Jedním z důležitých terapeutických cílů je tedy minimalizovat variabilitu glykemie v bezpečném pásmu (např. 7–10 mmol/l) s frekventní monitorací, dočasným vysazením perorálních antidiabetik a jejich nahrazením inzulinoterapií (38). Samostatnou kapitolou jsou pak akutní komplikace DM vedoucí k deterioraci stavu nemocných s nutností jejich přijetí do IP. Pojednání o těchto stavech je nad rámec tohoto sdělení.
Obezita
Tuková tkáň má signifikantní anatomický i (pato)fyziologický význam pro kritické stonání (39). Obezita je dle některých studií asociována s lepším přežíváním kritického stonání (18, 40, 41). Významnost tohoto faktu však není jasná – nelze přesně specifikovat, zda se jedná o protektivní vliv obezity jako takové či pouze limitace a nedostatky studií (42, 43).
Změny mechaniky ventilace obézních jedinců mohou vést k hypoventilačnímu syndromu obézních (Pickwickův syndrom) s hypoxií/ hypoxemií a hyperkapnií/hyperkapnémií (39, 44). Problematická může být ventilační podpora kriticky nemocných obézních jedinců. Selhání neinvazivní ventilace (NIV) obličejovou maskou je častější, stejně jako i významná periintubační hypoxie (39, 44, 45). Obezita může dále komplikovat i vlastní konvenční UPV (mechanika dýchání, rezistence hrudníku, atelektázy apod.) i případné ventilační rescue postupy jako pronační poloha či extrakorporální membránovou oxygenaci (ECMO) (46, 47). Překvapivě nemusí být obezita vždy asociována s obtížným či protrahovaným weaningem z UPV ani s vyšším výskytem komplikací tracheostomií (48, 49). Obézní nemocní mají relativně větší incidenci systolické i diastolické dysfunkce LKS (a PKS), plicní hypertenze a fibrilace síní (52, 53). Tyto faktory pak mohou sehrávat důležitou roli v průběhu kritického stonání např. ve smyslu vyšší arytmogenní pohotovosti a hypodynamického fenotypu septického šoku. Obezita je rizikovým faktorem pro CKD i akutní poškození ledvin (acute kidney injury, AKI) v populaci kriticky nemocných (54–56). Subklinické CKD, intraabdominální hypertenze, alterace imunitní odpovědi a popřípadě změny cirkulujících chemokinů vč. adipokinů jsou jen některé zvažované mechanismy spojující obezitu s poškozením ledvin (55, 56). Velká nadváha může být významně zavádějící (overdiagnosis) v definování AKI na základě diurézy vztažené na tělesnou hmotnost (ml/kg/h) (57). Diagnostika na základě hladiny sérového kreatininu či jeho clearance vykazuje vyšší spolehlivost nebo je třeba k odhadu hodinové diurézy používat ideální či adjustovanou tělesnou hmotnost. Obdobný problém nastává také v preskripci dávky náhrady funkce ledvin (dialýzy; 20–25 ml/kg/h) (58). Obezita je také rizikovým faktorem pro rozvoj infekcí, infekcí krevního proudu, kůže a měkkých tkání a pneumonie (59, 60). Obézní jedinci vykazují známky chronické inflamace, alterace vrozené a adaptivní imunitní odpovědi celulární i protilátkové a jsou vystaveni riziku neadekvátního dávkování antibiotik (44, 61). Čelí tak většímu riziku sekundárních, nozokomiálních infekcí (44, 59).
Dávkování léčiv je zpravidla doporučeno na základě studií na kohortách s normální, resp. průměrnou tělesnou hmotností a aplikace těchto dávkovacích schémat na populaci obézních pacientů může být zavádějící a nepřesná. Obézní mají vetší distribuční prostor jak pro lipofilní, tak i pro hydrofilní léčiva a také jejich clearance se může významně lišit (62). Dávkování léků je tedy potřeba přísně individualizovat, a pokud je to jen trochu možné, využít monitorace plazmatických lékových hladin s adekvátní úpravou dávek či dávkovacího intervalu, a to zejména u léků s úzkým terapeutickým oknem či potenciálně významnými nežádoucími účinky předávkování i poddávkování (LMWH, ATB apod.).
Obezita je asociována s vyšším rizikem hluboké žilní trombózy u běžné populace i u populace kriticky nemocných (63). Příčinou může být prokoagulační stav, snížený žilní návrat, intraabdominální hypertenze a také neadekvátní dávka antikoagulační profylaktické léčby (viz výše) (64–66). Ultrasonografická (DUSG) diagnostika je pro obezitu často velkou výzvou (67).
Obtížnější ošetřovatelská péče, polohování, rehabilitace a mobilizace, limitace některých vyšetření (USG, MR apod.) jsou také častěji spojeny s obezitou nemocných v IP. Problematické může být i zajištění spolehlivého žilního vstupu, resp. kanylace centrální žíly arterie k adekvátní hemodynamické monitoraci a odběru vzorků krve k vyšetření.
Chronické srdeční selhání
Prevalence a délka života nemocných s chronickým srdečním selháním (chronic heart failure, CHF) stoupají (68, 69). Na jejich mortalitě mají v posledních letech stále významnější podíl nekardiální příčiny (až 43 %) a to zejména systémová infekce/sepse (až 55 % z nekardiálních příčin, resp. až 24 % ze všech úmrtí jedinců s CHF) (70). Zhruba 31 % úmrtí je v důsledku progrese srdečního selhání a přibližně v 16 % je příčinou náhlá srdeční smrt (70). Ať už je příčina deteriorace chronického stavu a následného přijetí nemocných s CHF do IP jakákoliv, jejich trajektorie stonání je významně komplikovanější, pravděpodobnost rozvoje selhání dalších orgánových systémů větší, infekční komplikace častější a mortalita vyšší a časná readmise do IP častější (71). Pro správnou diagnostiku, diferenciální diagnostiku, stratifikaci, terapeutickou rozvahu a sledování jejího efektu je zcela nepostradatelné kvalitní echokardiografické, resp. ultrasonografické vyšetření. Kriticky nemocní jedinci s CHF mají vyšší riziko významné hemodynamické kompromitace a příp. refrakterního šoku, arytmií (iontová dysbalance, lékové interakce, změny QT intervalu apod.), infekčních komplikací (nozokomiální infekce), deliria, polyneuromyopatie, nežádoucích účinků analgosedace (hypotenze, arytmie, delirium) a pozičních traumat (dekubity) než populace kriticky nemocných bez CHF (71).
Primárním terapeutickým cílem je zajištění adekvátní orgánové perfúze a oxygenace a současná léčba vyvolávající příčiny (strukturální onemocnění srdce, ischemická myokardiální léze, arytmie, infekce atd.). Neinvazivní či invazivní ventilace s pozitivním tlakem je modalitou volby u nemocných s CHF a respiračním selháním (např. kardiogenní plicní otok) (72). V současné době obecně přijímaná a doporučená restriktivní strategie tekutinové léčby a resuscitace (např. u pacientů v septickém šoku) je zvláště účelná u jedinců s CHF a to zejména u CHF se sníženou ejekční frakcí levé komory srdeční (LKS) (HFrEF) a měla by být řízena a optimalizována na základě opakovaného dynamického hodnocení volémie, resp. efektu volumoterapie. Noradrenalin je vazopresorem volby i u hypotenzních pacientů s CHF (72). Při zvyšujících se dávkách noradrenalinu je vhodné jej časně kombinovat s vazopresinem, resp. arginin‑vazopresinem (AVP), a předcházet tak nežádoucím efektům vysokých dávek noradrenalinu (tachyarytmie, dynamická obstrukce výtokového traktu levé komory apod.). AVP lze rovněž využít při selhání pravé komory srdeční (PKS) pro jeho vazodilatační účinek na plicní cirkulaci (72). Dobutamin je inotropikem volby u nemocných v kardiogennícm šoku či kardiogenním v kombinaci s jiným typem šoku (nejčastěji septickém) (72). Opatrnosti při jeho užití je potřeba zvláště u nemocných s (rizikem) tachyarytmií, hypertrofickou kardiomyopatií, probíhající myokardiální ischemií (akutní koronární syndrom) či současnou vazoplegií (např. septický šok). Terapeutický efekt dobutaminu může být významně mitigován u jedinců s chronickou léčbou betablokátory. Alternativou inotropní podpory je levosimendan či milrinon (72). Časná kontrola srdečního rytmu nebo srdeční frekvence může významně přispět ke stabilizaci hemodynamiky. Před užitím potentních antiarytmik či bradykardizující medikace je vhodné eliminovat potenciální (tachy) arytmie‑provokující okolnosti (stres, bolest, horečka apod.) (72).
Volba i načasování případné mechanické podpory cirkulace (ECMO, IABP, VAD, TAH) by měly být přísně individualizované s pečlivou selekcí nemocných. I zde je nezbytná úzká mezioborová spolupráce (kardiolog, kardiochirurg, intenzivista, internista). Obdobně to platí i pro výběr a přípravu nemocných k transplantaci srdce. U nemocných s diastolickým srdečním selháním se zachovanou systolickou funkcí LKS je důležitá zejména adekvátní léčba hypertenze a tachykardie; inotropika nejsou u této populace nemocných vhodná/indikovaná (72).
Chronická obstrukční plicní nemoc
Prevalence chronické obstrukční plicní nemoci (CHOPN) je v populaci poměrně vysoká (10–20 %) (73). Nejčastějším důvodem přijetí nemocných s CHOPN do IP je její akutní exacerbace při plicní infekci (74, 75). Spektrum kauzálních patogenů této populace je odlišné od nemocných bez CHOPN. Virové infekce dýchacích cest jsou velmi často spouštěči exacerbace s komplikující bakteriální ko‑infekcí (superinfekcí) s frekventním výskytem multirezistentních patogenů. Tento fakt může být mj. důsledkem odlišné miktrobioty nemocných s CHOPN (76, 77). Jedinci s CHOPN mají vyšší incidenci akutního respiračního selhání a potřeby umělé plicní ventilace (UPV) a také ICU‑mortalitu (78). Hospitalizace jedinců s CHOPN v IP je delší, stejně tak i doba UPV a weaning z ní bývá relativně často protrahovaný. Relativně častou komplikací bývá i pravostranné srdeční selhání.
Primárním terapeutickým cílem je zajištění adekvátní oxygenace, a to v úvodu i za cenu permisivní hyperkapnie. Cíl oxygenace musí být zvolen realisticky (např. SpO2 > 85–90 %), a to i s ohledem na chronické hodnoty. Při rychlé normalizaci kapnémie, u nemocných s chronickou hyperkapnií s metabolickou kompenzací, hrozí riziko významné metabolické alkalózy, a to zejména u pacientů na UPV (79).
Chronické onemocnění ledvin
Chronické onemocnění ledvin (CKD) je velmi častou komorbiditou populace kriticky nemocných s prevalencí přesahující 15–20% (80). Nejčastější příčiny přijetí nemocných s CKD do IP jsou shrnuty v tabulce 1. Jedinci s CKD a zejména chronicky dialyzovaní (end‑stage kidney disease, ESKD) mají v průběhu kritického stonání vyšší mortalitu a pravděpodobnost opakovaného přijetí do IP po relativně dlouhou dobu (81–83). V porovnání s pacienty s akutním poškozením ledvin vyžadujícím dialýzu je však smrtnost kriticky nemocných s CKD nižší (83). Dle literárních dat samotné prodělání kritického stonání zásadně neovlivňuje dlouhodobou prognózu pacientů s CKD/ESKD (83). Vyšší incidence infekčních komplikací u CKD a ESKD jsou dány porušenou bariérovou funkcí, abnormální imunitní reaktivitou a také opakované expozici antibiotiky (83, 84).
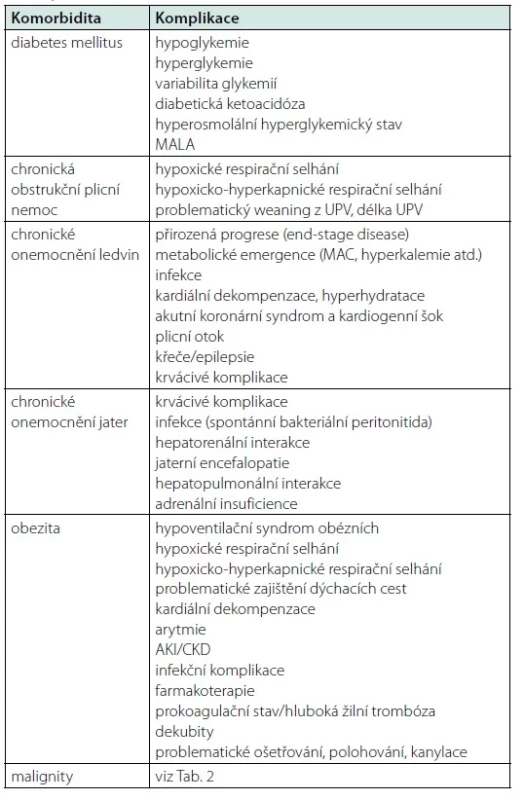
Z praktického pohledu se u nemocných s CKD/ESDK nedoporučuje zavádění PICC vzhledem k riziku možného vyčerpání míst k příp. založení AVF v budoucnu. Je nezbytné dobře zvažovat užití kontrastních látek při zobrazovacích vyšetřeních a radiointervenčních výkonech pro riziko progrese CKD do ESKD, přičemž přístrojová náhrada, resp. podpora funkce ledvin (konkrétně většinou hemodialýza) po aplikaci kontrastní látky nijak nesnižuje riziko této progrese (85, 86). Obdobně je nutné také zvažovat užití nefrotoxických léků (např. ATB) a léků, jejichž farmakokinetiku a farmakodynamiku ovlivňuje poškození ledvin (např. digoxin, některá antiepileptika, virostatika aj.). Dle možností pracoviště a dostupnosti příslušných metod je vhodné využívat monitorace plazmatických koncentrací vybraných léčiv (terapeutic drug monitoring, TDM) a adjustace dávek léků s ohledem na renální funkce a užití RST.
Zvláštní zmínku zasluhují nemocní po transplantaci ledviny. Míra a biologická povaha jejich imunoalterace/imunosuprese se liší dle načasování po transplantaci a konkrétnímu profilu užité imunosupresivní léčby. Tato skupina nemocných je ve významném riziku rozvoje závažných infekčních komplikací vč. infekcí oportunních. Mimo adekvátní individualizovanou antimikrobiální léčbu a antimikrobiální profylaxi je potřeba mít na paměti četné lékové interakce používaných imunosupresiv.
Chronické onemocnění jater
Tato populace se vyznačuje významnou morbiditou a mortalitou, zejména v případech akutní dekompenzace chronické hepatopatie. Mortalita může dosahovat až 50–100 % a to zejména v důsledku závažných komplikací, jako je jaterní encefalopatie, gastrointestinální krvácení, hepatorenální syndrom, kardiální dysfunkce a infekční komplikace (87 – 89). Jednou z nejčastějších komplikací kriticky nemocných hepatopatů je infekce. Příčinou je stav chronické imunodeficience (90, 91). Vzhledem k těmto skutečnostem je včasné zahájení adekvátní antimikrobiální terapie i případné antimikrobiální profylaxe zásadní (92, 93). Další velmi častým důvodem přijetí hepatopatů do IP je gastrointestinální, resp. varikózní krvácení. I přes adekvátní management má tato komplikace stále vysokou mortalitu (> 30%) (94,95). Optimálním postupem je u těchto pacientů zajištění dýchacích cest intubací, adekvátní analgosedace, přiměřená tekutinová resuscitace, rozumná hemosubstituce (Hb >70 g/l), rozvážná korekce koagulopatie (s ohledem na koagulační homeostázu chronické hepatopatie a příp. prokoagulační stav), antimikrobiální profylaxe (ideálně cefalosporin 3. generace) a vazoaktivní terapie s časnou (do 6–12 hodin) endoskopií a (definitivním) ošetřením zdroje krvácení (ligace jícnových varixů) (89, 96). Terlipresin je aktuálně stále jediným vazoaktivním lékem s prokázaným mortalitním benefitem (89, 97). Současně je také vždy potřeba zvážit možnost časného (do 48 hodin) založení transjugulárního portosystémového shuntu (TIPS). Tento postup vykazuje relativně dobrou úspěšnost (selhání v 1 roce cca 3% vs. 50% při konvenční léčbě) a snížení mortality (mortalita v 1 roce 14% vs. 40% při konvenční léčbě), a to bez významného rizika rozvoje jaterní encefalopatie (98).
Akutní poškození ledvin je u kriticky nemocných s pokročilou hepatopatií velmi časté a jeho etiologie je téměř vždy multifaktoriální. Nečastějšími faktory jsou infekce, hypovolemie či hypervolemie, léková nefrotoxicita a hepatorenální syndrom (HRS). Asociace AKI s chronickou hepatopatií zvyšuje krátkodobou mortalitu těchto kriticky nemocných až 10×, významně zvyšuje riziko dalších orgánových postižení a prodlužuje délku hospitalizace (99) 20 ± 8. Časná kompenzace hepatopatie, optimalizace volemie, kontrola infekce a omezení nefrotoxických inzultů spolu s užitím terlipresinu či analog vazopresinu jsou optimální léčebnou strategií pro nemocné s HRS‑AKI (100–102). Náhrada, resp. podpora funkce ledvin (dialýza) je často nezbytná jako „bridging“ terapie.
Maligní onemocnění
Incidence nádorových onemocnění stále roste a současně se zlepšuje jejich léčba a krátkodobá i dlouhodobá prognóza (103, 104). Komplikace alterující vitální funkce přivádí do IP cca 5–10 % nemocných se solidními tumory a cca 15–20 % pacientů s hematologickými malignitami (105–107). Obecná mortalita nemocných s malignitami se příliš neliší od jedinců se závažnými chronickými onemocněními, resp. chronickými orgánovými dysfunkcemi (108). Krátkodobou smrtnost (ICU/in‑hospital mortalitu) kriticky nemocných s maligním stonáním dominantně ovlivňuje konkrétní příčina deteriorace stavu a rozsah akutního orgánového poškození a daleko méně pak vlastní přítomnost malignity, její biologické charakteristiky, případná probíhající léčba (chemoterapie) či její případné komplikace (např. neutropenie) (19, 107). Důležité je načasování přijetí do IP a zahájení adekvátní léčby při alteraci vitálních funkcí nemocných s malignitami. Prodlení (cca > 6–12 hod.) je jednoznačně spojeno s vyšší mortalitou této populace kriticky nemocných (111–113). Nejčastější příčinou přijetí nemocných s malignitami do IP je infekce, resp. sepse/septický šok. Další onkologické emergence a akutní stavy stručně shrnuje tabulka 2. Z orgánových postižení je relativně nejčastější akutní respirační selhání a poškození ledvin.
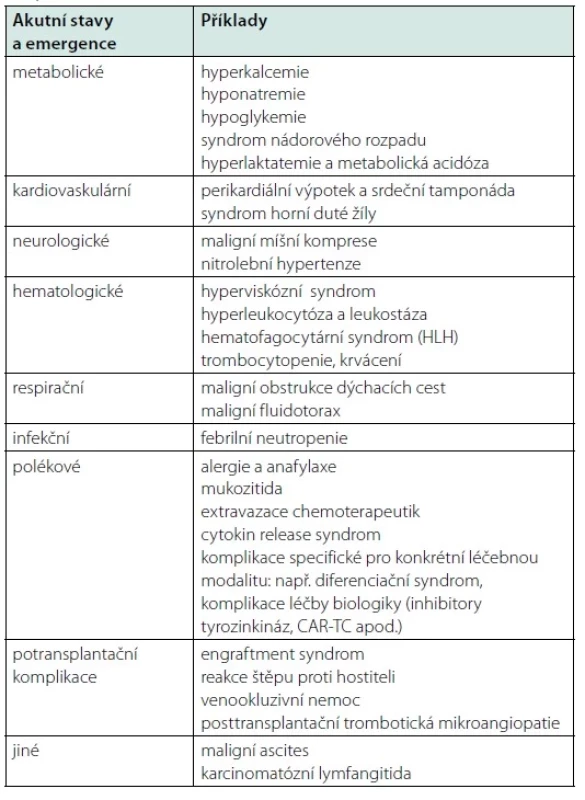
V průběhu IP se v současné době poměrně často setkáváme se současnou potřebou léčit akutní deterioraci stavu i vlastní nádorové onemocnění, zejména u pacientů s hematologickými malignitami. Chemoterapie a další cílená léčba (imunoterapie, biologika aj.) jsou modalitou s případným kurativním potenciálem a současně četnými riziky závažných komplikací (orgánová toxicita, infekce apod.). Zahájení či pokračování této léčby je však v mnoha případech zcela zásadní ke kontrole maligního onemocnění a tedy s ohledem na prognózu nemocných. Zahájení či pokračování této léčby v průběhu IP je zcela jistě možné a nepředstavuje zřejmě rizikový faktor vyšší mortality ani u nemocných se systémovou infekcí a s orgánovým postižením (19, 114–116).
Vybrané specifické problémy multimorbidních pacientů v intenzivní péči
Sepse
Prakticky každý multimorbidní pacient je ve zvýšeném riziku sepse. Záludností může být její včasné rozpoznání, protože typické projevy závažných infekcí mohou chybět. Často jsou první symptomy velmi vágní a nespecifické, např. náhlý rozvoj extrémní slabosti, malátnosti, zmatenost či spavosti. I když se léčba sepse u multimorbidních pacientů neliší od stávajících doporučení, některá úskalí je důvodné zmínit. Tekutinová resuscitace by měla být vedena s využitím dynamické monitorace predikce reakce na tekutiny (tzv. preload responsiveness), protože multimorbidní pacienti jsou obvykle ve vyšším riziku jak nedostatečné, tak nadměrné volumexpanze. Tito pacienti jsou i ve vyšším riziku toxicity katecholaminů (např. rozvoj tachyarytmií). I když tvrdá data chybí, snaha o dekatecholaminizaci s časným využitím analoga vazopresinu je obhajitelným přístupem. Multimorbidní pacient může být také častěji nositelem multirezistentních patogenů, které mohou ovlivnit úvodní volbu antibiotik.
Delirium
Delirium je velmi častou komplikací multimorbidních pacientů a významně negativně ovlivňuje morbiditu i mortalitu. Opatření směřující k prevenci deliria zahrnují minimalizaci analgosedace, preferenci nebenzodiazepinových sedativ (propofol, dexmedetomidin), adekvátní kontrolu bolesti („analgesia first and sedation free strategy“), časnou mobilizaci, frekventní reorientaci, dostatečný spánek, minimalizaci hluku, přítomnost rodiny, omezení restriktivních a invazivních procedur.
Multimorbidní pacient po propuštění z intenzivní péče
Překladem pacienta na standardní oddělení aktivní prevence a časná identifikace komplikací nekončí. Naopak mnoho komplikací se vyskytuje právě během několika prvních dní po překladu. Nejčastějšími jsou nozokomiální infekce (pozor na všechny vstupy – katetry), delirium, arytmie, srdeční selhání, hypoventilace. Zejména multimorbidní pacient z intenzivní péče je ohrožen důsledky polyneuromyopatie kriticky nemocných s imobilizací, dekubity, hypoventilací, poruchami polykání (riziko aspirace). Nejen z tohoto pohledu by jako mezistupeň („step down“) byla vhodná intermediární péče (jednotky/lůžka intermediární péče). Velkou pozornost zasluhuje pokračující výživa a aktivní rehabilitace.
Závěr
Multimorbidní pacienti tvoří v současné době majoritu populace kriticky nemocných a jejich počty budou i nadále růst. V intenzivní péči se tak stále více prolíná problematika akutní deteriorace zdravotního stavu či dokonce vitálních funkcí s chronickými onemocněními a orgánovými dysfunkcemi. S ohledem na obrovskou heterogenitu této populace je zřejmě správnou cestou intenzivní péči o tyto nemocné přísně individualizovat (pacient‑centred care, QoL‑centred care) a využít možnosti prediktivního a prognostického „enrichmentu“ a multioborové spolupráce.
Článek přijat redakcí: 20. 3. 2023
Článek přijat po recenzích: 18. 4. 2023
MUDr. Thomas Karvunidis
Jednotka intenzivní péče, I. interní klinika, LF v Plzni, Univerzita Karlova a FN Plzeň
Sources
1. Simpson A, Puxty K, McLoone P, et al. Comorbidity and survival after admission to the intensive care unit: A population‑based study of 41,230 patients. J Intensive Care Soc. 2021;22(2):143-51.
2. Beil M, Flaatten H, Guidet B, et al. The management of multi‑morbidity in elderly patients: Ready yet for precision medicine in intensive care? Crit Care. 2021;25(1):330.
3. Skou ST, Mair FS, Fortin M, et al. Multimorbidity. Nat Rev Dis Prim. 2022;8(1):48.
4. Nguyen H, Manolova G, Daskalopoulou C, et al. Prevalence of multimorbidity in community settings: A systematic review and meta‑analysis of observational studies. J comorbidity. 2019;9 : 2235042X19870934.
5. Danai PA, Moss M, Mannino DM, et al. The epidemiology of sepsis in patients with malignancy. Chest. 2006;129(6):1432-40.
6. Hodgin KE, Moss M. The epidemiology of sepsis. Curr Pharm Des. 2008;14(19):1833-9.
7. Shappell C, Rhee C, Klompas M. Update on Sepsis Epidemiology in the Era of COVID-19. Semin Respir Crit Care Med. 2023;44(1):173-84.
8. Miller PE, Thomas A, Breen TJ, et al. Prevalence of Noncardiac Multimorbidity in Patients Admitted to Two Cardiac Intensive Care Units and Their Association with Mortality. Am J Med. 2021;134(5):653-661.e5.
9. The Academy of Medical Sciences. Multi‑morbidity: a priority for global health research. 2018. https://acmedsci.ac.uk/fledownload/82222 577.
10. Min H, Avramovic S, Wojtusiak J, et al. A Comprehensive Multimorbidity Index for Predicting Mortality in Intensive Care Unit Patients. J Palliat Med. 2017;20(1):35-41.
11. Guidet B, de Lange DW, Boumendil A, et al. The contribution of frailty, cognition, activity of daily life and comorbidities on outcome in acutely admitted patients over 80 years in European ICUs: the VIP2 study. Intensive Care Med. 2020;46(1):57-69.
12. Nielsen AB, Thorsen‑Meyer H‑C, Belling K, et al. Survival prediction in intensive‑care units based on aggregation of long‑term disease history and acute physiology: a retrospective study of the Danish National Patient Registry and electronic patient records. Lancet Digit Heal. 2019;1(2):e78-89.
13. Paratz J, Thomas P, Adsett J. Re‑admission to intensive care: identification of risk factors. Physiother Res Int J Res Clin Phys Ther. 2005;10(3):154-63.
14. Ho KM, Dobb GJ, Lee KY, et al. The effect of comorbidities on risk of intensive care readmission during the same hospitalization: a linked data cohort study. J Crit Care. 2009;24(1):101-7.
15. Clerencia‑Sierra M, Calderón‑Larrañaga A, Martínez‑Velilla N, et al. Multimorbidity Patterns in Hospitalized Older Patients: Associations among Chronic Diseases and Geriatric Syndromes. PLoS One. 2015;10(7):e0132909.
16. Damluji AA, Forman DE, van Diepen S, et al. Older Adults in the Cardiac Intensive Care Unit: Factoring Geriatric Syndromes in the Management, Prognosis, and Process of Care: A Scientific Statement From the American Heart Association. Circulation. 2020;141(2):e6-32.
17. St Sauver JL, Boyd CM, Grossardt BR, et al. Risk of developing multimorbidity across all ages in an historical cohort study: differences by sex and ethnicity. BMJ Open. 2015;5(2):e006413.
18. Pepper DJ, Demirkale CY, Sun J, et al. Does Obesity Protect Against Death in Sepsis? A Retrospective Cohort Study of 55,038 Adult Patients. Crit Care Med. 2019;47(5):643-50.
19. Karvunidis T, Lysak D, Matejovic M. Dospely onkologicky nemocny v intenzivni peci. Je jiz cas rici „ano, zvazime to“ nez rikat „ne“?! Anesteziol a Intenziv Med [Internet]. 2017;28(6):346-53.
20. Forman DE, Maurer MS, Boyd C, et al. Multimorbidity in Older Adults With Cardiovascular Disease. J Am Coll Cardiol. 2018;71(19):2149-61.
21. Kivelitz L, Schäfer J, Kanat M, et al. Patient‑Centeredness in Older Adults With Multimorbidity: Results of an Online Expert Delphi Study. Gerontologist. 2021;61(7):1008-18.
22. McNelly AS, Flower L, Stephens TJ, et al. Attitudes of multimorbid patients to surviving future acute illness and subsequent functional disability: A systematic review. medRxiv [Internet]. 2020;1.
23. Wald R, Beaubien‑Souligny W, et al. Delivering optimal renal replacement therapy to critically ill patients with acute kidney injury. Intensive Care Med. 2022;48(10):1368-81.
24. Boyer N, Horne K, Selby NM, et al. Renal medicine in the intensive care unit: a narrative review. Anaesthesia. 2023; 11; doi:10.1111/anae.15964.
25. Singer P, Blaser AR, Berger MM, et al. ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr. 2019;38(1):48-79.
26. Compher C, Bingham AL, McCall M, et al. Guidelines for the provision of nutrition support therapy in the adult critically ill patient: The American Society for Parenteral and Enteral Nutrition. JPEN J Parenter Enteral Nutr. 2022;46(1):12-41.
27. Joshi N, Caputo GM, Weitekamp MR, et al. Infections in patients with diabetes mellitus. N Engl J Med. 1999;341(25):1906-12.
28. Graham BB, Keniston A, Gajic O, et al. Diabetes mellitus does not adversely affect outcomes from a critical illness. Crit Care Med. 2010;38(1):16-24.
29. Stegenga ME, Vincent J‑L, Vail GM, et al. Diabetes does not alter mortality or hemostatic and inflammatory responses in patients with severe sepsis. Crit Care Med. 2010;38(2):539-45.
30. Vincent J‑L, Preiser J‑C, Sprung CL, et al. Insulin‑treated diabetes is not associated with increased mortality in critically ill patients. Crit Care. 2010;14(1):R12.
31. Michalia M, Kompoti M, Koutsikou A, et al. Diabetes mellitus is an independent risk factor for ICU‑acquired bloodstream infections. Intensive Care Med. 2009;35(3):448-54.
32. Freire AX, Bridges L, Umpierrez GE, et al. Admission hyperglycemia and other risk factors as predictors of hospital mortality in a medical ICU population. Chest. 2005;128(5):3109-16.
33. Whitcomb BW, Pradhan EK, Pittas AG, et al. Impact of admission hyperglycemia on hospital mortality in various intensive care unit populations. Crit Care Med. 2005;33(12):2772-7.
34. Esper AM, Moss M, Martin GS. The effect of diabetes mellitus on organ dysfunction with sepsis: an epidemiological study. Crit Care. 2009;13(1):R18.
35. Ali NA, O’Brien JMJ, Dungan K, et al. Glucose variability and mortality in patients with sepsis. Crit Care Med. 2008;36(8):2316-21.
36. Krinsley JS. Glycemic variability and mortality in critically ill patients: the impact of diabetes. J Diabetes Sci Technol. 2009;3(6):1292-301.
37. Hermanides J, Vriesendorp TM, Bosman RJ, et al. Glucose variability is associated with intensive care unit mortality. Crit Care Med. 2010;38(3):838-42.
38. Boord JB, Graber AL, Christman JW, et al. Practical management of diabetes in critically ill patients. Am J Respir Crit Care Med. 2001;164(10 Pt 1):1763-7.
39. Anderson MR, Shashaty MG. Impact of Obesity in Critical Illness. Chest. 2021;160(6):2135-45.
Další literatura u autora
a na www.casopisvnitrnilekarstvi.cz
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2023 Issue 3
-
All articles in this issue
- Hlavní téma – Multimorbidita ve vnitřním lékařství
- Perioperační péče o pacienta s multimorbiditou
- Multimorbidita při nefrotickém syndromu
- Multimorbidní nemocný v intenzivní péči
- Specifika diagnostiky a léčby multimorbidních pacientů
- JAK inhibice v léčbě zánětlivých revmatických onemocnění
- Efekt inhibitoru sodíko‑glukózového ko‑transporteru 2 empagliflozinu na vývoj onemocnění u pacienta se srdečním selháním a zachovalou ejekční frakcí
- Diferenciální diagnostika intersticiálních plicních procesů
- Novinky v gastroenterologii, hepatologii a digestivní endoskopii
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Diferenciální diagnostika intersticiálních plicních procesů
- Hlavní téma – Multimorbidita ve vnitřním lékařství
- Multimorbidita při nefrotickém syndromu
- Multimorbidní nemocný v intenzivní péči
