Efekt inhibitoru sodíko‑glukózového ko‑transporteru 2 empagliflozinu na vývoj onemocnění u pacienta se srdečním selháním a zachovalou ejekční frakcí
Effect of sodium-glucose co-transporter-2 inhibitor empagliflozin on disease progression in a patient with heart failure and preserved ejection fraction
Sodiumglucose co-transporter 2 inhibitors – gliflozins – have a scientific evidence on efficacy in patients with heart failure regardless left ventricular ejection fraction. Gliflozins They reduced combined endpoint of cardiovascular mortality and heart failure hospitalization also in patients with heart failure and left ventricular ejection fraction above 40 %. We report a case study of a patient with new onset heart failure. Early initiation of therapy with empagliflozin was associated with an improvement of symptoms and laboratory parameters including NT-proBNP level.
Keywords:
disease progression – empagliflozin – heart failure with reduced ejection fraction
Authors:
Filip Málek
Authors‘ workplace:
Kardiovaskulární centrum, Nemocnice Na Homolce, Praha
Published in:
Vnitř Lék 2023; 69(3): 189-192
Category:
Case reports
doi:
https://doi.org/10.36290/vnl.2023.032
Overview
Inhibitory sodíko‑glukózového ko ‑ transporteru 2-glifloziny jsou podle vědeckých důkazů účinné u pacientů se srdečním selháním bez ohledu na ejekční frakci levé komory. Glifloziny snižují kombinovaný výsledek kardiovaskulární mortality a hospitalizace pro srdeční selhání i u nemocných se srdečním selháním a ejekční frakcí levé komory nad 40 %. Předkládáme kazuistiku pacienta s nově vzniklým srdečním selháním. Včasné zahájení léčby empaglifozinem bylo spojeno se zlepšením symptomatologie a laboratorních ukazatelů, včetně koncentrace NT‑proBNP.
Klíčová slova:
empagliflozín – srdeční selhání se zachovalou ejekční frakcí – průběh onemocnění
Úvod
Inhibitory sodíko‑glukózového ko‑transporteru 2 (iSGLT2) empagliflozin a dapagliflozin jsou nyní zařazeny do základní léčby pacientů se srdečním selháním a sníženou ejekční frakcí levé komory (HFrEF – heart failure with reduced ejection fraction) (1, 2). Pozitivní efekt inhibitoru SGLT2 empagliflozinu na průběh srdečního selhání byl prokázán ve studii EMPEROR‑Reduced. Empagliflozin ve srovnání s placebem snížil relativní riziko primárního kombinovaného výsledku: úmrtí z kardiovaskulárních (KV) příčin nebo hospitalizace pro srdeční selhání o 25 % (p < 0,001) a snížil relativní riziko sekundárního výsledku: první a opakovaná hospitalizace pro srdeční selhání o 30 % (p < 0,001) (3). Empagliflozin byl účinný stejně u pacientů s diabetes mellitus i u nediabetiků. Glifloziny byly také zkoušeny u pacientů se srdečním selháním s ejekční frakcí levé komory (EF LK) nad 40 %. Studie EMEROR‑PRESERVED s empagliflozinem byla randomizovaná placebem kontrolovaná studie, která zahrnovala 5 988 pacientů se srdečním selháním a EF LK > 40 % ve funkční třídě NYHA II‑IV (4). K podávání empagliflozinu v dávce 10 mg denně bylo randomizováno 2 997 pacientů, k podávání placeba 2 991 nemocných. Průměrný věk byl v obou skupinách kolem 72 let a téměř 45 % nemocných v obou skupinách tvořily ženy. Průměrná EF LK byla 54 % a EF > 40 < 50 % mělo 33 % pacientů. Nemocní byli nejčastěji ve funkční třídě NYHA II (81 % pacientů, NYHA III 18 % pacientů). Podmínkou zařazení do studie byla koncentrace NT‑proBNP > 300 pg/ml a u fibrilace síní > 900 pg/ml. Medián NT‑proBNP byl více než 900 pg/ml. Téměř jedna čtvrtina pacientů měla v anamnéze hospitalizaci pro srdeční selhání. Pacienti měli typické komorbidity HFpEF (heart failure with preserved ejection fraction) a HFmrEF (heart failure with mildly reduced ejection fraction). Více než polovina nemocných měla fibrilaci síní a téměř polovina měla diabetes mellitus. Více než 90 % pacientů mělo arteriální hypertenzi. Průměrný odhad glomerulální filtrace (eGFR) byl 60 ml/min, přibližně polovina pacientů mělo eGFR < 60 ml/min. Výsledky studie byly významné ve prospěch empagliflozinu. Empagliflozin po dobu sledování více než dvou let (medián 26 měsíců) snížil ve srovnání s placebem kombinovaný výsledek rizika úmrtí z KV příčin a hospitalizace pro srdeční selhání o 21 % (snížení relativního rizika, HR 0,79, p < 0,001). Snížení hospitalizací pro srdeční selhání bylo o 27 % (snížení relativního rizika, HR 0,73, p < 0,001). Studie EMPEROR‑Preserved se stala první klinickou studií, která prokázala příznivý efekt farmakologické léčby na průběh srdečního selhání u pacientů s EF LK > 40 %. Příznivý efekt gliflozinů na vývoj srdečního selhání u pacientů s EF LK > 40 % potvrdila studie DELIVER s dapagliflozinem (5).
Popis případu
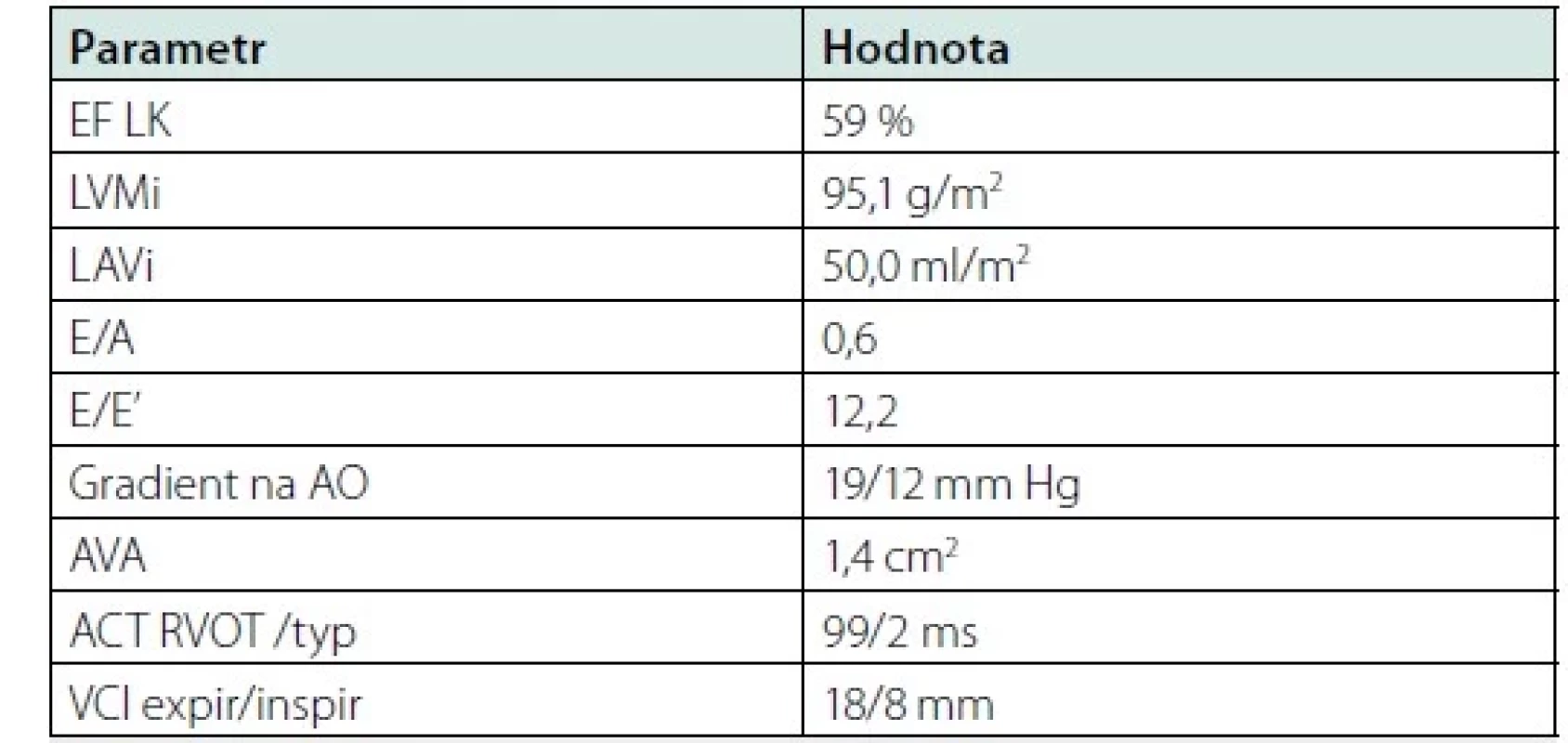
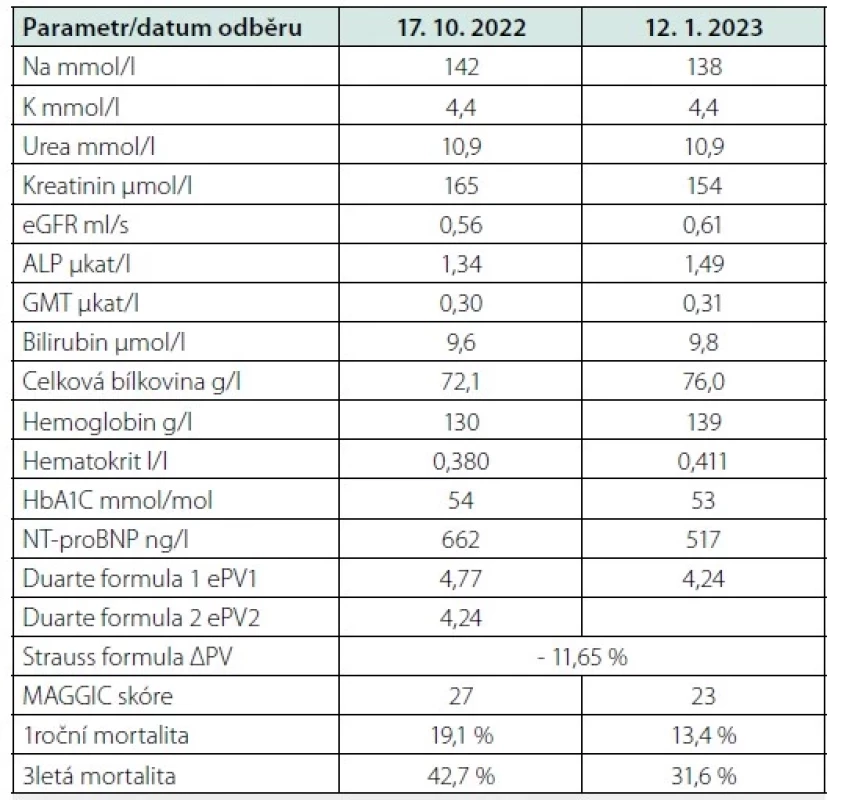
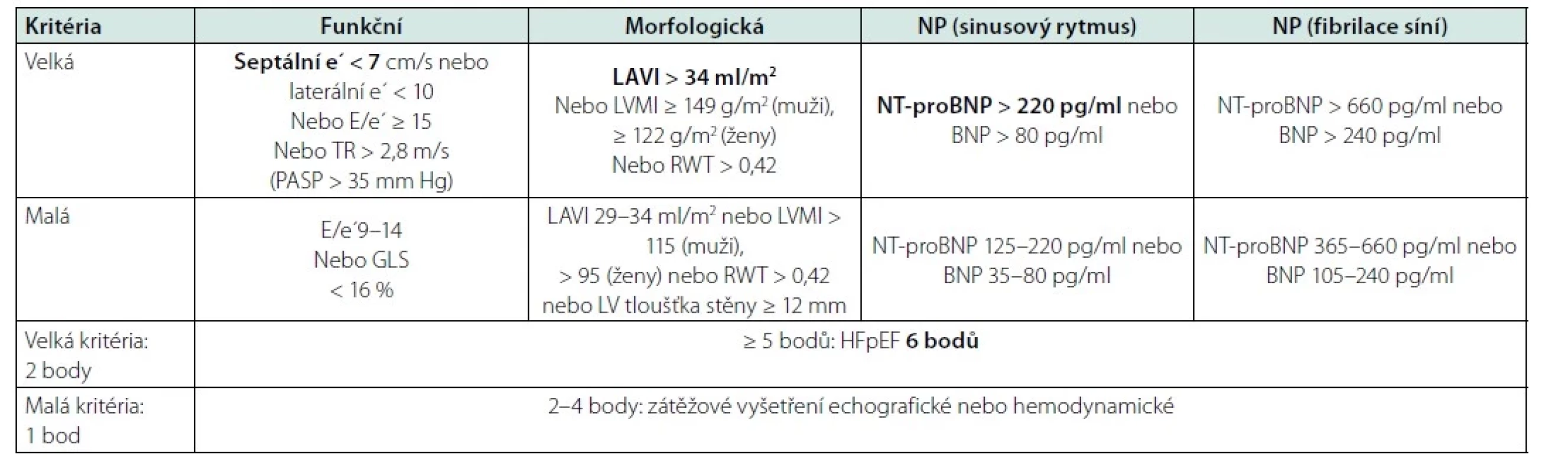
Pacient muž nyní ve věku 78 let s familiární hypercholesterolemií a arteriální hypertenzí prodělal infarkt myokardu již ve svých 39 letech v roce 1993 a v témže roce podstoupil čtyřnásobný aortokoronární bypass. V roce 2001 pak podstoupil koronární angioplastiku žilního bypassu pro nestabilní anginu pectoris. O 10 let později podstoupil náhradu aortální chlopně bioprotézou pro významnou degenerativní aortální stenózu. Po operaci byla zahájena léčba diabetes mellitus 2. typu metforminem. Stav pacienta byl dlouhodobě stabilní do roku 2020, kdy pro perzistující fibrilaci síní podstoupil elektrickou kardioverzi a pro následnou atrioventrikulární blokádu vyššího stupně implantaci dvoudutinového kardiostimulátoru. Pro zhoršení ledvinných funkcí byla u pacienta přerušena léčba metforminem a nahrazena gliquidonem a přerušena terapie inhibitorem angiotenzin‑konvertujícího enzymu ramiprilem. V té době byl pacient bez obtíží při aktivitách běžné denní činnosti a měl normální ejekční frakci levé komory. V roce 2021 došlo pozvolna k rozvoji námahové, později i klidové a noční dušnosti a otokům dolních končetin. Při vyšetření v ambulanci byl krevní tlak 144/76 mm Hg, tepová frekvence 60/min při stimulovaném rytmu (sekvenční síňokomorová stimulace), zvýšená náplň krčních žil, pretibiální otoky dolních končetin. Echokardiografické parametry ukazuje tabulka 1. U pacienta byla zjištěna normální ejekční frakce levé komory, zvětšení objemu levé síně a porucha diastolického plnění levé komory 2. typu (pseudonormální plnění). Koncentrace NT‑proBNP 680 pg/ml a odhad glomerální filtrace byla 0,56 ml/s. Farmakoterapie zahrnovala v té době: bisoprolol 5 mg denně, amlodipin 5 mg denně, dabigatran 110 mg dvakrát denně, atorvastatin 80 mg denně, ezetimib 10 mg denně, evolocumab 140 mg subkutánně jednou za 14 dní, gliquidon 30 mg denně, trimetazidin 35 mg dvakrát denně a rilmenidin 1 mg denně. Stav nemocného vyžadoval diuretickou terapii v úvodní dávce 40 mg denně, která byla zvýšena na 62,5 mg denně a pro sklon k hypokalemii byla terapie doplněna o 12,5 mg spironolaktonu denně. Byla provedena rekoronarografie prokazující normální průchodnost tepenného bypassu (LIMA‑RIA) a žilních bypassů s významným aterosklerotickým postižením nativního koronárního řečiště bez možnosti další intervence či revaskularizace. Funkce aortální bioprotézy byla podle transtorakální i jícnové echokardiografie v normě, bez průkazu restenózy nebo regurgitace. Pacient splňoval kritéria HFpEF, i po diuretické terapii byl pacient dušný při jakékoli činnosti (NYHA III), jen došlo k regresi otoků dolních končetin a poklesu hmotnosti o dva kilogramy. Koncentrace NT‑proBNP byla 662 pg/ml. Kritéria HFpEF ukazuje obrázek. Pro diagnózu HFpEF je nutná hodnota výsledného skóre ≥ 5 bodů, v případě výsledku 2–4 je doporučeno doplnit zátěžové vyšetření (6). Hodnota skóre byla u našeho pacienta rovna šesti bodům. Vzhledem k přetrvávající limitující symptomatologii jsme probrali s pacientem možnost léčby empagliflozinem, který v té době měl indikaci pro léčbu HFpEF, ale neměl úhradu ze zdravotního pojištění. Pacient souhlasil s úhradou léku v režimu samoplátce, léčba byla zahájena v říjnu 2022 se standardní dávkou 10 mg empagliflozinu denně. Cena empagliflozinu byla 1200 Kč za měsíc léčby. Pacienta jsme pozvali za tři měsíce ke klinické a laboratorní kontrole. Pacient udával zlepšení obtíží, menší dušnost při zátěži, zlepšení tolerance zátěže (zlepšení o třídu NYHA z III na II). Krevní tlak při kontrole byl 128/74 mm Hg v ordinaci, tepová frekvence se nezměnila. Došlo k poklesu hmotnosti ze 104 kg na 101 kg a regresi otoků dolních končetin. Změnu laboratorních parametrů před a po zahájení terapie empagliflozinem ukazuje tabulka 2.
Diskuze
Náš příklad z praxe ukazuje, že po terapii empagliflozinem došlo během tří měsíců k vzestupu koncentrace hemoglobinu a hematokritu zřejmě zvýšením diurézy s poklesem efektivního objemu plazmy. Tuto změnu je možné hodnotit pomocí ukazatelů hemokoncentrace (Duarte a Strauss formula) (7, 8). Došlo i k poklesu koncentrace NT‑proBNP jako ukazatele tíže srdečního selhání. Je známo, že po zahájení terapie gliflozinem dochází v prvním měsíci k poklesu glomerulární filtrace a vzestupu koncentrace kreatininu následkem snížení intraglomerulárního tlaku se zachováním až zvýšením diurézy při zvýšené tubulární sekreci. Tento jev je však z dlouhodobého hlediska renoprotektivní. V naší kazuistice došlo během tří měsíců ke snížení koncentrace kreatininu a ke zvýšení glomerulární filtrace. Zlepšení funkční třídy NYHA a pokles koncentrace kreatininu vedlo ke zlepšení prognostického skóre MAGGIC (9).
Závěry
Srdeční selhání je zřejmě nevyhnutelné v průběhu života pacienta s kardiovaskulárním onemocněním. Vznik srdečního selhání významně snižuje kvalitu života nemocných, zvyšuje riziko hospitalizace a zkracuje přežívání. Moderní léčba srdečního selhání je schopna průběh tohoto syndromu ovlivnit, a to bez ohledu na ejekční frakci levé komory a komorbidity. Včasné zahájení léčby iSGLT2 empagliflozinem u pacienta s HFpEF bylo v naší kazuistice spojeno se zlepšením klinických, laboratorních a prognostických ukazatelů. Empagliflozin tak prokazuje účinnost i v běžné klinické praxi. Pro syndrom HFpEF se stává nadějí pro širokou populaci pacientů.
Podpořeno MZ ČR – RVO (Nemocnice Na Homolce – NNH, 00023884),170501.
Článek přijat redakcí: 15. 3. 2023
Článek přijat po recenzích: 13. 4. 2023
prof. MUDr. Filip Málek, Ph.D., MBA
Kardiovaskulární centrum, Nemocnice Na Homolce, Praha
Sources
1. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2022;24 : 4–131.
2. Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/ HFSA Guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022;145:e895–e1032.
3. Packer M, Anker SD, Butler J, et al. For the EMPEROR‑Reduced Trial Investigators Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure N Engl J Med 2020 383,15 : 1413-24.
4. Anker SD, Butler J, Filippatos G, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med 2021, doi: 10.1056/NEJMoa2107038.
5. Solomon SD, McMurray JJV, Claggett B, et al. For the DELIVER Trial Committees and Investigators. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. N Engl J Med 2022, 387 : 1089-1098.
6. Pieske B, Tschöpe C, de Boer RA, et al. How to diagnose heart failure with preserved ejection fraction: the HFA‑PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur J Heart Fail 2019,22 : 391-412
7. Duarte K, Monnez JM, Albuisson E, et al. Prognostic value of estimated plasma volume in heart failure.
8. J Am Coll Cardiol HF 2015;3 : 886-93.
9. Mentz RJ, Kjeldsen K, Rossi GP, et al. Decongestion in acute heart failure. Eur J Heart Fail 2014;16 : 471-82.
10. Pocock SJ, Ariti CA, McMurray JJV, et al. Predicting survival in heart failure: a risk score based on 39 372 patients from 30 studies. Eur Heart J 2013 May;34(19):1404-13.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2023 Issue 3
-
All articles in this issue
- Hlavní téma – Multimorbidita ve vnitřním lékařství
- Perioperační péče o pacienta s multimorbiditou
- Multimorbidita při nefrotickém syndromu
- Multimorbidní nemocný v intenzivní péči
- Specifika diagnostiky a léčby multimorbidních pacientů
- JAK inhibice v léčbě zánětlivých revmatických onemocnění
- Efekt inhibitoru sodíko‑glukózového ko‑transporteru 2 empagliflozinu na vývoj onemocnění u pacienta se srdečním selháním a zachovalou ejekční frakcí
- Diferenciální diagnostika intersticiálních plicních procesů
- Novinky v gastroenterologii, hepatologii a digestivní endoskopii
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Diferenciální diagnostika intersticiálních plicních procesů
- Hlavní téma – Multimorbidita ve vnitřním lékařství
- Multimorbidita při nefrotickém syndromu
- Multimorbidní nemocný v intenzivní péči
