Perioperační péče o pacienta s multimorbiditou
Perioperative care about a patient with multimorbidity
The assumption of accelerated postoperative recovery according to the ERAS (Enhanced Recovery After Surgery) method is good condition of the patient prepared for surgery and gently operated on. Application of ERAS in postoperative care in the situation of patient with multimorbidity requires an individual approach and greater pre-operative preparation. During the healing process, the operation causes a systemic inflammatory reaction in the body, which is proportional to the size of the surgery trauma. There is fluid movement between the intravascular and interstitial spaces, increased protein catabolism, increased susceptibility to infectious complications and increased risk of decompensation of chronic diseases. The mandatory content of the pre-operative examination is a functional cardiopulmonary reserves assessment, nutritional risk screening, update of diagnostic summary and optimization of chronic medication before surgery. Prehabilitation and nutritional preparation before the planned operation is influenced by the time urgency of the operation, but even in the case of cancer, short-term nutritional preparation is indicated., Medical workplaces are the most suitable for parenteral and enteral pre-operative nutrition however some surgical departments perform the preparation themselves if necessary. The GDT (Goal Directed Therapy) regimen with a higher degree of hemodynamic monitoring and intervention is applied in the postoperative care of hemodynamic unstable risk patients. Next to decompensation of a chronic disease is mainly heart rhythm disorders (most often atrial fibrillation), cardiac complications including coronary event, stroke, acute delirium.
Keywords:
ERAS – Catabolism – multimorbidity – preoperative examination – surgery trauma – GDT – postoperative complicationes
Authors:
Eduard Havel
Authors‘ workplace:
Lékařská fakulta v Hradci Králové
Published in:
Vnitř Lék 2023; 69(3): 148-155
Category:
Main Topic
doi:
https://doi.org/10.36290/vnl.2023.027
Overview
Předpokladem urychlené pooperační rekonvalescence dle metody ERAS (Enhanced Recovery After Surgery) je dobře k operaci připravený a šetrně odoperovaný pacient. Uplatnění ERAS v pooperační péči v situaci polymorbidity pacienta vyžaduje individuální přístup a větší důraz na část předoperační přípravy a provedení vlastního operačního výkonu. Operace vyvolává během procesu hojení v organismu systémovou zánětovou reakci, která je úměrná velikosti operačního traumatu. Dochází k tekutinovým přesunům mezi intravaskulárním a intersticiálním prostorem, zvýšenému proteinovému katabolismu, zvýšené náchylnosti k infekčním komplikacím a ke zvýšení rizika dekompenzace chronických onemocnění, případně vzniku akutních komplikací. Povinným obsahem předoperačního vyšetření je odhad funkční kardiopulmonální rezervy, zhodnocení nutričního rizika, aktualizace diagnostického souhrnu a optimalizace chronické medikace před operačním výkonem. Prehabilitace a nutriční příprava před plánovanou operací je ovlivněna časovou naléhavostí operace, ale i u nádorových onemocnění má krátkodobá nutriční příprava definované doporučení, jehož naplnění může vyžadovat předoperační hospitalizaci. Pro parenterální i enterální předoperační výživu jsou nejvhodnější interní pracoviště, ale některá chirurgická oddělení si v případě nutnosti provádějí přípravu sama. V pooperační péči oběhově rizikových pacientů se uplatňuje režim GDT (Goal Directid Therapy) s vyšším stupněm hemodynamického monitorování a intervence. Zvláštní pozornost je věnována pooperačním komplikacím se zvýšeným rizikem vzniku u polymorbidních pacientů. Vedle dekompenzace chronického onemocnění jsou to především poruchy srdečního rytmu (nejčastěji fibrilace síní), kardiální komplikace včetně koronární příhody, cévní mozkové příhody, akutní delirium.
Klíčová slova:
ERAS – pooperační komplikace – multimorbidita – polymorbidita – předoperační vyšetření – operační trauma – GDT – katabolismus
Zvýšené riziko pooperačních komplikací u polymorbidních pacientů, kteří podstoupí velkou operaci, je obecně známé (1). Literární údaje ale ukazují těsnější souvislost s pooperačními komplikacemi při současné přítomnosti frailty syndromu, který se vyskytuje spolu s multimorbiditou zhruba v 20 % (2, 3). Polymorbidita tedy nepřináší zvýšené riziko pooperačních komplikací automaticky, důležitý je stupeň křehkosti organismu, který lépe vyjadřuje celkovou funkční rezervu k zvládnutí operačního traumatu. Moderní perioperační péče zdůrazňuje použití konceptu urychlené pooperační rekonvalescence – ERAS (Enhanced Recovery After Surgery) (4). Ten se plně prosazuje u standardních operačních výkonů prováděných na pacientech bez zvýšeného individuálního rizika. Ale i v případě komorbidity se zásady ERAS s výhodou uplatňují i u chronicky nemocných pacientů s potřebou individuální modifikace podle přítomných chronických onemocnění. Výsledný úspěch operačního zákroku závisí na kvalitním předoperačním vyšetření, odpovědné volbě operačního výkonu, předoperační přípravě, vedení anestezie, vlastním provedení operačního výkonu a individualizované pooperační péči. Znalost patofyziologie operačního traumatu je důležitá pro všechny zainteresované zdravotnické obory od praktických lékařů, přes různé klinické obory až po následnou a rehabilitační péči.
Patofyziologie operačního traumatu
Operace je invazivní způsob léčby, který charakterizuje poranění tkání a narušení jejich celistvosti. Dochází tak jednak ke ztrátě přirozených bariér s rizikem bakteriální invaze a také k narušení buněčné stability přímým poraněním buněk či narušením cévní mikrocirkulace. Buněčné fragmenty, hematomy a nestabilní buňky s produkcí reaktivních forem kyslíku ohrožují organismus narušením přirozené homeostázy a poruchou funkce orgánů. Pooperační reakci organismu charakterizuje imunitní úklidová a obranná reakce. Lokální složka hojení spočívá v úklidu poraněného terénu operačního pole a přes vytvoření jizvy k obnovení funkčního stavu. Systémovou složkou je zánětová reakce – SIRS (Systemic Inflammatory Response Syndrom) spouštěná hormonální a mediátorovou aktivitou (dominantně TNF‑α, interleukin-6) s projevy hemodynamickými, metabolickými a imunitními. Míra systémové reakce závisí na velikosti operačního traumatu a individuální reaktivitě organismu.
Oběhová složka operačního traumatu spočívá ve vazodilataci a zvýšené kapilární propustnosti. Ke zvýšenému přesunu tekutiny z intravaskulárního do intersticiálního prostoru dochází dominantně v místě operačního traumatu, ale silná imunitní reakce působí zvýšení kapilární propustnosti v celém organismu (5). Do mezibuněčného prostoru je transportováno více kyslíku a živin, humorálních látek a imunitních buněk, které se účastní úklidové reakce. Vlivem otoku stoupá intersticiální tlak a více tekutiny je filtrováno do systému lymfatické drenáže, kde v uzlinách dochází k aktivní fagocytóze transportovaných tkáňových fragmentů a dalšímu přenosu informací v regulaci systémové imunitní reakce. Pooperační riziko hypovolemie a hypotenze z důvodu vazodilatace a tekutinového přesunu bývá v prvních 24 hodinách po operaci. Následný návrat tekutiny do oběhu hrozí projevy srdečního selhávání u osob s nedostatečnou kardiální rezervou. Tekutinové přesuny a zvýšený obrat tekutin v perioperačním období jsou též spojeny s rizikem minerálových dysbalancí. Nejčastější jsou hypokalemie, hypomagnezemie a hypofosfatemie (6).
Metabolická složka operačního traumatu spočívá ve zvýšení klidového energetického výdeje a v proteinovém katabolismu. Metabolická reakce je navozena mediátorovou aktivitou systémové zánětové reakce (především IL-6, TNF-α) a hormonální stresovou aktivitou (kortizol, katecholaminy). Ze svalů jsou uvolňovány aminokyseliny, v játrech probíhá zvýšená glukoneogeneze a mastné kyseliny jsou mobilizovány z tukové tkáně. Vlivem inzulinorezistence navozené mediátorovou aktivitou v periferních tkáních jsou mobilizované substráty především v podobě glukózy spotřebovány bílými krvinkami a granulační tkání. Intenzita katabolické reakce je dána velikostí operačního traumatu, reaktivitou organismu a velikostí energetických zásob v těle. Na sklonu k hyperglykemii v pooperačním období se podílí inzulinorezistence i zvýšená glukoneogeneze. ESPEN (European Society of Parenteral and Enteral Nutrition) v doporučení pro optimální pooperační glykemii bere v úvahu prospěšnost mírné hyperglykemie, rizika patologické hyperglykemie i rizika při navozování normoglykemie a stanovila horní hranici tolerované hladiny glukózy v časném pooperačním období na 10 mmol/l (7, 8, 9). Proteinový katabolismus po velkém operačním výkonu je největší v prvním týdnu po operaci se ztrátami okolo 12–20 g N/den a sníženou proteosyntézou ve svalech (10). Dále ale přetrvává řádově po dobu týdnů mírně zvýšená proteolýza, která ve spojení s pooperačním nechutenstvím a tělesnou imobilizací může vést k fatální ztrátě proteinové hmoty během několika týdnů či měsíců po operaci.
Předoperační vyšetření
Pečlivé zhodnocení zdravotního stavu, míry operačního rizika, optimalizace kompenzace chronických nemocí a posílení individuálně dosažitelné funkční rezervy organismu před operací jsou důležitými předpoklady následného úspěchu chirurgické léčby. Organizace interního předoperačního vyšetření je definována ve Věstníku ministerstva zdravotnictví České republiky z roku 2018. Hlavním obsahem věstníku je stanovení povinného vyšetření před plánovanou operací, stanovení individuálního rizika a rozdělení odpovědnosti mezi základní zúčastněné obory praktického lékařství, interny, anesteziologie a příslušného operačního oboru. Kompetence odborností v interním předoperačním vyšetření jsou rozděleny podle omezující komorbidity a velikosti plánovaného operačního výkonu. Znalost příslušného věstníku je pro praxi předoperačního vyšetření nezbytná (11).
Obecným povinným obsahem předoperačního vyšetření je stanovení funkční kardiopulmonální rezervy a zhodnocení nutričního stavu ve smyslu metabolické rezervy organismu. Rizikovým faktorem pro zvládnutí velké operace je snížená kardiopulmonální a metabolická rezerva vyjádřená v metabolických ekvivalentech (MET) pod 4 MET. Rezervu 4–4,5 MET mají pacienti, kteří jsou schopni rychlejší chůze, práce na zahradě, stoupání do schodů dvou pater, rekreačního plavání (12). Stárnutí organismu spolu s přidruženými nemocemi snižuje funkční kardiopulmonální rezervu a ve věku 80 až 85 let se běžný Středoevropan dostává pod hranici 4–4,5 MET, přičemž pravidelnou fyzickou aktivitou lze pokles úbytku MET zpomalit. Nutričně rizikový chirurgický pacient je charakterizován nízkou tělesnou hmotností BMI pod 18,5 (Body Mass Index) nebo nechtěným poklesem hmotnosti v posledních 3 až 6 měsících (o 5 a 10 %), případně jen ztrátou kalorického příjmu v posledním týdnu před operací, kdy již dojde ke snížení metabolické aktivity adaptací na hladovění (13). Z pohledu nutričního stavu je samostatným rizikovým faktorem pro pooperační komplikace sarkopenie. V rámci komplexního geriatrického vyšetření nízké skóre v Barthelově testu základních všedních činností (ADL), sama multimorbidita a polypragmazie (≥ 5 léků/den) jsou spojeny s vysokým rizikem závažných pooperačních komplikací (14). Závěr interního předoperačního vyšetření má obsahovat aktualizovaný diagnostický souhrn včetně zhodnocení rizika přítomné komorbidity. Zhodnocení užívané medikace se provádí i s možností přechodného vysazení zbytné medikace v perioperačním období. Povinnou součástí závěru je zhodnocení kardiopulmonální rezervy s případným odhadem počtu MET, posouzení nutričního stavu a vyjádření se k případné předoperační přípravě. Zvláštní pozornost je věnována anémii a její léčbě. Není vzácností v rámci předoperačního vyšetření odhalení hypotyreózy u chronicky nemocných pacientů, pokud je na její možnost aktivně pomýšleno.
Předoperační příprava se zaměřením na pacienta s multimorbiditou
Prvním krokem předoperační přípravy je důležité seznámení pacienta (a v případě multimorbidity i vhodného rodinného příslušníka na základě souhlasu pacienta) s plánovaným operačním výkonem. Je třeba vzít v úvahu, že v případě multimorbidity nemusí být standardní operace optimálním řešením, a je třeba brát v úvahu životní postoj, preference pacienta a míru přijatelného rizika. To má význam nejen pro volbu operačního výkonu, ale i pro pooperační rozhodování v případě závažných komplikací. Adekvátní poučení pacienta a vysvětlení operačního postupu i pooperační péče zvyšuje důvěru pacienta ke zdravotnickému týmu a snižuje míru stresu. Komplex perioperační přípravy a péče je součástí strategie urychlené pooperační rekonvalescence – ERAS.
Prehabilitace znamená komplex předoperačních opatření k optimalizaci kondice pacienta k operačnímu výkonu. Míra přípravy závisí na individuálních možnostech a času před operačním výkonem. Hlavní součásti přípravy jsou výživa, rehabilitace a prevence úzkosti – mírnění stresu.
Na základě stanovení nutričního rizika je indikována nutriční příprava. V případě odložitelných výkonů u malnutričních pacientů má smysl aplikovat nutriční podporu enterální, případně parenterální po dobu zlepšování nutričního stavu v délce 4 až 8 týdnů. V případě onkologických onemocnění je indikována nutriční podpora v délce 7–14 dnů před operací. Ke zlepšení nutričního stavu za tuto dobu viditelně nedochází, ale normalizuje se metabolická aktivita organismu, jsou doplněny deplece minerálů, vitaminů a stopových prvků. V případě rozvoje refeeding syndromu po zahájení nutriční podpory je výhodné absolvovat tuto situaci ještě před operací než po operaci v kombinaci s reakcí na operační trauma. V případě sideropenie je perorální substituce železa pomalá a většinou neúčinná, je nutné korigovat depleci železa opakovanou parenterální aplikací.
Diskutovanou přípravou je několikadenní podávání immunonutričního sippingu před velkým operačním výkonem. Jde o preparáty obohacené o omega-3 mastné kyseliny, nukleotidy a arginin. V současné době je příznivý efekt na zkrácení pooperační hospitalizace, snížení rizika infekčních pooperačních komplikací a úspora pooperační ztráty proteinové hmoty přisuzována navýšenému příjmu omega-3 mastných kyselin v dávce okolo 2–5 g/den. S ohledem na sarkopenii je v současné době upřednostňována obecně nutriční příprava s vyšším obsahem proteinů 1,5–2 g/kg/den.
Bezprostředně před operací je perorální příjem solidní stravy zastavován 6 hodin před operací a příjem tekutin 2 hodiny před operací u osob, u kterých nepředpokládáme poruchu vyprazdňování žaludku. S ohledem na multimorbiditu a převážně zvýšený věk těchto pacientů je vhodné večer před operací podávat lehce stravitelnou stravu. Smažená jídla, tuk a maso vyprazdňování žaludku zpomalují.
Předoperační pohybový trénink vede ke zlepšení kardiopulmonální funkční rezervy (navýšení maximální spotřeby kyslíku, aerobního prahu), zvyšuje proteosyntézu i mitochondriální aktivitu. Spolu s nutriční podporou je pohybový režim základem pro obecnou předoperační přípravu. Ordinace pohybového režimu je individuální podle možností konkrétního pacienta. Obecně lze doporučit stejně jako v běžné populaci 150 minut týdně aerobní aktivity rozdělené do 30 až 45minutových aktivit ob den ve střední intenzitě 50–75 % maximální tepové frekvence pro daný věk. Aerobní aktivita může být prováděna v pacientem zvolené aktivitě (chůze, práce na zahradě, plavání, jízda na kole, chůze do schodů). Dvakrát týdně by mělo být zařazeno odporové posilovací cvičení pro všechny svalové skupiny, po kterém by měl být zajištěn příjem proteinového jídla s 30 g bílkovin (14). Reálně se přizpůsobuje doporučení individuálním možnostem pacienta, ale je třeba zdůraznit, že multimodální prehabilitace zlepšuje výsledek operace zejména u rizikových pacientů s multimorbiditou, frailty syndromem či sarkopenií (15, 16). U imobilních pacientů je doporučeno třeba jen desetiminutové denní cvičení. Většina nemocných s multimorbiditou je schopna pravidelného půlhodinového až hodinového chodeckého tréninku v individuální intenzitě ob den, který při zátěži zvýší srdeční frekvenci a přináší subjektivní pocit prodělávané námahy.
Psychologické postupy (klidové relaxace, meditace či modlitby, prvky jógy a příjemné zážitky) napomáhají ve zvládnutí deprese a anxiety, které jsou v předoperačním období zejména u nádorových pacientů časté a je třeba je upravovat.
Předoperační vynechání kouření a minimalizace příjmu alkoholu před operací je doporučeno v minimálním intervalu čtyř týdnů.
Předoperační optimalizace chronické medikace
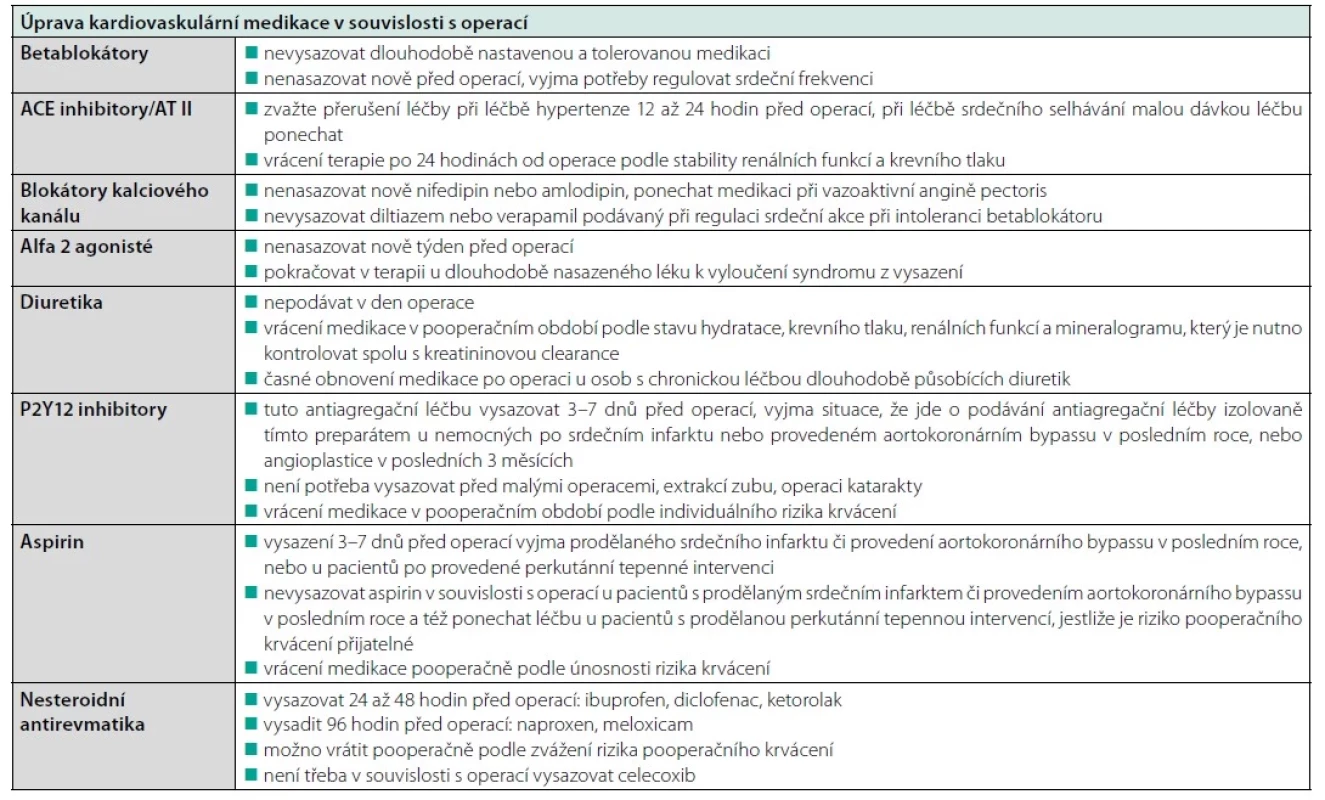
U multimorbidních pacientů je důležitá předoperační optimalizace kompenzace chronických onemocnění nejčastěji optimalizací chronické medikace. Nově bezprostředně před operací by neměly být nasazovány betablokátory. Naopak dlouhodobě nastavená a tolerovaná léčba betablokátory nemá být vysazována. U pacientů se sklonem k pomalé srdeční akci pod 60/min má smysl zvážit v den operace podat sníženou dávku chronicky užívaného betablokátoru. Riziko perioperační ischemické mozkové příhody je při současné léčbě betablokátory zvýšené a souvisí s perioperačním poklesem krevního tlaku.
Alespoň tři dny před velkou operací je vysazován metformin. Léčba statiny není kolem operace vysazována. Důvodem je pleiotropní účinek statinů na stabilitu endotelu. Warfarinizovaní pacienti se převádějí před operací na terapeutické podávání nízkomolekulárního heparinu. U pacientů s antikoagulační léčbou nové generace NOAC je doporučeno jen krátkodobé přerušení léčby bez přemosťující terapie nízkomolekulárním heparinem podle konkrétních doporučení k příslušnému léku – tabulka 1.
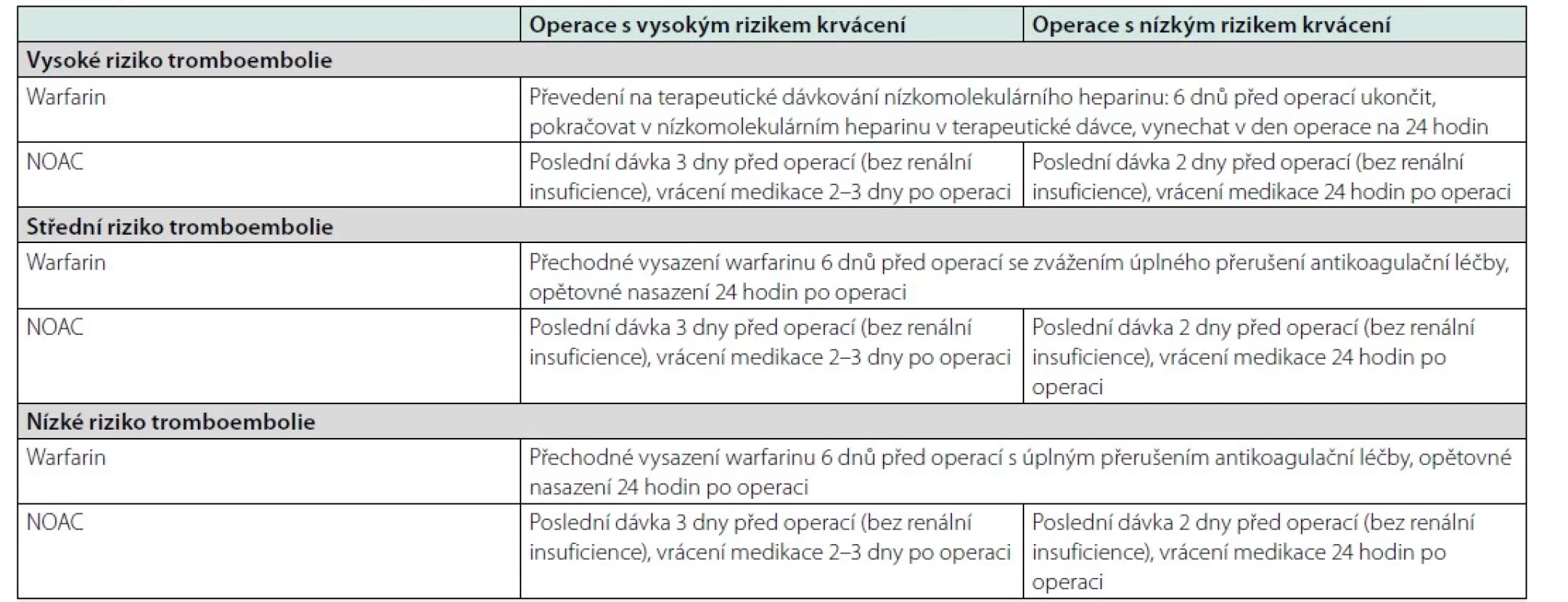

Předoperační vysazování antiagregační terapie není paušální. Vždy je třeba zvažovat riziko pooperačního krvácení spolu s rizikem trombózy. U duální antiagregace by neměl být odložitelný výkon proveden méně než za měsíc po vaskulární intervenci s nasazením duální antiagregace, lépe po 6 měsících. Modifikace duální agregace se provádí většinou 5 dnů před operací a navrací se po 24–48 hodinách po operačním výkonu. Trvale bez přerušení je podáván preparát ASA. V situaci monoterapie ASA platí, že u pacientů s implantovanými stenty by terapie neměla být přerušována. Strategie modifikace antiagregační terapie kolem operačního výkonu je přísně individuální a u rizikových pacientů se provádí vždy ve spolupráci s příslušným odborníkem, který antiagregační léčbu ordinoval. Příklad vysazení ukazuje tabulka 1 (17). Přehled nejčastěji upravované medikace z důvodu operačního výkonu je v tabulce 2 (18).
Kardiální rizika u nekardiálních operací
Riziko srdečního infarktu a úmrtí z kardiální příčiny v důsledku operace je dáno individuálním stavem operovaného organismu v závislosti na typu operačního výkonu a dalšími známými vyvolávajícími faktory jsou změny tělesné teploty během operace, výkyvy krevního tlaku, ztráta krve a tekutinové přesuny v organismu v pooperačním období. U velkých operací je popisováno obecné kardiální riziko přesahující 5 % (18).
Problematika myokardiálních ischemických příhod po nekardiální operaci je složitá vzhledem k asymptomatickému průběhu léze, která byla zachycena podrobnějším laboratorním monitorováním troponinu T. U pacientů starších 45 let byly laboratorní známky myokardiální léze zjištěny u 8 % operantů v prvních 72 hodinách po nekardiální operaci. Pouze v 35 % těchto příhod byla změna zachycena na EKG. Klinický význam tiché ischemie myokardu spočívá v riziku 30denní letality 9,8 % proti 1,1 % u pacientů bez myokardiální léze (19). U všech pacientů ve věku ≥ 65 a u pacientů ve věku ≥ 45 let s anamnézou ischemické choroby srdeční či vysokého individuálního rizika je nově doporučeno vyšetření natriuretického peptidu předoperačně a v případě zvýšení NT‑pro‑BNP > 300 mg/l monitorování troponinu T 72 hodin po operaci a provedení pooperačního EKG (17). Při naplnění definice srdečního infarktu je následně postupováno podle platných doporučení odborné společnosti. V roce 2022 byla publikována nová doporučení Evropské kardiologické společnosti (20), která doporučují použití biomarkerů kardiální ischemie a srdeční zátěže u rizikových osob pro kardiální komplikace v důsledku nekardiální operace (hs‑cTn I/T, NTpro‑BNP/ BNP). Vysoce senzitivní srdeční troponin I nebo T kvantifikuje myokardiální poškození a NTpro‑BNP nebo BNP kvantifikují hemodynamickou zátěž levé komory. Velmi nízké hodnoty troponinů mají velmi vysokou negativní prediktivní hodnotu k vyloučení myokardiální ischemie. Na druhou stranu pozitivní hodnoty mají t.č. výpovědní hodnotu menší. Monitorování kardiálních biomarkerů bylo diskutováno již v doporučení z roku 2014 (12), (v české verzi z roku 2014 je tento postup zmiňován v kategorii zvážení (21)).
Podrobnější neinvazivní a invazivní předoperační vyšetření kardiovaskulární soustavy je popsáno v platném evropském doporučení (20) poměrně složitě a je nutno s tímto materiálem pracovat při podezření na riziko pooperačních kardiálních komplikací. Vždy se týká velké, případně střední operace spolu s klinickou symptomatologií nebo přítomností jednoho či více klinických rizikových faktorů: ischemická choroba srdeční (angina pectoris, infarkt myokardu v anamnéze), srdeční selhání, nemocný po cévní mozkové příhodě nebo tranzitorní ischemické atace, porucha renálních funkcí (koncentrace kreatininu v séru > 170 μmol/l, kreatinová clearance < 60 ml/min/1,73 m2), diabetes mellitus na inzulinu. Echokardiografické vyšetření je základem pro zhodnocení srdeční funkce a závažnosti chlopenních vad. Dobutaminová echokardiografie doplňuje informaci o koronární situaci u rizikových imobilních pacientů s < 4 MET funkční rezervy. Předoperační koronarografie je doporučována ve stejných situacích jako bez plánované operace, a navíc u pacientů s anginou pectoris na farmakologické léčbě při změně námahové bolesti před plánovanou neurgentní operací. V kategorii zvážit provedení koronarografie je situace stabilních kardiologických pacientů, kteří podstoupí elektivní karotickou endarterektomii. Obdobně lze indikovat i UZ vyšetření karotid a vertebrálních arterií před plánovanou velkou operací u pacientů s přítomností cévních sklerotických onemocnění či přítomnosti klinických rizikových faktorů.
Perioperační a pooperační péče o pacienty s multimorbiditou
Moderní doporučení komplexní perioperační péče je označováno jako ERAS (Enhanced Recovery After Surgery). Jde o komplex doporučených postupů, jejichž cílem je zlepšení bezpečnosti a efektivity chirurgické péče. Pro řadu operací jsou vypracovány samostatné postupy dostupné na www.erassociety.org.
Hlavními principy ERAS jsou kvalitní předoperační příprava, minimálně invazivní operace s udržením oběhové stability a stability vnitřního prostředí. To umožňuje redukci pooperačních intervencí, časnou mobilizaci z lůžka a obnovení perorálního příjmu jídla včetně zkrácení doby hospitalizace. Zjednodušeně lze říci, že hlavním principem ERAS je operace pacienta v tak dobré kondici a tak šetrným způsobem, že v pooperačním období nemá velký přesun tekutin, protrahovanou nevolnost, nemá silnou bolest, brzy začne jíst a chodit, nepotřebuje pojistné drény, infuzní léčbu, umělou výživu a může být brzy propuštěn domů. Z velké části jsou jednotlivé body ERAS postupů důležité i pro multimorbidní pacienty s tím rozdílem, že jejich individuální riziko pooperačních komplikací je vyšší a pečlivějším způsobem musíme monitorovat jejich pooperační rekonvalescenci.
U multimorbidních pacientů je kladen vyšší důraz na oběhovou perioperační stabilitu. Znamená to udržení dostatečné tkáňové perfuze přiměřeným příjmem tekutin případně s inotropní a vazoaktivní podporou podle monitorovaných parametrů. Tuto strategii v sobě nese koncept GDT (Goal Directed Therapy). Peroperační a pooperační hemodynamické monitorování je možné provádět méně invazivním způsobem monitorováním srdečního výdeje s použitím echokardiografie, monitorováním variace pulzové vlny či termodiluční metody s variací kalibrace chloridem lithia (PICCO, LIDCO), monitorování saturace centrální žilní krve atd.
Tekutinová perioperační léčba respektuje patofyziologickou situaci organismu s přesunem tekutin a jejich následnou mobilizací tak, aby na jedné straně nedocházelo k hypoperfuzi periferních tkání s deficitem kyslíku a s hypotenzí, a na druhé straně aby mobilizovaná dříve sekvestrovaná tekutina byla včas vyloučena navýšením diurézy bez známek srdečního selhávání. Přitom je nutné udržet stabilitu elektrolytového hospodářství a korigovat hyperglykemii s cílem pod 10 mmol/l. Terapeutické postupy hemodynamické optimalizace pracují většinou s monitorovanými bolusy intravenózních infuzí krystaloidů. Cílem je ověřit situaci volum respondence a vyvarovat se zbytečného podávání vazokonstrikčních léků v situaci hypovolemie s rizikem tkáňové hypoperfuze.
Od prvních prací strategie GDT, které pracovaly s dosažením supranormálních parametrů srdečního výdeje a dodávky kyslíku, dospěla metoda cílené terapie ke kontrolovanému individuálnímu podávání minimálně nutných tekutin i katecholaminů, čímž se stala součástí pooperační péče v systému ERAS. V současné době aplikace metody GDT s hemodynamickým per a pooperačním monitorováním paradoxně snižuje celkový objem tekutin nutných k oběhové stabilitě (22). Obecně platí jak u podávání vasokonstrikčních léků, tak u tekutinové léčby podávat jen nezbytné dávky k udržení středního arteriálního tlaku nad 65 mm Hg a pooperační diurézy 0,5–1 ml/kg hmotnosti za hodinu. U multimorbidních pacientů je optimální hodnota krevního tlaku individuální, snahou je zamezit výkyvům krevního tlaku přes 10 % od obvyklé hodnoty pacienta, případně korigovat arteriální hypertenzi pod 180/110 mm Hg. U pacientů s kardiostimulátorem je výhodné před velkou operací nebo bezprostředně pooperačně zvážit zvýšení nastavené frekvence kardiostimulátoru o 10 až 15 tepů za minutu.
Pooperační fibrilace síní
Výskyt pooperační nově vzniklé fibrilace síní je popisován u 3 % pacientů s nekardiální operací a jde o nejčastější poruchu srdečního rytmu v pooperačním období. Fibrilace síní vzniká častěji u pacientů po břišních, hrudních a cévních operacích. Většinou k poruše srdečního rytmu dochází do čtvrtého pooperačního dne, nejčastěji první den po operaci. Častější výskyt je spojen s hypokalemií, hypo - i hypervolemií. Po úpravě vnitřního prostředí dochází ke spontánní verzi na sinusový rytmus. Při rychlé odpovědi komor a hemodynamické nestabilitě je účinné podávání amiodaronu, případně do 48 hodin po vzniku fibrilace síní je možné provést elektrickou kardioverzi. Při časném obnovení sinusového rytmu je přechodně nasazená léčba amiodaronem ukončena.
U pacientů s opakovanou fibrilací síní a tam, kde fibrilace síní pooperačně trvala více než 48 hodin, je doporučena antikoagulační léčba po dobu 30 dnů s provedením kontrolního Holterova monitorování EKG. V případě krátkodobé epizody je preventivní podávání nízkomolekulárního heparinu indikováno podle standardní pooperační péče prevence trombembolické nemoci. V případě chronické fibrilace síní je odpověď komor regulována pod 110 tepů za minutu u pacientů bez projevů ischemické choroby srdeční.
Pacienti, kteří prodělali pooperační ataku fibrilace síní, mají větší riziko pooperační letality, delší hospitalizaci, nákladnější pooperační péči a vyšší riziko mozkové příhody v prvním roce po prodělané operaci. Riziko recidivy pooperační epizody fibrilace síní je v prvním roce 37 % ve srovnání s pacienty bez pooperační epizody fibrilace síní, kde je udáváno v 1,5 % (23, 24).
Pooperační akutní delirium
Jedná se o akutní mozkovou pooperační dysfunkci, která má přechodné trvání a různé projevy. Dominuje dezorientace, porucha vnímání, halucinace, emoční dysregulace a poruchy spánku. Pooperačně se delirium objevuje do pátého dne, nejčastěji již první den po operaci. Delirium může mít formu hypoaktivní, při které převládá apatie, zpomalení řeči, snížení motorické aktivity. Hyperaktivní formu charakterizuje psychomotorický neklid, agitovanost, rychlá řeč, agresivita a halucinace (27). Po odeznění deliria pacienti často prodělanou epizodu charakterizují jako živé sny, často spojené s úzkostí a strachem. Rizikovými faktory pro vznik pooperačního deliria jsou již přítomné kognitivní poruchy, frailty syndrom, vysoký věk a tíže základního onemocnění.
Patofyziologie pooperačního deliria není plně objasněna. Jedním evokujícím mechanismem je zánětová reakce s účinkem cytokinů na hematoencefalickou bariéru a stresem vyvolaný účinek cytokinů a hormonů v mozku. Druhým popisovaným mechanismem je neurochemická dysbalance týkající se změn koncentrací acetylcholinu, dopaminu, glutaminu, gama‑aminomáselné kyseliny a serotoninového systému v mozku. Popsána je porucha spojení mezi oblastmi metabolizujícími acetylcholin a dopamin, mezi subkortikálními oblastmi. Další funkční změny jsou popisovány v dorzolaterální prefrontální kůře a zadní cingule (26).
Pooperační delirium vzniká jako kumulativní interakce predisponujícíh – rizikových (Tab. 3) a precipitujících faktorů (27). Precipitujícími faktory může být protrahovaná sedace, analgezie opiáty, stresující faktory, nelaskavé, neurotické, hostilní či despotické prostředí, spánková deprivace.
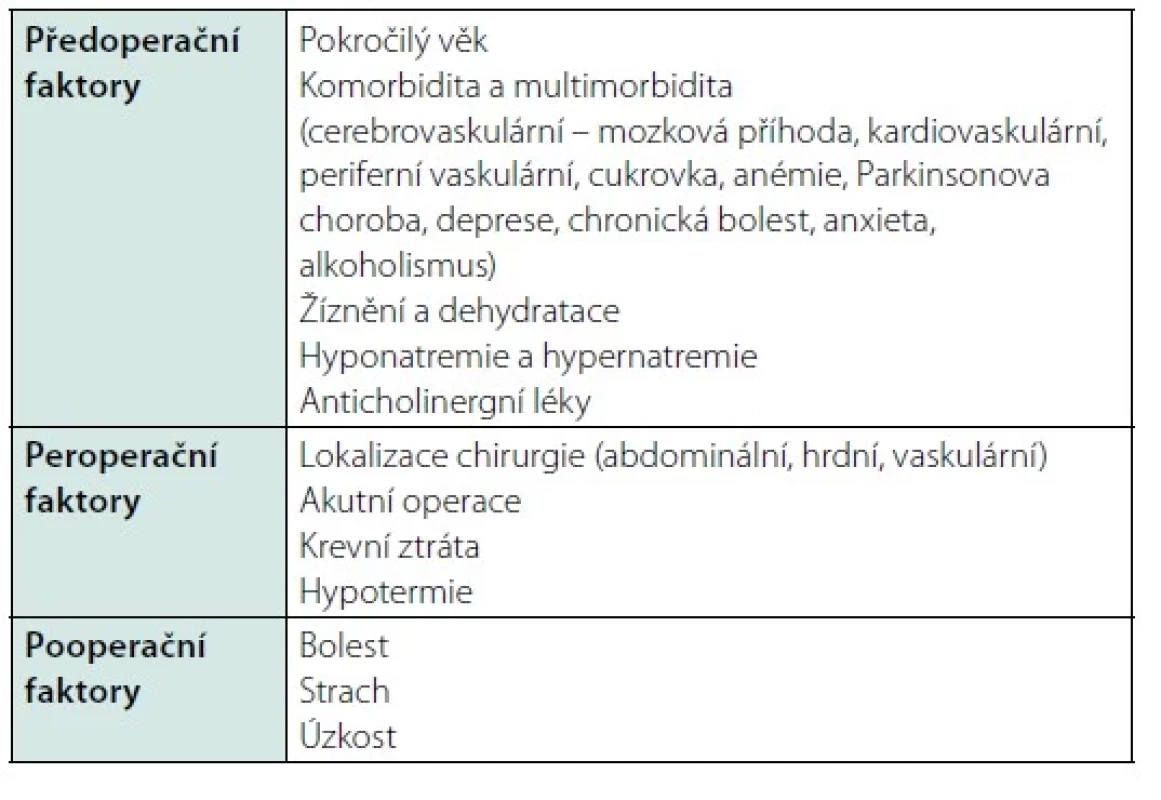
Přestože je akutní delirium definované jako reverzibilní, jde o faktor signalizující horší pooperační prognózu, dochází k dlouhodobému zhoršení kognitivních funkcí, prodlužuje se pobyt na JIP i délka hospitalizace. V průběhu akutního deliria je organismus ohrožen sníženým příjmem tekutin i jídla, sebepoškozením ve stavu dezorientace a motorického neklidu.
Prevenci akutního deliria pomáhá svědomitá aplikace ERAS protokolu v perioperační péči. Tlumení strachu a úzkosti je povinnou součástí nejen v předoperačním poučení pacienta, ale i v pooperační organizaci péče, kterou pacient má vnímat jako laskavou a bezpečnou. Součástí pooperační péče je intervence šesti rizikových faktorů nefarmakologické intervence: orientace (komunikace), sluch (naslouchadlo), zrak (brýle), dodržování cyklu spánek/bdění, časná mobilizace z lůžka (minimalizace imobilizujících pomůcek), hydratace (příjem jídla a pití). Návštěvy blízkých s pomocí v orientaci, zklidnění agitovanosti a úzkosti. Aktivní přístup v aplikaci nefarmakologických preventivních a terapeutických postupů je významný a účinný v prevenci pádů, výskytu deliria, zkrácení doby jeho trvání a hospitalizace (29).
Farmakologická intervence je zaměřena na snížení agitovanosti a úzkosti. Široce je používán haloperidol, případně tiaprid. Indikovaná jsou atypická antipsychotika risperidon, olanzapin, quetiapin s nižším rizikem extrapyramidového efektu a silnějším efektem tlumení halucinací ve srovnání s haloperidolem. Benzodiazepiny prodlužují trvání deliria. Jejich podání má význam v situacích neklidu při syndromu z odnětí u alkoholiků či při abúzu léků se sedativním účinkem. Na jednotkách intenzivní péče je používáno kontinuální podávání dexmedetomidinu a nízce dávkovaného propofolu s dobrým efektem, ale dosud diskutovanou bezpečností u obou preparátů.
Pooperační cévní mozková příhoda
Riziko pooperační cévní mozkové příhody je popisováno v 0,1–2 % operačních výkonů, s narůstajícím věkem a zvýšením počtu rizikových faktorů podobně jako u koronárních komplikací riziko pooperační mozkové příhody stoupá (29). V naprosté většině jde o ischemické cévní mozkové příhody emboligenní, trombogenní a hypoperfuzní etiologie. Peroperačně vzniklá akutní mozková příhoda nebývá včas diagnostikována, čímž bývá ztracena možnost akutní intervence. Mozková příhoda významně zvyšuje riziko pooperační letality nebo trvalých následků dokonaného iktu. Výskyt méně významných nerozpoznaných ischemických perioperačních inzultů je popisován až u 8 % pacientů nekardiální chirurgie ve věku vyšším 65 let (30). Důsledkem tichých mozkových ischemií dochází ke zhoršení kognitivních funkcí podobně jako u dokonaných iktů. Výskyt pooperačních cévních mozkových příhod tedy není zanedbatelný a významně mění pooperační morbiditu i letalitu.
Rizikové faktory pro vznik pooperační cévní mozkové příhody jsou obdobné jako pro pooperační srdeční infarkt a jsou uvedeny v tabulce 4 (31). Po prodělané mozkové příhodě je zvýšené riziko vzniku nové mozkové příhody peroperačně z důvodu dosud narušené autoregulace mozkové perfuze nejvyšší v prvních třech měsících a upravuje se do 9 měsíců po prodělaném iktu (32). O preventivním UZ vyšetření magistrálních tepen mozku je třeba uvažovat u rizikových pacientů podstupujících odložitelnou velkou operaci. Velký důraz je kladen na předoperační optimalizaci chronické medikace. Nově nasazená léčba betablokátory zvyšuje riziko perioperační cévní mozkové příhody. Léčba statiny je lépe dokumentovaná v prevenci kardiovaskulárních než cerebrovaskulárních onemocnění, proto doporučení ohledně statinů je formulováno jako ponechání nastavené medikace. Vzhledem k velkému zastoupení trombembolických příhod v etiologii perioperačních cerebrovaskulárních komplikací je důležité věnovat pozornost perioperačnímu vysazování antikoagulační léčby. Vždy je zvažováno riziko trombembolismu na jedné straně a riziko pooperačního krvácení na straně druhé (34). V průběhu operace a v pooperačním období je důležitým faktorem zvyšujícím riziko vzniku cévní mozkové příhody pokles krevního tlaku. Bezpečná hodnota středního arteriálního tlaku 70 mm Hg je jen orientační. U rizikových osob má význam udržovat krevní tlak bez výkyvů přesahujícíh 10 % obvyklé hodnoty krevního tlaku konkrétního pacienta.

Pooperační výživa a pohybová rehabilitace
Doporučení Evropské společnosti parenterální a enterální výživy – ESPEN jednoznačně označuje výživu za povinnou součást chirurgické péče (9, 13). Multimorbidní pacienti převážně spadají do kategorie nutričně rizikových pacientů. Koncepce urychlené pooperační rekonvalescence zdůrazňuje minimalizaci pooperačního hladovění s tím, že u většiny pacientů včetně operací na zažívacím traktu je možné perorální příjem zahájit časně v prvních 24 hodinách po operaci. Důvodem je minimalizace ztráty endogenního proteinu, udržení funkce střeva a jeho střevní bariéry, což zmírňuje zánětovou rekci a zrychluje pooperační rekonvalescenci.
Ve vztahu k multimorbiditě, fragilitě a pokročilému věku je ale třeba zdůraznit zvýšené riziko pooperační střevní paralýzy, zvýšeného výskytu gastroezofageálního refluxu a dysfagie, neuropatie a menší intenzity obranných reflexů. S tím souvisí zvýšené riziko regurgitace a nebezpečné aspirace. Přestože je důležité nezanedbat časné obnovení perorálního příjmu po operaci, je stejně důležité zohledňovat bezpečnost jídla v individuální situaci konkrétního pacienta (úroveň vědomí, pohybová koordinace, svalová síla, stav hydratace a stabilita vnitřního prostředí apod.) Důležitá je poloha vsedě při perorálním příjmu a pečlivé klinické sledování tolerance perorálního příjmu.
Nedostatečný perorální příjem je doplňován umělou enterální, případně parenterální cestou v indikovaných případech. Oba typy umělé výživy přispívají ke zmírnění důsledků pooperačního proteinového katabolismu, ale vždy je třeba brát v úvahu i riziko jejich vedlejších účinků. V rámci ošetřovatelské péče je třeba aplikaci umělé výživy organizovat tak, aby nebránila v důležité pohybové rehabilitaci a časné mobilizaci z lůžka. Přítomnost nazogastrické, ale i tenké enterální sondy může být nepříjemným stresovým faktorem stejně jako zavedený periferní žilní katétr. Hlavním vedlejším účinkem parenterální výživy je zvýšené riziko infekčních komplikací z důvodu přítomného žilního katétru a sklonu k hyperglykemii.
Indikací k umělé nutriční podpoře v pooperačním období je přítomná malnutrice či nutriční riziko s nulovou tolerancí k pooperačnímu hladovění. Nutriční podpora je též podávána pacientům, u kterých nebude perorální příjem možný déle než 5 dnů nebo jejich perorální příjem nedosáhne alespoň 50 % energetické potřeby po dobu 7 dnů. V těchto případech je výživa zahajována bez prodlení, jakmile tato situace bude předpokládána, nikoliv po uplynutí oněch 5 a 7 dnů (9). Pacienti, kteří přichází k operaci bez nutričního rizika a předpokládáme obnovení plného perorálního příjmu do pěti až sedmi dnů žádného nebo částečného příjmu jídla, umělou výživu nepotřebují a byli by zbytečně zatíženi rizikem jejích vedlejších účinků.
Závěr
Pacientů s multimorbiditou v chirurgické péči přibývá na základě stárnutí populace. Sama multimorbidita není rozhodujícím faktorem pro zvýšené riziko pooperačních komplikací, o kterém více rozhoduje často současně přítomná sarkopenie a frailty syndrom. Operační trauma obecně představuje zátěž pro oběhovou soustavu a v metabolické reakci vede ke ztrátám proteinové hmoty organismu se všemi důsledky v riziku pooperačních komplikací konkrétního často chronicky nemocného pacienta. V současné době je kladen velký důraz na předoperační přípravu k plánované operaci. Moderní perioperační péči představuje komplex systému ERAS (Enhanced Recovery After Surgery), jehož součástí se stalo i hemodynamické monitorování GDT (Goal Directed Therapy) u rizikových pacientů. Funkční komplex péče umožňuje zrychlení pooperační rekonvalescence a zkrácení pooperační hospitalizace. Nutriční péče je povinnou součástí chirurgické léčby.
Článek přijat redakcí: 10. 3. 2023
Článek přijat po recenzích: 11. 4. 2023
MUDr. Eduard Havel, Ph.D.
Lékařská fakulta v Hradci Králové
Sources
1. Ihemelandu C, Zheng C, Hall E, et al. Multimorbidity and access to major cancer surgery at high‑volume hospitals in a regionalized era. Am J Surg. 2016;211(4):697-702. doi:10.1016/j. amjsurg.2015. 09. 017.
2. Ko FC. Preoperative Frailty Evaluation: A Promising Risk‑stratification Tool in Older Adults Undergoing General Surgery. Clin Ther. 2019;41(3):387-399. doi:10.1016/j.clinthera. 2019. 01. 014.
3. Au Yong PSA, Sim EYL, Ho CYX, et al. Association of Multimorbidity With Frailty in Older Adults for Elective Non‑Cardiac Surgery. Cureus. 2021;13(5):e15033. Published 2021 May 14. doi:10.7759/cureus.15033.
4. Ljungqvist O, Scott M, Fearon KC. Enhanced recovery aftersurgery: a review. Journal of the American Medical Association Surgery 2017;152 : 292-8.
5. Rosenthal MH. Intraoperative fluid management - what and how much?. Chest. 1999;115(5 Suppl):106S-112S. doi:10.1378/chest.115.suppl_2.106 s.
6. Ebrahim M, Larsen PB, Hannani D, Liest S, Jørgensen LN, Jørgensen HL. Preoperative risk factors including serum levels of potassium, sodium, and creatinine for early mortality after open abdominal surgery: a retrospective cohort study. BMC Surg. 2021;21(1):62. Published 2021 Jan 26. doi:10.1186/s12893-021-01070-0.
7. van den Berghe G, Wouters P, Weekers F, et al. Intensive insulin therapy in critically ill patients. N Engl J Med. 2001;345(19):1359-1367. doi:10.1056/NEJMoa011300.
8. Preiser JC, Devos P, Ruiz‑Santana S, et al. A prospective randomised multi‑centre controlled trial on tight glucose control by intensive insulin therapy in adult intensive care units: the Glucontrol study. Intensive Care Med. 2009;35(10):1738-1748. doi:10.1007/s00134-009-1585-2
9. Weimann A, Braga M, Carli F, et al. ESPEN practical guideline: Clinical nutrition in surgery. Clin Nutr. 2021;40(7):4745-4761. doi:10.1016/j.clnu.2021. 03. 031.
10. Jaconelli M, Greenhaff PL, Atherton PJ, Lobo DN, Brook MS. The effects of elective abdominal surgery on protein turnover: A meta‑analysis of stable isotope techniques to investigate postoperative catabolism. Clin Nutr. 2022;41(3):709-722. doi:10.1016/j.clnu.2022. 01. 023
11. Doporučeny postup interniho předoperačniho vyšetřeni před elektivnimi operačnimi vykony. Věstnik ministerstva zdravotnictvi Česke republiky 2018; častka 1 : 35–49. Dostupné z: ttp://www.mzcr.cz/Legislativa/dokumenty/vestnik - c1/2018_14762_3810_11. html [cit 2019 Jan 14].
12. Kristensen SD, Knuuti J, Saraste A, et al. 2014 ESC/ESA Guidelines on non‑cardiac surgery: cardiovascular assessment and management: The Joint Task Force on non‑cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA). Eur Heart J. 2014;35(35):2383 - 2431. doi:10.1093/eurheartj/ehu282.
13. Weimann A, Braga M, Carli F, et al. ESPEN guideline: Clinical nutrition in surgery. Clin Nutr. 2017;36(3):623-650. doi:10.1016/j.clnu.2017. 02. 013.
14. Xue D‑d, Cheng Y, Wu M, Zhang Y. Comprhensive geriatric assessment prediction of posoperative complications in gastrointestinal cancer patients: a meta‑analysis. Clinical Interventions in Aging 2018;13 : 723-736.
15. Scheede‑Bergdahl C, Minnella EM, Carli F. Multi‑modal prehabilitation: addressing the why, when, what, how, who and where next? Anaesthesia 2019;74 : 20-26.
16. Barberan‑Garcia A, Ubré M, Roca J, et al. Personalised Prehabilitation in High‑risk Patients Undergoing Elective Major Abdominal Surgery: A Randomized Blinded Controlled Trial. Ann Surg. 2018;267(1):50-56. doi:10.1097/SLA.0000000000002293.
17. Moťovská Z, et al., 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Summary of the document prepared by the Czech Society of Cardiology, Cor et Vasa 2017;59: e592-e612, jak vyšel v online verzi Cor et Vasa na https://www.sciencedirect.com/science/article/pii/S0010865017301728.
18. Ganesh R, Kebede E, Mueller M, Gilman E, Mauck KF. Perioperative Cardiac Risk Reduction in Noncardiac Surgery. Mayo Clin Proc. 2021;96(8):2260-2276. doi:10.1016/j.mayocp. 2021. 03. 014
19. Botto F, Alonso‑Coello P, Chan MT, et al. Myocardial injury after noncardiac surgery: a large, international, prospective cohort study establishing diagnostic criteria, characteristics, predictors, and 30-day outcomes. Anesthesiology 2014;120(3):564-578.
20. 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non‑cardiac surgery: Developed by the task force for cardiovascular assessment and management of patients undergoing non‑cardiac surgery of the European Society of Cardiology (ESC) Endorsed by the European Society of Anaesthesiology and Intensive Care (ESAIC), European Heart Journal, 2022;, ehac270, https://doi.org/10.1093/eurheartj/ehac270
21. Skalická H, et al., Summary of the 2014 ESC Guidelines on non‑cardiac surgery: Cardiovascular assessment and management. Prepared by the Czech Society of Cardiology, Cor et Vasa 2015;57:e190–e213, jak vyšel v online verzi Cor et Vasa na http://www.sciencedirect. com/science/article/pii/S0010865015000193.
22. Weinberg L, Mackley L, Ho A, et al. Impact of a goal directed fluid therapy algorithm on postoperative morbidity in patients undergoing open right hepatectomy: a single centre retrospective observational study. BMC Anesthesiol. 2019;19(1):135. Published 2019 Jul 31. doi:10.1186/s12871-019-0803-x.
Další literatura u autora
a na www.casopisvnitrnilekarstvi.cz
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2023 Issue 3
-
All articles in this issue
- Hlavní téma – Multimorbidita ve vnitřním lékařství
- Perioperační péče o pacienta s multimorbiditou
- Multimorbidita při nefrotickém syndromu
- Multimorbidní nemocný v intenzivní péči
- Specifika diagnostiky a léčby multimorbidních pacientů
- JAK inhibice v léčbě zánětlivých revmatických onemocnění
- Efekt inhibitoru sodíko‑glukózového ko‑transporteru 2 empagliflozinu na vývoj onemocnění u pacienta se srdečním selháním a zachovalou ejekční frakcí
- Diferenciální diagnostika intersticiálních plicních procesů
- Novinky v gastroenterologii, hepatologii a digestivní endoskopii
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Diferenciální diagnostika intersticiálních plicních procesů
- Hlavní téma – Multimorbidita ve vnitřním lékařství
- Multimorbidita při nefrotickém syndromu
- Multimorbidní nemocný v intenzivní péči
