V prevenci demence je třeba se zaměřit na časnou a důslednou léčbu hypertenze
In the prevention of dementia, the focus should be on early and consistent treatment of hypertension
The brain is among the target organs of hypertension. Patients with hypertension have a higher risk of developing stroke as well as experiencing a decline in cognitive functions and dementia. Changes in the white matter and atrophy of the grey matter of the brain induced by high blood pressure develop insidiously since the onset of hypertension, even in young individuals. The effect of high blood pressure on the vessel wall cumulates in time; therefore, hypertension in younger people implies an increased risk of dementia in older age. Hypertension in young age cannot be considered a benign condition. Hypertension in middle age increases the risk of dementia by 61 %. Consistent and early hypertension control can reverse the adverse development towards dementia and lack of self-sufficiency in the patient. Data comparing individual antihypertensive drugs in terms of preventing dementia are scarce. However, renin angiotensin system blockers have been found to protect against Alzheimer’s disease more than other classes of antihypertensive drugs. To achieve rapid and effective hypertension control, a combination of antihypertensive drugs is usually required. Using a fixed-dose triple combination of perindopril, indapamide, and amlodipine, blood pressure targets of < 130/80 mm Hg can be achieved within three months in 93 % of patients.
Keywords:
dementia – hypertension – cognitive function – hypertension-induced end-organ damage – RAS inhibitors – ACEI – sartans – fixed-dose triple combination of antihypertensive drugs – Triplixam
Authors:
Miroslav Souček
Authors‘ workplace:
II. interní klinika FN u sv. Anny v Brně
Published in:
Vnitř Lék 2023; 69(4): 249-253
Category:
Review Articles
doi:
https://doi.org/10.36290/vnl.2023.047
Overview
Mozek patří mezi cílové orgány hypertenze. Pacienti s hypertenzí mají nejen vyšší riziko cévních mozkových příhod, ale i poklesu kognitivních funkcí a demence. Rozvoj změn v bílé hmotě a atrofie šedé hmoty mozkové navozené vysokým tlakem krve se rozvíjejí plíživě již od nástupu hypertenze, a to i u mladých jedinců. Efekt vysokého tlaku krve na cévní stěnu se kumuluje v čase, a proto hypertenze u mladších osob znamená zvýšené riziko demence ve vyšším věku. Hypertenzi v mládí nelze považovat za benigní onemocnění. Hypertenze ve středním věku zvyšuje riziko vzniku demence o 61 %. Důsledná a včasná kompenzace hypertenze dokáže nepříznivý vývoj směrem k demenci a nesoběstačnosti pacienta zvrátit. Data z porovnání jednotlivých antihypertenziv z hlediska prevence demence jsou skromná. Bylo ale zjištěno, že blokátory systému renin‑angiotenzin chrání před Alzheimerovou chorobou více než ostatní skupiny antihypertenziv. Pro dosažní rychlé a účinné kompenzace hypertenze je obvykle nutná kombinace antihypertenziv. Pomocí fixní trojkombinace perindoprilu, indapamidu a amlodipinu lze dosáhnout cílových hodnot krevního tlaku < 130/80 mm Hg během 3 měsíců u 93 % pacientů.
Klíčová slova:
kognitivní funkce – demence – hypertenze – poškození cílových orgánů navozené hypertenzí – inhibitory RAS – ACEI – sartany – fixní trojkombinace antihypertenziv – Triplixam
Hypertenze, cévní mozkové příhody a demence
Cévní mozkové příhody (CMP) jsou v ČR druhou hlavní příčinou smrti (1). Jedním z nejvýznamnějších rizikových faktorů CMP je arteriální hypertenze. Symptomatické poškození mozku navozené hypertenzí zahrnuje kromě CMP také pokles kognitivních funkcí a rozvoj demence. Rozvoj demence v důsledku hypertenze je dlouhodobý proces s kumulací nepříznivého dopadu v čase. Předchází mu subklinické poškození mozku (zmnožení bílé hmoty, němé infarkty a mikrohemorhagie), které lze nalézt u pacientů nad 65 let u 44 % jedinců s hypertenzí (2).
Pokud se týká CMP, 54 % všech těchto příhod je způsobeno vysokým krevním tlakem. Jedinci s arteriální hypertenzí mají 3–4násobné riziko CMP v porovnání s obecnou populací. Zásadní význam pro prevenci CMP má proto kompenzace hypertenze. Dostatečné kompenzace krevního tlaku k doporučeným hodnotám je ve velké části případů možné dosáhnout pouze kombinací antihypertenziv. Bylo doloženo, že s každou další přidanou skupinou antihypertenziv klesá riziko CMP o 23 % (3).
Naléhavá začíná být problematika demence. Nejen v ČR dochází vlivem stárnutí k nárůstu prevalence kognitivní dysfunkce. Odhaduje se, že do roku 2050 se počet pacientů s demencí u nás více než zdvojnásobí ze stávajících 180 000 na 400 000 případů. K rozvoji demence přispívá i hypertenze, a to cestou zvýšení tuhosti intrakraniálních tepen (4, 5). Jak vyplývá z klinického výzkumu, přítomnost hypertenze ve středním věku zvyšuje riziko vzniku demence o 61 % (6). Neléčená mírná až střední hypertenze ve věku 50–60 let zvyšuje riziko lézí bílé hmoty spojených s demencí (7). Již krevní tlak 120/80 mm Hg ve věku 19–40 let je spojen s redukcí šedé hmoty mozkové (8). To vše naznačuje, že cestou, jak omezit rozsah pandemie demence, je včasná a důsledná kompenzace hypertenze již od mládí (9).
Mozek jako cílový orgán hypertenze
Mezi cílové orgány hypertenze patří cévy, srdce, ledviny, mozek a oči. Ve studii se 142 pacienty s hypertenzí bylo zjištěno poškození srdce u 21 %, poškození ledvin u 26 % a subklinické poškození mozku u 44 % případů (2). Subklinické poškození mozku lze identifikovat pomocí magnetické rezonance jako hyperdenzity v bílé hmotě, které nacházíme u starších osob s hypertenzí, němé infarkty, přítomné u 10–30 % hypertoniků, a mikrohemoragie, které se vyskytují asi u 5 % těchto pacientů (2). Subklinické poškození mozku je nezávislým, aditivním a prognosticky relevantním markrem preklinického poškození cílových orgánů souvisejícím s hypertenzí (2).
Souvislost mezi incidencí demence / zhoršením kognitivních funkcí a výskytem subklinického poškození mozku je již dlouho doložena. Relativní riziko demence je při výskytu 1–2 lakunárních infarktů v bazálních gangliích, thalamu nebo bílé hmotě 20násobné (2).
Negativní vliv hypertenze na cílové orgány se v čase kumuluje (11). Pokud jsou tedy cévy vystaveny vysokému krevnímu tlaku dlouhodobě, je riziko poškození cílových orgánů vyšší. Z tohoto pohledu je riziková zejména hypertenze u osob mladšího a středního věku s předpokládanou větší zbývající délkou života, a tedy i dlouhodobější expozicí cévní stěny vysokému krevnímu tlaku. Hypertenzi v mládí proto nelze považovat za benigní onemocnění a její léčbu odkládat.
Riziko hypertenze v mladším věku pro rozvoj demence
Studie CARDIA ukázala, že v 50 letech má polovina osob s hypertenzí poškozen nejméně 1 cílový orgán (12). Ke strukturálním změnám mozku navozeným hypertenzí dochází od mládí. Ve studii se 423 pacienty s hypertenzí ve věku 19–40 let byl již krevní tlak >120/80 mm Hg provázen snížením objemu šedé hmoty mozkové v oblasti frontálního laloku, parietálního laloku, thalamu, hipokampu a amygdaly (8). U 1903 osob z Framinghamu průměrného věku 46 let byla zvýšená arteriální tuhost spojená s poruchou integrity bílé hmoty corpus callosum a corona radiata a s atrofií šedé hmoty thalamu. Antihypertenzní terapie poškození mozku zmírňovala (13). Podle dat z UK Biobank je rozsah atrofie mozku dán věkem vzniku hypertenze. Významné zmenšení objemu mozku bylo zjištěno u osob, u nichž se rozvinula hypertenze do 54 let věku, přičemž u jedinců, u nichž se hypertenze rozvinula již před 35. rokem věku, bylo snížení objemu mozku největší (14).
V již zmíněné studii CARDIA měl věk při vzniku hypertenze vliv na míru poklesu kognitivních funkcí u 50letých osob s hypertenzí (12). Největší pokles celkového skóre kognitivních funkcí dle Montrealského testu, Testu substituce digitálních symbolů, Reyova auditorně‑verbálního testu učení a Stroopova prostorového testu byl zjištěn u osob se vznikem hypertenze před 35. rokem věku. Studie UK Biobank také ukázala, že rozvoj hypertenze v mládí zvyšuje riziko demence ve stáří, a to zejména demence vaskulárního typu (Obr. 1) (14).
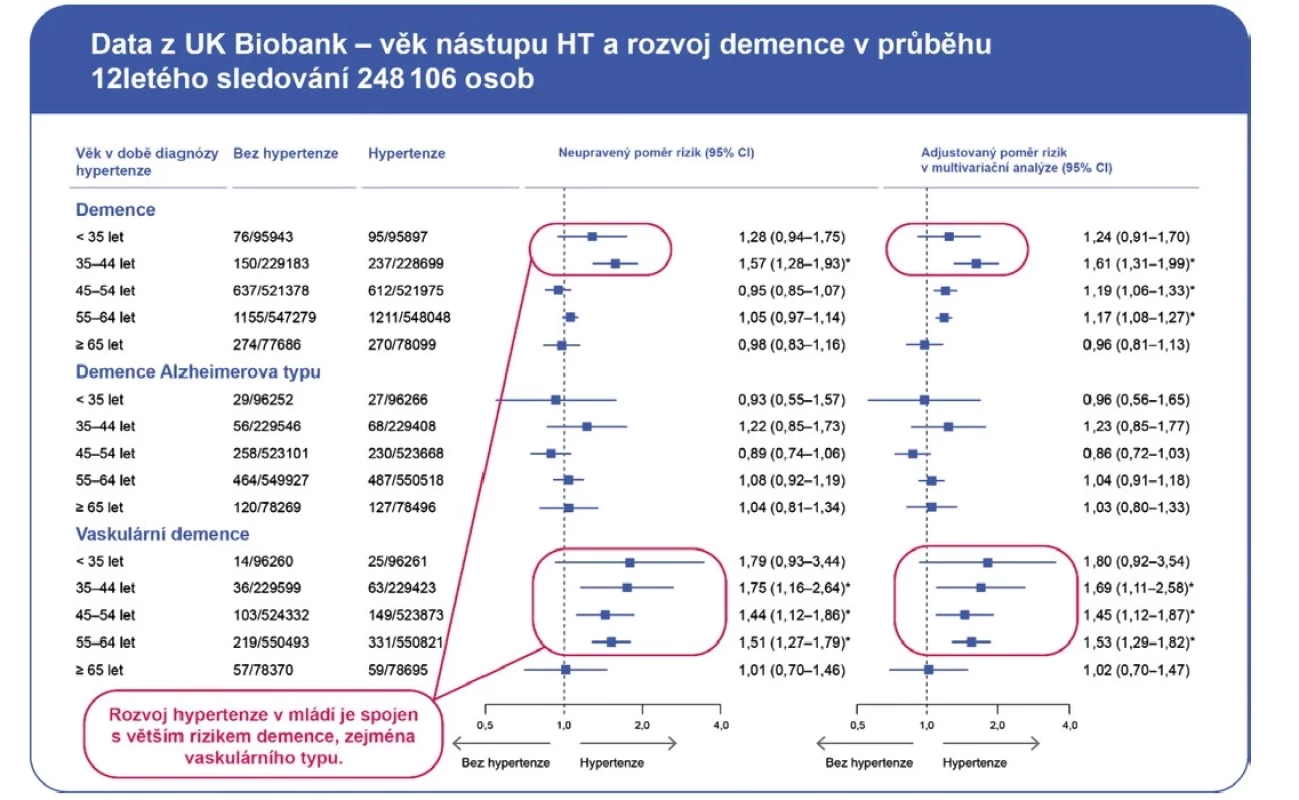
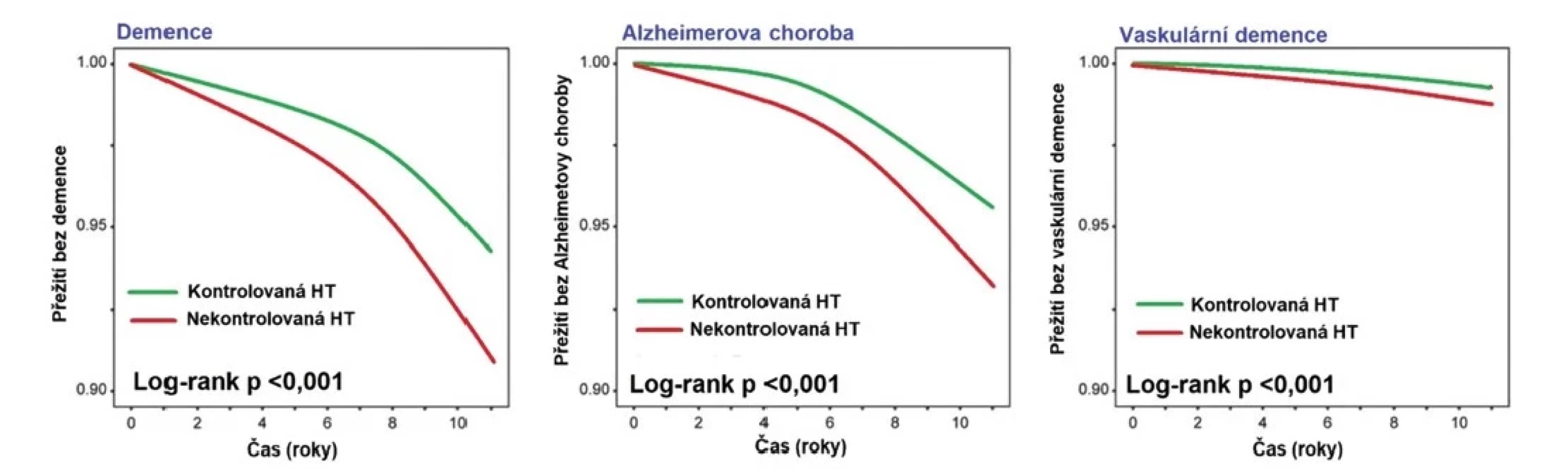
Kompenzace hypertenze může pomoci předejít rozvoji demence již u nízkorizikových pacientů s hypertenzí 1. stupně. V nedávné studii zahrnující jedince s hypertenzí I. stupně (TK 140–159/90–99 mm Hg) měli pacienti s kontrolovanou hypertenzí nižší riziko rozvoje demence, a to jak vaskulární, tak i Alzheimerova typu (Obr. 2) (15). Bylo také doloženo, že intenzivní kompenzace krevního tlaku k hodnotám STK < 120 mm Hg je lepší než standardní kompenzace s cílem STK < 140 mm Hg. Progrese změn bílé hmoty byla u hypertoniků pomalejší při intenzivní léčbě v porovnání s léčbou standardní, a to u pacientů ve všech tercilech STK (≥ 129 mm Hg / 130–142 mm Hg / ≥143 mm Hg) (16). Pacientům, zejm. mladšího věku, je třeba problematiku kumulace nepříznivého dopadu hypertenze na mozek a další cílové orgány vysvětlit a motivovat je tak k dodržování antihypertenzní léčby. Poškození mozku hypertenzí je zvláště nebezpečné z důvodu své ireverzibility. Může vést až ke ztrátě soběstačnosti a invalidizaci.
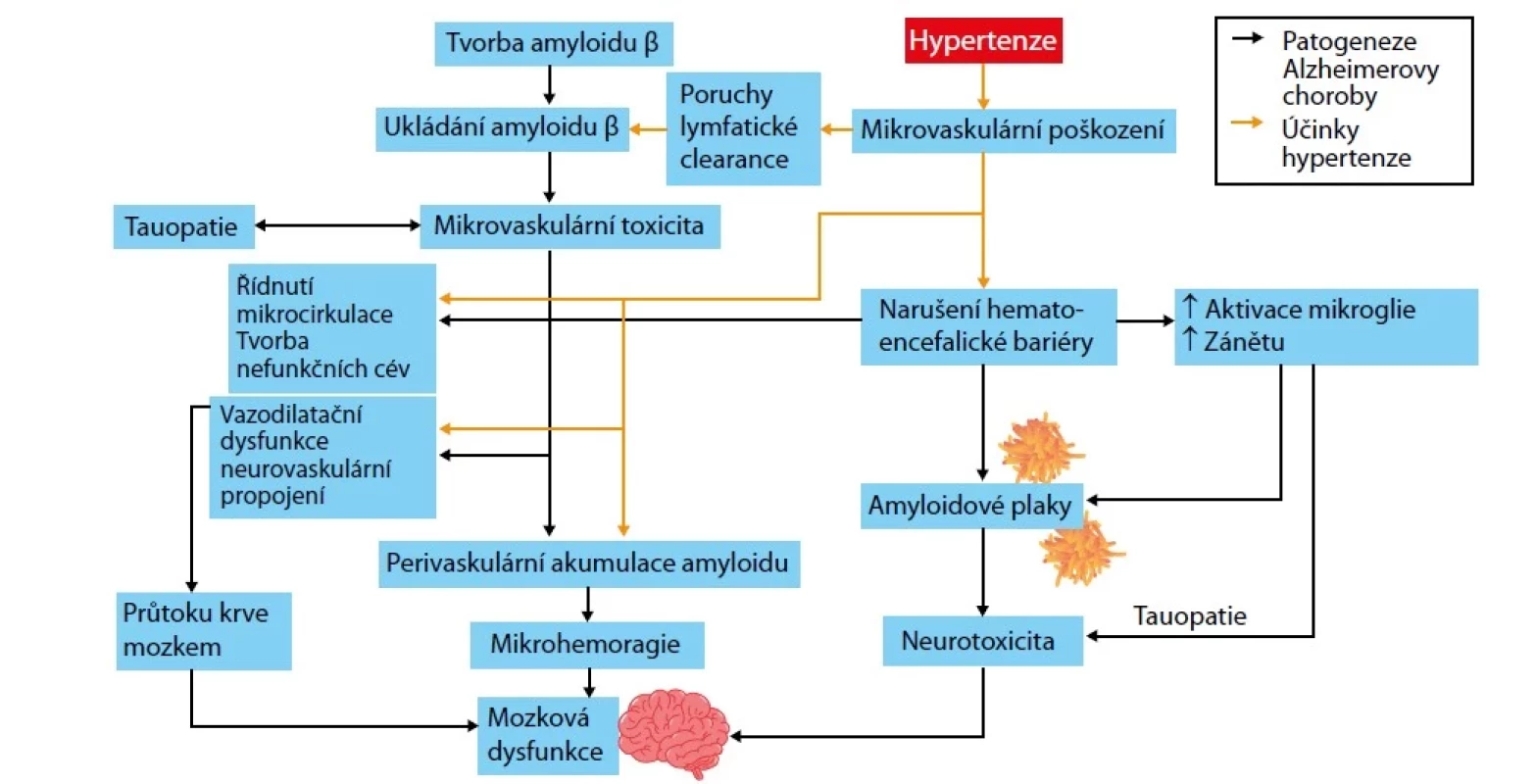
Kromě vaskulární demence hypertenze akceleruje i Alzheimerovu chorobu, a to cestou narušení hematoencefalické bariéry a lymfatické clearance, které podporují tvorbu amyloidových plaků a ukládání amyloidu β (Obr. 3) (17).
Volba antihypertenzní terapie
V souvislosti s příznivým vlivem kompenzace hypertenze proti rozvoji demence je určitě zajímavý přínos jednotlivých antihypertenziv, či jejich porovnání z hlediska tohoto parametru. Takových dat je ale zatím málo. Analýza výsledků 1 343 334 pacientů pojištěných u americké zdravotní pojišťovny Medicare ukázala, že blokátory systému renin‑angiotenzin (RAS) chrání před Alzheimerovou chorobou více než ostatní skupiny antihypertenziv (18). Při porovnání jednotlivých inhibitorů RAS můžeme vycházet pouze z vlivu na jiné parametry. Studie zahrnující 120 pacientů s hypertenzí a nadváhou/obezitou, která porovnávala snížení krevního tlaku během 24 týdnů při léčbě perindoprilem, enalaprilem, telmisartanem a losartanem, ukázala největší pokles ve skupině s perindoprilem. Metaanalýzy randomizovaných studií, které porovnávaly ACEI a sartany, prokázaly, že u pacientů s hypertenzí snižují celkovou mortalitu významně ACEI nikoliv sartany (20). ACEI také na rozdíl od sartanů prokázaly prevenci vniku diabetického onemocnění ledvin u pacientů s diabetem a normoalbuminurií (22). U pacientů se stabilní ICHS a zachovanou funkcí levé komory vedlo přidání ACEI na rozdíl od sartanů ke standardní farmakoterapii ke snížení mortality a rizika infarktu myokardu (23).
Popsané rozdíly mohou být dány odlišným mechanismem účinku těchto 2 tříd antihypertenziv. Sartany, jako blokátory AT1 receptorů pro angiotenzin II, vedou z důvodu svého mechanismu účinku k významnému zvýšení hladiny angiotenzinu II a nadměrné aktivaci AT2 a AT4 receptorů. Chronická aktivace AT2 receptorů při zvýšené plazmatické hladině angiotenzinu II může navozovat fibrózu srdce a cév. Aktivace AT4 receptorů zase přispívá k zánětu cévní stěny, což je rozhodující faktor rozvoje aterosklerózy. ACEI naopak snižují hladinu angiotenzinu II a zvyšují hladinu bradykininu, který potlačuje zánět, hypertrofii srdce a cév a podporuje angiogenezi (24). Tedy zatímco ACEI mají specifický mechanismus účinku příznivě ovlivňující funkci endotelu, aterogenezi a fibrinolýzu, chronické podávání sartanů může přispívat k rozvoji aterosklerózy cestou regulace 2 klíčových pochodů – zánětu a fibrózy (24).
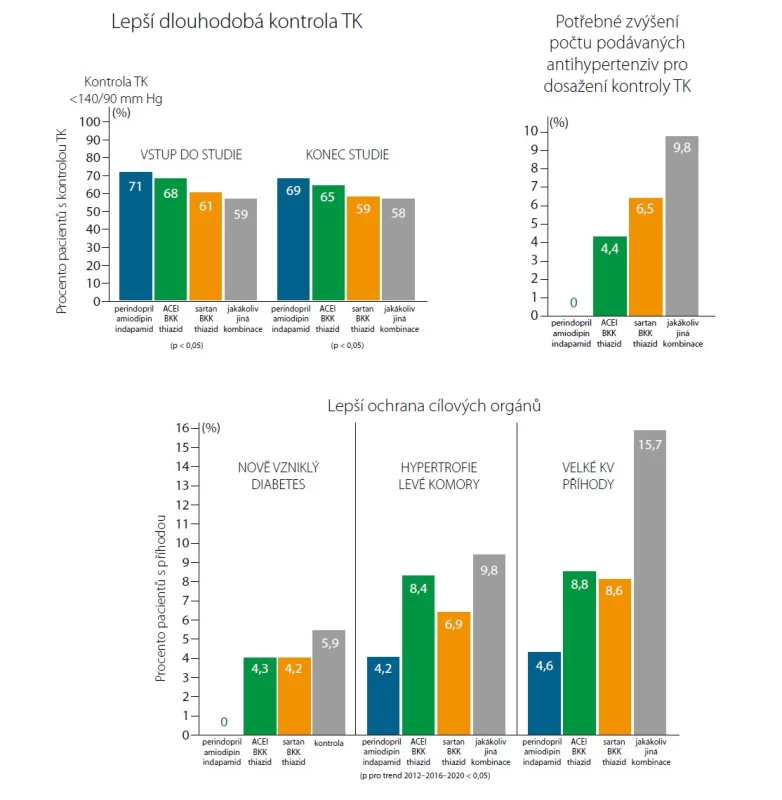
Pro kombinovanou léčbu hypertenze, která je u většiny pacientů nutná k dosažení cílových hodnot krevního tlaku, je s nejvyšší mírou doporučení uvedeno současné podávání ACEI + diuretika + blokátoru Ca kanálu (BKK). Pro zjednodušení léčby jsou vhodné fixní dvoj - a trojkombinace antihypertenziv. Právě takovou alternativu nabízí Triplixam® – fixní trojkombinace perindoprilu, indapamidu a amlodipinu. Multicentrická observační studie TRICOLOR potvrdila u Triplixamu® vysokou antihypertenzní účinnost, dobrou toleranci a adherenci k léčbě u pacientů s hypertenzí v běžné klinické praxi. Cílové hodnoty krevního tlaku (< 130/80 mm Hg) dosáhlo po 3 měsících léčby 93,3 % pacientů (25).
Kombinace perindoprilu s indapamidem a amlodipinem byla porovnávána s trojkombinací ACEI, BKK a thiazidového diuretika, s trojkombinací sartanu, BKK a thiazidového diuretika a s jakoukoliv další trojkombinací antihypertenziv v běžné klinické praxi ve studii Brishigella. Složky přípravku Triplixam® vykázaly lepší dlouhodobou kompenzaci krevního tlaku, méně častou potřebu přidat další antihypertenzivum k dosažení kontroly krevního tlaku a lepší ochranu cílových orgánů v podobě nižšího výskytu hypertrofie levé komory a velkých kardiovaskulárních příhod (26).
Závěr
Mozek patří mezi cílové orgány hypertenze nejen z důvodu rizika CMP, ale také rizika poklesu kognitivních funkcí a vzniku demence. Arteriální hypertenze je významným ovlivnitelným rizikovým faktorem rozvoje kognitivního deficitu. V současné době stojíme v ČR na prahu pandemie demence, kterou dosud nedokážeme léčit. Změny v mozku související s demencí navozené hypertenzí jsou nevratné. Jejich rozvoj začíná se vznikem hypertenze již od mládí a kumuluje se v čase. Pro mozek je věk vzniku hypertenze zásadní: hypertenze, která se rozvine již v mládí, je spojena s horší prognózou než hypertenze se začátkem v pozdním věku. Včasné zachycení a zahájení antihypertenzní léčby v mládí a důsledná dlouhodobá kompenzace hypertenze může rozvoj poklesu kognitivních funkcí a demence zvrátit. S léčbou je třeba začít již u mladých nízkorizikových pacientů.
Článek přijat redakcí: 5. 5. 2023
Článek přijat po recenzích: 25. 5. 2023
prof. MUDr. Miroslav Souček, CSc.
II. interní klinika FN u sv. Anny v Brně
Sources
1. GBD 2019 Diseases and Injuries Collaborators. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2020 Oct 17;396(10258):1204-1222. Dostupné na: http://www.healthdata. org/czech‑republic.
2. Henskens LH, van Oostenbrugge RJ, Kroon AA, et al. Detection of silent cerebrovascular disease refines risk stratification of hypertensive patients. J Hypertens. 2009 Apr;27(4):846-853.
3. Madsen TE, Howard G, Kleindorfer DO, et al. Sex Differences in Hypertension and Stroke Risk in the REGARDS Study: A Longitudinal Cohort Study. Hypertension. 2019 Oct;74(4):749-755.
4. Elyas S, Adingupu D, Aizawa K, et al. Cerebral small vessel disease, systemic vascular characteristics and potential therapeutic targets. Aging (Albany NY). 2021 Sep 22;13(18):22030–22039.
5. Melgarejo J, Vernooij MW, Ikram MA, et al. Intracranial carotid arteriosclerosis mediates the association between blood pressure and cerebral small vessel disease: the Rotterdam Study. Prezentováno na kongresu ESC 2022 v Barceloně.
6. Barnes DE, Yaffe K. The projected effect of risk factor reduction on Alzheimer’s disease prevalence. Lancet Neurol. 2011 Sep;10(9):819-828.
7. Sierra C, de La Sierra A, Mercader J, et al. Silent cerebral white matter lesions in middle‑aged essential hypertensive patients. J Hypertens. 2002 Mar;20(3):519-524.
8. Schaare HL, Kharabian Masouleh S, et al. Association of peripheral blood pressure with gray matter volume in 19 - to 40-year‑old adults. Neurology. 2019 Feb 19;92(8):e758-e773.
9. Wohlfahrt P. Cognitive impairment and the threat of dementia pandemic or the journey of hypertensive patients to self‑care deficit. Vnitr Lek. 2022 Winter;68(8):532-536.
10. Snowdon DA, Greiner LH, Mortimer JA, et al. Brain infarction and the clinical expression of Alzheimer disease. The Nun Study. JAMA. 1997 Mar 12;277(10):813-817.
11. Wang N, Harris K, Hamet P, et al. Cumulative Systolic Blood Pressure Load and Cardiovascular Risk in Patients With Diabetes. J Am Coll Cardiol. 2022 Sep 20;80(12):1147-1155.
12. Suvila K, McCabe EL, Lehtonen A, et al. Early Onset Hypertension Is Associated With Hypertensive End‑Organ Damage Already by MidLife. Hypertension. 2019 Aug;74(2):305-312.
13. Maillard P, Mitchell GF, Himali JJ, et al. Effects of Arterial Stiffness on Brain Integrity in Young Adults From the Framingham Heart Study. Stroke. 2016 Apr;47(4):1030-1036.
14. Shang X, Hill E, Zhu Z, et al. The Association of Age at Diagnosis of Hypertension With Brain Structure and Incident Dementia in the UK Biobank. Hypertension. 2021 Nov;78(5):1463-1474.
15. Lee CJ, Hwang J, Kang CY, et al. Protective effect of controlled blood pressure on risk of dementia in low‑risk, grade 1 hypertension. J Hypertens. 2021 Aug 1;39(8):1662-1669.
16. SPRINT MIND Investigators for the SPRINT Research Group. Association of Intensive vs Standard Blood Pressure Control With Cerebral White Matter Lesions. JAMA. 2019 Aug 13;322(6): 524-534.
17. Ungvari Z, Toth P, Tarantini S, et al. Hypertension‑induced cognitive impairment: from pathophysiology to public health. Nat Rev Nephrol. 2021 Oct;17(10):639-654.
18. Barthold D, Joyce G, Wharton W, et al. The association of multiple anti‑hypertensive medication classes with Alzheimer’s disease incidence across sex, race, and ethnicity. PLoS One. 2018 Nov 1; 13(11):e0206705.
19. Nedogoda SV, Ledyaeva AA, Chumachok EV, et al. Randomized trial of perindopril, enalapril, losartan and telmisartan in overweight or obese patients with hypertension. Clin Drug Investig. 2013 Aug;33(8):553-561.
20. Nedogoda SV, Ledyaeva AA, Chumachok EV, et al. Randomized trial of perindopril, enalapril, losartan and telmisartan in overweight or obese patients with hypertension. Clin Drug Investig. 2013 Aug;33(8):553-561.
21. van Vark LC, Bertrand M, Akkerhuis KM, et al. Angiotensin‑converting enzyme inhibitors reduce mortality in hypertension: a meta‑analysis of randomized clinical trials of renin‑angiotensin‑aldosterone system inhibitors involving 158,998 patients. Eur Heart J. 2012 Aug;33(16):2088-2097.
22. Lv J, Perkovic V, Foote CV, et al. Antihypertensive agents for preventing diabetic kidney disease. Cochrane Database Syst Rev. 2012 Dec 12;12:CD004136.
23. Baker WL, Coleman CI, Kluger J, et al. Systematic review: comparative effectiveness of angiotensin‑converting enzyme inhibitors or angiotensin II‑receptor blockers for ischemic heart disease. Ann Intern Med. 2009 Dec 15;151(12):861-871.
24. Lévy BI, Mourad JJ. Renin Angiotensin Blockers and Cardiac Protection: From Basis to Clinical Trials. Am J Hypertens. 2022 Apr 2;35(4):293-302.
25. Logunova N, Khomitskaya Y, Karpov Y, et al. Antihypertensive effectiveness and tolerability of perindopril/indapamide/amlodipine triple single-pill combination in the treatment of patients with arterial hypertension (TRICOLOR), J Hypertens. 2021;39:e373.
26. Cicero AFG, Fogacci F, Rizzoli E, et al. Long‑Term Impact of Different Triple Combination Antihypertensive Medications on Blood Pressure Control, Metabolic Pattern and Incident Events: Data from the Brisighella Heart Study. J Clin Med. 2021 Dec 17;10(24):5921.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2023 Issue 4
-
All articles in this issue
- Ultrazvuk ve vnitřním lékařství – zaostřeno na Point‑of‑Care ultrasonografii
- Point‑of‑Care Ultrasound in internal medicine
- Point‑of‑Care Ultrasound – accuracy, education
- How much POCUS for Czech internists?
- The current training for non‑echocardiographers in University Hospital Hradec Králové
- Implementation of Point‑of‑Care ultrasound examination in general practice
- Statement of the Expert Discussion Panel of the 1st Expert Conference on Point‑of‑Care ultrasound
- Deep vein thrombosis – the role of ultrasound in the diagnosis and follow-up of patients
- In the prevention of dementia, the focus should be on early and consistent treatment of hypertension
- Osteomalacia
- Dapagliflozin in the treatment of heart failure with preserved ejection fraction
- Initial use of subcutaneous plasma-derived C1 inhibitor in prophylaxis of acute attacks of hereditary angioedema in pregnant patients in Slovakia
- News in diabetology 2022
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Point‑of‑Care Ultrasound in internal medicine
- Osteomalacia
- Deep vein thrombosis – the role of ultrasound in the diagnosis and follow-up of patients
- Point‑of‑Care Ultrasound – accuracy, education
