Akutní poškození ledvin u pacientů s jaterní cirhózou - shrnutí pro praxi
Acute kidney injury in patients with cirrhosis – practical summary
Acute kidney injury (AKI) is a relatively common condition in patients with advanced liver disease and which is associated with increased mortality. It mainly affects patients with decompensated cirrhosis, particularly those with advanced portal hypertension and ascites. The dual organ involvement may have different forms. The contributing pathogenetic mechanisms are common and predict a dismal prognosis. Early diagnosis and interventions involving specialists (in particular, hepatologists and nephrologists) are essential to improve outcomes.
Keywords:
hepatorenal syndrome – liver cirrhosis – therapy – acute kidney injury
Authors:
Kateřina Množil Střídová 1; Soňa Fraňková 2; Jan Šperl 2
Authors‘ workplace:
Interní klinika FNKV a 3. LF UK, Praha
1; Klinika hepatogastroenterologie, Institut klinické a experimentální medicíny, Praha
2
Published in:
Vnitř Lék 2023; 69(5): 299-304
Category:
Main Topic
doi:
https://doi.org/10.36290/vnl.2023.059
Overview
Akutní poškození ledvin (AKI, acute kidney injury) je u pacientů s pokročilým jaterním onemocněním relativně častou komplikací, která významně ovlivňuje jejich mortalitu. Týká se především pacientů s dekompenzovanou jaterní cirhózou a současně se vyskytujícím ascitem. Toto duální orgánové postižení může mít různou podobu a podílejí se na něm společné patogenetické mechanismy, které vedou k významnému zhoršení celkové prognózy. Včasné odhalení příčiny a terapeutický zásah se zapojením specialistů (zejména hepatologů a nefrologů) zásadně ovlivňuje přežití těchto nemocných.
Klíčová slova:
léčba – hepatorenální syndrom – jaterní cirhóza – akutní poškození ledvin
Úvod
Kombinace pokročilého jaterního onemocnění a renální dysfunkce činí v klinické praxi velký problém, kterému je potřeba věnovat pozornost. Týká se to zejména akutního renálního poškození (AKI) u pacientů s dekompenzovanou jaterní cirhózou. Predominantně jde o funkční renální selhání, jehož nejtěžší formou je hepatorenální syndrom (HRS).
Hodnocení funkce ledvin u jaterní cirhózy
Tradičním ukazatelem renální funkce je glomerulární filtrace (GF – CKD-EPI, MDRD) endogenního kreatininu odhadnutá na základě měření sérové koncentrace kreatininu (s-Cr). U pacientů s dekompenzovanou jaterní cirhózou je však skutečný odhad GF značně limitován (1, 2). Čím závažnější je poškození jater, tím je stupeň nadhodnocení GF vyšší, a to především v důsledku snížené tvorby endogenního kreatininu z důvodu sarkopenie. Koncentrace kreatininu je také ovlivněna objemovou expanzí, redistribucí vlastních tělních tekutin, ale současně i množstvím tekutin podaných (včetně roztoků aminokyselin, krve, plazmy), nebo naopak tekutinovou restrikcí a užíváním diuretik. I přes výše uvedené limitace je zmíněný marker pro hodnocení renální funkce stále používán a pro odhalení AKI je kruciální sledování jeho trendu v čase (3).
Koncentrace cystatinu C v séru (neglykosylovaného, nízkomolekulárního proteinu z rodiny inhibitorů cysteinových proteáz, jež je filtrovaný glomeruly a plně reabsorbovaný tubuly ledvin) je dalším slibným markerem k odhadu GF, zejména při rychlých změnách GF, získané výsledky však nejsou zatím zcela jednoznačné a vyžadují obvykle srovnání více metod stanovení GF (1, 2). Další alternativu představuje výpočet frakční exkreci sodíku (FE Na) (4, 12).
Na výzkumné úrovni se zatím nacházejí močové biomarkery, které by mohly, v rámci diferenciální diagnostiky AKI u cirhózy, hrát významnou roli v rozlišení jednotlivých typů renálního postižení. Např. NGAL (Neutrophil Gelatinase – associated Lipocalin) se zdá být přínosným v diagnostice zejména ATN, u které byly zaznamenány výrazně zvýšené hodnoty. Mezi další biomarkery AKI patří IL-18 (interleukin 18), KIM-1 (Kidney Injury Molecule -1) a L-FABP (liver-type-fatty-acid binding protein) (4).
Renální poškození u jaterní cirhózy
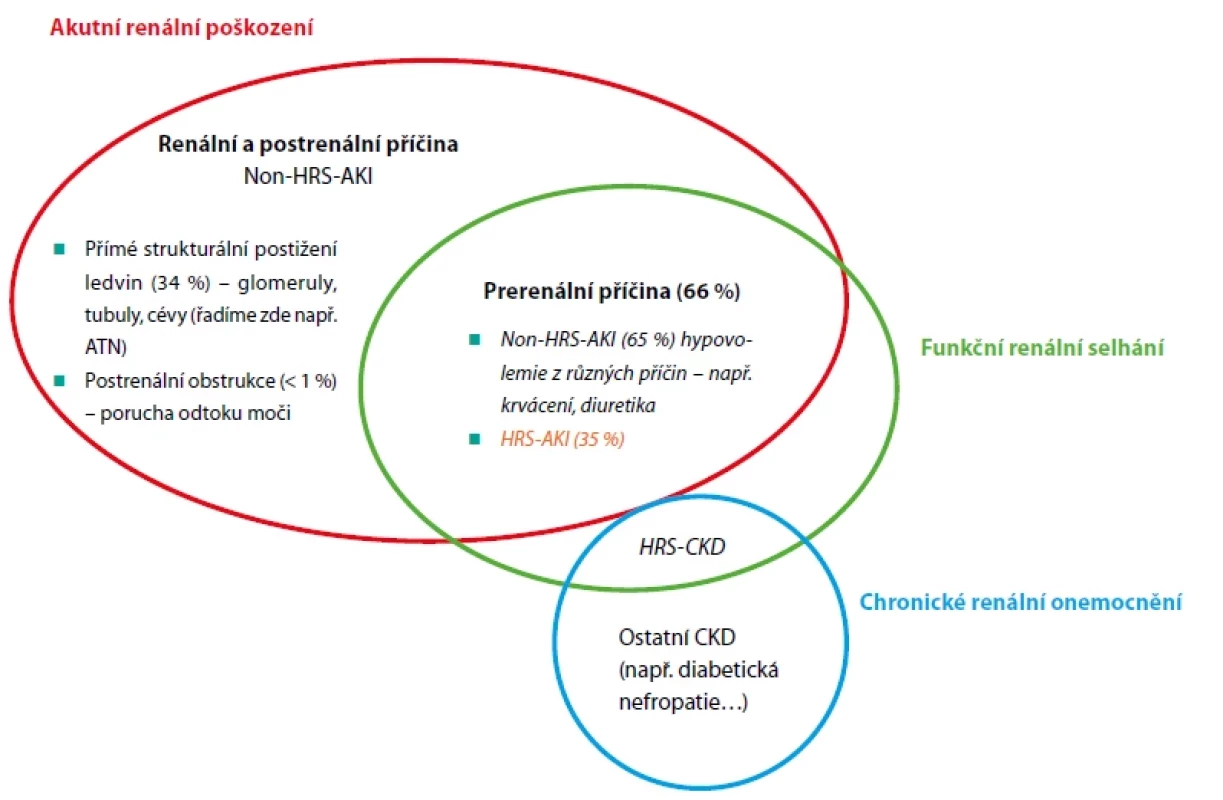
Snížená funkce a poškození ledvin u jaterní cirhózy představuje jednu z nejzávažnějších komplikací péče o pacienty s pokročilou jaterní cirhózou. Prognóza těchto pacientů bývá obvykle velmi závažná. Spektrum renálního postižení, které může vést až k renálnímu selhání, je rozmanité (Obr. 1). Příčinou akutního poškození ledvin může být přímé strukturální poškození ledvinného parenchymu a/nebo funkční selhání ledvin, vyplývající z hemodynamických změn provázejících jaterní cirhózu (5).
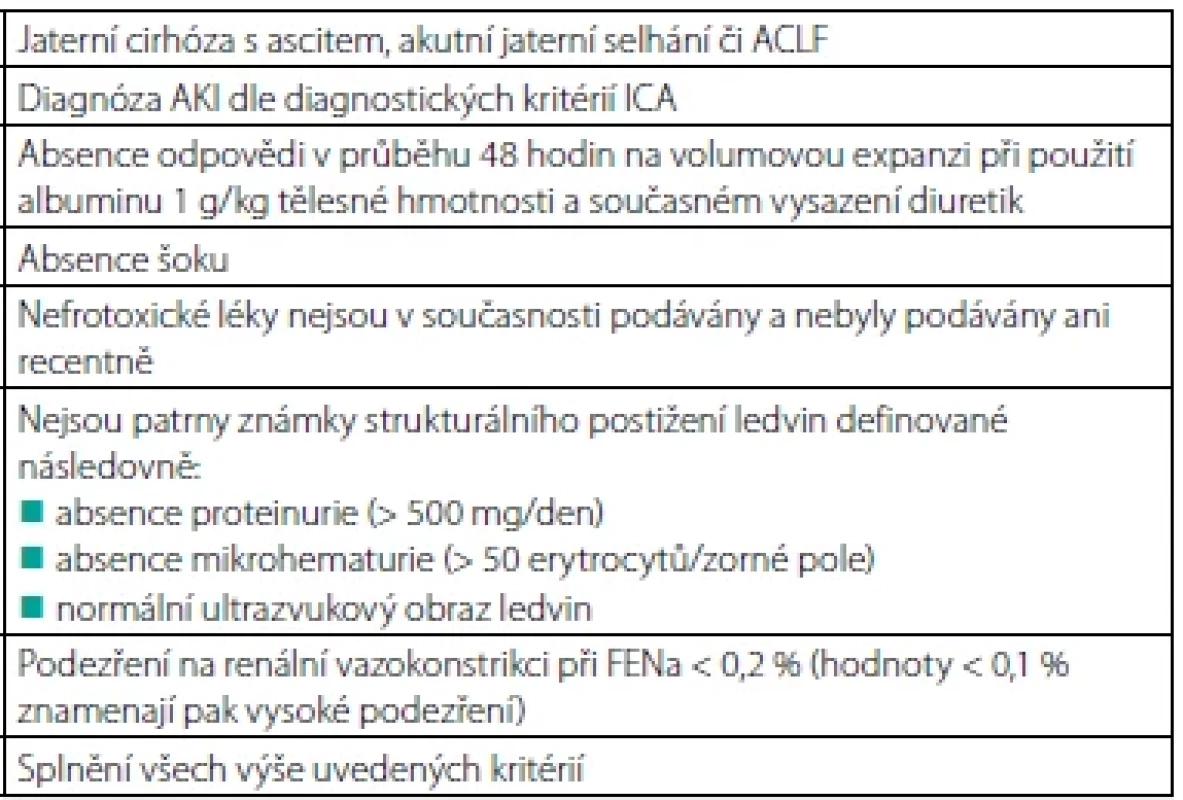
V roce 2015 byla odbornou společností International Club of Ascites (ICA) navržena nová klasifikace akutního renálního postižení v rámci jaterní cirhózy a nová definice HRS. Obě lépe odrážejí klinický scénář a jsou v souladu se současně uznávanou terminologií a klasifikací AKI. Definice a stadia tohoto typu postižení přehledně prezentuje tabulka 1, diagnostická kritéria HRS-AKI pak tabulka 2 (6, 7). Včasné odhalení příčiny a terapeutický zásah je zcela zásadní. Cílem je zabránit rozvoji ireverzibilního renálního selhání. Bohužel i při respektování těchto doporučení je příznivých výsledků při současných možnostech léčby dosaženo jen zřídka (8).
Jednoznačně nejčastější formou AKI u pacientů s jaterní cirhózou je AKI prerenální etiologie (66 %). Mezi nejčastější vyvolávající faktory patří např. excesivní diuretická terapie, velkoobjemová paracentéza bez následné aplikace albuminu, krvácení do gastrointestinálního traktu nebo bakteriální infekce (tzv. „volume-responsive“ 65 %). Naproti tomu absence odpovědi na objemovou expanzi definuje hepatorenální syndrom (HRS-AKI) (35 %) (9). Tato forma renálního postižení je spojena se sekundárně navozenou vazokonstrikcí v ledvinách, vznikající v důsledku komplexních cirkulačních změn spojených s portální hypertenzí.
Další formou akutního postižení je strukturální postižení ledvin ve formě ATN – akutní tubulární nekrózy (15–34 %) (9). Ta je nejčastěji způsobena ischemickým postižením tubulů následkem hypotenze (po krvácení z jícnových varixů, při sepsi apod.). Diagnostika ATN představuje skutečnou klinickou výzvu, běžnými rutinními vyšetřeními je prakticky nerozlišitelná od HRS-AKI. Hlavní problém spočívá ve skutečnosti, že hepatorenální syndrom můžeme teoreticky zvrátit specifickou léčbou, zatímco u ATN tato léčba neexistuje.
Klinická jednotka akutní selhání jater nasedající na chronické (acute on chronic liver failure, ACLF), v dnešní době často zmiňovaná, úzce souvisí s AKI a je spojena s významně vyšší mortalitou. Přítomnost renální dysfunkce je nejčastějším samotným orgánovým postižením a hlavní komponentou v hodnocení závažnosti akutního jaterního selhání (10).

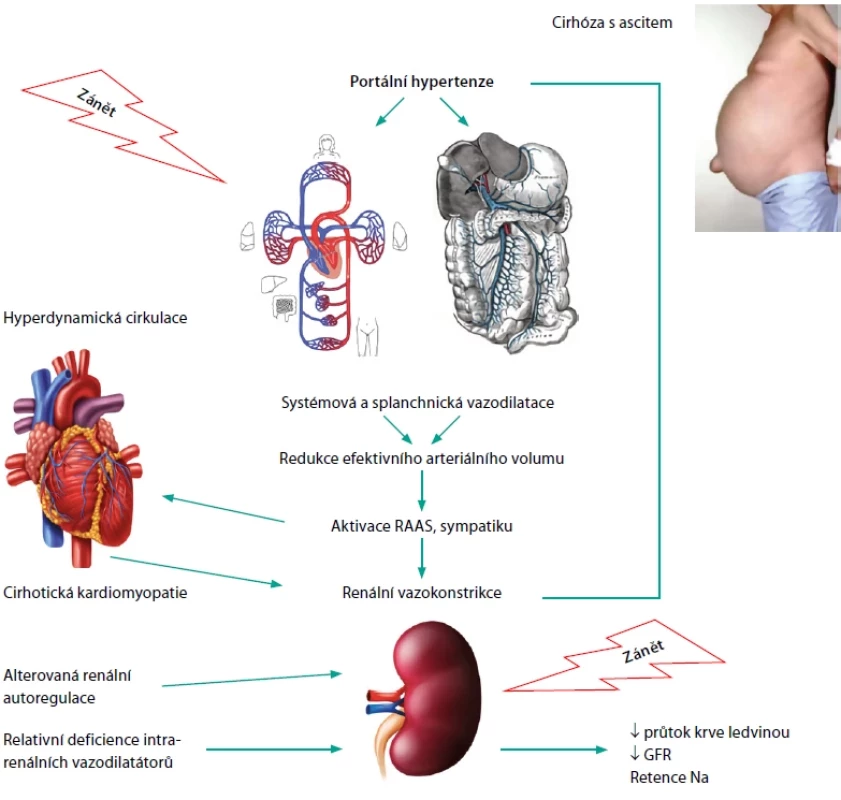
Patogeneze hepatorenálního syndromu
HRS-AKI se vyskytuje u pokročilé jaterní cirhózy jakékoliv etiologie. Tradiční a zjednodušené vysvětlení popisuje zásadní úlohu portální hypertenze, která je příčinou zpomaleného průtoku krve a sníženého prokrvení portálního řečiště. To vede k uvolnění vazodilatátorů (predominantně oxidu dusnatého, NO) a hromadění krve ve splanchniku. Systémové řečiště je naopak nedostatečně naplněné a cirkulace hyperdynamická, což způsobí aktivaci jak renin-angiotenzin-aldosteronového systému, tak sympatického nervového systému. Reakcí na periferní arteriální vazodilataci je intenzivní renální vazokonstrikce. Postižení ledvin, ke kterému dochází v rámci HRS-AKI, je zprvu reverzibilní, ve svém dalším trvání ovšem vede k nezvratnému selhání ledvin (Obr. 2) (5).
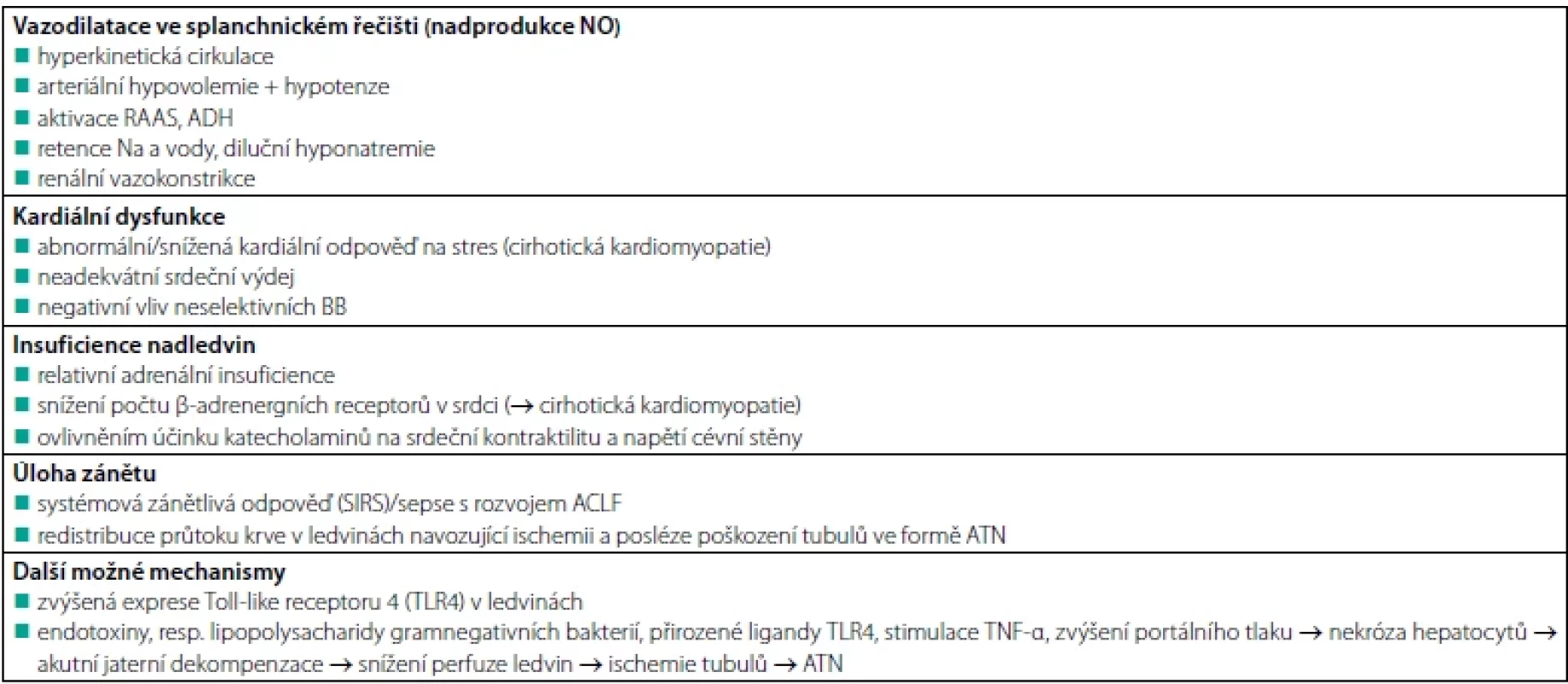
Během uplynulých let však došlo k výraznému posunu v pohledu na patofyziologii tohoto onemocnění, což přehledně dokládá tabulka 3. Kromě cirkulačních změn je nyní velká úloha přisuzována vlivu zánětlivých změn, které významně ovlivňují terapeutické výsledky s běžně používanými vazokonstriktory ve splanchnickém řečišti (11).
Vedení farmakoterapie
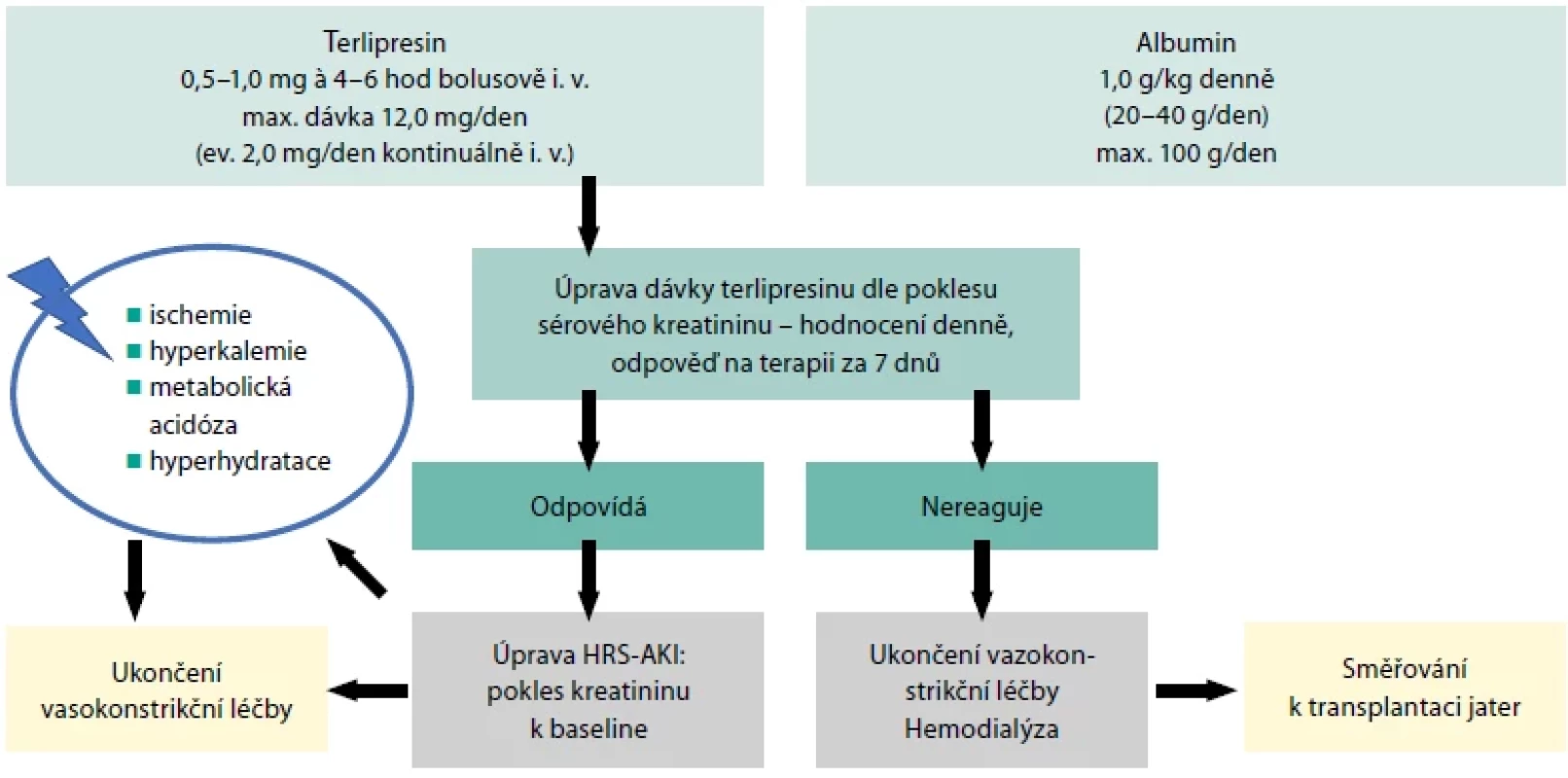
Základem léčby je včasná identifikace a eliminace spouštěcího faktoru. V klinické praxi by měl být dodržen následující postup (Tab. 4) (3). Od stadia AKI 1 B, při současně splněných kritériích HRS-AKI, se k dosažení zvýšení efektivního cirkulujícího objemu přidává do kombinace s albuminem systémový vazokonstriktor. Pacient by měl být (ideálně) umístěn na monitorované lůžko. Vedení léčby HRS-AKI shrnuje Obr. 3 (3). Obzvlášť je kladen důraz na monitoraci výskytu komplikací při terapii vazokonstriktorem (ischemické komplikace), sledování odpovědi na léčbu, její zhodnocení během 7denního podávání, s celkovým podáváním vazokonstriktoru maximálně 14 dní a ukončení jeho podávání při neefektu a směřování k transplantaci jater (ev. i ledviny).
Albumin je považován za přirozený plazmaexpandér, který udržuje efektivní cirkulující objem, a tím zvyšuje srdeční výdej i v nejpokročilejších fázích jaterního onemocnění. Parenterálně podávaný 20% lidský albumin má v kombinaci s vazokonstriktorem doporučené dávkování 1 g/kg/den (maximálně však 100 g/den) první dva dny, poté s redukcí na 20–40 g/den.
Vazokonstrikční složka léčby může probíhat několika mechanismy, přes agonisty alfa-adrenergních receptorů (norepinefrin seu noradrenalin, midodrin), dále pomocí somatostatinového analoga oktreotidu, vazopresinu či analog vazopresinu (terlipresin, ornipresin). Použití midodrinu a oktreotidu, stejně jako norepinefrinu, je v dnešní době považováno za off-label léčbu. V léčbě HRS-AKI mají však tyto léky stále svoje místo, a to především v případě nedostupnosti ev. kontraindikaci terlipresinu (8). V Evropě schválený a používaný terlipresin je lékem první volby.
Terlipresin vazbou na V1 receptory buněk hladkého svalstva způsobuje splanchnickou a systémovou extrarenální vazokonstrikci, zrychluje splanchnický průtok krve a snižuje portální tlak, zlepšuje hyperdynamickou cirkulaci a zlepšuje efektivní cirkulující objem a renální perfuzní tlak. Stimulace receptorů V2 ve stěně sběrných kanálků ledvin zvyšuje reabsorpci vody, což může vést k hyponatremii. Biologický poločas terlipresinu je 3,5 hodiny, podává se bolusově v dávce 0,5–1 mg intravenózně po 4–6 hodinách s možností postupného navyšování dle klinické odpovědi až na 2 mg/dávku do celkové dávky 12 mg/den. Nutné je sledovat možné nežádoucí účinky. Možné je i podání kontinuální infuzí (2 mg terlipresinu ředěného ve 250 ml roztoku 5% glukózy/24 hodin), kdy je kumulativní denní dávka a výskyt nežádoucích účinků nižší. Alternativu v léčbě představuje noradrenalin.
Mezi nežádoucí účinky léčby patří u albuminu hlavně objemové přetížení, u terlipresinu ischemické komplikace (ischemické srdeční příhody, střevní ischemie, ischemie akrálních částí těla, cévní mozkové příhody), závažné arytmie, minerálový rozvrat ve formě těžké hyponatremie a plicní edém (12).
Prevence AKI – obecná doporučení
Na možnost vzniku HRS-AKI bychom měli myslet především u pacientů s ascitem a spontánní bakteriální peritonitidou (SBP). Prevence HRS-AKI je u těchto pacientů založena na intravenózním podávání albuminu (1–1,5 g/kg/den) a antibiotik (cefalosporiny 3. generace) v akutní fázi, dále na dlouhodobém podávání norfloxacinu (400 mg/den) v rámci prevence SBP. Důraz je kladen také na pečlivou monitoraci pacientů na diuretické léčbě (včetně podávání laktulózy) a na prevenci variceálního krvácení s cílem předcházet objemové depleci. Během užívání potenciálně nefrotoxických léků (nesteroidní antirevmatika, blokátory renin-angiotenzin-aldosteronového systému) by měla být u pacientů s cirhózou pečlivě sledována funkce ledvin.

Závěr
Pacienti s pokročilým jaterním onemocněním se současně přítomnou renální dysfunkcí mají velmi závažnou prognózu. Včasná diagnostika, klasifikace poruchy funkce ledvin a intervence se zapojením specialistů (hepatologů, nefrologů) je zcela zásadní v léčbě takových pacientů. Transplantace jater představuje jedinou léčebnou modalitu, která dokáže zlepšit nepříznivou prognózu pacientů s pokročilou cirhózou jater. HRS-AKI negativně ovlivňuje i krátkodobou mortalitu, a tím i přístup pacientů s HRS-AKI k transplantační léčbě. Hemodialýza (RRT, renal replacement therapy) je dočasná a život zachraňující metoda, která má být zvažována pouze jako přemosťující léčba k transplantaci jater. Z hlediska farmakologické terapie je u HRS-AKI nezbytné uvážlivé použití albuminu v kombinaci s vazokonstriktorem s cílem zvýšení efektivního cirkulujícího objemu.
Problematikou akutního poškození ledvin u jaterní cirhózy se zabývá Evropská asociace pro studium jater (EASL) ve svých praktických doporučeních z r. 2018 (7). V české verzi jsou tato doporučení k dispozici od r. 2020 na stránkách České hepatologické společnosti (3).
MUDr. Kateřina Množil Střídová
Interní klinika FNKV a 3. LF UK, Praha
katerina.stridova@fnkv.cz
Sources
- Teplan V. Posuzování funkce ledvin u pacientů s jaterním onemocněním. Gastroent Hepatol. 2021; 75(2):138-142.
- Merta M. Renální komplikace akutních a chronických onemocnění jater. Gastroent Hepatol. 2019;73(3):250-256.
- Krátká K, Libicherová P, Tesař V, et al. Doporučené postupy ČNS a ČHS JEP pro diagnostiku a léčbu akutního poškození ledvin u jaterní cirhozy. Aktuality v nefrologii. 2021;27(1):7-14.
- Gupta K, Bhurwal A, Law C, et al. Acute kidney injury and hepatorenal syndrome in cirrhosis. World J Gastroenterol. 2021 July 14;27(26):3984-4003.
- Sanyal AJ, Boyer TD, Terrault NA, et al. Zakim and Boyer's hepatology. 7th ed. Elsevier - Health Sciences Division: 2016 : 262-280. ISBN 9780323375917
- Bera C, Wong F. Management of hepatorenal syndrome in liver cirrhosis: a recent update. Therap Adv Gastroenterol. 2022;15 : 17562848221102679.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. Journal of Hepatology. 2018;69 : 406-460.
- Flamm SL, Brown K, Wadei HM, et al. The Current Management of Hepatorenal Syndrome - Acute Kidney Injury in the United States and the Potential of Terlipressin. Liver Transpl. 2021 Aug;27(8):1191-1202.
- Sanchez LO, Francoz C. Global strategy for the diagnosis and management of acute kidney injury in patients with liver cirrhosis. United European Gastroenterol J. 2021 Mar; 9(2):220-228
- Chancharoenthana W, Leelahavanichkul A. Acute kidney injury spectrum in patients with chronic liver disease: Where do we stand? World J Gastroenterol. 2019 July 28; 25(28):3684-3703.
- Møller S, Bendtsen F. The pathophysiology of arterial vasodilatation and hyperdynamic circulation in cirrhosis. Liver International. 2018;38 : 570-580.
- Nadim MK, Garcia‑Tsao G. Acute Kidney Injury in Patients with Cirrhosis. N Engl J Med. 2023;388 : 733-45.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2023 Issue 5
-
All articles in this issue
- Acute kidney injury in patients with cirrhosis – practical summary
- Cardiovascular disease and kidney transplantation
- Implications of highly suppressive treatment HIV infection
- Internal comorbidities and complications of multiple sclerosis therapy – don’t be caught off guard!
- Dyslipidemia – the known unknown
- Differentiated thyroid cancer – possible risks of treatment, suppressive therapy and adherence to current recommendations
- Atypical form of Goodpasture’s disease
- Pharmacological profile of mepolizumab
- News in respiratory medicine
- Finerenon: další možnost léčby u pacientů s chronickým onemocněním ledvin a diabetem 2. typu
- Zemřela prof. MUDr. Marie Brodanová, DrSc.
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Acute kidney injury in patients with cirrhosis – practical summary
- Dyslipidemia – the known unknown
- News in respiratory medicine
- Cardiovascular disease and kidney transplantation
