Úspěšná léčba SAPHO syndromu (nebakteriální osteomyelitidy a akné) anakinrou a denosumabem. Popis případu a přehled léčebných možností
Successful treatment of SAPHO syndrome (chronic nonbacterial osteomyelitis and acne) with anakinra and denosumab. Case report and review of therapy
SAPHO is an acronym derived from capital letters of Synovitis, Acne, Pustulosis, Hyperostosis, and Osteitis (SAPHO). SAPHO syndrome is an umbrella term covering a constellation of bone lesions and skin manifestations.
A 40-year-old male complained about his jaw and back pain, swelling of multiple joints and weight loss accompanied by physical deterioration and acne type skin lesions. Laboratory tests revealed abnormal elevation of inflammatory markers. Imaging studies illustrated multiple osteolytic bone lesions and paraosseal infiltrates. According to the set of criteria diagnosis of SAPHO syndrome was stated. The patient was treated with glucocorticoids and non-steroidal anti-inflammatory drugs (NSAIDs), but only high dose dexamethasone and prednisone were effective. Daily subcutaneous administration of anakinra at the dose of 100 mg was initiated due to limited response to more classical therapies. Because of planned mandibular osteosynthesis initiation of denosumab was preferred before bisphosphonates. Therapeutic response was confirmed by FDG-PET/MR after 5 months of anakinra and denosumab therapy, showing decreased accumulation of FDG in periosteal and paraosseal infiltrates. Inflammatory markers significantly decreased, bone pain deferred but skin manifestation receded only partially. Therefore the response was evaluated as partial remission.
Keywords:
Osteomyelitis – anakinra – denosumab – osteitis – SAPHO syndrome – multiple bone osteolysis
Authors:
Zdeněk Adam 1; Anna Šedivá 2; David Zeman 3; Zdeněk Fojtík 1; Hana Petrášová 4; Jana Diatková 1; Miroslav Tomíška 1; Zdeněk Král 1; Jana Treglerová 5; Vojtěch Peřina 5; Kateřina Kamaradová 6; Zdenka Adamová 7; Luděk Pour 1
Authors‘ workplace:
Interní hematologická a onkologická klinika LF MU a FN Brno
1; Oddělení imunologie FN Motol a 2. LF UK, Praha
2; Ústav laboratorní medicíny – Oddělení klinické biochemie, LF MU a FN Brno
3; Klinika radiologie a nukleární medicíny LF MU a FN Brno
4; Klinika ústní, čelistní a obličejové chirurgie LF MU a FN Brno
5; Fingerlandův ústav patologie, Fakultní nemocnice Hradec Králové
6; Ordinace praktického lékaře pro děti a dorost, Obilní trh, Brno
7
Published in:
Vnitř Lék 2023; 69(E-5): 4-14
Category:
doi:
https://doi.org/10.36290/vnl.2023.065
Overview
SAPHO syndrom představuje zastřešující termín pro autoinflamatorní kostní zánětlivé procesy spojené s osteolýzou a pro současně se vyskytující patologické morfy na kůži. SAPHO syndrom je akronym pro synovitis, akné, pustulózu, hyperostózu a osteitidu. Popisujeme 40letého muže, který si stěžoval na bolesti čelisti a v zádech vedoucí k výraznému snížení fyzické zdatnosti, úbytku hmotnosti a synovitidu četných kloubů, u něhož se objevily kožní změny typu akné. Laboratorní vyšetření odhalilo abnormálně zvýšené známky zánětu. Předchozí četná zobrazovací vyšetření odpovídala obrazu multifokální nebakteriální osteomyelitidy s osteolytickými změnami a periostálními infiltráty a synovitidy velkých kloubů. Pacient splňoval kritéria SAPHO syndromu, jiné příčiny těchto změn nebyly potvrzeny. Zpočátku byl léčen glukokortikoidy a nesteroidními antiflogistiky (NSAIDs). Účinné byly pouze vysoké dávky dexametazonu nebo prednisonu, což vedlo ke změně léčebné strategie a zahájení léčby anakinrou. Pro inhibici zvýšené aktivity osteoklastů, odbourávajících kostní tkáň, jsme upřednostnili denosumab před bisfosfonáty, protože je plánována osteosyntéza patologické fraktury mandibuly. Laboratorní zánětlivé markery se snížily, kostní bolesti ustoupily, ale kožní projevy ve formě akné vykázaly pouze částečný ústup. Kontrolní PET/MR vyšetření po pěti měsících léčby anakinrou a denosumabem prokázalo výraznou regresi metabolické aktivity a signifikantní zmenšení patologických perioseálních infiltrátů. Léčebnou odpověď na anakinru hodnotíme tedy jako parciální remisi. Text přináší přehled možností biologické terapie.
Klíčová slova:
Osteomyelitis – anakinra – denosumab – osteitis – SAPHO syndrom – mnohočetná kostní ložiska
Úvod a charakteristika SAPHO syndromu
SAPHO syndrom je akronym vytvořený z názvů typických příznaků této nemoci: Synovitis, Akné, Pustulosis, Hyperostosis, Osteitis. První popis SAPHO syndromu je z roku 1988 (1). Etiopatogeneze tohoto syndromu nebyla v době prvního popisu jasná, a tak ani nebylo jasné, do které kategorie tento syndrom zařadit. Až poté, co byla po roce 2000 definována skupina autoinflamatorních chorob, byl SAPHO syndrom přiřazen do této skupiny.
Autoinflamatorní onemocnění jsou charakterizována výraznými známkami zánětu na podkladě poruchy regulačních mechanismů zánětu na úrovni vrozené imunity. Tvoří vzácnou a relativně recentně popsanou kategorii poruch imunity s postupně narůstajícím počtem definovaných klinických jednotek. Skupina autoinflamatorních chorob čítá dle zprávy International Union of Immunological Societies celkem 37 monogenních autoinflamatorních chorob. Dále obsahuje četné autoinflamatorní choroby, u kterých zatím nebyla odhalena genetická podstata (2). K těm geneticky nedefinovaným patří syndrom Schnitzlerové a Stillova choroba vznikající v dospělosti, s nimiž jsme se u našich pacientů již setkali, a také SAPHO syndrom.
V roce 2013, tedy před 10 lety, byla definována skupina autoinflamatorních chorob, které postihují kosti. Některé choroby z této skupiny jsou již geneticky definované (monogenní), ale vedle nich existuje skupina geneticky nedefinovaných autoinflamatorních kostních chorob, k nimž patří SAPHO syndrom, kterému věnujeme tento text (1).
Na možnost SAPHO syndromu je vhodné pomyslet u pacientů, jejichž subjektivní potíže a klinické nálezy odpovídají osteitidě, hyperostóze, synovitidě, artropatii a entenzopatii provázené otokem postižených oblastí. Při uvedených lokalizovaných zánětlivých procesech může být přítomna horečka jako odraz systémové zánětlivé reakce. Zánětlivé změny při SAPHO syndromu postihují nejčastěji sternokostální a sternoklavikulární klouby, případně sakroiliakální, kyčelní či kolenní klouby.
Uvedené kostní a kloubní zánětlivé postižení může být provázeno kožními projevy typu akné, ale může probíhat i bez kožních projevů.
Na naše pracoviště přivedla pacienta osteolýza provázená zánětlivými projevy s podezřením na maligní krevní onemocnění typu mnohočetného myelomu, lymfomu nebo Castlemanovy choroby. Vzhledem k vzácnosti této klinické jednotky uvádíme popis případu a přehled současných léčebných možností. Biologická léčba velmi výrazně zlepšila prognózu nemocných.
Popis případu
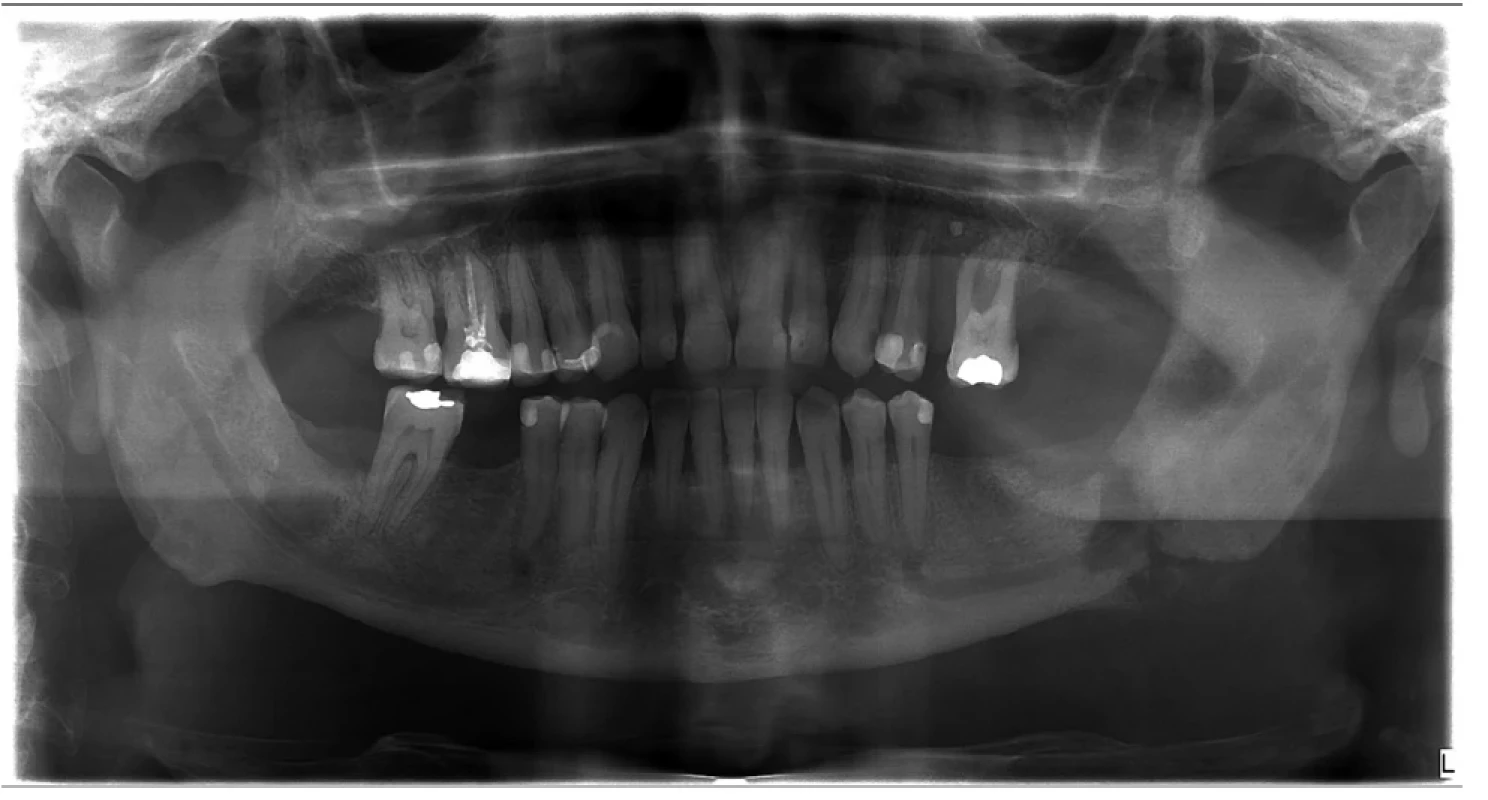
Diagnózu SAPHO syndromu jsme stanovili v roce 2022 u muže ve věku 42 let. První problémy začal pociťovat v únoru 2021, po extrakci třetího moláru z mandibuly vlevo. Při tomto výkonu byla odebrána granulační tkáň ze zubního lůžka k histologickému vyšetření. Hodnotící patolog popsal nespecifické zánětlivé změny kosti. Následně v březnu roku 2021 začaly bolesti v zádech, v oblasti hrudní a bederní páteře a sakroiliakálního skloubení a postupně se obnovily bolesti v dolní čelisti v místech extrahovaného moláru. Změny v čelisti ilustruje obrázek 1.
Pro bolesti způsobené patologickou frakturou mandibuly v oblasti levého čelistního úhlu byla provedena revize fraktury a resekce postižené kosti. Při dalším vyšetření byla sonograficky detekována mírně zvětšená krční uzlina, která byla vyjmuta pro histologické vyšetření. Morfologicky byl v uzlině popsán obraz, který by mohl odpovídat Castlemanově nemoci. V té době udával úbytek hmotnosti z 96 kg na 56 kg, na čemž se jistě také v poslední době podílely problémy s příjmem potravy po operaci dolní čelisti.
Při přeložení na naše pracoviště v červenci 2022 byl pacient značně kachektický, upoután na lůžko s končetinami ve flekční poloze, pohyb v končetinách byl limitován výraznou synovitidou nosných kloubů dolních končetin, ale postižené byly i klouby horních končetin. Dominovaly velmi silné bolesti kloubů, svalů, celého těla. Analgetická léčba, včetně silných opioidů, tyto bolesti zmírnila pouze částečně.
Vstupní laboratorní parametry odpovídaly nebakteriálnímu zánětlivému procesu s hodně vysokou hodnotou CRP a normální hodnotou prokalcitoninu.
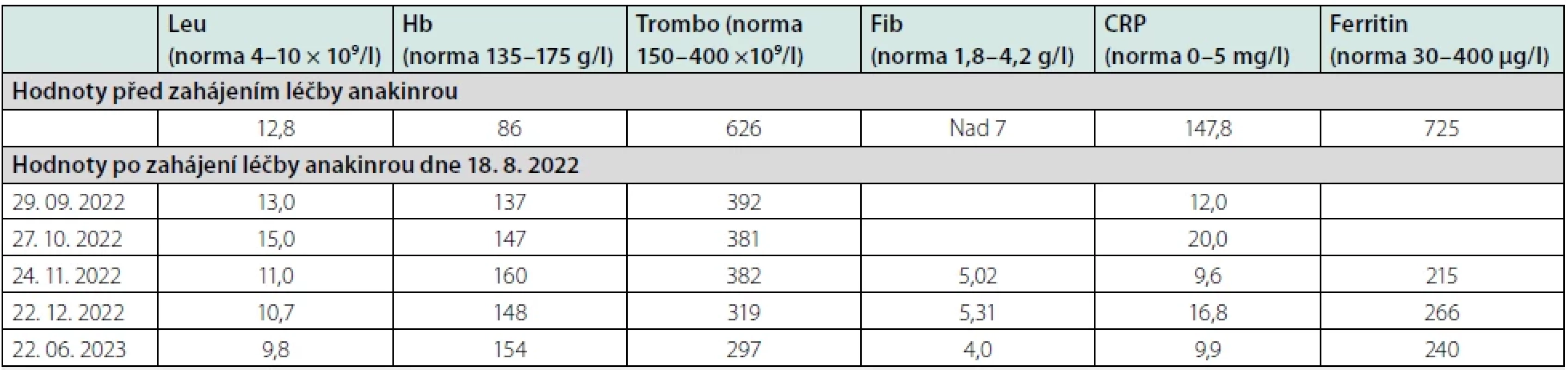
Hematologické vyšetření krve prokázalo změny odpovídající anémii chronických chorob, v tomto případě anémii spojenou s chronickým zánětem: leukocyty 12,8 × 109/l (norma 4–10 × 109/l), hemoglobin 86 g/l (norma 135–175 g/l), trombocyty 626 × 109/l, (norma 150–400 × 109/l). Koagulační vyšetření prokázalo zvýšený fibrinogen, který byl vyšší než 7 g/l (norma 1,8–4,2 g/l). Biochemické vyšetření prokázalo zvýšené CRP 136 mg/l (norma 0–5 mg/l), prokalcitonin byl 0,22 µg/l (norma 0,00–0,50 µg/l, kreatinin 37 µmol/l (norma 59–104 µmol) vyšší byly hodnoty GGT 2,10 µkat/l (norma 0,17–1,19 µkat/l) a ALP 4,67 µkat/l (norma 0,67–2,15 µkat/l), Ferritin 588 µg/l (norma 30–400 µg/l), Fe 2,7 µmol/l (norma 5,8–34,5 µmol/l).
V séru byla zvýšená koncentrace IgG (31,7 g/l) a volných lehkých řetězců obou typů (free kappa 104 mg/l, free lambda 57,4 mg/l) s hraničním poměrem free kappa/free lambda (1,81; referenční meze dle výrobce diagnostické soupravy 0,26–1,65), zatímco koncentrace IgA byla normální (1,37 g/l) a koncentrace IgM mírně snížená (0,37 g/l). Po proběhlé léčbě došlo k normalizaci koncentrací IgG i volných lehkých řetězců. Koncentrace IgA a IgM se při kortikoterapii rovněž snížily (IgA 0,64 g/l, IgM 0,17 g/l) a dále klesaly po zahájení léčby anakinrou pod dolní hranici referenčního rozmezí ve všech třídách (IgG 5,03 g/l, IgA 0,49 g/l, IgA 0,08 g/l). Monoklonální komponenta nebyla při kontrolní imunofixaci v séru ani v moči prokázána, další imunofixace o měsíc později vykázala opět negativní výsledek.
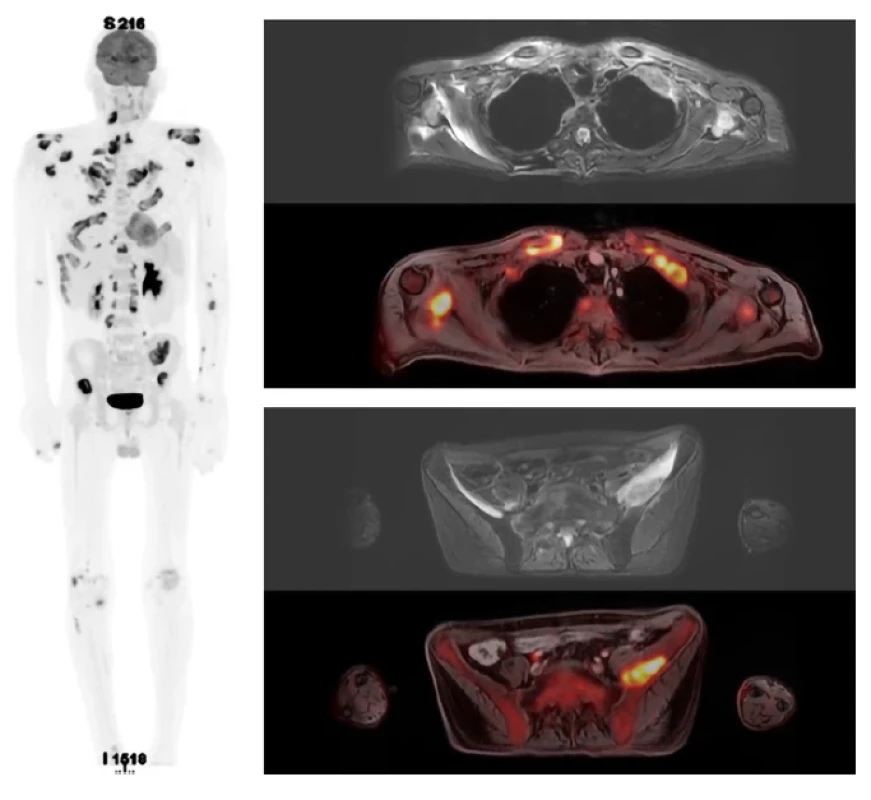
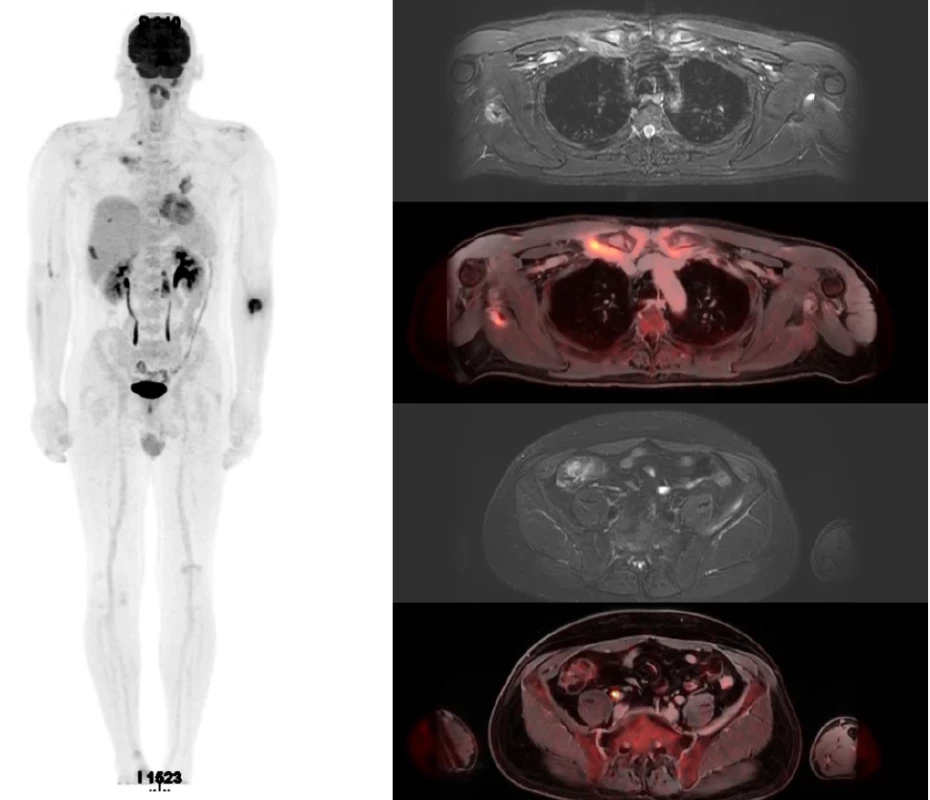
Jako první celotělové vyšetření v naší nemocnici bylo provedené zobrazení FDG-PET/MR dne 30. 5. 2022, viz obrázek 2, které popsalo vícečetné extraoseální měkkotkáňové infiltráty se známkami zvýšené akumulace FDG aktivity v oblasti mandibuly, páteře, žeber oboustranně, lopatek, podél ramenních a sterno-klavikulárních kloubů, podél žeber a pánve, i podél kloubů horních a dolních končetin. Obraz nebyl typický pro metastatický rozsev, parenchymatózní orgány byly bez ložisek. Na PET/MR zobrazení nebyly nalezeny metabolicky aktivní zvětšené uzliny, jejichž přítomnost je podmínkou multicentrické formy Castlemanovy nemoci.
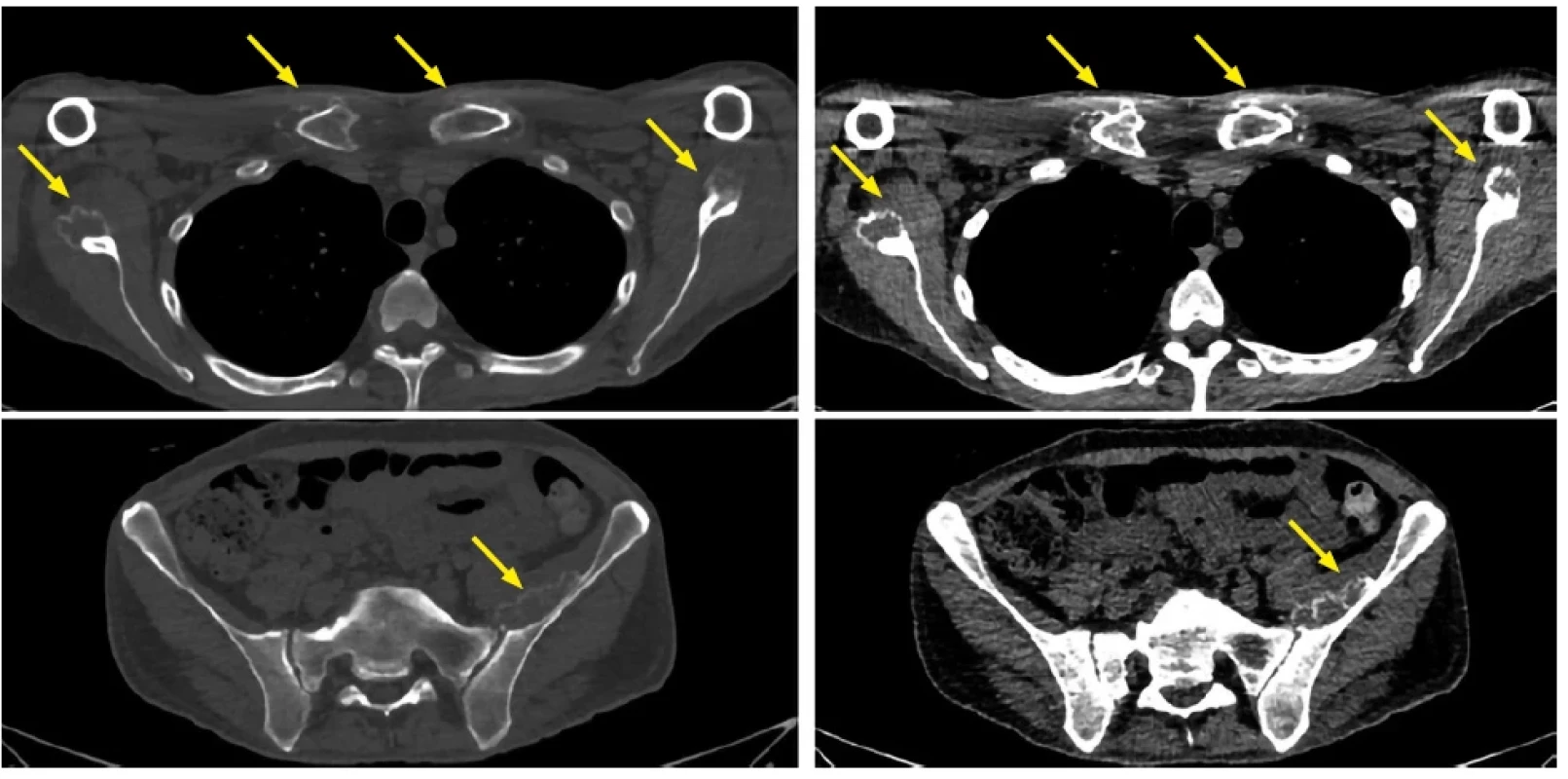
V nevelkém časovém odstupu, 10. 6. 2022, bylo též provedeno zobrazení skeletu pomocí celotělového low dose CT, které ukázalo mnohočetné extraoseální, paraskeletální infiltráty navazující přímo na kosti s periferním kalcifikovaným lemem, viz obrázek 3.
Paravertebrálně byly popsány vícečetné drobné infiltráty v oblasti krční, hrudní a bederní páteře. Další objemné infiltráty průměru až 5 cm navazovaly ventrálně na lopatu kosti kyčelní vlevo, menší pak byly v pánvi bilaterálně. Četné infiltráty obklopovaly i akromio-klavikulární skloubení a sternoklavikulární skloubení bilaterálně, neostrá byla kontura manubria sterni. Vícečetné okrouhlé infiltráty byly též zřetelné paraskapulárně oboustranně, v oblasti oblouků žeber oboustranně, v oblasti předloktí vlevo a v oblasti drobných kloubů ruky.
Takový obraz byl hodnocen jako netypický pro mnohočetný myelom, v diferenciální diagnostice bylo uvažováno spíše o rozsáhlém inflamatorním procesu, případně o maligním procesu s propagací hmot tumoru z kostní dřeně extraoseálně.
Na podkladě uvedených zobrazovacích vyšetření byly provedeny další biopsie. Nejprve pod CT kontrolou biopsie ložiska lopaty kosti kyčelní. Materiál z tohoto ložiska byl hodnocen jako „nespecifické zánětlivé změny“.
Pro stanovení diagnózy SAPHO syndromu bylo třeba sloučit závěry zobrazovacích, morfologických, laboratorních a klinických vyšetření. Morfologicky byl prokázán chronický sklerotizující a fibrózní zánět kosti s přestavbou spadající do obrazu chronické osteitidy, osteomyelitidy, s postižením přilehlých měkkých tkání s osifikací. Bakteriální etiologie zánětlivých změn nebyla prokázána. Celotělové zobrazovací metody prokázaly masivní zánětlivý proces kostí s přesahem do okolí. Proto bylo pojato podezření na autoinflamatorní kostní onemocnění typu rekurentní nebakteriální chronické osteomyelitidy anebo SAPHO syndromu.
Léčba za hospitalizace, kdy ještě nebyla známá definitivní diagnóza SAPHO syndromu, byla zahájena klasickými antiflogistiky a vysokými dávkami glukokortikoidů. Zpočátku nitrožilní aplikace metylprednisolonu (Solumedrol) 1 mg/kg přivodila s okamžitým efektem ústup bolestí, zlepšení hybnosti i celkového stavu. Pacient v průběhu několika dní začal chodit, byl téměř bez bolestí, bez nutnosti užívat analgetika. Celkové zlepšení bylo provázeno poklesem CRP do normy. Kortikoterapie dále pokračovala ambulantně po propuštění. Na ambulanci zpočátku začal dostávat dexametazon v dávce 20 mg na 6 dní, a pak přešel na prednison v dávce 60 mg denně. Jakmile se ale dávka prednisonu začala snižovat na 40 a posléze na 30 mg denně, příznaky nemoci se vracely.
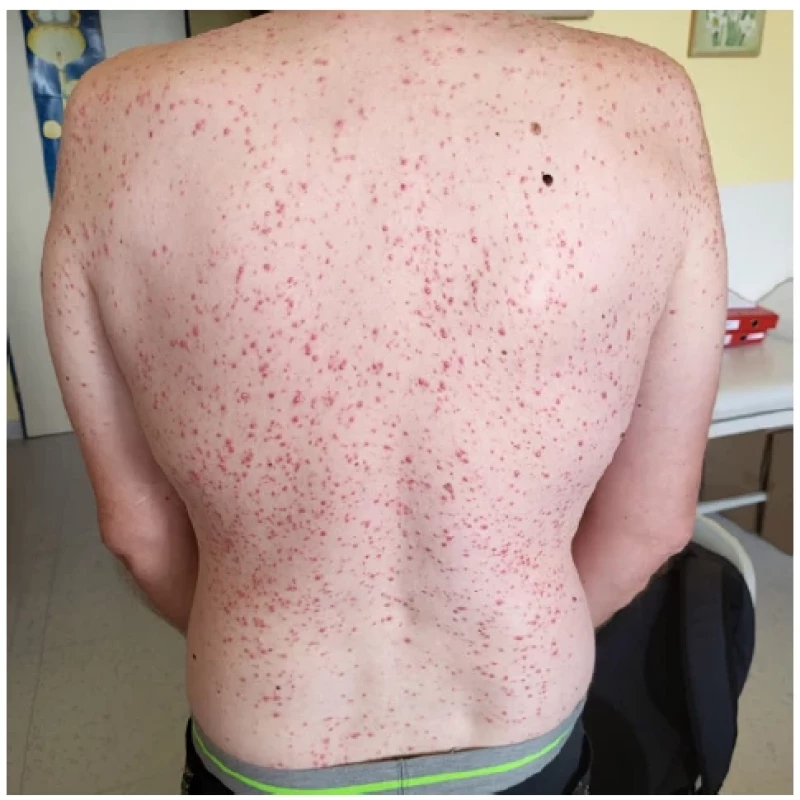
Kožní morfy na těle se objevily později. Exantém byl hodnocen jako možné steroidní akné. Po snížení dávky kortikoidů akné ustoupilo. V dalším průběhu při ambulantních kontrolách se opět akné objevilo v mnohem výraznější podobě a postihovalo celý trup. Kožní projevy v době maximální intenzity ilustruje obrázek 4. Akné se tedy objevilo s určitým zpožděním.
Protože k potlačení nemoci byly stále nutné vysoké dávky glukokortikoidů (více než 40 mg prednisonu denně), a ty při dlouhodobém podávání mohou způsobit četné nežádoucí účinky, bylo nutné přejít urychleně na jiný způsob léčby. Vzhledem k předpokládané zásadní roli interleukinu-1 (Il-1) v patofyziologii tohoto syndromu bylo zvoleno podání antagonisty receptoru pro Il-1, anakinry. Od 18. 8. 2022 byla po schválení revizním lékařem zahájena léčba SAPHO syndromu anakinrou v dávce 100 mg, podávané denně jako subkutánní injekce, na které je pacient doposud (červenec 2023). Pacient měl zpočátku lokalizované zarudnutí v místě aplikace anakinry, které ale po měsíci podávání postupně vymizelo. Zavedení anakinry do léčby umožnilo výrazné snížení dávky prednisonu na 10 mg denně a tuto dávku jsme postupně snižovali do vysazení. V současnosti si pacient bere prednison nárazově pouze v době akutní exacerbace potíží.
Výsledný efekt hodnotíme zatím jako parciální remisi, poněvadž kožní změny neustoupily, ale jen se zmírnily. Akné, které zpočátku postihovalo celý trup, je nyní přítomné jenom na zádech a v méně výrazné formě. Teploty a bolesti kostí při léčbě anakinrou téměř ustaly, ale nevymizely zcela. Pacient si po 12 měsících léčby stále stěžuje na občasné bolesti tu v horní končetině, tu v dolní končetině, tedy na stěhovavé bolesti. Markery zánětu v průběhu léčby anakinrou postupně klesají, viz tabulka 1. Léčba anakinrou je tedy účinná, ale i při této léčbě vznikají nová ložiska zánětlivé infiltrace s kalcifikacemi.
Pro osteolytickou aktivitu se jeví jako racionální použití léků inhibujících osteoklasty (bisfosfonáty nebo denosumab). Výhodou denosumabu je, že riziko osteonekrózy čelisti je zvýšeno pouze po dobu jeho podávání, takže po jeho ukončení by mohla proběhnout rekonstrukční operace čelisti bez rizika osteonekrózy. Proto jsme od 24. 11. 2022, po schválení plátcem zdravotní péče, zahájili aplikace denosumabu v 28denních intervalech a přidali suplementaci vitaminu D a vápníku pomocí preparátu Caltrate.
Pro přetrvávání potíží i při léčbě anakinrou jsme přidali lék ze skupiny DMARDs (Disease Modifying Anti-Rheumatic Drugs), sulfasalazin. V každém případě lze potvrdit léčebnou účinnost podání anakinry. Vybrané laboratorní hodnoty před léčbou anakinrou a v průběhu léčby jsou uvedeny v tabulce 1.
V pátém měsíci léčby anakinrou proběhlo také kontrolní PET MR vyšetření, obrázek 5.
Ve srovnání s PET/MR před léčbou došlo k výrazné regresi metabolické aktivity ve většině minule popsaných postižených oblastí v návaznosti na skelet. Většina ložisek zvýšené metabolické aktivity vymizela či alespoň metabolicky regredovala. Signální změny v MR obraze jsou celkově též v parciální regresi. Takže PET/MR potvrdilo léčebnou odpověď, nedošlo ke kompletnímu vymizení všech patologických změn, ale k velmi výraznému zlepšení.
Diskuze
Autoinflamatorní onemocnění představují heterogenní skupinu chorob spojených s mutacemi genů kódujících proteiny s klíčovou úlohou v regulaci zánětlivé odpovědi. Nejdéle známou skupinu představují syndromy periodické horečky, mezi něž se řadí například familiární středomořská horečka. Jedná se o monogenní onemocnění manifestující se většinou již v dětství. Mezi další autoinflamatorní choroby patří takzvané pyogenní syndromy, autoinflamatorní onemocnění kůže a kostí, kam lze přiřadit i SAPHO syndrom, granulomatózní choroby, monogenní vaskulopatie a onemocnění spojená s poruchou proteazomu. Z hlediska genetiky lze autoinflamatorní choroby dělit na choroby s definovanou genetickou poruchou a dále na autoinflamatorní choroby geneticky zatím nedefinované, ke kterým patří jak Stillova choroba dospělých a syndrom Schnitzlerové, tak i SAPHO syndrom a nebakteriální osteomyelitidy. Autoinflamatorní onemocnění jsou vzácné choroby s obtížnou diagnostikou, přesto je potřeba je vést v patrnosti, a to zejména u pacientů s febriliemi nejasné etiologie (1).
Frekvence výskytu a klinické příznaky
SAPHO syndrom se může manifestovat v jakémkoliv věku. U kavkazské populace byla roční prevalence odhadnuta na 1 / 10000 obyvatel (3). Tato prevalence se může jevit poměrně vysoká, ale nutno připomenout, že v revmatologické literatuře se termín SAPHO syndrom uvádí jako zastřešující název (deštník) pro mnoho klinicky definovaných jednotek, jejichž projevy nemusí být tak mutilující jako u našeho pacienta (3, 4).
Názvy chorob v původním anglickém znění, které jsou řazeny pod zastřešující termín SAPHO syndrom, uvádí tabulka 2. Méně výrazné projevy SAPHO syndromu, sterno-kosto-klavikulární zduření s osifikacemi, nemusí být správně diagnostikovány. Uvádí se, že u chorobných stavů, patřících pod skupinové označení SAPHO syndrom, je sternoklavikulární ligamentum chorobou postiženo u 48 %, a proto je zduření v oblasti sternoklavikulárního skloubení (případně přední hrudní stěny) uváděno jako časný příznak SAPHO syndromu (3, 4).
Většina pacientů se SAPHO syndromem si stěžuje na chronické bolesti kostí a kloubů, na celkové zánětlivé příznaky a na patologickou únavu (fatigue). Noční bolesti se objevují u části pacientů a mohou být interpretovány jako růstové bolesti, případně jako osteom, osteosarkom. Někdy může být zduření nad bolestivou kostí. Bolest se může objevit akutně, ale obvykle je intenzita bolestí v průběhu času kolísavá (1–6).
Ložiska nemoci mimo hrudní stěnu často postihují metafýzy dlouhých kostí, hlavně dolních končetin, kolena a kotníky a často také klavikulu, sternoklavikulární skloubení, dále pak pánev včetně kosti křížové, acetabulum a jeho okolí, pubické kosti. Podskupina pacientů ale má jako další příznak spondylitidu, tedy bolesti páteře. Proto je tento typ postižení někdy také přiřazován ke skupině spondylartropatií (1). Postižení sterna a jeho skloubení bývá častěji u dospělých než u dětí. Zánětlivý proces postihuje také okolí kloubů a kostí a tato ložiska mohou být považována za neoplastické či lymfatické masy. Entezopatie může způsobit osifikaci. Zánětlivé změny větších kloubů jsou popisovány u 92 % případů SAPHO syndromu (3).
Možné je ale také dominující postižení čelisti. V odborné lékařské literatuře, evidované v databázi PubMed, jsme našli k datu prosinec 2022 jen šest publikací popisujících postižení čelisti SAPHO syndromem nebo chronickou nebakteriální osteomyelitidou. Takže postižení čelisti není běžné.
Přehled publikovaných lokalizací SAPHO syndrom shrnula Iva Rukavina (3) do následujícího pořadí:
- sternokostoklavikulární lokalizace 65–90 %
- páteř a paravertebrální lokalizace 32–52 %
- pánev 13–52 %
- dlouhé kosti 30 %
- mandibula 11 % (3).
Z dalších možných projevů nutno zmínit projevy kožní, ke kterým se počítá akné, psoriáza a palmoplantární pustulóza. Psoriáza a pustulóza se mohou manifestovat až po zahájení léčby. Bývá také zmiňována asociace se střevními záněty, což může vysvětlit kostní bolesti u některých pacientů se střevními záněty (5). Odraz SAPHO syndromu ve funkci mozku analyzovala jedna práce. Její autoři zjistili depresi u 46,2 % (u 13 z 28 pacientů). Tím můžeme vysvětlit špatnou vybavitelnost všech předchozích vyšetření a léčení u našeho pacienta. Nemoc může začít v kterékoliv oblasti, a tak příznaky přivedou pacienty za lékaři všech možných specializací. Našeho pacienta přivedly první příznaky ke stomatochirurgům.
Patofyziologie nemoci
SAPHO syndrom a chronická nebakteriální osteomyelitida (CNO) případně chronická rekurentní multifokální osteomyelitida (CRMO) jsou považovány za autoinflamatorní choroby (1, 2). Tyto nemoci souvisejí s alterovanou cytokinovou a chemokinovou expresí a aktivací buněk vrozené imunity. Monocyty od pacientů se SAPHO syndromem nebo s CNO/CRMO obsahovaly zvýšené množství prozánětlivých cytokinů (IL-1β, IL-6, TNF-α) a chemokinů (IL-8, IP-10, MCP-1, MIP-1a, MIP-1 b). Dále je známo, že pacienti s CNO/CRMO mají zvýšenou aktivaci NLRP3 inflamazomu (1, 5).
NLRP3 inflamazom je kritická komponenta vrozeného imunitního systému, která funguje jako rozpoznávací receptor patologického poškození, a tento receptor zprostředkuje aktivaci kaspázy-1 a sekreci proinflamatorních cytokinů IL-1β/IL-18 jako odpověď na mikrobiální a celulární poškození.
U větší části osob se SAPHO syndromem lze nalézt v rodině jiné autoimunitní/autoinflamatorní onemocnění včetně psoriázy, střevních zánětů nebo revmatické artritidy. Náš pacient svého otce nezná a u matky žádnou podobnou nemoc neuvedl.
Majeed syndrom je závažná familiární forma CNO/CRMO, projevující se sterilním kostním zánětem, dyserytropoetickou anémií a neutrofilní dermatózou. Tato nemoc je autozomálně recesivně dědičná a je spojena s homozygotní mutací LPIN2 genu.
Léčebný úspěch anakinry potvrzuje centrální roli proinflamatorního cytokinu IL-1β v patofyziologii Majeed syndromu a vedl ke klasifikaci nemoci jako NLRP3 inflamazom-asociované onemocnění (inflammasomopathy) (1).
Léčebné úspěchy anakinry u malé skupiny pacientů s Majeedovým syndromem zdůrazňují význam IL-1β v patofyziologii tohoto syndromu. Obojí, jak kostní zánět, tak anémie, ustoupilo při blokádě IL-1β (6).
Deficience antagonisty IL-1 receptoru (DIRA) je další, časně se manifestující, autoinflamatorní choroba charakterizovaná multifokální sterilní osteitidou, periostitidou a pustulózou. Pro tuto nemoc způsobenou genetickou poruchou je charakteristická autozomálně recesivní ztráta funkce (mutace IL-1RN) přirozeně se vyskytujícího inhibitoru receptoru pro IL-1, která má za následek neinhibovanou pro-inflamatorní IL-1 signalizaci. Proto je DIRA spojena se značnou morbiditou a mortalitou.
Pokud se však tato choroba (DIRA) zavčas rozpozná dle příznaků (časně se manifestující osteitida, periostitida a pustulóza, většinou v časném novorozeneckém věku), je možné podezření potvrdit DNA sekvenční analýzou. Pro onemocnění DIRA je jedinou léčbou substituce pomocí antagonisty IL-1 receptoru (1).
U většiny případů CNO/CRMO se však nejedná o monogenní chorobu.
V těchto případech se předpokládá genetická predispozice, podílející se na patofyziologii této nemoci. Skutečností je, že mezi sporadickou, non-familiární CNO/CRMO a monogenní chorobou DIRA je hodně podobností. Je popisována změna exprese inhibitoru interleukinu-1 anebo redukce exprese imunoregulačního cytokinu IL-10 v monocytech pacientů.
Laboratorní vyšetření
Tato vyšetření jsou nespecifická, mírně či výrazně zvýšená hodnota CRP a zvýšené hodnoty sedimentace erytrocytů jsou přítomny u 50–80 % nemocných. Antinukleární protilátky jsou zvýšené v 8–38 % a HLA-B27 je pozitivní ve 2–25 %. Koncentrace TNF-alfa a IL-6 jsou mírně zvýšené u části pacientů. Jsou popisovány změny v koncentracích dalších cytokinů, ty však nejsou rutinně v nemocnicích vyšetřovány (1). Do konce roku 2022 byla zveřejněna pouze jedna práce, v níž autoři analyzují vliv přítomnosti zvýšené koncentrace IgG4 na průběh SAPHO syndromu. Autoři prokázali zvýšenou koncentraci IgG4 u 23 % (12/52) pacientů se SAPHO syndromem a tito pacienti se vyznačovali závažnějším průběhem nemoci (7). Náš pacient měl vstupně zjištěnou poměrně vysokou koncentraci imunoglobulinů IgG 31 g/l, jejichž koncentrace při kortikoterapii a další léčbě poměrně rychle klesala. Podtřídy imunoglobulinu IgG a tedy IgG4 jsme u našeho pacienta před léčbou nevyšetřili.
Zobrazovací vyšetření
Na klasických rentgenových snímcích má nemoc nespecifický obraz. Nejčastějším místem postižení bývá sternoklavikulární kloub pod obrazem osteitidy a hyperostózy. Dalšími morfologickými obrazy můžou být osteoskleróza obratlových těl, osteolytická nebo osteosklerotická ložiska v metafýzách dlouhých kostí nebo sakroiliitida. Jejich absence však nemoc nevylučuje. U dospělých na rozdíl od dětí je optimální zobrazení metodou počítačové tomografie (CT) případně magnetické rezonance (MR). MR je dnes preferovanou metodou pro monitorování chronické nebakteriální osteomyelitidy (CNO). Výhodou MR je vysoký tkáňový kontrast a absence ionizujícího záření. Metoda magnetické rezonance umožňuje posouzení jak oseálních, tak i extraoseálních struktur a stanovení rozsahu zánětlivých změn (8). V české literatuře přínos MR zobrazení pro detekci změn skeletu nebakteriální osteomyelitidou popsala Korčáková (9), Skotáková a Červinková (10).
V poslední době se objevují práce o přínosu zobrazení rozsahu SAPHO syndromu pomocí radiofarmaka fluorodeoxyglukózy (FDG) metodou FDG-PET/CT (1). U našeho pacienta jsme použili zobrazení pomocí FDG-PET/MR. Zatím v databázi PubMed není evidována žádná publikace o FDG-PET/MR zobrazení této nemoci. Dle našich zkušeností je FDG-PET/MR zobrazení velmi přínosné jak pro stanovení rozsahu nemoci, tak i pro vyhodnocení léčebné odpovědi.
Histologie kosti
Kostní biopsie v případě SAPHO syndromu či CNO nemůže tyto diagnózy stanovit, identifikovat specifický znak těchto chorob, ale může vyloučit jiné nemoci, jako je fibrózní dysplazie, malignity nebo histiocytózu z Langerhansových buněk, které by podobný zobrazovací nález mohly způsobit. Histologické nálezy z CNO popisují známky osteitidy s denzními infiltráty zánětlivých elementů, kostní osteolýzu, remodelaci s nadprodukcí osteoidu a zmnožení osteoblastů fibrózou kostní dřeně. V časných stadiích choroby se popisují buňky vrozené imunity, tedy neutrofily, monocyty/makrofágy. Lymfocyty, včetně buněk plazmatických, se objevují v pozdějších stadiích. Makrofágy jsou považovány za nejstabilnější komponentu ve všech fázích vývoje. Nicméně infiltráty vrozené a adaptivní imunity mohou koexistovat jako důsledek kolísavé intenzity projevů. V některých případech byly identifikovány bakterie Propionibacterium/Cutibacterium acnes, které mohou komplikovat stanovení diagnózy. Propionibacteriae jsou považovány za kontaminace (11).
Histologické hodnocení vzorku z periostálních infiltrátů či z kosti může popsat sice zánětlivé změny, ale nemůže prokázat, že se jedná o autoinflamatorní onemocnění!
Stanovení diagnózy SAPHO syndromu
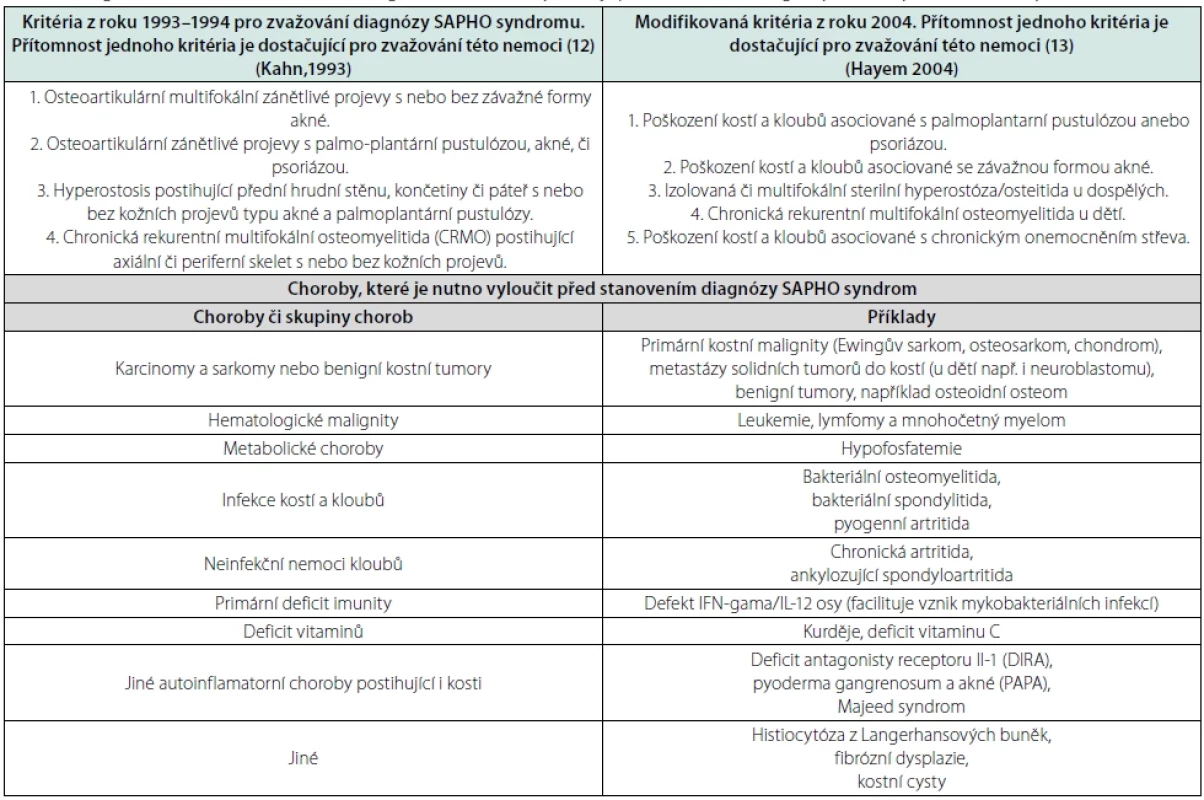
SAPHO syndrom a chronická nebakteriální osteomyelitida nemají specifických znaků, dle nichž by bylo možné tyto nemoci morfologicky (histologicky) rozpoznat. Stejně tak zatím nebyla odhalena genetická příčina onemocnění, takže ani molekulárně biologické vyšetření nemůže stanovit diagnózu. Proto se diagnóza této nemoci stále stanovuje na základě splnění klinických kritérií, která požadují typické zánětlivé změny na kostech, kloubech, případně na kůži a na základě pečlivého vyloučení jiných příčin těchto kostních změn, jak uvádí tabulka 3.
Diagnózu SAPHO syndromu lze zvažovat, když je naplněna jedna ze čtyř charakteristik (inclusion kritérií):
- závažná forma akné a osteoartikulární zánětlivé projevy,
- palmo-plantární pustulóza a osteoartikulární zánětlivé projevy,
- hyperostosis postihující přední hrudní stěnu, končetiny či páteř s nebo bez kožních projevů typu akné a palmoplantární pustulózy,
- chronická rekurentní multifokální osteomyelitida (CRMO) postihující axiální či periferní skelet s nebo bez popsaných kožních projevů (12).
Modifikovaná kritéria zveřejnil v roce 2004 Hayem (13), tento návrh byl založen na analýze 120 pacientů se SAPHO syndromem. Tato kritéria se opět zakládají na přítomnosti typických osteoartikulárních a kožních projevů, podobně jak popsal Kahn. Podmínkou je opět vyloučení jiných příčin těchto změn:
- poškození kostí a kloubů asociované s palmoplantární pustulózou, poškození kostí a kloubů asociované se závažnou formou akné.
- nebo izolovaná či multifokální sterilní hyperostóza/osteitida u dospělých či chronická rekurentní multifokální osteomyelitida u dětí (13).
Od zveřejnění prvních kritérií v roce 1993 do roku 2022 se tyto principy stanovení diagnózy SAPHO syndromu nezměnily. Stanovení diagnózy je stále založeno na přítomnosti osteoartikulárních a kožních změn a vyloučení jiných známých příčin kostních a kožních projevů. Pomyslet na tyto nemoci se má vždy, pokud je splněna charakteristika této nemoci. Diagnóza se považuje za stanovenou, pokud je vyloučena jiná diagnóza, která by tyto změny mohla zapříčinit. Diagnostická kritéria a diferenciálně diagnostické alternativy, které je před stanovením diagnózy SAPHO syndromu třeba vyloučit, uvádí tabulka 3 (1, 12, 13).
Citovaný princip (per exclusionem) stanovení diagnózy vysvětluje, proč pod tento zastřešující termín SAPHO syndrom mohou být zařazeny různě aktivní a různě rozsáhlé zánětlivé změny kostí, kloubů a okolních struktur, pro něž se nenajde jiná prokazatelná etiologie.
Revmatologové, do jejichž oboru patří systémové zánětlivé nemoci pojiva dospělých, tedy i autoinflamatorní choroby, používají termín SAPHO syndrom v souvislosti s chronickou nebakteriální osteomyelitidou. Termín SAPHO syndrom by ale měl být vyhrazen pro stavy s přítomností kožních změn odpovídajících akné a pustulóze (1).
V pediatrické literatuře se častěji používá termínu „chronic non-bacterial ostemyelitis, chronická nebakteriální osteomyelitida“, která se popisuje ponejvíce u dětí a adolescentů, ale může postihnout i dospělé jedince. Chronická nebakteriální osteomyelitida může mít velmi různorodý klinický průběh a spektrum příznaků, od self-limiting monofokálního ložiska po chronicky aktivní a rekurentní multifokální chorobu. Pro tyto závažné případy se používá termín „chronic recurrent multifocal osteomyelitis (CRMO)“, tedy chronická rekurentní multifokální osteomyelitida. Autoinflamatorní choroby postihující kosti, klouby a kůži, byly v české a slovenské odborné literatuře opakovaně popsány, i když počet publikací „in extenso“ není velký (14, 15).
Léčba
Kortikoidy, nesteroidní antiflogistika a léky ze skupiny DMARDs (Disease Modifying Anti‑Rheumatic Drugs)
Léčba této nemoci se odvozuje od publikovaných popisů případů, žádné randomizované klinické studie u této diagnózy nebyly prováděny. Kortikosteroidy, podobně jako nesteroidní antiflogistika (NSAIDs), inhibují tvorbu zánětlivých cytokinů inhibicí fosfolipázy-A1. Kortikosteroidy inhibují tvorbu pro-inflamatorních cytokinů, které jsou regulovány transkripčním faktorem NFκB, včetně IL-1, IL-6 a TNF-α.
V klinické praxi se tedy používá prednison v dávce 2 mg/kg/den po dobu 5–10 dní, k pokrytí období než léky ze skupiny DMARDS rozvinou svůj potenciál. Kortikosteroidy sice mají schopnost rychle zmírnit probíhající kostní zánět ve většině případů, ale nevedou k dlouhodobým remisím, navíc je jejich dlouhodobé podávání provázeno nežádoucími účinky potřebných vysokých dávek.
Nesteroidní antiflogistika mají potenciál zmírnit symptomy a mohou u části pacientů pomoci s mírněním zánětu kostí. Jejich účinek je ale limitovaný jak intenzitou, tak i časově. Nesteroidní antiflogistika mírně redukují tvorbu cytokinů stimulujících zánět ve skeletu, samotná antiflogistika ale nemají potenciál nemoc zmírnit (1, 2).
Z těchto důvodů se obvykle podávají současně s léky řazenými do skupiny „Disease Modifying Anti-Rheumatic drugs – DMARDs“, kam je řazen sulfasalazin, metotrexát, cyklosporin-A, cyklofosfamid a thalidomid, případně další léky ze skupiny Imunomodulatory Drugs (IMiDs). Nově byl popsán také pozitivní efekt leflunomidu. Retinoidy byly použity s cílem zmírnit akné. Léky ze skupiny konvenčních DMARDs mají omezený potenciál zásadně zmírnit průběh nemoci a skutečný zřetelný efekt mají jen ve výjimečných případech (16).
Bisfosfonáty
Bisfosfonáty pomáhají u pacientů s výraznou osteolýzou, inhibují osteoklastickou aktivitu. Pamidronát má potenciál tlumit i expresi proinflamatorních cytokinů. Pamidronát indukoval dle několika publikací dlouhotrvající remise u CNO pacientů. V podstatě byly použity dva léčebné pamidronátové režimy, 1 mg/kg maximálně 60 mg 1× za měsíc nebo stejnou dávku 3 dny po sobě každé 3 měsíce po dobu 9–12 měsíců. Bisfosfonáty jsou tedy u pacientů s patologicky aktivovanou aktivitou osteoklastů vždy vhodným lékem (17). Použití denosumabu v této indikaci bylo zveřejněno až v roce 2023.
Biologické léky používané pro SAPHO syndrom
Blokátory TNF
Léky blokující tumor nekrotizující faktor (anti-TNF léky) jsou nejdéle a tedy nejvíce používány pro léčbu SAPHO syndromu. Pro jejich použití mluví vysoká exprese TNF-α v kostních biopsiích a abnormální exprese IL-8 a IL-18 v séru u pacientů se SAPHO syndromem. Vysoká exprese těchto cytokinů ovlivňuje aktivitu neutrofilů a jejich počet v oběhu a zvyšuje expresi TNF-α. Blokátory TNF-α dosahují poměrně rychle léčebné odpovědi, ale obvykle je třeba dlouhodobé léčby a zde mohou být problémem jejich nežádoucí účinky. U pacientů se SAPHO syndromem byly popsány léčebné úspěchy po použití infliximabu, etanerceptu, adalimumabu a certolizumabu. Podání TNF-α inhibitorů se dle vysokého počtu publikací s pozitivním hodnocením jeví jako léčba první volby pro pacienty se SAPHO syndromem (1, 18), nicméně dlouhodobá aplikace těchto léků je spojena s určitými riziky plynoucími z imunosuprese, mimo jiné s rizikem vzplanutí tuberkulózy (18, 19).
Anakinra
Dalším potenciálně přínosným lékem jak pro SAPHO syndrom, tak pro klasické CNO/CRMO je blokáda interleukinu-1 pomocí anakinry, antagonisty receptoru pro Il-1. Používání tohoto léku bylo v Evropské unii schváleno již v roce 2002. Jednoznačnou indikací pro anakinru jsou takzvané periodické horečky, familiární středozemní horečka, Stillova choroba dospělých a syndrom Schnitzlerové, ale i další monogenní a polygenní autoinflamatorní choroby.
Anakinra velmi účinně tlumí kostní příznaky, asi v 80 %, ale efekt na kožní příznaky se popisuje jako malý (20–25), což potvrzuje i naše zkušenost.
Wendling popsal použití anakinry u 8 pacientů se SAPHO syndromem. Tato práce je důležitá tím, že popisuje pozitivní účinek anakinry dokonce u dvou pacientů, u nichž nebyla dostatečná odpověď na léčbu s pomocí anti-TNF (25). Na anakinru lze v této indikaci tedy pohlížet jako na další alternativu pro iniciální léčbu.
Léčba anakinrou zasahuje do imunitní reaktivity organismu, a tak není překvapením, že při léčbě anakinrou jsou popisovány závažné infekce u 1–10 % pacientů. Nicméně tyto informace jsou odvozeny od studií hlavně s revmatoidní artritidou a v některých z nich byla použita anakinra s dalšími léky (s metotrexátem a někdy s anti-TNF preparáty). Ovlivnění imunitní odpovědi anakinrou je důvod, proč se tento lék nedoporučuje u pacientů s aktivní infekcí, u pacientů s latentní tuberkulózou anebo u pacientů s leukopenií. Při závažné infekci se má léčba anakinrou přerušit. Zvýšené riziko infekcí je popisováno mimo jiné také při léčbě anti-TNF inhibitory, a proto se nedoporučuje kombinovat anakinru s TNF-inhibitory. Vzácnou komplikací je pokles leukocytů anebo trombocytů, a proto je vhodné osoby léčené anakinrou pravidelně komplexně kontrolovat.
Další alternativy biologické léčby
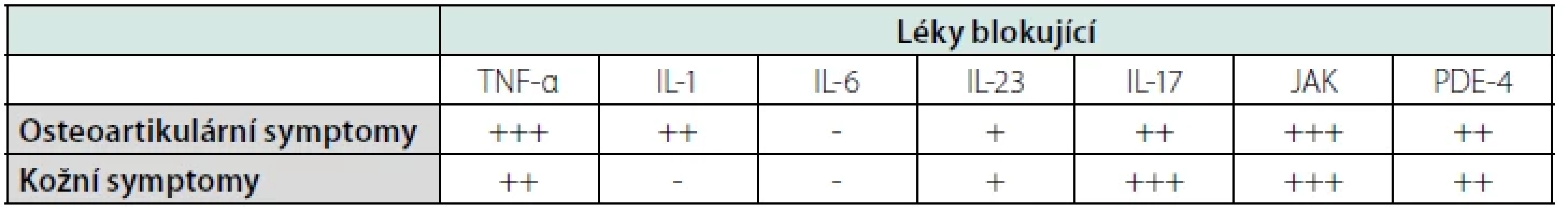
Testována byla také inhibice interleukinu-6 pomocí tocilizumabu, což je humanizovaná monoklonální protilátka proti receptoru interleukinu-6. Publikované zkušenosti však nehodnotí tuto léčbu jako efektivní (26). V současnosti probíhá testování i další formy biologické léčby působící na osu IL-23/IL-17. Testována byla inhibice IL-17 preparátem secukinumab (27, 28) a inhibice osy IL-12/23 preparátem ustekinumab (29) s pozitivním výsledkem. Jako velmi nadějné byly hodnoceny první zkušenosti s inhibitorem Janusových kináz (JAK) tofacitinibem (30, 31) a inhibitorem fosfodiesterázy-4 (PDE-4), preparátem s názvem apremilast (32) a dalšími (33, 34).
Historicky je tedy nejvíce zkušeností s preparáty, které inhibují TNF, ale léčba anakinrou má také dostatečné opodstatnění dle počtu publikací s pozitivním hodnocením. S nověji zavedenými léčebnými alternativami je zatím méně publikovaných zkušeností. Vyhodnocení účinnosti léčby jednotlivými biologickými preparáty bylo zveřejněno v roce 2022 v článku nazvaném „New Insights in the Treatment of SAPHO Syndrome and Medication Recommendations“ (16). Tabulku 4 jsme z této publikace převzali.
Závěr
SAPHO syndrom a chronická nebakteriální osteomyelitida jsou onemocnění řazená mezi autoinflamatorní choroby. Je charakterizován bolestí, otokem a deformitami kostí a v některých případech i patologickými frakturami ve spojení s kožními zánětlivými projevy. V etiopatogenezi má centrální roli porucha regulace zánětlivých mechanismů spojená s dysregulací exprese cytokinů a s patologickou aktivací inflamazomu. V našem případě šlo o mnohočetné postižení skeletu, první manifestace nemoci však byla atypicky v dolní čelisti.
Diagnózu SAPHO syndromu či nebakteriální osteomyelitidy musí stanovit klinik. Role patologa zde je pomocná, morfologicky nelze tyto choroby diagnostikovat, lze však morfologicky rozpoznat jiné choroby, které by mohly vytvořit podobný klinický obraz (35).
Pro léčbu jsou používány léky inhibující zánět, nesteroidní antiflogistika, kortikosteroidy, klasické DMARDs, ale hlavně biologická léčba. Z preparátů biologické léčby je nejvíce zkušeností s podáním TNF-α inhibitorů a anakinrou. Zobrazení s pomocí pozitronové tomografie umožnuje hodnocení aktivity nemoci (36). Popis našeho případu potvrzuje velmi dobrou účinnost anakinry na kostní postižení a menší na kožní projevy SAPHO syndromu.
Text vytvořen na podporu MZ ČR – RVO (FNBr, 65269705)
Děkujeme revizní lékařce MUDr. Kristině Slavíkové a Ústředí Vojenské zdravotní pojišťovny ČR (201)
za vstřícnost a za schválení léčby pro velmi vzácné onemocnění ze skupiny autoinflamatorních chorob.
prof. MUDr. Luděk Pour, Ph.D.I
)nterní hematologická a onkologická klinika LF MU a FN Brno
pour.ludek@fnbrno.cz
Sources
- Benhamou CL, Chamot AM, Kahn MF, et al. Synovitis-acne-pustulosis hyperostosis-osteomyelitis syndrome (SAPHO). A new syndrome among the spondyloarthropathies? Clin Exp Rheumatol. 1988;6(2):109-112.
- Němec P. Revmatologie pro praxi. 2., přepracované a doplněné vydání. Praha: Grada Publishing, 2021;819 s
- Rukavina I. SAPHO syndrome: a review. J Child Orthop. 2015;9(1):19-27.
- Kishimoto M, Taniguchi Y, Tsuji S, et al. SAPHO syndrome and pustulotic arthro-osteitis.
- Girschick H, Finetti M, Orlando F, et al. The multifaceted presentation of chronic recurrent multifocal osteomyelitis: a series of 486 cases from the Eurofever international registry. Rheumatology. 2018;57(8):1504-1506.
- Roy NBA, Zaal AI, Hall G, et al. Majeed syndrome: description of a novel mutation and therapeutic response to bisphosphonates and IL-1 blockade with anakinra. Rheumatology. (Oxford) 2020;59(2):448-451.
- Li C, Xiang Y, Wu X, Cao Y, et al. Serum IgG4 elevation in SAPHO syndrome: does it unmask a disease activity marker? Clin Exp Rheumatol. 2020;38(1):35-41.
- Zhao Y, Sato TS, Nielsen SM, et al. Development of a scoring tool for chronic nonbacterial osteomyelitis magnetic resonance imaging and evaluation of its interrater reliability. J Rheumatol. 2020;47(5):739-747.
- Korčáková E, Jeremiáš P, Ríčař J, et al. SAPHO vzácná diagnóza. Česká radiologie. 2017;71(3):201-206.
- Skotáková J, Červinková I, Šenkyřík J, et al. Význam MR vyšetření u diagnózy chronická rekurentní multifokální osteomyelitida Česká radiologie. 2017;71(3):197-200.
- Watanabe S, Sawa N, Mizuno H, et al. Bone histomorphometric and immunohistological analysis for hyperostosis in a patient with SAPHO syndrome: A case report. Bone Rep. 2020;13 : 100296. doi:10.1016/j.bonr.2020.100296
- Kahn MS: Proriatic arthritis and synovitis, acne, pustulosis, hyperostosis et osteitis. Current Opinion in Rheumatology. 1993;5 : 428-435.
- Hayem G. SAPHO syndrome. Rev Prat. 2004;54(15):1635-1636.
- Bouchalová K, Fráňová J, Schüller M, et al. Chronická rekurentní multifokální osteomyelitida (CRMO) v dětském věku – přehled a vlastní výsledky. Česká Revmatol. 2019;27(3):116-124.
- Růžičková-Jarešová L. Machovcová A. SAPHO syndrom. Dermatologie pro praxi. 2009;3(4):188-190.
- Cheng W, Li F, Tian J, et al. New Insights in the Treatment of SAPHO Syndrome and Medication Recommendations. J Inflamm Res. 2022;15 : 2365-2380.
- Otto S, Troeltzsch M, Burian E, et al. Ibandronate treatment of diffuse sclerosing osteomyelitis of the mandible: pain relief and insight into pathogenesis. J Craniomaxillofac Surg. 2015;43 : 1837-42.
- Vekic DA, Woods J, Lin P, et al. SAPHO syndrome associated with hidradenitis suppurativa and pyoderma gangrenosum successfully treated with adalimumab and methotrexate: a case report and review of the literature. Int J Dermatol. 2018;57(1):10-18.
- Vilar-Alejo J, Dehesa L, de la Rosa-del Rey P, et al. SAPHO syndrome with unusual cutaneous manifestations treated successfully with etanercept. Acta Derm Venereol. 2010;90(5):531-532.
- Colina M, Pizzirani C, Khodeir M, et al. Dysregulation of P2X7 receptor-inflammasome axis in SAPHO syndrome: successful treatment with anakinra. Rheumatology. 2010;49(7):1416-1418.
- Daoussis D, Konstantopoulou G, Kraniotis P, et al. Biologics in SAPHO syndrome: a systematic review. Semin. Arthritis Rheum. 2019;48(4):618-625.
- Pardeo M, Pires, S, Marafon D, et al. Anakinra in a cohort of children with chronic nonbacterial osteomyelitis. J. Rheumatol. 2017;44(8):1231-1238.
- Maniscalco V, Abu-Rumeileh S, Mastrolia MV, et al. The off-label use of anakinra in pediatric systemic autoinflammatory diseases. Ther Adv Musculoskelet, DiS. 2020;12 : 1759720X20959575. doi:10.1177/1759720X20959575.
- Firinu D, Garcia-Larsen V. SAPHO Syndrome: Current Developments and Approaches to Clinical Treatment. Curr Rheumatol Rep. 2016;18(6):35. doi: 10.1007/s11926-016-0583-y
- Wendling D, Prati C, Aubin F. Anakinra treatment of SAPHO syndrome: short-term results of an open study. Ann. Rheum, DiS. 2012;71(6):1098-1100.
- Sun XC, Liu S, Li C, et al. Failure of tocilizumab in treating two patients with refractory SAPHO syndrome: a case report. J Int Med Res. 2018;46(12):5309-5315.
- Sun B, Cao Y, Wang L, Wang M, Li C. Successful treatment of refractory mandibular lesions in SAPHO syndrome with secukinumab. Rheumatology (Oxford). 2021;60(1):473-474.
- Wang L, Sun B, Li C. Clinical and radiological remission of osteoarticular and cutaneous lesions in SAPHO patients treated with secukinumab: a case series. J Rheumatol. 2021;48(6):953-955.
- Cornillier H, Kervarrec T, Tabareau-Delalande F, et al. Interstitial granulomatous dermatitis occurring in a patient with SAPHO syndrome one month after starting leflunomide, and subsequently disappearing with ustekinumab. Eur J Dermatol. 2016;26(6):614-615.
- Yang Q, Zhao Y, Li C, et al. Case report: successful treatment of refractory SAPHO syndrome with the JAK inhibitor tofacitinib. Medicine (Baltimore). 2018;97(25):e11149.
- Li C, Li Z, Cao Y, et al. Tofacitinib for the treatment of nail lesions and palmoplantar pustulosis in synovitis, acne, pustulosis, hyperostosis, and osteitis syndrome. JAMA Dermatol. 2021;157(1):74-78.
- Adamo S, Nilsson J, Krebs A, et al. Successful treatment of SAPHO syndrome with apremilast. Br J Dermatol. 2018; 179(4):959-962.
- Wang L, Gong L, Zhang X, et al. Tripterygium wilfordii Hook F. in the treatment of synovitis, acne, pustulosis, hyperostosis, and osteitis syndrome: a clinical trial. Clin Rheumatol. 2021;40(6):2427-2438.
- Li C, Sun X, Cao Y,et al. Case report: remarkable remission of SAPHO syndrome in response to Tripterygium wilfordii hook f treatment. Medicine (Baltimore). 2017;96(47):e8903.
- Ščudla V, Horák P, Karásek D. Základy diferenciální diagnostiky ve vnitřním lékařství 1. vydání. Olomouc: Univerzita Palackého v Olomouci, 2021. 679 stran.
- Němec P, Řehák Z, Fabián P. Využití pozitronové emisní tomografie (18 FFDG PET) v diagnostice chronických periaortitid. Vnitř Lék. 2008;54(11):1093-1099.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2023 Issue E-5
-
All articles in this issue
- Úspěšná léčba SAPHO syndromu (nebakteriální osteomyelitidy a akné) anakinrou a denosumabem. Popis případu a přehled léčebných možností
- Vybrané biomarkery ortostatickej intolerancie
- Pacient s akutní závratí – role klinického vyšetření a zobrazovacích metod
- Steroid responzívna encefalopatia asociovaná s autoimunitnou tyreoiditídou ako príčina akútnej encefalopatie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Úspěšná léčba SAPHO syndromu (nebakteriální osteomyelitidy a akné) anakinrou a denosumabem. Popis případu a přehled léčebných možností
- Pacient s akutní závratí – role klinického vyšetření a zobrazovacích metod
- Vybrané biomarkery ortostatickej intolerancie
- Steroid responzívna encefalopatia asociovaná s autoimunitnou tyreoiditídou ako príčina akútnej encefalopatie