Farmakogenetické aspekty současné medikamentózní léčby
Pharmacogenetic aspects of current pharmacotherapy
Pharmacogenetics is a specific area of personalized medicine. Pharmacogenetic testing is in the ideal situation conducted prior to the initiation of pharmacotherapy in order to increase efficacy or to minimize risk of toxicity in predisposed patients. There are only few examples of such prospective pharmacogenetics in real praxis so far. We summarize examples of pharmacogenetic tests used in praxis. The pharmacogenetic testing should be applied whenever there is evidence that such test can bring benefit over the therapy without such guidance. However, for most of the drugs on the market, reliable evidence is missing and it will take a lot of effort to obtain pharmacogenetic data for future wider use of these tests.
Key words:
pharmacogenetics, personalized medicine, individualized treatment.
Authors:
Ondřej Slanař 1,2; Tomáš Zima 2
Authors‘ workplace:
Univerzita Karlova v Praze, 1. lékařská fakulta, Farmakologický ústav
1; Univerzita Karlova v Praze, 1. lékařská fakulta, Ústav klinické biochemie a laboratorní diagnostiky
2
Published in:
Čas. Lék. čes. 2010; 149: 472-475
Category:
Review Article
Overview
Farmakogenetika je specifický podobor spadající do oblasti personalizované medicíny. V optimálním případě je farmakogenetické vyšetření indikováno před zahájením terapie vybranými léčivy s cílem zvýšit účinnost nebo omezit rizika vzniku toxicity u predisponovaných pacientů. K individualizaci farmakoterapie se v klinické praxi prozatím uplatňuje stanovování jen několika vybraných polymorfismů spadajících do oblasti farmakogenetiky. V tomto sdělení jsou uvedeny příklady, kdy se farmakogenetických testů prospektivně využívá k prevenci výskytu hypersenzitivity (abakavir), myelotoxicity (irinotekan, azathioprin), krvácení (warfarin) nebo predikci účinnosti (klopidogrel, protinádorová léčba). V souladu s požadavky medicíny založené na důkazech by tyto postupy měly být používány vždy, pokud k jejich použití důkazy jsou. Pro většinu léčiv však věrohodné farmakogenetické důkazy zatím chybí a bude třeba ještě mnoho úsilí taková data prostřednictvím validních studií získat.
Klíčová slova:
farmakogenetika, personalizovaná medicína, individualizace léčby.
Úvod
Farmakogenetika je specifický podobor spadající do oblasti personalizované medicíny. Jde zároveň o relativně nový obor farmakologie, jehož cílem je popsat a predikovat individuální geneticky podmíněné predispozice pro odlišnosti ve farmakokinetice, účinnosti nebo bezpečnosti léčiv. Farmakogenetika bývá často zaměňována za farmakogenomiku a opačně, přestože tyto pojmy zcela zaměnitelné nejsou. Farmakogenetika je vlastně podoborem farmakogenomiky a popisuje variabilitu lékové odpovědi v závislosti na přítomnosti jednotlivých variant izolovaných genů. Naproti tomu farmakogenomika hledá souvislosti mezi variabilitou lékové odpovědi v širším kontextu celého genomu respektive přepisu informace kódované v genech. Do praxe však prozatím pronikly jen některé farmakogenetické postupy, zatímco farmakogenomika je v současnosti spíše záležitostí intenzivního klinického výzkumu. Mezi postupy farmakogenetiky/farmakogenomiky se obvykle nezařazuje zjišťování genetické výbavy pacienta, která je spojená s tíží nebo charakterem onemocnění, byť i tato genetická výbava jedince představuje podstatný faktor pro prognózu a případnou terapeutickou odpověď na podávanou medikaci.
K individualizaci farmakoterapie se v klinické praxi prozatím uplatňuje stanovování jen několika vybraných polymorfismů spadajících do oblasti farmakogenetiky. Důvodem pro omezené využití je malé množství dostatečně kvalitně provedených klinických studií, na jejichž podkladě by bylo možné zavést příslušná vyšetření do praxe. V optimálním případě je farmakogenetický screening indikován před zahájením terapie vybranými léčivy s cílem zvýšit účinnost nebo omezit rizika vzniku toxicity u predisponovaných pacientů. Přehled „tradičních“ léčiv, kde je v současné době takové screeningové vyšetření doporučováno, je uveden v tabulce 1. Pro tato léčiva byly farmakogenetické poznatky získány až po jejich registraci. Farmakogenetický screening u nich prozatím v našich podmínkách není striktně vyžadován v rámci schválené indikace, byť zejména v USA je jejich provádění již běžným standardem. U ostatních léčiv se farmakogenetické testy v současnosti provádějí v případě komplikací (toxicity i nedostatečného účinku) již nasazené farmakoterapie. Situace je odlišná u některých novějších, většinou protinádorových látek, u nichž je podmínkou jejich indikace provedení farmakogenetického vyšetření (často nádorové tkáně). Poznatky o geneticky podmíněné variabilitě účinnosti byly u těchto látek získány již v průběhu klinického vývoje léčiv (1). Mnoho z těchto léčiv uvedených v tabulce 2 by patrně bez farmakogenetického biomarkeru pro účinnost/bezpečnost nebylo pro neselektovanou populaci zaregistrováno, protože v podskupinách pacientů s nepříznivým genotypem není poměr rizika ku prospěchu akceptovatelný. Důvodem může být přílišná toxicita, nedostatečná účinnost nebo kombinace obou těchto faktorů. U této nové skupiny léčiv jsou většinou rozhodující vlastnosti nádoru a jde tak o velmi specifickou oblast farmakogenetiky.
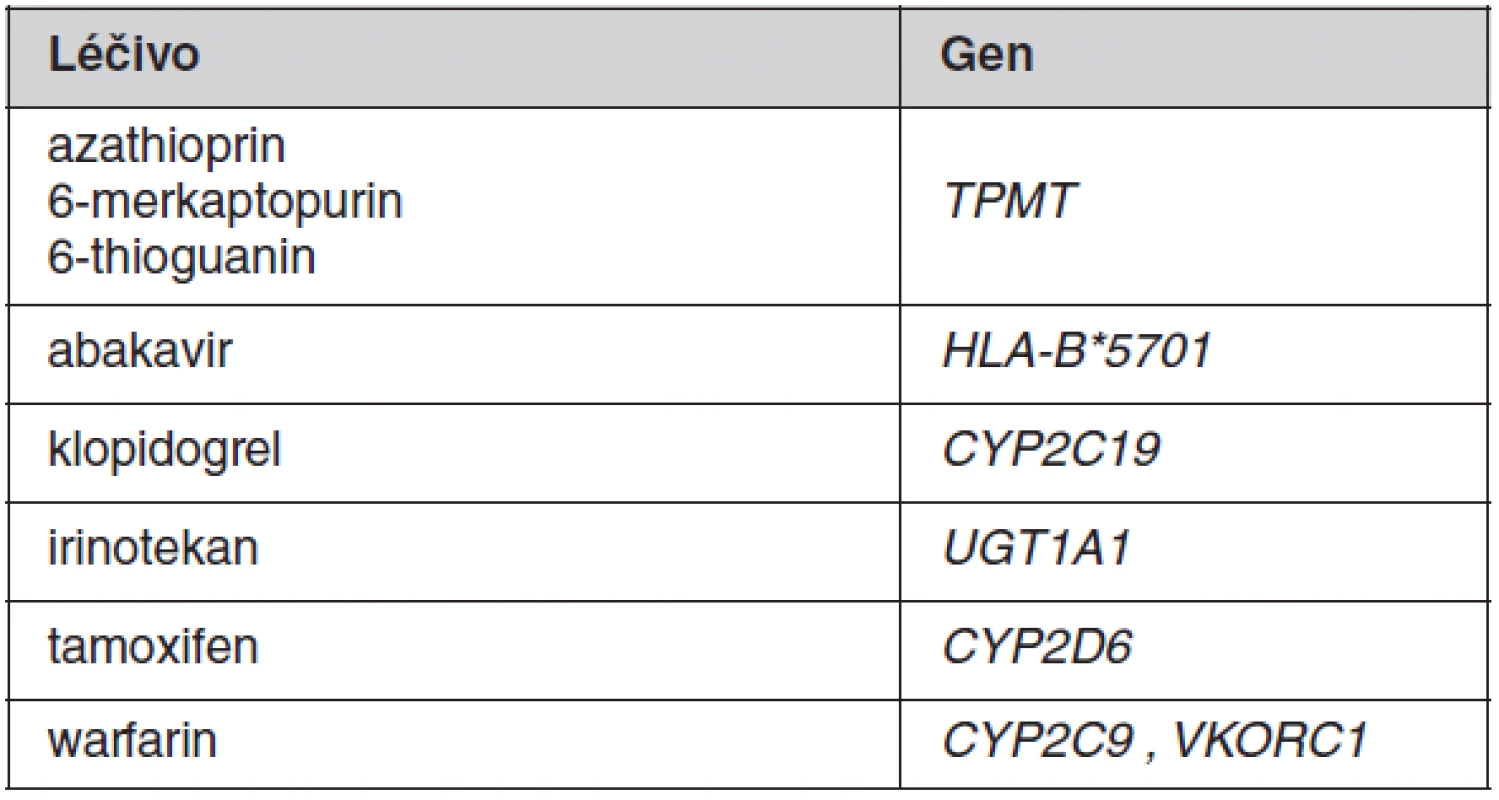
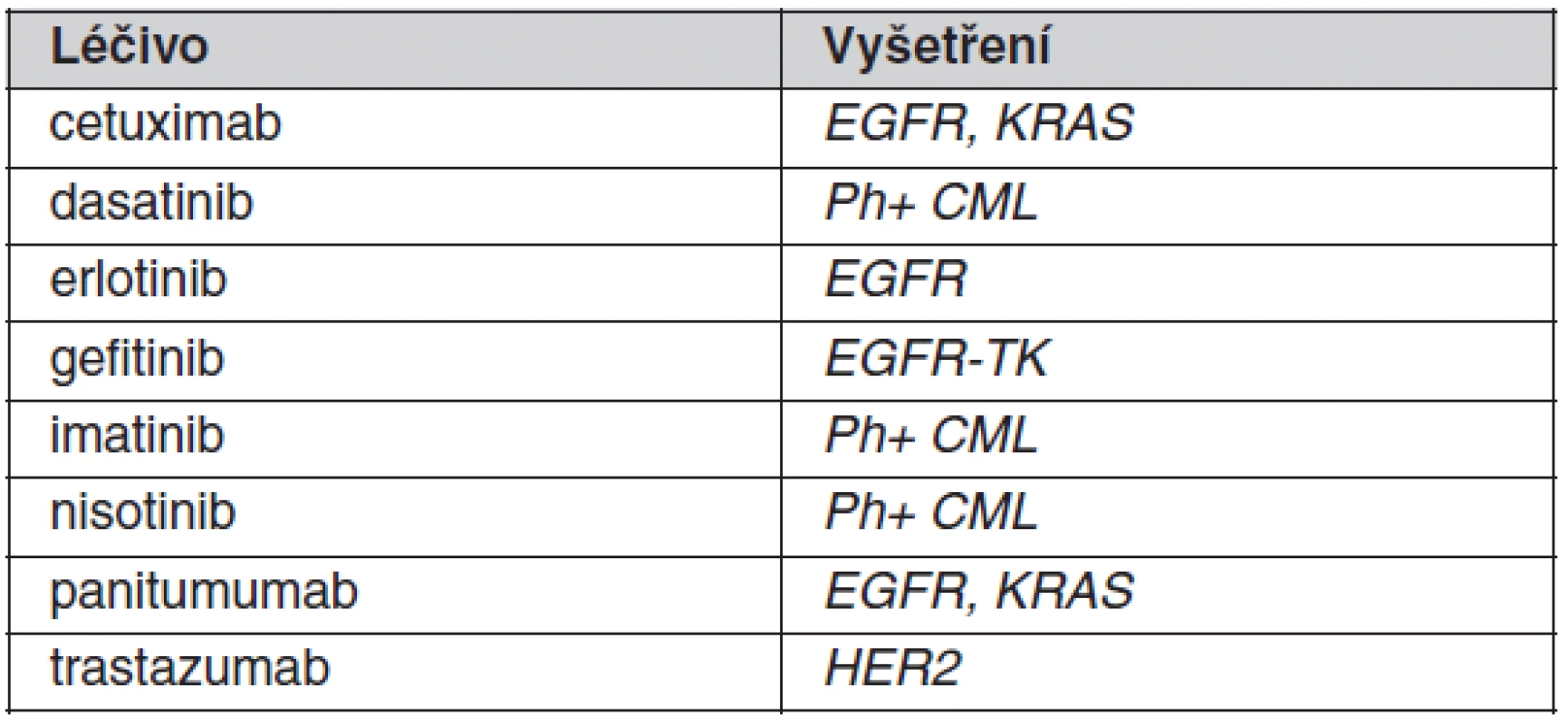
Farmakogenetické testy v klinické praxi
Prevence nežádoucích účinků
V současnosti je většina farmakogenetických vyšetřní mimo oblast onkologické léčby prováděna s cílem omezit výskyt nežádoucích reakcí na podávané léčivo. Na základě jejich výsledku můžeme identikovat pacienty s nepřiměřeně vysokým rizikem při standardním způsobu použití léčiva, ale nejsme schopni predikovat pozitivní individuální terapeutickou odpověď.
Prevence hypersenzitivity
V celé populaci reaguje přibližně 5 % bělochů léčených abakavirem neadekvátní imunologickou odpovědí se závažným postižením kůže. Tato reakce je nezávislá na dávce a dříve by byla řazena mezi idiosynkratické reakce. To znamená mezi nežádoucí účinky, jejichž výskyt nelze predikovat. Klinické studie po registraci léčiva však ukázaly, že hlavním faktorem predikujícím vysoké riziko hypersenzitivní reakce na abakavir je přítomnost alely v histokompatibilním systému HLA-B*5701. Přibližně 50–60 % pacientů s touto alelou v genomu bylo postiženo závažnou kožní reakcí, zatímco u žádného pacienta bez tohoto predisponujícího faktoru hypersenzitivní reakce pozorována nebyla (2). Screening na přítomnost HLA-B*5701 před léčbou a následné nepodání abakaviru pacientům s touto alelou je proto racionálním krokem podstatně měnícím poměr rizika a prospěchu u léčiva. Regulační agentury v Eropě i v USA screening přidaly mezi indikační kritéria pro abakavir. Přestože existuje poměrně značná rezervovanost vůči podobným screeningovým testům jak v regulačních agenturách, tak i u farmaceutického průmyslu, což je zřejmě způsobeno obavami o nízké užívání takového léčiva z důvodu komplikovanosti použití, zkušenost s abakavirem ukazuje opačný trend. Po přidání preskripčního omezení se nejen omezil výskyt hypersenzitivních reakcí, ale zároveň došlo k významně větší preskripci léku a zvýšení prodejů z pohledu výrobce. Abakavir je jedním z nejlépe popsaných případů individualizace léčby na farmakogenetické podkladě, která umožnila účinnou léčbu u mnoha pacientů.
Prevence myelotoxicity
Imunosupresiva ze skupiny derivátů merkaptopurinu jsou mnoho let používána k léčbě idiopatických střevních zánětů, roztoušené sklerózy nebo hematoonkologických onemocnění, zejména u dětí. S podáváním této skupiny léčiv je spojeno riziko závažného útlumu krvetvorby, ke kterému dochází často u pacientů s deficitem thiopurin S-metyltransferázy (TPMT). TPMT je cytosolický enzym druhé fáze biotransformace léčiv s nejasnou fyziologickou funkcí. Tento enzym nicméně představuje dominantní cestu biodegradace imunosupresiv azathioprinu, 6-merkaptopurinu a 6-thioguaninu na neaktivní metabolity. Uvádí se, že přibližně 90 % podané dávky léčiva je prostřednictvím TPMT degradováno na neúčinný 6-metylmerkaptopurin a jen zbývající část dávky léčiva se přeměňuje thioguaninové metabolity, což jsou vlastní aktivní metabolity těchto léčiv s cytotoxickým účinkem. Přibližně 0,3 % naší populace má nedetekovatelné hladiny enzymové aktivity TPMT a 11 % má její aktivitu signifikantně sníženou (3). U pacientů s deficiencí TPMT je vysoké riziko myelosuprese a pravděpodobně i některých dalších toxických účinků (sekundární malignity), které jsou způsobené kumulací imunosupresiv v organismu (4, 5). Aktivitu TPMT je možné predikovat z výsledku genotypizace, nebo přímo stanovovat sledování rychlosti konverze merkaptorpurinu in vitro. Oba postupy vycházejí z jediného odběru krve a z hlediska možnosti využití k identifikaci rizikových pacientů před zahájením léčby příslušnými imunosupresivy jsou až na výjimečné situace zastupitelné. Vyšetření aktivity TPMT je v současnosti nejčastějším screeningovým farmakogenetickým vyšetřením v rutinní klinické praxi jak v České republice, tak i v zahraničí, a to i přes to, že formálně takový screening regulačními agenturami vyžadován není.
Genetický polymorfismus na úrovni promotoru genu kódujícího uridindifosfát glukuronyltranferázu 1A1 (UGT1A1) vede ke snížení exprese enzymu s následným snížením katalytické aktivity UGT1A1. Homozygotní genotyp pro variantní alelu bývá často diagnostikován na základě fenotypových projevů jako familiární hyperbilirubinémie s přibližně 12% frekvencí výskytu v naší populaci. Cytostatikum irinotekan používané při léčbě nádorových onemocnění je léčivo, u kterého je popisováno vysoké riziko toxických nežádoucích účinků (myelotoxicityy a průjmů) u pacientů s genetickým deficitem UGT1A1 po podávání standardních dávek (1). Z toho důvodu se screening provádí v současnosti zejména v USA, byť i tento postup je Food and Drug Administration (FDA) jen doporučen a nikoliv striktně vynucen indikačním omezením.
Prevence krvácení
Antikoagulační účinek warfarinu je obvykle monitorován sledováním protrombinového času (INR). Jsou popisovány dva významné genetické faktory, z nichž cytochrom P450 2C9 způsobuje významnou interindividuální variabilitu farmakokinetiky a polymorfismy ve vitamin K-epoxidreduktáze1 (VKORC1) ovlivňují individuální vnímavost k účinkům léčiva (6–8). VKORC1 je enzym, který vytváří v organismu hydrochinonovou formu vitaminu K, což je kofaktor karboxylace koagulačních faktorů II, VII, IX, X, proteinu C, S a Z. Odhaduje se, že genetická výbava v těchto dvou genech zodpovídá za přibližně 50 % variability dávkování warfarinu v populaci, zatímco druhou polovinu představují jevy demografické (věk, výška, váha, pohlaví) a epigenetické (obsah vitaminu K ve stravě, compliance, jaterní a renální funkce, lékové interakce atp.). Individualizované dávkování na začátku antikoagulační léčby snižuje riziko krvácení na jednu třetinu podle některých prací. V současnosti probíhají v Evropě velké nadnárodní studie k potvrzení takového prospěchu screeningového testování pro warfarin.
Predikce účinnosti
Pro predikci účinnosti existuje zdaleka nejvíce příkladů v onkologické farmakoterapii a léčiva užívaná v ostatních oblastech zůstávají spíše jednotlivým výjimkami. Jednou z nich je klopidogrel, jehož farmakokinetika je významně závislá na aktivitě jaterního cytochromu P450 2C19. V naší populaci není výskyt pacientů s kompletním deficitem této metabolické cesty zanedbatelný. Přibližně 3 % naší populace jsou klasifikována jako pomalí metabolizátoři s kompletním deficitem aktivity. Klopidogrel je proléčivo, které je aktivováno zejména CYP2C19 na aktivní metabolit zajišťující vlastní antiagregační účinky léčiva. V posledních několika letech byla popsána nejen farmakokinetická variabilita aktivního metabolitu závisející na genotypu CYP2C19, ale bylo také ukázáno, že deficit této metabolické cesty zvyšuje riziko trombózy stentu a opačně alela CYP2C19*17, jež vede k ultrarychlému typu metabolismu je spojována s vyšší účinností klopidogrelu a potažmo také 3× zvýšeným rizikem krvácení v porovnání s pacienty, kteří mají obvyklou aktivitu přeměny klopidogrelu na aktivní metabolit (9, 10). Podobné konsekvence jako deficit CYP2C19 je popisován také u konkomitantního podávání inhibitoru protonové pumpy omeprazolu, který je známým inhibitorem CYP2C19 (1). Taková komedikace napodobuje vrozený deficit bioaktivace klopidogrelu. Tento příklad ilustruje nutnost interpretovat genetická data vždy s přihlédnutím k epigenetickým faktorům. Regulační autority v nedávné době aktualizovaly SPC klopidogrelu přidáním příslušného varování.
V onkologické oblasti je řada příkladů, které ilustrují nástup personalizované medicíny do praxe v posledních letech. Jedním z prvních příkladů z této oblasti je herceptin, účinný v léčbě karcinomu prsu jen v případě zvýšené exprese receptoru HER2 . Podobné podmínky použití jsou uvedeny v tabulce 2 i pro další protinádorovou léčbu. Většina z těchto látek vyžadující individualizaci byla zaregistrována v posledních několika letech.
Mezi dříve zaregistrované přípravky, u kterých se v posledních letech intenzivně diskutuje o vhodnosti zavést screeningové vyšetření před léčbou, patří tamoxifen. Tamoxifen je proléčivo vyžadující ke své bioaktivaci cytochrom P450 2D6, jež je známý svým extenzivním polymorfismem v naší populaci. Existuje řada prací, které ukazují, že u pacientek s částečným nebo úplným deficitem této metabolické cesty je účinnost tohoto léčiva snížená (11). Přestože prozatím není dostatek prospektivních dat z řádně naplánovaných studií, některá zahraniční pracoviště začala tento cytochrom rutinně vyšetřovat před zahájením léčby. Podobně nejsou ani žádná velmi průkazná data o vlivu inhibitorů CYP2D6 na účinnost tamoxifenu. Z obecných principů lze usuzovat, že taková komedikace není vhodná a toto doporučení je také podporováno i regulačními autoritami, které postupně zpřísňují texty v SPC v tomto ohledu.
Objasnění příčiny nežádoucích účinků nebo neúčinnosti léčiva
Kromě optimálního preventivního vyšetření před zahájením léčby se často provádějí farmakogenetická vyšetření u pacientů, u kterých již byla léčba nasazena, ale objevila se neočekávaná odpověď na podávanou léčbu. Tou bývá jak selhání účinku, tak i výskyt nežádoucích reakcí. V těchto případech se většinou pátrá po variabilitě cytochromu P450. Poměrně velké množství studií je například publikováno o vztahu polymorfismu cytochromu P450 2D6 a farmakokinetice antidepresiv a neuroleptik. Jsou také známé příklady, kdy u ultrarychlých metabolizátorů dochází při běžném dávkování k selhání léčby, zatímco u pomalých metabolizátorů se mnohem častěji u pacientů vyskytují nežádoucí účinky (12–14). Byly také publikovány farmakokinetické modely pro antidepresiva, podle kterých by měla být pro pacienty s různou aktivitou cytochromu P450 upravována dávka podle genotypu, ale tento postup nebyl nikdy úspěšně ověřen terapeutickou studií (15, 16). Naproti tomu stanovením genotypu u pacientů s problematickou odpovědí na léčbu umožňuje u některých jedinců identifikovat příčinu atypické odpovědi a může být přínosné pro stanovení další volby léčby.
Závěr
Personalizovaná medicína se nyní dostává do praxe, zejména v oblasti protinádorové léčby, což je způsobeno nejen charakterem vlastního onemocnění, ale také úzkým terapeutickýcm oknem protinádorové léčby a relativní hodnotou poměru rizika ku prospěchu u těchto látek. Farmakogenetika se však začíná prosazovat i v ostatních terapeutických skupinách léčiv. Regulační lékové agentury nyní podporují klinický farmakogenetický výzkum a řada nových léčiv je registrována s indikačním omezením na základě farmakogenetických dat z klinického vývoje léčiva. Stále však existuje mnoho nezodpovězených otázek ohledně širšího využití prospektivní farmakogenetiky: Jaká je nákladové efektivita personalizované medicíny, je ve většině případů stále velkou neznámou. Jaká bude akceptace lékařů a pacientů pro širší využití takových testů je také otázkou. Na druhou stranu v souladu s požadavky medicíny založené na důkazech by tyto postupy měly být používány vždy, pokud k jejich použití důkazy jsou. Pro většinu léčiv však přesvědčivé farmakogenetické důkazy zatím chybí a bude třeba ještě mnoho úsilí taková data prostřednictvím validních studií získat.
Zkratky
CYP2C9 – cytochrom P 450 2C9
CYP2C19 – cytochrom P 450 2C19
CYP2D6 – cytochrom P 450 2D6
HER2 – receptor2 lidského epidermálního růstového faktoru
HLA-B – hlavní histokompatibilní systém, třída I.B
EGFR – receptor epidermálního růstového faktoru
FDA – Food and Drug Administration
INR – Mezinárodní normalizovaný poměr protrombinového času
KRAS – onkogen ze skupiny RAS proteinů (Kirsten rat sarcoma oncogene homolog)
Ph+CML – filadelfský chromozom
TPMT – thiopurin S-metyltransferáza
UGT1A1 – uridindifosfát glukuronyltranferáza 1A1
VKORC – vitamin K-epoxidreduktáza
Práce vznikla za podpory VZ MSM 0021620849 a VZ MSM 0021620820.
Adresa pro korespondenci:
doc. MUDr. Ondřej Slanař, Ph.D.
Oddělení klinické farmakologie, Farmakologický ústav 1. LF UK
Na Bojišti 1, 120 00 Praha 2
e-mail: oslan@lf1.cuni.cz
Sources
1. Cascorbi I. The promises of personalized medicine. Eur J Clin Pharmacol 2010; 66(8): 749–754.
2. Mallal S, Phillips E, Carosi G, et al. HLA-B*5701 screening for hypersensitivity to abacavir. N Engl J Med 2008; 358(6): 568–579.
3. Slanar O, Bortlik M, Buzkova H, et al. Polymorphisms of the TPMT gene in the Czech healthy population and patients with inflammatory bowel disease. Nucleosides Nucleotides Nucleic Acids 2008; 27(6): 835–838.
4. Slanar O, Chalupna P, Novotny A, et al. Fatal myelotoxicity after azathioprine treatment. Nucleosides Nucleotides Nucleic Acids 2008; 27(6): 661–665.
5. Zhou S. Clinical pharmacogenomics of thiopurine S‑methyltransferase. Curr Clin Pharmacol 2006; 1(1): 119–128.
6. Caraco Y, Blotnick S, Muszkat M. CYP2C9 genotype-guided warfarin prescribing enhances the efficacy and safety of anticoagulation: a prospective randomized controlled study. Clin Pharmacol Ther 2008; 83(3): 460–470.
7. D‘Andrea G, D‘Ambrosio RL, Di Perna P, et al. A polymorphism in the VKORC1 gene is associated with an interindividual variability in the dose-anticoagulant effect of warfarin. Blood 2005; 105(2): 645–649.
8. Klein TE, Altman RB, Eriksson N, et al. Estimation of the warfarin dose with clinical and pharmacogenetic data. N Engl J Med 2009; 360(8): 753–764.
9. Ho PM, Maddox M, Wang L, et al. Risk of adverse outcomes associated with concomitant use of clopidogrel and proton pump inhibitors following acute coronary syndrome. JAMA 2009; 301(9): 937–944.
10. Mega JL, Close SL, Wiviott SD, et al. Cytochrome p-450 polymorphisms and response to clopidogrel. N Engl J Med 2009; 360(4): 354–362.
11. Higgins MJ, Stearns V. CYP2D6 polymorphisms and tamoxifen metabolism: clinical relevance. Curr Oncol Rep 12(1): 7–15.
12. Laika B, Leucht S, Heres S, et al. Intermediate metabolizer: increased side effects in psychoactive drug therapy. The key to cost-effectiveness of pretreatment CYP2D6 screening? Pharmacogenomics J 2009; 9(6): 395–403.
13. Sjoqvist F, Eliasson E. The convergence of conventional therapeutic drug monitoring and pharmacogenetic testing in personalized medicine: focus on antidepressants. Clin Pharmacol Ther 2007; 81(6): 899–902.
14. Zackrisson AL, Lindblom B, Ahlner J. High Frequency of Occurrence of CYP2D6 Gene Duplication/Multiduplication Indicating Ultrarapid Metabolism Among Suicide Cases. Clin Pharmacol Ther 2010; in press.
15. Kirchheiner J, Brosen K, Dahl ML, et al. CYP2D6 and CYP2C19 genotype-based dose recommendations for antidepressants: a first step towards subpopulation-specific dosages. Acta Psychiatr Scand 2001; 104(3): 173–192.
16. Seeringer A, Kirchheiner J. Pharmacogenetics-guided dose modifications of antidepressants. Clin Lab Med 2008; 28(4): 619–626.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental HygienistArticle was published in
Journal of Czech Physicians

- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
-
All articles in this issue
- Role patologie v prediktivní onkologii solidních nádorů
- Problematika personalizované medicíny v hematoonkologii – pohled patologa
- Dědičné trombofilie – doporučení k provádění genetických testů v klinické praxi
- Farmakogenetické aspekty současné medikamentózní léčby
- Farmakogenetika v léčbě kardiovaskulárních chorob aneb léčba podle guidelines či podle potřeb nemocného?
- Význam TDM, fenotypizace a genotypizace pro správné dávkování léčiv
- Journal of Czech Physicians
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Význam TDM, fenotypizace a genotypizace pro správné dávkování léčiv
- Dědičné trombofilie – doporučení k provádění genetických testů v klinické praxi
- Farmakogenetické aspekty současné medikamentózní léčby
- Farmakogenetika v léčbě kardiovaskulárních chorob aneb léčba podle guidelines či podle potřeb nemocného?
