Nová metoda semikvantitativního hodnocení 123I-MIBG u neuroblastomu – výpočet celkového retenčního skóre
New method for semiquantitative evaluation of 123I-MIBG in neuroblastoma – calculation of total retention score
Introduction:
Semiquantitative evaluation of 123I-MIBG accumulation in pediatric neuroblastoma make it possible to quantify answer to therapy and to assess prognosis – ability to achieve complete remission. Semiquantitative scores Curie and SIOPEN are mostly used nowadays. Japanese authors introduced a new method in 2012; it is based on the calculation of total retention score (TMRR). We evaluated this method in our department.
Material and methods:
We evaluated retrospectively 10 patients (5 boys, 5 girls, age 0 to 7 years); we performed 20 examinations with time interval of 2 to 12 months between initial and follow-up examination. Planar whole-body images were performed 4 and 24 hours after injection of 123I-MIBG. Total retention score based on total whole body counts was calculated for all images and compared to Curie and SIOPEN scores.
Results:
We detected decline of TMRR (on average 8,11 %) in 6/10 pts. Decline of Curie score was on average 50,76 % and SIOPEN score 56,23 % in these patients. Two pts had increase level of TMRR, effect of therapy was minimal, their finding did not almost change. Last two pts had also increase of TMRR even if Curie and SIOPEN scores declined significantly.
Conclusion:
Based on our resluts we believe that the proposed method calculating total retention score in evaluation of 123I-MIBG accumulation in padiatric neuroblastoma can serve only as a complementary method and cannot replace current semiquantitative methods.
Key words:
neuroblastoma, 123I-MIBG, quantification
:
Igor Černý; Jiří Prášek; Helena Kašpárková
:
Klinika nukleární medicíny, Masarykova Univerzita a FN Brno
:
NuklMed 2014;3:62-66
:
Original Article
Úvod:
Semikvantitativní hodnocení akumulace 123I-MIBG u neuroblastomu umožňuje kvantifikovat odpověď na terapii a odhadnout prognózu pacienta – schopnost dosáhnout kompletní remise. V současné době jsou nejpoužívanější semikvantitativní hodnocení Curie a SIOPEN. V roce 2012 japonští autoři představili novou metodu založenou na výpočtu celkového retenčního skóre (TMRR). Tuto metodu jsme testovali na našem pracovišti.
Materiál a metody:
Hodnocení touto metodou jsme provedli retrospektivně u 10 našich pacientů (věk 0–7 let, 5 chlapců, 5 dívek), celkem 20 vyšetření, interval mezi opakovanými vyšetřeními 2–12 měsíců. Bylo provedeno planární snímání po 4 a 24 hodinách od aplikace, vypočítán celotělový počet impulzů z každého snímání a stanoveno celkové retenční skóre. Hodnoty jsme porovnali s metodou Curie a SIOPEN.
Výsledky:
U 6 pacientů z 10 jsme zaznamenali pokles TMRR v průměru o 8,11 %. U těchto pacientů byl průměrný pokles skóre u metody Curie 50,76 % a u metody SIOPEN 56,23 %. U dvou pacientů jsme zaznamenali nárůst hodnoty TMRR, tito pacienti byli s velmi malým či sporným efektem terapie, nález se prakticky nezměnil. U dalších dvou rovněž došlo ke zvýšení hodnoty TMRR, přestože hodnocení metodou Curie i SIOPEN bylo s výrazným poklesem.
Závěr:
Metoda výpočtu celkového retenčního skóre akumulace 123I-MIBG u neuroblastomu je pouze doplňkovou metodou, která nemůže nahradit dosavadní semikvantitativní metody.
Klíčová slova:
neuroblastom, 123I-MIBG, kvantifikace
Úvod
Scintigrafické vyšetření pomocí 123I-MIBG se v nukleární medicíně používá od roku 1981. První indikace byla detekce nádorů nadledvin, později se 123I-MIBG začal využívat pro diagnostiku neuroblastomu a neuroendokrinních nádorů. Sensitivita vyšetření je 88 %, specificita 83 %. 1 V současné době je to základní metoda pro iniciální staging onemocnění a sledování efektu terapie. 2
Velký význam má semikvantitativní hodnocení. Existuje několik schémat, která se liší v počtu hodnocených segmentů, kvantifikační stupnicí a tím, zda se do hodnocení zahrnují i měkké tkáně nebo jen skelet. 3 V roce 2012 kolektiv japonských autorů představil novou semikvantitativní metodu, která je založena na výpočtu celkového retenčního skóre (TMRR – Total MIBG Retention Ratio) 123I-MIBG. 4 Cílem naší práce bylo otestovat tuto metodu v podmínkách našeho pracoviště.
Materiál a metody
Hodnocení touto metodou jsme provedli retrospektivně u 10 našich pacientů (věk 0–7 let, 5 chlapců, 5 dívek), celkem 20 vyšetření, pacienti hodnoceni od roku 2009, interval mezi opakovanými vyšetřeními 2–12 měsíců. Do studie jsme zařadili pouze pacienty s difuzním postižením před zahájením terapie (Obr. 1).
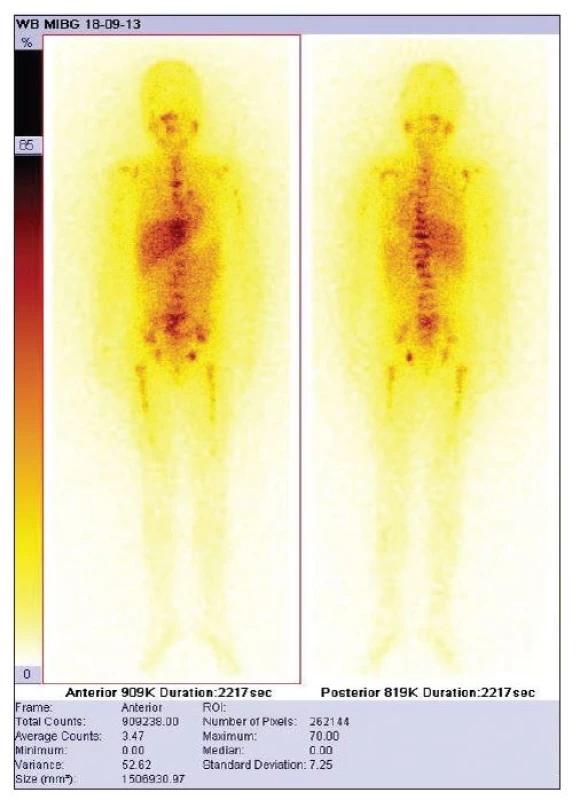
V naší studii jsme vyšetření prováděli na přístroji Siemens Symbia T2, bylo provedeno planární snímání po 4 a 24 hodinách od aplikace s parametry snímání matice 256x1024 pixelů, posun lůžka 6 cm za minutu. Přední a zadní celotělové snímky byly snímány první den 4–5 hodin po aplikaci, druhý den 24–30 hodin po aplikaci se zapnutím autocontouringu. Aplikovaná aktivita vycházela z DRU 400 MBq s přepočtem na váhu pacienta dle tabulky EANM. Byl vypočítán celotělový počet impulzů z každého snímání a stanoveno celkové retenční skóre (TMRR) podle vzorce:
Jako oblast zájmu se vybere celé tělo pacienta, zaslepí se oblast močového měchýře, eventuálně extravazální aplikace (Obr. 2). Korelaci s laboratorními onkologickými markery jsme neprováděli, protože ne všichni pacienti měli v dané době provedeny odběry, studii jsme prováděli retrospektivně.
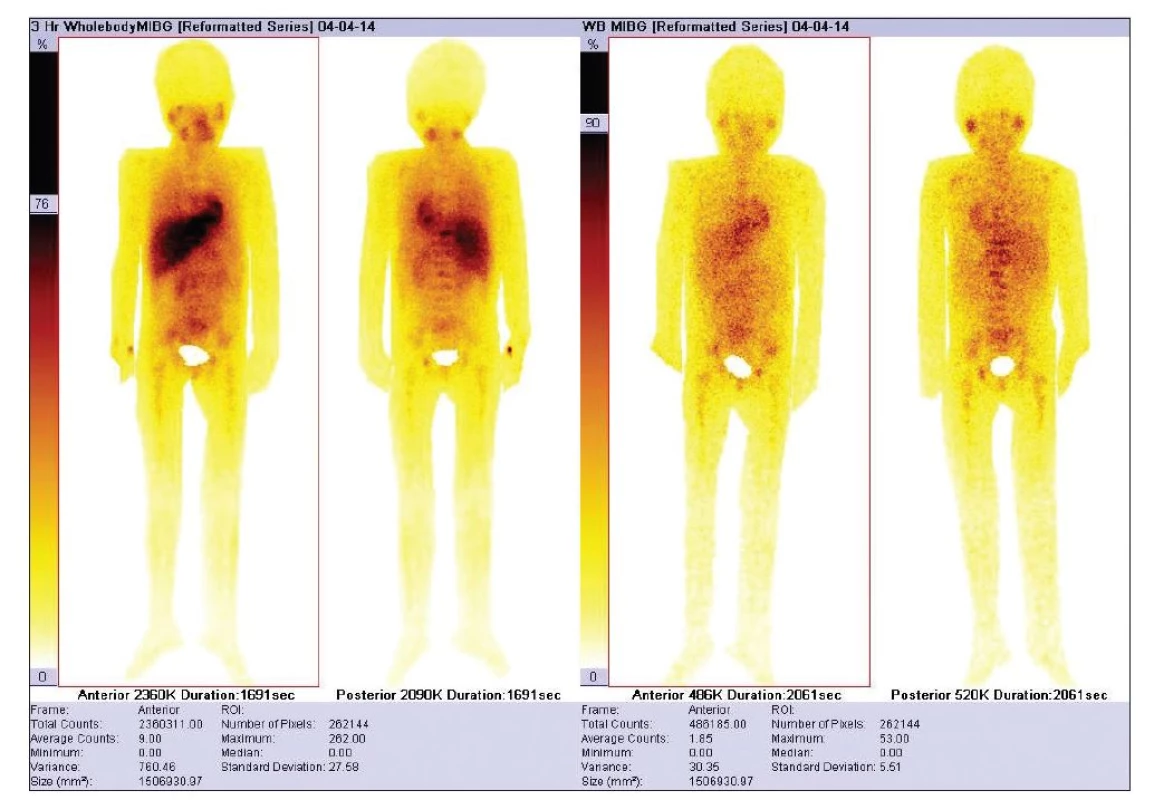
Zjištěné hodnoty TMRR jsme porovnali s metodou Curie a SIOPEN.
Výsledky
Hodnota TMRR se pohybovala v rozmezí 0,66–1,14, průměrná hodnota byla 0,936. Průměrná hodnota TMRR před léčbou byla 0,935, po léčbě 0,937.
U 6 pacientů z 10 jsme zaznamenali pokles TMRR v průměru o 8,11 %. U těchto pacientů byl průměrný pokles skóre u metody Curie 50,76 % a u metody SIOPEN 56,23 %. U dvou pacientů jsme zaznamenali nárůst hodnoty TMRR, tito pacienti byli s velmi malým či sporným efektem terapie, nález se prakticky nezměnil. U dalších dvou rovněž došlo ke zvýšení hodnoty TMRR, přestože hodnocení metodou Curie i SIOPEN bylo s výrazným poklesem.
Do naší studie jsme vybrali jak pacienty s minimálním efektem léčby (4 pacienti), tak pacienty s dobrou reakcí na terapii (6 pacientů). V podskupině pacientů s minimálním efektem terapie vidíme u dvou pacientů pokles hodnoty TMRR
v souladu s poklesem skóre u metody Curie a SIPOPEN. U dvou pacientů je naopak nárůst hodnoty TMRR v protikladu s poklesem skóre u metod Curie (pokles Extensity score) a SIOPEN. V jednom případě tento nárůst je dán nejspíše větším objemem metabolicky aktivní nádorové tkáně – u hodnocení metodou Curie je zde vyšší hodnota skóre hodnotící intenzitu vychytávání, je to tedy v souladu s hodnocením Curie. V druhém případě nejsme schopni rozhodnout, zda zvýšení hodnoty TMRR po terapii je dáno nárůstem metabolicky aktivní tkáně nádoru či arteficiální chybou (Tab. 1).
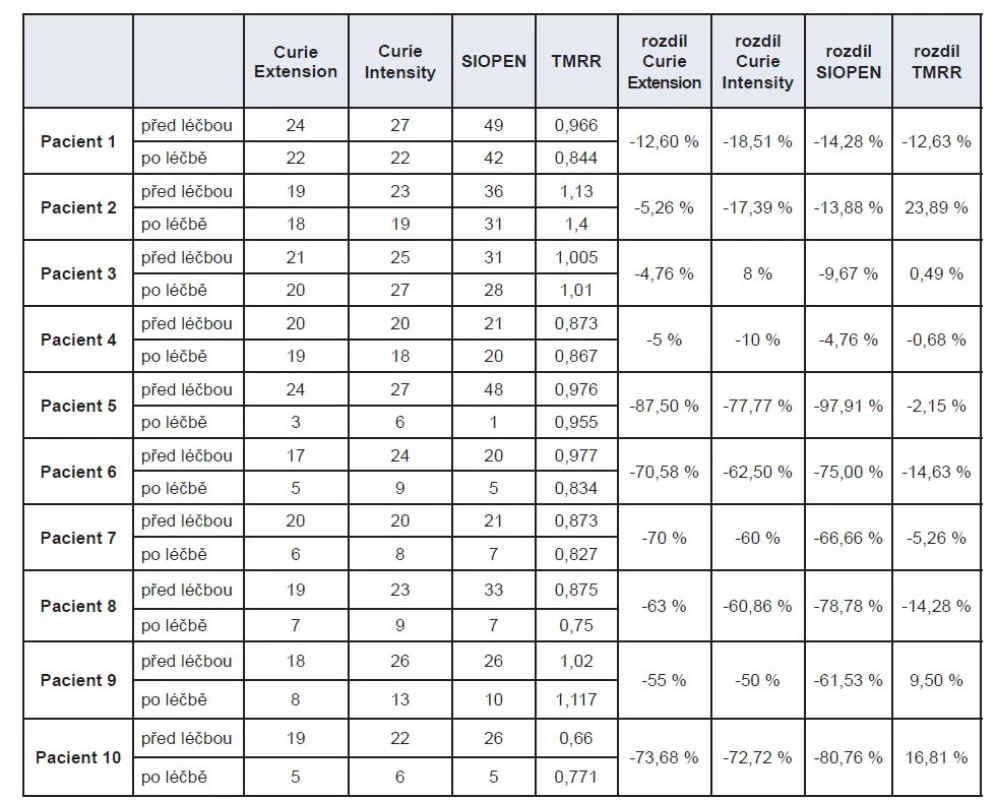
V druhé podskupině pacientů s jasným poklesem hodnoty skóre u metody Curie a SIOPEN ve 4 případech vidíme pokles hodnot po léčbě jak u TMRR, tak u metod Curie a SIOPEN. U zbývajících dvou pacientů pozorujeme nárůst hodnoty TMRR oproti poklesu skóre u metod Curie a SIOPEN. Zde podle nás se jedná o arteficiální chybu. Oba pacienti měli v prvním snímání naplněný močový měchýř, který jsme při hodnocení zaslepovali. Při druhém snímání měli již močový katetr a nebylo potřeba žádnou oblast zaslepovat. Tím byl počítán počet impulzů z větší plochy než v prvním snímání před terapií.
Diskuse
Maligní onemocnění u dětí tvoří jen asi 1 % ze všech malignit ve vyspělých zemích, ale na rozdíl od pacientů dospělého věku je druhým nejčastějším důvodem úmrtí u dětí do 15 let věku. Neuroblastom je nejčastější extrakraniální nádor v dětském věku, tvoří asi 7 % z dětských malignit do 15 let věku a odpovídá za 15 % úmrtí dětí na maligní nádory. 5
Etiologie neuroblastomu je stále neznámá. Diskutuje se vliv toxických látek, kterým jsou ženy vystaveny v těhotenství (kouření, alkohol, některé typy kosmetiky obsahující těžké kovy), ale průkazné tyto vlivy zatím nejsou. Existuje i familiární, dědičná forma neuroblastomu, která je však velmi vzácná. Pozitivní rodinná anamnéza se vyskytuje asi v 1,4 % případů. 6
Neuroblastom vychází z nediferencovaných nezralých buněk sympatického nervového systému. V důsledku toho se může vyskytovat prakticky kdekoliv v oblasti sympatického nervového systému. Nejčastější lokalizací neuroblastomu je dutina břišní (65 % výskytu), zde téměř polovina nádorů je adrenální. Další lokalizace jsou zejména oblasti hrudníku, pánve, krku. 7
V současné době se v semikvantitativním hodnocení akumulace 123I-MIBG u neuroblastomu používají nejčastěji dvě schémata, schéma Curie 8 a SIOPEN. 9 Rozdíl v obou metodách je v jiném rozdělení tělních segmentů a v jiném bodování patologických ložisek (Obr. 3). Hlavní rozdíl ale představuje hodnocení měkkých tkání. V systému Curie tvoří měkké tkáně samostatný tělní segment, v systému SIOPEN měkké tkáně hodnoceny nejsou. 10
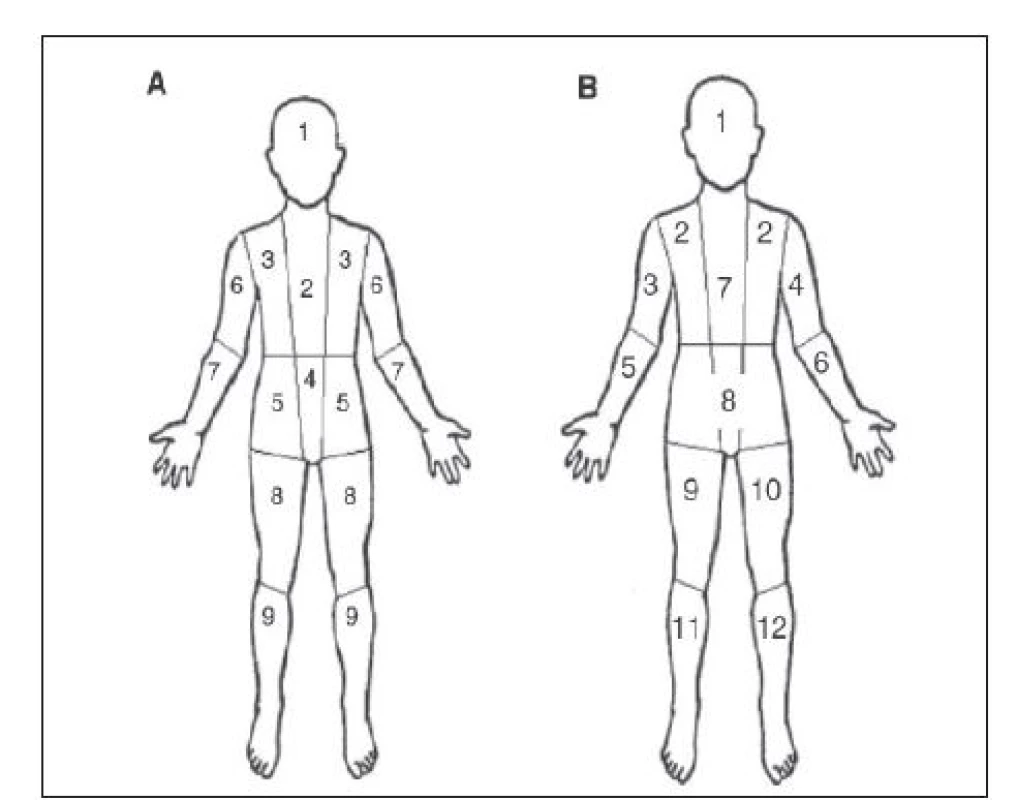
V roce 2012 kolektiv japonských autorů představil novou semikvantitativní metodu, která je založena na výpočtu TMRR 123I-MIBG. 4 Důvodem pro zavedení nové metody je specifická skupina pacientů, kteří po indukční chemoterapii mají výrazný pokles onkomarkerů, ale hodnota skóre u metody Curie se nemění nebo jen velmi málo. Základní myšlenkou nové metody je fakt, že patologická ložiska jsou lépe detekovatelná na pozdních skenech po 24–30 hodinách oproti časným skenům po 4–6 hodinách. To je dáno vyšším rozdílem kontrastu patologicky zvýšené a fyziologické akumulace na pozdních skenech. Autoři předpokládají, že změna v celkovém retenčním skóre před chemoterapií a po ní koresponduje se změnou velikosti aktivní nádorové tkáně. Základním předpokladem je difuzní metastatické postižení, tuto metodu nelze použít u solitárních ložisek.
Ve své studii japonští autoři hodnotili 13 dětských pacientů s neuroblastomem ve stádiu M dle INRGSS (International Neuroblastoma Risk Group Staging System). Aplikovali aktivitu 37–90 MBq na pacienta, první snímání probíhalo v čase 5–7,5 hodiny po aplikaci, druhé 24,5–33,5 hodin od aplikace. Parametry snímání: přední a zadní celotělové snímky, rychlost posunu lůžka 7 cm/min, matice 256x1024 pixelů, použitá kamera PRISM 2000XP a PRISM-IRIX.
Současně s výpočtem TMRR japonští autoři stanovili i skóre metodou Curie. Následně srovnávali hodnoty TMRR, Curie a hladinu katecholaminů v moči. Výsledkem bylo zjištění, že změna TMRR před chemoterapií a po ní koreluje velmi dobře se změnou hladiny katecholaminů (p<0,0001), zatímco hodnota Curie skóre velmi špatně (p=0,697). Důvodem této nízké korelace je situace, kdy rozsah ložisek před chemoterapií a po ní se nemění, Curie skóre zůstává stejné, je však nižší intenzita vychytávání 123I-MIBG – známka nižší metabolické aktivity nádoru. Při snížení celkového množství metabolicky aktivní nádorové tkáně dochází samozřejmě k poklesu hladiny metabolických odpadů v moči, který ale není provázen poklesem Curie skóre. 4
Semikvantitativní hodnocení akumulace 123I-MIBG u neuroblastomu bylo zavedeno pro možnost kvantifikace odpovědi na terapii a pro možnost odhadnout prognózu onemocnění. Některé studie ukazují, že již hodnota Curie skóre >4 je asociována s neúspěšností dosáhnout celkové remise po indukční terapii. 11 Dosavadní jednotlivá semikvantitativní schémata se liší jen způsobem hodnocení, nikoliv svým základním principem. Mají velmi dobrou shodu mezi hodnotiteli, metody Curie je shoda mezi 92–95 %. 12, 3 Semikvantitativní hodnocení metodou Curie na konci indukční terapie dobře koreluje s celkovou odpovědí a dobou přežití pacientů. Podobné údaje vykazuje i hodnocení metodou SIOPEN (shoda mezi hodnotiteli 95 %). 9 Pro zhodnocení odezvy terapie se vypočítává relativní skóre jako poměr bodového hodnocení před zahájením indukční terapie a po jejím ukončení. Hodnota relativního skóre 0,5 je známkou částečné odpovědi na terapii a skóre 0 znamená kompletní odpověď na indukční léčbu.
U všech metod existuje řada úskalí, kterých si musí být vědom jak hodnotitel, tak klinik. Jedním z úskalí je situace, kdy po indukční terapii nedojde ke změně rozsahu postižení neuroblastomem, ale jen ke snížení objemu aktivní tumorózní tkáně. Tento stav se v hodnocení metodou Curie projeví změnou ve skóre intenzity vychytávání. Hodnocení intenzity je však poměrně subjektivní a u metody SIOPEN pak chybí zcela. Hodnota relativního skóre je pak nadhodnocená a skutečný stav je lepší, než indikuje relativní skóre. Pro tuto situaci zavedli japonští kolegové výpočet TMRR. Relativní retenční skóre, jako hodnota před zahájením indukční terapie a po jejím ukončení, nám dává informaci o změně množství metabolicky aktivní nádorové tkáně. 4 Hodnota TMRR díky principu výpočtu neumožňuje srovnání výsledků u různých pacientů na rozdíl od metody Curie a SIOPEN. Srovnávat má význam pouze rozdíl TMRR před chemoterapií a po ní.
Závěr
Metoda stanovení celkového retenčního skóre má tedy také svá úskalí. Je třeba pečlivě definovat oblast zájmu, což někdy nemusí být technicky snadné a rychlé. Rovněž případná extravazální aplikace, zbytek radiofarmaka v oblasti aplikace (port, žilní kanyla) může znesnadnit tvorbu oblasti zájmu. Problém může být rovněž příliš naplněný močový měchýř, kdy se zaslepuje relativně velká oblast těla, což má výrazný vliv na hodnotu TMRR. Doporučujeme tedy snímat pacienty se zavedeným močovým katétrem. Metoda má své limitace. Nelze ji použít u drobných či solitárních ložisek, ale pouze u pacientů s difuzním postižením. Problémem může být i dodržet stejnou polohu pacienta při opakovaném snímání.
Metoda výpočtu TMRR 123I-MIBG je pouze doplňkovou metodou, která nemůže nahradit dosavadní semikvantitativní metody. V přesně definovaných situacích však může být pomocným ukazatelem úspěšnosti chemoterapie. Touto situací je stav, kdy se zmenšuje metabolicky aktivní, viabilní nádorová tkáň beze změny rozsahu postižení a tím beze změny Curie či SIOPEN skóre. Díky vysoké korelaci s hladinami katecholaminů v moči dostává onkolog relevantní informaci o efektu chemoterapie. Je však třeba pečlivě vybrat vhodné pacienty pro toto hodnocení a to nejen z hlediska postižení, ale i kvality snímků, jakékoliv artefakty mohou výrazně hodnocení ovlivnit.
Igor Černý, Jiří Prášek, Helena Kašpárková
Klinika nukleární medicíny, Masarykova Univerzita a FN Brno
icerny@fnbrno.cz
Sources
1. Vik TA, Pfluger T, Kadota R et al. 123I-MIBG scintigraphy in patients with known or suspected neuroblastoma: Results from a prospective multicenter trial. Pediatr Blood Cancer 2009;52 : 784–790
2. Kushner BH, Yeh SD, Kramer K et al. Impact of metaiodobenzylguanidine scintigraphy on assessing response of high-risk neuroblastoma to dose-intensive induction chemotherapy. J Clin Oncol 2003;21 : 1082–1086
3. Messina JA, Cheng SC, Franc Bl et al. Evaluation of semi-quantitative scoring system for metaiodobenzylguanidine (MIBG) scans in patients with relapsed neuroblastoma. Pediatr Blood Cancer 2006;47 : 865–874
4. Sano Y, Okuyama C, Iehara T et al. New semi-quantitative 123I-MIBG estimation method compared with scoring system in follow-up of advanced neuroblastoma: utility of total MIBG retention ratio versus scoring method. Ann Nucl Med 2012;26 : 462–470
5. Brodeur GM. Neuroblastoma – biological insights into a clinical enigma. Nat Rev Cancer 2003;3 : 203–216
6. Mazánek P, Bajčiová V, Šterba J et al. Novinky v diagnostice a léčbě neuroblastomu. Onkológia 2008;3 : 257–261
7. Maris JM, Hogarty MD, Bagatell R et al. Neuroblastoma. Lancet 2007;369 : 2106–2120
8. Ady N, Zucker JM, Asselain B et al. A new 123I-MIBG whole body scan scoring method - application to the prediction of the response of metastases to induction chemotherapy in stage IV neuroblastoma. Eur J Cancer 1995;31A:256–261
9. Lewington V, Bar Sever Z, Lynch T et al. Development of a new, semi-quantitative I-123 MIBG reporting method in high risk neuroblastoma. Eur J Nucl Med Mol Imaging 2009;36S:334(A)
10. Matthay KK, Shulkin B, Ladenstein R et al. Criteria for evaluation of disease extent by 123I-metaiodobenzylguanidine scans in neuroblastoma: a report for the International Neuroblastoma Risk Group (INRG) Task Force. Br J Cancer 2010;102 : 1319–1326
11. Suc A, Lumbroso J, Rubie H et al. Metastatic neuroblastoma in children older than one year: prognostic significance of the initial metaiodobenzylguanidine scan and proposal for a scoring system. Cancer 1996;77 : 805–811
12. Matthay KK, Edeline V, Lumbroso J et al. Correlation of early metastatic response by 123I-metaiodobenzylguanidine scintigraphy with overall response and event-free survival in stage IV neuroblastoma. J Clin Oncol. 2003;21 : 2486–2491
Labels
Nuclear medicine Radiodiagnostics RadiotherapyArticle was published in
Nuclear Medicine

2014 Issue 4
Most read in this issue
- Dynamic esophageal scintigraphy for detection of esophageal motility disorders – practical aspects
- Metastasis into parapharyngeal lymph node in papilary thyroid cancer
- New method for semiquantitative evaluation of 123I-MIBG in neuroblastoma – calculation of total retention score

