Intrahepatálna cholestáza gravidných a liečba kyselinou ursodeoxycholovou
Intrahepatic cholestasis of pregnancy and treatment with ursodeoxycholic acid.
Intrahepatic cholestasis of pregnancy (ICP) is a disease characterized by generalized pruritus and biochemical signs of cholestasis that appears typically during the last trimester of gestation. Despite that this is essentially benign ilness for the mother, evidence associates ICP with fetal poor prognosis resulting from increased transfer of bile acids from mother to fetus. Those conditions lead to an accumulation of bile acids in amniotic fluid which may account for a diminished state of fetal well‑being and sudden intra-uterine death by ICP. One of the most predictive and accurate markers for diagnosis and follow‑up of ICP is increasing total bile acid levels. Ursodeoxycholic acid (UDCA) treatment was shown to reduce the toxic bile acid content in the fetal compartment, while decreasing bile acid levels in maternal serum and its passage to the fetus. We observed the levels of total serum bile acid, alanine aminotransferase (ALP), aspartate aminotransferase (AST), alkaline phosphatase (ALP), gammaglutamyl transferase (GMT) and bilirubin during pregnancy in women with diagnosis of ICP. Serum levels of bile acids were determined enzymatically with commercial diagnostic kit BILE ACIDS kit 450-A (SIGMA Chemicals, USA). In 83,38 % of patients the level of total bile acids was between 11 and 40 μmol. l-1 (milder form of intrahepatic cholestasis of pregnancy) on average with double increase of the bile acids compared to control group. In remaining 16,62 % the level of total bile acids was higher than 40 μmol . l-1 (heavier form of intrahepatic cholestasis of pregnancy) on average with 10 times increase of the bile acids compared to control group. From the examined parameters, examination of the level of total bile acids proved statistically most important differences between heavier form of ICP and milder form of ICP, as well as with their comparison with the control group. Bilirubine levels showed statistically important difference between heavier and milder form, heavier form and control group, however not between the control group and milder form of the illness, while they moved in range of normal values. ALP and GMT values did not show statistically important differences between heavier and milder form of the illness and likewise, not even between the control group and milder form of ICP. ALP values were statistically importantly different only between heavier form of the illness and control group. AST and ALT values showed statistically important difference between heavier form of the illness and control group, as well as between control group and milder form of the illness but not between milder form and heavier form of the illness. Administration of UDCA was well tolerated and it was shown that the concentration of total bile acid had decreasing trend after UDCA administration. After UDCA administration there was also decrease of aminotransferases (ALT, AST) and we confirmed the beneficial effect on other investigated parameters as well (Tab. 1, Scheme 1, Ref. 20).
Key words:
intrahepatic cholestasis of pregnancy – treatment with ursodeoxycholic acid – preliminary report
:
V. Kupčová; L. Turecký 1; K. Plank 2 3
:
III. interná klinika LF UK a FNsP akad. Dérera
1; Ústav lekárskej chémie, biochémie a klinickej biochémie LF UK
2; Gynekologicko‑pôrodnícka klinika SZU, Bratislava
3
:
Prakt Gyn 2009; 13(2): 99-105
Intrahepatálna cholestáza gravidných (ICP) je ochorenie charakterizované generalizovaným pruritom a biochemickými znakmi cholestázy, ktorá sa objavuje typicky v poslednom trimestri gravidity. Napriek tomu, že ide v podstate o benígne ochorenie pre matku, existujú dôkazy súvislosti ICP so zlou prognózou pre plod, nakoľko nastáva zvýšenie prechodu žlčových kyselín z matky do plodu. Tento stav vedie k akumulácii žlčových kyselín v amniotickej tekutine, čo môže viesť k zhoršeniu stavu plodu a náhlemu úmrtiu plodu pri ICP. Jedným z najpresnejších a najviac prediktívnych markerov pre diagnózu a sledovanie ICP je zvýšenie hladiny celkových žlčových kyselín. Zistilo sa, že liečba pomocou ursodeoxycholovej kyseliny (UDCA) znižuje množstvo žlčových kyselín vo fetálnom kompartmente, ďalej znižuje hladinu žlčových kyselín v sére matky a ich pasáž do plodu. Sledovali sme hladiny celkových žlčových kyselín, alanínaminotransferázy (ALP), aspartátaminotransferázy (AST), alkalickej fosfatázy (ALP), gamaglutamyltransferázy (GMT) a bilirubínu počas tehotnosti u žien s diagnózou ICP. Sérové hladiny žlčových kyselín boli stanovované enzymaticky, s použitím diagnostickej súpravy Bile Acids kit 450-A (SIGMA Chemicals, USA). U 83,38 % pacientok hladina celkových žlčových kyselín bola medzi 11 a 40 μmol. l-1 (ľahšia forma intrahepatálnej cholestázy gravidných), v priemere s dvojnásobným zvýšením hladiny žlčových kyselín oproti kontrolnej skupine. U zvyšných 16,62 % bola hladina celkových žlčových kyselín vyššia než 40 μmol. l-1 (ťažšia forma intrahepatálnej cholestázy gravidných), v priemere s desaťnásobným zvýšením hladiny žlčových kyselín oproti kontrolnej skupine. Spomedzi vyšetrovaných parametrov, vyšetrenie hladiny celkových žlčových kyselín preukázalo štatisticky najvýznamnejšie rozdiely medzi ťažšou formou ICP a ľahšou formou ICP, ako aj ich porovnaním s kontrolnou skupinou. Hodnoty bilirubínu vykazovali štatisticky významný rozdiel medzi ťažšou a ľahšou formou, ťažšou formou a kontrolnou skupinou, avšak nie medzi kontrolnou skupinou a ľahšou formou ochorenia, pričom sa pohybovali v pásme normálnych hodnôt. Hodnoty ALP a GMT nevykazovali štatisticky významné rozdiely medzi ťažšou a ľahšou formou ochorenia, a podobne ani medzi kontrolnou skupinou a ľahšou formou ICP. Hodnoty ALP boli štatisticky významne rozdielne len medzi ťažšou formou ochorenia a kontrolnou skupinou. Hodnoty AST a ALT vykazovali štatisticky významný rozdiel medzi ťažšou formou ochorenia a kontrolnou skupinou, aj medzi kontrolnou skupinou a ľahšou formou ochorenia, avšak nie medzi ľahšou a ťažšou formou ochorenia. Podávanie UDCA bolo dobre tolerované, koncentrácia celkových žlčových kyselín mala po podaní UDCA klesajúci trend. Po podávaní UDCA nastáva aj zníženie aminotransferáz (ALT, AST), potvrdili sme pozitívny účinok UDCA aj na ostatné vyšetrované parametre (tab. 1, graf 1, lit. 20).
Kľúčové slová:
intrahepatálna cholestáza v gravidite – liečba kyselinou ursodeoxycholovou – predbežné výsledky
Intrahepatálna cholestáza gravidných sa objavuje najčastejšie v posledných troch mesiacoch gravidity, resp. predominantne koncom druhého a začiatkom tretieho trimestra tehotnosti, môže však niekedy začať už v druhom alebo treťom mesiaci gravidity. Nazýva sa aj cholestatická hepatopatia tehotných, resp. icterus gravidarum. Ochorenie charakterizuje zvýšenie aktivít niektorých hepatálnych enzýmov (alkalická fosfatáza, aminotransferázy), zvýšenie koncentrácie žlčových kyselín v sére tehotných a niekedy aj ikterus [13,18,10]. V najmiernejšej forme je jedinou klinickou abnormalitou svrbenie. Pruritus je prítomný najmä v oblasti dlaní a chodidiel, viac v nočných hodinách, často býva prítomná aj zvýšená únavnosť. Ide teda o ochorenie spojené s cholestázou, ktorá je vo väčšine prípadov klinicky pomerne výrazná (pruritus), biochemicky zreteľná a histologicky môže byť relatívne málo vyjadrená [15,10].
Pacienti a metódy
Sledovali sme hladiny celkových žlčových kyselín (ŽK), alkalickej fosfatázy (ALP), alanínaminotransferázy (ALT), aspartátaminotransferázy (AST), gamaglutamyltranferázy (GMT) a bilirubínu (Bi) v priebehu gravidity u 36 pacientok s intrahepatálnou cholestázou gravidných. Súbor pacientok bol rozdelený podľa hladiny žlčových kyselín na dve skupiny: skupinu s ťažšou formou ICP a ľahšou formou ICP.
Použili sme nasledovné delenie: ľahšia forma intrahepatickej cholestázy (hladina celkových žlčových kyselín medzi 11 a 40 μmol. l-1) a ťažšia forma intrahepatálnej cholestázy gravidných (hladina celkových žlčových kyselín vyššia než 40 μmol. l-1). Ako fyziologická hranica hladiny žlčových kyselín sa používa koncentrácia do 11 μmol/l, ako diskriminačná hranica ľahšej a ťažšej formy bola použitá koncentrácia žlčových kyselín vyššia ako 40 μmol/l [13,15,18]. Pacientky s ICP dostávali ursodeoxycholovú kyselinu v dávke 1000 mg denne. Kontrolný súbor tvorilo 30 tehotných žien bez prítomnosti ICP alebo iného hepatálneho ochorenia.
Hladiny celkových žlčových kyselín boli stanovené enzymaticky s použitím diagnostickej súpravy Bile Acids kit 450-A (SIGMA Chemicals, USA). Metóda je založená na oxidácii žlčových kyselín pomocou 3alfa hydroxysteroid-dehydrogenázy. Ako štandardy sa používali Bile Acids calibrator (SIGMA Chemicals, USA). Štandardne vyšetrované hepatálne vyšetrenia (bilirubín, ALT, AST, GMT a ALP) boli vyšetrované komerčnými diagnostickými súpravami podľa návodu výrobcu. Výsledky boli spracované štatistickým programom Statgraphics.
Výsledky
Z celkového počtu 38 pacientok s ICP bola u 30 z nich (83,3 %) hladina celkových žlčových kyselín medzi 11 a 40 μmol. l-1 (ľahšia forma intrahepatickej cholestázy), u zvyšných 6 pacientok (16,62 %) bola hladina celkových žlčových kyselín vyššia ako 40 μmol. l-1 (ťažšia forma intrahepatálnej cholestázy gravidných). Priemerné hodnoty žlčových kyselín, AST, ALT, ALP, MT a bilirubínu vo vyšetrovanom súbore sú uvedené v tab. 1.
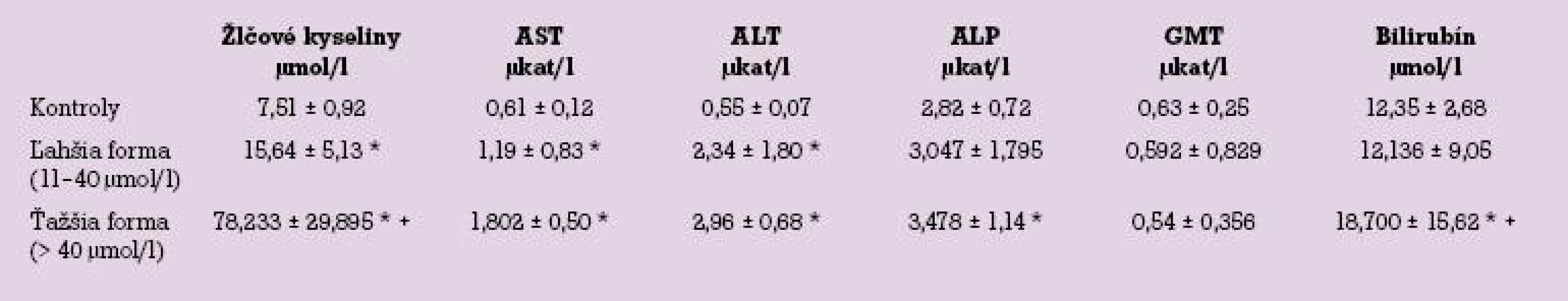
Hladiny žlčových kyselín vykazovali štatisticky významný rozdiel pri porovnaní ťažšej formy ICP oproti kontrolnej skupine, ako aj ľahšej formy ICP oproti kontrolnej skupine. Pri vzájomnom porovnaní ľahšej a ťažšej formy ICP bol medzi hladinou žlčových kyselín taktiež prítomný štatisticky významný rozdiel.
Hodnoty ALP a bilirubínu boli významne vyššie u ťažšej formy ICP oproti kontrolnej skupine, avšak nevykazovali štatisticky významný rozdiel medzi ľahšou formou ICP a kontrolnou skupinou. Pri porovnaní medzi ľahšou a ťažšou skupinou hladiny bilirubínu vykazovali signifikantne vyššie hodnoty u pacientok s ťažšou formou ICP. Hodnoty ALP nevykazovali štatisticky významný rozdiel pri porovnaní medzi skupinou pacientok s ťažšou a ľahšou formou ICP. U pacientok s ťažšou formou ICP bola hladina ALT, AST štatisticky signifikantne zvýšená, v porovnaní s kontrolnou skupinou pacientok bez prítomnej intrahepatálnej cholestázy gravidných. Pri ľahšej forme bola hladina ALT a AST taktiež signifikantne zvýšená oproti kontrolnej skupine. Pri porovnaní medzi ľahšou a ťažšou skupinou však tieto hladiny nevykazovali štatisticky významný rozdiel. Hodnoty GMT neboli štatisticky významne odlišné medzi ťažšou formou ICP a kontrolnou skupinou, ako aj medzi ľahšou formou ICP a kontrolnou skupinou a taktiež neboli štatisticky významne odlišné medzi ťažšou a ľahšou formou ochorenia.
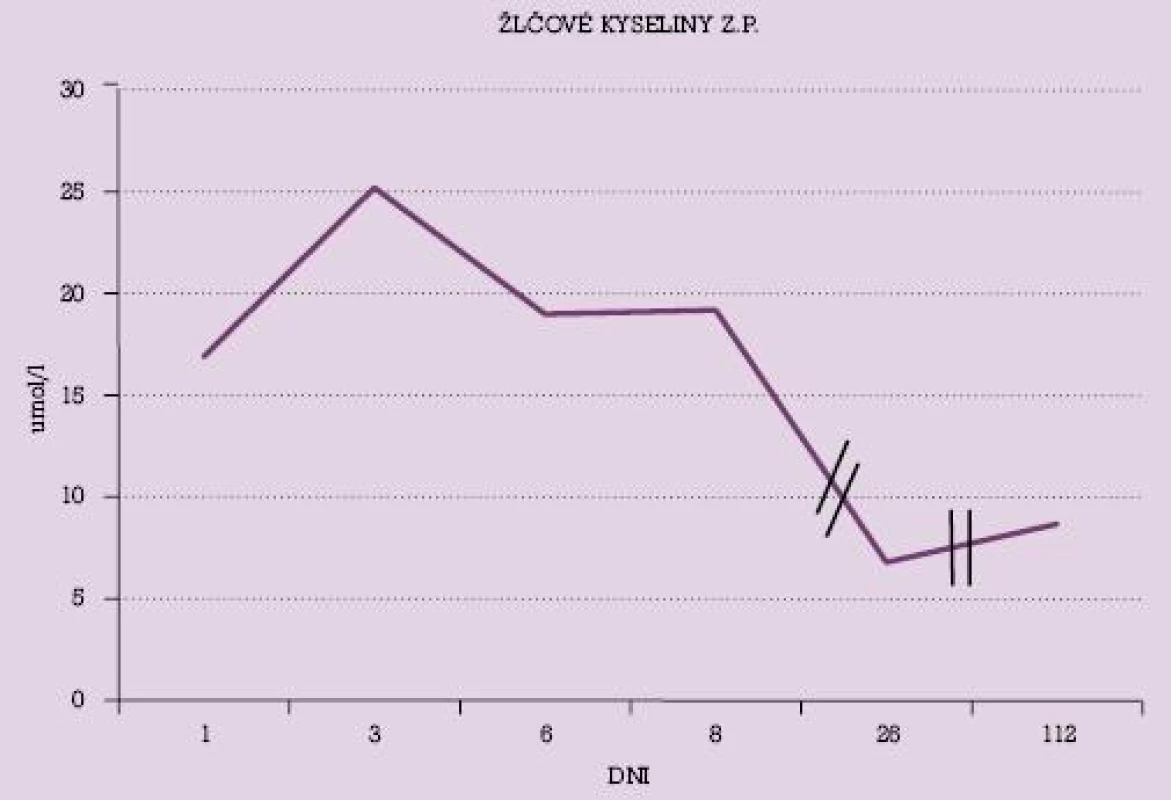
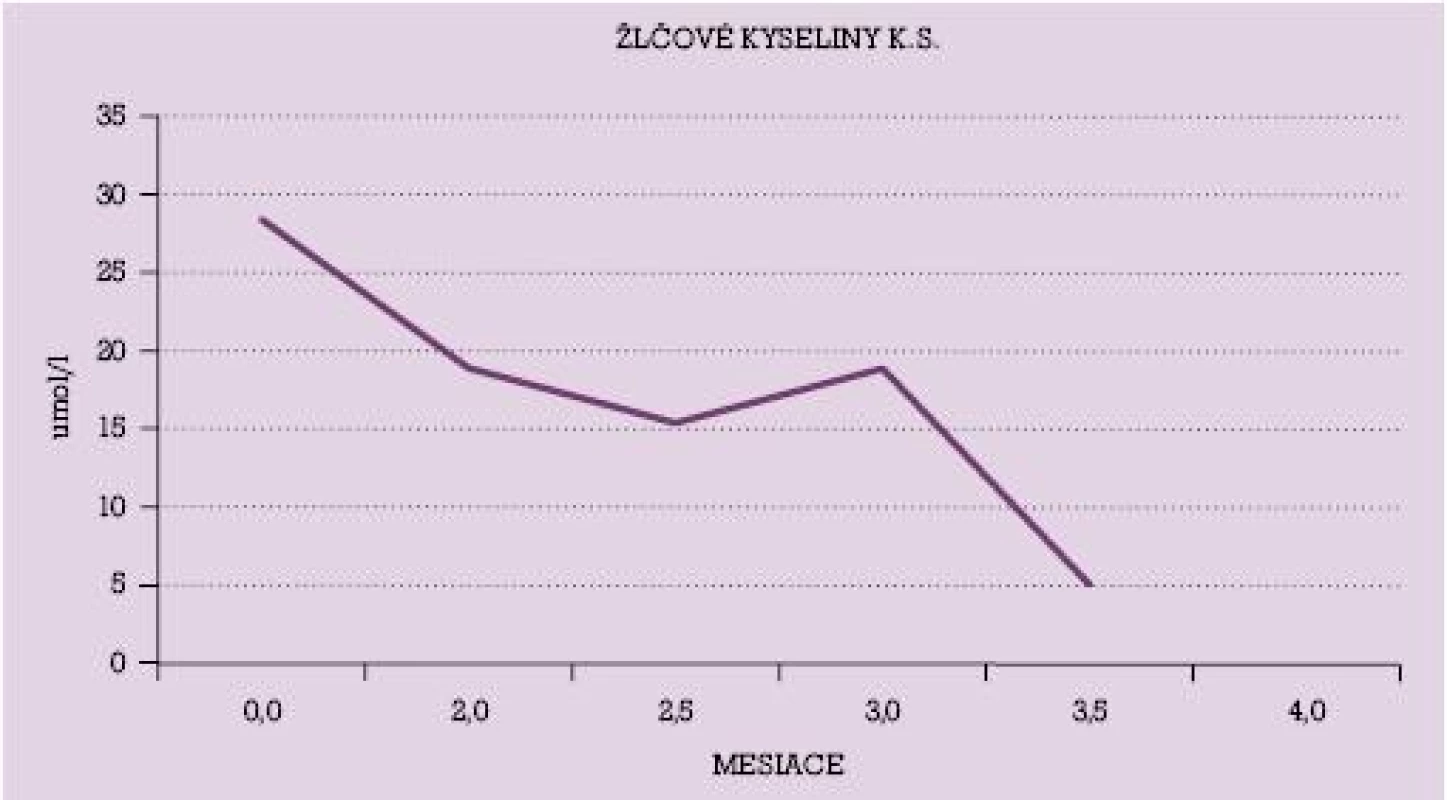
Na obrázku č. 1 a č. 2 sú uvedené dynamické priebehy hladiny žlčových kyselín u vybraných dvoch pacientok s poklesom ich hladín v priebehu liečby UDCA. V grafe č. 1 je uvedený dynamický priebeh hodnôt AST u niekoľkých pacientok v priebehu liečby UDCA.

Diskusia
Príčinou ICP je intrahepatálna cholestáza s následným zvýšením koncentrácii žlčových kyselín v sére, bez prítomnosti obštrukcie v žlčových cestách. Etiológia ochorenia nie je úplne jasná, ide o súčasné pôsobenie viacerých faktorov [10].
Predpokladá sa, že vyvolávateľom ochorenia sú gonadálne a placentové hormóny. Dôkazom toho, že podnetom sú hormónové faktory, je aj zhoršenie prejavov pri opakovaných tehotnostiach, ako aj niekedy uvádzané recidívy príznakov pri menštruácii alebo liečbe estrogénmi. Zistilo sa tiež, že významnú úlohu pri manifestácii poruchy majú zvýšené hladiny estrogénov a progesterónu, ktoré práve v treťom trimestri dosahujú vrchol [14]. Okrem toho je známe, že v tehotnosti sa vplyv hormónov na pečeňovú bunku uplatňuje vo zvýšenej miere. Biliárne vylučovanie metabolitov estrogénov je znížené, stúpa cholesterol v žlči, môže vzniknúť cholestáza, nastáva zvýšený výskyt žlčových kameňov. Je prítomná aj zmena kanalikulárnej membrány, s následnou zmenou transportu hormónových steroidov. Ide teda síce o ochorenie typické pre graviditu, podobné príznaky však boli opakovane opísané aj u žien užívajúcich hormónové kontraceptíva [10,14].
Ochorenie máva často rodinný výskyt a bolo zaznamenaná u matiek, sestier a dcér v niektorých rodinách. Viacerí autori potvrdili, že pri tehotenskej cholestáze je dokázaná genetická predispozícia [13,15]. Rodinná anamnéza je spojená so zvýšeným výskytom HLA B8 a HLA Bw16. V niektorých prípadoch sa objavil pruritus aj pri užívaní orálnych kontraceptív. Mužskí členovia rodiny niekedy vykazujú cholestatické tendencie, ak sa im podávajú estrogény [14]. Nálezy podporujú mendelovskú dominantnú dedičnosť [3]. Už v minulosti sa predpokladala spoluúčasť genetickej mutácie génu BSEP (génu pre exkrečnú pumpu žlčových kyselín), MDR-3 (génu pre kanalikulárny fosfolipidový transport) a PFIC (génu, ktorý kóduje P typ ATPázy, zúčastňujúcej sa na aminofosfolipidovom transporte v kanalikulárnej membráne hepatocytov a cholangiocytov) [4]. Viacerými autormi bola už dokázaná spoluúčasť heterozygotnej mutácie MDR-3 (génu kanalikulárneho biliárneho fosfolipidového transportéru), ktorý je zapojený do biliárnej sekrécie fosfolipidov [17].
Zistila sa tiež zvýšená senzitivita exkretorického biliárneho systému na endogénne a exogénne estrogény, ale aj progesteron. Okrem toho je známe, že ethynilestradiol znižuje objem žlče, sekréciu bilirubínu, znižuje kanalikulárne transportné funkcie a zvyšuje spätný tok žlče z kanálikov do plazmy.
Predpokladá sa aj selektívna porucha biliárneho vylučovania sulfátových metabolitov, hlavne disulfátov. Uvádza sa tiež znížená aktivita sulfát transferázy [12,17].
Pozorovala sa tiež častejšia súvislosť výskytu tohto ochorenia s intra vitro fertilizáciou (IVF), ako aj s hypertenziou, niektorí autori uvádzajú častejší výskyt aj pri tehotenstvách s dvojičkami. Pruritus, ktorý sprevádza toto ochorenie je pravdepodobne centrálneho pôvodu, čo je sprostredkované neurotransmisiou endogénnych opiátov, alebo látok podobných sérotonínu [13,7].
Tehotenská intrahepatálna cholestáza predstavuje cca 20 % ikterov v gravidite. Po vírusovej hepatitíde je to druhá najčastejšia príčina ikteru v gravidite. Prevalencia ochorenia sa udáva 0,5–1 % gravidít. Táto porucha sa vyskytuje obzvlášť často v Škandinávii, severnej Európe, v Chile a Bolívii, ale aj v Číne. Veľmi zriedka sa vyskytuje u aziatiek a černošiek. Jej rozšírenie sa lokálne mení, ale celosvetovo narastá. V súčasnosti sa najvyššia incidencia udáva v Chile. Podľa niektorých autorov sa celkový výskyt udáva 1 z 1 500–2 000 gravidít, rodinný výskyt je asi u 50 % pacientov [13]. Množstvo prípadov sa manifestuje už krátko pred pôrodom, ale mnohé ľahšie formy sa pravdepodobne nezistia vôbec. Výskyt ICP je častejší u viacplodových gravidít [1,2,8].
Klinicky sa ochorenie prejavuje v poslednom trimestri gravidity (zriedka skôr), napr. v druhej polovici gravidity. Podľa závažnosti u jednotlivých foriem býva prítomný pruritus, môže sa vyskytnúť aj tmavší moč a svetlejšia stolica, prípadne aj strata hmotnosti. Môže sa objaviť aj hnačka, býva prítomná steatorea, ktorá odpovedá závažnosti cholestázy. Ikterus sa nemusí prejaviť (býva prítomný len asi u 25 % prípadov), je zriedkakedy výrazný (môže sa objaviť po 1–4 týždňoch a trvať rôzne dlho – jeden, aj viac týždňov). Pruritus aj ikterus väčšinou spontánne ustúpia do 1–2 týždňov po pôrode [8]. Stav sa obvykle opakuje v nasledujúcich graviditách u viacrodičiek s rôznym stupňom závažnosti a dobou nástupu. Klinické príznaky väčšinou výrazne obťažujú tehotnú, riziko ohrozenia zdravia alebo života nie je však vysoké [6]. Výrazný pruritus kože je prítomný hlavne v oblasti chodidiel a dlaní, manifestuje sa hlavne v nočných hodinách a spôsobuje poruchy spánku a psychickú alteráciu pacientky. Častá je aj zvýšená únavnosť, môže byť prítomná mierna strata hmotnosti, nie sú však prítomné žiadne bolesti a pocit celkového zdravia je zachovaný. Pečeň a slezina nebývajú hmatné. U pacientiek sa môže vyvinúť hypokoagulačný stav, v dôsledku dlhšie trvajúcej cholestázy a zhoršenej resorpcie vitamínu K, ktorý ovplyvňuje syntézu koagulačných faktorov protrombínového komplexu [13].
V sére sa vyskytujú zvýšené hodnoty alkalickej fosfatázy (ALP), môžu byť prítomné aj zvýšené hodnoty konjugovaného bilirubínu. Zvýšený konjugovaný bilirubín môže v ťažších prípadoch stúpnuť aj do 6násobku normálnych hodnôt (cca 2 týždne po začiatku pruritu), v moči môže byť prítomný bilirubín aj urobilinogén. Zvýšenie ALP môže dosiahnuť aj do 5–10-násobku normy, kým GMT býva v norme alebo málo zvýšené. Cholesterol môže byť v norme alebo mierne zvýšený [15]. Hodnoty aminotransferáz v sére môžu byť ľahko zvýšené, hoci občas sa zistia aj veľmi vysoké hodnoty, kedy môžu dosahovať až do 5–10-násobku normy, ale môžu to byť aj normálne hodnoty. Tieto zmeny sa po pôrode vracajú do normálneho stavu. Môže byť prítomné zvýšenie 5-nukleotidázy, ako aj zvýšenie alfa 2 - a beta globulínu. Hodnoty žlčových kyselín v sére bývajú zvýšené a prevažujú primárne žlčové kyseliny (cholová a chenodeoxycholová kyselina). Zvýšenie žlčových kyselín v sére môže dosiahnuť až 10násobok normy, sú prítomné aj v koži a prenikajú aj placentou [2]. Protrombínový čas môže byť predĺžený v dôsledku nedostatku vitamínu K. Môže byť prítomná aj znížená produkcia vitamín K-dependentných koagulačných faktorov (II, VII, IX, X). V niektorých prípadoch sa opisuje tiež zvýšenie postprandiálnej glykémie [1]. Pri histologickom vyšetrení sa opisuje fokálna nepravidelná cholestáza, žlčové tromby, zmeny mikroklkov žlčových kanálikov, ako aj dilatácia žlčových kanálikov. Nebýva prítomná hepatocelulárna nekróza, ani zápalové reakcie, býva prítomná ľahká periportálna infiltrácia, ako aj mitochondrie s kryštalickými inklúziami. Elektrónová mikroskopia môže odhaliť zmeny mikroklkov žlčových kanálikov, ktoré sú spoločné všetkým formám cholestázy [13].
Pri diferenciálnej diagnostike je potrebné odlíšiť cholestatickú formu vírusovej hepatitídy, obštrukciu žlčových ciest (na základe USG), ďalej primárnu biliárnu cirhózu (kedy je prítomný pokračujúci pruritus, zvýšenie ALP, prítomnosť antimitochondriálnych protilátok), ďalej benígnu familiárnu rekurentnú intrahepatálnu cholestázu, ako aj liekové cholestázy. V diferenciálnej diagnostike je významná prítomnosť pomerne výrazného pruritu a biochemických vyšetrení naznačujúcich cholestázu [15]. Použitie rutinných laboratórnych vyšetrení nemá vždy dostatočnú diagnostickú hodnotu a významným laboratórnym vyšetrením pre diagnózu ICP je stanovenie plazmatickej hladiny žlčových kyselín [18,11,1].
Ultrazvukové vyšetrenie pomáha vylúčiť diagnózu obštrukcie žlčovodov. Pečeňová biopsia je málokedy nevyhnutná počas gravidity, ale jej výsledok môže mať významnú diagnostickú hodnotu. Pruritus pokračujúci po pôrode a pretrvávajúce zvýšenie hodnôt alkalickej fosfatázy v sére upozorňujú na možnosť primárnej biliárnej cirhózy, ktorá doposiaľ nebola manifestná. V takých prípadoch je indikovaná pečeňová biopsia a vyšetrenie antimitochondriových protilátok v sére.
Po pôrode sa môže u žien, ktoré prekonali ICP objaviť cholestatická odpoveď aj na malú dávku estrogénu [10].
Prognóza pre matku je pri ICP priaznivá. Po pôrode ťažkosti pacientky v priebehu maximálne troch týždňov vymiznú a laboratórne parametre sa znormalizujú. Matku upozorňujeme, že táto porucha sa obvykle vracia v ďalšej tehotnosti, a že sa môže prejaviť pruritus, ak bude brať orálne antikoncepčné prostriedky. Prognóza je horšia pre plod ako pre matku. Uvádza sa možnosť nižšej pôrodnej hmotnosti plodu (hypotrofizácia plodu je prítomná u 15–20 % prípadov), možné sú aj predčasné pôrody (asi u 35 %). Je prítomné zvýšené riziko ohrozenia plodu, nedozretia (až do 50 %), aj úmrtia plodu, kedy sa väčšinou jedná o intrauterinnú smrť plodu. Perinatálna úmrtnosť sa u neliečených prípadov uvádza približne 8 %, podľa niektorých autorov aj viac [6,16].
V snahe predísť perinatálnym, ale hlavne prenatálnym komplikáciám je dôležité dôsledne monitorovať stav plodu v maternici a včas ukončiť tehotnosť. Pri závažnej cholestáze je často potrebné elektívne indikovať pôrod v 38. týždni, prípadne aj v 36. týždni tehotnosti, ak je cholestáza závažná [9].
V liečbe sa skúšali rôzne hepatoprotektívne látky (silymarín, fosfatidylcholín) bez výraznejšieho efektu a ovplyvnenia základnej príčiny ochorenia.
Z iných možností terapie sa okrem antihistamíník použili viaceré lieky: dexamethason, cholestyramín, phenobarbital, S-adenosylmetionín a pod. – ich efekt bol variabilný [13,15,7]. Dexamethason znižuje placentovú tvorbu estrogénov a tým sekundárne aj žlčových kyselín a zároveň aj urýchľuje tvorbu surfaktantu v pľúcach novorodenca. Cholestyramín viaže žlčové kyseliny a zvyšuje ich vylučovanie črevom. Phenobarbital pôsobí ako enzymatický induktor na mikrozomálne enzýmy, ktoré znižujú hladinu žlčových kyselín [13,15]. S-adenosylmetionín znižuje negatívny vplyv ethynilestradiolu na motilitu žlče a zvyšuje produkciu sulfátov, potrebných k biotransformácii žlčových kyselín. Zároveň znižuje aktivitu sérových aminotransferáz a pozitívne ovplyvňuje pruritus (doposiaľ nie celkom objasneným mechanizmom) [1].
V poslednom období sa diskutuje najmä o toxickom vplyve nekonjugovaného bilirubínu prechádzajúceho placentou a o vplyve toxických žlčových kyselín, u ktorých sa experimentálne potvrdil kardiodepresívny vplyv na plod potkanov. Toxické žlčové kyseliny (ako je kyselina cholová a chenodeoxycholová) okrem toho stimulujú motilitu čreva, čo môže spôsobiť predčasný odchod mekónia a následné komplikácie zo strany plodu. Žlčové kyseliny tiež zvyšujú citlivosť myometria na oxytocín, čo môže viesť k predčasnému pôrodu.
Ursodeoxycholová kyselina (UDCA) v dávke od 10–12 mg/1 kg/24 h, podľa niektorých autorov 14–16 mg/kg/deň zlepšuje profil žlčových kyselín v sére matky, aj amniotickej tekutine a zlepšuje transport žlčových kyselín cez placentu. V tejto indikácii bola použitá v dávke 10–12 mg/kg/deň, podľa niektorých autorov 14 mg/kg/deň, zriedkavo až 20–25 mg/kg/deň [13,11,7].
Kyselina ursodeoxycholová je prirodzene sa vyskytujúca hydrofilná žlčová kyselina, ktorá vytesňuje v spektre žlčových kyselín litotvorné žlčové kyseliny, ktoré pôsobia toxicky na membrány hepatocytov. UDCA zároveň znižuje spätnú resorpciu toxickej kyseliny cholovej a chenodeoxycholovej v čreve, čím znižuje ich hladiny v sére. Opisuje sa tiež imunologický efekt UDCA, ktorý spočíva v tom, že znižuje expresiu HLA antigénov I. triedy, ktoré sú cieľom pôsobenia cytotoxických látok [1].
S-adenylmetionín aj UDCA sa vyznačujú veľmi nízkou toxicitou a neboli u nich zaznamenané ani negatívne účinky na plod. Tehotné pacientky obe látky veľmi dobre tolerujú [1,7].
Pri ľahších formách ochorenia s miernou metabolickou aktivitou možno ponechať tehotné pacientky v ambulantnej starostlivosti, pri dodržiavaní pokojového režimu, hepatoprotektívnych diétnych opatrení a podávaní hepatoprotektív. Pruritus možno ovplyvniť antihistaminikami alebo cholestyramínom. Je potrebné sledovať biochemické parametre cca 1× týždenne, resp. podľa individuálneho priebehu v jednotlivých prípadoch. Súčasne sa monitoruje ultrasonograficky stav plodu, sledujú sa prietoky placentovými cievami a kardiotokografia. Pri ťažších formách je nevyhnutná hospitalizácia, s intenzívnejšími laboratórnymi kontrolami – cca 2× týždenne, v prípade potreby aj častejšie [13,6]. Pri indikácii ukončenia pôrodu cisárskym rezom je vhodné vzhľadom na hepatálne poškodenie uvážiť pôrod v spinálnej alebo epidurálnej analgézii [8]. Pacientky je potrebné sledovať až do úplného uzdravenia aj po pôrode a vylúčiť iniciálne štádium iných možných cholestatických ochorení (napr. primárna biliárna cirhóza). Pri ďalších tehotnostiach sú možné recidívy (až u 50–70 %), podobne aj pri hormónovej antikoncepcii, ktorá je v týchto prípadoch kontraindikovaná. Okrem toho sa pozorovala zvýšená možnosť tvorby žlčových kameňov [14].
Vzhľadom na možné rozvinutie sekundárneho hypokoagulačného stavu je potrebné počítať s hemoragickými komplikáciami pri pôrode, môže byť prítomné aj zvýšené popôrodné krvácanie. Na konci gravidity je preto potrebné uvážiť potrebu suplementácie vitamínu K parenterálne. Substitúcia vitamínu K je potrebná na syntézu K-vitamín-dependentných koagulačných faktorov. Z hľadiska celkových opatrení je zásadným krokom podpora výživy, preto v individuálnych prípadoch sú indikované infúzie sacharidov z hľadiska zlepšenia rastu plodu [13,15].
Pre matku je prognóza väčšinou dobrá. U plodu je však zvýšené riziko ohrozenia, nedozretia, prípadne úmrtia [19]. Plod musí byť starostlivo sledovaný a ukončenie tehotnosti je indikované v prípade jeho ohrozenia.
V súčasnosti sa vyšetrenie plazmatickej hladiny celkových žlčových kyselín považuje za najcitlivejší test pre diagnostiku ICP a zhodnotenie závažnosti tohto ochorenia [18,7]. V našom sledovaní sme zistili, že hladiny žlčových kyselín boli pri ťažšej forme, ale aj pri ľahšej forme ICP štatisticky vysoko významne odlišné od kontrolnej skupiny pacientok bez ICP.
Hodnoty ALP a bilirubínu boli štatisticky významne odlišné len pri ťažšej forme ICP oproti kontrolnej skupine. Pri ľahšej forme ICP sa neodlišovali významne oproti kontrolnej skupine. Porovnaním ľahšej a ťažšej formy ochorenia štatisticky významný rozdiel z ostatných sledovaných biochemických parametrov preukázal len bilirubín – jeho priemerné hladiny sa však stále pohybovali v pásme normálnych hodnôt. Hodnoty ALP sa významne neodlišovali medzi ľahšou a ťažšou formou ochorenia.
Zvýšenie hodnôt AST a ALT pri ťažšej aj ľahšej forme ICP v porovnaní s kontrolnou skupinou v našom sledovaní nasvedčuje pre cytolýzu, uvedený nález však nie je špecifický pre diagnózu ICP a býva prítomný aj pri iných formách hepatopatií.
Hodnoty GMT nevykazovali štatisticky významný rozdiel pri ľahšej, ani ťažšej forme ICP v porovnaní s kontrolnou skupinou.
Pri rozdelení nášho súboru pacientok s ICP podľa závažnosti poruchy na dve skupiny [6,18], na ľahšiu formu (s hladinou žlčových kyselín do 40 μmol/l) a ťažšiu formu (s koncentráciou žlčových kyselín nad 40 μmol/l), sme v našom súbore zistili výrazné rozdiely v hladinách žlčových kyselín. Pri ľahšej forme ICP hladiny žlčových kyselín dosahovali v priemere cca dvojnásobok oproti kontrolnej skupine, pri ťažšej forme v priemere až 10-násobok, oproti hodnotám v kontrolnej skupine. Uvedené nálezy svedčia o význame vyšetrenia žlčových kyselín pri ICP.
V hodnotách ostatných vyšetrovaných parametroch neboli prítomné tak výrazné rozdiely medzi ľahšou a ťažšou formou ochorenia. Na základe použitia štandardných vyšetrovacích metód teda nie je možné jednoznačné odlíšenie ľahšej a ťažšej formy ochorenia pri ICP. Jednoznačné oddiferencovanie závažnosti ochorenia umožnilo až vyšetrenie žlčových kyselín.
Nové poznatky v súčasnosti svedčia o tom, že žlčové kyseliny prechádzajú placentou tak do organizmu plodu, ako aj do amniotickej tekutiny. V sére plodu je vyššia hladina žlčových kyselín, ako v sére matky a hlavný smer prechodu žlčových kyselín je z tela plodu do tela matky. V prípade cholestatickej hepatopatie gravidných nastáva jednak celkové zvýšenie hladiny žlčových kyselín v sére matky, jednak k zvýšeniu transportu žlčových kyselín v opačnom smere – z tela matky do tela plodu a tým ku kumulácii žlčových kyselín vo fetálnom organizme [8,20]. Kumulácia žlčových kyselín vo fetálnom organizme môže byť spojená s vyšším výskytom fetálneho distresu. Bola zistená súvislosť medzi zvýšenou celkovou hodnotou žlčových kyselín v sére a súčasne zvýšenou incidenciou prítomnosti intrauterínneho fetálneho distresu a mekónia. Mení sa aj zloženie spektra žlčových kyselín – s prevahou kyseliny cholovej a chenodeoxycholovej [8,16,20]. Celková hladina žlčových kyselín v sére matky (viac ako 50 μmol/l) a v pupočníkovej krvi plodu (viac ako 25 μmol/l), sú spojené so zhoršením stavu plodu a zvýšeným rizikom náhleho úmrtia plodu. V prípadoch náhleho úmrtia plodu u matky s ICP bolo zistené, že poškodenie a smrť plodu nastali v dôsledku akútnej intrauterinnej anoxie.
Z experimentálnych prác je známe, že mekónium a žlčové kyseliny, predovšetkým kyselina cholová, vyvolávajú vazokonstrikciu chóriových vén in vitro a spôsobujú aj akútnu konstrikciu umbilikálnych vén. Ďalej existujú experimentálne dôkazy o tom, že žlčové kyseliny sa podieľajú na spúšťaní mechanizmov, ktoré vedú k intrauterinnej fetálnej asfyxii u žien s ICP [8]. V experimentálnych prácach sa tiež zistilo, že kyselina taurocholová, hlavná žlčová kyselina, môže pri cholestatickej hepatopatii gravidných spôsobiť pokles kontraktility kardiomyocytov a poruchy srdcového rytmu u potkanov [20,16]. Z uvedených poznatkov možno usúdiť, že určité zmeny v zložení a množstve žlčových kyselín pri ICP, by mohli aj u ľudí vyvolať náhle intrauterinné úmrtie plodu [16].
Pri ICP okrem genetickej predispozície pravdepodobne vzájomne pôsobí veľa faktorov tak, že sa menia kanalikulárne a pečeňové membrány a týmto spôsobom sa mení aj transport pohlavných steroidov. Podnet k tomu dávajú hormónové faktory, ako tomu nasvedčuje aj zhoršenie stavu pri opakovaných tehotnostiach a recidívy pri menštruácii alebo pri liečbe estrogénmi. V odbornej literatúre sú údaje o tom, že aj krátko po podávaní progesterónu sa vyvinula cholestáza [14]. Usudzuje sa, že primárna zmena môže byť v reproduktívnom mechanizme progesterónu, so selektívnou poruchou biliárneho vylučovania sulfátových metabolitov, zvlášť disulfátov [7]. Bola dokázaná aj heterozygotná non sense mutácia MDR-3 biliárneho transportéru [5].
Viacerí autori zistili, že kyselina ursodeoxycholová (v dávke 10–15 mg/kg/deň) stimuluje vylučovanie biliárnych steroidných sulfátov, okrem toho potláča pruritus a zlepšuje biochemické parametre [13,15,7].
Pokles hladiny žlčových kyselín v sére matky i v umbilikálnej krvi pri užívaní ursodeoxycholovej kyseliny (UDCA) má význam nielen pre matku, z hľadiska zmiernenia subjektívnych ťažkostí, ale aj pre plod, z hľadiska vyššej perspektívy donosenia plodu a pôrodu zdravého dieťaťa. Potvrdilo sa, že u pacientok liečených UDCA nastáva spontánny pôrod v kratšom časovom úseku voči stanovenému termínu pôrodu ako u pacientok neliečených UDCA. Okrem toho aj frekvencia výskytu fetálneho distresu bola nižšia ako u pacientok, ktoré nedostávali UDCA [8,7].
Záver
Intrahepatálna cholestáza gravidných je pomerne zriedkavým ochorením, pri ktorom nastávajú subjektívne aj objektívne zmeny nielen v organizme matky, ale toto ochorenie môže predstavovať závažné riziko aj pre plod. Vyšetrenie celkových žlčových kyselín predstavuje skvalitnenie diagnostiky ICP. V našom sledovaní pacientky podávanie UDCA veľmi dobre tolerovali. Koncentrácia celkových žlčových kyselín po podaní UDCA u jednotlivých sledovaných prípadov mala klesajúci trend, podobne zvýšené hodnoty aminotransferáz mali po terapii UDCA klesajúci trend, v závislosti na dĺžke podávania. Subjektívne pacientky liečené UDCA udávali zlepšenie celkového stavu a zmiernenie pruritu.
Terapia UDCA zlepšuje stav matky a v súvislosti so súčasnými poznatkami môže zabrániť aj komplikáciám zo strany plodu.
prof. MUDr. Viera Kupčová, Ph.D.1
prof. MUDr. Ladislav Turecký, Ph.D.2
MUDr. Karol Plank, Ph.D.3
1 III.
interná klinika LF UK a FNsP akad. Dérera
2 Ústav
lekárskej chémie, biochémie
a klinickej biochémie LF UK
3 Gynekologicko pôrodnícka
klinika SZU, Bratislava
Sources
1. Ambros-Rudolph CM, Glantz M, Trauner M et al. The importance of serum bile acid level analysis and treatment with ursodeoxycholic acid in intrahepatic cholestasis of pregnancy: a case series from central Europe. Arch Dermatol 2007; 143(6): 757–762.
2. Binder T, Zima T, Vítek L. Biochemical parameters of the intrahepatic cholestasis of pregnancy. Česká Gynekol 2007; 72(2): 90–94.
3. Cicek D, Kandi B, Demir B et al. Intrahepatic cholestasis occurring with prurigo of pregnancy. Skinmed 2007; 6(6): 298–301.
4. Dixon PH, Weerasekera N, Linton KJ et al. Heterozygous MDR3 missense mutation associated with intrahepatic cholestasis of pregnancy: evidence for a defect in protein trafficking. Hum Molec Genet 2000; 9 : 1209–1217.
5. Floreani A, Carderi I, Paternoster D et al. Hepatobiliary phospholipid transporter ABCB4, MDR3 gene variants in a large cohort of Italian women with intrahepatic cholestasis of pregnancy. Dig Liver Dis 2008; 40(5): 366–370.
6. Glantz A, Marshall HU, Mattsson LA. Interhepatic cholestasis of pregnancy: relationships between bile acid levels and fetal complication rates. Hepatology 2004; 40 : 467–474.
7. Glantz A, Reilly SJ, Benthin L et al. Intrahepatic cholestasis of pregnancy: Amelioration of pruritus by UDCA is associated with decreased progesterone disulphates in urine. Hepatology 2008; 47(2): 544–551.
8. Jóźwik M, Jóźwik M, Bartnicki J et al. Intrahepatic cholestasis of pregnancy: a disorder with increased fetal risks. Part II: fetal condition and medical management. Ginekol Pol 2007; 78(5): 405–410.
9. Kondrackiene J, Beuers U, Zelinkevicius R et al. Predictors of premature delivery in patients with intrahepatic cholestasis of pregnancy. World J Gastroenterol 2007; 13(46): 6226–6230.
10. Kondrackiene J, Kupcinskas L. Intrahepatic cholestasis of pregnancy – current achievements and unsolved problems. World J Gastroenterol 2008; 14(38): 5781.
11. Kupčová V, Turecký L, Plank K et al. Investigation of plasma total bile acids after treatment by ursodeoxycholic acid in intrahepaticcholestasis of pregnancy. In: Falk Symposium No 155. Freiburg 2006 : 90.
12. Lam P, Pearason CL, Soroka CJ et al. Levels of plasma membrane expression in progressive and benign mutations of the bile salt export pump (Bsep/Abcb11) correlate with severity of cholestatic diseases. Am J Physiol Cell Physiol 2007; 293(5): 1709–1716.
13. Lammert F, Marschall HU, Glantz A et al. Intrahepatic cholestasis of pregnancy: molecular pathogenesis, diagnosis and management. J Hepatol 2000; 33 : 1012–1021.
14. Meier Y, Zodan T, Lang C et al. Increased susceptibility for intrahepatic cholestasis of pregnancy and contraceptive‑induced cholestasis in carriers of the 1331T>C polymorphism in the bile salt export pump. World J Gastroenterol 2008; 14(1): 38–45.
15. Paus TC, Schneider G, van der Vondel P et al. Diagnosis and therapy of interhepatic cholestasis of pregnancy. Z Gastroenterol 2004; 42 : 623–628.
16. Shao Y, Yao Z, Lu J et al. Change of heart rate power spectrum and its association with sudden death in the fetuses of rats with intrahepatic cholestasis of pregnancy. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi 2007; 24(6): 1215–1219.
17. Trauner M, Fickert P, Wagner M. MDR3 (ABCB4) defects: a paradigm for the genetics of adult cholestatic syndromes. Semin Liver Dis 2007; 27 : 77–98.
18. Turecký L, Kupčová V, Kubičková K et al. Význam vyšetrovania plazmatickej koncentrácie žlčových kyselín u žien s intrahepatálnou cholestázou gravidných. Praktická gynekológia 2005; 12 : 56–60.
19. Yang X, Ding YL. Relationship of the occurrence of fetal distress and change of umbilical cord and expression of vasoactive substance in umbilical vein in intrahepatic cholestasis of pregnancy. Zhonghua Fu Chan Ke Za Zhi 2008; 43(2): 85–89.
20. Zecca E, De Luca D, Barbato G et al. Predicting respiratory distress syndrome in neonates from mothers with intrahepatic cholestasis of pregnancy. Early Hum Dev 2008; 84(5): 337–341.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Practical Gynecology

2009 Issue 2
-
All articles in this issue
- Perioperative adhesion prevention in gynaecology.
- Adenocarcinoma in situ of the uterine cervix – analysis of 10 cases
- Thyroid cancer therapy with radioiodine 131I, the impact on gonadal functions and fertility.
- Some bioethical questions in assisted reproduction – review of literature (Strassbourg convention, human embryo status).
- Pregnancy loss after the assisted reproductive technologies.
- Intrahepatic cholestasis of pregnancy and treatment with ursodeoxycholic acid.
- Identification of the estrogen alpha receptor in normal endometrium and in clear cell carcinoma
- Forensic Aspects of Assisted Reproduction in Czech and Slovak Legislation
- Practical Gynecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Intrahepatic cholestasis of pregnancy and treatment with ursodeoxycholic acid.
- Pregnancy loss after the assisted reproductive technologies.
- Thyroid cancer therapy with radioiodine 131I, the impact on gonadal functions and fertility.
- Perioperative adhesion prevention in gynaecology.
