Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
Prognosis of women with breast cancer and sentinel lymph node micrometastases.
The advent of sentinel lymph node biopsy and improvements in histopathological and immunohistochemical analysis has increased the rate at which micrometastases are identified. However their significance has been the subject of much debate. Published studies have reported divergent results regarding the significance and implications of axillary lymph node micrometastases. Some studies demonstrate no associations, whilst others have found these to be indicators of poor prognosis, associated with non‑SLN involvement, in addition to local and distant failure. The objective of our study was to evaluate the impact of sentinel lymph node micrometastatic cancer to prognosis of the disease. From January 2000 to December 2006 in 89 cases with sentinel axillary node negative cancer we reexamined the axillary tissue blocks by serial sectioning, haematoxilin‑eosin staining and immunohistochemistry. Additional 13 cases of micrometastatic sentinel node involvement detected by frozen section were included. The overall and disease free survivals of patients with sentinel negative status (N0 – 69 cases) and with sentinel node micrometastases (Nmic ‑ 33 cases) were evaluated. The median follow‑up was 46 months (12 – 96 months). Micrometastases (Nmic) were found in 20 cases (22,5 %). From the group of 69 nodes negative patients (N0) in 10 cases (14,5 %) developed tumor recurrence and from the group of 33 Nmic in 3 cases developed tumor recurrences (9,1 %). In the group of N0 patients developed 2 regional recurrences and 4 patients died, but 3 of them died of other causes. In the group of Nmic developed one regional recurrence and one patient died of generalization of disease. Our study demonstrated that the presence of sentinel node micrometastases is not associated with worsening of the disease.
Key words:
micrometastases – sentinel lymph node – breast cancer
Authors:
P. Strnad 1; Lukáš Rob 1
; P. Škapa 2; H. Stankušová 3; K. Michalová 4; J. Chod
Authors‘ workplace:
Gynekologicko-porodnická klinika 2. LF UK a FN Motol
1; Ústav patologie a molekulární medicíny 2. LF UK a FN Motol
2; Radioterapeuticko-onkologické oddělení 2. LF UK a FN Motol
3; Klinika nukleární medicíny 2. LF UK a FN Motol
4
Published in:
Prakt Gyn 2009; 13(4): 218-223
Overview
Zavedení biopsie sentinelové uzliny do rutinní praxe a zlepšení metodik histopatologického a imunohistochemického vyšetření je spojeno s vyšší frekvencí detekovaných mikrometastáz. V současné době není jednotný názor na klinický význam těchto mikrometastáz, publikované studie o vztahu mezi přítomností mikrometastázy a průběhem onemocnění přinášejí rozdílné výsledky. Cílem práce bylo vyhodnocení vlivu mikrometastáz karcinomu prsu v sentinelové uzlině k průběhu onemocnění. Retrospektivně bylo vyšetřeno 89 sentinelových uzlin s negativním nálezem za období od ledna 2000 do prosince 2006. Tkáňové bločky uzlin byly sériově vyšetřeny metodou hematoxylin‑eosinem a imunohistochemicky. Dále bylo vyhodnoceno dalších 13 případů mikrometastatického postižení sentinelových uzlin ze stejného období, které bylo nalezeno již při zpracování uzliny v průběhu operace metodou „zmrazeného řezu“. U 69 žen s negativním nálezem v sentinelové uzlině a u 33 žen s mikrometastázou byl vyhodnocen průběh onemocnění. Průměrná délka sledování žen byla 46 měsíců (12 – 96 měsíců). V původně negativním souboru sentinelových uzlin bylo sériovým vyšetřením a imunohistochemicky nalezeno 20 případů (22,5 %) mikrometastáz. Ve skupině 69 žen s negativním nálezem (N0) došlo v 10 případech k vývoji recidivy nádoru (14,5 %) a ve skupině 33 žen s mikrometastázou (Nmic) nastala recidiva ve 3 případech (9,1 %). Ve skupině N0 jsme pozorovali dvě regionální recidivy a čtyři úmrtí, ze kterých však tři úmrtí nesouvisela se základním onemocněním. Ve skupině Nmic došlo k jedné regionální recidivě s úmrtím následkem generalizace nemoci. V naší práci nebyl prokázán vztah mezi přítomností mikrometastázy a horší prognózou nemoci.
Klíčová slova:
mikrometastázy – sentinelová uzlina – karcinom prsu
Přehled problematiky
Postižení regionálních lymfatických uzlin nádorem je jedním z nepříznivých prognostických faktorů karcinomu prsu, který má rozhodující vliv na strategii další léčby, ve které dominuje chemoterapie a/ nebo radiační léčba axily. Mnoho studií jednoznačně prokázalo souvislost mezi velikostí nádoru, postižením uzlin a délkou intervalu přežití [21]. Ve 30. – 40. letech minulého století dosahovala frekvence metastatického postižení axilárních uzlin 60 – 70 % a toto postižení bylo obvykle vícečetné. Zlepšením diagnostiky nádorů prsu v 60. – 70. letech minulého století poklesla frekvence metastáz v axile na 50 %, avšak stále bylo postiženo vícero uzlin [6]. I když je postižení uzlin spojeno s nepříznivou prognózou nemoci, nemá rozsah chirurgické disekce axily podstatný vliv na interval přežití. Disekce axily je spojena pouze s dobrou regionální kontrolou nemoci. Zavedením mammárního screeningu došlo k významnému poklesu frekvence axilárních metastáz nádorů prsu, která se pohybuje okolo 26 % a většinou se jedná o metastázu v jedné uzlině [10]. Současně patologové stále častěji nalézají minimální postižení uzliny označované jako mikrometastáza. Mikrometastázou je označováno nádorové depozitum v uzlině velikosti 0,2 – 2 mm. Používáním senzitivních imunohistochemických metod jsou detekovány shluky nádorových buněk menší než 0,2 mm, které jsou označovány jako izolované nádorové buňky (ITC). Tyto změny se odrazily i v nové klasifikaci TNM, kdy mikrometastatické postižení je označeno jako pN1(mic) a postižení ITC jako pN0(+).Vedle jednoznačného rizika přítomnosti makrometastázy v regionálních uzlinách zůstává rizikový vliv mikrometastázy nejasný. Nálezy recidiv nemoci v případech absence postižení regionálních uzlin nádorem vedly k řadě retrospektivních histopatologických studií, které revidovaly původně negativní bioptické vzorky uzlin.V těchto případech sériové vyšetření a imunohistochemické metody nalezly mikrometastázy karcinomu s frekvencí mezi 9 – 33 % [18]. Avšak při sledování vztahu mezi přítomností mikrometastáz s průběhem onemocnění vykazovaly výsledky jednotlivých studií značnou heterogenitu.
Cíl práce
V naší práci jsme se snažili řešit několik problematických okruhů spojených s průkazem mikrometastázy v sentinelové uzlině.
- Je průkaz mikrometastázy skutečně indikací pro disekci axily?
- Jsou mikrometastázy rizikovým faktorem pro regionální i vzdálené recidivy?
- Bude existence mikrometastázy v sentinelové uzlině vyžadovat speciální postupy sledování a adjuvantní léčby?
Cílem práce bylo retrospektivní vyhodnocení klinického významu nalezené mikrometastázy ve vztahu k prognóze mezi skupinou žen se skutečně negativními uzlinami a ženami s mikrometastázami. V případech nalezené mikrometastázy bylo sledováno postižení nesentinelových axilárních uzlin. V závislosti na klinickém průběhu nemoci u žen s mikrometastázou měl být stanoven adekvátní follow up i postup adjuvantní terapie.
Soubor a metodika
Za období leden 2000 až prosinec 2007 bylo na gynekologicko porodnické klinice FN Motol provedeno 375 biopsií sentinelové uzliny. Z tohoto souboru ve 13 případech již peroperační vyšetření sentinelové uzliny detekovalo přítomnost mikrometastázy (3,5 %). V těchto případech byla provedena standardní disekce (exenterace) axily. Všechny získané sentinelové i nesentinelové uzliny byly vyšetřeny erudovaným histopatologem.
Z období let 2000 – 2006 bylo vybráno 89 negativních nálezů v sentinelových uzlinách, které byly retrospektivně sériově vyšetřeny pro potvrzení či vyloučení přítomnosti mikrometastáz.
Vybraná série uchovaných bločků sentinelových uzlin, ve kterých standardním vyšetřením nebyly prokázány makrometastázy, byla dodatečně podrobena sériovému prokrájení.
Z parafinových bločků byly připraveny řezy barvené hematoxylinem eozínem jako pro rutinní bioptické vyšetření. V rámci vyhledávání mikrometastáz v sentinelových lymfatických uzlinách však byly parafinové bločky dále prokrajovány v intervalu 0,2 mm a vyšetřeny mikroskopicky standardním vyšetřením hematoxylinem eozínem a dále imunohistochemicky, polyklonálními protilátkami (cytokeratin large spectrum – Immunotech, anti human cytokeratin AE1/ AE3 – DAKO) a monoklonálními protilátkami (anti human cytokeratin – clone MNF 116, anti human epithelial membrane antigen – DAKO). Reakce byly vizualizovány za použití diaminobenzidinu – FLUKA.
V listopadu roku 2008 bylo provedeno vyhodnocení průběhu onemocnění (frekvence lokálních, regionálních a vzdálených metastáz, frekvence přežití) u souboru žen s nálezem mikrometastázy a u kontrolního souboru žen s negativním nálezem v sentinelové uzlině. Rovněž tak byl vyhodnocen průběh nemoci u 13 žen s nálezem mikrometastázy detekované již při peroperačním vyšetření sentinelové uzliny. Průměrná doba sledování byla 46 měsíců s rozptylem od 12 do 96 měsíců. Základní charakteristiky sledovaných souborů žen jsou uvedeny v tab. 1. Nálezy mikrometastáz u žen operovaných v roce 2008 již do sledování zařazeny nebyly. U těchto žen by byla doba sledování příliš krátká.

Výsledky
Ve 375 případech biopsie sentinelové uzliny byla absence postižení uzliny nádorem nalezena ve 268 případech (71,5 %), postižení uzliny nádorem větším než 2 mm (makrometastázou) se vyskytlo v 94 případech (25 %) a přítomnost mikrometastázy byla detekována ve 13 případech (3,5 %). Při postižení sentinelové uzliny nádorem (makro - i mikrometastázou) následovala systematická disekce axily. Z 94 případů makrometastáz bylo nalezeno postižení nesentinelových uzlin v 39 případech (41,5 %) a sentinelová uzlina postižená jako jediná se vyskytla v 55 případech (58,5 %). Disekované, nesentinelové uzliny u třinácti případů mikrometastáz byly vždy bez postižení nádorem.
Ze sériového zpracování 89 původně negativních sentinelových uzlin byly mikrometastázy nalezeny ve 20 případech (22,5 %). To je podstatný rozdíl proti 3,5% frekvenci mikrometastáz nacházených peroperačním vyšetřením metodou zmraženého řezu. Ve 12 případech byly nalezeny mikrometastázy (velikost 0,2 – 2 mm), v 8 případech byly imunohistochemicky detekovány pouze izolované nádorové buňky (ITC).
Postup další onkologické léčby v obou skupinách se podstatně nelišil, protože všechny ženy byly léčeny jako „node negativní“ podle parametrů primárního nádoru: velikost, histotyp, grade, stav angioinvaze, lymfangioinvaze, věk, stav hormonálních receptorů, mitotický index a úroveň exprese ERB2.
V listopadu 2008 byl vyhodnocen průběh onemocnění 33 žen s mikrometastázou (Nmic) a 69 žen s negativním nálezem v sentinelové uzlině. V souboru 33 žen s mikrometastázou v sentinelové uzlině se ke konci roku 2008 vyskytly celkem 3 případy recidivy nemoci (9,1 %) a u 69 žen bez postižení uzliny bylo 10 recidiv nádoru (14,5 %). Tab. 2 zobrazuje zastoupení různých druhů recidiv (lokální, regionální a vzdálené) a počet úmrtí ve sledovaných skupinách žen.
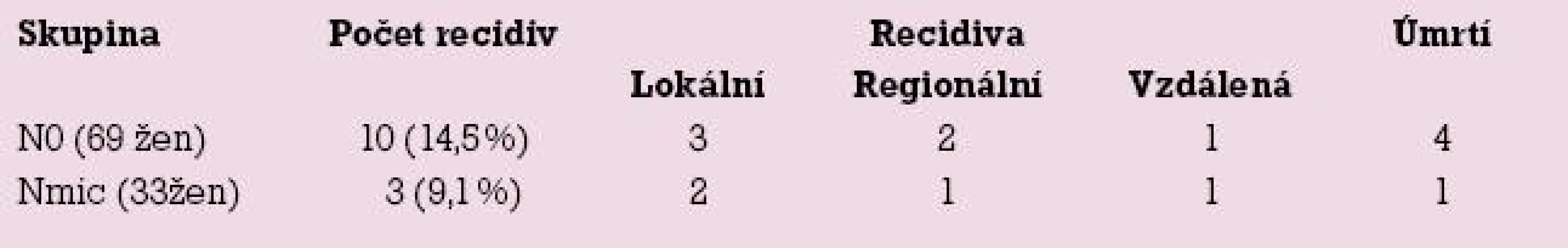
Při rozboru recidiv onemocnění jsme nalezli překvapivě nízkou frekvenci regionálních recidiv u žen s mikrometastázou. Jednalo se pouze o jednu recidivu v axile za rok po primární léčbě u mladé 36leté ženy s agresivní formou karcinomu prsu rezistentním na léčbu. Současně s regionální metastázou došlo k manifestaci vzdálených metastáz ve skeletu a přes intenzivní léčbu žena po dalším roce zemřela. Další dva případy lokálních recidiv byla lokální recidiva v prsu za dva roky po konzervativním výkonu a recidiva v kontralaterálním prsu za tři roky po mastektomii. Tyto recidivy nelze vysvětlit přítomností mikrometastázy v sentinelové uzlině.
Ve skupině žen s negativním nálezem se vyskytla čtyři úmrtí, avšak tři z nich nesouvisely se základním onemocněním, jednalo se o kardiovaskulární příhody starších žen. Pouze v jednom případě došlo k úmrtí na vzdálenou metastázu (plíce) u ženy s transplantovanou ledvinou na imunosupresivní léčbě. U jedné ženy došlo k manifestaci vzdálené metastázy ve skeletu, která je však po pět let stabilizována. Dvě regionální recidivy bychom spíše očekávali u žen s mikrometastázami, jedna se vyskytla také u ženy s transplantovanou ledvinou, ve druhém případě zůstala příčina nejasná, sériové vyšetření uzliny nenalezlo mikrometastázy. Tři případy lokálních recidiv byly:
- recidiva v jizvě po mastektomii za 5 let po primární léčbě u mladé ženy s manifestací karcinomu prsu v těhotenství a po transplantaci ledviny
- recidiva v kontralaterálním prsu současně s recidivou v ipsilaterální axile za 15 měsíců od primární léčby u pacientky, která odmítla další adjuvantní léčbu včetně radioterapie
- recidiva v kontralaterálním prsu za 5 let od primární léčby
Statisticky nebyl prokázán významný rozdíl ve frekvenci metastáz mezi oběma soubory. K recidivám docházelo v přítomnosti dalšího rizikového faktoru jako například imunosupresivní léčba, odmítání adjuvantní léčby, agresivní fenotyp nádoru rezistentní na chemoterapii. V našem souboru žen přítomnost mikrometastáz v sentinelové uzlině nebyla spojena s přítomností dalších metastáz v nesentinelových uzlinách, ale ani s vyšší frekvencí recidiv nemoci či s horším průběhem nemoci.
Diskuze
Mikrometastáza v sentinelové uzlině a axilární disekce
Přítomnost mikrometastázy v sentinelové uzlině představuje dilema pro další postupy léčby. Peroperační detekce mikrometastázy metodou zmraženého řezu je nahodilou záležitostí, v našem souboru to představovalo 3,5 % případů. Podle současných pravidel léčby je tento nález indikací k disekci axily, avšak my jsme v žádném případě v získaných uzlinách nenalezli nádorové postižení, byť jen mikrometastázou. Na druhou stranu sériové zpracování a imunohistochemické vyšetření původně negativních uzlin odhalilo 22,5% frekvenci mikrometastáz. V naší práci jsme u skupiny žen s mikrometastázou nalezli pouze jednu regionální recidivu, a tato recidiva byla spojena s manifestací vzdálené metastázy velmi agresivního nádoru u mladé 36leté ženy. Naskýtá se tedy otázka, jestli v příznivých případech (nádor do 2 cm, nízký grade, příznivý histotyp nádoru, absence lymfangioinvaze, přítomnost hormonálních receptorů, postmenopauzální věk pacientky) má klasická exenterace axily u detekované mikrometastázy v sentinelové uzlině smysl, jak změnit strategii léčby. Jestli nikoli, což je náš názor, potom ve vybraných případech je možné od exenterace upustit.
Dilema dalšího postupu léčby v případech mikrometastáz řešilo mnoho dalších studií. Van Deurzen [17] nalezl v případech výskytu izolovaných nádorových buněk v sentinelové uzlině postižení dalších uzlin metastázou ve 20 %, při nálezu mikrometastázy byla frekvence postižení 13 % a v případech makrometastázy dosáhlo postižení ostatních uzlin 48 %. Jiné studie nalezly významné riziko postižení nesentinelových uzlin, Menses et al [35] referují až o 20% uzlinovém postižení, metaanalýza 25 studií z let 1999 – 2003 nalezla postižení nesentinelových uzlin v 10 – 15 % [14]. Tyto studie podporují stávající management léčby, kdy při detekci mikrometastázy je indikována kompletní axilární disekce.
Naopak Rutledge [41] nalezl pouze 3% riziko postižení nesentinelových uzlin. Houvenaeghel [25] doporučuje vynechání axilární disekce při nálezu mikrometastázy u nádorů nízkého rizika: pT1a, pT1b nebo u stadia pT1a b c s histotypem tubulárního, koloidního nebo medulárního karcinomu. Jiné studie podporují vynechání disekce axily v přítomnosti prognosticky příznivých parametrů primárního nádoru (velikost do 2 cm, absence lymfangioinvaze, mitotický index pod 10 % [9]. Riziko nesentinelového postižení je spojováno spíše s vlastnostmi primárního nádoru, kdy přítomnost lymfangioinvaze, velikost nádoru a vysoký grade indikují provedení axilární disekce [9,23,33].
V našem souboru žen s mikrometastázou v sentinelové uzlině jsme nenalezli postižení ostatních uzlin, což je podporou vynechání disekce axily u nádorů stadia T1a, b, nízkého grade, bez angioinvaze.
Mikrometastáza a prognóza nemoci
Prognostický význam mikrometastatického postižení sentinelové uzliny je stále diskutován. Řada studií prokázala při výskytu mikrometastáz zhoršení prognózy nemoci [11,31,35,39,42]. Naopak některé studie významné zhoršení prognózy nenalezly [27,29,32,37]. Velká retrospektivní studie čítající přes 10 000 žen s délkou sledování 25 let nalezla horší prognózu při nálezu mikrometastázy, která však dosahovala statistické významnosti jen u skupiny, která neobdržela adjuvantní systémovou léčbu [31]. Colleoni [11] nalezl významné zhoršení intervalu bez recidivy v případech výskytu mikrometastáz při průměrném intervalu sledování 50 měsíců. Další autoři nalezli v případech mikrometastáz velikosti pod 1 mm nesentinelovou pozitivitu uzlin v 16 % a při výskytu metastáz nad 1 mm referují o nesentinelové pozitivitě v 51,1 % [44]. Nutno podotknout, že jsme v našem souboru makrometastáz v sentinelové uzlině nezaznamenali tak vysokou frekvenci nesentinelového postižení uzlin jako italští autoři ve své práci u mikrometastáz.
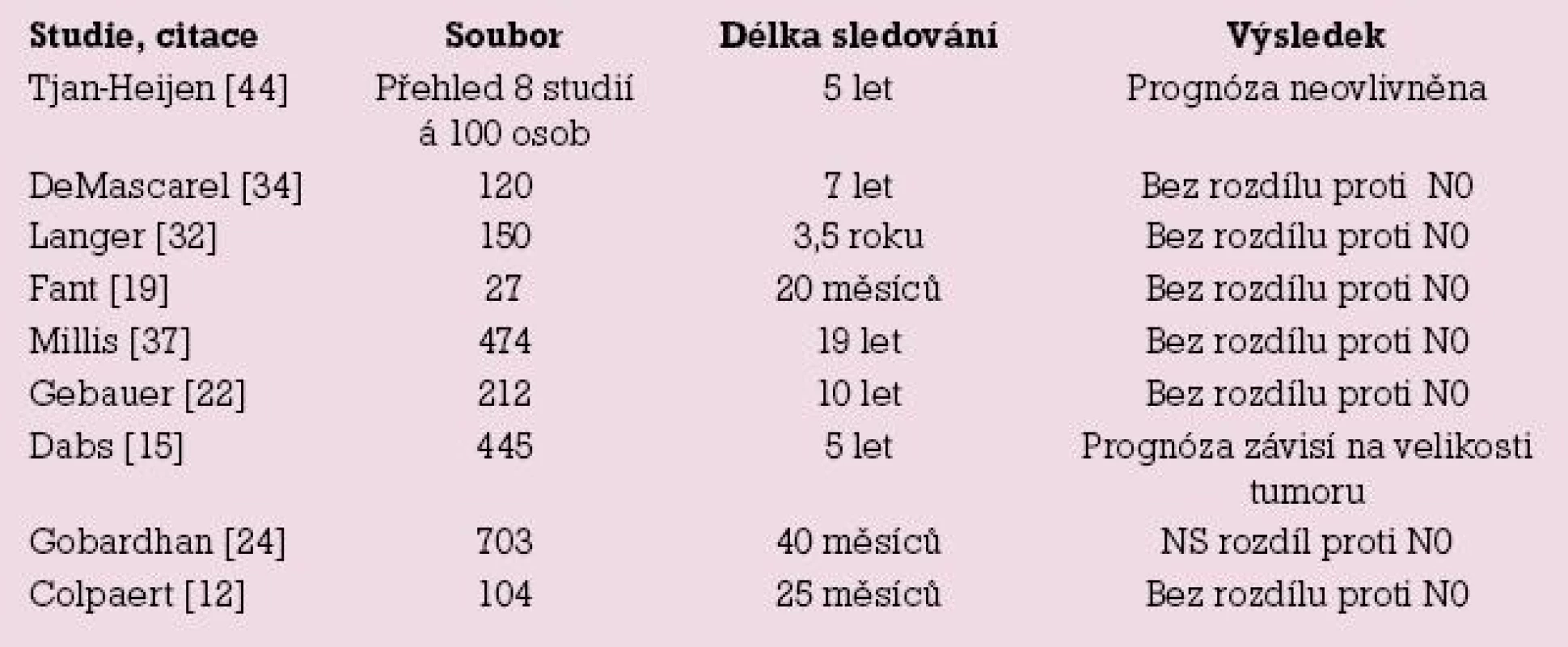
Výsledky Milánské studie [11] uvádějí zvýšení rizika Nmic proti N0 dané indexem HR (hazard ratio) = 1,5 pro interval bez nemoci ve čtyřletém intervalu sledování. Interval přežití mezi oběma skupinami nebyl odlišný, avšak doba sledování pro tento parametr byla velmi krátká. Další studie nenalezly rozdíl v průběhu onemocnění (DFI, OS) mezi pNmic a pN0, autoři proto nevidí indikaci k adjuvantní chemoterapii u stadia pNmic [24], nenalezli vyšší frekvenci axilárních recidiv tumoru [30,32] a nedoporučují následnou axilární disekci. Závěry studie z Bordeaux vyzněly obdobně, mikrometastatické postižení uzliny samo o sobě není indikací k adjuvantní chemoterapii [34]. V roce 2008 publikovali autoři z Tampy výsledky sledování velkého souboru 2 408 žen. V případech mikrometastázy v sentinelové uzlině nalezli postižení dalších uzlin u 9,3 % žen. Avšak v průběhu dalších sedmi let sledování nedošlo k rozdílu v intervalu přežití mezi skupinami Nmic a N0 [13]. Vyhodnocením databáze SEER čítající přes 200 000 žen s karcinomem prsu se prognóza mikrometastáz pohybovala mezi prognózou stadií N0 a N1 [28]. Mnozí autoři pochybují o tom, že tak malý metastatický objem, jakým je mikrometastáza nebo ITC, bude hrát roli při jejich terapeutické rozvaze [4,40]. Obdobně jako naše práce řada studií nenalezla zhoršení prognózy nemoci při nálezu mikrometastáz v sentinelové uzlině, přehled studií uvádí tab. 3.
Problematiku významu mikrometastázy v sentinelové uzlině dokumentují výsledky dvou rozdílných studií z poslední doby. Tan [43] v souboru 368 žen s negativním nálezem v uzlinách po dobu dvaceti let sledování nalezl signifikantní zhoršení prognózy nemoci v souvislosti s mikrometastázou, zatímco Bulte et al [5] nikoli.
Nádorové mikrometastázy v sentinelové uzlině je nutno posuzovat v kontextu s parametry primárního nádoru a také s metodou detekce a uložením metastáz v uzlině. Například jednotlivé nádorové buňky zachycené imunohistochemicky v subkapsulárním sinusu uzliny jsou důkazem schopnosti nádorových buněk překonat anatomické bariéry, nemusí být však důkazem jejich schopnosti přežít v imunologicky nepříznivém prostředí lymfatické uzliny. Stejně tak nádorové buňky obklopené leukocyty a jinými imunologickými elementy mají dvě možnosti: budou tímto systémem zničeny, nebo založí ložisko, které poroste. Naše zkušenosti s lymfatickým mapováním sentinelové uzliny přinesly doklady o poměrně velmi rychlém lymfatickém proudění, kdy barvivo po dvou minutách od aplikace je „dopraveno“ až do axilárních uzlin. Vzhledem k prokázanému benignímu mechanickému transportu epiteliálních buněk do sentinelové uzliny je možné předpokládat delší expozici této uzliny nádorovými buňkami a určitou roli imunitního dozoru při jejich likvidaci nebo toleranci. Daleko častěji byly nalezeny izolované nádorové buňky po intervencích jako „core cut“ biopsie nebo po masáži prsu po aplikaci lymfotropního barviva [16,38]. Je možné předpokládat, že určité množství nádorových buněk v sentinelové uzlině je důsledkem tohoto tzv. „benigního transportu“ a není projevem metastatického potenciálu nádoru.
V nedávné době prokázal Brodt [3] v experimentu, že metastatické nádorové buňky získané z lymfatických uzlin se po systémové aplikaci do oběhu preferenčně „ukládají“ do stromatu lymfatických uzlin. Obdobnou orgánovou specificitu měly v animálních experimentech nádorové buňky jaterních či plicních metastáz [20,26]. Příčinou toho, že mnoho žen s metastázami v regionálních uzlinách přežívá dlouhou dobu bez příznaků vzdálené recidivy, je zřejmě skutečnost, že metastatické nádorové buňky v uzlinách nemají kapacitu k usídlení a růstu v jiných orgánech. Naopak u mnoha žen s negativním nálezem v uzlinách dochází k vývoji orgánových metastáz a k úmrtím, což nasvědčuje tomu, že není spojení mezi metastázami v lymfatických uzlinách a metastázami v životně důležitých orgánech a přežitím.
Je pravděpodobné, že metastázy v lymfatických uzlinách jsou dobrým prognostickým ukazatelem zvýšené pravděpodobnosti primárního nádoru zakládat vzdálené metastázy, avšak samy o sobě nejsou schopny progredovat do životně důležitých orgánů [8,45]. Tuto koncepci potvrzuje dávno známá skutečnost, že disekce axily je jen tzv. stagingovým výkonem, na kterém nezávisí délka přežití. Při randomizaci pacientek s karcinomem prsu, u kterých byla provedena klasická disekce axily nebo jen observace bez chirurgické intervence, nebyl nalezen rozdíl jak v dlouhodobém přežívání, tak i v intervalu bez recidiv [7]. Při tvorbě vzdálených metastáz karcinomu prsu bude významnou roli hrát hematogenní šíření. Angioinvaze provází malignity od velmi časných stadií a cirkulující nádorové buňky v periferní krvi jsou prokazovány až u 60 % žen s karcinomem prsu [1]. U malých nádorů stadia T1 byly v kostní dření nalezeny nádorové buňky u 25 – 35 % žen, ačkoli jejich 15leté přežití bylo 95 – 90 % [2]. Studie nemocnice MD Anderson Hospital prokázala, že za 7 až 22 let od primární léčby karcinomu prsu se vyskytovaly cirkulující nádorové buňky v periferní krvi u třetiny žen v klinické remisi nemoci [36]. V kostní dřeni mohou mít nádorové buňky karcinomu prsu funkci tzv. kmenových buněk, které za určitých okolnosti mohou zakládat orgánové metastázy [1].
Postižení axilárních uzlin v tomto konceptu znamená pouze prognostický faktor schopnosti nádoru zakládat vzdálené metastázy, avšak nikoli přímým přestupem z uzlin, nýbrž jinou (hematogenní) cestou. Zaměření výzkumu na význam mikrometastáz v periferní krvi a kostní dřeni, jejich detekce a eventuelní včasná systémová léčba ještě před klinickou manifestací nádoru by pomohly objasnit a někdy zabránit nevysvětlitelné generalizaci nemoci.
Závěr
Výsledky našeho projektu neprokázaly rizikový vliv mikrometastáz v sentinelové uzlině. V případě nálezu mikrometastázy v sentinelové uzlině jsme neprokázali postižení vyšších etáží uzlin. V případě příznivých charakteristik nádoru (tubulární histotyp, velikost nádoru do 20 mm, nízký grade, absence lymfangioinvaze, přítomnost hormonálních receptorů, nízká mitotická aktivita nádoru, postmenopauzální status ženy) je možno i při nálezu mikrometastázy vynechat disekci axily. Ve sledovaném souboru negativních sentinelových uzlin byla sériovým vyšetřením nalezena 22,5% frekvence mikrometastáz. Dalším sledováním průběhu onemocnění u skupiny žen s mikrometastázou a s negativním nálezem jsme neprokázali signifikantní rozdíl ve frekvenci lokálních, regionálních či vzdálených metastáz.
Naše práce neprokázala, že by přítomnost mikrometastázy v sentinelové uzlině měla významně měnit průběh sledování a léčby. Adjuvantní léčba bude záviset na biologických parameterech primárního nádoru a pouze v hraničních individuálních případech je možné přihlížet k faktoru přítomnosti mikrometastázy. Další výzkum v oblasti angiogenního šíření nádoru je nezbytný.
Práce je výsledkem grantového projektu IGA MZ ČR NR 8874 - 3.
doc.
MUDr. Pavel Strnad, CSc.1
prof.
MUDr. Lukáš Rob, CSc.1
MUDr. Petr Škapa, Ph.D.2
prim.
MUDr. Hana Stankušová, CSc.3
MUDr. Kateřina Michalová4
1
Gynekologicko-porodnická klinika 2. LF UK a FN Motol
2
Ústav patologie a molekulární medicíny 2. LF UK a FN Motol
3
Radioterapeuticko-onkologické oddělení 2. LF UK a FN Motol
4
Klinika nukleární medicíny 2. LF UK a FN Motol
Sources
1. Alix ‑ Panabieres C, Muller V, Pantel K. Current status in human breast cancer micrometastases. Curr Opin Oncol 2007; 19(6): 1463 – 1472.
2. Braun S, Vogl F, Naume B. A pooled analysis of bone marrow micrometastasis in breast cancer, N Engl J Med 2005; 353(8): 793 – 802.
3. Brodt P, Fallavollita L, Sawka RJ. Tumor cell adhesion to frozen lymph node sections ‑ a correlate of lymphatic metastasis in breast carcinoma models of human and rate origin. Breast Cancer ResTreat 1990; 17(2): 109 – 120.
4. Broekhuizen LN, Wijsman JH, Peterse JL et al. The incidence and significance of micrometastases in lymph nodes of patients with ductal carcinoma in situ and T1a carcinoma of the breast. Eur J Surg Oncol 2006; 32(5): 502 – 506.
5. Bulte CS, van der Heiden ‑ van der Loo M, Hennipman A. Axillary recurrence rate after tumor negative and micrometastatic positive sentinel node procedures in breast cancer patients, a population based multicenter study. Eur J Surg Oncol 2009; 35(1): 25 – 31.
6. Cady B, Stone M, Schuler J. The new era in breast cancer. Arch Surg 1996; 131(7): 301 – 308.
7. Martelli G, Boracchi P, De Palo M. A randomized trial comparing axillary dissection to no axillary dissection in elderly patients with T1N0 breast cancer. Ann Surg 2005; 242(1):7 – 9.
8. Cady B. Should positive sentinel node cases have a further axillary dissection? Breast Cancer Online 2006; 9(8): 1 – 5.
9. Carcoforo P, Maestroni U, Querzoli P et al. Primary breast cancer features can predict additional lymph node involvement in patients with sentinel node micrometastases. World J Surg 2006; 30(9): 1653 – 1657.
10. Coburn N, Chung MA, Fulton J. Decreased breast cancer tumor size, stage, and mortality in Rhode Island: an example of a well‑screened population. Cancer Control 2004; 11(4): 222 – 289.
11. Colleoni M, Rotmensz N, Peruzzoti G. Size of breast cancer metastases in axillary lymph nodes: clinical relevance of minimal lymph node involvement. J Clin Oncol 2005; 23(7): 1379 – 1389.
12. Colpaert C, Vermeulen P, Jeuris W et al. Early distant relapse in “node ‑ negative” breast cancer patients is not predicted by occult axillary lymph node metastases, but by the features of the primary tumor, J Pathol 2001; 193(4): 442 – 449.
13. Cox CE, Kilo JV, Riker AI et al. Significance of sentinel lymph node micrometastases in human breast cancer. J Am Cull Surg 2008; 206(2): 261 – 268.
14. Caserne G, Gregory D, Marlette F et al. Meta‑analysis of non‑sentinel node metastases associated with micrometastatic sentinel nodes in breast cancer. Br J Surg 2004; 91(10): 1245 – 1252.
15. Dabs DJ, Fung M, Landsittel D et al. Sentinel lymph node micrometastasis as a predictor of axillary tumor burden. Breast J 2004; 10(2): 101 – 105.
16. Diaz NM, Cox CE, Ebert M et al. Benign mechanical transport of breast epithelial cells to sentinel lymph nodes. Am J Surg Pathol 2004; 28(12): 1641 – 1645.
17. Van Deurzen CH, Hobbelink MG, Seldenrijk CA et al. Predictive value of tumor load in breast cancer sentinel lymph nodes for second echelon lymph node metastases. Cell Oncol 2007; 29(6): 497 – 505.
18. Dowlatshahi K, Fan M, Snider HC et al. Lymph Node Micrometastases from Breast Carcinoma. Reviewing the Dilemma. Cancer 1997; 80(7): 1188 – 1197.
19. Fant JS, Grant MD, Knox SM. Preliminary outcome analysis in patients with breast cancer and a positive sentinel lymph node who declined axillary dissection. Ann Surg Oncol 2003; 10(2): 126 – 130.
20. Fiedler IJ. Seed and soil revisited: Contribution of the organ microenvironment to cancer metastasis. Surg Oncol Clin N Am 2001; 10(2): 257 – 269.
21. Fisher B, Gebhardt MC. The evolution of breast surgery, past, present, and future. Semin Oncol 1978; 5(4): 385 – 394.
22. Gebauer G, Fehm T, Merkle E et al. Micrometastases in axillary lymph nodes and bone marrow of lymph node ‑ negative breast cancer patients ‑ prognostic relevance after 10 years. Anticancer Res 2003; 23(5b): 4319 – 4324.
23. Gipponi M, Canavese G, Lionetto R et al. The role of axillary lymph node dissection in breast cancer patients with sentinel lymph node micrometastases. Eur J Surg Oncol 2006; 32(2): 143 – 147.
24. Gobardhan PD, Elias SG, Madsen EV et al. Prognostic value of micrometastases in sentinel lymph nodes of patients with breast carcinoma: a cohort study, Ann Oncol 2009;20(1): 41 – 48.
25. Houvenaeghel G, Nos C, Mignotte H et al. Micrometastases in sentinel lymph node in a multicentric study: predictive factors of nonsentinel lymph node involvement – Groupe des Chirugiens de la Federation des Centres de Lutte Contre le Cancer. J Clin Oncol 2006; 24(12): 1814 – 1822.
26. Chambers AF, Varghese HJ, MacDonald IC. Critical steps in hematogenous metastasis: An overview. Surg Oncol Clin N Am 2001; 10(2): 243 – 255.
27. Chapgar A, Middleton LP, Sahin AA et al. Clinical Outcome of Patients with Lymph Node ‑ Negative Breast Carcinoma who have Sentinel Lymph Node Micrometastases detected by Immunohistochmistry. Cancer 2005; 103(8): 1581 – 1586.
28. Chen SL, Hoehne FM, Giuliano AE. The prognostic significance of mikrometastases in breast cancer: a SEER population‑based analysis. Ann Surg Oncol 2007;14(12): 3378 – 3384.
29. Kahn HJ, Hanna WM, Chapman JA et al. Biological significance of occult micrometastases in histologically negative axillary lymph nodes in breast cancer patients using the recent American Joint Committee on Cancer breast cancer staging system. Breast J; 12(4), 2006 : 294 – 301.
30. Kamath VJ, Giuliano R, Dauway EL et al. Characteristics of the sentinel node in breast cancer predict further involvement of higher ‑ echelon nodes in the axilla: a study to evaluate the need for complete axillary lymph node dissection. Arch Surg 2001; 136(6): 688 – 692.
31. Kuijt GP, Voogd AC, van de Poll ‑ Franse LV et al. The prognostic significance of axillary lymph ‑ node micrometastases in breast cancer patients. Eur J Surg Oncol 2005; 31(5): 500 – 505.
32. Langer I, Marti WR, Guller U et al. Axillary recurrence rate in breast cancer patients with negative sentinel node (SLN) or SLN micrometastases: prospective Analysis of 150 patients after SLN biopsy. Ann Surg 2005; 241(1): 152 – 158.
33. Maibenco DC, Dombi GW, Kau TY et al. Significance of micrometastases on the survival of women with T1 breast cancer. Cancer 2006; 107(6): 1234 – 1239.
34. De Mascarel I, MacGrogan G, Debled M et al. Distinction between isolated tumor cells and micrometastases in breast cancer is it reliable and useful? Cancer 2008; 112(8): 1672 – 1678.
35. Menes TS, Tartter PI, Mizrachi H et al. Breast cancer patients with pN(i+) and pN1(mi) sentinel nodes have high rate of nonsentinel node metastases. J Am Coll Surg 2005; 200(3): 323 – 327.
36. Meng S, Tripathy D, Frenkel EP. Circulating tumor cells in patients with breast cancer dormancy. Clin Cancer Res 2004; 10(24): 8152 – 8162.
37. Millis RR, Springall R, Lee AH et al. Occult axillary lymph node metastases are of no prognostic significance in breast cancer. Br J Cancer 2002; 86(3): 396 – 401.
38. Moore KH, Thaler HT, Tan LK. Immunohistochemically detected tumor cells in the sentinel lymph nodes of patients with breast carcinoma: biologic metastasis or procedural artifact? Cancer 2004; 100(5): 929 – 934.
39. Querzoli P, Pedriali M, Rinaldi R et al. Axillary lymph node nanometastases are prognostic factors for disease‑free survival and metastatic relapse in breast cancer patients. Clin Cancer Res 2006; 12(22): 6696 – 6701.
40. Rutgers EJ. Sentinel node micrometastasis in breast cancer. Br J Surg 2004; 91(10): 1241 – 1242.
41. Rutledge H, Davis J, Chiu R et al. Sentinel node micrometastases in breast carcinoma may not be an indication for complete axillary dissection. Mod Pathol 2005; 18(6): 762 – 768.
42. Susnik B, Frkovic ‑ Grazio S, Bracko M. Occult micrometastases in axillary lymph nodes predict subsequent distant metastases in stage I breast cancer: a case ‑ control study with 15‑year follow up. Ann Surg Oncol 2004; 11(6): 553 – 554.
43. Tan LK, Giri D, Hummer AJ. Occult axillary node metastases in breast cancer are prognostically significant: results in 368 node ‑ negative patients with 20‑year follow‑up. J Clin Oncol 2008; 26(11): 1803 – 1809.
44. Viale G, Maiorano E, Mazzarol G. Histologic detection and clinical implications of micrometastases in axillary sentinel lymph nodes for patients with breast carcinoma. Cancer 2001; 92(6): 1378 – 1384.
45. Woelfle U, Cloos J, Sauter G. Molecular signature associated with bone marrow micrometastasis in human breast cancer. Cancer Res 2003; 63(18): 5679 – 5684.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Practical Gynecology

2009 Issue 4
-
All articles in this issue
- Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
- Dopplerometrie ductus venosus
- Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
- Molekulovo- genetická analýza tumorsupresorových génov PTEN a TP53 u pacientky s karcinómom endometria
- Biologická léčba karcinomu prsu
- Tradiční peruánská medicína v léčbě neplodnosti
- Rýchla prenatálna diagnostika chromozómových aneuploidií
- Mikrobiologické vlastnosti kmenů endogenní vaginální flóry asymptomatických žen reprodukčního věku
- Practical Gynecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Dopplerometrie ductus venosus
- Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
- Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
- Mikrobiologické vlastnosti kmenů endogenní vaginální flóry asymptomatických žen reprodukčního věku
