Vybrané imunohistochemické prognostické faktory karcinomu endometria
Selected immunohistochemical prognostic factors of endometrial cancer
Objective:
To assess the immunohistochemical expression of p53, bcl - 2, c - erbB - 2, Ki - 67, estrogen (ER) and progesterone (PR) receptors, matrix metalloproteinase - 7 (MMP - 7) and matrix metalloproteinase - 26 (MMP - 26) in endometrial cancer patients. To assess the relation between steroid receptor positivity and other markers. Design: Experimental prospective study. Setting: Department of Obstetrics and Gynecology, Department of Genetics, Department of Pathology, Palacky University Medical School and University Hospital, Olomouc. Methods: We studied 144 cases of primary untreated endometrial carcinoma in which the p53, bcl - 2, c - erbB - 2, Ki - 67, ER, PR, MMP - 7 and MMP - 26 antigens were investigated with the use of immunohistochemical methods. We evaluated the correlations between immunohistochemical staining and the age, FIGO stage, grading, depth of invasion and metastatic spread to lymph nodes. Results: Mean age was 65.7 years (range 34 – 90). p53, bcl - 2, c - erbB - 2, Ki - 67, ER, PR were positive in 35 (24.3 %), 100 (69.4 %), 41 (28.4 %), 65 (45.1 %), 115 (79.8 %) and 127 (88.1 %) cases respectively. MMPs were evaluated in a group of 70 patients, MMP - 7 was positive in 33 (47.1 %), MMP - 26 in 40 (57.1 %) cases. MMP - 7 expression decreased with higher patient age. p53 and Ki - 67 overexpression was found to be related to poor differentiation. Immunostaining for bcl - 2 correlated with the positivity of steroid receptors status, while immunostaining for c - erbB - 2 correlated inversely with ER positive group of cases. Conclusion: The overexpression of p53 and Ki - 67 seems to indicate a more malignant phenotype, while bcl - 2 expression in dependence on steroid receptor positivity could contribute to the identification of high‑risk tumors.
Key words:
endometrial cancer – immunohistochemistry – prognostic factors
Authors:
I. Marková; M. Lubušký; M. Procházka; Milan Kudela
; M. Dušková; J. Zapletalová; R. Pilka
Authors‘ workplace:
Ústav genetiky a fetální medicíny, LF UP a UP Olomouc, Porodnicko‑gynekologická klinika, LF UP a UP Olomouc, Ústav patologické anatomie, LF UP a UP Olomouc, Ústav lékařské biofyziky, pracoviště biometrie, UP Olomouc
Published in:
Prakt Gyn 2010; 14(1): 14-21
Category:
Original Article
Overview
Cíl studie:
Zjistit pomocí imunohistochemického vyšetření expresi p53, bcl - 2, c - erbB - 2, Ki - 67, estrogenového (ER) a progesteronového (PR) receptoru, matrix metaloproteinázy - 7 (MMP - 7) a matrix metaloproteinázy - 26 (MMP - 26) u pacientek s karcinomem endometria. Zhodnocení vztahu mezi pozitivitou steroidních receptorů a ostatními markery. Typ studie: Experimentální prospektivní studie. Název a sídlo pracoviště: Porodnicko‑gynekologická klinika, Ústav lékařské genetiky, Ústav patologie, Ústav lékařské biofyziky, LF UP a FN Olomouc. Metodika: Studovali jsme 144 případů primárně neléčeného karcinomu endometria, u nichž jsme pomocí imunohistochemického vyšetření stanovovali přítomnost p53, bcl - 2, c - erbB - 2, Ki - 67, ER, PR, MMP - 7 a MMP - 26. Stanovili jsme korelace mezi imunohistochemickým barvením a věkem, FIGO stadiem, grade, hloubkou invaze a metastatickým šířením do lymfatických uzlin. Výsledky: Průměrný věk byl 65,7 let (rozmezí 34 – 90). p53, bcl - 2, c - erbB - 2, Ki - 67, ER a PR byly pozitivní u 35 (24,3 %), 100 (69,4 %), 41 (28,4 %), 65 (45,1 %), 115 (79,8 %) a 127 (88,1 %) případů. MMP - 7 a MMP - 26 byly hodnoceny ve skupině 70 pacientek s endometriálním karcinomem, MMP - 7 byla pozitivní ve 33 (47,1 %) a MMP - 26 ve 40 (57,1 %) případech. Snížená exprese MMP - 7 korelovala s vyšším věkem pacientek. Zvýšená exprese p53 a Ki - 67 signifikantně korelovala se špatnou diferenciací. Imunohistochemické barvení pro bcl - 2 signifikantně korelovalo s pozitivitou v hormonálním zastoupení steroidních receptorů, zatímco imunohistochemické barvení pro c - erbB - 2 korelovalo inverzně ve skupině ER pozitivních případů. Závěr: Zvýšená exprese p53 a Ki - 67 pravděpodobně indikuje malignější fenotyp, zatímco exprese bcl - 2 v závislosti na steroidních receptorech by mohla přispět k identifikaci vysoce rizikových nádorů.
Klíčová slova:
endometriální karcinom – imunohistochemie – prognostický faktor
Úvod
Gynekologické zhoubné nádory představují přibližně 15% všech nádorových onemocnění ženské populace v České republice. Endometriální karcinom je po zhoubných nádorech prsu nejčastější gynekologickou malignitou. Stejně jako v ostatních vyspělých zemích má jeho incidence v ČR neustále stoupající trend. Odhaduje se, že každým rokem onemocní celosvětově tímto onemocněním asi 170 000 žen [1]. V roce 2005 dosáhla v ČR incidence poměru 33,2/100 000 žen, což v absolutních číslech znamená, že onemocnělo 1 739 žen [2].
Příčiny rostoucí incidence jsou multifaktoriální, v určitém smyslu lze proto hovořit o nemoci civilizační. Průběh onemocnění závisí při diagnóze na věku, histologickém typu, stavu hormonálních receptorů, klinickém stadiu a dalších faktorech. Je zřejmé, že tyto údaje odrážejí složitou etiologii onemocnění, která zahrnuje jak endogenní, tak exogenní faktory [3]. Důležitou roli při vzniku endometriálního karcinomu hrají faktory životního prostředí. Rostoucí frekvence výskytu tohoto onemocnění se často vysvětluje dietními a hormonálními vlivy, velmi důležitým faktorem je stále se prodlužující průměrný věk ženské populace [4].
Ve skupině sporadických případů tvoří přibližně 80% případů karcinom endometria typu I (hormonálně dependentní, se vztahem k absolutnímu či relativnímu hyperestrinismu, vznikající na terénu hyperplastického endometria). Zbývajících cca 20% pak představuje typ II (s nejasnou etiopatogenezou, s absencí typických rizikových faktorů typu I a vznikající na terénu atrofického endometria). Mezi nejdůležitější rizikové faktory patří prolongovaná stimulace endometria vlivem estrogenů neoponovaná gestageny, obezita, věk, nulliparita, diabetes mellitus, hypertenze a léčba tamoxifenem. V mnoha případech je patrné jejich současné spolupůsobení [3,5–8]. Ačkoli většina případů endometriálního karcinomu je sporadickým onemocněním, na hereditárním podkladě jich vzniká přibližně 5–10%. Naprostá většina těchto pacientek nese mutaci v některém z genů tzv. mismatch-repair systému (geny MLH1, MSH2, MSH6, PMS2), a je tak nosičkou Lynchova syndromu označovaného také jako HNPCC (Hereditary non‑polyposis colorectal cancer syndrom) [9].
Pro zlepšení léčby a dispenzarizace pacientek s endometriálním karcinomem byla studována řada prognostických faktorů. Dobře známý a rutinně v klinické praxi používaný je věk pacientky, stadium onemocnění, histologický typ nádoru, histologický grade, hloubka myometrální invaze a postižení lymfatických uzlin [3,5,10–12]. U endometriálního karcinomu dosud nebyl nalezen žádný specifický sérový tumor marker. V současné době je velká snaha o přesnější identifikaci vysoce rizikových skupin, která by umožnila jednak konzervativní léčbu u pacientek s dobrou prognózou a také rezervovat účinnou a radikálnější léčbu pro nemocné s agresivnějšími typy nádorů. Proto jsou v poslední době intenzivně studovány další faktory, které by mohly vést k lepšímu pochopení molekulárních základů endometriální kancerogeneze a následně ke zlepšení klasifikace, prognózování a individualizaci léčby těchto nádorů. Názor, že proces kancerogeneze je mnohastupňový děj, je již poměrně široce akceptován. Řada studií prokázala, že zhoubné tumory vykazují rozdílné typy genetické instability a molekulárních alterací. Stejně tak je pro endometriální karcinom charakteristická škála genetických změn na molekulární úrovni [13–15].
Abnormální zvýšená exprese p53 tumor supresorového genu u karcinomu endometria koreluje s agresivními histologickými typy, pokročilým stadiem onemocnění a kratší dobou přežití [16–19].
Bcl-2 je onkogen, který inhibuje apoptózu a prodlužuje přežití buňky. Zvýšená exprese je popisována u hyperplazie endometria, kdežto ztráta exprese je spojována s horší prognózou, větší hloubkou myometrální invaze, pokročilejším stupněm onemocnění a vyšší pravděpodobností výskytu lymfatických metastáz [19–22].
Amplifikace a zvýšená exprese onkogenu c-erbB-2 (lidský celulární onkogen identický s krysím HER 2/neu) se vyskytuje u 10–40% karcinomů endometria a koreluje s horší prognózou a agresivnějším chováním nádoru [23–24]. Klinické využití tohoto faktoru zůstává zatím nejednoznačné, protože negativní prognostický dopad nebyl potvrzen ve všech studiích [23,25].
Mezi jeden z nejznámějších markerů buněčné proliferace patří Ki-67. Většina endometriálních karcinomů exprimuje nízký proliferační index Ki-67 a má příznivou prognózu, zatímco většina serózních a světlobuněčných tumorů má vysoký proliferační index. Korelace s gradingem, stadiem onemocnění a histopatologickým typem tumoru byla potvrzena v mnoha studiích [26–28].
Endometrium je cílovou tkání steroidních hormonů produkovaných ovarii. Jak v epiteliálních, tak ve stromálních buňkách endometria jsou přítomny estrogenové (ER) a progesteronové (PR) receptory. Zdá se, že exprese ER a PR hraje významnou roli v endometriální kancerogenezi. Dle výsledků řady studií je exprese těchto receptorů spojena s dobře diferencovanými tumory, koreluje se stadiem nádoru a přežitím [26,29–31].
Matrix metaloproteináza (MMP-7) byla imunolokalizována v nádorových buňkách 73% případů endometriálního karcinomu a vyšší hladina její exprese byla spojena s pokročilejším stupněm onemocnění a přítomností metastáz v lymfatických uzlinách [32].
Vysoké hladiny matrix metaloproteinázy 26 (MMP-26) byly popsány v hyperplastickém endometriu, zatímco s histologickou dediferenciací její exprese v endometriálním karcinomu klesá. Podobně jako MMP-7 je i tento enzym omezen pouze na epiteliální a nádorové buňky endometria [33]. Význam MMP-7 a MMP-26 pro prognózu žen s karcinomem endometria dosud nebyl studován.
Význam různých imunohistochemických parametrů pro prognózu pacientek s karcinomem endometria dosud nebyl jednoznačně stanoven. Snahou je použitím informací získaných ze změn exprese nádorových biomarkerů přispět ke snížení radikality chirurgické a radiační terapie. Cílem naší práce bylo imunohistochemické stanovení exprese molekulárně biologických markerů, zhodnocení vztahu mezi pozitivitou steroidních receptorů a ostatními markery a korelace všech biomarkerů s klinickopatologickými charakteristikami endometriálního karcinomu.
Materiál a metodika
Charakteristika souboru
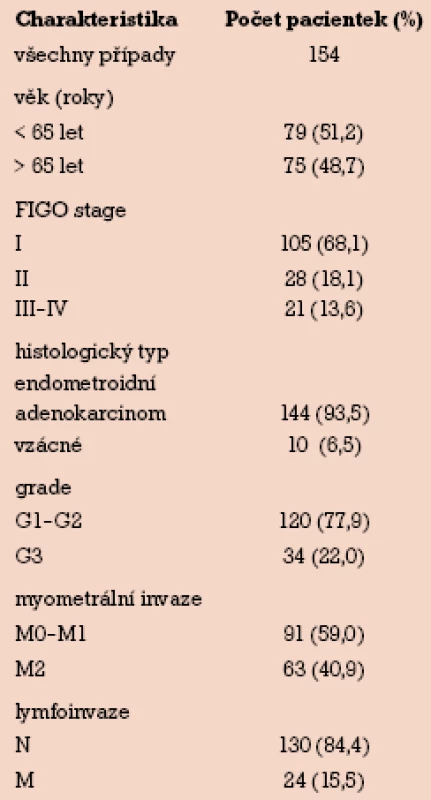
V období od září 2001 do března 2009 jsme na porodnicko‑gynekologické klinice FN Olomouc studovali 154 případů primárně neléčeného karcinomu endometria. Pooperační staging byl proveden podle FIGO klasifikace (1988). Průměrný věk pacientek byl 65,7 let (rozmezí 34–90). Do stadia I dle FIGO klasifikace bylo zařazeno 105 (68,1%) pacientek, do stadia II 28 (18,1%) pacientek a do stadia III a IV 21 (13,6%) pacientek. Histologickým typem nádoru byl ve 144 (93,5%) případech endometroidní adenokarcinom. Skupinu zbývajících 10 (6,5%) vzácných nálezů tvořil v šesti případech serózní papilární adenokarcinom, ve dvou případech světlobuněčný karcinom, jeden karcinosarkom a jeden stromální sarkom, které byly ze studie vyloučeny. Do skupiny grading G1 a G2 bylo zařazeno 120 (77,9%) pacientek, skupinu G3 tvořilo 34 (22,0%) pacientek. Nádory bez myometrální invaze (M0) nebo nádory s invazí do méně než poloviny tloušťky myometria (M1) tvořilo skupinu 91 (59,0%) pacientek, invaze přesahující polovinu tloušťky myometria (M2) tvořilo 63 (40,9%) případů. Metastatické šíření bylo nepřítomno u 130 (84,4%) pacientek, u 24 (15,5%) případů byly metastázy přítomny (tab. 1).
U všech pacientek byla provedena abdominální hysterektomie s oboustrannou adnexektomií. Systematická pánevní lymfadenektomie byla provedena u 107 (69,4%) rizikových pacientek.
Rizikové pacientky dále pooperačně v rámci onkologické kliniky FN Olomouc podstupovaly aktinoterapii a brachyterapii dle individuálního rozhodnutí. Po skončení radioterapie byly dále dispenzarizovány v pravidelných intervalech v Centru onkologické prevence na gynekologicko‑porodnické klinice FN Olomouc.
Imunohistochemické zpracování
Zpracovaný materiál tvořily karcinomy endometria získané od pacientek z abdominální hysterektomie po potvrzení diagnózy z diagnostické kyretáže. Vzorky byly standardně rutinně zpracovány po 24hod fixaci 10% formaldehydem a zality do parafinových bloků s následným rutinním barvením hematoxylin‑eosinem pro světelnou mikroskopii ke stanovení histopatologické diagnózy. Pro následnou sérii imunohistologických vyšetření byly vybrány vzorky s dostatečným množstvím dobře zachované nádorové struktury a zpracovány ve tkáňových řezech o síle 5–8 μm na sklíčkách potažených Vectabondem (Vector). Pro detekci jednotlivých markerů byla použita standardní nepřímá imunohistochemická technika se souborem králičích nebo myších protilátek (pro p53, c-erbB-2, Ki-67, ER a PR – DAKO, pro bcl-2 – BIOGENEX, pro MMP-7 a MMP-26 ABCAM).Vyšetření byla prováděna s pozitivní kontrolou.
Kvantifikace pozitivity byla vyjadřována v procentech. Jako hranice pozitivity p53, bcl-2, c-erbB-2, Ki-67, MMP-7 a MMP-26 byla stanovena hodnota mediánu. Jako p53 a bcl-2 pozitivní byly hodnoceny vzorky s jaderným barvením 20% nádorových buněk a více, jako Ki-67 pozitivní s barvením 40% a více. Vzorky s membránovou pozitivitou c-erbB-2 byly hodnoceny jako pozitivní v 10% a více, hranice pozitivity MMP-7 byla stanovena na 65% a více, MMP-26 40% a více. Hranice pozitivity ER a PR byla na základě četných předchozích studií stanovena na 5% [34–36].
Statistické vyhodnocení
K posouzení vztahu klinickopatologických parametrů s imunohistochemickými markery a vztahu mezi imunohistochemickými markery v závislosti na stavu hormonálních receptorů byly použity chí-kvadrát test a Fisherův exaktní test. Hladina statistické významnosti byla stanovena pro p < 0,05. Ke zpracování byl použit statistický program SPSS verze 15 (SPSS Inc., Chicago, USA).
Výsledky
Korelace s klinickopatologickými parametry
V tab. 2 uvádíme distribuci pozitivního imunohistochemického barvení v závislosti na jednotlivých klinickopatologických parametrech u 144 případů endometriálního karcinomu.
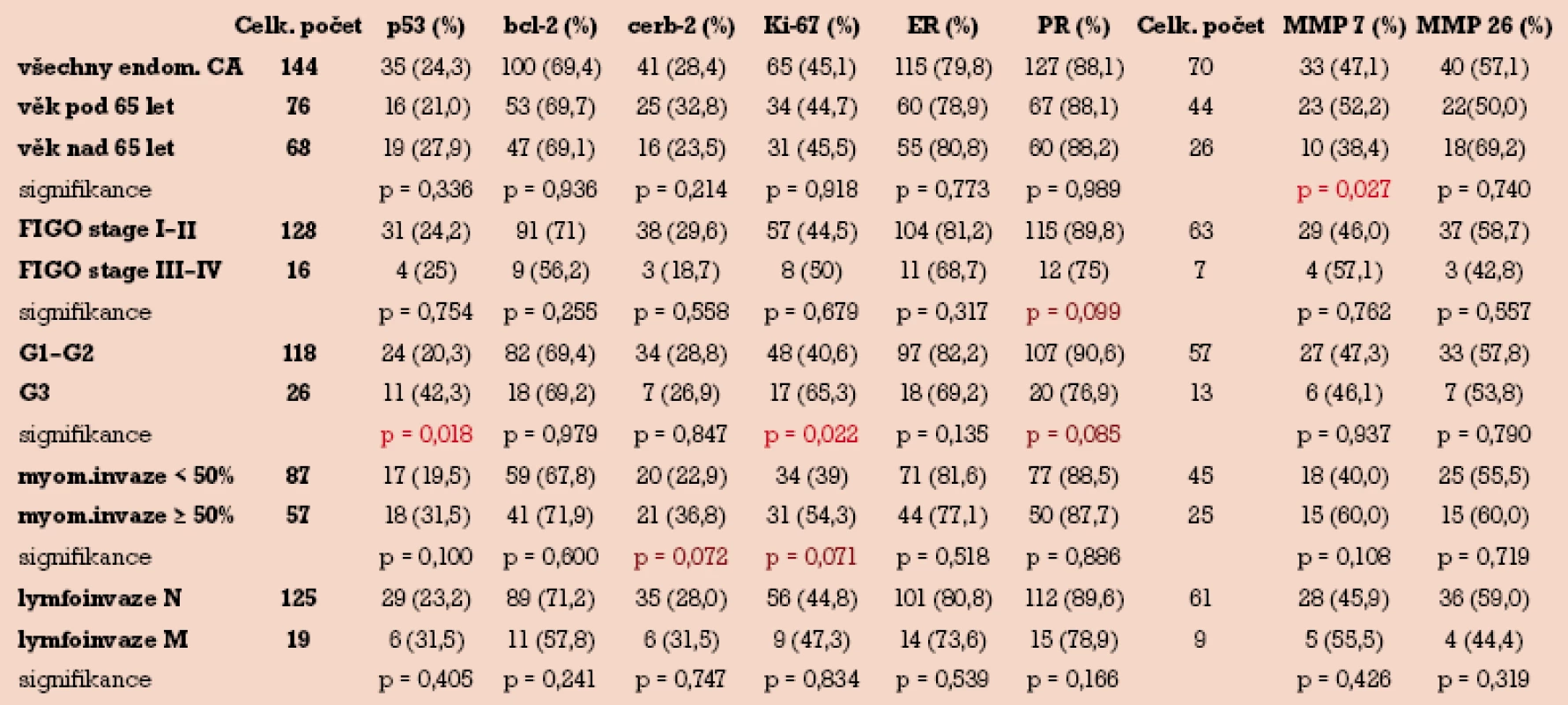
p53 byl pozitivní ve 35 (24,3%), bcl-2 ve 100 (69,4%), c-erbB-2 ve 41 (28,4%), Ki-67 v 65 (45,1%), ER ve 115 (79,8%) a PR ve 127 (88,1%) případech. Metaloproteinázy MMP-7 a MMP-26 byly hodnoceny ve skupině pouze 70 pacientek s endometriálním karcinomem, z čehož MMP-7 byla pozitivní ve 33 (47,1%) případech a MMP-26 ve 40 (57,1%) případech.
Byla prokázána statisticky významná závislost mezi gradingem a p53. Ve skupině s G3 byla signifikantně vyšší pozitivita p53 ve srovnání se skupinou G1–G2 (42,3% vs 20,3%) při hladině signifikance testu p = 0,018. Podobně ve skupině Ki-67 pozitivních tumorů byla nalezena korelace s gradingem, ve skupině s grade G3 byla signifikantně vyšší pozitivita Ki-67 ve srovnání s G1–G2 (65,3% vs 40,6%) při hladině p = 0,022. Jediný marker, který koreloval s věkem pacientek, byla MMP-7, kdy ve skupině pacientek s věkem pod 65 let byla signifikantně vyšší pozitivita tohoto markeru ve srovnání s pacientkami nad 65 let (52,2% vss 38,4%) při hladině p = 0,027.
Ačkoli nebyla nalezena statisticky významná závislost mezi bcl-2, c-erbB-2, ER, PR, MMP-26 a některým z klinickopatologických parametrů, pozorovali jsme trend zvýšené exprese c-erbB-2 a Ki-67 při myoinvazi nad 50% tloušťky myometria. Naopak u PR jsme zaznamenali trend snížené exprese u klinicky pokročilých nádorů (FIGO III–IV) a u nádorů špatně diferencovaných (G3).
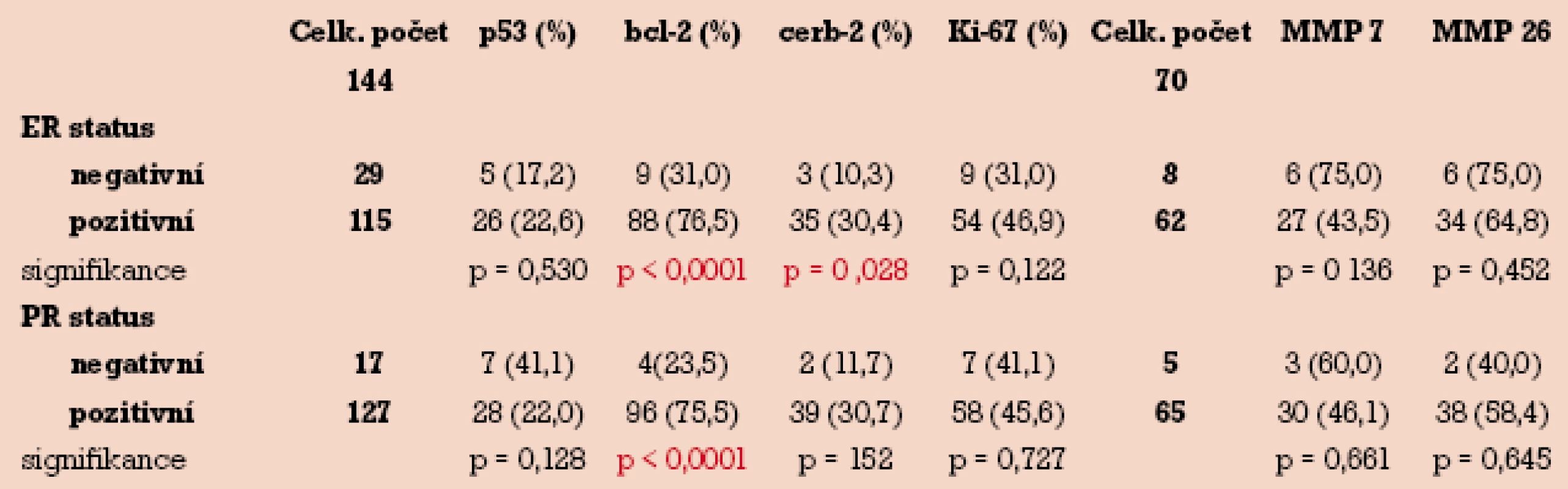
p53, bcl-2, c-erbB-2, Ki-67 a MMP v závislosti na stavu hormonálních receptorů
Dle stanovené hranice pozitivity (5%) bylo 115 (79,8%) vzorků se středním nebo výrazným stupněm imunohistochemického barvení pro ER hodnoceno jako pozitivních. Rovněž pro PR dle stanovené hranice pozitivity (5%) bylo 127 (88,1%) vzorků hodnoceno jako pozitivní. Jak vyplývá z tab. 3, nebyl nalezen žádný významný rozdíl v pozitivitě barvení p53, Ki-67, MMP-7 a MMP-26 v závislosti na ER nebo PR pozitivitě. Naproti tomu procento bcl-2 pozitivních endometriálních tumorů bylo signifikantně vyšší ve skupině ER pozitivní než ve skupině ER negativní (76,5% vs 31,0%) při hladině p < 0,0001. Podobně byla nalezena signifikantně vyšší pozitivita bcl-2 ve skupině PR pozitivní než ve skupině PR negativní (75,5% vs 23,5%) při hladině p < 0,0001. Překvapivě byla nalezena statisticky významná závislost mez ER skupinou a c-erbB-2, kdy ve skupině ER pozitivní byla signifikantně vyšší pozitivita tohoto markeru ve srovnání se skupinou ER negativní (30,4% vs 10,3%) při hladině p = 0,028.
Diskuze
Z výsledků naší práce vyplývá korelace některých biologických markerů s klinickopatologickými prognostickými faktory u primárního karcinomu endometria.
Zvýšená exprese p53 signifikantně korelovala v naší studii pouze s nízkým stupněm diferenciace endometriálních nádorů. Tumor supresorový gen p53 je jeden z nejčastěji mutovaných genů v lidských nádorech, velmi důležitou roli hraje rovněž u zhoubných nádorů endometria. Řada prací dokládá souvislost mezi zvýšenou expresí p53 a nepříznivými prognostickými faktory u žen s primárním endometriálním karcinomem [19–20,28,37]. Geisler et al navíc prokázali, že p53 imunoreaktivita může predikovat rekurenci u pacientek s endometriálním karcinomem [38]. Mariani et al ve své studii popisují p53 jako jediný molekulární marker schopný predikovat vzdálené metastázy nezávisle na ostatních histopatologických, molekulárních a cytokinetických parametrech [24]. Podobných výsledků dosáhli nedávno Pijnenborg et al průkazem zvýšené exprese p53 v recidivujích nádorech, kdy tím stejně jako Mariani podpořil hypotézu, že p53 se podílí na nádorové progresi a procesu metastazování u endometriálního karcinomu [39]. Dále byla různými autory prokázána daleko vyšší exprese p53 v serózních a světlobuněčných nádorech než v endometriálním karcinomu, což potvrzuje hypotézu mutace genu p53 jako pozdní události u endometriálního karcinomu, kdežto časné události vzniku u vzácných nádorů endometria [29,40–41]. Svými výsledky studia imunoreaktivity p53 u G3 tumorů a serózních papilárních nádorů Halperin et al dokládají jedinečnost G3 tumorů, které mají histopatologicky blíže k seróznímu papilárnímu než k endometriálnímu karcinomu. G3 tumory pravděpodobně vykazují odlišnou cestu kancerogeneze než G1 a G2 tumory [29,42]. Podobný závěr předpokládají i výsledky naší práce.
Antiapoptotický gen bcl-2 svou regulací programované buněčné smrti prodlužuje přežití buňky, a přispívá tím k šíření nádorového procesu. Imunohistochemická exprese proteinu se během menstruačního cyklu mění; zvýšená exprese je typická pro proliferativní fázi cyklu, kdežto v sekreční fázi cyklu je zřetelná down-regulace v expresi tohoto onkogenu. Proto se předpokládá, že zvýšená exprese bcl-2 může být časným dějem v rámci kancerogeneze různých typů nádorů [43–44]. V řadě studií již bylo ověřeno, že exprese bcl-2 se zvyšuje u endometriálních hyperplazií, kdežto v endometriálním karcinomu je exprese snížena. Tato ztráta exprese koreluje s horší prognózou, horším klinickým stadiem onemocnění, hloubkou myometrální invaze a postižením lymfatických uzlin [19–22,45]. Vztah mezi ztrátou exprese bcl-2 a biologickou agresivitou endometriálního karcinomu se zdá paradoxní, mechanizmus tohoto jevu zatím není přesně znám. Nicméně vzhledem k tomu, že exprese bcl-2 je alespoň částečně regulována estrogenem a p53 a pokročilé karcinomy jsou často spojeny se ztrátou ER a mutací p53, mohou tyto molekulární změny do jisté míry vysvětlovat ztrátu exprese tohoto onkogenu [19,46]. Stejně tak jako Appel et al jsme v naší práci nenalezli souvislost bcl-2 exprese se stupněm diferenciace nádorů, hloubkou myometrální invaze a postižením lymfatických uzlin [47]. V souladu s pracemi dalších autorů jsme ale prokázali významnou pozitivní korelaci mezi expresí bcl-2 a pozitivitou v hormonálním zastoupení ER a PR [21,29,45], což by mohl být důležitý prognostický faktor pro negativní prognózu pacientek.
Zvýšená exprese Ki-67 svědčí o zvýšené buněčné mitotické aktivitě a proliferaci. Většina endometriálních karcinomů exprimuje nízký proliferační index Ki-67 a má příznivou prognózu, zatímco většina serózních a světlobuněčných tumorů má vysoký proliferační index. Řada autorů ve svých studiích prokázala, že Ki-67 je nezávislý prognostický indikátor přežití [16,28,48–49]. Naproti tomu Pansare et al neprokázali žádnou korelaci mezi Ki-67, histologickým typem, grade nebo klinickým stadiem onemocnění [50]. Zvýšená Ki-67 exprese signifikantně korelovala v naší práci s nízkou diferenciací, pozorovali jsme také trend zvýšené exprese u nádorů s hlubokou invazí. Naše výsledky jsou částečně v souladu s pracemi Laxe et al a Salvesenové et al, kteří prokázali korelaci zvýšené exprese Ki-67 s gradingem, hloubkou myometrální invaze a rizikem rekurence [18,27].
Zvýšená exprese onkogenu c-erbB-2 korelující s horší prognózou již byla potvrzena u různých zhoubných nádorů, např. u karcinomu prsu [51]. Údaje ohledně amplifikace a exprese u karcinomu endometria se různí. Zvýšená exprese dle některých autorů koreluje s gradingem, hloubkou myometrální invaze a pokročilým stadiem onemocnění. Je velmi pravděpodobné, že zvýšená exprese tohoto onkogenu bude patřit mezi pozdní události v kancerogenezi endometriálního karcinomu, kdežto u serózních karcinomů půjde o časnou událost vzniklou de novo [52–55]. V naší práci jsme neprokázali signifikantně významnou závislost s tradičními prognostickými faktory endometriálního karcinomu, podobně jako Coronado et al, Czerwenka et al nebo Pisani et al [25,56–57]. Nicméně jsme mohli pozorovat trend zvýšené exprese s hlubokou invazí, což koreluje s výše uvedenými výsledky studií. Naopak v závislosti exprese c-erbB-2 na stavu hormonálních receptorů jsme prokázali signifikantně vyšší expresi ve skupině ER pozitivních případů. Mariani et al prokázali ve své analýze u 283 pacientek silnou vazbu pozitivního barvení c-erbB-2 s predikcí vzdálených metastáz a horší celkovou prognózou [24]. Navíc Morrison et al prokázali nedávno ve své rozsáhlé studii (483 případů) zvýšenou expresi c-erbB-2 jako nezávislého prognostického faktoru korelující s horším přežitím [58]. Vzhledem k častým protichůdným výsledkům studií je využití tohoto faktoru zatím nejednoznačné.
ER a PR jsou přítomny jak v normální endometriální tkáni, tak u endometriálních karcinomů, typická je jejich rozdílná distribuce. Dle výsledků různých autorů přítomnost a množství steroidních receptorů koreluje s klinickým stadiem onemocnění, histologickým gradingem a přežitím. Absence steroidních receptorů je považována za negativní prognostický faktor agresivního růstu a špatné prognózy [26,30,59–60]. Exprese ER a PR v naší práci nedosáhla statistické významnosti v závislosti na klinickém stadiu, gradingu, myometrální invazi či metastatickém šíření, nicméně je patrný trend inverzní korelace PR s klinickým stadiem III–IV a horší diferenciací nádorů. Tento výsledek je v souladu s výše uvedenými pracemi, navíc se zdá, že PR může být silnějším prognostickým faktorem než ER, jak dokládají další autoři [31,60–61].
Matrix metaloproteinázy patří do rodiny enzymů zinek-dependentních endopeptidáz, které degradují extracelulární matrix. Doposud bylo popsáno více než 25 podtypů těchto enzymů, na základě své struktury jsou dále řazeny do osmi různých tříd, jejich produkce je vyvolána zánětlivým nebo nádorovým procesem [62]. Jeden z důležitých členů rodiny metaloproteináz s epiteliální expresí je MMP-7 (matrilysin‑1), jehož exprese byla zachycena jak v normálních, tak v maligních epiteliálních buňkách. Publikovaných studií zaměřených na expresi MMP-7 v endometriálním karcinomu je v současné době omezené množství. Ueno et al ve své práci prokázali zvýšenou expresi MMP-7 korelující s horším klinickým stadiem nemoci a přítomností lymfatických metastáz [32]. Podobný trend popisují ve své studii i Graesslin et al a Wang 2005 [63–64]. V naší práci jsme nalezli pouze významnou závislost mezi věkem a MMP-7, kdy u pacientek starších 65 let byla exprese MMP-7 signifikantně nižší.
Další člen podrodiny matrilysin enzymů byl popsán jako MMP-26 (matrilysin‑2). MMP-26 je rovněž exprimována v různých tkáních jak normálních, tak maligních včetně endometriálního karcinomu. Výsledky práce různých autorů napovídají, že ačkoli MMP-26 patří do stejné podrodiny metaloproteináz jako MMP-7, její funkce bude patrně odlišná. Je známo, že exprese MMP-26 specificky kolísá během menstruačního cyklu. Nález vysokých hladin uprostřed cyklu a v hyperplastickém endometriu a naopak nízké hladiny v pozdní fázi cyklu a endometrálním karcinomu napovídají korelaci s estrogenovými receptory. Isaka et al a Pilka et al prokázali výrazně sníženou expresi MMP-26 v endometriálním karcinomu, což je v rozporu s výsledky práce Tunuguntly et al, kteří popisují zvýšenou imunohistochemickou expresi MMP-26 v nízce diferencovaném endometrálním karcinomu [33,65–66]. V naší studii jsme neprokázali závislost na klasických prognostických faktorech endometriálního karcinomu.
Závěr
Cílem naší práce bylo imunohistochemické stanovení exprese molekulárně biologických markerů a zhodnocení korelace těchto markerů s tradičními klinickopatologickými charakteristikami endometriálního karcinomu. Význam různých imunohistochemických parametrů pro prognózu pacientek s karcinomem endometria dosud nebyl jednoznačně stanoven. Snahou je použitím informací získaných ze změn exprese nádorových biomarkerů přispět ke snížení radikality chirurgické a radiační terapie. Z výsledků naší práce vyplývá, že kromě klinickopatologických faktorů mohou molekulárně biologické prognostické faktory přispět k lepší charakteristice nádorů, a přispět tak k přesnějšímu stanovení jejich klinického chování. Cílem do budoucna by mělo být další rozdělení podtypů endometriálního karcinomu v závislosti na jejich genetických alteracích, a to zejména těch, které mají prognostický význam. Je pravděpodobné, že budoucí histologické klasifikace budou více spočívat na molekulární bázi. Pro případné praktické diagnosticko‑terapeutické využití molekulárně biologických faktorů bude potřeba dalších zpřesňujících studií.
Tato studie byla podpořena grantem IGA MZ ČR NR 9098-4/2006.
MUDr. Ivana Marková1
doc. MUDr. Marek Ľubušký, Ph.D.2
doc. MUDr. Martin Procházka, Ph.D.2
prof. MUDr. Milan Kudela, CSc.2
MUDr. Milada Dušková3
Mgr. Jana Zapletalová, Dr.4
doc. MUDr. Radovan Pilka, Ph.D.2
1 Ústav genetiky a fetální medicíny,
LF UP a UP Olomouc
2 Porodnicko‑gynekologická klinika,
LF UP a UP Olomouc
3 Ústav patologické anatomie,
LF UP a UP Olomouc
4 Ústav lékařské biofyziky,
pracoviště biometrie, UP Olomouc
imickova@email.cz
Sources
1. World Cancer Research Fund/ American Institute for Cancer Research.: Food, Nutrition and the Prevention of Cancer: a Global Perspective. Washington DC: AICR 1997.
2. Ústav zdravotnických informací a statistiky ČR ve spolupráci s Národním onkologickým registrem ČR. Novotvary 2005 ČR.
3. Rose PG. Endometrial carcinoma. N Engl J Med 1996; 335(9): 640 – 649.
4. Fader AN, Gibbons HE. Pomáháme ženám s karcinomem endometria žít déle a lépe. Gynekologie po promoci 2008; 8(1): 34 – 39.
5. Ascher SM, Reinhold C. Imaging of cancer of the endometrium. Radiol Clin North Am 2002; 40(3): 563 – 576.
6. Canavan TP, Doshi NR. Endometrial cancer. Am Fam Physician 1999; 59(11): 3069 – 3077.
7. Detailed guide: Endometrial (uterine) cancer. American Cancer Society. Available from: <http:/ / documents.cancer.org/140.00/ 140.00.pdf>.
8. Goodman MT, Hankin JH, Wilkens LR et al. Diet, body size, physical activity, and the risk of endometrial cancer. Cancer Res 1997; 57(22): 5077 – 5085.
9. Lu KH, Broaddus RR. Gynecologic cancers in Lynch syndrome/ HNPCC. Fam Cancer 2005; 4(3): 249 – 254.
10. Creasman WT. Malignant tumors of the uterine corpus. In: Rock JA, Jones HW (eds). Operative gynecology. Philadelphia: Lippincott Williams & Wilkins 2003; 1445 – 1486.
11. Kodama S, Kase H, Tanaka K et al. Multivariate analysis of prognostic factors in patients with endometrial cancer. Int J Gynaecol Obstet 1996; 53(1): 23 – 30.
12. Hrachovec P, Pilka R, Dzvinčuk P et al. Rizikové a protektivní faktory karcinomu endometria. Gynekolog 2001; 3 : 120 – 122.
13. Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100(1): 57 – 70.
14. Liu FS. Molecular carcinogenesis of endometrial cancer. Taiwan J Obstet Gynecol 2007; 46(1): 26 – 32.
15. Salvesen HB, Akslen LA. Molecular pathogenesis and prognostic factors in endometrial carcinoma. APMIS 2002; 110(10): 673 – 689.
16. Geisler JP, Wiemann MC, Zhou Z et al. p53 as a prognostic indicator in endometrial cancer. Gynecol Oncol 1996; 61(2): 245 – 248.
17. Cherchi PL, Marras V, Capobianco G et al. Prognostic value of p53, c - erb - B2 and MIB - 1 in endometrial carcinoma. Eur J Gynaecol Oncol 2001; 22(6): 451 – 453.
18. Lax SF, Pizer ES, Ronnett BM et al. Clear cell carcinoma of the endometrium is characterized by a distinctive profile of p53, Ki - 67, estrogen, and progesterone receptor expression. Hum Pathol 1998; 29(6): 551 – 558.
19. Ohkouchi T, Sakuragi N, Watari H et al. Prognostic significance of Bcl - 2, p53 overexpression, and lymph node metastasis in surgically staged endometrial carcinoma. Am J Obstet Gynecol 2002; 187(2): 353 – 359.
20. Erdem O, Erdem M, Dursum A et al. Angiogenesis, p53 and bcl - 2 expression as prognostic indicators in endometrial cancer: Comparison with traditional clinicopathological variables. Int J Gynecol Pathol 2003; 22(3): 254 – 260.
21. Sakuragi N, Ohkouchi T, Hareyama H et al. Bcl - 2 expression and prognosis of patients with endometrial carcinoma. Int J Cancer 1998; 79(2): 153 – 158.
22. Yamauchi N, Sakamoto A, Uozaki H et al. Imunohistochemical analysis of endometrial adenocarcinoma for bcl - 2 and p53 in relation to expression of sex steroid receptor and proliferative activity. Int J Gynecol Pathol 1996; 15(3): 202 – 208.
23. Lukes AS, Kohler MF, Pieper CF et al. Multivariable analysis of DNA ploidy, p53, and HER - 2/ neu as prognostic factors in endometrial cancer. Cancer 1994; 73(9): 2380 – 2385.
24. Mariani A, Sebo TJ, Webb MJ et al. Molecular and histopathologic predictors of distant failure in endometrial cancer. Cancer Detect Prev 2003; 27(6): 434 – 441.
25. Pisani AL, Barbuto DA, Chen D et al. HER - 2/ neu, p53, and DNA analyses as prognosticators for survival in endometrial carcinoma. Obstet Gynecol 1995; 85(5 Pt 1): 729 – 734.
26. Ferrandina G, Ranelletti FO, Gallotta V et al. Expression of cyclooxygenase - 2(COX‑2), receptors for estrogen (ER) and progesteron (PR), p53, Ki - 67, and neu protein in endometrial cancer. Gynecol Oncol 2005; 98(3): 383 – 389.
27. Salvesen HB, Iversen OE, Akslen LA. Identification of high‑risk patients by assessment of nuclear Ki - 67 expression in aprospective study of endometrial carcinomas. Clin Cancer Res 1998; 4(11): 2779 – 2785.
28. Salvesen HB, Iversen OE, Akslen LA. Prognostic significance of angiogenesis and Ki - 67, p53, and p21 expression: a population‑based endometrial carcinoma study. J Clin Oncol 1999; 17(5): 1382 – 1390.
29. Halperin R, Zehavi S, Habler L et al. Comparative immunohistochemical study of endometrioid and serous papillary carcinoma of endometrium. Eur J Gynaecol Oncol 2001; 22(2): 122 – 126.
30. Kadar N, Malfetano JH, Homesley HD. Steroid receptor concentrations in endometrial carcinoma: effect on survival in surgically staged patients. Gynecol Oncol 1993; 50(3): 281 – 286.
31. Morris PC, Anderson JR, Anderson B et al. Steroid hormone receptor content and lymph node status in endometrial cancer. Gynecol Oncol 1995; 56(3): 406 – 411.
32. Ueno H, Yamashita K, Azumano I et al. Enhanced production and activation of matrix metalloproteinase - 7 (matrilysin) in human endometrial carcinomas. Int J Cancer 1999; 84(5): 470 – 477.
33. Pilka R, Norata GD, Domanski H et al. Matrix metalloproteinase - 26 (matrilysin‑2) expression is high in endometrial hyperplasia and decreases with loss of histological differentiation in endometrial cancer. Gynecol Oncol 2004; 94(3): 661 – 670.
34. Fitzgibbons PL, Page DL, Weaver D et al. Prognostic factors in breast cancer. College of American Pathologists Consensus Statement 1999. Arch Pathol Lab Med 2000; 124(7): 966 – 978.
35. Jalava P, Kuopio T, Huovinen R et al. Immunohistochemical staining of estrogen and progesterone receptors: aspects for evaluating positivity and defining the cutpoints. Anticancer Res 2005; 25(3c): 2535 – 2542.
36. Ogawa Y, Moriya T, Kato Yet al. Immunohistochemical assessment for estrogen receptor and progesterone receptor status in breast cancer: analysis for a cut‑off point as the predictor for endocrine therapy. Breast Cancer 2004; 11(3): 267 – 275.
37. Soong R, Knowles S, Williams KE et al. Overexpression of p53 protein is an independent prognostic indicator in human endometrial carcinoma. Br J Cancer 1996; 74(4): 562 – 567.
38. Geisler JP, Geisler HE, Wiemann MC et al. p53 expression as a prognostic indicator of 5‑year survival in endometrial cancer. Gynecol Oncol 1999; 74(3): 468 – 471.
39. Pijnenborg JM, van de Broek L, Dam de Veen GC et al. TP53 overexpression in recurrent endometrial carcinoma. Gynecol Oncol 2006; 100(2): 397 – 404.
40. Tashiro H, Isacson C, Levine R et al. P53 gene mutations are common in uterine serous carcinoma and occur early in their pathogenesis. Am J Pathol 1997; 150(1): 177 – 185.
41. Zheng W, Cao P, Zheng M et al. P53 overexpression and bcl - 2 persistence in endometrial carcinoma: comparison of papillary serous and endometroid subtypes. Gynecol Oncol 1996; 61(2): 167 – 174.
42. Inoue M. Current molecular aspects of the carcinogenesis of the uterine endometrium. Int J Gynecol Cancer 2001; 11(5): 339 – 348.
43. Chen Y, Sato M, Fujimura S et al. Expression of Bcl - 2, Bax, and p53 proteins in carcinogenesis of squamous cell lung cancer. Anticancer Res 1999; 19(2B): 1351 – 1356.
44. Stattin P, Damber JE, Karlberg L et al. Bcl - 2 immunoreactivity in prostate tumorigenesis in relation to prostatic intraepithelial neoplasia, grade, hormonal status, metastatic growth and survival. Urol Res 1996; 24(5): 257 – 264.
45. Geisler JP, Geisler HE, Wiemann MC et al. Lack of bcl - 2 persistence: an independent prognostic indicator of poor prognosis in endometrial carcinoma. Gynecol Oncol 1998; 71(2): 305 – 307.
46. Liu G, Schwartz JA, Brooks SC. p53 down - regulates ER - responsive genes by interfering with the binding of ER to ERE. Biochem Biophys Res Commun. 1999; 264(2): 359 – 364.
47. Appel ML, Edelweiss MI, Fleck J et al. p53 and bcl - 2 as prognostic markers in endometrial carcinoma. Pathol Oncol Res 2008; 14(1): 23 – 30.
48. Geisler JP, Geisler HE, Miller GA et al. MIB - 1 in endometrial carcinoma: prognostic significance with 5‑year follow‑up. Gynecol Oncol 1999; 75(3): 432 – 436.
49. Nordström B, Strang P, Bergström R et al. A comparison of proliferation markers and their prognostic value for women with endometrial carcinoma. Ki - 67, proliferating cell nuclear antigen, and flow cytometric S - phase fraction. Cancer 1996; 78(9): 1942 – 1951.
50. Pansare V, Munkarah AR, Schimp V et al. Increased expression of hypoxia - inducible factor 1alpha in type I and type II endometrial carcinomas. Mod Pathol 2007; 20(1): 35 – 43.
51. Kakar S, Puangsuvan N, Stevens JM et al. HER - 2/ neu assessment in breast cancer by immunohistochemistry and fluorescence in situ hybridization: comparison of results and correlation with survival. Mol Diagn 2000; 5(3): 199 – 207.
52. Ioffe OB, Papadimitriou JC, Drachenberg CB et al. Correlation of proliferation indices, apoptosis and related oncogene expression (bcl - 2 and c - erbB - 2) and p53 in proliferative, hyperplastic and malignant endometrium. Hum Pathol 1998; 29(10): 1150 – 1159.
53. Khalifa MA, Mannel RS, Haraway SD et al. Expression of EGRF, HER - 2/ neu, p53 and PCNA in endometrioid, serous papillary and clear cell endometrial adenocarcinomas. Gynecol Oncol 1994; 53(1): 84 – 92.
54. Matias - Guiu X, Catasus L, Bussaglia E et al. Molecular pathology of endometrial hyperplasia and carcinoma. Hum Pathol 2001; 32(6): 569 – 577.
55. Williams JA jr, Wang ZR, Parrish RS et al. Fluorescence in situ hybridisation analysis of HER - 2/ neu, c - myc and p53 in endometrial cancer. Exp Mol Pathol 1999; 67(3): 135 – 143.
56. Coronado PJ, Vidart JA, Lopez - Asenjo JA et al. P53 overexpression predicts endometrial carcinoma recurrence better than HER - 2/ neu overexpression. Eur J Obstet Gynecol Reprod Biol 2001; 98(1): 103 – 108.
57. Czerwenka K, Lu Y, Heuss F. Amplification and expression of the c - erbB - 2 oncogene in normal, hyperplastic, and malignant endometria. Int J Gynecol Pathol 1995; 14(2): 98 – 106.
58. Morrison C, Zanagnolo V, Ramirez N et al. HER - 2 is an independent prognostic factor in endometrial cancer: association with outcome in a large cohort of surgically staged patients. J Clin Oncol 2006; 24(15): 2376 – 2385.
59. Jazaeri AA, Nunes KJ, Dalton MS et al. Well‑differentiated endometrial adenocarcinomas and poorly differentiated mixed mullerian tumors have altered ER and PR isoform expression. Oncogene 2001; 20(47): 6965 – 6969.
60. Nyholm HC, Christensen IJ, Nielsen AL. Progesterone receptor levels independently predict survival in endometrial adenocarcinoma. Gynecol Oncol 1995; 59(3): 347 – 351.
61. Fukuda K, Mori M, Uchiyama M et al. Prognostic significance of progesterone receptor immunohistochemistry in endometrial carcinoma. Gynecol Oncol. 1998; 69(3): 220 – 225.
62. Nagase H, Woessner JF jr. Matrix metalloproteinases. J Biol Chem. 1999; 274(31): 21491 – 21494.
63. Graesslin O, Cortez A, Uzan C et al. Endometrial tumor invasiveness is related to metalloproteinase 2 and tissue inhibitor of metalloproteinase 2 expressions. Int J Gynecol Cancer 2006; 16(5): 1911 – 1917.
64. Wang FQ, So J, Reierstad S et al. Matrilysin (MMP - 7) promotes invasion of ovarian cancer cells by activation of progelatinase. Int J Cancer 2005; 114(1): 19 – 31.
65. Isaka K, Nishi H, Nakai H et al. Matrix metalloproteinase - 26 is expressed in human endometrium but not in endometrial cancer. Cancer 2003; 97(1): 79 – 89.
66. Tunuguntla R, Ripley D, Sang QX et al. Expression of matrix metalloproteinase - 26 and tissue inhibitors of metalloproteinases TIMP - 3 and - 4 in benign endometrium and endometrial cancer. Gynecol Oncol 2003; 89(3): 453 – 459.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Practical Gynecology

2010 Issue 1
-
All articles in this issue
- Stav okrajů konizací s histologickým nálezem carcinoma in situ
- Vybrané imunohistochemické prognostické faktory karcinomu endometria
- ICTP marker a karcinóm prsníka s mts do kostí – naše skúsenosti
- Terapeutické možnosti asistované reprodukce u pacientek se sníženou ovariální rezervou
- Intrahepatálna cholestáza gravidných – vybrané perinatologické ukazovatele
- Obezita v perimenopauze a možnosti řešení
- Vliv kyseliny dokosahexaenové na antenatální vývoj plodu a postnatální vývoj dítěte
- Practical Gynecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Stav okrajů konizací s histologickým nálezem carcinoma in situ
- ICTP marker a karcinóm prsníka s mts do kostí – naše skúsenosti
- Intrahepatálna cholestáza gravidných – vybrané perinatologické ukazovatele
- Terapeutické možnosti asistované reprodukce u pacientek se sníženou ovariální rezervou
