REHABILITACE V ONKOLOGII
Rehabilitation in Oncology
The authors present a comprehensive review of general principles of therapeutic rehabilitation in patients with oncological diseases.
Key words:
tumor diseases, oncology, multimodal oncological therapy, complex rehabilitation care
Authors:
V. Hradil; O. Kittlerovátrávníčková
Authors‘ workplace:
Institut onkologie a rehabilitace Na Pleši, s. r. o, Nová Ves pod Pleší
Published in:
Rehabil. fyz. Lék., 14, 2007, No. 4, pp. 135-146.
Category:
Original Papers
Overview
Autoři podávají ucelený přehled obecných principů léčebné rehabilitace u pacientů s onkologickým onemocněním.
Klíčová slova:
nádorová onemocnění, onkologie, multimodální onkologická terapie, komplexní rehabilitační péče
ÚVOD
V ČR ročně přibývá přes 66 tisíc nových záchytů novotvarů a ročně na nádorová onemocnění umírá přibližně 29 tisíc pacientů. Statisticky lze konstatovat, že každých 8 minut je diagnostikován nový onkologický pacient. Rozšiřující se spektrum multimodální onkologické terapie prodlužuje u nemocných s nádorovým onemocněním 5leté přežití. U těchto pacientů tak vzrůstá význam komplexní rehabilitační péče. Jejím cílem je udržení maximální možné kvality života, soběstačnosti, nezávislosti a návrat do normálního života či do zaměstnání s minimálním pracovním omezením.
OBECNÉ ASPEKTY REHABILITACE
Rehabilitační problematika u pacientů s novotvary má svá specifika a je závislá na:
- postižené anatomické oblasti,
- histologickém typu tumoru,
- stadiu onemocnění,
- onkologické léčbě s vedlejšími efekty,
- věku pacienta,
- prognóze,
- psychickém stavu,
- sociálním zázemí.
Didakticky lze terapeutické cíle rehabilitace dělit do 4 kategorií:
- preventivní,
- obnovující,
- podpůrný,
- paliativní.
Základem adekvátní rehabilitační péče je komplexní týmová spolupráce s dalšími lékařskými obory ve spojení s péčí rodiny, event. sociálních pracovníků a dopomocí homecare.
Při vstupním vyšetření je vhodné funkční ohodnocení (otestování), posuzující celkový stav a dovednosti pacienta s využitím některé mezinárodní klasifikační stupnice: např. Karnofski skore, FIM, WHO klasifikace. Onkologická terapie a vývoj onemocnění způsobují změny klinického stavu a tak i posun klasifikačního stupně u jednotlivých nemocných.
Rehabilitace onkologických pacientů má svá specifika i kontraindikace, ale v zásadě je přístup obdobný jako u ostatních nemocných. Rehabilitační program je často přerušován z důvodů plánované chemoterapie, radioterapie, imunoterapie, event. pro vedlejší účinky onkologické léčby.
Časté jsou specifické komplikace:
- interního charakteru (anémie, kardiomyopatie, infekty v důsledku myelosuprese apod.),
- neurologického charakteru (encefalopatie, parézy, polyneuropatie apod.),
- chirurgické komplikace (komprese různých anatomických strukturileozní stavy apod.),
- ortopedické komplikace u metastatického rozsevu do skeletu apod.
PARAMETRY SIGNALIZUJÍCÍ PŘERUŠENÍ NEBO OMEZENÍ REHABILITAČNÍHO PROGRAMU
1. Laboratorní hodnoty
Hematologický profil:
Leukocyty pod 3000 (snížení imunity)-individuální rehabilitační přístup v závislosti na klinickém stavu (teploty, schvácenost, únava). Svalová aktivita způsobuje přechodnou leukocytózu s eventuální možností zkreslení laboratorních výsledků (proto je vhodné před krevními odběry i při stabilizovaném onkologickém stavu omezení tělesné zátěže).
Hemoglobin (saturace kyslíku)
V případě poklesu pod 75g/l: volíme pouze minimální fyzickou aktivitu na lůžku, pasivní udržení kloubních rozsahů, polohování.
Při hodnotách 75-100 g/l ordinujeme svalovou aktivní práci v režimu zejména izometrických kontrakcí v celém rozsahu kloubní hybnosti.Vhodná je svalová aktivita do 3. stupně svalového testu. Nevhodná je aerobní zátěž a koncentrická svalová kontrakce. Hodnoty 100-120g/l dovolují svalovou práci s koncentrickou svalovou kontrakcí. Je možná lehká aerobní aktivita, plná mobilita
Trombocyty (riziko krvácení)
U trombocytopenických stavů hrozí zvýšené riziko hypertenze, nebezpečí svalového a nitro-kloubního krvácení. Proto dodržujeme režimová opatření dle laboratorních hodnot:
- pod 25 000: nulová fyzická aktivita,
- 25 000-50 000: aktivně jen udržení rozsahů hybnosti a mobility pacienta,
- nad 50 000: možná izometrická a lehká koncentrická svalová práce, nevhodný je protrahovaný strečink a výraznější koncentrická svalová aktivita
2. Metastázy dlouhých kostí
(femur, tibie, humerus)
- více než 50 % postižení kompakty kosti vede k imobilizaci v daném segmentu; vzhledem k omezené mobilitě s nutností adekvátního polohování využíváme ortézy a dlahy,
- u 25-50 % postižení kostní kompakty má rhb pomoci udržet mobilitu, možný je aktivní pohyb do spontánní kloubní hybnosti,
- 25 % kompakty kosti nebo léze větší než 3 cm v oblasti femuru umožňují submaximální izometrickou svalovou zátěž a lehké individuální aerobní cvičení.
3. Komprese důležitého orgánu, cévy nebo kosti
- pasivní i aktivní LTV dle závažnosti stavu ve spolupráci s onkologem.
4. Pleurální, perikardiální, retroperitoneální výpotek nebo ascites
(sdružený s bolestí, dušností a omezenou střevní motilitou), vhodná jen submaximální izometrická svalová zátěž a udržení celkové mobility.
5. Poruchy vědomí, koma nebo zvýšený intrakraniální tlak - polohování, pasivní cvičení.
6. Minerálová dysbalance(především K+ pod 3,0 mmol/l, Na+ pod 130 mmol/l)-submaximální svalová zátěž, s kontrolou laboratorních hodnot, konzultace s ošetřujícím lékařem.
7. Výrazná ortostatická hypotenze nebo hypertenze
nad 160/100 mm Hg, srdeční akce nad 110/min nebo závažné poruchy rytmu – individuální zatížení podle NYHA, submaximální TF s monitoringem TF+TK. Kontrola TF před zátěží-během-a po svalové práci, kontrola TK před a po zátěži.
TF nesmí být během zátěže zvýšena o více než 30 tepů/minutu. Pokud je klidová TF 100/min a více, aktivní zátěž setrvává na výchozí hodnotě TF, tzv. podprahová cvičební jednotka. Nutná konzultace s internistou.
ZÁSADY REHABILITACE U ONKOLOGICKÝCH PACIENTŮ
Principy
- Přístup a rozhodnutí o použité aplikaci rehabilitačních technik a prostředků fyzikální terapie je přísně individuální.
- Důležitá je spolupráce s onkologem a posouzení tzv. TNM onkologické klasifikace, která určuje rozsah tumoru, uzlinové postižení a vzdálené metastázy.
- Fyzikální terapii lze aplikovat jen na vzdálených místech od primárního nádoru, s přihlédnutím k přítomnosti známých nádorových ložisek v proudové dráze (mimo TENS proudů).
- Při aplikaci fyzikální terapie nutno vyloučit aplikaci v lokalitách lymfatických splavů (mimo pressoterapie).
MOŽNOSTI APLIKACE FYZIKÁLNÍ TERAPIE
Termoterapie
- Negativní termoterapie s respektováním zásadních kontraindikací termoterapie - (pozor na následnou reaktivní hyperémii).
- Celková hydroterapie s teplotou vody do 36°, (37 °C vzestup teploty jádra o 0,1st/ 5 min, s rizikem zvýšeneného prokrvení).
- Lokální hydroterapie (na principu hypotermické aplikace se snížením teploty dané oblasti).
Elektroterapie – principy aplikace
- Lege artis je v místě tumoru nebo metastatického rozsevu možná pouze aplikace TENS analgetických proudů.
- Mimo místo tumoru či metastatického rozsevu je možné analgetické využíti nízkofrekvenční, středofrekvenční a stejnosměrné elektroterapie (např. vzestupná nebo sestupná klidová galvanizace nebo Amosovy proudy u postcytostatické periferní polyneuropatie).
- Jako elektrostimulace oslabených nebo denervovaných svalů.
Aplikace světelné energie
Použití laseru nebo polarizovaného světla je možné pouze na místech vzdálených od primárního tumoru (dle klasifikace TNM).
SPECIÁLNÍ TECHNIKY VYUŽÍVANÉ V ONKOLOGII
Rehabilitace onkologických pacientů má svá specifika a kontraindikace.V principu je přístup obdobný jako u ostatních nemocných, ale vždy je přísně individuální, s přihlédnutím ke klinickému i psychickému stavu nemocného a schopnostem jeho aktivní spolupráce.
- Manuálně-mobilizační techniky a techniky měkkých tkání: jsou běžně užívány s přihlédnutím k onkologickým KI, nikdy však ne v místě ložiska či metastázy nádoru.
- Manuální lymfodrenáž (přístrojová pressoterapie): jsou běžně užívány s přihlédnutím k onkologickým KI, nutno respektovat event. porušení kožního krytu.
- Relaxační techniky: nejpoužívanějším je Schultzův autogenní trénink.
- Techniky a metodiky na neurofyziologickém podkladě: využívají se hlavně u neurologických komplikací onkologických pacientů. Vždy je nutno předem posoudit možnosti a schopnosti spolupráce nemocného, s přihlédnutím k jeho objektivnímu i subjektivnímu stavu.
PNF – Kabat: nutná aktivní spolupráce pacienta, při cvičení je výhodné pokud nemocný kontroluje pohyby zrakem. Používá se cvičení v diagonálách pro horní i dolní končetiny, hlavu a krk. Pohyby lze provádět pasivně, s dopomocí, aktivně i proti odporu. Pasivní vedení pohybu v diagonálách je neurofyziologicky mnohem účinnější než pasivní pohyby prováděné izolovaně v jednotlivých rovinách.
Bobath koncept: nutná adekvátní spolupráce pacienta. Cílem metodiky je nácvik základních poloh a pohybů jako je sed, stoj, chůze, ale i zlepšení kvality prováděných běžných denních činností, včetně oblékání a schopnosti sebeobsluhy při příjmu potravy. Výhodné je využívat terapeutické postupy při polohování pacientů. Postup terapie (při nácviku antispastických vzorců), je často negativně ovlivněn sníženou schopností pacienta uvědomit si a prožít pohyb.
Senzomotorická stimulace: vhodná je zvýšená opatrnost při cvičení na labilních plochách vzhledem k častému metastatickému postižení skeletu a přítomnosti neurologických komplikací. Metodiku lze využít ke zlepšení držení těla a stabilizaci trupu ve stoji a při chůzi, k ovlivnění senzorických poruch a poruch propriocepce doprovázejících neurologická onemocnění, u nestability a hypermobility pohybového aparátu i k úpravě poruch rovnováhy.
Vojtova reflexní lokomoce: oficiálně KI, ale používaná jak u neurologických poruch, tak u poruch pohybového aparátu. Výhodou metodiky je automatické vyvolání pohybových programů. Při terapii tak není nutná aktivní spolupráce pacienta. Terapie se většinou provádí v nejrůznějších modifikacích lehu, takže ji lze použít i u zcela imobilních pacientů.
Kontraindikace
Kontraindikovány jsou všechny postupy a metodiky zvyšující buněčný metabolismus, lokální hyperémii a následnou vasodilataci v místě tumoru pro vyšší riziko nádorové disseminace.
Mezi tyto metody patří :
- ultrazvuk,
- aplikace pozitivní termoterapie v místě primárního tumoru,
- vodoléčebné procedury nad 36° C,
- magnetoterapie,
- diatermie,
- elektroterapie v blízkosti primárního tumoru (s vyjímkou TENS),
- Vojtova reflexní lokomoce je KI pro zvýšení metabolismu, ovlivnění vegetativních funkcí a u onkologických pacientů pro časté další rizikové faktory, např. kortikoterapie, febrilní stavy,
- jakékoliv typy stimulací a masáží v místě tkáně postižené nádorovými buňkami, event. po nedávném odstranění tumoru,
- zásadně kontraindikovány jsoumanipulační a nárazové techniky v místě metastatického postižení skeletu i v sousedních segmentech.
Volba rehabilitačního programu u onkologických pacientů a jeho intenzita jsou přísně individuální s ohledem k aktuálním indikacím a kontraindikacím u pacienta. Pokud přetrvává únava i 60 minut po aktivní svalové práci, doporučuje se svalovou zátěž redukovat.
Problematika rehabilitace onkologických pacientů je velmi obsáhlá. Před zahájením rehabilitační léčby je nutno zvážit všechny dále uvedené skutečnosti, které ovlivňují stav pacienta a podstatně předurčují možnosti a kvalitu rehabilitace.
A) BOLESTIVÝ VZOREC A JEHO OVLIVNĚNÍ
Bolestivý syndrom je přítomen u 30-50 % pacientů s primárním onkologickým onemocněním bez metastatického rozsevu, ale až u 90 % pacientů s pokročilým nádorovým onemocněním. Léčebná strategie spočívá ve správném výběru farmakologické i nefarmakologické léčby. Rozlišení mezi akutní a chronickou bolestí, typem bolesti, intenzitou, lokalizací a vlivem bolesti na různé denní činnosti a spánek má důležitý vliv na úspěch terapie.
Chronická bolest u onkologických pacientů převládá a je nejčastějším příznakem. Její ovlivnění je značně složité pro fixovaný centrální bolestivý vzorec. Postihuje až 90 % pacientů s pokročilým disseminovaným onkologickým onemocněním.Působí nejen ve sféře fyzické a emocionální, ale i v oblasti existenčně sociální (např. návrat do zaměstnání).
Bolest a obecně všechny subjektivně nepříjemné příznaky vedou cestou společných neuromediátorů (neurokininy, substance P, noradrenalin atd.) k depresivnímu ladění a poté cestou poruchy v oblasti thalamo-hypothalamické ke zhoršení funkce autonomního nervového systému s poklesem imunity. Tato fyziologická reakce je mnohonásobně potencována u onkologických pacientů. U 65-75 % pacientů vzniká bolest následkem invaze nádorového procesu do viscerálních orgánů, měkkých tkání, nervových struktur, ev. infil-tracíkostní tkáně. U 15-25 % pacientů je přítomna bolest na podkladě chirurgické, radiační a cytostatické léčby s následným poškozením nervových struktur, vznikem steroidního pseudorevmatismu, aseptických kostních nekróz, mukozitidy, fibrózních změn ve tkáních, píštělích, dráždivých jizvách atd. U 5-10 % pacientů bolest nesouvisí s onkologickou problematikou.
Onkologickou bolest podle patogenních mechanismů dělíme na:
- Nociceptivně somatickou, vznikající drážděním mechano-termo a chemoreceptorů v postižené tkáni, kůži, podkoží a periostu, např. kostními metastázami.
- Neuropatickou bolest, provázející paraneoplastické syndromy, toxické polyneuropatie apod.
- Deaferentační bolest při prorůstání nádoru do nervového kořene, plexu či periferního nervu, event. jako postchirurgický bolestivý syndrompři poškození kožních a hlubokých nervů, nebo jako fantomové bolesti, postamputační kauzalgie .
- Reaktivní bolest.
- Psychogenní bolest.
V závislosti na individuálním prahu bolesti a psychologickém stavu má bolest složku nervově senzorickou, kognitivně vyhodnocovací a emoční.
Farmakologický přístup ovlivnění bolesti vychází z doporučeného schématu WHO: neopiodní analgetika až silné opioidy + adjuvantní užití antidepresiv, psychostimulancíí, bisfosfonátů, kortikoidů atd.
Hlavním problémem analgetické léčby je poddávkování, dle statistik bylo v r. 2001 v USA farmakologicky nedostatečně léčeno až 80 % pacientů s pokročilým onkologickým onemocněním.Bariérou účinné analgetické léčby je neznalost základních pravidel analgetické farmakoterapie, strach z tolerance vůči opiátům, z psychického návyku, z deprese dýchacího centra.
U chronické bolesti rezistentní na opiátyse relativně běžně ve vhodné indikaci a s přihlédnutím k prognóze, používají:
- a) anesteziologicko-chirurgické výkony, např. somatické a sympatické nervové blokády, epidurální či subarachnoidální anestezie s aplikací opiátů a anestetik k ovlivnění spinálních i centrálních receptorů, chemická neurolýza (alkoholem) a radiační neurolýza,
- b) individuální epidurální katetry s automatickým dávkovačem nebo portem vyvedeným na kůži.
Vzácné neurochirurgické výkony v onkologii užívané k ovlivnění bolesti v závislosti na prognóze nemocného:
- a) SCS-(spinal cord stimulation) - epidurální vpich v etáži Th7/9, elektroda se zavádí do výšších etáží k Th 5/7 a v principu jde o elektrostimulaci dorzálních drah-baterie vydrží 5 let,
- b) DREZ-(dorzal root entry zone) provádí se v oblasti C p., principem je spálení vstupní zóny kořene v míše (přerušení 1 vrátek),
- c) termoleze míšních drah v centrálním kanále.
Zcela vyjímečně jsou v onkologii užívané neurochirurgické ablativní stereotaktické procedury, např. analgetická hypofyzektomie, thalamectomie, anterolaterální chordotomie, komisurální myelotomie, spinální traktotomie, rizotomie, cingulotomie.
Zvyšuje se četnost využití metodik psychologického ovlivnění chronické bolesti, s využitím modulace dolního prahu bolesti. Využívají se behaviorální a kognitivní strategie, relaxační metody a autogenní trénink, biofeedback, hypnóza aj.
B) PROBLEMATIKA METASTATICKÉHO POSTIŽENÍ SKELETU
Kostní metastázy se vyskytují nejčastěji u pokročilých karcinomů prsu, plic, prostaty, ledviny a štítné žlázy. Častá je rozsáhlá infiltrace kostní dřeně u hematologických malignit (např. leukémií mnohočetného myelomu, maligních lymfomů). Nejčastěji jsou postiženy obratle, pánevní skelet, femur, žebra a lebeční kost. Klinicky je přítomna různě intenzivní bolest, lokální nestabilita a variabilní neurologická symptomatologie. Kostní metastický proces může mít charakter lytické nebo plastické léze, event. charakter smíšeného postižení. Lytické léze jsou typické u tumorů prsu, plic, ledvin, gastrointestinálního traktu, neuroblastomu, lymfomu a melanomu. Plastické léze jsou typické pro ca prostaty a oba typy se mohou vyskytovat současně u jednoho typu tumoru.
Statisticky Mirels na velkých souborech čísel prokázal, že přítomnost osteolytického ložiska vede ve 48 % ke vzniku patologické fraktury. Přítomnost smíšené metastázy vede ve 32 % ke vzniku patologické fraktury, kdežto přítomnost osteoplastického metastatického ložiska vede ke vzniku fraktury jen výjimečně.
Karcinom prsu je podle celosvětových statistik zodpovědný za 30-50 % všech patologických fraktur dlouhých kostí. Více než polovina z nich je lokalizována v proximálním femuru. Vyšší riziko fraktury je v intervalu 6-8 týdnů po analgetické radiaci, vzhledem k nekróze tumoru a zvýšené fragilitě kostní tkáně.
Riziko vzniku patologické fraktury v onkologii určuje tzv. Mirelsův skórovací systém
Mirels statisticky prokázal, že:
- jen 5 % meta ložisek vel. 1/3 až 2/3 šíře kosti vede k patologické zlomenině,
- 81 % meta ložisek nad 2/3 šíře kosti vede k patologické zlomenině (tab. 1, schéma 1).
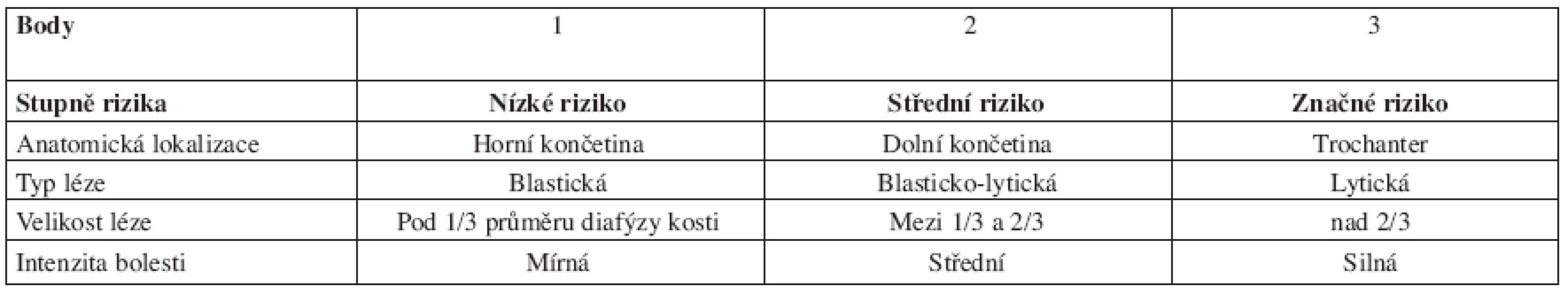

Určení rizika patologické fraktury v oblasti páteře s využítím třísloupcového modelu podle Denise
Významné narušení stability páteře vzniká při metastatickém postižení středního sloupce samotného nebo předního a zadního sloupce zároveň. Jednoznačný laboratorní průkaz meta postižení zatím neexistuje. Metastatické postižení skeletu má nespecifickou odezvu v laboratorních parametrech. Ovlivněny jsou hodnoty: Ca2+, osteokalcinu, ALP, paraproteinu, prokolagenu 1, hydroxyprolinu a hydroxylyzinu v moči, parathormonu, dynamika v hodnotách KO a dynamika onkologických markerů (schéma 2).

Markery kostního metabolismu
- a) markery novotvorby kostní tkáně: ALP, kostní izoenzym ALP, osteokalcin, prokolagen, N-terminální propeptid kolagenu I (PINP),
- b) markery kostní resorpce: hydroxyprolin a hydroxylyzin v moči, Ca v moči, sialoprotein, N-telopeptid, C-terminální peptid kolagenu I (ICTP).
Stabilizace metastatických fraktur v oblasti páteře
1. Konzervativní přístup - stabilizace-korzety a ortotické pomůcky) následně rehabilitační program.
2. Operační přístup - dnešním trendemjsou miniinvazivní metody:
- a) vertebroplastika - indikace: osteolytické metastázy ve skeletu. Cílem je stabilizace a analgetický efekt. Jde o paliativní výkon (princip navrtání obratlového těla + doplnění kostním cementem) s možností časné vertikalizace. Nevýhodou je ne vždy dokonalá repozice obratlového těla s rizikem malpozice cementu a nebezpečím embolizace;
- b) kyfoplastika - indikace: izolované porotické postižení na principu roztlačení obratle balonkem s reparací kyfotizovaného obratlového těla cementem. Je indikována u větších lokálních deformit – (úhel kyfozy větší než 15 %, ev. snížení obratlového těla nad 20 % výšky). U onkologických postižení používána spíše vyjímečně;
- c) spondylochirurgické operační techniky k ošetření metastatického postižení skeletu: náhrada těla obratle, posterolaterální déza, laterální déza, PLIF, ALIF, intersegmentální fixace, 360° fúze ze zadního přístupu atd.
Cíle rehabilitace při metastatickém postižení skeletu
- Maximální možná stabilizace osového orgánu se zaměřením na biomechaniku trupu a končetin se zachováním maximálního možného stupně pohyblivosti a funkce postižené oblasti.
- Zkrácení imobility nemocného vzhledem k negativním důsledkům na organismus jako celek : svalová atrofie, následná hypotonie, ztráta kondice a funkční zdatnosti s rizikem tromboembolických komplikací, hyperkalcémii a vznikem hypokinetického syndromu.
- Nácvik substitučních mechanismů a náhradních pohybových dovedností a vybavení pacienta adaptačními pomůckami.
- Zvážení možností modifikace okolního prostředí (byt, bariéry).
C) METASTATICKÉ POSTIŽENÍ MOZKU A PÁTEŘNÍ MÍCHY
Do CNS nejčastěji metastazují karcinomy plic, prsu a maligní melanom, méně často hematologické malignity a nádory urogenitálního traktu. Až 80 % metastáz je lokalizováno intracerebrálně a cca 40 % v oblasti mozkových plen.
Postižení míchy metastatickým procesem je asi v 70 % lokalizováno do oblasti Th páteře, ve 20 % v oblasti LS páteře a v 10 % v oblasti C páteře. Asi u 5 % pacientů jsou přítomny klinické známky míšní komprese. Až v 95 % se tumor šíři epidurálně, s klinickými příznaky zvýšení bolesti při zvýšení intraabdominálního tlaku, bolestivé iritace při flexi v krční a bederní páteři při protažení mening. Klinická symptomatologie je výrazně variabilní od ložiskových neurologických příznaků, přes parézy, plegie, bolesti hlavy, zrakové poruchy až různé stupně poruchy vědomí
Terapie akutního neurologického stavu spočívá v aplikaci kortikoidů, podání chemoterapie a radioterapie CNS. Při solitárním výskytu metastázy je možná neurochirurgická intervence v jednoznačných indikacích i ošetření Leksellovým gamanožem. Klinika u míšního metastatického postižení se projevuje jako progredující slabost, porucha autonomních funkcí, zprvu s motorickým deficitem a později senzorickou poruchou. Terapie spočívá v ovlivnění bolesti, aplikaci kortikoidů, radioterapii, chemoterapii, v indikovaných případech s provedením dekompresního a stabilizačního operačního výkonu.
D) PARANEOPLASTICKÝ NEUROMUSKULÁRNÍ SYNDROM A NEUROTOXICITA ONKOLOGICKÉ LÉČBY
Nedílnou problematikou léčby onkologických pacientů je vznik komplikací vzniklých na podkladě aplikace cytostatik, radioterapie, imunoterapie, event. biologických faktorů. Vývoj farmakoterapie a zlepšení podpůrné léčby umožňuje zvyšování dávek jednotlivých cystostatických preparátů, a tím prohloubení jejich neurotoxicity a ostatních vedlejších účinků.
Paraneoplastický syndrom zahrnuje velmi širokou škálu symptomů a syndromů, např: syndrom subakutní cerebelární degenerace, periferní motorické a senzorické neuropatie, poruchy neuromuskulárního spojení, organickou demenci a reflexní sympatickou dystrofii. Velmi časté jsou zánětlivé, karcinoidní, steroidní proximální myopatie a kachektická slabost.
Cerebelární syndrom
Aplikace cytostatik v určitých režimech může vést k akutní cerebelární toxicitě s časným nástupem klinických příznaků, někdy i v průběhu několika dní. Většinou je cerebelární syndrom přechodný a mizí s ukočením chemoterapie. Těžký až nezvratný cerebelární syndrom se statisticky objevuje v 8-20 % po aplikaci vysokých dávek chemoterapie. Klinicky se manifestuje ataxií trupu a končetin, dysartrií, nystagmem. Patofyziologicky je prokázána ztráta Purkyňových buněk v mozečku. Patogeneze není zatím známá.
Méně často může dojít k výskytu encefalopatie s klinicky dominující spavostí, letargií, hlavně při aplikaci vysokých dávek cytostatik. Klinické příznaky většinou mizí ihned po ukočení aplikace cytostatik. Intratekální aplikace způsobuje míšní toxicitu se vznikem myelopatie, s postupnou ztrátou neurologických funkcí během několika dní. Statisticky se uzdraví jen polovina takto postižených pacientů. Výjimečně může myelopatie vzniknout již během několika minut, většinou se však obtíže objevují po dnech a výjimečně po týdnech od aplikace onkologické léčby.
Histologicky se v míšní tkáni prokazují ostrůvky nekrózy - nejčastěji podél periferie nervů, je přítomen axonální otok spolu s demyelinizací a zvýšení hladiny myelinu Hi v cerebrospinální tekutině (tab. 2).
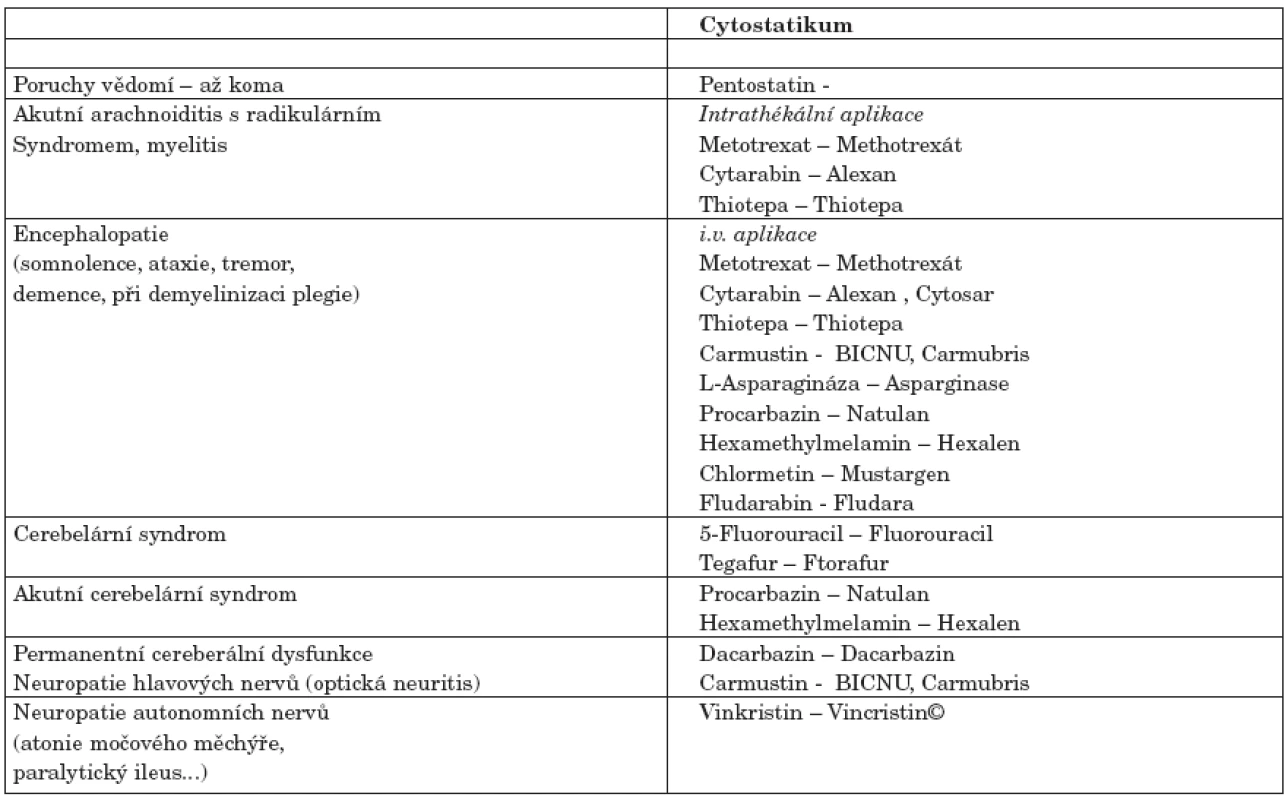
Periferní polyneuropatie je vůbec nejčastějším vedlejším projevem cytostatické léčby. Vyskytuje se v rámci paraneoplastického syndromu u celé řady malignit. Je potencována aktinoterapií a nutričním deficitem. Téměř vždy se u onkologických pacientů léčených chemoterapií a radioterapií vyskytuje mírná reverzibilní forma senzomotorické neuropatie.
Patogeneze příčiny vzniku polyneuropatie není jednoznačně známá, ale předpokládá se, že nejdůležitější příčinou vzniku je toxické poškození axonálního transportu cytostatiky s ovlivněním funkce axonálních mikrotubulů a následnými metabolickými změnami až zánikem axonu. Periferní polyneuropatie je nejčastěji charakterizována symetrickým senzitivně-motorickýmpostižením s primárním poškozením neuritů jednotlivých axonů.
EMG vyšetření prokazuje fibrilace nebo polyfázické motorické jednotkové potenciály.
Neuropatologický podklad polyneuropatií
Podle užité chemoterapie jsou predilekčně postiženy jednotlivé typy nervových vláken. Nejčastěji jde o toxické postižení myelinu velkých (silných) senzorických nervových vláken, s následnou poruchou propriocepce, vibračního čití, s poruchou hlubokých reflexů klinicky se projevující jako syndrom senzitivní ataxie s následnou poruchou rovnováhy, ataxií při chůzi. Objektivně je přítomno snížení šlachookosticových reflexů, porucha hlubokého, částečně i taktilního čití a porucha polohocitu i pohybocitu. Porucha propriocepce vede k oslabení kloubních, protektivně senzitivních mechanismů s možným degenerativním odrazem na chrupavkách kloubů.
Při poškození myelinu malých (tenkých) senzorických nervových vláken odpovídajících za vedení bolesti a termocit, jsou dominujícími klinickými příznaky hluboká bolest tupého až palčivě-pálivého charakteru, vznikající již při lehkém doteku charakteru hlazení). Objektivně je přítomna porucha termického, taktilního i algického čití, minimálně nebo vůbec je postiženo vibrační čití, šlachookosticové reflexy nejsou sníženy. Jen ojediněle se vyskytuje čistě motorické nebo čistě senzitivní postižení.
Motorické neuropatie jsou provázeny poruchou přenosu vzruchů v aferentní části reflexního oblouku s následnou postupnou izolovanou ztrátou nižších motorických neuronů s různým stupněm postižení motorických funkcí. Senzitivní neuropatie jsou provázeny zánětlivou reakcí a neuronálním poškozením v zadních kořenech ganglií. V literatuře se hovoří o ganglionitidě dorzálních kořenů. Většinou je charakter periferní neuropatie reverzibilní, nebo alespoň částečně reverzibilní.
Klinika je variabilní:parestezie, hypestezie (punčochovitého a rukavicového charakteru), dysestezie, porucha termocitu, pseudoparetické postižení akrálního svalstva, poruchy rovnováhy, instabilita. Dochází ke změnam charakteru vnímané bolesti, s rozvíjejícími se bolestivými křečemi, svalovou únavou a dysesteziemi akrálního svalstva HK i DK. Vlivem opakovaných dávek se zvyšující se toxicitou může dojít až k postižení kořenového, trupového i mimického svalstva. Trofické kožní změny nejsou časté a vyskytují se spíše jako součást jiného vedlejšího onemocnění. Pacienti po onkoterapii udávají pocit nejistoty při chůzi a necitlivost rukou.
Nástup klinických obtíží je různý, může být velmi časný (řádově v desítkách minut), ale většinou je v intervalu dnů až týdnů od podání cytostatika. Statisticky je u cca 11 % pacientů prokázán nástup klinických obtíží po podání chemoterapie v časovém odstupu dnů. Až u 65 % pacientů se různá forma a intenzita obtíží objeví po uplynutí 3 měsíců od podání cytostatik.
Častější poškození periferních nervových struktur oproti CNS vysvětlují patrně nálezy elektronové mikroskopie, které opakovaněprokázaly až 20krát vyšší množství přítomných cytostatik v periferních nervech a spinálních gangliích oproti mozkové tkáni.
U pacientů s jinou formou neuropatie (DM, M. Charcot Marie Toth), u pacientů s dysfunkcí štítné žlázy, u hypovitaminózy B, u alkoholové polyneuropatie) se klinické symptomy objevují již při výrazně menších dávkách aplikovaných cytostatik (tab. 3).
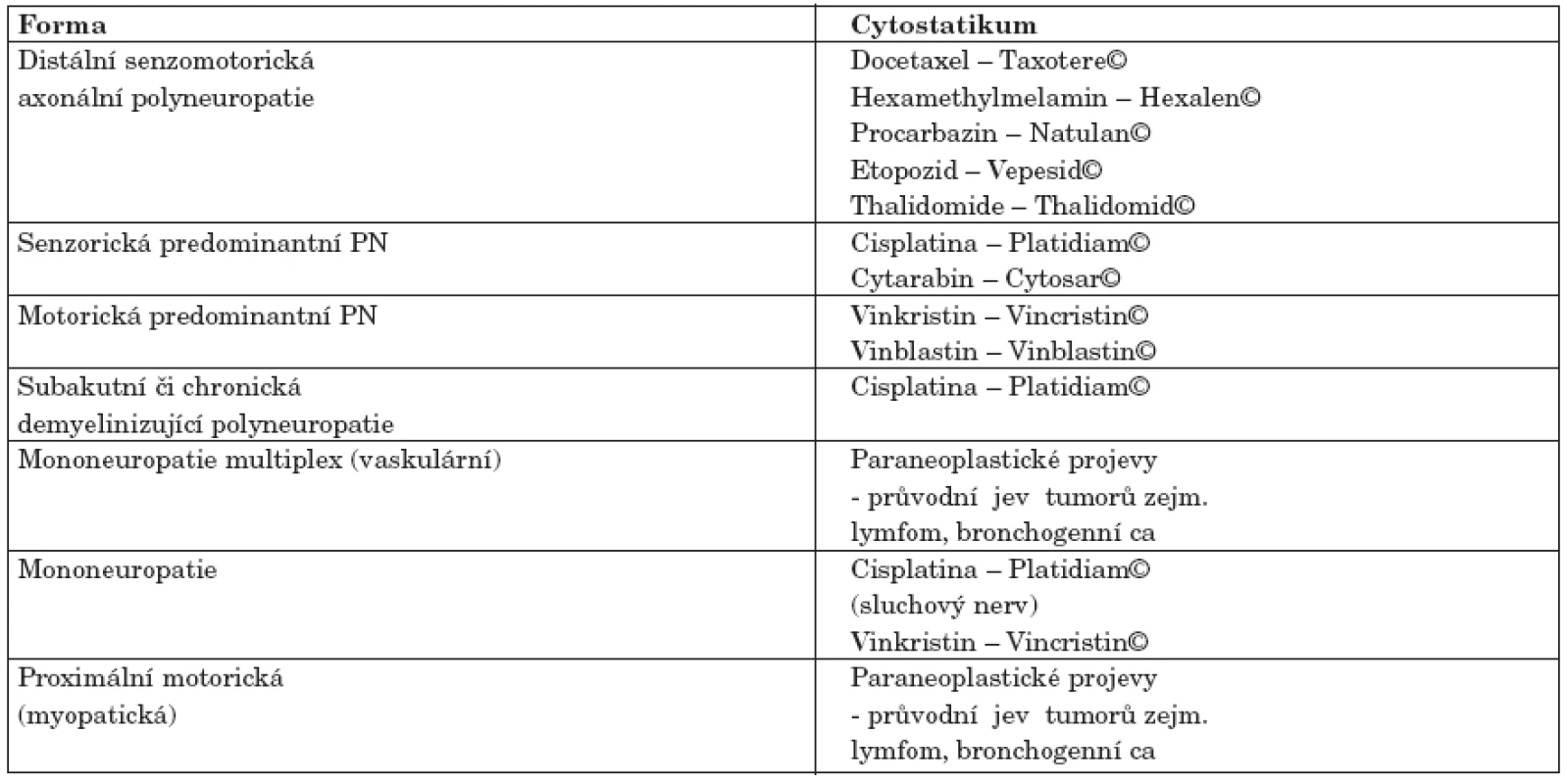
Rehabilitační ovlivnění periferní neuropatie - možnosti léčby:
- Vakuově-kompresivní terapie.
- Klidová galvanizace s podélnou aplikací, kdy využíváme dráždivý účinek katelektrotonu nebo tlumivý účinek anelektrotonu, event. Amosovy proudy.
- Syntetické i analytické techniky.
- Režimová opatření, např. vhodná obuv, nekonstriktivní ponožky, prevence poranění a popálení kožního krytu, minimalizace nevhodných psychologických stimulů (stres).
Rehabilitační léčba je vždy dlouhodobá, klinický stav nemocného je často kolísavý, vzhledem k vývoji onemocnění a opakovaným sériím onkologické terapie. Téměř vždy je nutno rehabilitační program opakovat.
E) POSTIŽENÍ MĚKKÝCH TKÁNÍ A SVALOVÝCH VLÁKEN A RADIAČNÍ TERAPIE
Samotný růst nádorové tkáně vede k významným metabolickým a biochemickým změnám na buněčné úrovni s patologickými odchylkami v enzymatických řetězcích svalových buněk s výskytem mikroangiopatií, přestavbě, event. atrofii svalových buněk. Postižením zdravých tkání nádorem spolu s event. operačním výkonem vzniká rozsáhlá škála poškození s odrazem v přestavbě svalového vlákna, kontraktilitě a timingu zapojení svalů. Tyto změny jsou potencovány aktinoterapií s nasedajícím poškozením jak kožního krytu, podkoží, ale i fascií a svalových vláken s následnou ztrátou přirozené elasticity, změnami struktury, přestavbou a atrofií.
Negativní vliv na strukturu měkkých tkání má aplikace chemoterapie, kterou doprovází ztráta chuti k jídlu, nevolnost, zvracení, snížená kondice a malnutrice s projevy periferní neuropatie. Onkologické onemocnění je stresujícím faktorem a vede ke snížení prahu bolesti a zvýšenému svalovému napětí.
RADIAČNÍ TERAPIE
Formy aplikace:
- radikální (redukce tumoru, ozáření po chirurgickém výkonu v místě původního tumoru),
- paliativní (potlačení symptomů bolesti při metastázách v mozku, skeletu nebo prevence komplikací, např. syndromu horní duté žíly, patologických fraktur).
Vedlejší účinky radioterapie se dělí na časné a pozdní:
- časné - leukopenie, trombocytopenie, únava, deskvamace buněk, změny na sliznicích (snížení salivace, mukositis, ztráta citlivosti chuťových buněk), nauzea, vomitus, anorexie. Časté jsou poradiční esophagitidy, proctitidy, cystitidy i amenorhea či ztráta libida;
- pozdní - velmi častá je fibróza měkkých tkání s kontrakturami, kožní atrofie nebo ulcerace, osteonekrózy, lymfedém, plicní fibrózy, gastrointestinální striktury nebo chronická cystitida a nefritida. Výjimkou nejsou transverzální myelitis, mozkové nekrózy, xerostomie, poruchy sluchu a zraku, endokrinní insuficience a pozdní malignity.
Z psychologického hlediska nelze opomenout možnost vzniku impotence u mužů a sterility u žen. Současná aplikace chemoterapie a aktinoterapie vzájemně potencuje toxické účinky.
Neurotoxicita radioterapie v časové posloupnosti:
- časná, která je výjimečná,
- subakutní-vznik encefalopatie na podkladě demyelinizace nervových buněk po ozáření CNS (v prvních 8 měsících po aktinoterapii). Klinické projevy jsou variabilní, většinou s dobrou odpovědí na kortikoidy a velmi často reverzibilní;
- chronická–manifestující se jako opožděná radiační encefalopatie na podkladě koagulační nekrózy bílé mozkové hmoty vznikající 1-2 roky po léčbě s malou odpovědí na podání kortikosteroidů. Po ozáření CNS může dojít až k mozkové atrofii se ztrátou paměti a kognitivní dysfunkcí.
Svalová tkáň a radioterapie
Svalové buňky jsou považovány za relativně odolné vůči účinkům radioterapie, i když aplikace vyšších dávek, (nad 50 Gy) může způsobit pozdní toxicitu ve svalových buňkách. Rané (brzké) účinky radioterapie na svalové buňky nejsou běžné. Pozdní účinky se objevují několik měsíců až rok od ukončení radioterapie. Klinicky se objevují svalové kontrakce, oslabení svalové síly, event. až patologické zlomeniny.
Radiační poškození míchy
Mícha je z hlediska radiosenzitivity citlivější než mozková tkáň. V klinice je používáno u poškození míchy členění dle Reagana :
1. typ
- přechodná forma tzv. Lhermittův syndrom (často u pacientů po aktinoterapii ORL oblasti) se vyskytuje do 4 měsíců po ozáření, přetrvává týdny až měsíce a je charakterizována paresteziemi končetin a tzv. „elektrickými šoky” podél páteře do končetin. Obtíže jsou provokovány flexí krku. Klinické projevy jsou reverzibilní. Podkladem je demyelinizace nervovu a poté zvýšená citlivost obnaženého axonu;
2. typ
- je charakterizován chabou obrnou dolních končetin bez poruchy citlivosti jako důsledek postižení předních míšních rohů;
3. typ
- s rychle se rozvíjejícími příznaky paraplegie a kvadruplegie v důsledku infarktu míchy a radiačních změn na cévách míšních splavů;
4. typ
- chronická progresivní postradiační myelopatie je nejčastější formou radiačního poškození míchy. Klinika se rozvíjí postupně s únavou, slabostí, paresteziemi, bolestmi HK, DK, poruchami chůze až úplnou spastickou nebo chabou parézou. Prognóza je špatná.
Radiační poškození míchy se může manifestovat jako různé klinické jednotky, např. transverzální myelitis, opožděná radiační myelopatie (v intervalu 9-18 měsíců po ozáření), klinickými příznaky charakteru Brown-Sequard syndromu, radikulární bolestí, sfinkterovými dysfunkcemi sdruženými s poruchou horního motoneuronu, výjimečně i s poruchou dolního motoneuronu. V intervalu měsíců až let po ozáření míchy se může manifestovat radiačně indukovaná brachiální nebo lumbální plexopatie
F) LYMFEDÉM
Je častá komplikace onkologických nemocných. Etiologicky se uplatňuje blokáda odtoku lymfy vlivem operačního výkonu, tlakem nádorových hmot nebo radiační fibrózou. Nejpočetnější skupinou jsou pacientky s nádorem prsu a následným operačním výkonem, včetně exenterace axily a poté aktinoterapií na oblast spádových uzlin a hrudní stěny. Druhou častou skupinu tvoří pacientky s gynekologickými tumory po operačních výkonech s následným ozářením pánevních a inguinálních uzlin. Další skupinou jsou pacienti po lymfadenektomii u karcinomu prostaty, s tumory ledvin, sarkomy měkkých tkání, eventuálně po i.v. aplikaci chemoterapie.
Patogeneze lymfedému: podkladem je snížení transportní kapacity makromolekulárních látek lymfy a jejich hromadění osmotickou vazbou ve tkáních. Ke vzniku může dojít i při zachovalé kapacitě lymfatického systému, ale nadměrné tvorbě tkáňového moku. Makromolekulární bílkovinné látky nakumulované v intersticiu mění svůj stav, rozpadají se, přeměňují se ve fibrinová vlákna a vytváří fibrinovou síť. Do této tkáně pronikají fibroblasty, dochází k ukládání kolagenu a při delším trvání lymfedému k fibróze s další progresí stavu.
Lymfedém narušuje metabolismus, hlavně oxidační procesy v buňkách, tím se zhoršuje odstraňování produktů látkové výměny a oslabuje přísun a pohyb lymfocytů i makrofágů. Dochází tak k narušení imunitních reakcí. Velikost lymfedému může dosahovat až ,,sloních” objemů s útlakovou parézou akra končetiny.
Z terapeutického hlediska rozlišujeme:
- a) reverzibilní stadium edému (měkký otok, negativní Stemmerovo znamení, tj. lze vytvořit řasu na prstech a „důlek na kůži”);
- b) ireverzibilní stadium edému (trvalý otok, pozitivní Stemmerovo znamení, se vznikem fibrotizace, sklerózou až deformitami).
Rehabilitace lymfedému - možnosti:
- Manuální lymfodrenáž – má za cíl podporu dosud zachované vstřebávací a transportní funkce lymfatického systému, stimulaci makrofágy a zvýšení počtu monocytů ve tkáni, (nevyhodou je velká časová náročnost).
- Mechanoterapie pomocí tlakové masáže-(tzv. pressoterapie).
- Vakuum-kompresivní terapie.
- Speciální techniky kompresivního bandážování, kterése užívají u reverzibilního i ireverzibilního stadia lymfedému, slouží k udržení dosaženého objemu končetiny, ale nelze je použít k normalizaci objemu. Je vhodnou technikou ve 2. fázi terapie, kdy je objem končetiny konstatní (používané elastické bandáže mají vysoký klidový tlak a nízký pracovní tlak).
- Speciální sestavy cviků podle dr. Bechyněho jsou součástí technik navazujících bezprostředně na manuální lymfodrenáž (cvičební jednotka se provádí hlavně ráno a večer).
Režimová opatření: dodržovaní zásad polohování postižené končetiny, péče o kožní kryt, nepřetěžování končetin, s nutnou vhodnou pohybovou aktivitou. Farmakoterapie v principu využívá dlouhodobé podávání enzymoterapie a benzopyronů. V indikovaných případech je možné mikrochirurgické řešení lymfaticko-cévními anastomózami.
SHRNUTÍ FAKTORŮ OVLIVŇUJÍCÍCH REHABILITACI U ONKOLOGICKY NEMOCNÝCH
1. Masa nádorových hmot se změnami v měkkých tkáních vede nebo může vést k útlaku nervových struktur, vnitřních orgánů i měkkých tkání.
2. Podpůrná léčba s aplikací kortikosteroidů a jejich patologickým vlivem na svalové vlákno a kostní buňky vede ke svalové dystrofii se ztrátou kontraktility a oslabením svalového vlákna. Tuto skutečnost je nutno respektovat při event. excentrických kontrakcích.
3. Operační řešení s odstraněním nádorových hmot, resekcí jednotlivých orgánů a lymfatických splavů, vede k nutnosti pooperační péče o jizvy, k prevenci fibrotických změn kůže a podkoží s využitím technik ovlivňujících měkké tkáně a vznik lymfedému. Po stabilizujících výkonech při metastatickém postižení skeletu, je nutné polohování pacientů s cílem předejít ireverzibilním změnám pohybových možností a schopností.
4. Aplikace chemoterapie s četnými negativními účinky, z nichž nejdůležitější jsou:
- a) kardiotoxicita mnohých preparátů s následným snížením kardiovaskulární výkonnosti, redukcí maximální kyslíkové spotřeby se snížením srdečního výdeje a srdeční frekvence (na EKG změny v ST + T úsecích) až trvalým poškozením myokardu charakteru-toxické kardiomyopatie. Neadekvátní tělesná zátěž u těchto pacientů může vyvolat hypotenzní reakci;
- b) neurotoxicita se vznikem periferních polyneuropatií, poruchou inervace svalů se změnou svalové aktivity a koordinace, s poruchami čití, trofickými změnami a vznikem bolestivého syndromu.
5. Aplikace multimodální onkologické terapie a její četné vedlejší účinky:
- a) hormonální terapie-podávání inhibitorů aromatáz má v onkologii důležitémísto v komplexní terapii karcinomu prsu, prostaty a endometria. Mezi nežádoucími účinky patří únava, návaly, bolesti hlavy s vegetativní symptomatologií, ospalost, ataxie, arthralgie;
- b) imunoterapie je v onkologii významná terapeutická strategie posledních let s nežádoucími účinky při terapii interferony (alfa, beta, gama) a cytokiny (interleukin 1, 2, 4, 6), např. v podobě výskytu myalgií, arthralgií, bolestí hlavy, svalové ztuhlosti, ataxie, parestezií, únavy, horečky, třesavky, schvácenosti. Aplikaci interferonů často provázejí neuropsychické poruchy, změny nálady, deprese, halucinace, kóma, poruchy vizu;
- c) radioterapie - viz předchozí kapitoly.
6. Stav výživy - malignita samotná i onkologická léčba vedou k redukci váhy, poruchám příjmu potravy, malabsorpčním stavům a nechutenství. Podíl na kachektizaci má vzestup cytokinů (např. tumor necrosis faktor-TNF-kachektin) s indukcí anaerobní glykolýzy, uvolnění aminokyselin ze svalů, sekrecí hepatálních lipidů, redukcí albumin syntézy a zvýšením teploty. Důsledkem těchto pochodů je svalová atrofie a postupná kachektizace.
7. Dlouhodobá inaktivita a imobilizace má odraz v jednotlivých orgánových systémech:
- a) muskuloskeletálním systému (kontraktury, svalové atrofie, snížení svalové síly a kondice-ztráta až 3 % svalové síly za den, osteoporóza);
- b) kardiovaskulárním aparátu (zvýšení srdeční frekvence, snížení minutového srdečního objemu, posturální hypotenze, trombotické komplikace);
- c) endokrinním systému (zpomalení tkáňového metabolismu, zvýšení katabolismu, negativní dusíková bilance, osteoporóza, sacharidová intolerance);
- d) respiračním systému (snížení dechové frekvence a plicního objemu, atelektáza, respirační insuficience a riziko plicní embolizace);
- e) zažívacím systému (snížení peristaltiky, zácpa, nechutenství);
- f) močovém systému (močová retence, lithiáza, infekce);
- g) kůži a podkoží (vývoj dekubitů, zpomalené hojení ran);
- h) psychice a sociálních aspektech (depresivní syndrom, odmítání reality, pocit strachu, úzkosti a obavy ze smrti, intelektuální a sociální izolace, ztráta zaměstnání, zhoršení ekonomické situace rodiny, vliv na partnerské vztahy).
Imobilizace a inaktivita vede až k tzv. nemoci z hypokinézy, se zvýšenou aktivitou sympatiku, snížením svalového tonu, hypotrofií svalstva, vaziva, osteoporózou, katabolickou reakcí organismu, poruchou vazomotorické a proprioceptivní adaptace organismu, snížením funkce kardiovaskulárního aparátu, snížením schopnosti tkání utilizovat kyslík.
MUDr. Vitězslav Hradil
Institut onkologie a rehabilitace Na Pleši, s. r. o.
262 04 Nová Ves pod Pleší
e-mail: V.Hradil@seznam.cz
Sources
1. TRÁVNÍČKOVÁ-KITTLEROVÁ, O., HRADIL, V., VACEK, J.: Rehabilitace pacientů s onkologickou diagnózou. Triton, s.r.o., 2004.
2. DeLISA, J. A.: Rehabilitation medicine, principles and practice, 3rd.edition. Lippincott - Raven Publishers, Philadelphia, 1998.
3. VINCENT, T., DEVITA, J. R., S., HELLMAN, S. A.: Rosenberg–cancer, principles and practice of oncology, 3rd.edition. J. B.Lippincott comp, Philadelphia, 1989.
4. GOODGOLD, J.: Rehabilitation medicine. C.V.Mosby comp., St.Louis,Washington, Toronto, 1988.
5. HERBERT, J.: Dietz - rehabilitation. John Wiley and Sons, New York, 1981.
6. FLETCHER, G. F., BANJA, J. D. A KOL.: Rehabilitation medicine - contemporary clinical perspectives. Lea and Febiger, Malvern – Pennsylvania, 1992.
7. FREDERIC, J. KOTTKE, E., AMATE, A: Clinical advances in physical medicine and rehabilitation. Pan American Health Organization, Washington, 1991.
8. KLENER, P.: Protinádorová chemoterapie. Galén, Praha, 1996.
9. JANDA, V.: Funkční svalový test. Grada, Praha, 1996.
10. JANDA, V.: Základy kliniky funkčních /neparetických/ poruch. ÚPVSZP, Brno, 1982.
11. VÉLE, F.: Kinesiologie pro klinickou praxi. Grada, Praha, 1997.
12. JANDA, V., KRAUS, J.: Neurologie pro rehabilitační pracovníky. Avicenum, Praha, 1997.
13. PODĚBRADSKÝ, J., VAŘEKA, I.: Fyzikální terapie I.+II.. Grada Publishing, Praha, 1998.
14. JANDA, V., VACEK, J.: Přednášky. 1995, 2000.
15. PODĚBRADSKÝ, J.: Přednášky Kurz fyzikální terapie. 2001.
16. LEWIT, K.: Manipulační léčba v rámci léčebné rehabilitace. Nakladatelství dopravy a spojů, Praha, 1990.
17. BECHYNĚ, M.: Terapie lymfedému. Phlebomedica, Praha, 1993.
18. PFEIFFER, J. A KOL.: Rehabilitace, léčebné, pracovní a sociální aspekty. SPN, Praha, 1989.
19. ČASOPIS ARCH OF PHYSICAL MEDICINE AND REHABILITATION. 77, 1996, 3, 81, 2000, 5, 82, 2001, 3.
20. VACEK, J. A KOL.: Kurs diagnostiky a terapie funkčních poruch hybné soustavy - přednášky. 1996, 1997.
21. ZEMANOVÁ, M. A KOL.: Kurs neurofyziologie - přednášky. 2001.
22. VEVERKOVÁ, M.: Üstní sdělení, 2007.
Labels
Physiotherapist, university degree Rehabilitation Sports medicineArticle was published in
Rehabilitation & Physical Medicine

2007 Issue 4
- Hope Awakens with Early Diagnosis of Parkinson's Disease Based on Skin Odor
- Deep stimulation of the globus pallidus improved clinical symptoms in a patient with refractory parkinsonism and genetic mutation
Most read in this issue
- REHABILITACE V ONKOLOGII
- SROVNÁNÍ EFEKTU POSTIZOMETRICKÉ RELAXACE A MANUÁLNÍ CENTRACE RAMENE DLE ČÁPOVÉ NA REFLEXNÍ ZMĚNY V MUSCULUS TRAPEZIUS PŘI CERVIKÁLNÍCH BOLESTIVÝCH SYNDROMECH
- REGRESNÍ ZMĚNY STÁRNOUCÍHO ORGANISMU A JEJICH VLIV NA POSTURÁLNÍ STABILITU
