KREVNÍ PÉČE U ELEKTIVNÍCH UROLOGICKÝCH VÝKONŮ
BLOOD CARE AT ELECTIVE UROLOGICAL OPERATIONS
In case of extensive or complicated urologic operation there may arise a need of blood tranfusion aplication. The new knowledge in physiology and pathophysiology found that even strong anaemia is quite well tolerated by human organism. Former dogma to apply blood when haemoglobin is lower than 100g/l does not govern anymore. In spite of all the progress in testing donors and blood conserves, the transfusion is relatively risk operation. Nowadays, it is especially the transfer of infectuous diseases which is threatening. After AIDS pandemy there are still new pathogenes occuring. They are transferred by blood and no routine and effective tests on them do not exist. Therefore there is a maximal effort to avoid the application of foreign blood.
In urology, the standard method of blood care has been preoperational autologous blood donorship or autotransfusion. However, nowadays it is often being replaced or complemented by acute normovolaemic haemodilution, since this method is very effective and at the same time safe and cheap.
An effective news are also the pharmacologic remedies, especially human recombinant erythropoetin or activated factor VII. Their disadvantage is that their price is still high. Suitable combination of various methods of blood care enables us to make the prevalent majority of mostly urologic operations as a part of bloodless medicine.
KEY WORDS:
blood care, anaemia, blood tranfusion, preoperational autologous blood donorship, acute normovolaemic haemodilutio, erythropoetin
Authors:
MUDr. Bronislav Stibor; MUDr. Roman Gál, Ph.D.; doc. MUDr. Ivan Čundrle, CSc.
Authors‘ workplace:
1. anesteziologicko-resuscitační oddělení FN Brno
Published in:
Urol List 2005; 3(1): 47-52
Overview
V případě rozsáhlé nebo komplikované urologické operace může vzniknout potřeba podání krevní transfuze. Díky novým poznatkům ve fyziologii a patofyziologii zjišťujeme, že lidský organizmus snáší poměrně dobře i výraznou anémii. Dřívější dogma o nutnosti aplikovat krevní transfuzi při hemoglobinu nižším než 100 g/l již neplatí. Transfuze je i přes veškeré pokroky v testování dárců i krevních konzerv poměrně rizikovým úkonem. V současnosti hrozí zejména přenos infekčních onemocnění. Po pandemii AIDS se objevují stále nové patogeny, které jsou krví přenášeny a na které neexistují rutinní a účinné testy. Proto je maximální snaha se aplikaci cizí krve vyhnout.
V urologii je doposud standardní metodou krevní péče předoperační autologní krevní dárcovství neboli autotransfuze. V současnosti je však často nahrazována či doplňována akutní normovolemickou hemodilucí, která je velmi efektivní a přitom bezpečnou a levnou metodou. Účinnou novinkou jsou i farmakologické prostředky, zejména lidský rekombinantní erytropoetin či aktivovaný faktor VII. Nevýhodou je doposud jejich vysoká cena. Vhodná kombinace různých metod krevní péče nám nyní umožňuje provádět převážnou většinu urologických výkonů jako součást bezkrevní medicíny.
KLÍČOVÁ SLOVA:
krevní péče, anémie, krevní transfuze, předoperační autologní krevní dárcovství, akutní normovolemická hemodiluce, erytropoetin
ÚVOD
Krevní transfuze jsou v mnoha případech nezbytnou součástí léčby. Krevní ztráty v průběhu operačních výkonů patří mezi časté indikace k jejich podání a urologické operace nebývají výjimkou, ba právě naopak. Avšak související rizika, jako např. nebezpečí přenosu infekčních chorob, imunologické problémy a jiné nežádoucí účinky spolu s rostoucími náklady a problémy s nedostatkem krve přispěly k rozvoji postupů, jejichž cílem je podávání krevních transfuzí omezit.
Jedním z hlavních cílů bezkrevní medicíny nebo přesněji účelné hemoterapie je tedy omezení spotřeby cizí neboli dárcovské (alogenní) krve na nezbytné minimum. V současné době jsou již k dispozici takové metody krevní péče, které umožňují, zvláště při jejich vhodné kombinaci, tohoto cíle dosáhnout.
HISTORIE KREVNÍ TRANSFUZE
Určité představy o krevní transfuzi měl již německý vědec Andreas Libavius z Halle v roce 1615: „Lékař si připraví 2 stříbrné trubice, které se k sobě hodí. Otevře pak tepnu zdravého člověka, vloží do ní trubici a připevní ji. Potom otevře žílu nemocného, do níž vloží druhou trubici. Tyto trubice pak spojí. Ze zdravého člověka teče krev teplá, svěží, vzduchem bohatá, která je pro nemocného pramenem nového života.“ Není bez zajímavosti, že teprve o rok později v roce 1616 objevuje William Harvey krevní oběh. První transfuzi člověku podali v Paříži v roce 1667 J.B. Denis s ranhojičem Emmerezem. Převedli beránčí krev mladému muži, který trpěl vysokými horečkami a byl zesláblý pouštěním žilou. Mladík nejenom tuto transfuzi přežil, ale údajně se i uzdravil. Následovaly více, většinou však méně úspěšné pokusy zachránit lidský život pomocí krevní transfuze, povětšinou totiž byla opět použita krev beránčí - bohužel. Až v roce 1818 londýnský profesor fyziologie a porodnictví J. Blundell poprvé uskutečnil převod lidské krve dvěma rodičkám. Jedné zachránila život, druhá zemřela na „rozpad“ krve [1].
I pozdější pokusy o transfuzi - by již krve lidské - měly pochopitelně krajně riskantní charakter. Teprve objev krevních skupin na začátku 20. století dovolil provádět úspěšné krevní transfuze. Vídeňský lékař K. Landsteiner v roce 1901 popisuje 3 krevní skupiny A, B, 0 a jeho spolupracovníci o rok později i čtvrtou krevní skupinu - AB. Nezávisle na něm (i když později, v roce 1907) určuje 4 základní krevní skupiny i český lékař Jan Janský ve spise Hematologické studie u psychotiků. Objevení krevního faktoru Rhesus týmž K. Landsteinerem v roce 1940 znamenalo dovršení základních znalostí antigenů červených krvinek a zároveň obrovský pokrok v léčbě krevními transfuzemi. Započala éra bezpečného podávání krevních transfuzí. Ty se staly velmi potřebné během právě probíhající světové války.
ANÉMIE A TRANSFUZNÍ TRIGGER
Hlavní funkcí erytrocytů je zásobování tkání kyslíkem a zpětný odvod oxidu uhličitého. Přestože dodávka kyslíku tkáním (oxygen delivery - DO2) závisí i na jiných faktorech (jako je minutový srdeční výdej či saturace krve kyslíkem), hlavní determinantou je koncentrace hemoglobinu.
Normální hodnoty červené krevní řady (tab. 1) u zdravých jedinců jsou celosvětovým standardem a závisí pouze na věku, pohlaví, nadmořské výšce a případné graviditě. Podobně jako většina orgánových systémů jsou předimenzovány a organizmus toleruje za klidových podmínek mnohem nižší hodnoty hematokritu a hemoglobinu než hodnoty fyziologické, je zde tedy velká funkční rezerva. Tyto tolerované hodnoty samozřejmě souvisí s věkem a přidruženými chorobami.
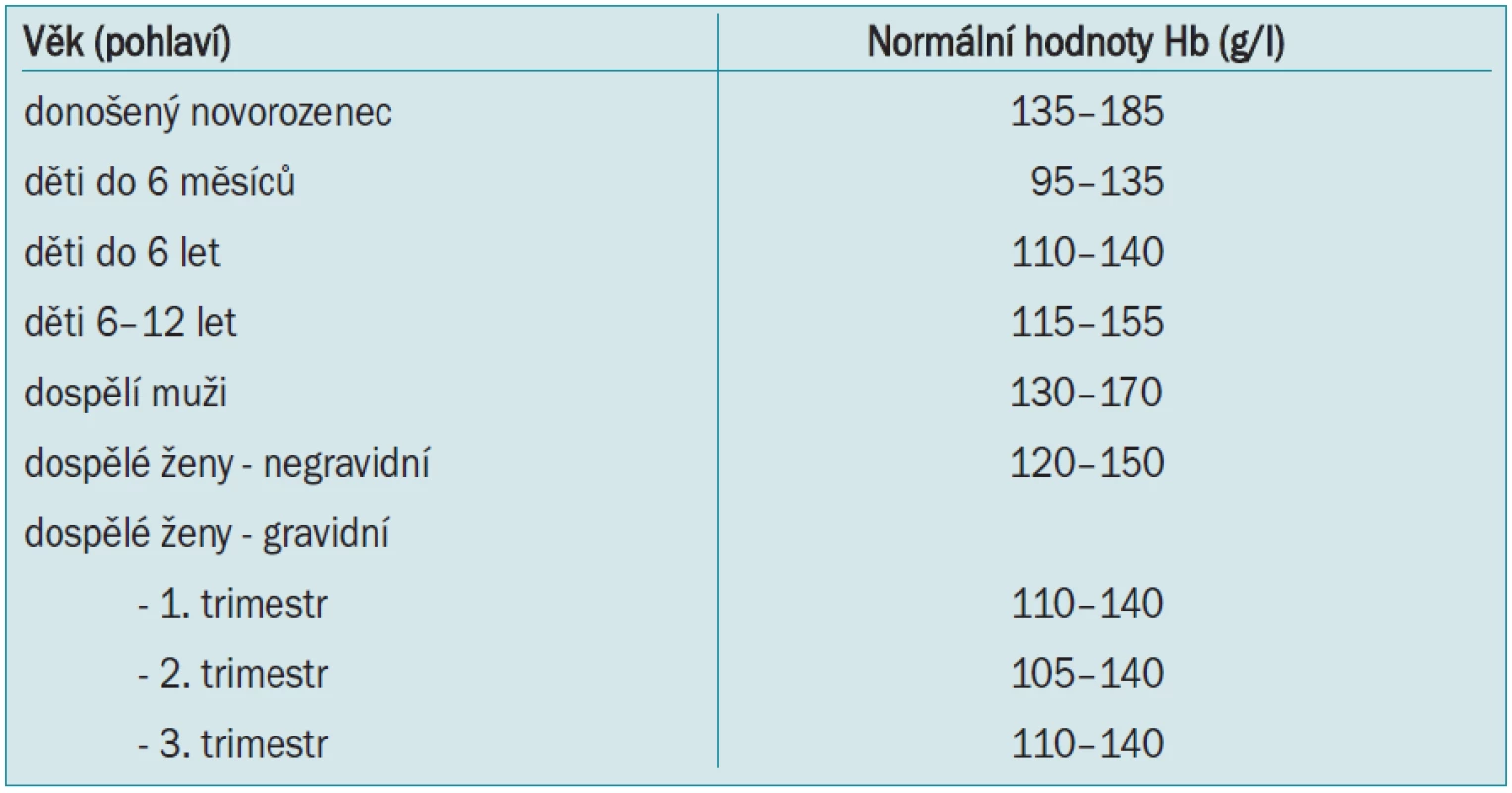
Určitá hodnota hemoglobinu či hematokritu, při které je indikována krevní transfuze, se nazývá transfuzní „trigger“. Tato hodnota byla na začátku 80. let minulého století stanovena na hodnotu Hb < 100 g/l, což přibližně odpovídá hodnotě hematokritu 0,30 - tzv. Allenovo pravidlo 10/30. Tato hodnota byla stanovena spíše na základě empirie než výsledků kritických studií, zjednodušovala totiž kinetické výpočty pro kyslík, byla snadno zapamatovatelná a měření koncentrace Hb bylo rutinní a levné. Proto se na více než 20 let stala všeobecně uznávanou a používanou. Avšak po poznání rizik alogenní transfuze (zejm. přenosu HIV) a prohloubení znalostí fyziologie a patofyziologie anémie došlo k výraznému přehodnocení a zpřísnění indikací ke krevním transfuzím. Do té doby se za hlavní nebezpečí spojené s transfuzí považoval převod krve inkompatibilní v AB0–systému. Při dodržení kompatibility se transfuze jevila jako velmi bezpečná, což však způsobilo její často zbytečné podávání.
Postupně bylo zjišováno, že lidský organizmus toleruje poměrně dobře i nižší hodnoty hemoglobinu, samozřejmě v závislosti na svém celkovém stavu. Takoví pacienti jsou sice anemičtí, ale to samo o sobě ještě neznamená indikaci k transfuzi. Bylo prokázáno, že mladí zdraví pacienti bez přidružených onemocnění zejména kardiovaskulárního a plicního systému tolerují hodnoty kolem Hb 50–60 g/l. Pouze starší lidé s výrazným kardiálním onemocněním (např. těžká forma ICHS a zejména její akutní formy) vyžadují udržení hodnoty hemoglobinu 100 g/l a vyšší.
Přelomovou byla práce Héberta, která je řazena mezi studie nejvíce ovlivňující současnou intenzivní medicínu [2]. Zkoumala vliv podaných transfuzí na mortalitu i morbiditu u kriticky nemocných. Tato prokázala, že tzv. restriktivní transfuzní strategie s triggerem Hb 70 g/l (a snahou držet Hb v rozmezí 70–90 g/l) měla signifikantně nižší hospitalizační mortalitu ve srovnání se strategií liberální, jež měla transfuzní trigger Hb 100 g/l (s udržováním v rozmezí 100–120 g/l). Navíc pacienti v restriktivní skupině obdrželi o 54 % (!) méně transfuzí než ve skupině liberální. Je třeba zdůraznit, že se jednalo o nejvíce, tj. kriticky nemocné pacienty v resuscitační péči.
Proto stanovení anémie u konkrétního pacienta ještě neznamená automaticky indikaci k transfuzi, ta vždy závisí na komplexním posouzení všech faktorů.
RIZIKA TRANSFUZE ALOGENNÍ KRVE
Základní rizika lze rozdělit do 4 základních skupin a jsou všeobecně známa [3] (tab. 2). Dárcovská krev se v současnosti testuje na několik nejvýznamnějších mikroorganizmů (viz níže). Přesto nyní největším nebezpečím z každé provedené transfuze zůstává riziko přenosu infekčních agens [1]. Papež Jan Pavel II. přežil atentát, ale málem nepřežil nákazu cytomegalovirem z podané alogenní krve. Navíc na mnohé z patogenních mikroorganizmů nemáme doposud spolehlivé diagnostické metody a mnohé z nich neznáme vůbec [4]. Jen čas opravdu ukáže, kolik přenášených infekcí číhá v dodávané krvi. Každý rok je identifikován v průměru 1 krví přenosný patogen.

Byla to právě pandemie syndromu získaného selhání imunity (AIDS) a možnost přenosu HIV krevními deriváty, jež soustředila pozornost na rizika spojená s krevními transfuzemi a podstatně zpřísnila indikace k jejich podávání. Přestože poprvé byl AIDS popsán v roce 1981, první infekce virem HIV byla prokázána retrospektivně v krevním vzorku muže zemřelého na tehdy neznámou chorobu již v roce 1959!
I přes neustálé zdokonalování testů na infekční markery stále existuje nebezpečná latentní perioda („diagnostické okno“), tj. čas mezi nákazou a možností ji diagnostikovat. V tomto období může odebraná krev přenést infekci, i když je sérologický screening negativní. Protilátky totiž nejsou přítomny vůbec, anebo v podprahovém množství. Koncept převodu alogenní krve bez rizika je tedy utopií [1].
V posledních letech se dostalo do popředí nebezpečí přenosu zejména viru nové varianty Creutzfeld-Jacobovy nemoci (nv-CJD), způsobující tzv. „nemoc šílených krav“. Z obavy před nedokonalými metodami byl dokonce v USA z programu vyřazen preventivně každý dárce krve, jež od roku 1980 strávil ve Velké Británii déle než 3 měsíce. Z těchto důvodů dominuje nyní všemožná snaha se cizí krvi vyhnout.
Z pohledu urologa jsou rovněž důležité výsledky některých studií, které uvádějí souvislost mezi četností transfuzí a pooperačními infekčními komplikacemi [5,6]. V tomto případě zřejmě moc nezáleží na tom, zdali byla podána krev dárcovská či autotransfuze.
UROLOGICKÉ OPERACE Z POHLEDU KREVNÍ PÉČE
Spektrum urologických operací je velmi různorodé. Od menších výkonů typu cystoskopií nebo cirkumcizí, u kterých je pravděpodobnost nutnosti krevního převodu malá až zanedbatelná, až po výkony typu radikální cystektomie, u kterých bývá krevní transfuze spíše pravidlem.
Velká skupina operací, u kterých dochází k aplikaci krve, patří bohužel mezi onkochirurgické výkony. To obrací pozornost přinejmenším na 2 aspekty krevní péče.
(1) ‑By stále ještě není definitivně kvantifikován vliv převodu alogenní krve na imunitní systém pacienta [7,8,9], je potvrzen názor, že takto způsobená imunosuprese může způsobit zhoršení obranyschopnosti organizmu vůči maligním buňkám a zvýšení rizika progrese u některých typů tumorů. I z tohoto důvodu se u onkologických pacientů snažíme podání cizí krve vyhnout.
(2) ‑Limitovány jsou i některé postupy pracující s pacientovou vlastní krví, zejména peroperační rekuperace krve (viz dále).
MINIMALIZACE KREVNÍCH ZTRÁT
Současný pohled na otázku transfuze lze shrnout do lapidárního konstatování: Absolutně bezpečná, a navíc nejlevnější je ta krev, která vůbec nebyla podána.
Proto je zdokonalování operačních technik s minimalizací krevních ztrát to nejdůležitější, co lze pacientovi nabídnout. Pro tento účel existují i vhodné anesteziologické techniky. řízená hypotenze během operace (snížení středního arteriálního tlaku na cca 60 mmHg) signifikantně snižuje krevní ztráty menším krvácením z tepen i žil [10]. Je vhodnější pro výkony, při nichž je operační pole na horní části pacientova těla (např. operace páteře v poloze na břiše) a pro mladší pacienty bez přidružených komorbidit. Proto má v urologii spíše okrajový význam. Hlavním postupem, který minimalizuje krevní ztráty, tedy zůstává správná operační technika.
MONITORACE KREVNÍCH ZTRÁT
Pro úspěšné provádění většiny metod krevní péče je nezbytná dokonalá monitorace krevních ztrát. Zahrnuje přesné měření množství odsáté krve, odečítání roztoků používaných k proplachům operační rány i vážení operačních roušek. To je podmíněno dobrou spoluprací anesteziologů a operatérů. Na pracovišti autorů se krevní ztráty průběžně zaznamenávají na viditelném místě operačního sálu.
Velmi obtížně se krevní ztráty hodnotí u endoresekčních výkonů. V tomto případě je nejdůležitějším momentem zkušenost, kterou má anesteziolog s podobnými výkony. Ten pak posuzuje velikost krevní ztráty spíše dle klinického stavu pacienta než na základě přesného měření. Samozřejmostí je i sledování hodnot hemoglobinu či hematokritu v průběhu výkonů.
PŘEDOPERAČNÍ AUTOLOGNÍ KREVNÍ DÁRCOVSTVÍ
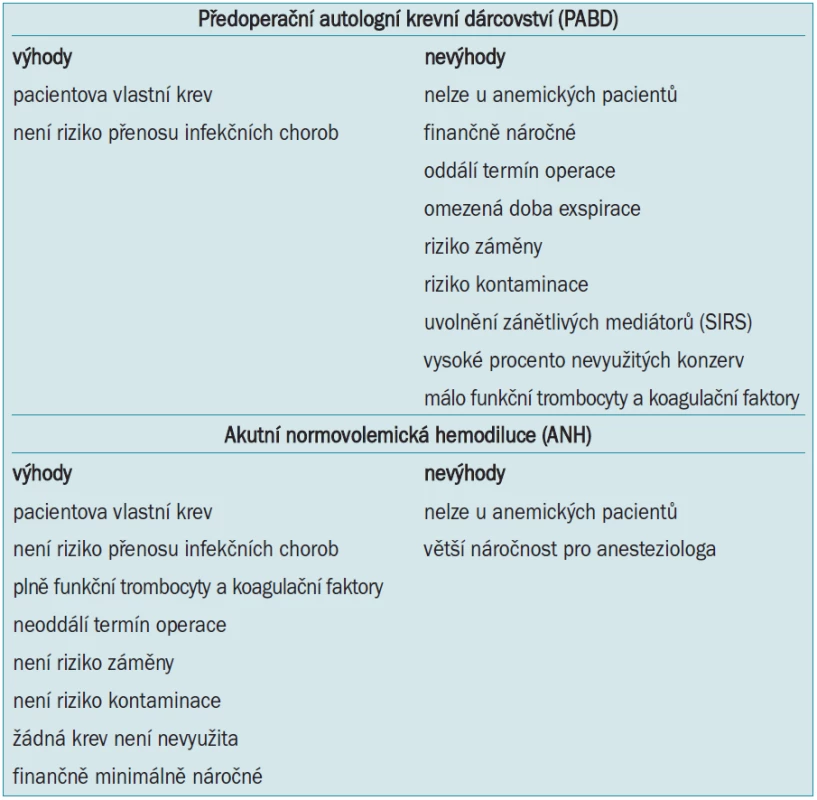
Předoperační autologní krevní dárcovství (preoperative autologous blood donation - PABD) je v české literatuře označováno jako autotransfuze. Jde o předoperační odběr a skladování pacientovy vlastní krve několik týdnů před plánovanou operací a její transfundování v případě potřeby během operace nebo po operaci. Rozšíření programu PABD znamenalo obrovský pokrok v bezpečnosti pro pacienty a v transfuzologii obecně [11,12]. U nás jde doposud o nejrozšířenější metodu pracující s autologní krví. Vedle nesporných výhod jako zamezení přenosu infekčních nemocí, možnost použití u pacientů s nepravidelnými protilátkami apod jsou však v poslední době zdůrazňována i její negativa. Časová náročnost, nutnost oddálení termínu operace, omezená exspirace (tab. 3), riziko záměny, či kontaminace a v neposlední řadě i vysoké náklady vedou k přehodnocení provádění PABD. Ve vyspělých zemích je tato metoda postupně nahrazována akutní normovolemickou hemodilucí - ANH (viz níže). Bylo opakovně prokázáno, zejména u urologických výkonů, že ANH má stejné výsledky (ve smyslu snížení aplikace alogenní krve, hodnot Hb apod) jako PABD při současně mnohem nižších nákladech [13,14].
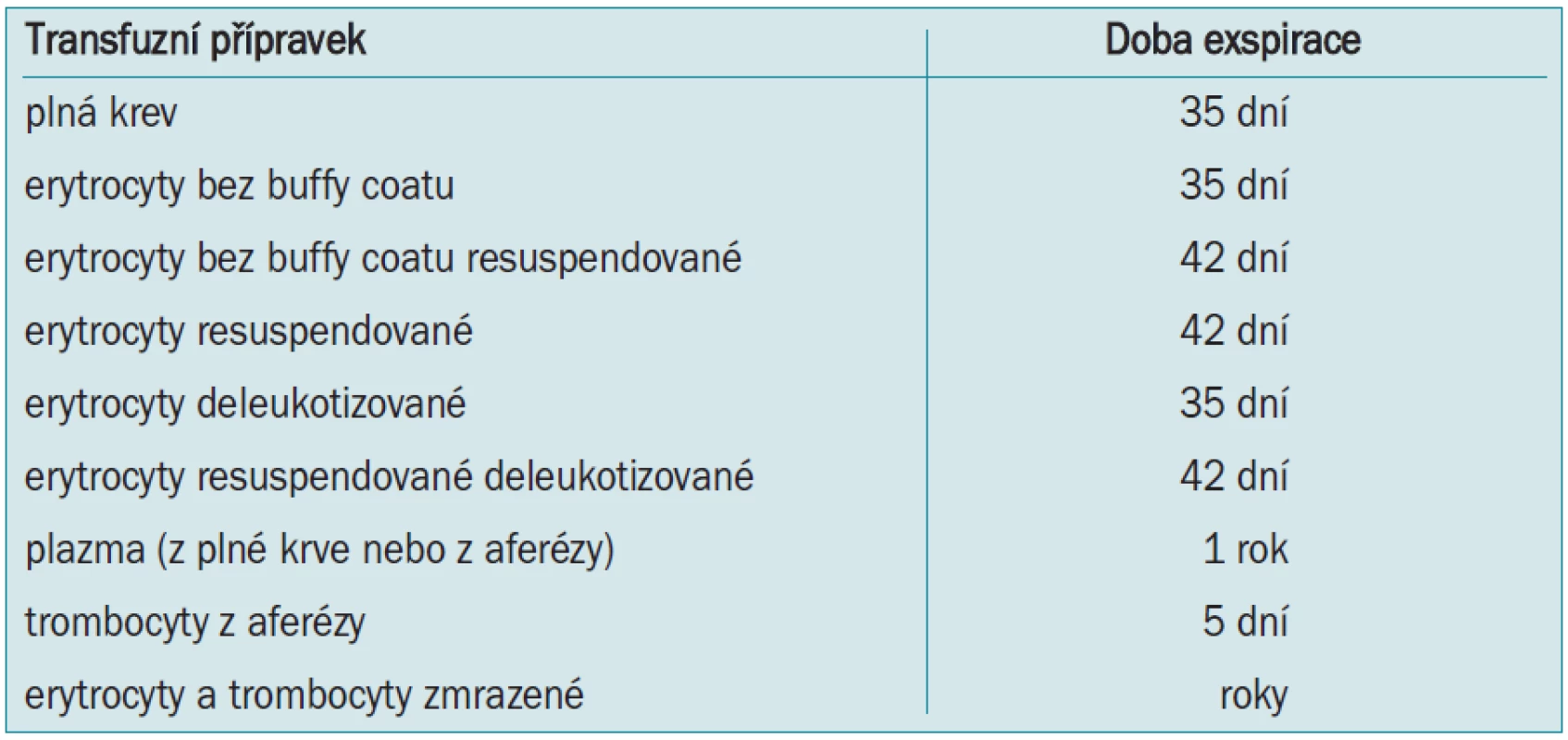
Navíc existují i rizika související s podáním pacientovy vlastní krve, zejména pokud byla delší dobu skladována. Studie prokázaly, že během skladování krve dochází k rozpadu jejich buněčných složek, zejména erytrocytů a leukocytů. Následně uvolněné mediátory typu interleukinů způsobují v různé míře zánětlivou reakci až typu systémové zánětlivé reakce (systemic inflammatory response syndrome - SIRS) [15]. Z toho důvodu platí: čím je krev „starší“, tím je méně kvalitní, a naopak.
Dárci jsou opakovaně vyšetřováni na přítomnost několika nejvýznamnějších nemocí (tab. 4). Nespornou vedlejší výhodou programu PABD je proto i každoroční záchyt těchto patogenů u několika doposud asymptomatických nemocných (tab. 5).


AKUTNÍ NORMOVOLEMICKÁ HEMODILUCE
Akutní normovolemická hemodiluce (acute normovolemic hemodilution - ANH) je postup, při kterém se bezprostředně před operací (proto akutní) odebere pacientovi několik jednotek krve a nahradí se náhradními roztoky (proto normovolemická), čímž dojde ke zředění pacientovy krve (proto hemodiluce) [16]. Krev následně ztracená během operace tedy obsahuje méně erytrocytů, a tudíž je menší i výsledná absolutní ztráta červených krvinek. Odebranou krví jsou poté hrazeny peroperační krevní ztráty. Tato velmi elegantní metoda vznikla v kardioanestezii při naplňování mimotělního oběhu. Záhy se rozšířila především do urologie a ortopedie, a posléze do všech operačních oborů. Bylo prokázáno, že správně provedená hemodiluce neznamená pro organizmus žádné nebezpečí. Naopak hemodiluce zlepšuje reologické vlastnosti krve, klesá periferní cévní odpor a zvyšuje se minutový srdeční výdej. Při zachované normovolemii nedochází ke zvýšení tepové frekvence, a tím ani ke zvýšení spotřeby kyslíku [17].
Stupeň provedení ANH (tab. 6) je individuální dle klinického stavu pacienta. Jelikož se v urologii většinou jedná o starší pacienty s přidruženými chorobami, bývá prováděna převážně tzv. mírná hemodiluce na hematokrit 0,30, transfuzní „trigger“ je obvykle stanoven na hematokrit 0,25. U vybraných pacientů v dobrém klinickém stavu lze provést i hemodiluci na cílový hematokrit 0,25 či 0,20 s příslušně nižším transfuzním triggerem. Množství odebrané krve závisí na předoperační hodnotě hematokritu a celkového tělesného krevního objemu (total body blood volume - - TBBV) a pohybuje se cca mezi 500–3 500 ml krve. Provádění ANH neoddaluje začátek ani nezpomaluje průběh operace.

Exspirační doba, po kterou může být odebraná krev ponechána na předsálí při pokojové teplotě, činí 6 hodin. Pokud je krev transfundována týmž anesteziologem, který ji odebíral, není třeba provádět před aplikací ani křížovou zkoušku. Krevní vaky s krví získanou pomocí ANH jsou podávány v obráceném pořadí, než v jakém byly odebírány.
Hemokoagulační parametry - alespoň ty základní, které se běžně vyšetřují - nejsou provedenou hemodilucí významně ovlivněny anebo tyto změny nemají klinický efekt. Oproti PABD máme přímo na sále zásobu plné krve, s funkčními trombocyty a koagulačními faktory, kterou není potřeba ohřívat, a je okamžitě k dispozici [18]. To je velká přednost oproti objednávání krve z krevní banky, při kterém může být doba mezi objednáním krve a jejím podáním pacientovi poměrně dlouhá. Krev získaná při ANH je navíc vůbec nejkvalitnější autologní krví.
Srovnání PABD a ANH je uvedeno v tab. 7. Na pracovišti autorů byl proto pro urologické výkony zcela zrušen program autotransfuzí a nahrazen rutinním používáním ANH u výkonů typu radikálních cystektomií, prostatektomií, nefrektomií a dalších.
FARMAKOLOGICKÉ PROSTŘEDKY KREVNÍ PÉČE
Zvláště v posledních 2 dekádách se díky farmaceutickému výzkumu a vývoji dostávají do popředí farmakologické postupy při beztransfuzní léčbě. Jsou to jednak léky podporující tvorbu a zrání červených krvinek (hematopoetika) a jednak léky zvyšující hemostázu (hemostatika).
Hematopoetika
Pro syntézu erytrocytů jsou nezbytné adjuvantní látky jako železo, kyselina listová a vitamin B12 [19]. Při jejich deficitu vzniká anémie již předoperačně, či je prodloužené zotavování červené krevní řady po operačním výkonu. Jsou stejně důležité pro syntézu způsobenou jak endogenním erytropoetinem, tak jeho exogenně aplikovanou rekombinantní formou (viz níže).
Rekombinantní lidský erytropoetin (recombinant human erythropoietin - rHuEPO) je produkt genového inženýrství. Jedná se o biosyntetickou formu přirozeného lidského hormonu, který stimuluje tvorbu červených krvinek [20]. Cílovým orgánem je kostní dřeň. Poprvé byl použit ve druhé polovině 80. let minulého století pro úpravu anémie u pacientů v dialyzačním programu a následně pro léčbu anémie zhoubných nemocí a nemoci AIDS. Koncem 90. let bylo schváleno jeho použití během odběru autotransfuzí před operačními výkony a pro léčbu tzv. chirurgické anémie. V roce 1994 vyslovila společná rada Amerického červeného kříže a Americké asociace krevních bank postulát, že léčba rHuEPO je „specifická terapie, která by měla být použita místo krevní transfuze, pokud klinický stav pacienta poskytuje dostatek času, aby tento lék zvýšil erytropoézu“. Jeho velký přínos potvrzují mnohé studie [21,22], velmi často u urologických operací, i vlastní zkušenosti autorů. Pro delší biologický poločas se upřednostňuje podání subkutánní před intravenózním. Otázkou ještě zůstává optimální dávkovací schéma. Jedno z nejčastějších je 600 IU/kg t.hm. 1krát týdně po dobu 3 týdnů. Klinický efekt však mají i dávky podstatně nižší, zvl. u primárně neanemických pacientů [23]. Autoři mají výborné zkušenosti s aplikací 100 IU/kg t.hm. 2krát týdně po dobu 2 týdnů při současném agresivním odebírání autotransfuzí před radikální retropubickou prostatektomií. Erytropoetin umožnil odebrat 4 transfuzní jednotky během 2 týdnů všem pacientům (tj. 100 %) oproti pouze 55 % pacientům v kontrolní skupině bez aplikace rHuEPO. Stejně tak byla statisticky významně snížena spotřeba alogenní krve, a naopak zvýšeny hodnoty hemoglobinu v celém hospitalizačním období [24]. Výhody rHuEPO [25] jsou přehledně shrnuty v tab. 8. Nežádoucí účinky jsou vzácné a nemají větší klinický význam. Jeho hlavní nevýhodou, by relativní a dočasnou, je jeho vyšší cena. Modifikovanou verzí rekombinantního erytropoetinu s dlouhodobým účinkem je darbepoetin alfa [26].

Hemostatika
Kromě tradičních farmak, jako je kyselina aminokapronová, tranexamová nebo aprotinin (která se v urologii příliš neuplatnila) se na začátku 21. století objevil rekombinantní aktivovaný faktor VIIa (rFVIIa). Původně byl vyvinut pro pacienty s hemofilií, zejména s přítomností inhibitorů proti koagulačním faktorům. Postupně však byly popsány jeho vynikající účinky při terapii závažných a život ohrožujících krvácení u traumat nebo během operací i u pacientů s normálními hemostatickými poměry [27,28,29]. Je pokládán za univerzální hemostatickou zátku, která je schopna zvrátit jinak neztišitelné krvácení s infaustní prognózou (těžké peroperační koagulopatie nebo chirurgicky neošetřitelné krvácení např. z dolní duté žíly). Pro svůj skutečně excelentní účinek je v urologii používán jako ultimum refugium u jinak nestavitelných krvácení. Podobně jako u rHuEPO brání masovému rozšíření rFVIIa jeho cena.
PEROPERAČNÍ REKUPERACE KRVE
Jedná se o sterilní odsátí krve z operační rány, přístrojové oddělení erytrocytů od ostatních složek krve pomocí centrifugace a zpětnou transfuzi vzniklého erytrocytárního koncentrátu do pacientova oběhu. Tato účinná metoda je používána zejména v cévní, srdeční, ortopedické a transplantační chirurgii [30]. Jelikož však během zpracování nedochází k odstranění maligních buněk, není tato metoda pro riziko diseminace maligního procesu doporučována v onkochirurgii.
Proto byly zkoušeny různé technické modifikace a velmi často právě u urologických operací. Jednou z nadějných cest bylo ozařování rekuperované krve před navrácením do pacientova oběhu. Druhou možností byl průtok krve přes leukocytární filtry, jež prokazatelně zachytávaly buňky různých typů nádorů. Přestože byla v experimentech i některých klinických studiích dokázána takřka úplná eliminace maligních buněk v retransfundované krvi, obě zlepšení narážela na obtížnou proveditelnost a časovou náročnost. Tyto metody výrazně zpomalovaly rychlost retransfuze, a proto byly hůře použitelné v situacích prudkého krvácení, v nichž nebyl dostatek času na odstranění zhoubných buněk.
Z tohoto důvodu zůstává onkochirurgický výkon - spolu se septickými stavy - kontraindikací pro použití přístrojové rekuperace krve, by se jedná již jen o kontraindikaci relativní. V urologii je její uplatnění okrajové.
ZÁVĚR
Omezování krevních ztrát a minimalizace transfuzí alogenní krve je žádoucím cílem u všech léčebných postupů nejen v urologii.
Předoperační autologní krevní dárcovství je již několik let často používáno u náročnějších operací. Vzhledem k finanční a organizační náročnosti je tato metoda v zahraničí nahrazována, či doplňována akutní normovolemickou hemodilucí, která pracuje s nejkvalitnější autologní krví. Z tohoto důvodu se stala na našich urologických sálech rutinně používanou metodou u výkonů s očekávanou velkou krevní ztrátou. Jedná se především o výkony typu radikální cystektomie, prostatektomie či nefrektomie. Kromě odstranění rizik spojených s alogenní krví je zde i velká úspora ekonomická za nepodané dárcovské krevní transfuze. K výše uvedeným metodám se dají v indikovaných případech připojit i další, jako je např. velmi účinná aplikace erytropoetinu, řízená hypotenze, peroperační přístrojová rekuperace a jiné. Pro každý typ operačního výkonu a konkrétního pacienta lze tedy určit optimální postup krevní péče tak, aby pravděpodobnost podání cizí krve byla co nejmenší.
MUDr. Bronislav Stibor
MUDr. Roman Gál, Ph.D.
doc. MUDr. Ivan Čundrle, CSc.
1. anesteziologicko-resuscitační oddělení FN Brno
Sources
1. Čundrle I. Peroperační autotransfuze ve spondylochirurgii. Habilitační spis 1994 : 5.
2. Hébert PC, Wells G, Blajchman MA et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. N Engl J Med 1999; 340(6): 409-17.
3. Sandler SG. Risks of blood transfusion - 2002. Curr Opin Hematol 2002; 9(6): 509-10.
4. Hunter N, foster J, Chong A et al. Transmission of prion diseases by blood transfusion. J Gen Virol 2002; 83(11): 2897-905.
5. Chemeler SB, Prato BS, Cox PM jr et al. Association of bacterial infection and red blood cell transfusion after coronary artery bypass surgery. Ann Thorac Surg 2002; 73(1): 138-42.
6. Carson JL, Altman DG, Duff A et al. Risk of bacterial infection associated with allogeneic blood transfusion among patients undergoing hip fracture repair. Transfusion 1999; 39(7): 694-700.
7. Vamvakas EC, Blajchman MA. Deleterious clinical effects of transfusion-associated immunomodulation: fact or fiction? Blood 2001; 97(5): 1180-95.
8. Klein HG. Immunomodulatory aspects of transfusion: a once and future risk? Anesthesiology 1999; 91(3): 861-5.
9. Blumberg N, Heal JM. Transfusion immunomodulation. In: Anderson KC, Ness PM (eds). Scientific basis of transfusion medicine. 2. ed. Philadelphia: WB Saunders 2000 : 427-43.
10. Van Aken H, Miller ED jr. Deliberate hypotension. In: Miller RD (ed). Anesthesia. 5. ed New York: Churchill Livingstone 2000 : 1470-1486.
11. Goodnough LT, Grishaber JE, Birkmeyer JD, Monk TG, Catalona WJ. Efficacy and cost - effectiveness of autologous blood predeposit in patients undergoing radical prostatectomy procedures.Urology 1994; 44 : 226-231.
12. Toy PTCY, Menozzi D, Strauss RG, Stehling LC, Kruskull M, Ahn DK. Efficacy of preoperative donation of blood for autologous use in radical prostatectomy. Transfusion 1993; 33 : 721-724.
13. Monk TG, Goodnough LT, Brecher ME et al. Acute normovolemic hemodilution can replace preoperative autologous blood donation as a standard of care for autologous blood procurement in radical prostatectomy. Anesth Analg 1997; 85(5): 953-8.
14. Goodnough LT, Monk TG Brecher ME. Acute normovolemic hemodilution should replace the preoperative donation of autologous blood as a method of autologous-blood procurement. Transfusion 1998; 38(5): 473-6.
15. Avall A, Hyllner M, Bengtson JP, Carlsson L, Bengtson A. Postoperative inflammatory response after autologous and allogeneic blood transfusion. Anesthesiology 1997; 87 : 511-6.
16. Monk TG, Goodnough LT. Acute normovolemic hemodilution. Clin Orthop 1998; 357 : 74-81.
17. Lindahl S. Acute normovolemic haemodilution. Bailliere´s Clinical Anaesthesiology. 1996; 10 : 717-723.
18. Monk TG, Goodnough LT, Birkmeyer JD, Brecher ME, Catalona JW. Acute normovolemic hemodilution is a cost - effective alternative to preoperative autologous donation in patients undergoing radical retropubic prostatectomy. Transfusion 1995; 35 : 559-565.
19. Andrews CM, Lane DW, Bradley JG. Iron pre-load for major joint replacement. Transfus Med 1997; 7(4): 281-286.
20. Adamson JW, Spivak JL. Physiologic basis for the pharmacologic use of recombinant human erythropoietin in surgery and cancer treatment. Surgery 1994; 115 : 7-15.
21. Price TH, Goodnough LT, Vogler WR et al. The effect of recombinant human erythropoietin on the efficacy of autologous blood donation in patients with low hematocrits: a multicenter, randomized, double-blind, controlled trial. Transfusion 1996; 36 : 29-36.
22. Goodnough LT, Monk TG, Andriole GL. Erythropoietin therapy. N Engl J Med 1997; 336(13): 933-938.
23. Sans T, Bofill C, Joven J et al. Effectiveness of very low doses of subcutaneous recombinant human erythropoietin in facilitating autologous blood donation before orthopedic surgery. Transfusion 1996; 36 : 822-826.
24. Stibor B, Cundrle I, Gal R, Pacik D. The use of erythropoietin and red blood cell count optimalization in urological surgery. Br J Anaesth 1999; 82(Supp 1): 80.
25. Goodnough LT, Monk TG, Andriole GL. Current concepts: erythropoietin therapy. N Engl J Med 1997; 336 : 933-938.
26. Smith R. Applications od darbepoietin-alfa, a novel erythropoiesis-stimulating protein, in oncology. Curr Opin Hematol 2002; 9(3): 228-233.
27. Martinowitz U, Kenet G, Segal E et al. Recombinant activated factor VII for adjunctive hemorrhage control in trauma. J Trauma 2001; 51(3): 431-439.
28. Aldouri M. The use of recombinant factor VIIa in controlling surgical bleeding in non.haemophiliac patients. Pathophysiol Haemost Thromg 2002; 32(Suppl 1): 41-46.
29. Moscardo F, Perez F, de La Rubia J et al. Succesful treatment of severe intra-abdominal bleeding associated with disseminated intravascular coagulation using recombinant activated factor VII. Br J Haematol 2001; 114(1): 174-176.
30. Booke M, Ahlke C, Hagemann O, Hinder F. Intraoperative autotransfusion - influence of technique, speed, and hematocrit on quality. Infus Ther Transfus Med 2000; 27(6): 307-310.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2005 Issue 1
-
All articles in this issue
- SOUČASNÝ POHLED NA PORANĚNÍ MOČOVODU
- PORANĚNÍ LEDVIN A MOŽNOSTI ZACHOVÁNÍ RENÁLNÍHO PARENCHYMU
- PORANĚNÍ MOČOVÉHO MĚCHÝŘE
- PORANĚNÍ MUŽSKÉ URETRY - ČASNÉ A ODLOŽENÉ ŘEŠENÍ
- PORANĚNÍ ZEVNÍHO GENITÁLU
- TRAUMA INERVACE DOLNÍCH MOČOVÝCH CEST
- KREVNÍ PÉČE U ELEKTIVNÍCH UROLOGICKÝCH VÝKONŮ
- OPTIMÁLNÍ METODA MĚŘENÍ NITROBŘIŠNÍHO TLAKU
- STRESOVÁ INKONTINENCE MOČI U ŽEN A MOŽNOSTI JEJÍ FARMAKOLOGICKÉ LÉČBY
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- OPTIMÁLNÍ METODA MĚŘENÍ NITROBŘIŠNÍHO TLAKU
- PORANĚNÍ ZEVNÍHO GENITÁLU
- PORANĚNÍ MUŽSKÉ URETRY - ČASNÉ A ODLOŽENÉ ŘEŠENÍ
- PORANĚNÍ MOČOVÉHO MĚCHÝŘE
