Přehled nejnovějších technologií pro léčbu karcinomu prostaty (robotické systémy, laparoskopie, brachyterapie, kryoterapie, technologie Cyberknife)
A SUMMARY OF NEW TECHNOLOGIES FOR PROSTATE CANCER (ROBOT, LAP, BRACHY, CRYO, CYBERKNIFE)
The challenge of modern medicine is to increasingly use mini-invasive techniques. Nowadays, while surgery and ratio therapy must be considered the standard forms of treatment for prostatic cancer, nonetheless minivasive techniques are greeted with ever more enthusiasm by patiens. In addition the first long term results, indispensible for correct oncological evaluation of the technique, are also being reported. Brachytherapy, Cryotherapy and Cyberknife must be recognised by urology, and proposed for patiens with prostate cancer, albeit only in case where the indications are correct. This paper will demonstrate the techniques, the results and the complications of this procedure, highlighting those essential aspects which may sometimes make the use of these procedures preferable to conventional techniques.
Key words:
prostate cancer, cryotherapy, brachytherapy, Cyberknife, laparoscopic and robotic surgery
:
G. Morgia
:
Department of Urology University of Catania, Italy
:
Urol List 2011; 9(2): 31-37
V moderní medicíně převládá trend co nejčastěji využívat miniinvazivní techniky. Ačkoli chirurgická léčba a radioterapie i nadále představují standardní metody pro léčbu karcinomu prostaty, miniinvazivní techniky jsou pacienty přijímány s velkým nadšením. K dispozici začínáme mít rovněž první dlouhodobější výsledky nezbytné pro správné posouzení onkologických výsledků léčby. Techniky, jako jsou brachyterapie, kryoterapie a systém Cyberknife, by měly najít své uplatnění i v urologii a v případě vhodných indikací by měly být nabízeny pacientům jako vhodná alternativa pro léčbu karcinomu prostaty. Autoři článku se zaměřují na tyto novější techniky, hodnotí jejich výsledky a výskyt komplikací s nimi spojených a zdůrazňují některé aspekty, které mohou z těchto technik činit vhodnější alternativu pro léčbu karcinomu prostaty než mnohé běžné metody.
Klíčová slova:
karcinom prostaty, kryoterapie, brachyterapie, Cyberknife, laparoskopická a robotická operace
V řadě evropských států a v USA byla v uplynulých 10–15 letech zaznamenána radikální změna ve stadiu diagnostikovaného karcinomu prostaty.
Zatímco dříve tvořily tumory v pokročilém nebo metastazujícím stadiu 80 % všech diagnostikovaných tumorů a lokalizované tumory představovaly asi pouhých 10 %, v současné době je situace zcela opačná – většina tumorů je diagnostikována v počátečních stadiích, což v praxi znamená, že je možné u těchto tumorů indikovat kurativní terapii.
Podle údajů Americké společnosti pro boj s rakovinou bylo v roce 1995 v USA diagnostikováno 141 520 lokalizovaných karcinomů prostaty. O deset let později je toto číslo více než dvojnásobné – 306 600.
Zároveň bylo pozorováno podobné zvýšení míry přežití po dobu pěti let, která u pacientů s karcinomem ohraničeným na orgán dosáhla 100 %.
Pro léčbu onemocnění T1–2 cN0M0 máme k dispozici následující možnosti: operační léčbu, externí nebo intersticiální radioterapii, pozorné vyčkávání nebo medikamentózní terapii.
Při hodnocení výsledků z nejrůznějších evropských zemí (Británie, Itálie, Francie, Španělsko a Německo) je zřejmé, že nejčastěji indikovanou formou terapie je operační léčba, pouze s výjimkou Velké Británie, kde se nejčastěji využívá radiační terapie. V ostatních státech je operační léčba indikována ve 42–60 % případů, radioterapie se užívá podstatně méně často. Nejčastěji je radioterapie indikována ve Francii, ve 26 % případů. Pozorné vyčkávání je indikováno u 5 % pacientů s výjimkou Velké Británie, kde se tato forma terapie užívá v 15 % případů. Na tomto místě je třeba poznamenat, že nemáme k dispozici údaje ze skandinávských zemí, kde se metoda pozorného vyčkávání užívá podstatně častěji. Medikamentózní léčba je indikována u 5–10 % pacientů. Často využívanou strategií je kombinace dvou nebo více metod. Nejčastěji se kombinovaná strategie užívá v Itálii (29 % případů).
Nebudeme se dále zabývat strategií pozorného vyčkávání ani medikamentózní terapií, které mají pouze omezenou terapeutickou hodnotu, a zaměříme se na možnosti využití operační léčby a nejnovější formy radioterapie – brachyterapie.
OPERAČNÍ LÉČBA
Nejradikálnější formu operační léčby představuje radikální prostatektomie. Radikální prostatektomii lze provádět prostřednictvím retropubického přístupu (antegrádně, nebo retrográdně), prostřednictvím perineálního přístupu, transkokcygeálně a konečně pomocí otevřeného nebo laparo-skopického přístupu. V dnešní době je bezpochyby nejčastěji užívanou technikou retrográdní retropubická prostatektomie.
Dříve byla nedílnou součástí operace i pánevní lymfadenektomie, která dodnes představuje zlatý standard pro správné stanovení stadia onemocnění u pacientů, u nichž karcinom invaduje lymfatické uzliny. Na následující aspekty léčby však stále existují rozporuplné názory: rozsah výkonu, terapeutický význam operace a minimální počet lymfatických uzlin, které je nutné odebrat při pánevní lymfadenektomii.
Regulovaná či omezená lymfadenektomie (v oblasti zevních ilických a obturátorových lymfatických uzlin) byla po řadu let považována za vhodnou metodu pro stanovení onkologického stadia, terapeutickému efektu tohoto výkonu však nebyla přisuzována žádná hodnota.
Nedávná studie Studera et al, jež byla uveřejněna v Journal of Urology, uvádí, že u 58 % všech pacientů, kteří podstoupili lymfadenektomii, bylo zjištěno zasažení lymfatických uzlin podél hypogastrických cév. Přibližně u 19 % pacientů byly lymfatické uzliny zasaženy pouze v této oblasti. Autoři dospěli k názoru, že pakliže není provedena rozšířená lymfadenektomie (lymfatické uzliny v oblasti interní, externí a společné ilické arterie a presakrální ilické uzliny) vystavujeme pacienta riziku, že bude přehlédnuto zasažení lymfatických uzlin, a co je hlavní, nebude možné adekvátně stanovit stadium nádoru. Studer et al dále uvádí, že pacienti, kteří podstoupili výkon s rozšířenou lymfadenektomií, měli o 25 % vyšší míru přežití než pacienti, kteří podstoupili pouze omezenou lymfadenektomii. Heidenreich rovněž uvádí, že u pacientů s onemocněním s vysokým rizikem je vhodné provedení rozšířené lymfadenektomie, kterou lze u pacientů s příznivou prognózou (PSA < 10, Gleasonovo skóre < 6, sta-dium T1c–T2a) vynechat. O tom, zda provádět lymfadenektomii, nebo nikoli, rozhoduje operatér na počátku radikální operace.
Obvykle se provádí střední nebo příčná Pfannenstielova suprapubická incize, obvykle o délce max. 8 cm. Běžně se užívá Balfourův retraktor nebo Book-Walterův rozvěrač, díky čemuž výkon mohou provádět pouze dva operatéři. Pro zvětšení a osvětlení operačního pole lze při výkonu využít nejrůznější zvětšující brýle a čelní xenonovou lampu. První krok radikální prostatektomie spočívá v oboustranném otevření endopánevní fascie a přípravě apexu prostaty s resekcí puboprostatických ligament. Následně je provedena ligace a přerušení Santoriniho venózního svazku a odhalena močová trubice. Po přerušení anteriorní uretrální ploténky a vytažení katétru je přerušena posteriorní uretrální ploténka, čímž izolujeme vezikoprostatický blok. V této fázi (v závislosti na předoperačních parametrech) lze přistoupit k technice zachování obou neuro-vaskulárních svazků. Technika pro zachování neurovaskulárních svazků bude popsána později. Hrdlo močového měchýře je odděleno od prostaty a komplex sestávající z prostaty, chámovodu a semenných váčků je odstraněn „en bloc“. Pokud není zamýšleno šetření hrdla močového měchýře, je provedena rekonstrukce ve tvaru rakety a everze sliznice neohrdla. Následně je provedena sutura stěny pahýlu močové trubice (4–10 stehů) k močovému měchýři, čímž vytvoříme vezikouretrální anastomózu. Obvyklé pooperační komplikace (po radikální operaci) zahrnují vznik inkontinence a erektilní dysfunkce.
Pro urychlení obnovy kontinence byly navrženy určité modifikace standardní techniky zohledňující hlavní cíl operace. Walsh jako první (a následně Libertino) navrhuje podporu neohrdla plikací laterální části močového měchýře, což skutečně podporuje posteriorní stěny močového měchýře a neoveziky, který je nutné často rekonstruovat pro vytvoření adekvátního kalibru močové trubice. Walsh uvádí, že 93 % pacientů, u nichž byla užita tato technika, bylo po 12–18 měsících zcela kontinentních.
Ve snaze o zachování potence po radikální operaci byla na počátku devadesátých let vyvinuta nervy šetřící technika. Tato technika spočívá v zachování n. erigentes, které jsou zodpovědné za vznik erekce.
Nervy erigentes probíhají podél posteriolaterálního povrchu prostaty a tvoří větve pánevního plexu, které vychází ze sakrálních kořenů S2, S3 a S4. Vlákna těchto nervů vedou směrem k močové trubici v četných nervových zakončeních, která zasahují do corpora cavernosum urethrae.
Techniku umožňující ušetřit nervové svazky lze indikovat pouze u vybraných pacientů, kteří splňují následující parametry: věk < 60 let, lokalizované onemocnění, Gleasonovo skóre < 6, předoperační hladina PSA < 10 ng/ml, očekávaná délka života > 10 let, dobrá erektilní funkce před výkonem, motivace k obnovení uspokojivého sexuálního života, souhlas s dodržováním rehabilitačních technik a profylaxe.
Podstatou této techniky je preparace těsně u laterálního povrchu prostaty a tkání prostatickovezikálního spojení, až dosáhneme oblasti močové trubice mezi vrstvami prostatické fascie a prostatické kapsuly. Menon navrhnul modifikaci původní techniky nazývané „Afroditin závoj“ (Veil of Aphrodite), jež spočívá v zachování integrity laterální laminy kapsuly prostatické žlázy z anteriorní až po nejvíce posteriorní část, kde se nalézají všechny cévní i nervové struktury podílející se na erekci. Doposud jsme za pomoci této techniky dosáhli vynikajících výsledků. Pro tuto techniku je nezbytné speciální zařízení, tzv. „water jet dissection“ (preparace za pomoci aplikace proudu vody), jenž přenáší proud vody o velké rychlosti, čímž umožňuje přesně a snadno separovat chirurgické vrstvy, udržet operační pole čisté a poskytuje vynikající pohled na jednotlivé struktury.
Možnost zachování potence po radikální operaci však závisí na věku pacienta. Bylo prokázáno, že pakliže techniku provádí zkušený odborník, zůstane erektilní funkce zachována u 85–90 % pacientů mladších 60 let, u starších pacientů je toto procento nižší.
Výsledky z nejrůznějších publikací jsou poměrně různorodé – uvádí míru úspěšnosti v rozmezí od 25–30 % do 75–80 %. Tyto rozdíly jsou zčásti zapříčiněny nesprávným předoperačním hodnocením erektilní funkce (nebo dokonce jeho absencí) a rovněž úrovní zkušeností operatéra i operačního týmu, očekávání pacienta a načasováním pooperačního vyšetření.
BRACHYTERAPIE
Radioaktivita byla objevena manžely Pierre a Marie Curie na konci 19. století a v medicíně byla poprvé využita v Louis Hospital v Paříži 1901 pro léčbu kožní neoplazie. V urologii, a zejména při léčbě karcinomu prostaty, zavádí první implantáty Withmore na počátku 70. let minulého století. Současnou transperineální ultrasonografickou metodu vyvinul John Blasko ze Seattlu na počátku 90. let minulého století.
Radioaktivní zrna lze implantovat přechodně, nebo trvale. Nejčastěji se užívají izotopy jód-125 a palladium-103, které mají odlišný poločas rozpadu: 50 dní u jódu-125 a 17 dní u palladium-103. Brachyterapie se obvykle dělí do tří fází: plánování léčby, samotná implantace a kontrolní fáze (tzv. post-planning). V plánovací fázi je stanovena vhodná dávka a umístění implantátu do prostatické žlázy za pomoci ultrazvukového vyšetření v anestezii. Od apexu až po bázi prostaty je v 0,5 cm intervalech proveden scan celé prostatické žlázy v anteriorně-posteriorním směru. Snímky se následně převedou do speciálního softwaru, který umožňuje radioaktivní implantáty rozprostřít po celé žláze tak, aby byly všechny části vystaveny dostatečné dávce radiace. Obvykle se užívá dávka kolem 140–145 Gy.
Před samotnou implantací jsou připraveny jehly obsahující radioaktivní zrna. Distální konce jehel jsou uzavřeny pomocí vrstvy kostního vosku a následně naplněny implantátem. K rozmístění jehel je užita šablona vytvořená v plánovací fázi.
Rapid-strand (radioaktivní zrna ve vláknech) jsou oddělena do jednotlivých skupin, kdy všechna zrna jsou oddělena od sebe vzájemně pomocí spaceru. Pro uvolnění zrn se užívají rovněž tzv. „extra-needles“. Jehly jsou následně umístěny do „screened box“, který věrně kopíruje šablonu, která bude užita při implantaci.
Jehly se zavádí na základě předem stanovených souřadnic pod ultrazvukovou a skiaskopickou kontrolou pomocí instrumentu, který se nazývá „brachystepper“, který zobrazuje mřížku se souřadnicemi označenými pomocí číslic a písmen. Pacient je umístěn do litotomické polohy, výkon se provádí v periferní nebo celkové anestezii. Průměrně se zavádí 25–30 jehel se 70–100 implantáty.
Na konci výkonu je poloha zrn ověřena pomocí skiaskopie, abychom se přesvědčili o tom, že nedošlo k přesunu žádného z implantátů. 30 dní po výkonu je zahájena kontrolní fáze (post-planning). Jedná se ve své podstatě o kontrolu toho, jaká dávka byla skutečně aplikována do prostaty oproti ideálnímu terapeutickému plánu. Obvykle se post-planning provádí pomocí CT nebo CT/NMR pánve, pomocí techniky, jež se nazývá „image fusion“.
Kteří pacienti jsou vhodnými kandidáty pro brachyterapii?
Tři organizace EAU, EORTC, ESTRO společně v roce 2000 uveřejnily guidelines pro intersticiální brachyterapii.
Ideální kandidát splňuje následující charakteristiku: PSA < 10 ng/ml, Glea-sonovo skóre < 6, cT1–2, IPSS < 10, Qmax > 15 ml/s a objem prostaty < 50 ml.
U této populace pacientů představuje brachyterapie vhodnou terapeutickou možnost, která dosahuje vynikajících výsledků. V případě, že se onkologické parametry odlišují od výše zmíněných kritérií, může být nezbytná indikace jednoho cyklu ozařování zevním paprskem nebo hormonální terapie.
U pacientů, kteří splňují výše uvedené parametry, dosahuje brachyterapie srovnatelných výsledků jako radikální operace a pravděpodobně lepších výsledků než radioterapie s ozařováním zevním paprskem. Míra přežití bez recidivy po 12 let se pohybuje v rozmezí 70–75 %. V současné době čekáme na definitivní výsledky sledování po 15 letech, které mohou potvrdit vhodnost této metody pro léčbu pacientů splňujících výše uvedenou charakteristiku.
Je třeba mít na paměti, že kritéria pro definici odpovědi na brachyterapii obecně odpovídají kritériím pro radioterapii. Tato terapie je spojena s výskytem časných a pozdějších komplikací. Mezi časné komplikace patří: cystitida (70–90 %), proktitida (2–9 %), AUR (10–22 %), hematurie, bolest v oblasti perinea a nevhodné umístění zrn. Pozdější komplikace zahrnují: protrahovaný dysurický syndrom (5 %), uretrální stenózu (1–9 %) a rektální píštěl (< 1 %).
Co se týče inkontinence, lze potvrdit, že 15 let po terapii se míra inkontinence blíží 0 %. S ohledem na erektilní funkci: krátce po léčbě byla míra impotence velmi nízká – přibližně 5–8 %. Po pěti letech sledování však bylo zaznamenáno zvýšení míry impotence na 20–25 %. Brachy-terapie však stále představuje preferovanou volbu pro pacienty, kteří si přejí zachovat erektilní funkci.
KRYOTERAPIE
Kryoterapie byla poprvé využita při léčbě karcinomu v roce 1850, když James Arnott užil fyziologický roztok obsahující led při léčbě karcinomu prsu a čípku.
V rámci léčby prostaty využili poprvé kryoterapii Gonder et al v polovině 60. let minulého století. Tato skupina autorů vyvinula modifikované zařízení a sondy vhodné pro zmrazení prostatické tkáně trans-uretrální cestou.
Technologie první generace se využívala až do 70. let minulého století. Vzhledem tomu, že při této formě kryoterapie se neužívá TRUS navigace ani metoda k zahřívání močové trubice, je spojena s vysokou mírou výskytu komplikací (inkontinence, impotence a rektální píštěl), v důsledku čehož se od této formy léčby až do 80. let upouští.
Následně se objevuje několik ojedinělých studií z několika center, které prokazují příznivou míru doby přežití při užití kryoterapie ve srovnání s jinými druhy léčby.
Kryoterapie druhé generace využívá zdokonalené ultrazvukové metody a techniky pro zahřátí močové trubice. V současné době užívanou technologii třetí generace popisuje jako první Wong v roce 1997 a posléze Chin et al.
V rámci této nejnovější modifikace byl tekutý dusík nahrazen plynem (obsahujícím argon). Nový systém má následující přednosti: cyklus mrazení lze zahájit a zastavit téměř simultánně, argon lze snadno skladovat, aniž by došlo k jeho vypařování, a je připraven k okamžitému použití, hadička vedoucí argon je mnohem menší než u přístrojů předchozích generací a tzv. „kryojehly“ umožňují přímé zavedení transperineální sondy prostřednictvím šablony jako např. při brachyterapii bez nutnosti dilatace přístupové cesty.
Tato metoda vyvolala novou vlnu entuziazmu, protože ji lze skvěle kombinovat s brachyterapií. K dispozici je čím dál širší spektrum instrumentů pro obě techniky a řada specialistů na radioterapii je v současné době schopna provádět i kryoterapii.
Destrukční účinek kryoterapie lze shrnout do dvou hlavních mechanizmů: buněčné a vaskulární poranění. První mechanizmus spočívá ve snížení teploty, což vede k progresivnímu poškození buněk (v důsledku metabolizmu proteinů a lipidů). V případě, že pokles teploty trvá dostatečně dlouho, může nastat buněčná smrt. V případě, že teplota tkáně klesne na 0 °C, dochází ke krystalizaci extracelulární tekutiny, což vede ke zvýšení osmotického extracelulárního tlaku, zejména v těch místech, která nedosáhla bodu mrazu. Buněčná tekutina pak může unikat do extracelulárního prostoru. Dochází ke změně buněčného pH, což způsobuje denaturaci buněčných proteinů. Tato „dehydratace“ je nejsilnější při teplotách mezi 0 a -20 °C a v některých případech může vyvolat buněčnou smrt. Ne ve všech případech však tento mechanizmus (nazývaný též „solution-effect injury“) vyvolá destrukci buňky. V případě, že teplota klesne pod -20 °C, dochází k zániku buňky téměř ve všech případech. Intracelulární krystalizace začíná při teplotě -15 °C, tento proces je však úplný až při teplotách o něco nižších než -40 °C. Je pravděpodobné, že významnou roli hraje i rychlost poklesu teploty. V případě pomalého poklesu teploty může dojít pouze k „solution--effect“ poranění, které nemusí způsobit buněčnou smrt, zatímco rychlejší pokles podporuje vznik intracelulárních ledových krystalů. Vaskulární poranění vzniká v důsledku nepřímého nebo pozdějšího poranění (vyvolaného kryoterapií) a spočívá v hypoxii a vaskulární trombóze.
V další části popisuji operační techniku kryoterapie třetí generace s užitím inertního plynu a 17G CryoNeedles™ (Oncura, Inc., Plymouth Meeting PA), která se v našem pracovišti běžně provádí. Pacient je umístěn do extrémní litotomické polohy, perineum se nachází mírně přes operační stůl v 90° úhlu směrem k podlaze. Provedeme cystoskopii, během níž je zaveden vodič nezbytný pro pozdější umístění katétru k zahřátí močové trubice. Během cystoskopie je rovněž cystostomií zaveden Foleyho katétr, který je během výkonu uzavřený. Šablona (brachytherapy template) je pomocí stepperu upevněna před perineem. Pomocí TRUS (transrektálního ultrazvukového vyšetření) se změří velikost prostaty a tyto údaje jsou převedeny do počítače. Pod ultrazvukovou kontrolou jsou perkutánní cestou zavedeny kryosondy. První sonda je umístěna superiorně, další sondy jsou umístěny v intervalech po 1 cm a ve vzdálenosti 0,5 cm od prostatické kapsuly a hrdla močového měchýře. Obvykle se zavádí 5–20 kryosond v závislosti na tvaru a rozměrech prostaty, které jsou umístěny ve třech (výška prostaty < 3,5 cm) nebo čtyřech (výška prostaty > 3,5 cm) oddílech, kdy každý obsahuje 2–5 kryosond. Dále zavedeme jehly obsahující tepelný senzor – jedna je umístěna na periferní část prostatické žlázy a další dvě do Denonvilliersovy fascie mezi prostatou a rektální stěnou.
Po umístění všech jehel a tepelných senzorů zavedeme zahřívací uretrální katétr s pomocí vodiče, který byl zaveden během cystoskopie. V této fázi lze zahájit mrazicí cyklus. Mrazení zahájíme superiorně-inferiorním směrem. Je třeba zajistit, aby teplota v rektu neklesla pod 0 °C, v případě nutnosti můžeme rektum zahřát pomocí katétru. Po dosažení teploty -30 °C nebo v lepším případě méně než -40 °C udržujeme teplotu po dobu přibližně deseti minut, poté je mrazicí cyklus ukončen. Po několikaminutové pauze zahájíme krátký cyklus aktivního i pasivního zahřívání pomocí helia (přibližně minutu). Obvykle provádíme dva cykly. Další den je pacient propuštěn. Suprapubický Foleyho katétr je ponechán na místě přibližně dalších 7 dnů, je zahájena profylaxe antibiotiky. Po odstranění katétru se doporučuje po dobu jednoho měsíce alfalytická terapie.
Na základě indikací rozdělujeme kryoterapii do tří různých kategorií: primární terapie, záchranná terapie a paliativní léčba.
V prvním případě je kryoterapie indikována jako kurativní modalita, jež představuje alternativu k operační léčbě nebo zevní (RT) či intersticiální (BT) radioterapii. Indikaci této modality v rámci terapie první volby pro léčbu tohoto typu tumoru je však nutné dle našeho názoru potvrdit v dalších komparativních studiích.
Dalšími vhodnými kandidáty pro tuto modalitu jsou: pacienti s lokalizovaným onemocněním, u nichž není možná operační léčba, svědci Jehovovi a pacienti užívající trvale antikoagulancia.
Záchranná terapie v současné době představuje nejčastější indikaci. Vhodnými kandidáty jsou pacienti, u nichž došlo po radioterapii (ozařování zevním paprskem nebo brachyterapii) k lokální recidivě. Indikace kryoterapie po selhání operační léčby je dosud rozporuplným tématem. U této populace pacientů je ve srovnání s jedinci, kteří podstupují primární léčbu, zaznamenána vyšší incidence komplikací (zejména inkontinence a rektální píštěl). V poslední řadě lze tuto terapii užít pro její paliativní účinek po všech ostatních terapeutických modalitách.
Tato modalita má pouze málo kontraindikací: velký uretrální defekt v důsledku předchozí operace prostaty (BPH), prostata o velkém objemu (> 50–60 g). Za kontraindikaci lze rovněž považovat závažnou patologii v oblasti rekta.
Výsledky kryoterapie se liší v závislosti na užité technologii (první, druhé nebo třetí generace).
Nyní se zaměříme na výsledky nejčastěji užívané technologie, tj. třetí generace, a zejména systému SeedNet™. Nejprve uvádíme výsledky kryoterapie v rámci primární terapie a následně v rámci záchranné terapie. Jak ukazuje tab. 1, jsou výsledky kryoterapie v rámci primární terapie (definováno jako doba přežití bez biochemické recidivy) vynikající.
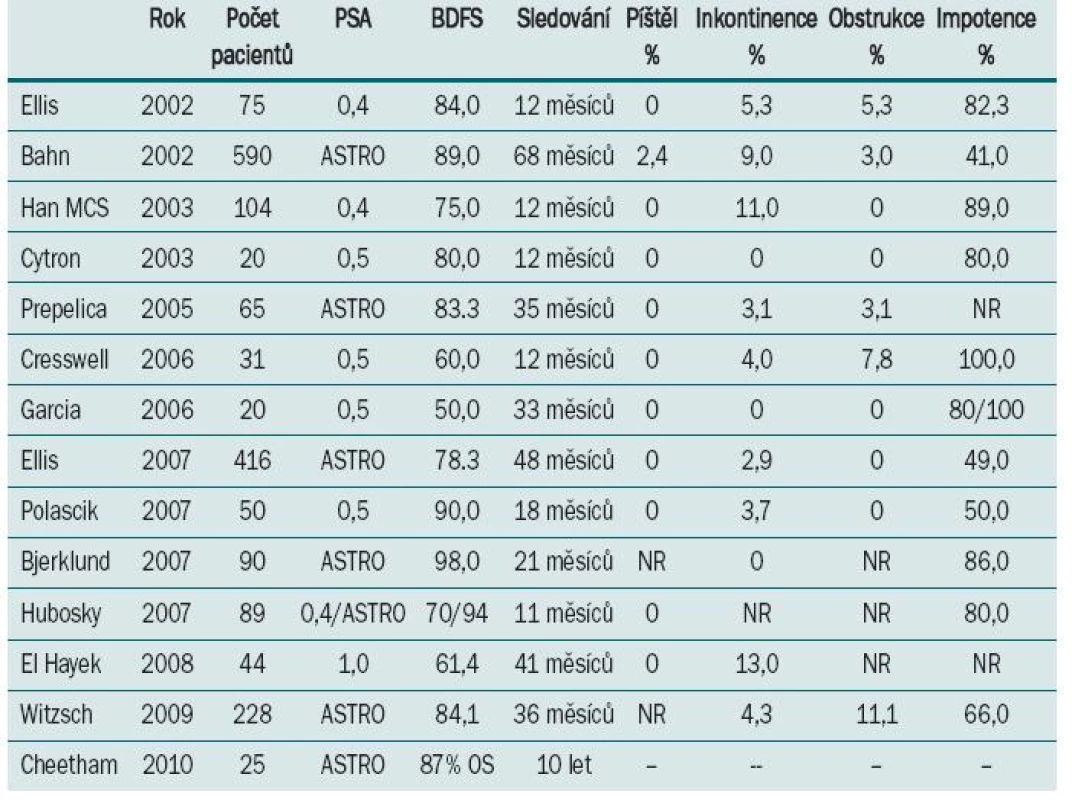
Míra BFDS se pohybuje v rozmezí 75–86 % (v závislosti na autorovi). Je však třeba zdůraznit, že studie zahrnovaly pouze malé množství pacientů, s výjimkou studie Prepelica et al, a sledování trvalo pouze 12 měsíců. Míra komplikací v těchto studiích je velmi nízká (ve srovnání se studiemi využívajícími technologie starších generací). Míra inkontinence se pohybuje v rozmezí 3–5 % (střední hodnota 4,7 %), míra výskytu obstrukce 2–3 %. Žádná ze studií neuvádí výskyt urorektální píštěle.
Katz ve svém přehledu publikovaném v Current Oncology (2003) srovnává výsledky kryoterapie a dalších modalit pro léčbu lokalizovaného onemocnění (operační léčby, brachyterapie, 3D-radioterapie, RT zevním paprskem) a uvádí, že operační léčba dosahuje nejlepších výsledků (BDFS) při léčbě pacientů s nízkým rizikem, zatímco kryoterapie je nejúčinnější při léčbě pacientů se středním a vysokým rizikem. Jak již však bylo uvedeno, počet pacientů, kteří podstoupili kryoterapii, je velmi malý a doba sledování příliš krátká. S ohledem na morbiditu dosahuje kryo-terapie rovněž vynikajících výsledků, zejména v oblasti snížení míry inkontinence (srovnatelné s brachyterapií). S ohledem na zachování sexuální funkce u potentních pacientů je však již méně úspěšná. Pouze u 15–20 % pacientů došlo po kryoterapii k obnově sexuální potence, což je výsledek srovnatelný s nejhoršími výsledky u ostatních technik. V nedávné době byla na zvířecím modelu vyzkoušena nová technika kryoterapie, kterou lze popsat jako „nervy šetřící“. Princip této techniky spočívá v zahřívání neurovaskulárního svazku. Výsledky nejsou zatím definitivní, ale jistě se jedná o jeden ze směrů, kterým se vydat.
TECHNOLOGIE CYBERKNIFE
CyberKnife® je robotický radiochirurgický systém. Jedná se o výhodný a neinvazivní alternativní způsob pro léčbu řady neoplazmat. Systém využívá počítačem ovládané robotické rameno, které umožňuje aplikovat různé fáze energie do tumoru z libovolného směru.
Tradičně se radiochirurgická technika využívala pouze pro léčbu tumorů lokalizovaných intrakraniálně. Technologie CyberKnife® však otevřela možnost využívat radiochirurgické techniky při léčbě nejrůznějších neoplazmat. Systém sestává ze 6 MV kompaktního lineárního akcelátoru (Linac), který je připevněn na robotickém systému (Gantry). Autonomního robota lze napolohovat do nejrůznějších pozic a úhlů pro aplikaci až z 1 248 různých směrů.
Operace s použitím technologie CyberKnife® zahrnuje čtyři fáze:
1. implantace pod navigací TRUS (GFM); 2. plánování; 3. samotná léčba a 4. post-planning (kontrolní fáze). První krok spočívá v implantaci 4–6 zlatých zrn sloužících jako markery zaměření (GFM) do prostatické žlázy pod ultrazvukovou navigací přibližně týden před výkonem.
Markery jsou zlatá zrna o průměru přibližně 0,8 mm a délce 5 mm. GFM se aplikují pomocí 19 G jehel o délce 15–20 cm.
GFM je nutné umístit na apex, do střední laterální zóny a na bázi prostaty. Jednotlivá zrna od sebe musí být vzdálena alespoň 2 cm a teoreticky by se neměla nalézat dál než 5–6 cm od tumoru. Výraz „teoreticky“ uvádíme z toho důvodu, že v prostatě nemáme vždy důkaz neoplastické léze. Úhel mezi jednotlivými skupinami GFM by neměl být méně než 15°.
Druhý krok spočívá v provedení CT vyšetření týden po implantaci GFM. Je velmi důležité užít stejný CT scan jako při výkonu, což umožní zobrazit prostatu stejným způsobem při léčbě jako během plánování.
S tím souvisí rovněž příprava okolních orgánů. Močový měchýř musí být vyprázdněn (spontánním močením nebo pomocí katétru), střeva jsou vyprázdněna pomocí klystýru před CT i před výkonem a do rekta je zaveden balonek pro imobilizaci, ačkoli ne všichni operatéři tento postup dodržují.
Při CT vyšetření je nezbytné zobrazit celou prostatickou žlázu a GFM.
V této fázi definuje radioterapeut plán léčby, což zahrnuje stanovení vhodné dávky pro ozařování prostaty (PTV) a rizikových orgánů (močový měchýř, rektum, uretra). Z tohoto postupu je zřejmé, že nejvyšší koncentrace radiace se nalézá v periferní zóně prostaty. Vzhledem k tomu, že CyberKnife® dosahuje vysoké přesnosti při zaměřování cíle, zasažené PTV okraje jsou významně omezeny ve všech směrech a CyberKnife® rovněž umožňuje zachovat přilehlé nervové struktury s přesností 0,7 mm, což dosud žádná jiná technologie neumožňuje.
Třetí krok procedury spočívá v hypofrakciované radioterapii. V současnosti se užívá několik terapeutických protokolů: Buď pět dávek po 7 Gy (celkem 35 Gy), nebo čtyři dávky po 9,5 Gy (celkem 38 Gy – v naší instituci užíváme tento protokol) nebo pět dávek po 7,25 Gy (celkem 36,25 Gy).
CT vyšetření je nezbytné provést maximálně jeden den po výkonu, přičemž je třeba zajistit, aby podmínky co nejlépe odpovídaly naplánovanému postupu.
Za normálních podmínek lze léčbu dokončit během jednoho týdne.
Poslední fází je kontrolní fáze (post--planning), která se obvykle provádí čtyři týdny po ukončení léčby. Tato fáze spočívá v hodnocení aplikované dávky pomocí CT vyšetření nebo „image fusion“ techniky pomocí CT a MRI.
Současné indikace CyberKnife® zahrnují karcinom ve stadiu cT1/T2a-b N0M0, Gleasonovo skóre < 7 a předoperační hladinu PSA < 10 ng/ml. Lze tedy říci, že tato metoda nahrazuje HDR brachyterapii, LDR brachyterapii, IMRT radioterapii nebo 3D konformní terapii a samozřejmé také radikální operaci. Ačkoli mezinárodní guidelines pro léčbu karcinomu prostaty se o technologii CyberKnife® nezmiňují, je třeba si uvědomit, že tento systém lze začlenit do jakékoli formy brachyterapie, a pakliže se počáteční výsledky potvrdí v dlouhodobém horizontu, lze indikaci pro tuto technologii považovat za oprávněnou.
Tato metoda je kontraindikována u pacientů s prostatou o velikosti > 80 ml (i když v tomto případě je možné zmenšit žlázu aplikací hormonů). Související kontraindikací, kterou je třeba ověřit, je závažná obstrukce (což zjistíme na základě vysokého skóre) a dřívější operační korekce obstrukce prostaty.
V současné době máme k dispozici pouze minimum publikací, které by hodnotily první výsledky tohoto robotického systému, i když od jeho uvedení na trh v roce 2003 podstoupilo operaci s pomocí technologie CyberKnife® přibližně 1 000 pacientů. V současné době je v USA k dispozici 94 systémů CyberKnife®, které jsou hojně využívány zejména při léčbě endokraniálních tumorů, ale rovněž při léčbě karcinomu pankreatu, plic a jater. Jako jedna z dalších možností využití systému CyberKnife® se jeví maxilofaciální operace. V Evropě je tato technologie dostupná bohužel pouze v deseti centrech. V Itálii a Francii jsou k dispozici tři systémy a po jednom systému v Německu, Řecku, Španělsku a Nizozemsku, což znamená, že v Evropě je pomocí této technologie léčeno podstatně méně pacientů.
Minimum údajů, jež máme k dispozici, tedy pochází z nerandomizovaných pilotních studií z individuálních center, které nesrovnávají tuto technologii s dalšími terapeutickými modalitami, a mají tedy z vědeckého hlediska pouze omezenou validitu.
Debra Freeman et al (Florida, USA) využili technologii CyberKnife® při léčbě 40 pacientů. 27 z nich podstoupilo radiochirurgický výkon a 13 radiochirurgický výkon v kombinaci s hormonální terapií (ADH). Všichni pacienti měli lokalizované onemocnění (pouze T1c) se střední hladinou PSA 5,78. Pacientům bylo aplikováno celkem pět dávek po 7 Gy (celkem 35 Gy). Po 12 měsících sledování autoři zaznamenali pokles hladiny PSA u všech pacientů s výjimkou jediného. U pacientů podstupujících výkon CyberKnife® bylo zaznamenáno PSA 1,2, u pacientů podstupujících výkon CyberKnife® plus ADH PSA 0,05.
Dalším průkopníkem této technologie při léčbě karcinomu prostaty je centrum CyberKnife Center v San Diegu. Urologové z tohoto centra v nedávné době publikovali studii zahrnující deset pacientů (všichni s lokalizovaným karcinomem prostaty). Terapeutický protokol sestával z aplikace pěti dávek po 7 Gy (celkem 35 Gy). Po čtyřech měsících sledování zaznamenali autoři pokles PSA o 86 % oproti počátečnímu stavu.
Nakonec uvádíme vlastní zkušenost s léčbou šesti pacientů (4 T2a a 2 T2b). Průměrný věk pacientů byl 74,8 let (pro tuto studii byli záměrně vybráni pacienti starší 70 let), průměrná hodnota IPSS byla 15,1 a průměrná hodnota IEEF-5 23 (tj. všichni pacienti byli před léčbou potentní). Terapeutický protokol sestával z aplikace čtyř dávek po 9,5 Gy (celkem 38 Gy). U všech pacientů došlo k poklesu hladiny PSA, šest měsíců po ukončení léčby činila průměrná hodnota PSA 0,8 ng/ml. IPSS skóre se po přibližně 2,5 měsících vrátilo zpět k normálu, zatímco skóre pro erektilní dysfunkci zůstalo téměř beze změny.
V současné době probíhají dvě klinické studie. Primární cíl první ze studií spočívá v hodnocení snášenlivosti léčby s ohle-dem na GU (močopohlavní) a GI (gastro-intestinální) systém. Sekundární parametry zahrnují hodnocení celkové doby přežití (OS), doby přežití bez biochemické recidivy (BDFS), kvality života (QoL) a nákladů na léčbu. Do studie byli zařazeni pacienti s nízkým a středním rizikem. Terapeutický protokol zahrnoval aplikaci pěti dávek po 7,25 Gy (celkem 36,25 Gy). Tato studie probíhá v několika centrech v Bostonu a Seattlu.
Druhá studie probíhá v San Diegu. Primární cíle studie zahrnují hodnocení BDFS po pěti letech, GU a GI toxicitu, QoL a konečně srovnání radiochirurgické léčby s HDR brachytherapií. Terapeutický protokol sestával z aplikace čtyř dávek po 9,5 Gy (celkem 38 Gy). Do studie byli zařazeni pouze pacienti s nízkým a středním rizikem.
Vedlejší účinky spojené s užíváním technologie CyberKnife® lze rozdělit do dvou skupin. První skupina tzv. přechodných komplikací zahrnuje dráždivé močové symptomy jako např. urgence a frekvence, slabé pálení při močení a rektální dráždivé symptomy jako např. urgence a frekvence peristaltiky nebo podráždění hemoroidů. Všechny výše uvedené komplikace však přetrvají po dobu maximálně 2–4 měsíců.
Druhá skupina vedlejších účinků pramení ze samotné léčby a obvykle souvisí zejména s incidencí erektilní dysfunkce. V současné době bohužel nemáme k dispozici žádné údaje týkající se tohoto fenoménu, vzhledem k nedostatku případů pro statistickou analýzu a absenci informací o dlouhodobé účinnosti této modality. Při užívání systému CyberKnife® nebyl popsán žádný případ inkontinence po léčbě. Možné využití tohoto robotického radiochirurgického systému se neomezuje pouze na monoterapii, ale bude možné ho v budoucnosti kombinovat s dalšími terapeutickými možnostmi po radioterapii.
Závěrem můžeme říci, že CyberKnife® je radiochirugický systém, který byl navržen pro léčbu tumorů v jakékoli části organizmu s přesností menší než 1 mm. Systém identifikuje a mapuje polohu tumoru i pacienta a automaticky upravuje aplikaci léčby v reálném čase. Jeho využití v rámci léčby karcinomu prostaty je teprve novinkou, dlouhodobý účinek a snášenlivost léčby pacienty je tedy nutné teprve posoudit.
ZÁVĚR
Závěrem lze říci, že ačkoli radikální prostatektomie představuje i nadále zlatý standard pro léčbu karcinomu prostaty ohraničeného na orgán, je zde jistě prostor i pro ostatní léčebné modality.
prof. Giuseppe Morgia, MD
Department
of Urology University
of Catania
Italy
Sources
1. Graefen M, Michl UHG, Heinzer H et al. Indication, technique and outcome of retropubic nerve-sparing radical prostatectomy. Eur Urol 2005; 4(3): 77–85.
2. Walsh PC, Marschke P, Ricker D. Patient-reported urinary continence and sexual function after anatomical radical prostatectomy. Urology 2000; 55(1): 58–61.
3. Menon M, Tewari A, Peabody JO. Vattikuti Institute prostatectomy, a tecnhnique of robotic radical prostatectomy for management of localized carcinoma of the prostate: experience of over 1100 cases. Urol Clin North Amer 2004; 31(4): 701–717.
4. Rassweiler J, Schulze M, Teber D. Laparoscopic radical prostatectomy: functional and oncological outcomes. Curr Opin Urol 2004; 14(2): 75–82.
5. Heidenreich A, Varga Z, Von Knobloch R. Extended pelvic lymphadenectomy in patients undergoing radical prostatectomy: high incidence of lymph node metastasis. J Urol 2002; 167(4): 1681–1686.
6. Bader P, Burkhard FC, Markwalder R et al. Is a limited lymph node dissection an adequate staging procedure for prostate cancer? Urol 2002; 168(2): 514–518.
7. Kim ED, Nath R, Kadmon et al. Bilateral nerve graft during radical retropubic prostatectomy: 1-year follow-up. J Urol 2001; 165 (6 Pt 1): 1950–1956.
8. Kim ED, Nath R, Slawin KM et al. Bilateral nerve grafting during radical retropubic prostatectomy: extend follow-up. Urology 2001; 58(6): 983–987.
9. Morgia G, Madonia M, Pischedda A et al. Nerve grafting radical prostatectomy: 24 months results in a single institution. European Urology 2005; 3 (Suppl 4): 288.
10. Grimm PD, Blasko JC, Sylvester JE et al. 10-year biochemical (PSA) control of prostate cancer with I-125 brachytherapy” Int J Rad Onc Biol Phys 2001; 51(1): 31–40.
11. Radge H, Korb LJ, Elgamal AA et al. Modern Prostate Brachytherapy. Cancer 2000; 89(1): 135–141.
12. Blasko JC, Radge H, Luse RW et al. Should brachytherapy be considered a teherapeutic option in localized prostate cancer? Urol Clin North Amer 1996; 23(4): 633–650.
13. De la Taille A, Hayek O, Benson MC et al. Salvage cryotherapy for recurrent prostate cancer after radiation therapy: the Columbia experience. Urology 2000; 55(1): 79–84.
14. De la Taille A, Benson MC, Bagiella E et al. Cryoablation for clinically localized prostate cancer using an argon-based system : complication and biochemical recurrence. BJU International 2000; 85(3): 281–286.
15. Han KA, Cohen JK, Miller RJ et al. Treatment of organ confined prostate cancer with third generation cryosurgery: preliminary experience. J Urology 2003; 170 : 1126–1130.
16. Cohen J. Cryosurgery of the prostate: techniques and indications. Reviews in Urology 2004; 6 (Suppl 4): S20-S26.
17. Han KA, Belldegrun AS. Third-generation cryosurgery for primary and recurrent prostate cancer. BJU International 2004; 93(1): 14–18.
18. Lam JS, Belldegrun AS. Salvage cryosurgery of the prostate after radiation failure. Reviews in Urology 2004; 6 (Suppl 4): S27–S36.
19. Han KA, Belldegrun AS. Third-generation cryosurgery for primary and recurrent prostate cancer. BJU International 2004; 93(1): 14–18.
20. Baust JG, Gage AA. The molecular basis of cryosurgery. BJU International 2005; 95(9): 1187–1191.
21. Robinson JW, Psych R, Donnelly BJ et al. Quality of life 2 years after salvage cryosurgery for the treatment of local recurrence of prostate cancer after radiotherapy. Urologic Oncology 2006; 24(6): 472–486.
22. Izawa JI, Busby JE, Morganstern N et al. Histological changes in prostate biopsies after salvage cryotherapy: effect of chronology and the method of biopsy. BJU International 2006; 98(3): 554–558.
23. Ismail M, Ahmed S, Kastner C et al. Salvage cryotherapy for recurrent prostate cancer after radiation failure: a prospective case series of the first 100 patients. BJU International 2007; 100(4): 760–764.
24. Lambert EH, Bolte K, Masson P et al. Focal cryosurgery: encouragiong health outcomes for unifocal prostate cancer. Urology 2007; 69(6): 1117–1120.
25. Eggener SE, Scardino PT, Carroll PR et al for the International Task Force on Prostate Cancer and the Focal Lesion Paradigm: Focal therapy for localized prostate cancer: a critical appraisal of rationale and modalities. J Urology 2007; 178 : 2260–2267.
26. Shelley M, Wilt TJ, Coles B et al. Cryotherapy for localised prostate cancer (Review). Cochrane Database Syst Rev 2007; (3). CD005010.
27. Jones JS, Rewcastle JC, Donnelly BJ et al. Whole gland primary prostate cryoablation: initial results from the cryo on-line data registry. J Urol 2008; 180(2): 554–558.
28. Theodorescu D. Cryotherapy for prostate cancer: what we know, what we need to know. J Urol 2008; 180(2): 437–438.
29. Pisters LL, Rewcastle JC, Donnelly BJ: Salvage prostate cryoablation: initial results from the cryo on-line registry. J Urol 2008; 180(2): 559–563.
30. Jones JS. Ten misconceptions regarding cryotherapy for prostate cancer. Eur Urol 2009; 55(1): 52–58.
31. Ritch CR, Katz AE. Prostate cryotherapy: current status. Curr Opin Urol 2009; 19(2): 177–181.
32. Polascik TJ, Mayes JM, Mouraiev V. Nerve sparing focal cryoablation of prostate cancer. Curr Opin Urol 2009; 19(2): 182–187.
33. Pisters LL, Leibovici D, Blute M et al. Locally recurrent prostate cancer after initial radiation therapy: a comparison of salvage radical prostatectomy versus cryotherapy. J Urol 2009; 182(2): 517–525.
34. Cytron S, Greene D, Witzsch U et al. Cryoablation of the prostate: technical recommendations. Prostate Cancer Prostatic Dis 2009; 12(4): 339–346.
35. King CT, Fowler JF. A simple analytic derivation suggests that prostate cancer α/b ratio is low. Int J Radiat Oncol Biol Phys 2001; 51(1): 213–214.
36. Alasti H, Petric MP, Catton CN et al. Imaging for evaluation of daily on-line set-up errors and off-line organ motion during conformal irradiation of carcinoma of the prostate. Int J Radiat Oncol Biol Phys 2001; 49(3): 869–884.
37. King CR, Lehman J, Adler JR et al. CyberKnife radiotherapy for localized prostate cancer: rationale and technical feasibility. Technol Cancer Res Treat 2003; 2(1): 25–30.
38. Fowler JF. The radiobiology of prostate cancer including new aspects of fractionated radiotherapy. Acta Oncol 2005; 44(3): 265–276.
39. Pawlicki T, Cotrutz C, King C. Prostate cancer therapy with stereotactic body radiation therapy. Front Radiat Ther Oncol 2007; 40 : 395–406.
40. Hannoun-Levi JM, Benezery K, Bondiau PY et al. Robotic radiotherapy for prostate cancer with CyberKnife. Cancer Radiother 2007 : 11(8): 476–482.
41. Fowler JF. The radiobiology of prostate cancer including new aspects of fractionated radiotherapy. Acta Oncol 2005; 44(3): 265–276.
42. Pawlicki T, Cotrutz C, King C. Prostate cancer therapy with stereotactic body radiation therapy. Front Radiat Ther Oncol 2007; 40 : 395–406.
43. Fuller DB, Naitoh J, Lee C et al. Virtual HDR(SM) CyberKnife treatment for localized prostatic carcinoma: dosimetry comparison with HDR brachytherapy and preliminary clinical observations. Int J Radiat Oncol Biol Phys 2008; 70(5): 1588–1597.
44. Xie Y, Djajaputra D, King CR et al. Intrafractional motion of the prostate during hypofractionated radiotherapy. Int J Radiat Oncol Biol Phys 2008; 72(1): 236–246.
45. Morgia G, De Renzis C. Cyerknife in the treatment of prostate cancer: a revolutionary system. Eur Urol 2009; 56(1): 40–42.
46. Friedland JL, Freeman DE, Masterson-McGary ME et al. Stereotactic body radiotherapy: an emerging treatment approach for localized prostate cancer. Technol Cancer Res Treat 2009; 8(5): 387–392.
47. Townsend NC, Huth BJ, Ding W et al. Acute toxicity after Cybernife-Delivered hypofractionated radiotherapy for treatment of prostate cancer. Am J Clin Oncol 2010.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2011 Issue 2
-
All articles in this issue
- THE STRATEGIES FOR PRIMARY PREVENTION OF PROSTATE CANCER – EVERYDAY PRACTICE, UNREALISTIC FICTION OR NEAR FUTURE?
- SCREENING OF PROSTATE CANCER
- A SUMMARY OF NEW TECHNOLOGIES FOR PROSTATE CANCER (ROBOT, LAP, BRACHY, CRYO, CYBERKNIFE)
- WILL BE REACHED THE EXPECTED NUMBERS OF KIDNEY AND BLADDER CANCERS?
- UROLOGIC MALPRACTICE IN THE UNITED STATES OF AMERICA: TRENDS AND ANALYSIS
- EAU GUIDELINES ON PROSTATE CANCER - PART 1: SCREENING, DIAGNOSIS, AND TREATMENT OF CLINICALLY LOCALISED DISEASE
- EAU GUIDELINES ON PROSTATE CANCERPART 2: TREATMENT OF ADVANCED, RELAPSING, AND CASTRATION-RESISTANT PROSTATE CANCER
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- A SUMMARY OF NEW TECHNOLOGIES FOR PROSTATE CANCER (ROBOT, LAP, BRACHY, CRYO, CYBERKNIFE)
- EAU GUIDELINES ON PROSTATE CANCER - PART 1: SCREENING, DIAGNOSIS, AND TREATMENT OF CLINICALLY LOCALISED DISEASE
- SCREENING OF PROSTATE CANCER
- EAU GUIDELINES ON PROSTATE CANCERPART 2: TREATMENT OF ADVANCED, RELAPSING, AND CASTRATION-RESISTANT PROSTATE CANCER
