Farmakoterapie LUTS/BPH v každodenní klinické praxi. Jak vybrat optimální alternativu?
Pharmacotherapy in LUTS/BPH in everyday clinical practise. How to choose the optimal alternative?
Benign hyperplasia of the prostate (BPH) is the most common non-malignant male disease that can be managed by non invasive procedures. The incidence is not evident due to the existence of different forms of this disease (histological, asymptomatic – compensated obstruction, symptomatic for example subvesical obstruction). It is generally acceptable, that nearly 40 % of men in their forties are affected by some lower urinary tract symptoms. Because there are additional diseases of both sexes that can cause identical symptoms the term lower urinary tract symptoms (LUTS) was introduced. In case of prostate obstruction accurate terminology is LUTS/BPH (Coffey). Diagnostic workup is quite undemanding, however differential diagnosis is unbelievably broad. It is true that basic examination includes digital rectal examination, appropriate diagnosis (including a specific questionnaire IPSS) and urine analysis to rule out infection. Prostate specific antigen (PSA) level is important in patients perspective for a therapy of possibly diagnosed prostate cancer. The examination of urinary flow by means of uroflowmetry (UFM) having in mind the limits of urine volume and data as such.
Key words:
benign prostatic hyperplasia, lower urinary tract symptoms, pharmacotherapy
Authors:
M. Ghazal
Published in:
Urol List 2013; 11(2): 12-24
Overview
Benigní hyperplazie prostaty (BPH) patří mezi časté nemoci stárnoucích mužů. Její léčba prodělala v posledních letech ohromný pokrok. Incidence není zcela zřejmá, neboť existují četné formy onemocnění (histologická, asymptomatická – kompenzovaná obstrukce, symptomatická, např. subvezikální obstrukce). Obecně lze akceptovat, že ve 40 letech trpí některým ze symptomů dolních močových cest téměř 40 % mužů. Protože identickou symptomatologii bez ohledu na pohlaví může vyvolat více onemocnění, je užíván název LUTS (Lower Urinary Tract Symptoms). Ten zahrnuje všechny příznaky při patologii dolních močových cest. Přesné označení onemocnění je pak v případě prostatické obstrukce LUTS/BPH (Coffey). Diagnostický algoritmus je standardní. Stále platí, že základním vyšetřením je vyšetření per rectum, řádná anamnéza (upřesněná vyplněním specifického dotazníku IPSS), vyšetření moči k vyloučení přítomnosti infekce a znalost hladiny prostatického specifického antigenu (PSA) u nemocných s perspektivou terapie, případně nalezeného adenokarcinomu prostaty (CaP). Lze kvantifikovat i průtok vymočené moči pomocí uroflowmetru (UFM) s akcentací výhrad stran validity mikčního objemu a dat.
Klíčová slova:
benigní hyperplazie prostaty, symptomy dolních cest močových, farmakoterapie
Úvod
Benigní hyperplazie prostaty (BPH) je nezhoubné zvětšení části prostaty, které může vyvolávat mikční obtíže. Dosud není přesně objasněno, proč se část prostaty (přechodná zóna a část periuretrálních žlázek) začne zvětšovat. Pro zvětšení prostaty je nezbytný testosteron a jeho aktivnější metabolit dihydrotestosteron (DHT) spolu s přítomností funkčních receptorů v prostatické tkáni. Nezbytnou podmínkou je androgenní stimulace, která ale není primární příčinou. Důvody, proč má obtíže s BPH pouze část mužů, nejsou dosud přesně vysvětlené. Na tomto poli probíhá rozsáhlý výzkum a zdá se, že klíčovou roli v tomto zvětšování části prostaty hrají růstové faktory, parakrinní a autokrinní modulace. Ze statistik vyplývá, že 60 % mužů ve věku 60 let má jistý stupeň příznaků z dolních močových cest (LUTS, lower urinary tract symptoms) [1]. Závažný stupeň LUTS má 13 % mužů ve věku 40–49 let a více než 28 % nad 70 let [2]. Dalším důležitým faktem v problematice BPH je, že není přímá souvislost mezi BPH a mikčními obtížemi pacienta. Proto také závažnost této diagnózy nelze určovat z velikosti prostaty, ale přítomností a intenzitou mikčních příznaků (LUTS). Ačkoli zvětšená prostata může přispívat ke vzniku LUTS u určitého procenta mužů ve věku nad 40 let, stejně důležité jsou i další faktory. Poslední poznatky naznačují, že LUTS mohou souviset s prostatou (BPH-LUTS), s močovým měchýřem [hyperaktivitou detruzoru – syndromem hyperaktivního močového měchýře (OAB), hypoaktivitou detruzoru nebo s ledvinami (noční polyurie)] [3]. Vzhledem ke značné prevalenci BPH u starších mužů se zdá, že k mikroskopickým změnám prostaty u některých mužů dochází souběžně s dalšími poruchami funkce močového měchýře nebo ledvin. U všech jedinců, kteří si stěžují na LUTS, je obvykle přítomno více těchto faktorů. Tento širší, komplexnější přístup k patogenezi LUTS vedl ke změně předchozího názvu EAU guidelines pro léčbu LUTS/BPH na aktuálnější a přesnější název guidelines pro léčbu symptomů dolních močových cest u mužů (LUTS) včetně obstrukce způsobené benigní prostatickou hyperplazií s cílem zohlednit změnu pohledu. Jelikož pacienti vyhledávají pomoc z důvodu LUTS a nikoli kvůli primárním problémům s prostatou, jako jsou například BPH nebo BPE (benign prostate enlargment), tato aktualizovaná guidelines byla vypracována z pohledu mužů, kteří si stěžují na řadu jímacích mikčních a/nebo postmikčních symptomů. Pro možnost jednoduchého zhodnocení obtíží se nejvíce osvědčil dotazník prostatických obtíží – IPSS (international prostate symptom score). Benigní hyperplazie prostaty může ovlivňovat shromažďovací i vyprazdňovací funkci dolních močových cest. Porucha shromažďovací funkce se projevuje iritačními symptomy: časté močení, strangurie, urgence, urgentní inkontinence a podobně, porucha vyprazdňovací funkce má obstrukční symptomatologii: retardace mikce, slabý proud, zpomalení proudu moči, pocit neúplného vyprázdnění a podobně. Diagnostika BPH je v současnosti jasná a přehledně popsaná v urologických guidelines). Základem je pečlivá anamnéza a fyzikální vyšetření, a to vždy s vyšetřením per rectum. Dále laboratorní vyšetření moči a krve včetně stanovení hladiny PSA (prostatický specifický antigen). Důležitým parametrem v hodnocení úspěšnosti léčby je uroflowmetrie (UFM). Před zahájením léčby je ještě nutná sonografie ledvin a močového měchýře s prostatou a vyšetření postmikčního rezidua. Další, a to invazivní vyšetřovací metody, jsou indikovány při komplikacích, neúčinné léčbě, patologických nálezech v laboratorních hodnotách a podobně. Jsou to zejména transrektální sonografie, vylučovací urografie, urodynamická P/Q studie, endoskopie dolních močových cest (diagnostická uretrocystoskopie) a další. Léčba BPH může být medikamentózní (konzervativní) či operační. Mezi těmito dvěma alternativami jsou miniinvazivní terapie (MIT), jako například mikrovlnná termoterapie (TUMT), fokusovaný ultrazvuk o vysoké intenzitě (HIFU), transurethral nebo laserové operace prostaty holmium – laserová resekce (HoLRP) nebo enukleace prostaty (HoLEP), či fotoselektivní vaporizace prostaty (PVP). Volba léčby závisí na mnoha faktorech, zejména na obtížích a stavu onemocnění, zkušenostech urologa, přání nemocného apod. V roce 1990 v USA bylo provedeno 1,2 miliónu kontrol pro diagnózu N40 a operováno téměř 400 000 pacientů transuretrální prostatektomií. Pozdější léta jsou ve znamení pozvolného odklonu od chirurgické léčby směrem k medikamentózní. Tento posun nastal nejprve ve prospěch preskripce blokátoru 5alfa-reduktázy (finasterid), později se významně uplatnila léčba alfa blokátory. V současné době se zdá být situace spíše stabilizovaná a medikamentózní léčba si získala pevné místo, které má v různých zemích různé spektrum (graf 1) [32]. Cílem tohoto článku je přehled současné farmakoterapie BPH.

Indikace k farmakoterapii
Indikací k farmakoterapii je léčba obtíží spojení se zvětšením prostaty, LUTS a také obavy pacienta z operační léčby. Pacienty odrazuje od operace riziko bolesti, pobyt v nemocnici a možné komplikace, jako například inkontinence, krvácení, retrográdní ejakulace a podobně. Operační léčba je zatížená vyšším rizikem morbidity i mortality na rozdíl od léčby konzervativní. Optimální preparát samozřejmě neexistuje, ale současná farmakoterapie prodělala veliký pokrok. To je také důvodem stálého zvyšovaní počtu pacientů léčených medikamentózně. Na druhé straně klesá počet operačních výkonů (TURP, TVPE). Je jasné, že s prodlužující se průměrnou délkou života a pokroky ve farmakoterapii bude nemocných s BPH stále přibývat. To s sebou přináší další důležitý fakt, a tím je ekonomická náročnost léčby. Je proto důležité vědět, jaký je cílový efekt jednotlivých preparátů, aby byla farmakoterapie co nejúčinnější. Pro určení efektivity léčby a pro srovnání účinnosti jednotlivých preparátů jsou nezbytné klinické studie, zaslepené a placebem kontrolované. Ty mohou dále napovědět, jaký efekt můžeme od jednotlivých léků očekávat a jaká jsou rizika nebo nejčastější nežádoucí účinky.
Medikamentózní léčba
Fytoterapie
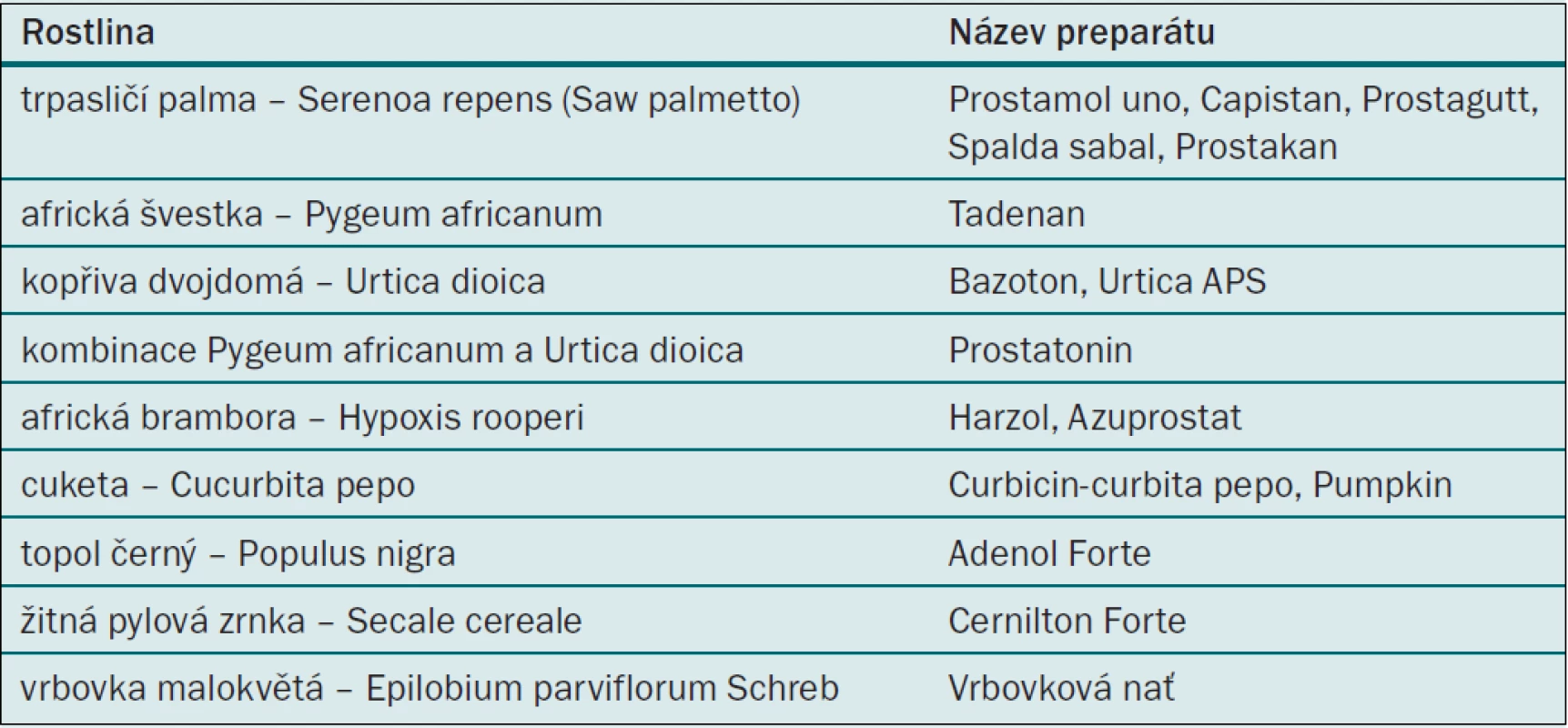
Používání bylinných preparátů je známé již z Egypta několik století před Kristem. Nejznámějším a nejpoužívanějším preparátem je lipidosterolový extrakt z plodů trpasličí palmy Serenoa repens (Sabal Serrulata, Saw palmetto), která roste na jihovýchodě Severní Ameriky. Vyráběné preparáty jsou Prostamol uno, Capistan, Prostagutt, Spalda Sabal. Dalším fytopreparátem je Tadenan, což je extrakt z kůry africké švestky (Pygeum africanum), která roste v Jižní a Střední Americe. K dalším fytopreparátům patří kombinace Pygeum africanum a extraktu z kořínků kopřivy dvojdomé (Urtica dioica) – Prostatonin, extrakt z kopřivy Urtica dioica – Bazoton. Méně známé jsou další extrakty: z africké brambory – Hypoxis rooperi rostoucí v Africe – Harzol, Azuprostat, semínka dýňovité rostliny cukety (Cucurbita pepo) – Curbicin, extrakt z výhonků topolu (Populus nigra) – Adenol Forte, extrakt z žitných pylových zrnek (Secale cereale) – CernitonForte a další (tab. 1). Nežádoucí účinky jsou minimální, nejčastěji se popisují mírné gastrointestinální obtíže. Další obtíže typu sníženého libida, bolesti hlavy, břišní bolesti a chřipce podobným symptomům jsou vzácné. V Čechách je jistě nejznámější vrbovka malokvětá, které bylá ještě před 15–20 lety často používaná. I dnes, pokud chceme neinvazivní léčbu s minimálním rizikem nežádoucích účinků, je vrbovka ideální fytoterapeutikum. Největší slabinou fytopreparátů je jejich ne zcela prokázaný léčebný účinek. Předpokládá se, že působí protizánětlivě, blokují 5alfa-reduktázu a ovlivňují růstové faktory [4]. Neexistence randomizovaných placebem kontrolovaných studií byla příčinou, proč nejsou v USA zařazeny mezi medikamenty, ale pouze mezi potravinové doplňky. V ČR jsou některé preparáty hrazeny pojišťovnami, ale jsou vhodné spíše u mírných obtíží nebo tam, kde předpokládáme kromě BPH v prostatě i zánět. Pokud uznáváme medicínu založenou na důkazech, potom lze doporučovat fytoterapii jen obtížně [4].
Pygeum africanum
Vyskytuje se na omezeném území Madagaskaru a ve vyšších nadmořských výškách střední a jižní Afriky. Extrakt obsahuje čtyři zásadní skupiny účinných látek:
A. fytosteroly – především beta sitosterol, jenž zasahuje do metabolizmu kyseliny arachidonové a inhibice prozánětlivých prostaglandinů,
B. triterpeny – enzymatickou inhibicí působí proti otokům a zánětům,
C. estery alkoholů s dlouhými řetězci (např. n-docosanol) – inhibují prolaktin a cholesterol ve tkáních prostaty se známými důsledky na konverzi testosteronu a pevnost jeho receptorových vazeb,
D. mastné kyseliny a steroly – ovlivňují testosteron a jeho vazby na androgenní receptor.
Ve většině studií byl použit extrakt z Pygeum africanum, Tadenan™. Metaanalýza zahrnovala 1562 mužů, ale jednotlivé studie byly malé a trvaly pouze 30–122 dnů. Většina studií byla provedena v 70. a 80. letech 20. století a nebyly použity validované dotazníky, jako například IPSS. Muži, kterým byl podáván extrakt z Pygeum africanum, uváděli zlepšení symptomů v porovnání s placebo skupinou s dvakrát vyšší četností (RR 2,07). Vážený průměrný rozdíl Qmax činil +2,5 ml/s a u postmikčního reziduálního objemu –13,2 ml ve prospěch extraktu z Pygeum africanum. Od zveřejnění Cochranovy zprávy v roce 2002 nebyly žádné další studie publikovány.
Serenoa repens
Je to drobná palma z jihovýchodu USA, k výrobě extraktu se obvykle užívají sušené plody. Jde o nejčastěji užívaný extrakt, jehož efekt není receptorově ani substrátově specifický a je navozen synergizmem všech přítomných látek. Patří mezi aktivní látky jako steroidní saponiny, fytosteroly, mastné kyseliny (kapriová, kaprylová, palmitová, stearová a další), prchavé oleje a mnoho jiných. Jedním ze zásadních a ověřených efektů je antiandrogenní efekt způsobený potlačením syntézy DHTs a jeho fixací k cytosolickému receptoru. Extrakt inhibuje oba dva izoenzymy 5alfa-reduktázy. In vitro bylo prokázáno, že extrakt inhibuje alfa-adrenergní receptory subtypu 1. Extrakt ze Serenoa repens (především Permixon™ nebo Prostaserene™) byl porovnáván jako monopreparát nebo jako kombinovaný preparát s placebem, jinými rostlinnými extrakty (Pygeum africanum, Urtica dioica), inhibitorem 5alfa-reduktázy finasteridem nebo alfa-1 blokátorem tamsulosinem. Průměrná doba sledování u těchto studií činila 4–60 týdnů. Ve studiích s finasteridem nebo tamsulosinem mohou být interpretovány jako terapeutická ekvivalence [6]. V případě nykturie byl extrakt ze Serenoa repens významně lepší než placebo (vážený průměrný rozdíl –0,78).
Urtica dioica
Dvě studie zkoumaly účinnost monopreparátů extrahovaných z kopřivy dvojdomé v porovnání s placebem [8,9]. Jedna studie zkoumala 246 mužů s LUTS/BPH po dobu 52 týdnů [8]; v této fytoterapeutické skupině se významně snížilo pouze skóre IPSS (Bazoton™ uno), zatímco Qmax a PVR se v jednotlivých skupinách na konci studie statisticky nelišily. Druhá studie zkoumala 620 pacientů s LUTS/BPH po dobu 26 týdnů [9]; skóre IPSS, Qmax a PVR se v porovnání s placebem významně zlepšily.
Hypoxis rooperi
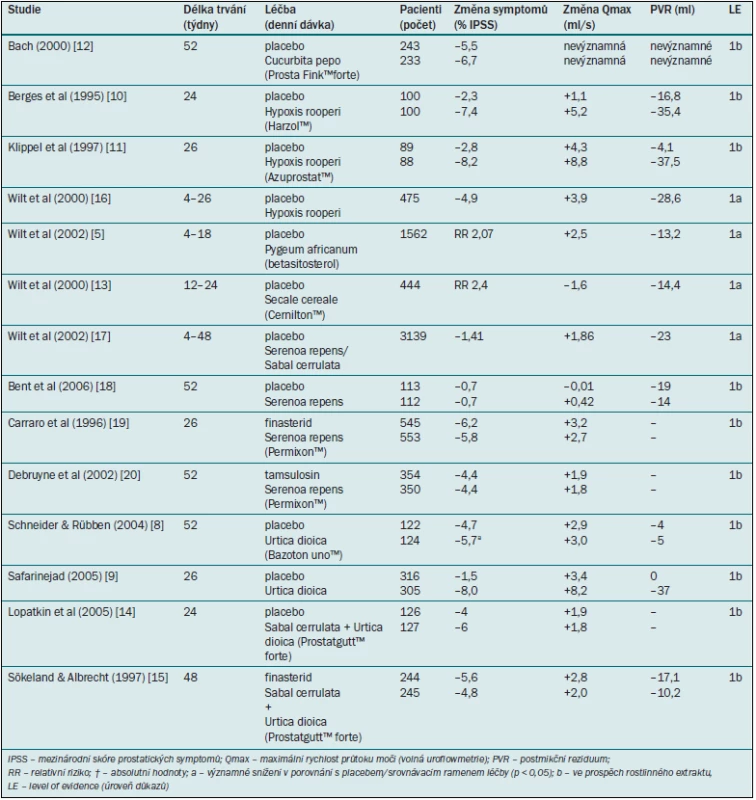
Tyto extrakty obsahují směs fytosterolů vázaných na glykosidy, z nichž nejdůležitější sloučeninou je betasitosterol (Harzol™, Azuprostat™). Byly publikovány čtyři randomizované, placebem kontrolované studie v délce trvání 4–26 týdnů, které jsou shrnuty v Cochranově zprávě [5]. Dvě studie hodnotily symptomy [10,11] a všechny čtyři studie zkoumaly Qmax a PVR. Pomocí metaanalýzy byly vypočteny vážené průměrné rozdíly –4,9 bodu pro IPSS, +3,9 ml/s pro Qmax a –28,6 ml pro PVR ve prospěch betasitosterolu. Velikost prostaty zůstala ve všech studiích nezměněná. Od zveřejnění Cochranovy zprávy v roce 2000 nebyly žádné další studie provedeny.
Cucurbita pepo
Pouze jedna studie hodnotila účinnost extraktů ze semen dýně (Prosta Fink™ forte) u pacientů s LUTS/BPH [12]. Do placebo skupiny a do skupiny, které byl podáván přípravek Prostat Fink™ forte, bylo randomizováno celkem 476 pacientů. Po 12 měsících sledování se IPSS a frekvence močení přes den významně snížily ve skupině, které byl podáván extrakt semen dýně. UFM (Qmax), PVR, objem prostaty, koncentrace PSA, nykturie nebo skóre kvality života (QoL) se však v uvedených dvou skupinách statisticky nelišily.
Secale cereale
Cochranova zpráva se zabývala klinickými výsledky hlavního produktu extrahovaného ze Secale cereale (Cernilton™) a zahrnovala 444 mužů, kteří byli zařazeni do dvou placebem kontrolovaných studií a dvou srovnávacích studií (Tadenan™, Paraprost™) v délce trvání 12–24 týdnů [13]. Muži, kterým byl podáván přípravek Cernilton™, uváděli v porovnání s placebo skupinou dvakrát vyšší pravděpodobnost benefitu terapie (RR 2,4). Neexistovaly však žádné významné rozdíly mezi přípravkem Cernilton™ a placebem, pokud jde o Qmax, PVR nebo objem prostaty. Od zveřejnění Cochranovy zprávy v roce 2000 nebyla publikována žádná další placebem kontrolovaná studie s monopreparátem extrahovaným ze Secale cereale.
Kombinované přípravky
Byly provedeny studie zejména s kombinací extraktů ze Sabal serrulata a Urtica dioica (PRO 160/120, Prostatgutt™ forte). Placebem kontrolovaná studie v délce 24 týdnů prokázala významné zlepšení skóre IPSS ve fytoterapeutické větvi (rozdíl skóre IPSS -2 body) [14]; snížení Qmax bylo u obou skupin obdobné. Otevřená nadstavbová studie v délce trvání 24 týdnů zahrnující tytéž pacienty, v níž byl všem pacientům podáván přípravek PRO 160/120, ukázala u obou skupin obdobná zlepšení IPSS v týdnu 48 (skóre IPSS –7 bodů). Druhá studie, v níž byli pacienti randomizováni k aplikaci PRO 160/120 a finasteridu, ukázala v obou skupinách obdobné výsledky pro IPSS i Qmax [15].
Vedlejší účinky
Vedlejší účinky fytoterapie jsou obvykle mírné a srovnatelné s placebem. S aplikací studovaných preparátů nebyly spojeny závažné nežádoucí účinky. Nejčastěji uváděnými vedlejšími účinky byly gastrointestinální potíže. V případě přípravků extrahovaných z Hypoxis rooperi se u 0,5 % pacientů objevila erektilní dysfunkce. Podíl na vyřazení subjektů ze studie byl téměř stejný u placebo skupiny i u skupiny, která byla podrobena fytoterapii.
Závěr
Použití fytoterapie zůstává problematické z důvodu různých koncentrací účinných látek v produktech různých značek obsahujících stejná fytoterapeutická agens. Metaanalýzy extraktů téže rostliny se zdají být nepodložené a výsledky těchto analýz musejí být interpretovány s opatrností. Fytopreparáty jsou lékem první volby u nemocných s lehkým a středním stupněm obtíží podle prostatického skóre a u nemocných, kde je ostatní léčba kontraindikována [7].
Analog vazopresinu – desmopresin
Mechanizmus účinku
Antidiuretický hormon arginin vazopresin (AVP) hraje klíčovou úlohu v homeostáze tělesné vody a při kontrole produkce moči tím, že se váže na receptor V2 ve sběrných kanálcích ledvin. Hormon AVP zvyšuje zpětné vstřebávání vody a rovněž osmolalitu moči a snižuje vylučování vody i celkový objem moči. Hormon AVP by mohl být terapeuticky využíván k úpravě množství vylučované moči, avšak díky vazbě na receptor V1 má hormon AVP také vazokonstriktivní/hypertenzní účinky a dále pak velmi krátký poločas rozpadu v séru, a proto je nevhodný pro léčbu nykturie/noční polyurie.
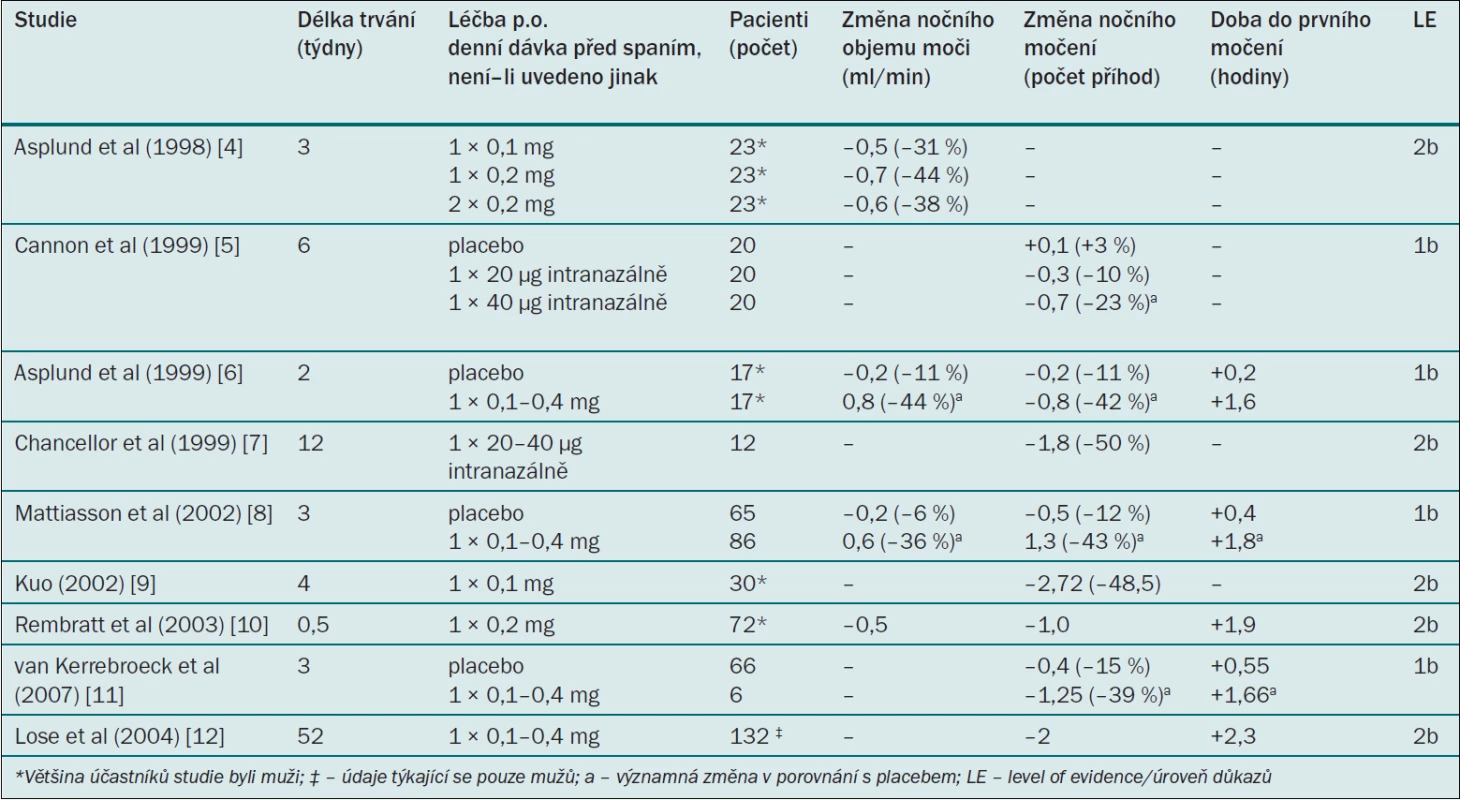
Desmopresin acetát (desmopresin) je syntetický analog hormonu AVP s vysokou afinitou k receptoru V2 a antidiuretickými vlastnostmi. Je to jediné registrované léčivo pro antidiuretickou léčbu (tab. 3). Na rozdíl od AVP nevykazuje desmopresin žádnou významnou afinitu k receptoru V1 a nemá hypertenzní účinky. Desmopresin lze podávat ve formě intravenózní infuze, nosního spreje, tablet nebo perorálního lyofilizátu (MELT). Nazálně nebo perorálně podávaný desmopresin se rychle vstřebává a 55 % desmopresinu ledviny později vyloučí v nezměněné podobě [21]. Desmopresin se používá více než 30 let v léčbě diabetes insipidus nebo primární noční enurézy a nedávno byl schválen ve většině evropských zemí pro léčbu nykturie/polyurie u dospělých mužů a žen. Pokud se desmopresin podá před spaním, vylučování moči během noci se omezí, čímž se odloží nucení na močení a sníží počet příhod nočního močení [22,23]. Klinický efekt – pokud jde o snížení objemu moči a zvýšení osmolality moči – trvá po dobu přibližně 8–12 hodin [22].

Účinnost
Ve většině klinických studií byl desmopresin podáván perorálně. Studie, jejímž cílem bylo stanovit dávkování, ukázala, že perorální desmopresin podávaný v dávce 0,2 mg snižuje noční objem moči/noční diurézu výrazněji než desmopresin podávaný v dávce 0,1 mg; tato studie však také ukázala, že jednorázové podání dávky 0,4 mg před spaním nemá v porovnání s dávkou 0,2 mg na noční diurézu žádné další účinky [24]. V klíčových klinických studiích bylo léčivo titrováno v množství 0,1–0,4 mg podle individuální klinické reakce. Desmopresin významně snížil noční diurézu přibližně o 0,6–0,8 ml/min (–40 %), snížil počet příhod nočního močení přibližně o 0,8–1,3 (–40 %) (–2 v dlouhodobé otevřené studii) a prodloužil dobu do prvního nočního močení o přibližně 1,6 hodiny (2,3 v dlouhodobé otevřené studii) (tab. 4). Desmopresin dále významně snížil noční objem moči a rovněž procento objemu moči vyloučené v noci [25,26]. Klinický efekt desmopresinu byl výraznější u pacientů se závažnější noční polyurií a s výchozí kapacitou močového měchýře v normálním rozmezí, 24hodinová diuréza se během léčby desmopresinem nezměnila. Klinický efekt byl po dobu sledování v délce 10–12 měsíců stabilní a po přerušení studie se hodnoty vrátily na výchozí úroveň [27]. Významně vyšší podíl pacientů se po podání desmopresinu cítil ráno svěží (odds ratio 2,71) [28].
Vedlejší účinky
Absolutní počet příhod výskytu nežádoucích účinků spojených s léčbou desmopresinem byl v porovnání s placebem vyšší, ale svou povahou byly tyto nežádoucí účinky obvykle mírné. Nejčastějšími nežádoucími účinky v krátkodobých studiích (do 3 týdnů) a v dlouhodobých studiích (12 měsíců) byly nevolnost, bolest hlavy, bolest břicha, závratě, sucho v ústech a hyponatremie. Tyto účinky byly srovnatelné s prokázaným bezpečnostním profilem desmopresinu při léčbě polyurie způsobené jinými stavy. V dlouhodobé studii byly uváděny periferní edém (2 %) a hypertenze (5 %) [27]. Hyponatremie byla pozorována zejména u pacientů ve věku 65 let nebo starších a podle všeho se méně často objevovala u mužů oproti ženám téhož věku [23]. Hyponatremie všech stupňů, která není nezbytně spojena se symptomy, se objevuje přibližně u 5 % [29] až 7,6 % pacientů [30] brzy po zahájení léčby. Riziko vzniku hyponatremie se významně zvyšuje s věkem (odds ratio 1,16 na každý rok věku), nižší výchozí koncentrací sodíku v séru (odds ratio 0,76) a vyšším základním 24hodinovým objemem moči na tělesnou hmotnost (odds ratio 1,09) [29]. Pravděpodobnost vzniku hyponatremie u pacientů mladších 65 let je méně než 1 %, zatímco riziko u starších pacientů se zvyšuje na 8 % při normální koncentraci sodíku a až na 75 % u pacientů s nízkou výchozí koncentrací sodíku [29]. Léčba mužů ve věku 65 let nebo starších by proto neměla být zahájena bez sledování koncentrace sodíku v séru. V okamžiku zahájení léčby nebo změny dávkování by u starších mužů s normálními hodnotami sodíku v séru mělo být provedeno měření Na+, a to třetí a sedmý den od zahájení léčby a rovněž po uplynutí jednoho měsíce. Pokud zůstane koncentrace sodíku v séru normální a není plánována žádná změna dávkování, hodnoty Na+ by poté měly být sledovány každých 3–6 měsíců [31].
Závěr
Desmopresin by měl být aplikován jednou denně před spaním. Jelikož se optimální dávka u různých pacientů liší, léčba desmopresinem by měla být zahájena aplikací nízké dávky (0,1 mg/den), kterou lze postupně každý týden zvyšovat až do dosažení maximální účinnosti. Maximální doporučená dávka je 0,4 mg/den. Pacienti by neměli pít alespoň hodinu před podáním desmopresinu a osm hodin poté. Mužům ve věku 65 let nebo starším by desmopresin neměl být aplikován, pokud je koncentrace sodíku v séru nižší než normální hodnota. U všech ostatních mužů ve věku 65 let nebo starších by koncentrace sodíku v séru měla být změřena třetí a sedmý den a rovněž po uplynutí jednoho měsíce a pokud zůstane koncentrace sodíku v séru normální, následně každých 3–6 měsíců. Desmopresin lze podávat při léčbě nykturie, která je sekundárním projevem noční polyurie.
Antagonisté alfa-1 adrenergních receptorů (alfa-1 blokátory)
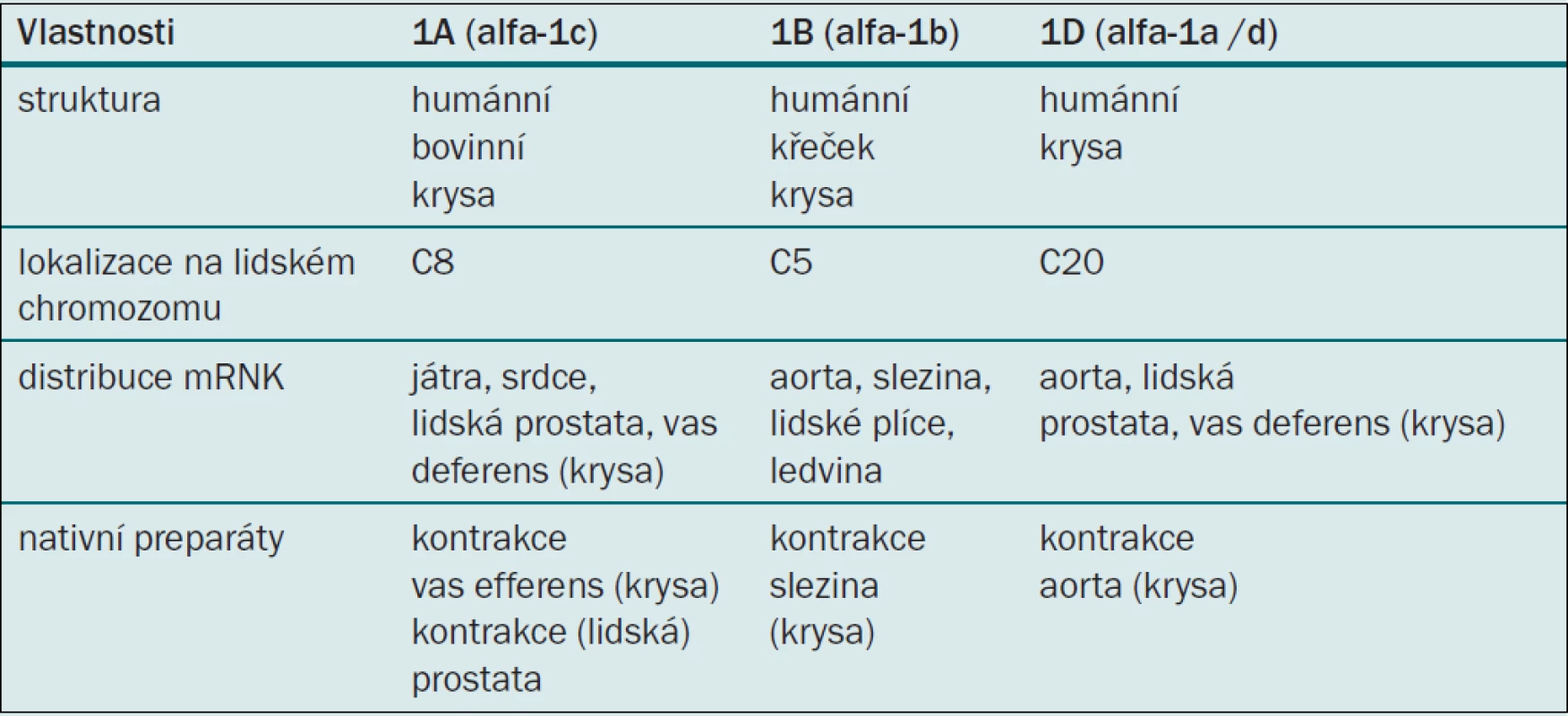
Alfa blokátory jsou založené na pionýrských objevech M. Caina, který v polovině 70. let (1974) publikoval své studie prokazující snížení uretrální rezistence blokádou prostatických alfa-1 receptorů neselektivním fenoxybenzaminem [34, 35]. Lepor a Shapiro pak prokázali selektivními alfa-1 blokátory primární vliv alfa-1 receptorů na tonus hladké svaloviny prostaty [32, 33]. V posledních letech řada prací dokládá heterogenicitu alfa-1 receptorů. Způsob studia a průkazu adrenergních receptorů na nativních preparátech či na klonovaných molekulách vedl k objevu nejméně třech podtypů. Podtypy objevené na nativních preparátech metodou vazby radioligand byly označovány za číslicí velkým písmenem, podtypy potvrzené klonováním nesly označení malými písmeny. Receptor alfa-1A vykazoval velkou afinitu ke všem používaným alfa-1A blokátorům, zatímco receptor alfa-1B tuto afinitu postrádal. Další vyklonované molekuly alfa-1a a alfa-1d se odlišovaly vlastnostmi od molekul alfa-1A, a byly proto označeny alfa-1D (alfa-1a/d). Bylo zjištěno, že některé molekuly alfa-1A nevykazují vysokou afinitu k prazosinu, a bylo pro ně zvoleno označení alfa-1L. Později však byla vyslovena domněnka, že může jít pouze o jiný farmakologický stav identické molekuly [36]. Znaky odlišující podtypy, i ve smyslu použité techniky (velká a malá písmena), měly za následek určitou nejednotnost v klasifikaci. Současnou nomenklaturu, která dovoluje rozlišení mezi klonovanými a nativními molekulami podtypů, předkládáme v tabulce 5 [37]. Alfa-1 adrenoreceptory (obr. 1) lze prokázat v hladkých svalových vláknech tkání mnoha orgánových systémů, především v kardiovaskulárním. Látky s alfa-1 antagonistickým efektem, vedle snížení intrauretrálního prostatického tlaku, navozují z urologického hlediska některé nežádoucí účinky, ponejvíce ve snižování ortostatického krevního tlaku. Kompozice molekuly selektivního alfa blokátoru s afinitou k podtypu alfa-1A (alfa-1c) může naopak vykazovat výrazný efekt na svalovinu prostaty s potlačením kardiovaskulárního nežádoucího efektu. Většina studií byla prováděna v experimentu nebo na humánních preparátech in vivo a na nativních i klonovaných molekulách. Neexistují tkáně selektivně osazené jedním typem či dokonce subtypem adrenoceptoru, což v klinickém použití hraje významnou roli. Klinické studie i empirické zkušenosti na rozsáhlých skupinách populace léčené konzervativně s diagnózou BPH mohou tedy poskytovat odlišné výsledky ve srovnání s experimentem.
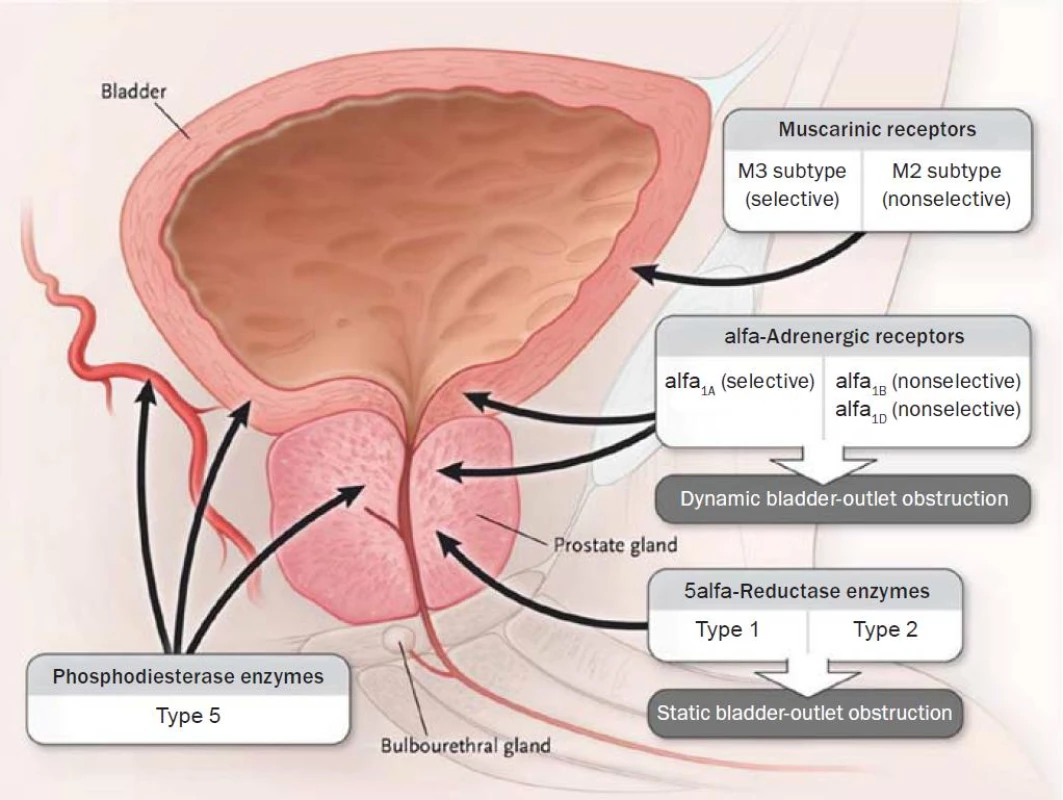
V současné době jsou na českém trhu prazosin, doxazosin, terazosin, alfuzosin a tamsulosin (tab. 6, 7). Některá i jako generika, jiná pouze jako originální molekuly. Doxazosin, terazosin a prazosin jsou podle údajů výrobců určeny k léčbě obtížné mikce i k léčbě hypertenze. Podle dané diagnózy je doporučováno dávkování. Alfuzosin a tamsulosin výrobci deklarují pouze k léčbě mikčních obtíží. Některé léky (doxazosin, terazosin a tamsulosin) jsou vyráběny také ve formě pomalu uvolňující účinnou látku, umožňující aplikaci jednou denně. Toto dávkovací schéma dnes převažuje.
Vedlejší účinky
Léky užívané též jako antihypertenziva mohou především na počátku léčby navodit ortostatickou hypotenzi s vážnými důsledky. Méně časté jsou bolesti hlavy, nauzea a další. Podle srovnávacích studií lze říci, že 4–10 % pacientů přeruší léčbu pro tyto nežádoucí účinky u alfuzosinu a tamsulosinu a dvojnásobný počet u terazosinu a doxazosinu [41]. Dalšími nežádoucími účinky mohou být sexuální, zejména retrográdní ejakulace. Ty se nejčastěji vyskytují u tamsulosinu [38], méně často u ostatních preparátů a nebyly popsány u alfuzosinu [40,39].
Proto bývá doporučována titrace (postupné zvyšování dávky). U jednotlivých přípravků se ojediněle setkáváme s erektilními poruchami, zcela výjimečně s gastrointestinálními obtížemi i lehkými alergickými projevy. Při průchodu hematoencefalickou bariérou se objevují přímé projevy účinků na centrálním nervovém systému (CNS) – hučení v hlavě, netečnost, ospalost. Poměr mezi nežádoucími účinky (hlavně kardiovaskulárními a CNS) a žádoucími účinky na močovou obstrukci vedl k vytvoření pojmu klinická uroselektivita. Distribuce receptorů a a d v prostatě, hrdle a bázi močového měchýře dovoluje významně cílenější ovlivnění mikčních symptomů s minimem nežádoucích vedlejších účinků. Pojem uroselektivita je nyní nahrazován přesnějším označením selektivita tkáňová či receptorová. Tamsulosin je v tomto kontextu pokládán za jeden z nejúčinnějších. Obecně je efekt léčby dokládán zlepšením urodynamických parametrů a snížením bodového skóre IPSS. Preferenci jednotlivých léků ovlivňují nejen faktory uvedené v odstavci indikace léčby, ale též přání pacienta, již existující farmakoterapie pro jiné diagnózy, možná i cena preparátu a výše jeho úhrady zdravotními pojišťovnami i další skutečnosti.
Objev selektivních alfa-adrenergních antagonistů (blokátorů) znamenal významný přínos v medikamentózní léčbě LUTS způsobených BPH. Celosvětově prováděné studie došly k závěru, že selektivní alfa-1 blokátory, zvláště pak receptorově selektivní, hrají významnou úlohu při výběru první léčby této diagnózy. Toto postavení je dáno především rychlým ústupem subjektivních obtíží a dobrou tolerancí. Do budoucna bychom přivítali uroselektivitu s detailnějším cíleným léčebným efektem, neboť epidemiologické studie prokazují výrazný nárůst ročníků populace nad 60 let v budoucích 20 letech (graf 2) [32] a lze očekávat nárůst léčených pacientů s polymorbiditou. Další studie jsou zaměřeny na účinky dlouhodobé terapie. Farmakologický výzkum by mohl poskytnout ještě selektivnější přípravky, dovolující širší využití např. u erektilních dysfunkcí, jako jistou prevenci močové retence, uplatnění pozitivního vlivu na metabolizmus lipidů a další. Také zůstávají velké možnosti v léčbě mikčních obtíží u žen. Z pohledů nákladů na léčbu je třeba si uvědomit, že alfa-1 blokátory umožňují zvýšený životní komfort a že jejich využití a dosažitelnost pacientem zásadně ovlivní i cenová politika výrobců. Jistou variantu by snad ještě nabízela intermitentní léčba.

Inhibitory 5alfa-reduktázy (5ARI)
V současné době je možný pouze jeden druh hormonálně založené terapie, a to pomocí inhibitorů 5alfa-reduktázy, které zamezují přeměně biologicky méně aktivního testosteronu (TST) na jeho účinnější formu dihydrotestosteron (DHT) (obr. 2). Přestože existují dva izoenzymy, tkáň prostaty obsahuje především izoenzym II, který je selektivně blokován azasteroidem finasteridem. Při zamezení konverze TST na DHT dochází k poklesu jak sérových hladin, tak intraprostatických hladin. Tento stav vede k atrofii glandulárně-epiteliální komponenty tkáně prostaty i v přechodné zóně a následně ke zmenšení objemu prostaty o 20–30 %. Doba účinku inhibitoru 5alfa-reduktázy se odhaduje po vysazení na cca 6 let. Po tuto dobu lze pozorovat stacionární velikost prostaty. Inhibitor 5alfa-reduktázy snižuje hladinu PSA na polovinu [42].
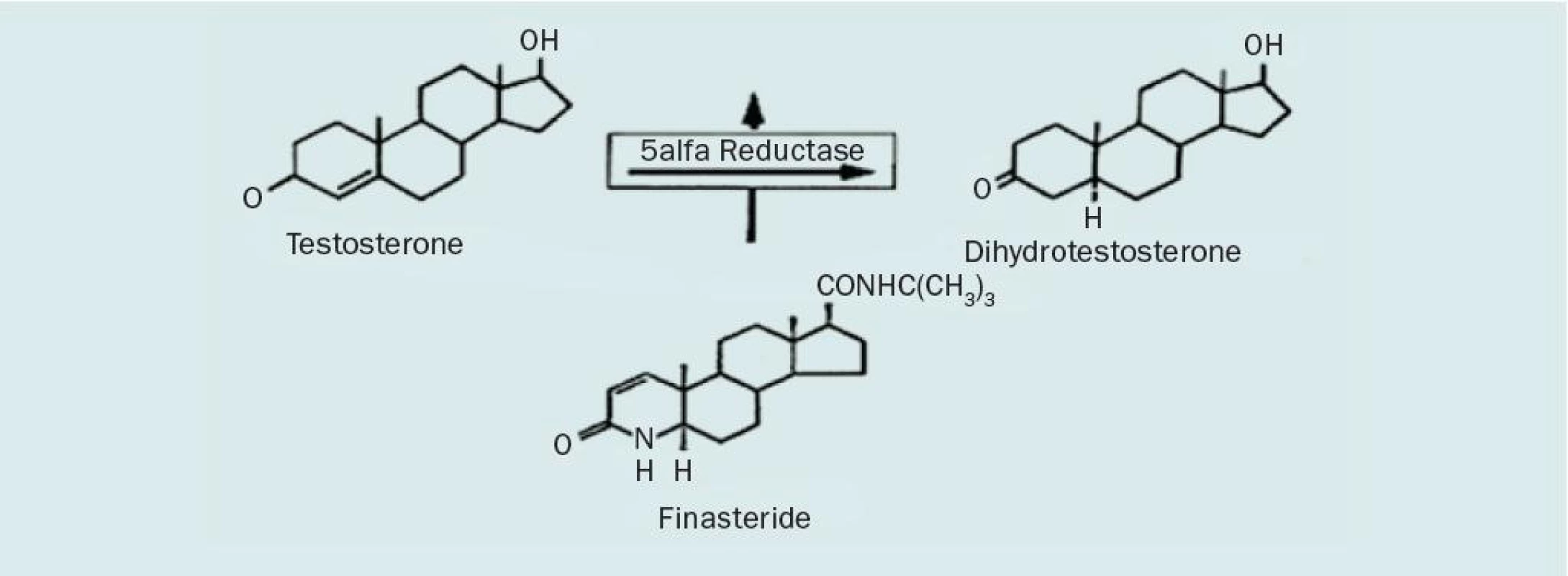
Jak již bylo zmíněno, enzym 5alfa--reduktázy se vyskytuje ve dvou izoformách. Každá z těchto forem je kódována na různých genech [43]. Izoenzym 1 se vyskytuje především v játrech, kůži, mazových žlázkách a vlasových folikulech. Typ 2 je zodpovědný za virilizaci mužského plodu a vyskytuje se především v oblasti kůže genitálu, vousech a prostatě (zde je obsažen částečně i izoenzym 1) [44, 45]. Do současnosti bylo vyvinuto více inhibitorů obou forem izoenzymů. Finasterid kompetetivně inhibuje typ 2 izoenzymu 5alfa-reduktázy, ale efekt na typ 1 je minimální. Sérová hladina DHT je redukována o 65–70 % a taktéž intraprostatická koncentrace DHT je nižší o 85–90 %. Recipročně však dochází k nárůstu koncentrace TST v prostatické tkáni [46]. Sérové hladiny testosteronu jsou na stejné úrovni tak jako před léčbou, tj. nedochází k významnému ovlivnění libida, fertility a sexuálních funkcí. I přes léčbu finasteridem je tkáň prostaty zásobována z 30 % DHT pocházejícím ze séra a z 10 % DHT, který je konvertován izoenzymem typu 1 [47]. Manipulací se steroidní strukturou byl vyvinut dutasterid (GI198745). Jedná se o duální inhibitor 5alfa-reduktázy, který vykazuje 60× vyšší účinnost vůči izoenzymu 1 ve srovnání s finasteridem a zároveň inhibuje izoenzym 2. Ve studii s 399 pacienty sledující depresi hladiny DHT u pacientů užívajících finasterid, dutasterid a placebo po dobu 24 týdnů bylo dosaženo maximální suprese právě u pacientů užívajících dutasterid s minimální variabilitou v sérových hladinách na rozdíl od finasteridu [48]. Ukazuje se, že používání 5ARI by mohlo být přínosné u rizikových skupin u karcinomu prostaty. Z rozsáhlé klinické studie Prostate cancer prevention trial (PCPT), které se zúčastnilo 18 000 mužů, kteří byli randomizováni a užívali 7 let finasterid 5 mg nebo placebo, vyplynulo, že u skupiny, která užívala finasterid, došlo ke snížení incidence karcinomu prostaty o 24,8 % na rozdíl od placebo skupiny [49]). Druhým závažným výstupem bylo signifikantně vyšší zastoupení agresivních karcinomů – gleasonského skóre 7–10 u finasteridové skupiny [40]. Vysvětlení tohoto faktu dosud chybí a bude nutné další sledování. Výsledky klinické studie PLESS (Proscar long-term efficacy and safety study) neprokázaly, že by finasterid měl nějaký efekt na morfologii buněk karcinomu prostaty [50].
Parasympatolytika (antimuskarinika)
Projevy LUTS v sobě obsahují symptomy hyperaktivního močového měchýře, jako jsou frekventní mikce, urgence a urgentní inkontinence. Tyto symptomy patří mezi nejvíce zatěžující a zhoršující kvalitu života pacientů s BPH. Kontrakce detruzoru močového měchýře je zprostředkována účinkem acetylcholinu na muskarinových receptorech (obr. 1) s následnou kontrakcí hladké svaloviny. Mezi nejčastěji používané preparáty ze skupiny antimuskarinik patří tolterodin, flavoxat, propiverin a oxybutinin. V minulosti byla léčba těmito preparáty určena výhradně ženám. V současné době se čím dál tím častěji objevují v léčbě pacientů s BPH. Výrazná inhibice kontraktility močového měchýře může vyústit v akutní retenci moči jako nežádoucí vedlejší účinek léčby. Výskyt tohoto negativního jevu v léčbě antimuskariniky v klinicky efektivním dávkování je však relativně nízký [51]. Toto tvrzení je založeno na výsledcích studie, která hodnotila 221 pacientů s potvrzenou subvezikální obstrukcí a OAB, kteří byli randomizováni do dvou skupin léčených tolterodinem a placebem po dobu tří měsíců [52]. Ve skupině pacientů užívajících tolterodin došlo k nárůstu posmikčního rezidua o 25 ml. To však nebylo doprovázeno vedlejšími negativními účinky. Urodynamická měření prokázala zvýšení kapacity a snížení kontraktility u pacientů užívajících tolterodin. Jedna z nejrozsáhlejších multicentrických studií s 1529 pacienty hodnotila účinek retardované formy tolterodinu s normálním tolterodinem a placebem. Ve skupině s účinnou látkou došlo k pozitivnímu ovlivnění urgencí a urgentní inkontinence, přičemž 24hodinová retardovaná forma vykazovala lepší účinnost. Nejčastějším vedlejším účinkem byl pocit sucha v ústech, ale četnost předčasného ukončení studie z tohoto důvodu byla stejná i ve skupině pacientů léčených placebem [53]. Solifenacin patří mezi jednu z nejmodernějších účinných látek ze skupiny antimuskarinik. Cardozo a kol. [54] hodnotí skupinu 911 pacientů užívajících 5 nebo 10 mg solifenacinu se skupinou s placebem. I zde dochází ke snížení urgencí a četností nočního močení. Pocit sucha v ústech byl zaznamenán u 7,7 % pacientů s dávkou 5 mg denně a 23 % užívajících 10 mg denně. Závěrem této studie je konstatováno, že 5 mg solifenacinu denně signifikantně zlepšuje symptomy OAB s minimální mírou vedlejších negativních účinků.
Mirabegron (beta-3 adrenergní agonista)
Prevalence histologické, makroskopické a klinické BPH koreluje se zvyšujícím se věkem, což vedlo k předpokladu jejich vzájemné příčinné souvislosti a vzniku hypotézy, podle které je zvětšená prostata na mechanickém principu příčinou LUTS. Představa statické a dynamické složky subvezikální obstrukce spojené s BPH se ukázala jako velmi zjednodušená a v dnešní době je jasné, že signifikantní část LUTS je způsobena dysfunkcí detruzoru (věkem podmíněnou, neurogenní nebo na podkladě primárních onemocnění močového měchýře) a dalšími stavy, jako jsou polyurie, poruchy spánku a různá systémová onemocnění, která nemají přímý vztah k prostatě a močovému měchýři.
Mirabegron jako zástupce nové třídy léčiv pro terapii OAB je aktivní, selektivní agonista beta-3 adrenoceptoru, snižuje frekvenci kontrakcí detruzoru v průběhu plnící fáze bez ovlivnění amplitudy stahu močového měchýře při mikci. V rozsáhlých studiích III. fáze mirabegron prokázal vysokou účinnost na symptomy OAB a zaznamenal signifikantní redukci počtu epizod urgence, urgentní inkontinence a frekvence močení. Bezpečnostní profil byl srovnatelný s placebem.
Na konferenci EAU 2013 v Miláně byla představena souhrnná data ze 3 randomizovaných, placebem kontrolovaných, dvojitě zaslepených, 12týdenních studií. Ukázala hodnocení mirabegronu 25 mg, 50 mg a 100 mg ve srovnání s tolterodinem ER 4 mg. Všechny studie zahrnovaly muže a ženy ve věku ≥ 18 let se symptomy OAB ≥ 3 měsíce. Mezi 4611 pacienty byl výskyt společných nežádoucích účinků spojených s antimuskariniky ve všech léčebných skupinách (mirabegron, tolterodin, placebo), s výjimkou sucha v ústech a svědění, kde došlo ke 4× vyšší incidenci ve skupině s tolterodinem (10,1 % a 1,4 %) versus mirabegron (07/01–05/02 % a 0,2–0,3 %) nebo placebem (2,1 % a 0,4 %) a retence moči, která byla vyšší u tolterodinu a placeba, než u mirabegronem léčených pacientů. Výskyt sucha v ústech a svědění po tolterodinu v této studii byl výrazně nižší než incidence uvedená v metaanalýze (29,6 % a 15,4 %, v uvedeném pořadí). Bylo prokázáno, že léčba přípravkem Betmiga 50 mg denně účinně snižuje počet močení a počet epizod inkontinence. Po třech měsících léčby snižoval přípravek Betmiga 50 mg průměrně počet močení o 1,8 za den ve srovnání se snížením o 1,2 za den u placeba. Přípravek Betmiga 50 mg vedl ke snížení počtu epizod inkontinence o 1,5 za den v porovnání se snížením o 1,1 epizod u inkontinence za den u placeba.
Nejčastějším nežádoucím účinkem přípravku Betmiga zaznamenaným u více než 1 osoby ze 100 je tachykardie a nejčastějším nežádoucím účinkem zaznamenanými u méně než 3 osob ze 100 je infekce močových cest. Mezi závažné, nicméně vzácné nežádoucí účinky patří fibrilace síní a alergie. Tyto údaje ukazují, že mirabegron může být alternativou antimuskarinika, zejména v těch případech, kdy dochází k netolerovanému suchu v ústech u antimuskarinové léčby.
Kombinované terapie
Alfa-1 blokátory + inhibitory 5alfa-reduktázy
Několik studií zkoumalo účinnost kombinované terapie oproti účinnosti samostatně podávaného alfa-1 blokátoru, inhibitoru 5alfa-reduktázy nebo placeba. Počáteční studie s dobou sledování v rozmezí 6–12 měsíců použily jako svůj primární výsledný parametr změnu symptomů (IPSS) [55–56]. Tyto studie jednotně prokázaly, že alfa-1 blokátor zmírňuje symptomy účinněji než finasterid, zatímco kombinovaná terapie nebyla v porovnání s aplikací samostatného alfa-1 blokátoru účinnější. Ve studiích, které zahrnovaly placebo skupinu, byl alfa-1 blokátor vždy účinnější než placebo, zatímco finasterid nebyl v porovnání s placebem nikdy účinnější. Údaje po prvním roce studie MTOPS (Medical Therapy of Prostatic Symptoms), které byly zveřejněny, ale nebyly pro tento časový úsek specificky analyzovány, ukázaly obdobné výsledky [57]. Byla zveřejněna analýza údajů po čtyřech letech studie MTOPS a rovněž výsledky po dvou a čtyřech letech studie CombAT (Combination of Avodart® and Tamsulosin) [57,58]. Studie CombAT zahrnovala starší muže s větší prostatou a vyššími koncentracemi PSA v séru, a proto by mohla reprezentovat muže, u nichž existuje větší riziko progrese onemocnění. Na rozdíl od předchozích studií, které zahrnovaly sledování v délce pouze 6–12 měsíců, dlouhodobé údaje prokázaly, že kombinovaná léčba je účinnější než monoterapie, pokud jde o snížení symptomů a zlepšení Qmax, a účinnější než alfa-1 blokátor při snižování rizika akutní retence moči a nutnosti operace [57,58]. Studie CombAT prokázala, že kombinovaná léčba je účinnější než monoterapie, pokud jde o zlepšení symptomů a Qmax, počínaje devátým měsícem, a účinnější než alfa-1 blokátor, pokud jde o snížení rizika akutní retence moči a nutnosti operace, po osmi měsících [58]. Různé výsledky studií CombAT a MTOPS jsou zřejmě důsledkem různých zařazovacích a vyřazovacích kritérií spíše než typů alfa-1 blokátorů nebo inhibitorů 5alfa-reduktázy. Samostatně aplikovaný dutasterid nebo finasterid redukoval objem prostaty stejně účinně jako kombinovaná léčba (–20 až –27 %). Otázkou vysazení léčby alfa-1 blokátorem se zabývaly tři studie [59–61]). Jedna studie hodnotila kombinaci tamsulosinu s dutasteridem a dopad vysazení tamsulosinu po šesti měsících [59]. Po vysazení alfa-1 blokátoru téměř tři čtvrtiny pacientů uváděly, že u nich nedošlo k žádnému zhoršení symptomů. Avšak pro pacienty, kteří před zahájením léčby trpí závažnými symptomy (IPSS > 20), může být dlouhodobější kombinovaná terapie přínosem. Nedávno zveřejněná studie hodnotila dopad monoterapie finasteridem na symptomy tři a devět měsíců po vysazení devítiměsíční kombinované terapie (finasterid plus alfa-1 blokátor) [60]. Zlepšení symptomů LUTS po kombinované terapii zůstalo patrné i po třech (rozdíl IPPS 1,24) a devíti měsících (rozdíl IPPS -0,44). V retrospektivní studii byla pravděpodobnost vysazení alfa-1 blokátoru, které vycházelo z individuálního rozhodnutí pacienta, hodnocena za období 12 měsíců u mužů starších 65 let, kterým byly podávány alfa-1 blokátory v kombinaci s dutasteridem nebo finasteridem [61].

Alfa-1 blokátory + antagonisté muskarinových receptorů
Bylo zveřejněno asi devět studií zkoumajících účinnost kombinované léčby alfa-1 blokátory a antagonisty muskarinových receptorů u dospělých mužů se symptomy LUTS [68]. Dále byla provedena jedna studie, v níž byl použit alfa-1 blokátor naftopidil s anticholinergními agens, či bez nich [69]. Pouze jedna z těchto studií zahrnovala placebo skupinu a testovala kombinaci léčiv oproti alfa-1 blokátoru a zároveň oproti antagonistovi muskarinových receptorů [70]; všechny ostatní studie porovnávaly účinnost kombinované terapie s účinností samostatně aplikovaného alfa-1 blokátoru. Maximální doba trvání studie činila 25 týdnů, většina studií však trvala pouze 4–12 týdnů. Kombinace léčiv byla v porovnání se samostatným podáváním alfa-1 blokátorů nebo pouze placeba obecně účinnější při LUTS nebo IPSS. Kombinovaná léčba dále významně snížila počet příhod urgenci i urgentní inkontinence a významně zvýšila kvalitu života [70]. Celkové zlepšení symptomů ve skupině, která byla podrobena kombinované terapii, bylo v porovnání s placebem významně vyšší bez ohledu na koncentrace PSA v séru, zatímco samostatné podávání tolterodinu významně zlepšovalo symptomy převážně u mužů s koncentrací PSA v séru nižší než 1,3 ng/ml [71]. Tři studie zkoumaly účinnost kombinované léčby u pacientů s přetrvávajícími symptomy LUTS během léčby alfa-1 blokátory, kdy byla stávající terapie alfa-1 blokátory rozšířena o aplikaci antagonisty muskarinových receptorů. Tyto studie prokázaly, že přetrvávající symptomy LUTS lze významně zmírnit přidáním antagonistů muskarinových receptorů tolterodin), zejména pokud byla prokázána hyperaktivita detruzoru. Ve skupině, která byla podrobena kombinované léčbě, uváděli pacienti významné zlepšení kvality života, benefitu léčby, obtěžování symptomy nebo vnímání stavu močového měchýře pacientem.
Nejčastějšími nežádoucími účinky ve všech studiích byla xerostomie (sucho v ústech). Některé (např. xerostomie nebo selhání ejakulace) se vyskytují s větší četností a nelze je jednoduše vysvětlit kumulací s nežádoucími účinky druhého léčiva. Ve většině studií bylo za znamenáno zvýšení postmikčního rezidua. Ačkoli bylo průměrné zvýšení objemu postmikčního rezidua nízké (6–24 ml), u některých mužů se objevily i vyšší hodnoty PVR nebo dokonce retence moči (0,9–3,3 %). Zůstává nejasné, u kterých mužů hrozí během kombinované léčby riziko výskytu postmikčního rezidua nebo retence moči.
Kombinovanou léčbu alfa-1 blokátorem a antagonistou muskarinových receptorů lze zvážit u pacientů se středně závažnými až závažnými symptomy dolních cest močových, pokud nebylo dostatečné úlevy od symptomů dosaženo monoterapií jedním z uvedených léčiv. Kombinovaná léčba by měla být předepisována s opatrností u mužů, u kterých existuje podezření na obstrukci výtoku z močového měchýře.
Inhibitory fosfodiesterázy 5 (PDE5-I)
LUTS a sexuální dysfunkce mají vysokou prevalenci u mužů vyššího věku a společně mají výrazný vliv na všeobecnou kvalitu života včetně psychiky. Mužská sexuální dysfunkce se manifestuje ve formě snížení libida, sexuální hypoaktivity, poruchy ejakulace, erektilní dysfunkce či kombinace výše uvedených. LUTS je nezávislým rizikovým faktorem, který se v případě přítomnosti dalších rizik jako např. ICHS, diabetes, či hypertenze stává signifikantním prediktorem vzniku erektilní dysfunkce [62]. Současná léčba BPH, resp. LUTS postihuje přímo i nepřímo sexuální funkce. Užití PDE5-I v léčbě erektilní dysfunkce pozitivně ovlivňuje LUTS a zlepšuje projevy BPH. Byly publikovány čtyři randomizované studie zabývající se vztahem PDE5-I a LUTS s použitím účinných látek sildenafilu, vardenafilu a tadalafilu. Studie užívající sildenafil probíhala po dobu 12 týdnů a bylo v ní zahrnuto 369 mužů starších 45 let, jejichž mezinárodní index erektilní dysfunkce (IIEF-5) byl menší než 26 a IPSS skóre větší než 11. Skupina 189 mužů užívajících sildenafil vykazovala signifikantní zlepšení IPSS skóre 6,3 vs. 1,93, oproti skupině mužů s placebem [63]. Studie s vardenafilem na 222 mužích s identickými vstupními kritérii trvala osm týdnů a pacienti užívali 2× denně dávku 10 mg vardenafilu, respektive placeba. I zde došlo k poklesu IPSS skóre o 2,2 bodu a pacienti užívající aktivní látku hodnotili kvalitu svého života jako výrazně lepší a taktéž došlo ke zlepšení LUTS symptomů [64]. Studie s tadalafilem byla tvořena tak, že pacienti užívali 5 mg tadalafilu po dobu 6 týdnů s následným zvýšením dávky na 20 mg po dobu 12 týdnů. Kontrolní skupina užívala placebo. Jednalo se o 281 mužů, jejichž IPSS skóre bylo větší než 12 s podmínkou minimálně půlročního trvání BPH. Tadalafil signifikantně zlepšil průměrné IPSS skóre v úvodních šesti týdnech o dva body IPSS a po 12 týdnech došlo k dalšímu zlepšení v IPSS skóre o 3,8 bodu. Zlepšení bylo popisováno i u LUTS v indexu kvality života a IIEF skóre [65]. Jedna z recentních velice dobře strukturovaných studií demonstruje pozitivní vliv tadalafilu na mikční symptomy dolních močových cest. Jedná se o velice rozsáhlou studii čítající 1 058 mužů. Doba užívání tadalafilu nebo placeba byla 12 týdnů. Závěry studie jsou takové, že optimální dávka tadalafilu ovlivňující projevy LUTS je 5 mg. Zvyšování dávky vede k dalšímu mírnému zlepšení, ale zároveň je doprovázeno významnějšími negativními vedlejšími účinky PDE5-I [66]. Všechny výše uvedené studie souhlasně poukazují na pozitivní efekt PDE5-I na LUTS, byť do budoucna je potřeba dalších studií, které tyto závěry potvrdí.
Nežádoucími účinky jsou bolesti hlavy, návaly, závratě, dyspepsie, ucpaný nos, myalgie, hypotenze, synkopa, tinitus, zánět spojivek nebo poruchy vidění (rozmazané vidění, vliv na barevné vidění). Frekvence vedlejších účinků se však u jednotlivých inhibitorů PDE5 liší. Pravděpodobnost vzniku priapismu nebo akutní retence moči je minimální. Inhibitory PDE5 jsou kontraindikovány u pacientů užívajících nitráty nebo otvírač draslíkových kanálů nicorandil z důvodu další vazodilatace, která by mohla způsobit hypotenzi, ischemii myokardu u pacientů s onemocněním koronárních tepen nebo cévní mozkové příhody [67]. Dále by žádný z inhibitorů PDE5 neměl být podáván pacientům, kteří užívají alfa-1 blokátory doxazosin nebo terazosin, trpí nestabilní anginou pectoris a další.
Inhibitory PDE5 byly doposud oficiálně FDA schváleny pouze pro léčbu erektilní dysfunkce a pulmonární arteriální hypertenze. Léčba nad rámec této indikace (např. symptomy LUTS u mužů) je zatím pouze experimentální a neměla by být v klinickém prostředí rutinně používána. Dlouhodobé zkušenosti u pacientů se symptomy LUTS stále chybí.
Závěr
Léčba LUTS/BPH se stále vyvíjí, budou se dále zpřesňovat indikace k zlepšení efektu. Bude jistě upřesněno, kdy je indikována monoterapie, kombinovaná terapie a který preparát. Jedním z nových preparátů je naftopidil. Jedná se o selektivní alfa-1D adrenergní blokátor. Při klinické studii, která srovnávala naftopidil s tamsulosinem, se ukázala obdobná efektivita obou preparátů ve všech sledovaných ukazatelích. Navíc se ukazuje, že alfa-1D subtyp, který se vyskytuje predominantně v močovém měchýři, by mohl být účinný na poruchy shromažďovací funkce dolních močových cest (urgence, nykturie a podobně). Spolu s pokrokem v patofyziologii BPH se možná dočkáme i nových preparátů. Jedním takovým je BXL628: analog vitaminu D3. Zjistilo se, že prostatické buňky mají receptory pro vitamin D (VDR) a použití VDR agonistů vede k snížení proliferace prostatických buněk. Výsledkem ročního podávání tohoto preparátu bylo snížení velikosti prostaty bez ovlivnění androgenní stimulace a tedy bez nežádoucích sexuálních účinků. Nejčastěji se vyskytovaly nauzea, bolest hlavy a synkopa. Minimální byla hypofosfaturie a hyperkalciurie. Velikost prostaty se po ročním podávání preparátu snížila o 2,9 % na rozdíl od nárůstu velikosti o 4,32 % u kontrolní skupiny. Toto relativně malé snížení velikosti může být hodnoceno jako nepříliš přesvědčivé. Proto bychom měli počkat na nové výsledky klinických studií s tímto nebo podobnými preparáty. V budoucnosti se dočkáme i snahy o pozitivní ovlivnění symptomů nestabilního měchýře. Antimuskarinový preparát tolterodin byl již s úspěchem u nemocných s urgentní symptomatologií BPH používán. Další zajímavou oblastí, ve které bychom se mohli dočkat nových možností léčby, je kombinace terapie LUTS/BPH a erektilní dysfunkce. Snad v budoucnosti obě tyto nemoci s rostoucí incidencí bude možné léčit dohromady.
Závěrem lze konstatovat, že medikamentózní léčba LUTS/BPH je velmi nákladná. Z tohoto důvodu je nezbytné, aby tato léčba byla správně indikována a aby z ní pacienti měli co největší prospěch a efekt s minimem nežádoucích účinků.
MUDr. Motasem Ghazal
Urologická klinika FN Brno
Jihlavská 20, 625 00 Brno
motasem.ghazal@fnbrno.cz
Sources
1. Arrighi HM, Metter EJ, Guess HA et al. Natural history of benign prostatic hyperplasia and risk of prostatectomy the Baltimore Longitudinal Study of Aging. Urology 1991; 35 : 4–8.
2. Chute CG, Panser LA, Girman CJ et al. The prevalence of prostatism: a population based survey of urinary symptoms. J Urol 1993; 150 : 85–89.
3. Chapple CR, Roehrborn CG.. A shifted paradigm for the further understanding, evaluation, and treatment of lower urinary tract symptoms in men: focus on the bladder. Eur Urol 2006; 49(4): 651–658.
4. Hora M. Fytopreparáty v léčbě BHP. Urol List 2004; 4 : 42–45.
5. Wilt T, Ishani A, Mac Donald R et al. Pygeum africanum for benign prostatic hyperplasia. Cochrane Database Syst Rev 2002; (1): CD001044.
6. Wilt T, MacDonold R, Rutks I. Tamsulosin for benign prostatic hyperplasia. Cochrane Database Syst Rev 2002; (4): CD002081.
7. Veselský Z. Pygeum africanum v kauzální terapii benigní hyperplazie prostaty. JAMA-CS, 8 (4), 2000, 326.
8. Schneider T, Rübben H. Bennesseltrockenextrakt (Bazoton®-uno) in der Langzeittherapie des benignen Prostatasyndroms (BPS). Ergebnisse einer randomisierten, doppelblinden, placebokontrollierten Multicenterstudie über 12 Monate. Urologe A 2004; 43(3): 302–306.
9. Safarinejad MR. Urtica dioica for treatment of benign prostatic hyperplasia: a prospective, randomised, double-blind, placebo-controlled, crossover study. J Herb Pharmacother 2005; 5(4): 1–11.
10. Berges RR, Windeler J, Trampisch HJ et al. Randomised, placebo-controlled, double-blind clinical trial of beta-sitosterol in patients with benign prostatic hyperplasia. Beta-sitosterol study group. Lancet 1995; 345(8964): 1529–1532.
11. Klippel KF, Hiltl DM, Schipp B. A multicentric, placebo controlled, double-blind clinical trial of betasitosterol (phytosterol) for the treatment of benign prostatic hyperplasia. Br J Urol 1997; 80(3): 427–432.
12. Bach D. Placebokontrollierte Langzeit therapie studie mit Kürbissamenextrakt bei BPH-bedingten Miktionsbeschwerden. Urologe B 2000; 40: 437–443.
13. Wilt T, Mac Donald R, Ishani A et al. Cernilton for benign prostatic hyperplasia. Cochrane Database Syst Rev 2000; (2): CD001042.
14. Lopatkin N, Sivkov A, Walther C et al. Long-term efficacy and safety of a combination of sabal and urtica extract for lower urinary tract symptoms – a placebo controlled, double-blind, multicenter trial. World J Urol 2005; 23(2): 139–146.
15. Sökeland J, Albrecht J. Kombination aus Sabalund Urticaextrakt vs. Finasterid bei BPH (Stad. I bis IInach Alken). Urologe A 1997; 36(4): 327–333.
16. Wilt T, Ishani A, Mac Donald R et al. Beta-sitosterols for benign prostatic hyperplasia. Cochrane Database of Syst Rev 2000; (2): CD001043.
17. Wilt T, Ishani A, Mac Donald R. Serenoa repens for benign prostatic hyperplasia. Cochrane Database of Syst Rev 2002; (3): CD001423.
18. Bent S, Kane C, Shinohara K et al. Saw palmetto for benign prostatic hyperplasia. N Engl J Med 2006; 354(6): 557–566.
19. Carraro JC, Raynaud JP, Koch G et al. Comparison of phytotherapy (Permixon®) with finasteride in the treatment of benign prostate hyperplasia: A randomised international study of 1,098 patients. Prostate 1996; 29(4): 231–240.
20. Debruyne F, Koch G, Boyle P et al. Comparison of a phytotherapeutic agent (Permixon) with an alpha-blocker (Tamsulosin) in the treatment of benign prostatic hyperplasia: A 1-year randomised international study. Eur Urol 2002; 41(5): 497–506.
21. Fjellestad-Paulsen A, Höglund P, Lundin S et al. Pharmacokinetics of 1-deamino-8-D-arginine vasopressin after various routes of administration in healthy volunteers. Clin Endocrinol 1993; 38(2): 177–182.
22. Rembratt A, Graugaard-Jensen C, Senderovitz T et al. Pharmacokinetics and pharmacodynamics of desmopressin administered orally versus intravenously at daytime versus night-time in healthy men aged 55–70 years. Eur J Clin Pharmacol 2004; 60(6): 397–402.
23. Hvistendahl GM, Riis A, Norgaard JP et al. The pharmacokinetics of 400 μg of oral desmopressin in elderly patients with nocturia, and the correlation between the absorption of desmopressin and clinical effect. BJU Int 2005; 95(6): 804–809.
24. Asplund R, Sundberg B, Bengtsson P. Desmopressin for the treatment of nocturnal polyuria in the elderly: a dose titration study. Br J Urol 1998; 82(5): 642–646.
25. Cannon A, Carter PG, McConnell AA et al. Desmopressin in the treatment of nocturnal polyuria in the male. BJU Int 1999; 84 : 20–24.
26. Mattiasson A, Abrams P, Van Kerrebroeck P et al. Efficacy of desmopressin in the treatment of nocturia: a double-blind placebo-controlled study in men. BJU Int 2002; 89(9): 855–862.
27. Lose G, Mattiasson A, Walter S et al. Clinical experiences with desmopressin for long-term treatment of nocturia. J Urol 2004; 172(3): 1021–1025.
28. Van Kerrebroeck P, Rezapour M, Cortesse A et al. Desmopressin in the treatment of nocturia: a double blind placebo-controlled study. Eur Urol 2007; 52(1): 221–229.
29. Rembratt A, Riis A, Norgaard JP. Desmopressin treatment in nocturia; an analysis of risk factors for hyponatremia. Neurourol Urodyn 2006; 25(2): 105–109.
30. Weatherall M. The risk of hyponatremia in older adults using desmopressin for nocturia: a systematic review and meta-analysis.Neurourol Urodyn 2004; 23(4): 302–305.
31. Bae JH, Oh MM, Shim KS et al. The effects of longterm administration of oral desmopressin on the baseline secretion of antidiuretic hormone and serum sodium concentration for the treatment of nocturia: a circadian study. J Urol 2007; 178(1): 200–203.
32. Lepor H, Shapiro E. (1984). Characterisation of alpha1 adrenergic receptors in human benign prostatic hyperplasia. J Urol 1984, 132 : 1226–1229.
33. Shapiro E, Lepor H. Alpha 2adrenergic receptors in hyperplastic human prostate: identification and characterization using /3H/ rauwolscine. J Urol 1986, 135 : 1038–1043.
34. Caine M, Raz S, Ziegler M. Adrenergic a cholinergic receptors in the human prostatic capsule and bladder neck. Br J Urol 1975, 47 : 193–202.
35. Caine M. The present role of alpha adrenergic blockers in the treatment of benign prostatic hyperplasia. J Urol 1986, 136 : 1–4.
36. Ford APDW, Daniels DV, Chang DJ et al. Pharmacological pleiotropism of the human recombinant alfa1A-adrenoceptor: implications for alfa1-adrenoceptor classification, B J Pharm 1997, 121: 1127–1135.
37. Kenny BA, Naylor AM, Wyllie MG.: Prostatic adrenoceptors in Kirby R, McConnell JD, Fitzpatrick JM, Roehrborn CG, Boyle P (1996). Textbook of Benign Prostatic Hyperplasia, ISIS, Oxford, 566 pp.
38. Marberger M, Harkaway R, de la Rosette J. Optimizing the medical management of benign prostatic hyperplasia. Eur Urol 2004; 45 : 411–419.
39. Navrátil P. Uroselektivita alfuzosinu při léčbě pacientů se symptomy BPH. Čes Urol 2001; 2 : 4–8.
40. MacDonald JD, Roehrborn CG, Bautista OM et al. Afluzosin for treatment of lower urinary tract symptoms compatible with benign prostatic hyperplasia: a systematic review of effi cacy and adverse effects. Urology 2005; 66 (4): 780–788.
41. Djavan B, Marberger M. A meta-analysis on the effi cacy and tolerability of alpha 1-adrenoreceptor antagonists in patients with lower urinary tract symptoms suggestive of benign prostatic hyperplasia. Eur Urol 1999; 36 : 1–13.
42. Gormley GJ, Stoner E., Bruskewitz RC. The effect of finasteride in men with benign prostate hyperplasia. The Finasteride Study Group (see Comments). N Engl J Med 1992; 327 : 1185–1191.
43. Russel DW, Wilson JD. Steroid 5 alpha reductase: two genes/two enzymes. Annu Rew Biochem. 1994; 63 : 25–61.
44. Thigpen AE, Silver RI. Tissue distribution and ontogens of steroid 5 alpha reductase isoenzyme expresion. J Clin Invest. 1993; 92 : 903–910.
45. Aumuller G, Eicheler W, Rennenberg H. Immunocytochemical evidence for differential subcellular localization of 5 alpha reductase isoenzymes in human tissues. Acta Anat (Basel) 1996; 156: 241–252.
46. Norman RW, Coakes KE, Wright AS, Rittmaster RS. Androgen metabolism in men recieving fi nasteris before prostatectomy. J Urol 1993; 150 : 1736–1739.
47. Steers WD. 5 Alpha reductases activity in the prostate. Urology 2001; 58(suppl 6a): 17–24.
48. Bartsch G, Rittmaster RS, Klocker H. Dihydrotestosteron and the concept of 5 alpha reductase inhibition in human benign prostatic hyperplasia. World J Urol 2002; 19 : 413 – 425.
49. Thompson IM, Goodman PJ, Tangen CM et al. The influence of finasteride on the development of prostate cancer. N Engl J Med 2003; 349 : 293–295.
50. Yang XJ, Lecksell K, Short K et al. Does long-term fi nasteride therapy affect the histological features of benign prostatic tissue and prostate cancer on needle biopsy? Urology 1999; 53 : 696–700.
51. Ruggieri MR, Braverman AS, Pontari MA. Combined USB of a-adrenergic and muscarinic antagonists for the treatment of voiding dysfunction. J Urol 2005; 174 : 1743–1748.
52. Abrams P, Kaplan S, De Koning Gans HJ, Miliard R. Safety and tolerability of tolterodine for the treatment of overactive bladder in men with bladder outlet obstruction. J Urol 2006; 175 : 999–1004.
53. Van Kerrenbroeck P, Kreder K, Jonas U, Zinner N, Wein A, for the Tolterodine Study Group. Tolterodine once-daily: superior efficacy and tolerability in the treatment of overactive bladder. Urology 2001; 57 : 414–421.
54. Cardozo L, Lisec M, Miliard R et al. Randomized, double-blind placebo controlled trial of the once daily antimuscarinic agent solifenacin succinate in patients with overactive bladder, J Urol 2004; 172 : 1919–1924.
55. Lepor H, Williford WO, Barry MJ et al. The efficacy of terazosin, finasteride, or both in benign prostatic hyperplasia. N Engl J Med 1996; 335(8): 533–539.
56. Kirby R, Roehrborn CG, Boyle P et al; Prospective European Doxazosin and Combination Therapy Study Investigators. Efficacy and tolerability of doxazosin and finasteride, alone or in combination, in treatment of symptomatic benign prostatic hyperplasia: the Prospective European Doxazosin and Combination The rapy (PREDICT) trial. Urology 2003; 61(1): 119–126.
57. McConnell JD, Roehrborn CG, Bautista O et al; Medical Therapy of Prostatic Symptoms (MTOPS) Research Group. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med 2003; 349(25): 2387–2398.
58. Roehrborn CG, Siami P, Barkin J et al; CombAT Study Group. The effects of combination therapy with dutasteride and tamsulosin on clinical outcomes in men with symptomatic benign prostatic hyperplasia: 4-year results from the CombAT study. Eur Urol 2010; 57(1): 123–131.
59. Barkin J, Guimarăes M, Jacobi G et al. Alpha-blocker therapy can be withdrawn in the majority of men following initial combination therapy with the dual 5alpha-reductase inhibitor dutasteride. Eur Urol 2003; 44(4): 461–466.
60. Nickel JC, Barkin J, Koch C et al. Finasteride monotherapy maintains stable lower urinary tract symptoms in men with benign prostatic hyperplasia following cessation of alpha blockers. Can Urol Assoc J 2008; 2(1): 16–21.
61. Issa MM, Lin PJ, Eaddy MT et al. Comparative analysis of alpha-blocker utilization in combination with 5-alpha reductase inhibitors for enlarged prostate in a managed care setting among Medicareaged men. Am J Manag Care 2008; 14 (5 Suppl 2): S160–S166.
62. Galeo BJ, Galee MA. Phosphodiesterase-5 inhibitors for lower urinary tract symptoms in men. Ann Pharmacother 2008; 42 : 111–115.
63. McVary KT, Monnig W, Camps Jr JL et al. Sildenafil citrate improves erectile function and urinary symptoms in men with erectile dysfunction and lower urinary tract symptoms associated with benign prostatic hyperplasia: a randomized, double-blind trial. J Urol 2007; 177 : 1071–1077.
64. Stief CG, Porst H, Neuser D, Beneke M, Ulbrich E. A randomized placebo controlled study to assess the efficacy of twice daily Vardenafi l in the treatment of LUTS secondary to BPH. Eur Urol 2008; 53 : 1236–1244.
65. McVary KT, Roehrborn CG, Kaminetsky JC et al. Tadalafi l relieves lower urinary tract symptoms secondary to benign prostatic hyperplasia. J Urol 2007; 177 : 1401–1407.
66. Roehrborn CG, McVary KT, EKon-Mboussa A, Viktim L. Tadalafil administered once a day in the treatment of men with LUTS secondary to BPH; a dose-finding study. J Urol 2008; 180 : 1228–1234.
67. Wright PJ. Comparison of phosphodiesterase type 5 (PDE5) inhibitors. Int J Clin Pract 2006; 60(8): 967–975.
68. Saito H, Yamada T, Oshima H et al. A comparative study of the efficacy and safety of tamsulosinhydrochloride (Harnal capsules) alone and in combination with propiverine hydrochloride (BUP-4 tablets) in patients with prostatic hypertrophy associated with pollakisuria and/or urinary incontinence. Jpn J Urol Surg 1999; 12 : 525–536.
69. Maruyama O, Kawachi Y, Hanazawa K et al. Naftopidil monotherapy vs naftopidil and an anticholinergic agent combined therapy for storage symptoms associated with benign prostatic hyperplasia: A prospective randomised controlled study. Int J Urol 2006; 13(10): 1280–1285.
70. Kaplan SA, Roehrborn CG, Rovner ES et al. Tolte rodine and tamsulosin for treatment of men with lower urinary tract symptoms and overactive bladder. JAMA 2006; 296(19): 2319–2328.
71. Roehrborn CG, Kaplan SA, Kraus SR et al. Effects of serum PSA on efficacy of tolterodine extended release with or without tamsulosin in men with LUTS, including OAB. Urology 2008; 72(5): 1061–1067.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2013 Issue 2
-
All articles in this issue
- Patofyziologie vzniku BPH – vývoj hypotéz a teorií, současnost a perspektivy
- Farmakoterapie LUTS/BPH v každodenní klinické praxi. Jak vybrat optimální alternativu?
- Současná realita a budoucí možné výhledy méně invazivních technologií v léčbě BPH
- Možnosti léčby a profylaxe recidivujících infekcí dolních močových cest
- Litotrypse rázovou vlnou versus ureteroskopie při léčbě ureterolitiázy: prospektivní hodnocení výsledků uváděných pacienty
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Možnosti léčby a profylaxe recidivujících infekcí dolních močových cest
- Farmakoterapie LUTS/BPH v každodenní klinické praxi. Jak vybrat optimální alternativu?
- Litotrypse rázovou vlnou versus ureteroskopie při léčbě ureterolitiázy: prospektivní hodnocení výsledků uváděných pacienty
- Současná realita a budoucí možné výhledy méně invazivních technologií v léčbě BPH

