Současná realita a budoucí možné výhledy méně invazivních technologií v léčbě BPH
The current reality and future prospects of less invasive technology for the treatment of BPH
The aim of this article is to present an overview of the current option of minimally invasive therapy of benign prostatic hyperplasia. The article focuses on the basic principles of each method, its effectivenessand the current use of these techniques. In the article are also discuss the possibilities of usinglasers in surgical treatment, although they are not minimally invasive procedures in the true sense ofthe word. Included, at the end of this article, are two new methods which were presented at the EAU Congress 2013 in Milan.
Key words:
benign prostatic hyperplasia, miniinvasive therapy, TUMT, HIFU, TUNA, lasers, stents, Rezūm™
Published in:
Urol List 2013; 11(2): 25-32
Overview
Cílem této práce je prezentovat stručný přehled současných možností méně invazivní léčby benigní hyperplazie prostaty. V práci jsou zmíněny základní principy každé metody, její účinnost a současné využití této techniky. Dále jsou zde uváděny možnosti využití laserů v operační léčbě, přestože je nelze považovat za miniinvazivní v pravém slova smyslu. Na závěr práce jsou uvedeny dvě nové metody prezentované na kongresu EAU 2013 v Miláně.
Klíčová slova:
benigní hyperplazie prostaty, miniinvazivní léčba, TUMT, HIFU, TUNA, lasery, stenty, Rezūm™
Úvod
Benigní hyperplazie prostaty (BPH) představuje u mužů velice časté onemocnění, prevalence BPH stoupá s věkem pacientů a to již od 4. decenia. Nejvíce se BPH manifestuje v 6.–8. deceniu. Progrese obstrukce, kterou zvětšená prostatická tkáň v uretře způsobuje, a symptomy BPH se však u pacientů projevují zcela individuálně. BPH je charakterizována na mikroskopické úrovni proliferací počtu epiteliálních a stromálních buněk (hyperplazií) v periuretrální oblasti prostaty v tzv. přechodné zóně. Buněčná proliferace prostatické tkáně slouží jako mikroskopický průkaz BPH, tato proliferace se makroskopicky projevuje zvětšením velikosti prostaty. Klinicky se BPH projevuje symptomy dolních cest močových (LUTS). Operační léčbu BPH indikujeme u pacientů, kteří mají těžké obstrukční příznaky a nereagují na konzervativní léčbu. K absolutním indikacím operační léčby patří: refrakterní močová retence s ureterohydronefrózou a retencí dusíkatých látek, kdy je však nejdříve nutná úprava renálních funkcí při zavedeném permanentním katetru a až poté operační řešení, dále při cystolitiáze, recidivujících uroinfekcích, recidivující makrohematurii a při výrazných subjektivních obtížích pacienta. V tomto přehledném článku se budeme zabývat stručným přehledem současných možností méně invazivních metod v léčbě BPH a budoucími možnými vyhlídkami v méně invazivní léčbě BPH.
TUMT (transurethral microwave thermotherapy)
Při této metodě využíváme působení mikrovlnné energie na tkáň prostaty, ve které se přemění mikrovlnná energie na energii tepelnou a ta vyvolá koagulační nekrózu tkáně. Dříve používaný nízkoenergetický protokol, při kterém dosahovala teplota v prostatě hodnot kolem 45 °C, je již opuštěn, výkon byl sice velice dobře tolerován, nicméně dlouhodobé výsledky nebyly uspokojivé a ukázaly velmi vysoké procento selhání po provedení tohoto typu výkonu (u 25–70 % pacientů [1]). Dnes se již výhradně používá vysokoenergetický protokol, při kterém se v prostatické tkáni generují teploty kolem 80 °C. K dispozici je v současnosti mnoho přístrojů od různých firem: Prostatron™, Targis™, CoreTherm™ nebo TMx-2000™, nejčastěji používaný je však Prostatron™.
Všechny přístroje mají podobné vybavení, obsahují terapeutický modul s generátorem mikrovlnné energie, jednotku měřící teploty v tkáni a chladící systém. K přenosu vln se užívá speciální katetr, který má na svém konci balonek. Balonek se po zavedení katetru nafoukne a umístí se do hrdla močového měchýře, dále katetr obsahuje aktivní část, která je uložena pod balonkem a při zavedeném katetru se tedy nachází v prostatické uretře. Tato část emituje mikrovlnné záření a působí terapeuticky na tkáň prostaty (obr. 1). K registraci teploty slouží tepelné senzory v rektu, tyto senzory kontinuálně registrují teplotu a brání před tepelným poškozením ostatních orgánů a okolí prostaty. Poškození uretry brání laváž prováděná chladícím roztokem. Výkon lze provést v lokální anestezii, tedy i ambulantně.
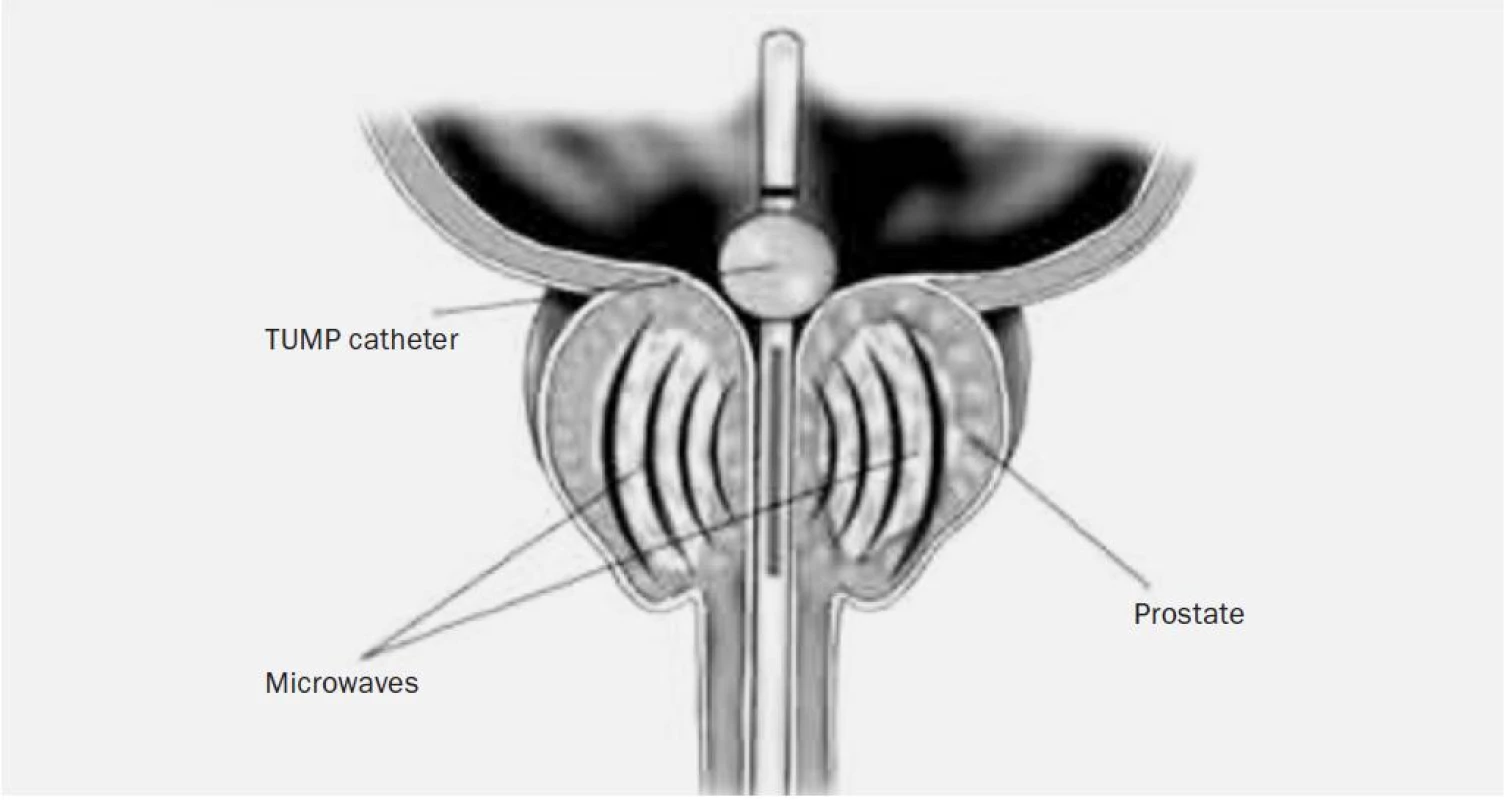
K nejčastějším komplikacím patří pooperační retence, která vyžaduje průměrně 14denní katetrizaci, z pozdních komplikací patří k nejzávažnějším iritační příznaky, které u 1/3 nemocných mohou přetrvávat i 1 rok po provedení léčby [2]. V současnosti je k dispozici několik randomizovaných studií. Porovnáme-li tuto metodu s TURP, dochází po 12 měsících k poklesu hodnoty IPSS skóre o 65 % u pacientů léčených TUMT a o 77 % u skupiny léčené TURP. U hodnoty Qmax byl zaznamenán vzestup u skupiny léčené TURP o 119 %, kdežto u skupiny TUMT jen o 70 % [3]. Při dlouhodobém sledování v prospektivní, multicentrické, randomizované studii [4] srovnávající TUMT a TURP u pacientů sledovaných 5 let nebyl zaznamenán statisticky signifikantní rozdíl v hodnotách Qmax a IPSS mezi těmito sledovanými skupinami. Z dalších výsledků studie stojí za zmínku úspěšnost této metody: ve skupině léčené TUMT byla u 10 % pacientů nutnost provedení jiné léčby, kdežto ve skupině léčené TURP byla potřeba jiné léčby zaznamenána pouze u 4,3 %.
Podle EAU guidelines je tato metoda velice dobře tolerována, je velice účinná, s nízkou morbiditou, vhodná především u pacientů s vysokým operačním rizikem nebo u pacientů nereagujících na medikamentózní léčbu a preferujících jiné než operační řešení.
HIFU (High intensity focused ultrasound)
Ultrazvukové vlnění, které se využívá při běžném ultrazvukovém vyšetření, prochází neškodně tkáněmi, aniž by poškozovalo či jinak ovlivňovalo zasaženou tkáň. Pokud je však ultrazvukový paprsek o dostatečné energii zacílen do jednoho centra, vyvolá v něm vzrůst teploty. Při této metodě se využívá účinku ultrazvukového vlnění o frekvenci 3,5 MHz s ohniskovou vzdáleností přibližně 4 cm, toto vlnění je emitováno přes transrektální ultrazvukovou sondu do ohniska zacíleného v prostatické tkáni a jeho účinek lze rozdělit na mechanický a termický. V ohnisku díky termickému účinku vznikají teploty kolem 80 °C, ale teplotní gradient mezi ohniskem a okolní tkání je poměrně vysoký, a proto nedochází k teplotnímu poškození okolní tkáně mimo ohnisko, v ohnisku dochází k vytvoření ložiska koagulační nekrózy eliptického tvaru o velikosti 10 × 2 mm, dále zde spolupůsobí i mechanická složka, která pracuje na podobném principu jako extrakorporální piezoelektrický lithotriptor využívající fenoménu kavitace. Výhodou je, že během zákroku lze kontrolovat hranice nekrózy na diagnostickém ultrazvuku, který je součástí zařízení.
Z komplikací bývají nejčastěji uváděny: močová retence, která u většiny pacientů přetrvává průměrně 7 dní, dále může pooperačně dojít k rozvoji makrohematurie a hemospermie. Xu [5] ve své práci zahrnující 3leté sledování 256 pacientů zaznamenal výrazné zlepšení hodnot IPSS a QoL skóre a zmenšení objemu prostaty. Nutnost provedení reoperace jinou metodou, například provedením TURP, uvádí u 6 % pacientů, oproti tomu Madersbacher [6] udává nutnost reoperace u 44 % pacientů. Dále ve své práci uvádí zlepšení hodnoty IPSS z 20 na 8,5 a po dobu 4 let tato hodnota pouze mírně kolísala. U hodnot Qmax došlo pooperačně ke zlepšení z 9,1 ml/s na 11,8 ml/s během jednoho roku, ale během 4 let k opětovnému poklesu na 10,2 ml/s.
Tato metoda je tedy relativně efektivní, bezpečná a většinou dobře tolerovaná, bez výskytu vážnějších komplikací. V EAU doporučeních však metoda HIFU není zmiňována v léčbě BPH. Tuto metodu nelze považovat za vhodnou alternativu k TURP nebo otevřené prostatektomii u pacientů indikovaných k operační léčbě.
TUNA (Transurethral needle ablation )
Tuto metodu řadíme spolu s HIFU a TUMT k takzvaným termickým metodám. Metoda využívá radiofrekvenční vlny o nízké frekvenci (490 kHz), v prostatické tkáni se tato energie transformuje na tepelnou energii, která vyvolává koagulační nekrózu přechodné zóny prostaty, během výkonu však nedochází k poškození sliznice uretry. Z dalších neméně důležitých účinků je třeba jmenovat destrukci alfa-adrenergních receptorů v tkáni prostaty. Výhodou této metody je možnost provedení výkonu pouze v lokální anestezii, tedy i případná možnost ambulantního provedení výkonu. Výkon se provádí pod optickou kontrolou, kdy se do obou laloků prostaty postupně provede série vpichů vzdálených od sebe cca 1 cm. Aktivní elektrodu tvoří dvě jehly (obr. 2), které se vysouvají ze speciálně upraveného katetru zavedeného přes uretrocystokop do oblasti prostatické uretry. Délka vysunutí jehel se určuje podle příčného průměru prostaty zjištěného pomocí TRUS. Dále je zapotřebí pasivní elektrody, která je uložena pod nemocným.
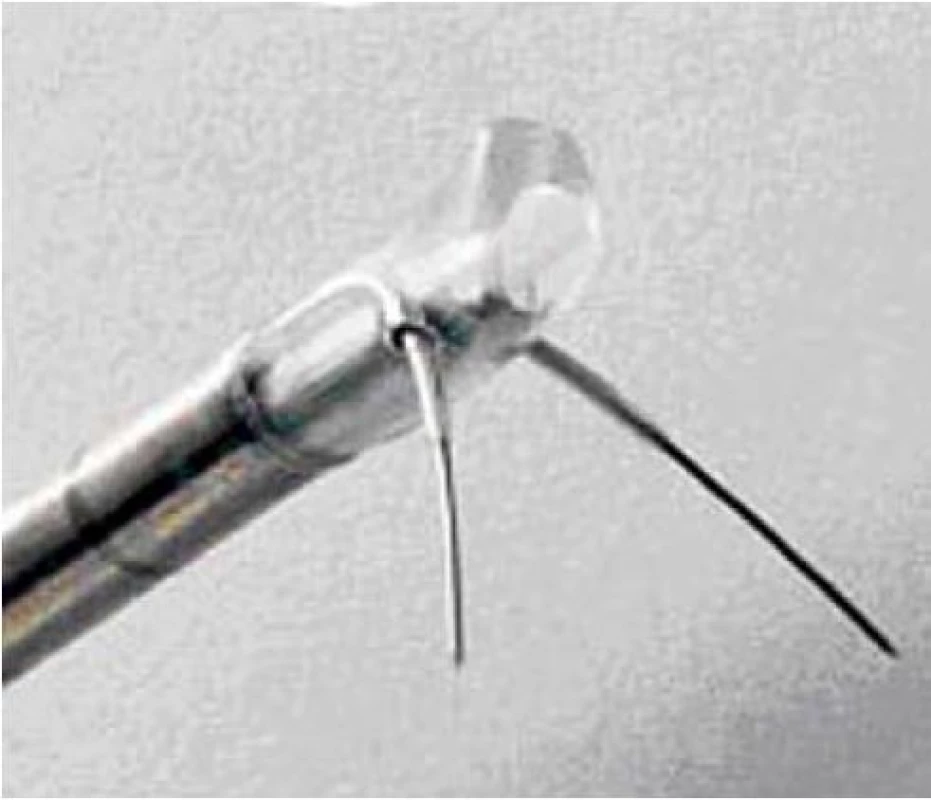
K nejčastějším komplikacím patří pooperační retence, která postihuje 13–40 % pacientů a odezní za 1–3 dny, iritační symptomy mohou přetrvávat 4–6 týdnů a také se může objevit přechodná hematurie [7]. V porovnání s TURP popsal Bruskewitz [8] ve své prospektivní randomizované multicentrické studii signifikantní zlepšení IPSS skóre, postmikčního rezidua i maximálního průtoku moči (Qmax). Zlepšení Qmax však bylo u skupiny léčené metodou TURP podstatně větší. Zlotta [9], který sledoval dlouhodobé výsledky této metody, udává po 5 letech od výkonu 58% zlepšení IPSS a 41% zlepšení Qmax, u 21 % pacientů bylo však nutné přistoupit k jiné léčebné metodě. Oproti tomu Benoist [10] udává ve své studii nutnost další léčby u 46 % pacientů po 20 měsících od operace.
Ze studií provedených v České republice lze zmínit práci publikovanou v roce 2002 [11], hodnotící prvotní výsledky tohoto léčebného postupu. Pacienti byli sledováni jeden rok od výkonu, do studie bylo zahrnuto 10 pacientů, u kterých bylo rok po výkonu zaznamenáno zlepšení hodnoty IPSS skóre z původních 19,5 na 7,5 a úprava hodnoty Qmax z 8,6 na 11,3 ml/s. Průměrná délka hospitalizace činila 4,3 dne, nebyly zaznamenány žádné závažné komplikace, z nezávažných komplikací se u 6 pacientů objevily dysurické potíže, u jednoho pacienta došlo k rozvoji pooperační makrohematurie a u jednoho pacienta se rozvinula uroinfekce.
Podle EAU je tato metoda vhodná u polymorbidních pacientů, kteří nejsou schopni celkové anestezie, není vhodná u pacientů s prostatou větší než 75 ml a u izolované sklerózy hrdla močového měchýře. Nicméně je poměrně bezpečnou a jednoduchou metodou, avšak důkazy o dlouhodobé účinnosti jsou sporné. Proto rozhodně není doporučována jako metoda první volby v léčbě BPH.
Stenty
Intraprostatické stenty se používají k zajištění dostatečně volně průchodné močové trubice v oblasti prostatické uretry u pacientů neschopných operačního výkonu z interního hlediska, nebo jako přechodné řešení, než dojde k interní stabilizaci stavu a následné operaci, nebo po jiném typu operačního výkonu na prostatě, který způsobí dočasný otok tkáně prostaty. Intraprostatická spirála umožňující mikci byla poprvé popsána Fabianem v roce 1980.
Při použití stentů musí být splněna důležitá podmínka, a tou je přítomnost funkčního detruzoru, močový měchýř tedy musí mít schopnost se sám vyprázdnit. Stenty dělíme na trvalé a dočasné. Trvalé stenty jsou vyrobeny z biokompatibilních materiálů, umožňujících kompletní reepitalizaci uretry. Jedná se převážně o kovové spirály nebo síťované endoprotézy tvořené z různých inertních kovů či jejich slitin (obr. 3). Dočasné stenty mohou být biostabilní nebo biodegradabilní, oproti trvalým stentům nereepitelizují a slouží pouze k překlenutí doby, než pacient bude schopen invazivnější chirurgické léčby, nebo k překlenutí pooperační retence po jiných méně invazivních výkonech [12].

Stenty se zavádějí transuretrálně do prostatické uretry, kde zabezpečují volný průchod moči přes prostatické laloky (obr. 4). Důležité je správné určení délky stentu a jeho umístění mimo vnější uretrální sfinkter, kde by stent mohl u pacienta vyvolat stresovou inkontinenci. K dalším komplikacím, které mohou nastat kromě nevhodného místa zavedení, je dislokace stentu distálně do oblasti vnějšího uretrálního svěrače nebo do močového měchýře. Dále může dojít k inkrustaci stentu nebo může stent způsobovat recidivující infekce močových cest. Odstranění trvalých stentů z výše uvedených důvodů může být technicky náročné a je při něm zapotřebí celková anestezie.
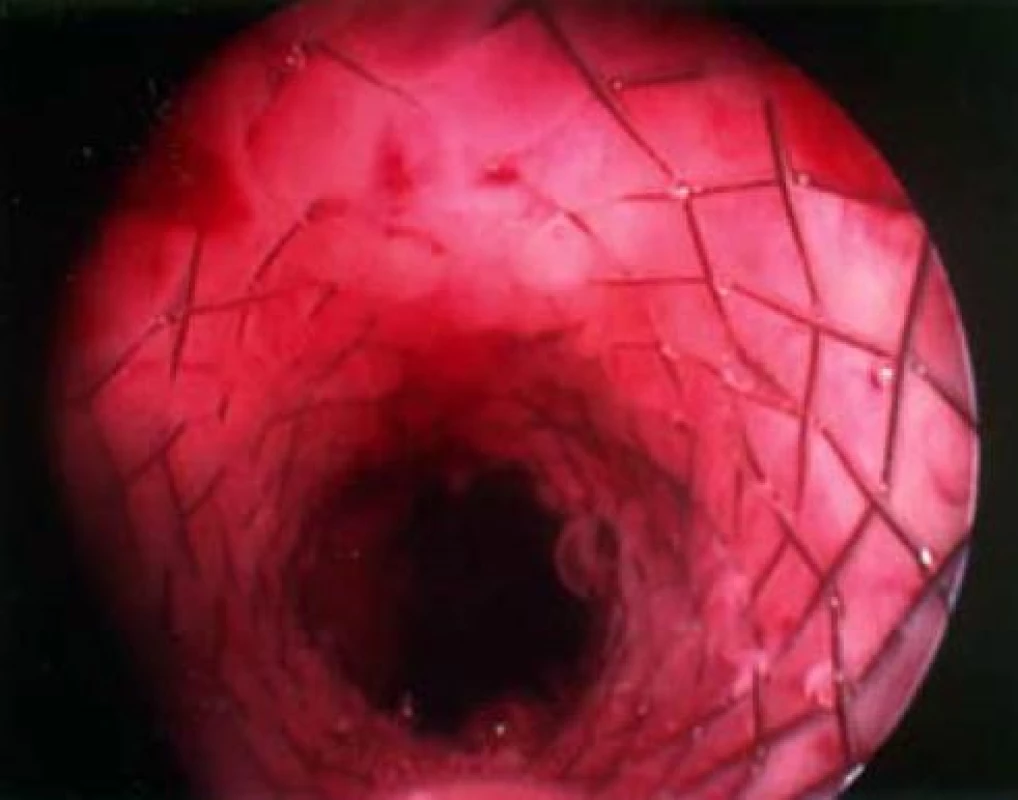
V přehledné multicentrické studii Armitage [13], sledující účinky po zavedení UroLume trvalého stentu, je uváděno zlepšení hodnoty IPSS o 10–12,4 bodu, zlepšení Qmax o 4,2–13,1 ml/s. Dlouhodobé sledování odhalilo 16% riziko selhání léčby během 1. roku, především z důvodu migrace stentu. V 5letém období sledování bylo celkové riziko selhání 27 %, je však nutné zdůraznit, že mnoho pacientů bylo ztraceno ze sledování a někteří z pacientů zemřeli z jiné příčiny, nesouvisející se subvezikální obstrukcí.
Podle doporučení EAU guidelines jsou stenty indikovány jako alternativa ke katetrizaci u pacientů s velmi vysokým rizikem operace v celkové anestezii, tedy převážně u starších polymorbidních pacientů nebo u pacientů, kteří podstoupili jinou miniinvazivní léčbu BPH a slouží jako dočasné úleva od pooperační BPO.
Lasery
V dnešní době dochází k mohutnému rozvoji a zapojení laserů do léčby BPH. Slovo LASER je zkratka pro „zesilování světla stimulovanou emisí záření“ z anglického Light Amplification by Stimulated Emission of Radiation. Laser tak obecně označuje optický zesilovač, který generuje elektromagnetické záření (světlo) pomocí procesu stimulované emise fotonů. Co dělá laserový svazek tak unikátním? Důležité je, že při procesu stimulované emise má dopadající a emitovaný foton stejnou energii (frekvenci), stejný směr, polarizaci a fázi. Z toho plynou základní tři vlastnosti laseru, které ho odlišují od jiných zdrojů záření. Svazek laseru je:
- Kolimovaný (tj. nerozbíhá se)
- Monochromatický („jednobarevný“, tj. generované fotony mají stejnou frekvenci, resp. vlnovou délku)
- Koherentní (generované fotony jsou tzv. ve fázi jak časové, tak prostorové)
Při použití laseru dochází k emisi elektromagnetického záření, které působí na tkáň prostaty. Každý laser má své jedinečné vlastnosti v závislosti na vlnové délce, se kterou pracuje. Elektromagnetická energie se absorpcí mění na energii tepelnou. V závislosti na množství energie můžeme v tkáni vyvolat koagulační nekrózu nebo přímo vaporizaci tkáně. K operacím prostaty se nejčastěji používají:
Nd: YAG laser, Ho: YAG laser, KTP: YAG laser a diodový laser.
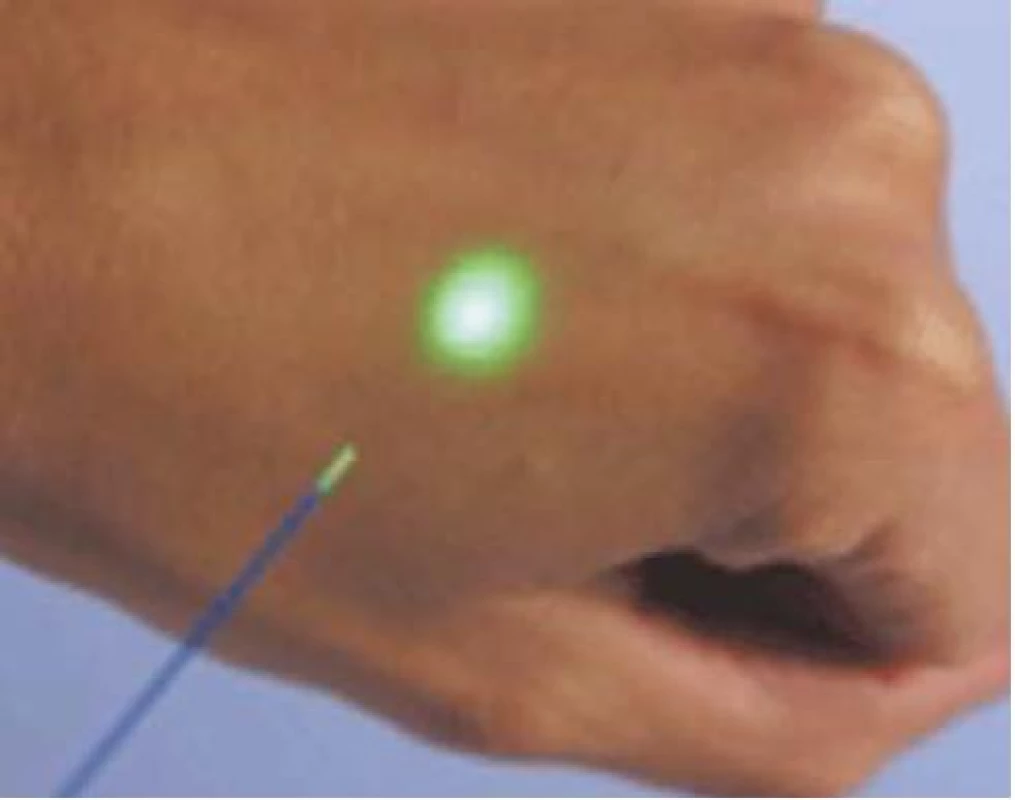
Holmium: yttrium-alumium-garnet laser (Ho: YAG laser) (obr. 5) se využívá k provedení holmium-laserové resekce (HoLRP) nebo enukleace (HoLEP) prostaty. Vlnová délka, se kterou tento laser pracuje, je 2 140 nm, což odpovídá infračervenému pásmu spektra. K zacílení laserového paprsku je tedy nutné použít druhý zaměřovací paprsek, který svou vlnovou délkou spadá do viditelné části spektra (obr. 6). Ho: YAG laser je poměrně silně vstřebáván ve vodním prostředí, což znamená, že oblast koagulační nekrózy dosahuje pouze do hloubky 0,3–0,4 mm. K účinnému provedení hemostázy je však tato hloubka dostačující. Paprsky Ho: YAG laseru umožňují precizní, přesné a velmi jemné provedení incize v prostatické tkáni.

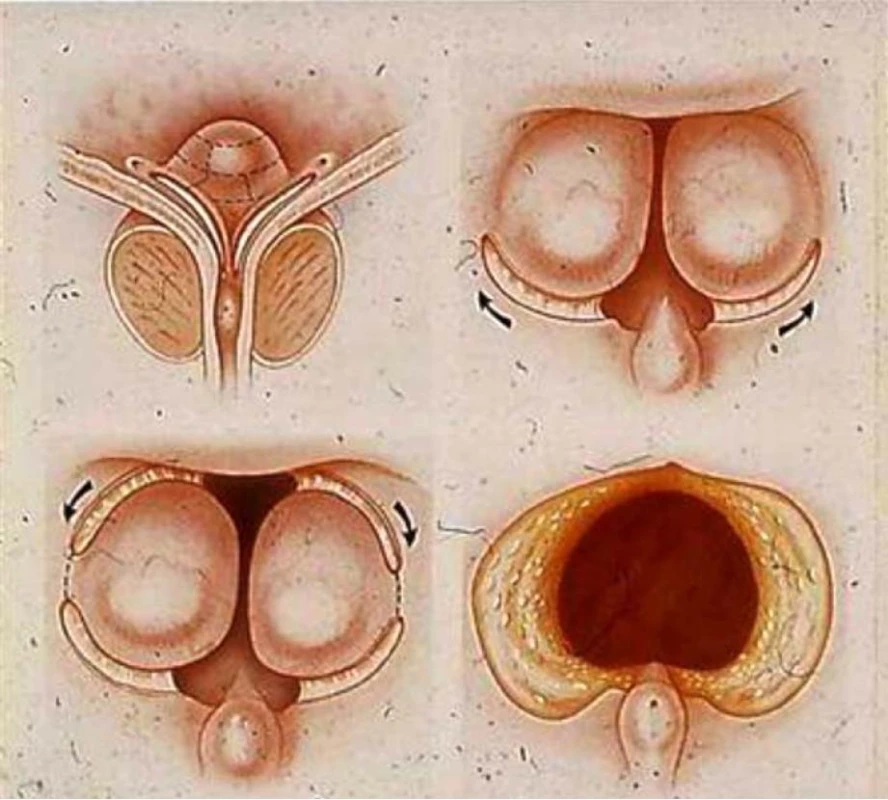
Operační výkon je prováděn ve spinální nebo celkové anestezii. Je k němu zapotřebí 550 μm široké skleněné optické vlákno, resektoskop s kontinuálním proplachem a jako irigační tekutina slouží fyziologický roztok. Operace je zahájena incizemi na č. 5 a 7, incize postupují od hrdla až ke kolikulu. Během HoLRP dochází k postupné resekci tkáně prostaty, jako je tomu u TURP, resekáty jsou poté evakuovány z močového měchýře přes pracovní kanál resektoskopu. Oproti tomu při HoLEP dochází k postupné enukleaci středního a postranních laloků prostaty a ty jsou poté v močovém měchýři morcelátorem rozmělněny a následně odsáty (obr. 7, 8, 9).
Výhodou této metody oproti ostatním laserovým technikám je možnost histologického vyšetření resekované tkáně, i když jeho množství může být o 20–40 % menší než po TURP, jelikož dochází k jeho částečné vaporizaci při výkonu.
Nebyly popsány žádné závažné peroperační ani pooperační komplikace této metody. Pooperační komplikace bývají vzácné a pouze lehké, k nejčastějším patří makrohematurie a dysurické potíže, z pozdějších komplikací jsou uváděny především stenózy hrdla a striktury uretry. Ve studii srovnávající dlouhodobé účinky HoLRP a TURP Westenberg [14] neudává po 4 letech sledování žádný statisticky významný rozdíl v urodynamických hodnotách mezi oběma metodami. Dále byla u HoLEP zaznamenána signifikantně kratší délka katetrizace, délka hospitalizace i pooperační morbidity, ovšem u HOLEP byl zaznamenán signifikantně delší operační čas než u TURP. Ve studiích srovnávajících HoLEP a otevřenou prostatektomii (OP) dosahují obě metody při dlouhodobém sledování srovnatelných výsledků [15].
Závěrem lze říci, že HoLEP/HoLRP je bezpečnou a efektivní metodou se srovnatelnými výsledky v porovnání s TURP/OP. Lze ji použít i u pacientů na antikoagulační terapii, kterou nelze před výkonem z interních důvodů vysadit. Je však nutná spinální nebo celková anestezie, další nevýhodou je obtížnější provedení, které vyžaduje zkušeného operatéra k úspěšnému a bezpečnému provedení výkonu a v neposlední řadě je nevýhodou i poměrně vyšší cena výkonu než je tomu u klasického TURP. Prof. Kuntz však metodu HoLEP ve své přednášce na EAU konferenci 2013 v Miláně označil za „švýcarský nůž“ urologa a současně udává, že má potenciál stát se novým zlatým standardem v léčbě BPH.
Fotoselektivní vaporizace prostaty (PVP) využívá Nd: YAG laser, který má vlnovou délku 1046 nm, paprsek tohoto laseru prochází skrz kalium-titanyl-fosfátový (KTP) krystal, který zdvojnásobuje frekvenci, ale zmenšuje vlnovou délku na polovinu, tedy na 523 nm, což odpovídá zelenému barevnému světelnému spektru, proto se někdy užívá název Greenlight laser. Tento laser má odlišné vlastnosti než Ho: YAG laser, především není pohlcován ve vodním prostředí, je však významně pohlcován hemoglobinem, což mu v prostatické tkáni, která je bohatě vaskularizovaná, zajišťuje výborné hemostatické vlastnosti. Hloubka absorpce v prostatické tkáni činí 1–3 mm. Výhodou tohoto laseru je poměrně rychlá vaporizace tkáně s nízkou penetrací energie do hlubších vrstev, a tím pádem nízký stupeň poškození okolní tkáně. Náhlým zvýšením teploty v prostatické tkáni dochází v buňkách k tvorbě vakuol s následnou dezintegrací buněk a vaporizací prostatické tkáně.
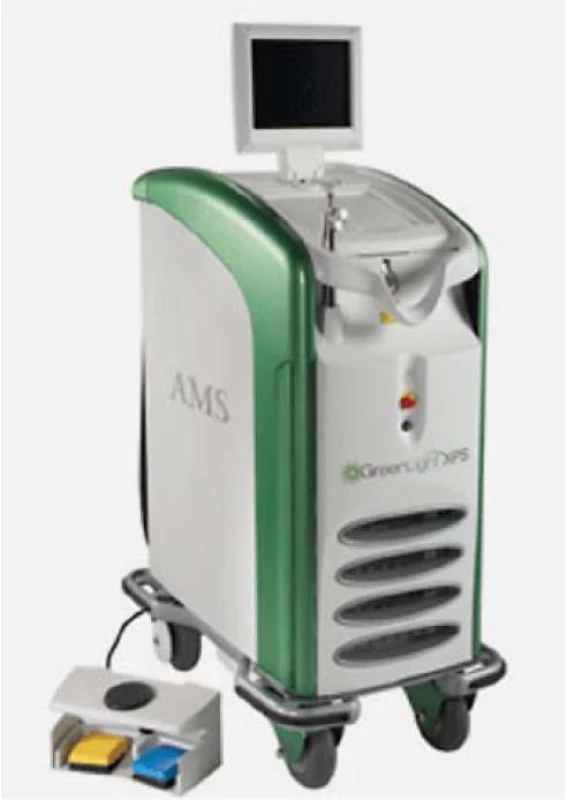
Operace se provádí ve spinální nebo celkové anestezii, po vytvoření pracovního kanálu se postupně vaporizují postranní laloky prostaty od hrdla k apexu kyvadlovitými laterálními pohyby vláknem. Následně se provede ablace apexu a středního laloku s vytvořením kavity podobně jako při TURP [16]. Nejvíce užívaným typem je 80W KTP laser. V roce 2007 se na trhu objevil 120W HPS laser, který je vybavený lithium-triborátovým krystalem a dále vláknem umožňujícím produkci více soustředěného paprsku. Nyní je nově od roku 2010 k dispozici i 180W (XPS) laser (obr. 10), který je již vybaven vláknem chlazeným kapalinou. Toto vlákno produkuje o 50 % větší paprsek, což umožňuje rychlejší provedení vaporizace.
Al-Ansari [17] srovnává účinnost a bezpečnost 120W HPS laseru a TURP po dobu 3 let u 120 pacientů, v této práci nebyla zaznamenána žádná peroperační komplikace oproti TURP. Ve skupině léčené TURP došlo u 3 pacientů k rozvoji TUR syndromu, u 10 došlo k perforaci kapsuly a u 12 bylo zapotřebí krevní transfuze. Pokud se podíváme na výskyt časných komplikací, u 93 % pacientů léčených PVP se vyskytovaly dysurické potíže, kdežto u TURP pouze ve 31 %, v dlouhodobém sledování byla potřeba reoperace u 11 % po PVP a pouze u 1,8 % po TURP, rozdíl výskytu stenózy hrdla močového měchýře nedosahoval statisticky významné hodnoty.
Závěrem lze říci, že tato technika dosahuje vynikající peroperační bezpečnosti a významné dlouhodobé účinnosti. Výhodou je možnost užití této metody i u pacientů užívajících perorální antikoagulační léčbu. Podle doporučení EAU je tato metoda vhodná k léčbě BPH u pacientů s velikostí prostaty nad 30 ml a právě u pacientů na antikoagulační terapii.
Intersticiální laserová koagulace (ILC) využívá paprsků Nd: YAG laseru nebo diodového laseru s vlnovou délkou 830 nm. Nyní s nástupem Ho: YAG laseru a KTP: YAG laseru ustupuje tato metoda do pozadí. Podstatou ILC je vytvoření koagulační nekrózy v prostatické tkáni za použití speciální sondy, která je transuretrálně pod optickou kontrolou zaváděna přímo do tkáně prostaty (obr. 11). Současně je nutná monitorace teploty v tkáni prostaty a podle potřeby počítač automaticky reguluje výkon přístroje. Paprsky laseru se difuzně šíří adenomem prostaty a vyvolávají nekrózu tkáně, během výkonu nedochází k poškození sliznice uretry. Nekrotická tkáň, která se po výkonu v prostatě vytvoří, není odlučována do uretry, ale je postupně resorbována. Díky tomu nedochází k rozvoji iritačních příznaků, jako je tomu u jiných metod využívajících laser. Výkon lze provést v lokální i celkové anestezii. Počet vpichů je určen velikostí prostaty. Jedním vpichem lze koagulovat 5–10 g tkáně. Metoda je velmi šetrná, nevýhodou je však nutnost pooperační katetrizace, která může trvat 18–30 dní, k dalším komplikacím patří vyšší riziko vzniku uroinfekce a mírné hematurie [18,19]. V EAU doporučeních již tato metoda není zmiňována jako možnost léčby BPH.
V poslední době se začíná do klinické praxe dostávat thulium: YAG laser (Tm: YAG). Tento laser lze využít při vaporizaci, resekci i enukleaci prostaty, pracuje na vlnové délce 2000 nm, má obdobné absorpční vlastnosti jako laser holmiový, ale je snížena hloubka jeho penetrace na 0,25 mm, má vynikající hemostatické vlastnosti. Je tedy poměrně bezpečný a účinný. Během výkonu dochází k relativně malým krevním ztrátám, je zapotřebí krátká doba katetrizace i hospitalizace. Resekce prováděné pomocí Tm:YAG laseru jsou technicky méně náročné než je tomu u HoLRP [20]. Zatím však nejsou k dispozici dlouhodobější randomizované studie k posouzení bezpečnosti a účinnosti. EAU doporučení se o této metodě zatím nezmiňují a není zahrnuta v léčbě BPH.
Intraprostatická injekce etanolu
Je to metoda, při které se do prostatické žlázy injekčně vpravuje 95–98% etanol, který v tkáni prostaty způsobí zánětlivou reakci s následnou koagulační nekrózou a denaturací proteinů, rozpad buněčných membrán, atrofii prostatické tkáně a následně vytvoření kavity v oblasti prostatické uretry během 7 dnů od výkonu. Současně dochází k poškození senzorických nervových zakončení v prostatické tkáni. Aplikace etanolu může být provedena transuretrálně, transperineálně nebo transrektálně. Jako nejčastější přístup ve většině studií byla zvolena transuretrální aplikace. Transurethral ethanol ablation of the prostate (TEAP) se provádí sérií injekcí 3–5 ml 98% etanolu na č. 3 a 9. Zatím však není vypracováno žádné detailní schéma, které by stanovovalo přesný počet a rozestupy jednotlivých injekcí etanolu do prostatické tkáně. Po výkonu je vhodné krátkodobé zavedení katetru.
Co se týče účinnosti této metody, většina studií demonstruje signifikantní redukci PVR a LUTS, zlepšení Qmax a dále redukci objemu prostatické tkáně. Žádná ze studií však zatím nebyla randomizována s TURP či jinou metodou léčby BPH. Navíc po 1–2 letech od aplikace došlo u většiny pacientů opět ke zvětšení objemu prostaty, avšak Qmax a LUTS i přesto zůstávají významně zlepšeny oproti stavu před operací [21]. Při dlouhodobém sledování (3 roky) se nutnost reoperace pohybuje okolo 41 % [21]. Z komplikací je vhodné jmenovat především riziko nekrózy hrdla, které vzniká nevhodnou injekcí etanolu v jeho blízkosti, z méně závažných jsou to především iritační symptomy, močová retence, hematurie a močová infekce.
Podle EAU doporučení je tato metoda zatím považována za experimentální. Je třeba dalšího výzkumu, provedení randomizovaných studií s dlouhodobým sledováním pacientů, aby mohla být určena bezpečnost a především účinnost této metody.
Intraprostatická injekce botulinového neurotoxinu typu A (BoNTA)
Botulinotoxin je produktem bakterie Clostridium botulinum. Známe 7 podtypů tohoto toxinu, v humánní medicíně se využívají pouze podtypy A a B. BoNTA indukuje v tkáni prostaty apoptózu prostatických buněk, která způsobí zmenšení velikosti prostaty. Rovněž dochází ke snížení počtu alfa1 adrenergních receptorů v prostatě, čímž dochází k relaxaci hladkých svalových buněk. Současně toxin blokuje uvolňování acetylcholinu na nervové ploténce, čímž ovlivňuje relaxaci hladkých svalových buněk.
Aplikace se provádí pod UTZ kontrolou, kdy je do parenchymu prostaty injikován botulinotoxin A. Aplikace může probíhat transperineálně, transuretrálně nebo transrektálně. Nejčastěji popsaným způsobem aplikace je transperineální přístup. Přesná dávka a způsob ředění se v jednotlivých studiích liší ( 100–300 jednotek Botox, 300–600 jednotek Dysport), ředění se pohybuje od 22 do 75 jednotek/ml, významnou roli má také samotná velikost prostaty [22].
Efekt léčby byl ověřen ve 2 randomizovaných placebem kontrolovaných studiích. Byla zaznamenána redukce IPSS o 46–62 %, Qmax se zlepšil o 27–81 % a velikost prostaty se zmenšila o 14–61 % [23,24]. Dlouhodobé výsledky zatím nejsou k dispozici, z komplikací se mohou objevit dysurické potíže, hematurie a u malé části pacientů se může vyskytnout nutnost krátkodobého zavedení permanentního katetru.
BoNTA se zdá být bezpečnou, dobře tolerovanou, slibnou a rychlou metodou léčby. Před dalším zavedením do širší medicínské praxe je však nutné provést další studie s dlouhodobým sledováním pacientů k ověření bezpečnosti a účinnosti této metody. Podle doporučení EAU je tato metoda zatím zmiňována jako experimentální.
Jako novinky v miniinvazivní léčbě BPH prezentované letos na EAU kongrese v Milánu lze uvést 2 techniky. Je to především léčba BPH pomocí paprsku vodní páry a dále zavedení speciálního implantátu do tkáně prostaty s názvem UroLift. V EAU doporučeních zatím o těchto metodách není pochopitelně žádná zmínka.
Transurethral water vapor therapy (Rezūm™)
Principem této metody je cílená instilace paprsku vodní páry do tkáně prostaty. Provádí se v litotomické poloze za použití speciálního instrumentaria pod přímou optickou kontrolou (obr. 12). Pomocí speciálního aplikátoru se do středního, levého i pravého prostatického laloku postupně vpraví 1–3 injekce vodní páry, v závislosti na velikosti prostaty. Po výkonu je zaveden permanentní katetr, který lze po několika dnech extrahovat.

Zatím byly prezentovány prvotní výsledky pilotní studie, prováděné v americko-české spolupráci. Celkově bylo do studie zahrnuto 30 pacientů z 2 center, kteří podstoupili tento typ léčby BPH. U pacientů byl sledován Qmax, QoL a IPSS, dále byla měřena velikost prostaty pomocí MRI. Po 3 měsících byl zaznamenán pokles IPSS z 23,2 na 8,4, tj. o –64 %, zlepšení Qmax Z 8,4 na 11,9, tj. o +42 %. Přesné, aktualizované výsledky budou prezentovány v plánovaném článku zabývajícím se speciálně touto metodou. Z výsledků této studie vyplývá, že se jedná o velice efektivní a rychlou metodu, při které dochází ke kontrolované ablaci prostaty. Samotný operační výkon trvá přibližně 5 minut, rozsah ablace lze snadno verifikovat pomocí MRI. Po výkonu došlo u pacientů k signifikantnímu zlepšení IPSS, QoL, Qmax a PVR během 6 měsíců. Z komplikací se nejčastěji vyskytují krátkodobá akutní močová retence a iritační mikční symptomy [25].
Metoda se podle předběžných výsledků zdá jako velice slibná a lze usuzovat, že je velice perspektivní jako nový způsob léčby BPH, je však třeba dalších studií a dlouhodobého sledování k přesnému ověření účinnosti a bezpečnosti této metody. Podrobnější informace jsou dostupné na následujícím internetovém odkazu, rovněž je zde k dispozici krátké instruktážní video zachycující celý operační postup: http://www.rezum.com/for-medical-professionals/the-rezum-system.
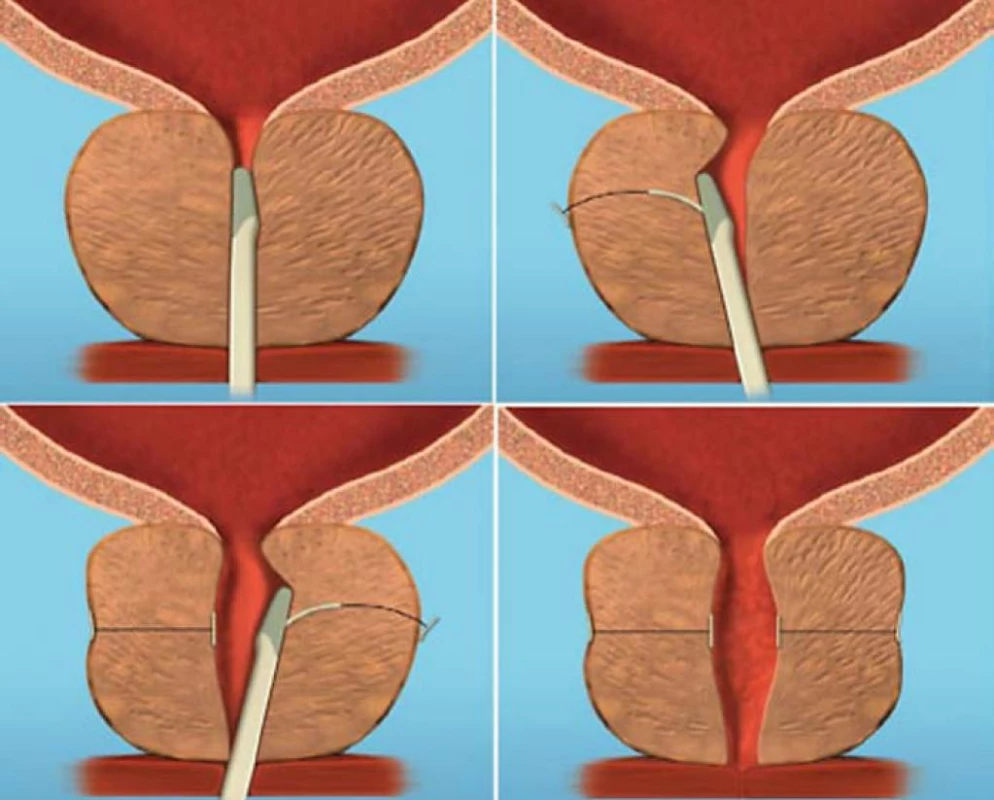
Urethral Lift (PUL, Urolift)
Jedná se o metodu, při které se do prostatické tkáně zavádějí speciálně upravené implantáty. Zavádějí se pod endoskopickou kontrolou přímo do prostatické žlázy přes prostatickou uretru (obr. 13), mají za úkol oddálit od sebe prostatické laloky a zrušit tak příčinu subvezikální obstrukce. Implantáty se zavádějí ventrolaterálně do levého i pravého laloku prostaty a zasahují od uretry až za prostatické pouzdro. Podle předběžných výsledků došlo do 2 týdnů od výkonu k subjektivní úlevě od potíží, sledování trvalo 6 měsíců, během kterých došlo k významnému zlepšení sledovaných parametrů (pokles IPSS z 19,2 ± 6,6 na 5,8 ± 3,3, pokles PVR z 281,1 ± 451,5 na 34,3 ± 36,6, zvýšení Qmax z 11,9 ± 4,4 na 18,4 ± 9,5 ). Nebyl hlášen žádný případ SUI nebo retrográdní ejakulace a pouze u 2 pacientů bylo nutné provedení TURP pro nedostatečný efekt [26]. K ověření výsledků je však třeba provést další studie a dlouhodobě sledovat tyto pacienty ke zjištění bezpečnosti této metody.
MUDr. Roman Wasserbauer
Urologická klinika FN Brno
Jihlavská 20, 625 00 Brno
roman.wasserbauer@fnbrno.cz
Sources
1. Ponholzer A, Marszalek M, Madersbacher S. Minimally invasive treatment of BPH: an update. EAU Update Series 2004; 2 : 24–33.
2. Tubaro A, Vicentini C, Renzetti R, Miano L. Invasive and minimally invasive treatment modalities for lower urinary tract symptoms: what are the relevant differences in randomised controlled trials. Eur Urol 2000; 38 (Suppl 1): 7–17.
3. Hoffman RM, Monga M, Elliot S et al. Microwave thermotherapy for benign prostatic hyperplasia. Cochrane Database Syst Rev 2007; (4): CD004135.
4. Mattiasson A, Wagrell L, Schelin S et al. Five-year follow-up of feedback microwave thermotherapy versus TURP for clinical BPH: a prospective randomised multicenter study. Urology 2007; 69(1): 91–6.
5. Xu WF, Zhang HB, Lin Z et al. Transrectal high-intensity focused ultrasound for treatment of benign prostatic hyperplasia: report of 262 cases. Nan Fang Yi Ke Da Xue Xue Bao. 2010; 30(8): 1906–1908.
6. Madersbacher S, Schatzl G, Djavan B, Stulnig T, Marberger M. Long-term outcome of transrectal highintensity focused ultrasound herapy for benign prostatic hyperplasia. Eur Urol 2000; 37 : 687–694.
7. Chapple CR, Issa MM, Woo H. Transurethral needle ablation (TUNA). A critical review of radiofrequency thermal therapy in the management of benign prostatic hyperplasia. Eur Urol 1999; 35 : 119–128.
8. Bruskewitz R, Issa MM, Roehrborn CG et al. A prospective, randomized 1-year clinical trial comparing transurethral needle ablation to transurethral resection of the prostate for the treatment of symptomatic benign prostatic hyperplasia. J Urol 1998; 159 : 1588–1594.
9. Zlotta AR, Giannakopoulos X, Maehlum O, Ostrem T, Schulman CC. Long-term evaluation of transurethral needle ablation of the prostate (TUNA) for treatment of symptomatic benign prostatic hyperplasia: clinical outcome up to five years from three centers. Eur Urol 2003; 44 : 89–93.
10. Benoist N, Bigot P, Colombel P et al. Tuna: Clinical retrospective study addressing mid-term outcomes. Prog Urol 2009; 19(1): 54–9.
11. První zkušenosti s metodou TUNA (transurethral needle ablation) při léčbě BPH v ČR, P. Kumstát, D. Pacík, Urologická klinika FN Brno-Bohunice, Ces Urol 2002; 6 (1): 12–16.
12. Vanderbrink BA, Rastinehad AR, Badlani GH. Prostatic stents for the treatment of benign prostatic hyperplasia. Curr Opin Urol 2007; 17(1): 1–6.
13. Armitage JN, Cathcart PJ, Rashidian A et al. Epithelializing Stent for Benign Prostatic Hyperplasia: A Systematic Review of the Literature. J Urol 2007 May; 177(5): 1619–1624.
14. Westenberg A, Gilling P, Kennett K et al. Holmium laser resection of the prostate versus transurethral resection of the prostate: results of a randomised trial with 4-year minimum long-term followup. J Urol 2004 Aug; 172(2): 616–619.
15. Kuntz RM, Lehrich K, Ahyai SA. Holmium laser enucleation of the prostate versus open prostatectomy for prostates greater than 100 grams: 5-year follow-up results of a randomised clinical trial. Eur Urol 2008 Jan; 53(1): 160–166.
16. Rieken M., Bachmann A. Vaporizace prostaty pomocí zeleného laseru (GreenLight laser) – zkušenost z jednoho centra po provedení více než 1 000 výkonů, Urol List 2012; 10(4): 22–26.
17. Al-Ansari A et al. GreenLight HPS 120-W laser vaporization versus transurethral resection of the prostate for treatment of benign prostatic hyperplasia: a randomized clinical trial with midterm follow-up. Eur Urol. 2010 Sep; 58(3): 349–55.
18. Babjuk M, Dvořáček J, Janský M et al. Transuretrální intersticiální laserová koagulace a její využití v léčbě benigní hyperplazie prostaty. Endoskopie 2000; 9 : 4–7.
19. Kursh ED, Concepcion R, Chan S et al. Interstitial laser coagulation versus transurethral prostate resection for treating benign prostatic obstruction: a randomized trial with 2-year follow-up. Urology 2003; 61 : 573–578.
20. Herrmann T et al. Thulium laser enucleation of the prostate (ThuLEP): transurethral anatomical prostatectomy with laser support. Introduction of a novel technique for the treatment of benign prostatic obstruction World J Urol 2010; 28 : 45–51.
21. Goya N, Ishikawa N, Ito F et al. Transurethral ethanol injection therapy for prostatic hyperplasia: 3-year results. J Urol 2004; 172(3): 1017–20.
22. Nikoobakht M, Daneshpajooh A, Ahmadi H et al. Intraprostatic botulinum toxin type A injection for the treatment of benign prostatic hyperplasia: initial experience with Dysport. Scand J Urol Nephrol 2010; 44(3): 151–7.
23. Maria G, Brisinda G, Civello IM et al. Relief by botulinum toxin of voiding dysfunction due to benign prostatic hyperplasia: results of a randomised, placebo-controlled study. Urology 2003; 62(2): 259–64.
24. Kuo HC, Liu HT. Therapeutic effects of add-on botulinum toxin A on patients with large benign prostatic hyperplasia and unsatisfactory response to combined medical therapy. Scand J Urol Nephrol 2009; 43(3): 206–11.
25. Dixon C, Rijo CE, Pacik D, Vit V, Varga V et al. Transurethral water vapor therapy for BPH; initial clinical results of the first in man trial and Rezūm™ I pilot study. European Urology Supplements, Volume 12, Issue 1 , Page e631, March 2013.
26. Miller F, Schönthaler M et al. The Prostatic Urethral Lift (PUL), a minimal-invasive transurethrally-placed implant, proves its efficacy in the treatment of LUTS in patients with BPH in daily clinic practice outside of studies, European Urology Supplements Volume 12, Issue 1, Pages e629–e630, March 2013.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2013 Issue 2
-
All articles in this issue
- Patofyziologie vzniku BPH – vývoj hypotéz a teorií, současnost a perspektivy
- Farmakoterapie LUTS/BPH v každodenní klinické praxi. Jak vybrat optimální alternativu?
- Současná realita a budoucí možné výhledy méně invazivních technologií v léčbě BPH
- Možnosti léčby a profylaxe recidivujících infekcí dolních močových cest
- Litotrypse rázovou vlnou versus ureteroskopie při léčbě ureterolitiázy: prospektivní hodnocení výsledků uváděných pacienty
- Urological Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Možnosti léčby a profylaxe recidivujících infekcí dolních močových cest
- Farmakoterapie LUTS/BPH v každodenní klinické praxi. Jak vybrat optimální alternativu?
- Litotrypse rázovou vlnou versus ureteroskopie při léčbě ureterolitiázy: prospektivní hodnocení výsledků uváděných pacienty
- Současná realita a budoucí možné výhledy méně invazivních technologií v léčbě BPH
