Aktivní přístup k časné detekci karcinomu prostaty – co je smysluplné a co již škodlivé
Active approach to prostate cancer detection – what is reasonable and what may cause harm
Active approach to prostate cancer detection – what is reasonable and what may cause harm
Despite the continuously improving diagnostics, prostate cancer represents the second most common cause of death from malignancy in men in the Czech Republic. Beginning in the 1980´s the first attempts of systematic screening were made by introducing regular check-ups using digital rectal examination and ultrasound screening, then in the 1990´s prostate specific antigen (PSA) appeared on stage, which meant a real breakthrough in the early detection of prostate cancer. Currently screening is routinely performed using rectal examination, PSA test supplemented by determination of free PSA and prostate biopsy, when indicated. The aim of this work is to present a basic overview of current possibilities of screening and early detection of prostate cancer.
Key words:
prostate cancer, prostate specific antigen, prostate biopsy, screening
:
R. Wasserbauer
:
Urol List 2014; 12(2): 19-28
Karcinom prostaty i přes stále se zlepšující diagnostiku patří ke druhé nejčastější příčině úmrtí na maligní onemocnění u mužů v ČR. Již od 80. let minulého století jsou vidět první pokusy o systematický screening zavedením pravidelných kontrol digitálním rektálním vyšetřením a ultrazvukem, poté se v 90. letech objevuje na scéně prostatický specifický antigen (PSA), který znamená opravdový průlom v časné detekci karcinomu prostaty. V současnosti je screening rutinně prováděn pomocí vyšetření per rektum, PSA doplněného o stanovení free PSA a v indikovaných případech odběru biopsie. Cílem práce je podat základní shrnutí současných možností screeningu a časné detekce karcinomu prostaty.
Klíčová slova:
karcinom prostaty, prostatický specifický antigen, biopsie prostaty, screening
Úvod
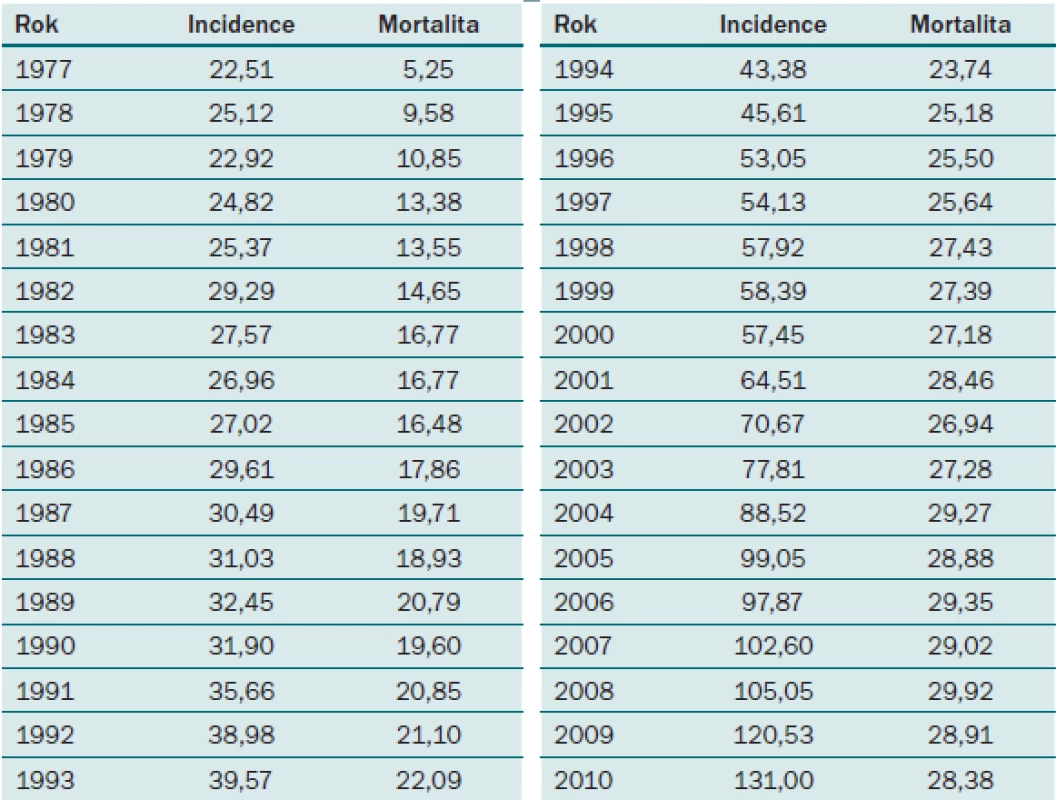
Karcinom prostaty je závažné urologické onemocnění s každoročně stoupající incidencí. V ČR byla v roce 2010 incidence karcinomu prostaty 131 nových případů na 100 000 mužů, což v absolutních číslech znamená 6 770 nových případů za rok (graf 1, tab. 1). Přestože vývoj mortality na tento typ nádoru v posledním desetiletí má stagnující až lehce klesající tendenci, patří stále u mužů ke druhé nejčastější příčině úmrtí na maligní onemocnění v ČR [1].

Riziko vzniku karcinomu prostaty stoupá se zvyšujícím se věkem pacienta. Na grafu 2 lze vidět incidenci dle věkových kategorií pacientů. Věk není samozřejmě jediným rizikovým faktorem vzniku, k dalším patří rasová příslušnost, kdy je nejvyšší výskyt zjištěn u afroamerické populace a nejnižší u populace asijské. Dále se na vzniku karcinomu prostaty podílí vlivy zevního prostředí a v neposlední řadě i vlivy hereditární. Vzhledem k rostoucí délce života v populaci je časná detekce tohoto onemocnění vysoce důležitá. Časná stadia jsou mnohem lépe léčitelná a potenciálně vyléčitelná. Primární prevence karcinomu prostaty, a tedy zabránění jeho vzniku, není v současné době možné, a je proto nutná důsledná prevence sekundární, která nám umožní onemocnění zachytit včas. Snahou je detekovat onemocnění lokalizované na prostatu, tedy zachytit karcinom prostaty nejpozději ve 2. stadiu. Tento cíl se díky zavedení vyšetření prostatického specifického antigenu (PSA) do klinické praxe v 90. letech minulého století daří, jak můžeme vidět na grafu 3, který ukazuje rozložení stadií onemocnění v době diagnostiky v jednotlivých letech. V časném stadiu bohužel karcinom prostaty nevyvolává žádné symptomy, a lze jej tedy zjistit pouze na podkladě časné prevence, která je realizována specializovaným vyšetřením v ordinaci urologa. Obecně lze říci, že pokud začne karcinom vyvolávat příznaky, je již v naprosté většině nález pokročilý a příznaky jsou způsobeny lokální progresí či generalizací onemocnění. Možnosti léčby již pokročilého stadia jsou však omezené. Nádor prostaty bývá rovněž často multifokální, pro potřeby léčby byl do klinické praxe zaveden termín „index lesion“. Jedná se o ložisko karcinomu prostaty, které je větší než ostatní, a je u něj tedy největší riziko progrese. Pokud je jeho Gleasonovo skóre větší nebo rovno 6 a velikost léze překročí 0,5 cm3, je třeba zahájit léčbu. Cílem vyšetření pacienta je tedy časná detekce onemocnění a dle rozsahu onemocnění i odpovídající terapie.


Zde je vhodné zmínit termín signifikantní a nesignifikantní karcinom prostaty. Za nesignifikantní karcinomy prostaty lze označit takové karcinomy, které neohrozí pacienta na životě vzhledem k pravděpodobnosti pomalé progrese onemocnění a předpokládané délce života pacienta. U těchto pacientů postačuje pouze aktivní sledování a není nutná razantní léčba. Oproti tomu za signifikantní lze považovat všechny karcinomy prostaty, které znamenají ohrožení života pacienta z hlediska progrese choroby a jako takové je třeba je léčit. Nesignifikatní karcinom bývá rovněž často zaměňován termínem IDLE (indolent lesions of epithelial origin) léze. Lze k nim řadit karcinomy, jejichž Gleasonovo skóre není větší než 5, jejich velikost nepřesahuje 0,5 cm3, riziko jejich maligního šíření je minimální, a lze u nich tedy uplatnit metodu aktivního sledování a razantní léčba není nutná.
K samotné diagnostice časného karcinomu prostaty nám slouží standardní klinické testy: vyšetření prostaty per rektum, stanovení hladiny PSA v krvi a k potvrzení diagnózy poté následná biopsie prostaty [3].
Digitální rektální vyšetření
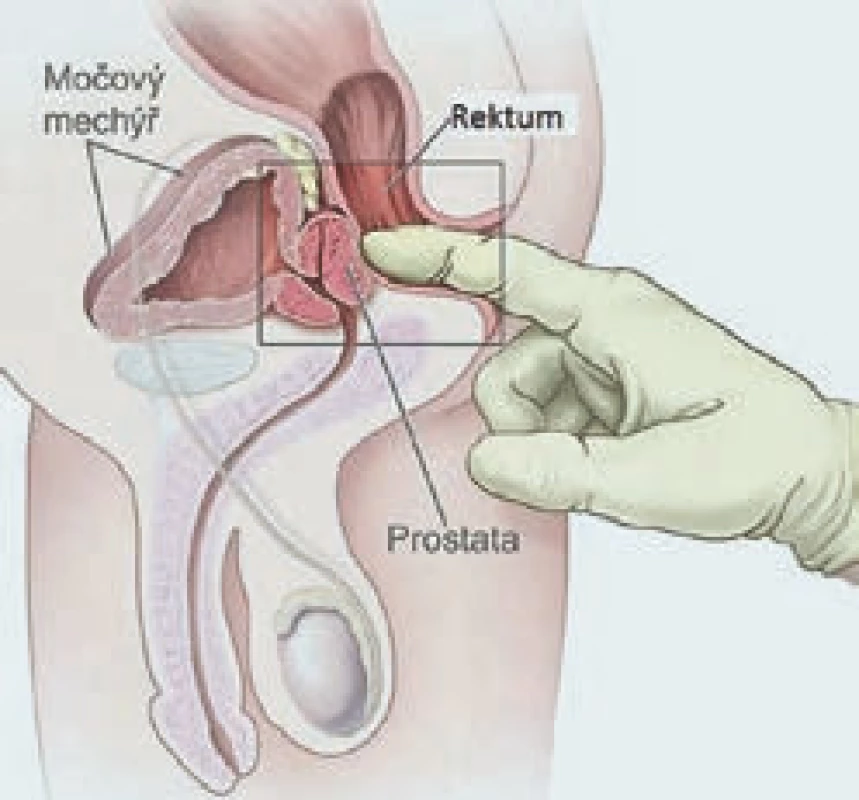
Digitální rektální vyšetření (DRV) je v ambulanci snadno proveditelné vyšetření, které nevyžaduje žádné speciální vybavení, a může jej tedy podstoupit skoro každý pacient, který navštíví urologickou ambulanci. Před vyšetřením je třeba pacienta důkladně poučit o jeho průběhu. Samotné vyšetření je možno provádět v předklonu či vleže na boku s pokrčenými koleny. Samozřejmostí je užití dostatečného množství gelu, aby se minimalizoval dyskomfort pacienta při vyšetření. Jeho nevýhodou je především to, že hodnocení nálezu na prostatě je vysoce subjektivní, a tedy vyžaduje určitou zkušenost vyšetřujícího (obr. 1). Další nevýhodou je existence karcinomů, především malých lézí, které nelze touto metodou zjistit. Prostatická tkáň je za normálních okolností elastická, hladká a ohraničená, pokud při DRV detekujeme na prostatě kulovité ložisko, tuhé části či neohraničené okraje, je u tohoto pacienta indikováno provedení biopsie prostaty. Nejvyšší procento karcinomů prostaty je lokalizováno do periferní zóny prostaty, a lze je tedy pomocí DRV detekovat, ovšem pouze za předpokladu, že jejich velikost přesahuje 0,2 ml. Suspektní nález při DRV je vždy indikací k provedení biopsie prostaty. Gosselaar et al ve své práci prokázali, že u pacientů se suspektním nálezem při DRV spolu s elevací PSA nad 3 ng/ ml je signifikantně vyšší riziko pozitivního nálezu karcinomu prostaty a rovněž vyšší riziko agresivnějšího nádoru (GS > 7) [2].
PSA a další nádorové markery
PSA je glykoprotein o molekulové hmotnosti 34 kD, který je primárně produkován v epitelových buňkách prostaty. PSA je proteolytický enzym ze skupiny humánních kalikreinů, konkrétně hK3 (obr. 2), jehož primární funkcí je zkapalňování spermatu. Jeho hladina v krvi je za normálních okolností velice nízká a měří se v jednotkách [ng/ ml]. Jeho množství v krvi je krom jiného silně ovlivňováno produkcí androgenů. Stanovení hladiny v krvi je objektivní a relativně levná metoda, existuje však více testovacích postupů k jeho stanovení, a jsou tedy i různá referenční rozmezí. K jeho nevýhodám patří to, že se jedná o orgánově specifický a ne nádorově specifický antigen. V praxi to znamená, že jeho hladina může být ovlivněna i nenádorovým onemocněním prostaty.
PSA se nachází v krvi ve dvou formách, ve formě volné a vázané, a to v poměru 1 : 4. Ve vázané formě, která převažuje, tvoří komplex s alfa1– antichymotrypsinem nebo alfa2– makroglobulinem. Poločas vázané formy v krvi tvoří přibližně 2– 3 dny a po kompletním odstranění prostatické tkáně klesá hodnota na nulu do tří měsíců. Poločas volného PSA v séru je oproti tomu jen dvě hodiny.
Na zvýšení hodnoty PSA se může podílet více faktorů, dochází k němu při porušení integrity buněčné membrány při onemocněních prostaty, jako je například její zánět, infekce moči, benigní hyperplazie prostaty, dále při mechanické manipulaci s prostatou: transrektální ultrazvukové vyšetření, biopsie prostaty, cystoskopické vyšetření nebo masáž prostaty [3]. Elevace PSA tedy není nezbytně spojena s přítomností karcinomu prostaty.
Od hodnoty PSA jsou odvozeny další parametry, které nám umožňují zpřesňovat určení rizika přítomnosti karcinomu prostaty u daného pacienta. Je to především určení poměru volného a vázaného PSA, PSA velocity, PSA „doubling time“ a věkově specifické PSA.
Poměr volného a vázaného PSA
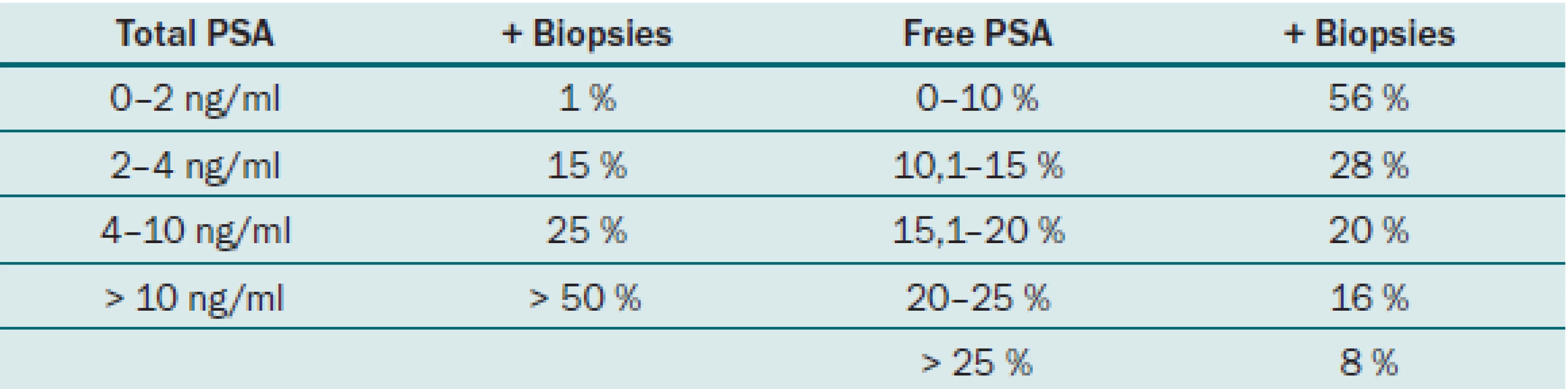
Jak již bylo řečeno, PSA se v séru vyskytuje volný (fPSA) a vázaný (tPSA). Volný PSA a PSA vázaný na alfa1– antichymotripsin lze imunologickými testy vyšetřit a stanovit jejich hladinu. Měření volné frakce pomáhá odlišit mezi benigní hyperplazií prostaty (BPH) a karcinomem prostaty. Nejvíce přesný je tento parametr u pacientů s hodnotou celkového PSA v rozmezí 4– 10 ng/ ml. S klesající hodnotou PSA pod 4 ng/ ml je prediktivní hodnota tohoto parametru nižší. Catalona et al ve své prospektivní multicentrické studii uvádějí, že u pacientů s hodnotou f/ t PSA pod 0,1 byla pozitivní biopsie až v 56 %. Pacienti s hodnotou nad 0,25 měli oproti tomu pozitivní biopsii pouze v 8 % [4]. Zavedením f/ t PSA u pacientů s hodnotou PSA mezi 4 a 10 ng/ ml byla zvýšena specificita testování PSA. Rovněž u pacientů s hodnotou celkového PSA 2,5– 4 ng/ ml bylo použito stanovení hodnoty f/ t PSA, u rizikových pacientů byla provedena biopsie a tumor byl detekován u 22 % pacientů a z nich bylo 81 % lokalizovaných [5]. F/ t PSA lze tedy považovat za užitečný parametr při stanovování rizika přítomnosti karcinomu prostaty, nejvyšší výpovědní hodnotu má při hodnotách celkového PSA 4– 10 ng/ ml. Tab. 2 ukazuje velikost rizika pozitivního nálezu z biopsie prostaty u jednotlivých hodnot PSA.
PSA velocita
PSA velocita (PSAV) je parametr, který hodnotí riziko karcinomu prostaty s využitím změny hodnoty celkového PSA za daný časový interval. Carter et al [6] ve své studii hodnotící změny PSA u mužů s karcinomem prostaty a bez něj zjistili významné rozdíly v nárůstu hodnot. Tyto závěry lze využít v klinické praxi. Výpočet vyžaduje tři po sobě následující měření v minimálním intervalu 18– 24 měsíců. PSAV = (PSA2 – PSA1) / t1 + (PSA3 – PSA2) / t2, kdy t1 je časový interval mezi 1. a 2. měřením a t2 je interval mezi 2. a 3. měřením. Při hodnocení rizika je nutné provést minimálně dvě měření celkového PSA. Pokud má pacient hodnotu celkového PSA nad 4 ng/ ml, pak za rizikovou lze považovat hodnotu PSAV 0,75 ng/ ml/ rok a vyšší. Při užití tohoto parametru má metoda 72% senzitivitu a 90% specificitu [7]. Pokud se však hodnota celkového PSA pohybuje v rozmezí 2,5– 4 ng/ ml, je nižší i hranice pro PSAV, kdy se pohybuje kolem 0,4 ng/ ml/ rok.
PSA „doubling time“
Hodnota PSA „doubling time“ (DTPSA) je časový interval, za který dojde ke zdvojnásobení hodnoty celkového PSA. Prospektivní studie prokázaly, že DTPSA slouží především v dispenzarizaci pacientů po definitivní léčbě pro již diagnostikovaný karcinom prostaty, kdy nám podává informace o jeho chování a případné recidivě onemocnění. V diagnostice již však takový význam nemá [8,9] a k časné detekci karcinomu prostaty se příliš nevyužívá.
Věkově specifická PSA
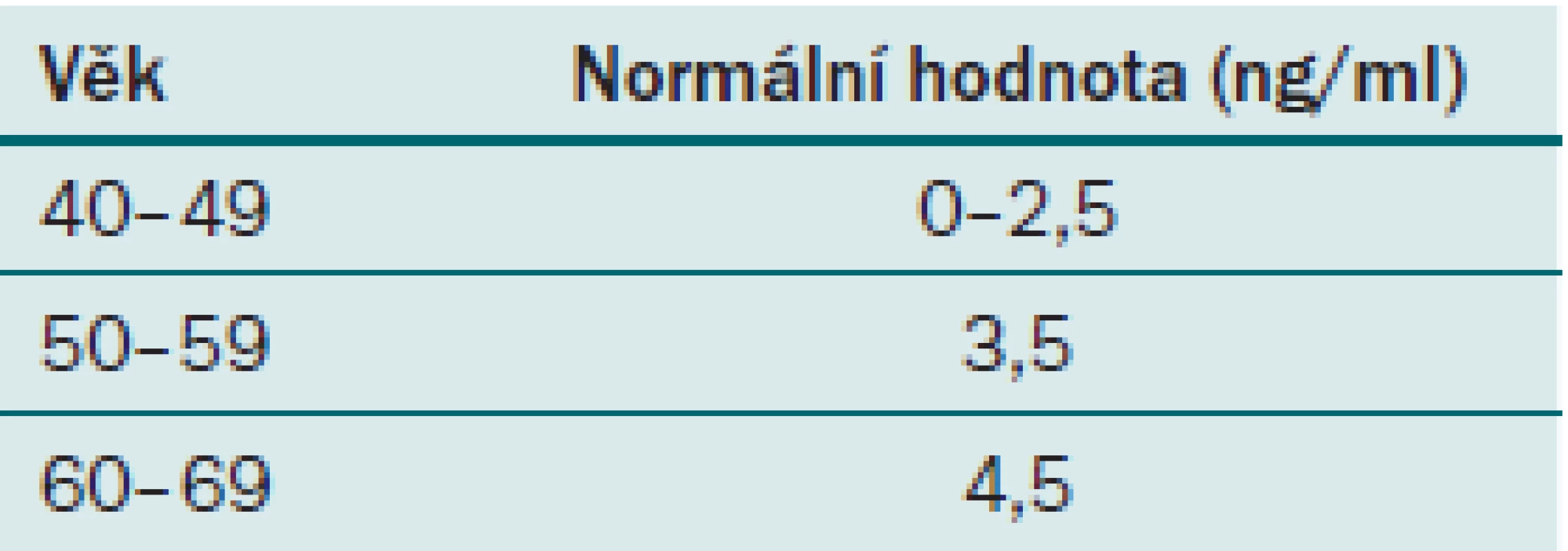
Hodnota PSA je u každého pacienta velice variabilní a jak již bylo řečeno, je ovlivnitelná mnoha faktory. Jedním z těchto faktorů je i věk. Jak muž stárne, fyziologicky se může zvyšovat i hodnota PSA. Elevace PSA je způsobena benigní proliferací buněk prostaty, s tím je spojeno zvětšování velikosti prostaty, a tedy i zvýšení množství PSA, které ovšem nesmí překročit povolenou hodnotu PSAV. Z toho důvodu je třeba zohlednit tuto skutečnost i v indikačních hranicích hodnot PSA pro biopsii prostaty. Za hranici k provedení biopsie prostaty u pacienta ve věku 40– 49 let se považuje hodnota celkového PSA nad 2,5 ng/ ml, ve věku 50– 59 je to hodnota 3,5 ng/ ml a ve věku nad 60 let je to 4,5 ng/ ml (tab. 3). Vzhledem k prodlužujícímu se průměrnému věku populace není vhodné posunovat horní hranici nad 4,5 ng/ ml, aby nedošlo k promeškání kurabilních karcinomů prostaty u pacientů, kteří mají stále dlouhou předpokládanou délku života. Je však nutný vysoce individuální přístup.
ProPSA
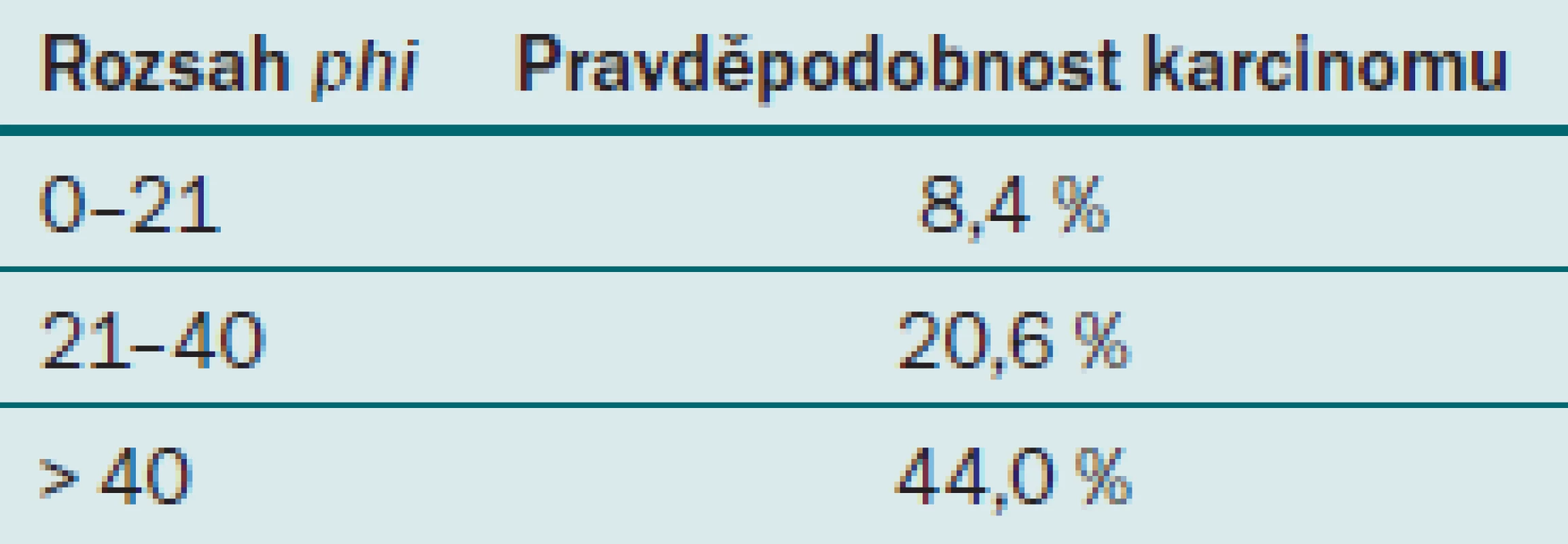
ProPSA je produkován v buňkách prostatické tkáně jako prekurzor PSA a postupně je enzymatickými pochody přeměn na definitivní formu PSA. Vyskytuje se v několika izoformách, které jsou meziprodukty ve tvorbě definitivního PSA. V krvi tvoří jeho normální hladina přibližně 30 % z celkového množství fPSA. Při přítomnosti karcinomu prostaty je výskyt izoforem proPSA v séru zvýšen. Je velice senzitivní a dokáže s vysokou pravděpodobností určit u pacientů s PSA 4– 10 ng/ ml, zda je pacient ohrožen karcinomem prostaty, a je tedy u něj indikována biopsie prostaty. Test však není hrazen z veřejného zdravotnictví a pacient si ho musí platit sám. V současné době není tedy hromadně využíván k detekci karcinomu prostaty. Nyní je do klinické praxe zaváděn nový parametr, tzv. phi‑ index neboli prostate health index. Tento index je stanovován v laboratoři z hodnot PSA, fPSA a izoformy (– 2)proPSA [10]. Při použití tohoto indexu se výrazně zvyšuje specificita detekce karcinomu prostaty a snižuje počet zbytečných biopsií. Jeho hodnota udává riziko přítomnosti karcinomu prostaty (tab. 4).
Prostate cancer gene 3
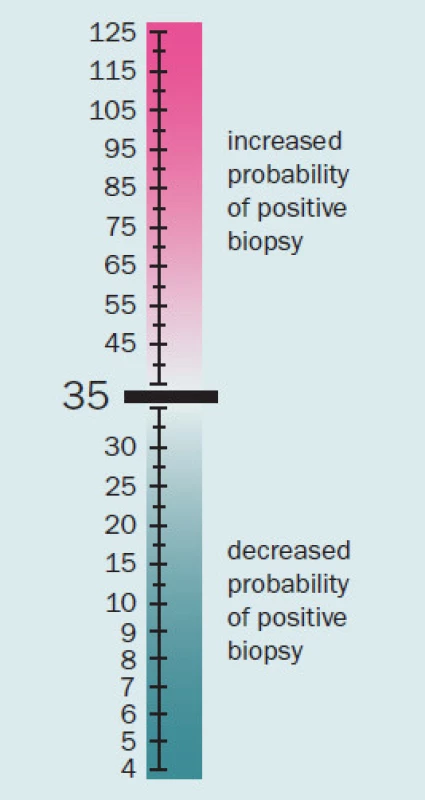
Prostate cancer gene 3 (PCA3) je marker využitelný k časné detekci karcinomu prostaty. Stanovuje se z močového sedimentu po masáži prostaty během DRV. Ve srovnání s PSA má nižší senzitivitu, avšak vyšší specificitu a má lepší pozitivní i negativní predikční hodnotu [11]. Poměr koncentrace PCA3 a mRNA PCA3 udává PCA3 skóre, které dokáže relativně přesně oddělit pacienty s BPH a s karcinomem prostaty; „cut‑off“ hodnota je u tohoto skóre 35 (obr. 3). Nevýhodou tohoto testu je, že není hrazen z veřejného zdravotnictví a pacient si jeho provedení musí hradit sám. V široké klinické praxi tedy není příliš využíván a z hlediska screeningu v současnosti není v plošném měřítku použitelný. Lze jej však využít u těch pacientů, kteří si nepřejí provést biopsii prostaty nebo rebiopsii prostaty, v těchto případech pomůže zpřesnit hodnotu rizika přítomnosti karcinomu prostaty [12].
Fuzní gen TMPRSS2:ERG
TMPRSS2 patří do rodiny serinových proteáz, která se vyskytuje v prostatické buňce a podílí se na její funkci. Napojením genu kódujícího tuto proteázu na transkripční faktor ERG vzniká fuzní gen, který zvyšuje maligní potenciál buňky a následně podporuje tumorigenezi. Karcinomy prostaty s tímto nálezem mají většinou horší prognózu a agresivnější chování. K vyšetření přítomnosti tohoto fuzního genu lze využít buď fluorescenční in situ hybridizace, ke které je však nutné získat vzorek tkáně prostaty, nebo lze provést vyšetření moči ve specializované laboratoři po masáži prostaty. Pozitivní záchyt přítomnosti tohoto fuzního genu tedy zhoršuje prognózu pacienta [13].
Prostatická kyselá fosfatáza
Prostatická kyselá fosfatáza (PAP) byla dlouhou dobu užívána jako hlavní marker karcinomu prostaty, dnes je již její role plně nahrazena vyšetřením PSA. PAP je enzym, který se ve vysokých hladinách vyskytuje v semenné tekutině a v prostatické tkáni, jeho zvýšená hladina se vyskytuje u pacientů s karcinomem prostaty, a to zejména již v generalizovaném stadiu, jako marker časného záchytu je tedy velice nevhodný. Rovněž je PAP oproti PSA produkována i v jiných částech těla a její hladina je zvýšena i u jiných maligních onemocnění, jako např. u karcinomu žaludku či tlustého střeva [3].
Transrektální ultrasonografie
Je metoda ultrazvukového vyšetření prostaty, při které je speciální ultrazvuková sonda zavedena do konečníku, kde detekujeme a následně vyšetříme prostatickou tkáň. Samostatné vyšetření transrektální ultrasonografie (TRUS) nemá v diagnostice časného karcinomu prostaty v současné době významnější přínos. Je zatíženo falešnou pozitivitou i negativitou při hodnocení ložiskových lézí prostaty. Nejčastěji karcinom prostaty vypadá v ultrazvukovém obraze jako hypoechogenní ložisko, avšak ne všechna hypoechogenní ložiska jsou karcinomy prostaty. Četnost záchytu karcinomu prostaty z těchto ložisek se pohybuje mezi 60 a 97 %. Část nádorových lézí prostaty, asi 30 %, se navíc vyskytuje v podobě izoechogenních, a tedy pomocí TRUS nedetekovatelných ložisek, asi 1– 5 % se může dokonce vyskytovat v podobě hyperechogenních ložisek [14]. Vyhodnocení je navíc zatíženo chybou v podobě zkušeností vyšetřujícího. Tato metoda není pro časný záchyt karcinomu prostaty pro svou nízkou senzitivitu příliš vhodná. Je však výborně využitelná při provádění systematické biopsie, kdy umožňuje odběr vzorků z přesně definovaných míst v prostatické tkáni, navíc pokud operatér na ultrazvukovém obraze prostaty detekuje hypoechogenní ložisko, které je suspektní z pozitivního nálezu, je vhodné i dle doporučení EUA z tohoto místa rovněž odebrat vzorek tkáně k vyšetření.
Magnetická rezonance
Nesmíme opomenout zmínit využití magnetické rezonance (MRI) v diagnostice karcinomu prostaty, přestože se zatím jedná o metodu spíše pomocnou. Indikována je u pacientů, kteří již absolvovali dvě a více biopsií provedených standardním způsobem pod UTZ kontrolou a vždy byl nález negativní. Dle studie Rosenkratze et al [15] má tato metoda téměř 100% senzitivitu, 74% specificitu a 68% pozitivní predikční hodnotu při detekci tumoru. S výhodou lze využít MRI‑ vedenou biopsii prostaty, kdy je odběr vzorků cílen pomocí MRI. Byla provedena studie na 100 pacientech, u kterých byla negativní biopsie s využitím TRUS, přetrvávaly u nich rizikové hodnoty PSA a na provedeném MRI vyšetření byla minimálně jedna suspektní léze. Poté se u pacientů provedla biopsie pod MRI kontrolou a u 52 % pacientů byl detekován tumor i vzhledem k předchozím negativním biopsiím s využitím TRUS [16]. MRI‑ vedená biopsie prostaty je tedy účinná metoda k časné detekci karcinomu prostaty, nevýhodou je však nadále její omezená dostupnost pro užití v klinické praxi a nezanedbatelným faktorem je i její cena, což zatím brání jejímu širšímu využití.
Z dalších vyšetření využívajících MRI je vhodné zmínit multiparametrické 3T MRI, které využívá při MRI vyšetření syntézy obrazu difuzně váženého zobrazení, dynamického postkontrastního zobrazení a MRI spektroskopie. Při vyšetření lze detekovat podezřelé ložisko a následně z něj provést biopsii. Také jej lze využít k určení pokročilosti nádoru a k naplánování následné nejvhodnější terapie. Tuto metodu lze zkombinovat s TRUS vyšetřením při provádění biopsie prostaty, kdy obrazová dokumentace z MRI vyšetření je uložena a následně s použitím speciálního softwaru promítnuta do obrazu TRUS při provádění biopsie prostaty, která tak může být více specifická a cílená na suspektní ložisko karcinomu.
Pozitronová emisní tomografie (PET, PET/ CT)
Od 90. let 20. století dochází k rozvoji této metody v diagnostice karcinomu prostaty. Dříve rutinně využívané F‑ FDG PET vyšetření pomocí značené flourodeoxyglukózy se ukázalo účinné u anaplastických forem karcinomu prostaty, avšak u pomalu rostoucích forem a pro primární diagnostiku nebylo příliš vhodné. Za slibnější radiofarmakum byl považován značený metylcholin při C‑ cholin PET vyšetření, ale ani on nepřinesl významnější posun v diagnostice, nevýhodou je především krátký poločas rozpadu, vysoká cena a neschopnost detekovat menší ložiska. Jako slibné se zdá být F značené NaF PET, které slouží jako možná alternativa ke scintigrafii skeletu, a tedy k průkazu kostních metastáz, ale nelze jím detekovat jiná ložiska karcinomu prostaty [17]. Novinkou v PET diagnostice je Ga‑ PSMA PET využívající značené Gadolinium vázané k ligandu pro prostatický specifický membránový antigen (PSMA), který je overexprimován na membránách buněk karcinomu prostaty. Výhodou oproti předchozím je jeho využití k časné detekci relapsu karcinomu prostaty a rovněž průkazu přítomnosti vzdálených metastáz i při nízkých hladinách hodnot PSA [18].
Biopsie prostaty
Pro potvrzení diagnózy, a tedy i včasné zahájení léčby, je nezbytná histologická verifikace přítomnosti karcinomu prostaty. Ke stanovení diagnózy karcinomu prostaty může dojít náhodně, při vyšetření tkáně po prostatektomii či transuretrální resekci prostaty. Nejčastěji je však karcinom prostaty diagnostikován z provedené biopsie prostaty. Biopsie prostaty se převážně provádí transrektálně s využitím TRUS (obr. 4). Lze využít i transperineální přístup, a to především k detekci malých signifikantních lézí, kdy je doporučováno provedení transperineální šablonové, event. cílené biopsie. Před samotným provedením biopsie je nutné zvážit potenciální přínos stanovení diagnózy u konkrétního pacienta, zhodnotit jeho předpokládanou délku života a následně případné terapeutické možnosti, které by bylo možné použít, pokud bychom skutečně karcinom prostaty prokázali.
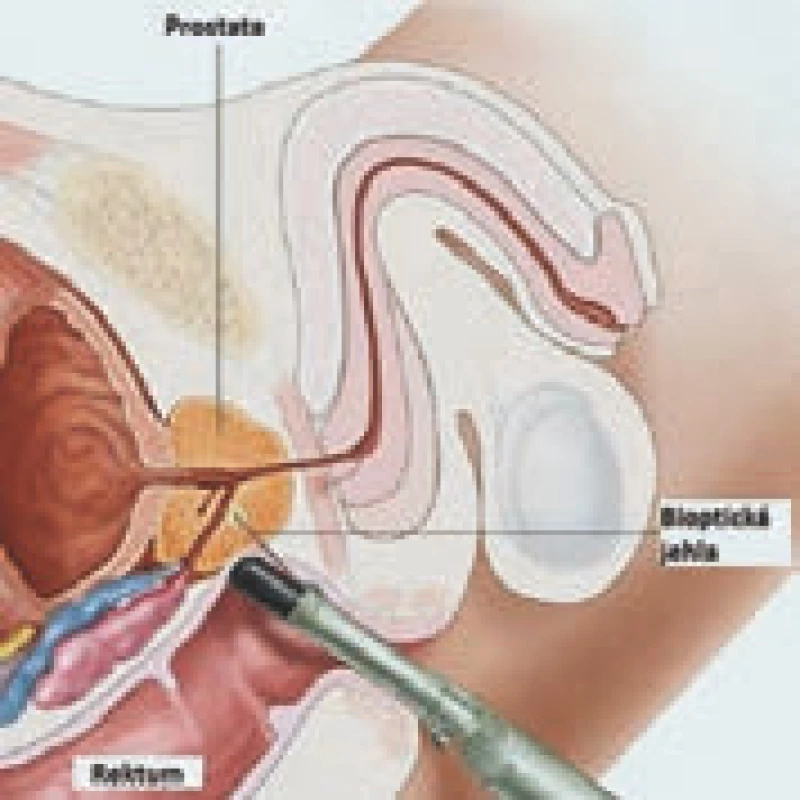
Hlavními indikacemi k provedení biopsie jsou: podezřelý nález při DRV, zvýšená hodnota PSA, případně suspektní hodnota jiného parametru hodnotící riziko přítomnosti karcinomu prostaty (f/ t PSA, proPSA, PSAV, PCA3). Pokud u pacienta detekujeme náhlé zvýšení PSA, nemělo by toto náhlé zvýšení vést automaticky k provedení biopsie prostaty. Indikováno je nejdříve kontrolní vyšetření hladiny PSA s odstupem několika týdnů, současně s odběrem PSA je vhodný odběr moči k vyloučení infekce močových cest. Kontrolní odběr PSA by měl být však vyšetřen ve stejné laboratoři, jelikož různé laboratoře mají různé metody ke stanovení hodnoty PSA [19].
Biopsie prostaty se standardně provádí pod TRUS kontrolou za pomoci tenké punkční jehly. Je třeba si uvědomit, že se jedná o náhodný odběr vzorků, a tedy negativní výsledek z biopsie ještě neznamená, že pacient nemá karcinom prostaty. Platí, že čím je prostata větší a karcinom menší, tím je vyšší riziko negativního nálezu z biopsie prostaty. Je tedy nutné v tomto smyslu poučit i pacienta a dále ho upozornit na možnost opakování biopsie prostaty při přetrvávání rizikových nálezů. Výkon je možné provádět v lokální anestezii, a tedy ambulantně. Před výkonem je nutná pečlivá edukace pacienta o samotném průběhu a možných komplikacích, dále pacient musí vysadit léky ovlivňující krevní srážlivost (warfarin, anopyrin, godasal, trombex, klopidogrel, nesteroidní antiflogistika a další). Vhodná je antibiotická profylaxe, názory na délku podávání se však různí: od jednorázové aplikace fluorochinolonů či gentamycinu po několikadenní podávání antibiotika, typ přípravku se rovněž liší v závislosti na zkušenostech jednotlivých pracovišť. Na našem pracovišti využíváme jednodenní aplikaci dvojkombinace Ciprinol, event. Zinat s Entizolem. Ve studii sledující pět let pacienty s touto profylaxí nebyla zaznamenána zvýšená incidence infekčních komplikací. Lze tedy říci, že tato kombinace je stále efektivní u více než 97 % biopsií, oproti tomu u pacientů s příznaky infekčních komplikací byl ve zvýšené míře diagnostikován rezistentní kmen bakterií a je doporučena razantní léčba širokospektrými antibiotiky [20,21].
Pacient by měl přijít k biopsii vyprázdněný, většinou však není třeba podávat klyzma, úplně postačí ranní spontánní defekace. Před samotným výkonem je důležitá lokální anestezie, inervace prostaty je zajišťována autonomními vlákny z kořenů S2– S5 a ze sympatických pletenců presakrálního a hypogastrického neurálního plexu. Tato vlákna tvoří periprostatický plexus s posterolaterálním průběhem [22,23]. Při provádění lokální anestezie je peri‑ , popřípadě intraprostaticky vpraveno lokální anestetikum a současně se využívá i lokálního anestetika aplikovaného intrarektálně k umrtvení sliznice rekta. Při porovnávání periprostatické vs intraprostatické aplikace lokálního anestetika bylo zjištěno, že obě metody mají srovnatelné výsledky i případné komplikace. Jsou bezpečné, neprodlužují výkon ani nezatěžují ekonomicky pracoviště provádějící výkon a významnou měrou zvyšují komfort pacienta při odběru [24].
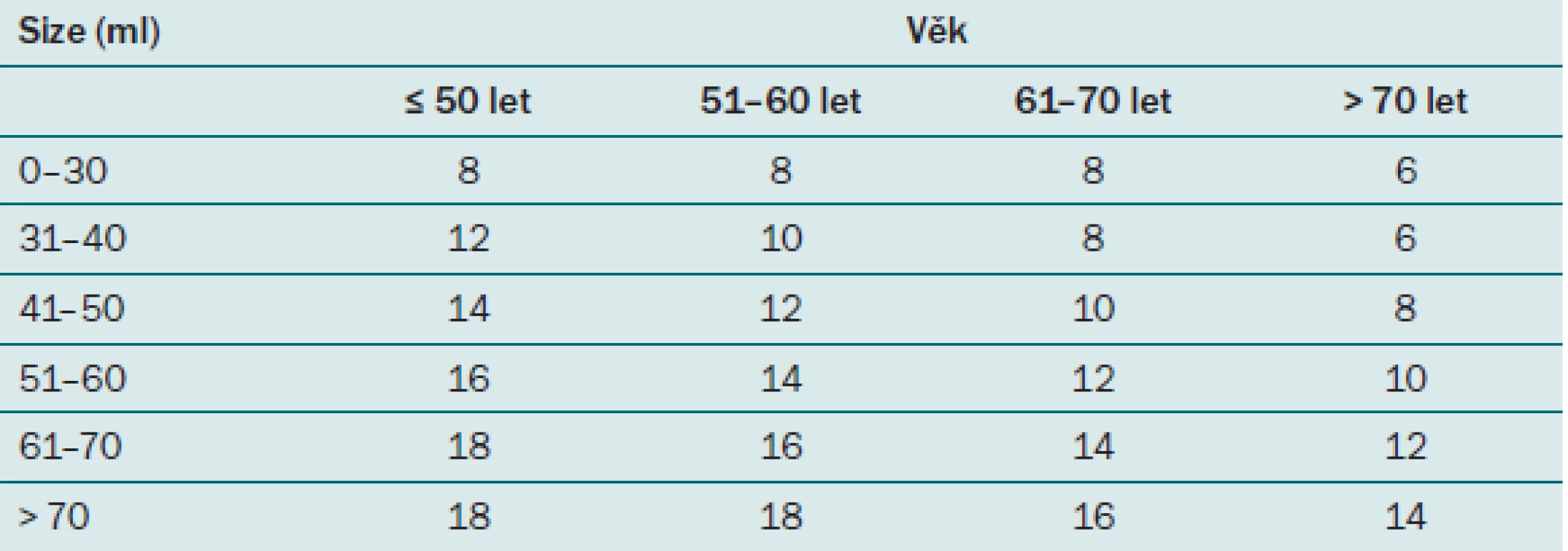
Strategie odběru se v průběhu času měnila. Jako první se využívala cílená biopsie, při které se prováděl odběr vzorků ze suspektních ložisek prostaty popsaných při DRV nebo na TRUS. Vzhledem k problémům hodnocení TRUS vyšetření popsaných výše nebyla tato metoda vhodná k detekci časných forem karcinomu prostaty, které mohou být při DRV obtížně zjistitelné a při TRUS špatně odlišitelné od normální tkáně prostaty. Tato metoda byla postupně vytlačena dnes již rovněž překonanou metodou, a to sextantovou biopsií. Při této metodě dochází k odběru tří vzorků z každého laloku prostaty z přesně definovaných lokalit, jak ukazuje obr. 5. Zejména však u větších prostat byl počet vzorků vysoce insuficientní. Navíc je sextantová biopsie zatížena vysokou mírou falešné negativity, která může dle studií dosahovat až 30 % [25]. Ve snaze stanovit standardizovaný postup v počtu odebíraných vzorků vytvořili Djavan et al [26] na podkladě věku a velikosti prostaty tzv. Vídeňský nomogram, podle kterého lze jednoduše určit ideální počet odebíraných vzorků (tab. 5). Celková detekce karcinomů prostaty se po zavedení tohoto schématu zvýšila o 66 %, což výrazně snížilo počet nutných rebiopsií. Další možností odběru vzorků je tzv. saturační biopsie, při které není počet vzorků přesně stanoven, udává se rozsah v průměru 16– 45 vzorků. Měla by být indikována u vysoce rizikových pacientů s negativní iniciální biopsií prostaty nebo u pacientů s dvakrát negativní biopsií [27]. U těchto pacientů je při saturační biopsii odhaleno o 30 % karcinomů více. Tyto karcinomy by při sekundárním standardním odběru ušly pozornosti [25]. Je však třeba mít na paměti, že odběrem většího počtu vzorků roste i riziko detekce nesignifikantních karcinomů, které by se nemusely vůbec klinicky projevit. Obecně se při saturační biopsii doporučuje odběr 20 vzorků s maximem v oblasti apexu a laterálních částech prostaty, kde je pravděpodobnost detekce karcinomu nejvyšší. Jones et al provedli studii, při které v periprostatické blokádě odebírali 20– 24 vzorků u pacientů s primárně negativním výsledkem při standardizované biopsii, výkony proběhly bez výraznějších komplikací a bylo detekováno 25– 30 % karcinomů a z toho celé 2/ 3 signifikantních [28]. Vzorková schémata však mohou obsahovat až 45 vzorků, u takto vysokého počtu vzorků se již doporučuje výkon provádět ve svodné či celkové anestezii.
Opakování biopsie je dle doporučení EAU pro karcinom prostaty vhodné u pacientů, u kterých i přes negativní primární biopsii nadále vzrůstá hodnota PSA nebo přetrvává v rizikových hodnotách, pokud přetrvává suspektní nález při DRV nebo pokud byl na histologii nález ASAP či mnohočetně HG‑ PIN. Odstup od první biopsie by se měl pohybovat v rozmezí 6– 12 měsíců. Při opakování biopsie se doporučuje odběr vyššího počtu vzorků než při primární biopsii prostaty, ohledně přesného počtu však není určeno žádné přesné doporučení.
Jako každý invazivní výkon má i biopsie prostaty své komplikace, k nejčastějším patří makrohematurie bezprostředně po výkonu a hematospermie přetrvávající i několik týdnů. Tyto komplikace však odezní většinou spontánně, bez nutnosti intervence. Riziko závažnějších postbioptických infekcí se vyskytuje v méně než 1 % případů [29,30]. Lze tedy říci, že biopsie prostaty je výkon relativně bezpečný a pro pacienta stran časné detekce karcinomu prostaty vysoce přínosný.
K provedení biopsie prostaty lze rovněž využít kromě přístupu transrektálního i přístup transperineální. Tento přístup je indikován u pacientů, u nichž byla předchozí transrektální biopsie negativní nebo nálezy byly nejednoznačné. Provádí se v celkové nebo spinální anestezii za transrektální ultrazvukové kontroly. Lze použít šablonovou biopsii, kdy se na perineum přiloží speciální destička s otvory, která je obdobná jako při brachyterapii. Na destičce jsou otvory pro jehlu v cca 5mm rozestupech. Tohoto přístupu lze využít i k odběru tzv. cílené transperineální biopsie, při které je pomocí MRI určeno podezřelé ložisko prostaty a z něho je následně odebrán vzorek. Tento přístup má oproti klasickému transrektálnímu odběru menší riziko infekcí, avšak vyšší riziko pooperační retence moči.
Další možností k provedení biopsie prostaty je využití 3T MRI‑ TRUS technologie. Při této metodě, jak již bylo zmíněno výše, je nejdříve pacient vyšetřen pomocí multiplanarické MRI, nálezy z tohoto vyšetření jsou uloženy a následně pomocí speciálního softwaru promítány do UTZ obrazu při standartní biopsii prostaty, která je prováděna pod TRUS kontrolou. Při MRI jsou detekována suspektní ložiska prostaty, která jsou při biopsii promítána do UTZ obrazu, a z těchto ložisek tedy lze brát cílené biopsie.
Screening karcinomu prostaty
Screening je definován jako vyšetření asymptomatických pacientů, u kterých je určité riziko možnosti vzniku sledovaného onemocnění. Může být iniciován vyšetřujícím, který screening provádí, nebo vyšetřovaným, případně jeho praktickým lékařem. Cílem screeningu je samozřejmě časná detekce tumoru, a tím snížení mortality na toto onemocnění. Byly publikovány dvě velké prospektivní, randomizované studie zabývající se screeningem karcinomu prostaty. The Prostate, Lung, Colorectal, and Ovarial (PLCO) Cancer Screening Trial [31] – v této studii bylo vyšetřeno 76 700 mužů, kteří byli rozdělení do dvou skupin. U jedné skupiny byl zaveden screening pomocí PSA a DRV a druhá byla skupina kontrolní. Po sedmiletém sledování byl poměr nově diagnostikovaných karcinomů u pacientů se zavedeným screeningem oproti skupině bez screeningu 1,22 a podíl mortality byl 1,13. V této studii tedy nebyl prokázán výrazný přínos zavedení screeningu k ovlivnění mortality karcinomu prostaty. Druhá práce s názvem The European Randomised Study of Screening for Prostate Cancer (ERSPC) [32] zahrnovala hodnocení u 162 000 mužů ze sedmi zemí. Pacienti byli opět rozděleni na dvě skupiny obdobně jako v předešlé studii. Po devítiletém sledování byla kumulativní incidence karcinomu prostaty 8,2 % u screeningové skupiny a 4,8 % u kontrolní. Poměr úmrtí na karcinom prostaty byl mezi skupinou screeningovou a kontrolní 0,8. Byl prokázán o 22 % nižší výskyt lokálně pokročilého onemocnění ve screeningové skupině oproti kontrolní skupině. Ze studie však také vyplývalo, že k zabránění jednoho úmrtí na karcinom prostaty je třeba vyšetřit screeningem 1 410 pacientů a léčit 48 pacientů s pozitivním nálezem z biopsie. Dalším zjištěním byl fakt, že ve screeningové skupině byla míra nesignifikantních karcinomů diagnostikovaných na podkladě screeningu až 50 %. Ani jedna studie však nedokázala odpovědět na otázku, zda dokáže častější screening ovlivnit poměr rizik a přínosu screeningu pro populaci. V rámci studie ERSPC prováděla skupina z Gothenburgu [33] delší sledování pacientů s cílem o získání validnějších dat, pacienti byli sledováni po dobu 14 let. Z výsledků vyplývá, že celková mortalita na karcinom prostaty byla snížena o 50 %, přetrvává ovšem vysoké riziko diagnostiky nesignifikantních karcinomů.
Doporučení
V současnosti jsou pro časnou detekci karcinomu prostaty nejvýhodnějšími metodami pravidelné provádění DRV a odběry krve k určení hodnoty PSA. Existují sice specifičtější testy ke stanovení rizika přítomnosti karcinomu prostaty (proPSA, PCA3), jejich využití je však omezeno tím, že jsou plně hrazeny pacientem. Zlatým standardem v časné diagnostice tedy zůstává stanovení hladiny PSA, DRV a dle nálezů následně indikovaná biopsie prostaty. Nejdůležitější otázkou je, kdy začít s odběry, jak často je provádět, kdy skončit a hlavně kdy indikovat provedení biopsie prostaty.
Jak postupovat v klinické praxi? Na podkladě dat ze studií PLCO a ERSPC vznikla řada doporučení, která se v určitých jednotlivých detailech liší a každé pracoviště si je upravuje podle svých zkušeností, ale v zásadě lze pro časnou detekci karcinomu prostaty doporučit následný postup [34,35]:
- první vyšetření DRV a PSA provést ve věku 40 let, zvláště důležité je toto vyšetření u pacientů s pozitivní rodinnou anamnézou stran karcinomu prostaty,
- pokud je hodnota PSA pod 1 ng/ ml, je další vyšetření indikováno za pět let,
- při hodnotě PSA 1– 2,5 je další odběr indikován s odstupem 1– 2 let,
- při suspektním nálezu na DRV je automaticky indikována biopsie prostaty.
Indikace k biopsii prostaty:
- suspektní nález při DRV,
- hodnota PSA nad horní hranicí normy pro daný věk pacienta (viz věkově specifická PSA),
- f/ t PSA pod 0,1 při PSA 2,5– 10,
- PSAV větší než 0,4 ng/ ml/ rok u hodnot celkového PSA 1– 4 ng/ ml a více než 0,75 ng/ ml/ rok u hodnot PSA nad 4 ng/ ml.
Indikace k rebiopsii [27]:
- při detekci ložiska ASAP z první biopsie, měla by následovat do tří měsíců,
- u multifokálního ložiska HG PIN, měla by být provedena do šesti měsíců s minimálním počtem vzorků 12– 16,
- pokud byla dvakrát negativní biopsie, případně u vysoce rizikových mužů po první negativní biopsii a při přetrvávajícím riziku přítomnosti karcinomu prostaty je indikována saturační biopsie,
- negativní první biopsie při nálezu těchto kontrolních hodnot krevních testů:
- PSA > 10 ng/ ml,
- PSA 4– 10 ng/ ml i pokud f/ t PSA 10– 30 %,
- PSAV > 0,75 ng/ ml/ rok u pacientů starších 60 let,
- PSAV > 0,4 ng/ ml/ rok u pacientů mladších 60 let nebo hodnoty PSA pod 4.
Dle EUA doporučení pro karcinom prostaty je první odběr PSA doporučen ve věku 40 let k určení základní hladiny, pokud je jeho hodnota pod 1 ng/ ml, je další odběr indikován za osm let. Dále EUA doporučují ukončení screeningu ve věku 75 let, neboť časná detekce již většinou nemá klinický dopad [36].
Co je v dnešní době při detekci karcinomu prostaty již škodlivé? Důležitá je již sama aktivní spoluúčast pacienta. Pokud pacient není ochoten podstupovat pravidelné kontroly a doporučená vyšetření včetně biopsie prostaty, může již jeho přístup být pro jeho zdraví škodlivý. Dalším škodlivým faktorem je nedostatečná zkušenost obvodního lékaře, který pacienta nepoučí o možnostech screeningu, neodebere hodnotu PSA, zvýšení hodnoty bagatelizuje nebo neodešle pacienta ke specialistovi. Rovněž nezkušený urolog může působit škodlivě, pokud indikuje zbytečně časté odběry nebo naopak s kontrolním odběrem zbytečně váhá. Neuvážená indikace k provedení biopsie prostaty je rovněž škodlivá pro pacienta. Důležité je si uvědomit, kdy s kontrolami PSA a DRV začít a kdy je možné již kontroly ukončit. Doporučení, jak při kontrolách postupovat, je uvedeno výše. Ukončení odběrů PSA je indikováno u pacientů, jejichž předpokládaná délka života nepřesahuje deset let. Rovněž odběry u pacienta staršího 75 let již nejsou indikovány, jelikož je předpoklad, že i při prokázání karcinomu prostaty nebude u pacienta příčinou smrti. Nejdůležitější je tedy vždy individuální přístup a před každým provedeným vyšetřením pečlivá rozvaha, zda bude pro pacienta přínosem.
MUDr. Roman Wasserbauer
Urologická klinika LF MU a FN Brno
Jihlavská 20, 625 00 Brno
roman.wasserbauer@fnbrno.cz
Sources
1. Novotvary 2010 ČR. Ústav zdravotnických informací a statistiky ČR. [online]. Dostupné z: http:/ / www.uzis.cz/ system/ files/ novot2010.pdf.
2. Gosselaar C, Roobol MJ, Roemeling S et al. The role of the digital rectal examination in subsequent screening visits in the European randomized study of screening for prostate cancer (ERSPC), Rotterdam. Eur Urol 2008; 54(3): 581– 588. doi: 10.1016/ j.eururo.2008.03.104.
3. Dvořáček J, Babjuk M et al. Onkourologie. Praha: Galén 2005: 261– 300.
4. Catalona WJ, Partin AW, Slawin KM et al. Use of the percentage of free prostate‑ specific antigen to enhance differentiation of prostate cancer from benign prostatic disease: a prospective multicenter clinical trial. JAMA 1998; 279(19): 1542– 1547.
5. Catalona WJ, Smith DS, Ornstein DK. Prostate cancer detection in men with serum PSA concentrations of 2.6 to 4.0 ng/ mL and benign prostate examination. Enhancement of specificity with free PSA measurements. JAMA 1997; 277(18): 1452– 1455.
6. Carter HB, Pearson JD, Metter EJ et al. Longitudinal evaluation of prostate‑ specific antigen levels in men with and without prostate disease. JAMA 1992; 267(16): 2215– 2220.
7. Carter HB, Pearson JD, Metter EJ. Longitudinal evaluation of prostate‑ specific antigen levels in men with and without prostate disease. JAMA 1992; 267(16): 2215– 2220.
8. Ramirez ML, Nelson EC, Devere White RW et al. Current applications for prostate‑ specific antigen doubling time. Eur Urol 2008; 54(2): 291– 300. doi: 10.1016/ j.eururo.2008.04.003.
9. Vickers AJ, Savage C, O’Brien MF et al. Systematic review of pretreatment prostate‑ specific antigen velocity and doubling time as predictors for prostate cancer. J Clin Oncol 2009; 27(3): 398– 403. doi: 10.1200/ JCO.2008.18.1685.
10. Jansen FH, van Schaik RH, Kurstjens J et al. Prostate‑ specific antigen (PSA) isoform p2PSA in combination with total PSA and free PSA improves diagnostic accuracy in prostate cancer detection. Eur Urol 2010; 57(6): 921– 927. doi: 10.1016/ j.eururo.2010.02.003.
11. Vlaeminck‑ Guillem V, Ruffion A, Andre J. Value of urinary PCA3 test for prostate cancer diagnosis. Prog Urol 2008; 18(5): 259– 265. doi: 10.1016/ j.purol.2008.03.029.
12. Auprich M, Bjartell A, Chun FK et al. Contemporary role of prostate cancer antigen 3 in the management of prostate cancer. Eur Urol 2011; 60(5): 1045– 1054. doi: 10.1016/ j.eururo.2011.08.003.
13. Král M, Vyhnánková V, Študent V et al. Genetické riziko karcinomu prostaty. Ces Urol 2010; 14(3): 139– 147.
14. Yu KK, Hricak H. Imaging prostate cancer. Radiol Clin North Am 2000; 38(1): 59– 85.
15. Rosenkrantz AB, Mussi TC, Borofsky MS et al. 3.0 T multiparametric prostate MRI using pelvic phased‑ array coil: utility for tumor detection prior to biopsy. Urol Oncol 2013; 31(8): 1430– 1435. doi: 10.1016/ j.urolonc.2012.02.018.
16. Roethke M, Anastasiadis AG, Lichy M et al. MRI‑ guided prostate biopsy detects clinically significant cancer: analysis of a cohort of 100 patients after previous negative TRUS biopsy. World J Urol 2012; 30(2): 213– 218. doi: 10.1007/ s00345‑ 011‑ 0675‑ 2.
17. Bělohlávek O, Jarolím L. Zobrazení karcinomu prostaty metodami nukleární medicíny. Ces Urol 2012; 16(4): 205– 213.
18. Afshar‑ Oromieh A, Zechmann CM, Malcher A et al. Comparison of PET imaging with a (68)Ga‑ labelled PSMA ligand and (18)F‑ choline‑based PET/ CT for the diagnosis of recurrent prostate cancor. Eur J Nucl Med Mol Imaging 2014; 41(1): 11– 20. doi: 10.1007/ s00259‑ 013‑ 2525‑ 5.
19. Eastham JA, Riedel E, Scardino PT et al. Variation of serum prostate‑ specific antigen levels: an evaluation of year‑ to‑year fluctuations. JAMA 2003; 289(20): 2695– 2700.
20. Čermák A, Marečková N, Pacík D. Infectious complications of prostate biopsy: the changes in antibiotics resistance patterns – the review of 5 years period. J Urol 2010, 183 (4 Suppl): 817– 818.
21. Čermák A, Marečková N, Karmašová K et al. Antibiotic resistance changes in infection following transrectal ultrasound guided prostate biopsy – review of 5 years period. Eur Urol 2010; 9 (2 Suppl): 82–83.
22. Čermák A, Pacík D. Transrektální ultrazvukem vedené biopsie prostaty. Urol List 2007; 5(4): 22– 29.
23. Pacík D, Páč L, Čermák A et al. Výzkum senzitivní inervace parenchymu prostaty se zaměřením na možnost ovlivnění bolestivého vjemu při biopsii prostaty. Ces Urol 2011; 15 (Suppl 2): 41.
24. Jones JS, Ulchaker JC, Nelson D et al. Periprostatic local anesthesia eliminates pain of office‑based transrectal prostate biopsy. Prostate Cancer Prostatic Dis 2003; 6(1): 53– 55.
25. Borboroglu PG, Comer SW, Riffenburgh RH et al. Extensive repeat transrectal ultrasound guided prostate biopsy in patients with previous benign sextant biopsies. J Urol 2000; 163(1): 158– 162.
26. Djavan B, Remzi M, Schulman CC et al. Repeat prostate biopsy: who, how and when? A review. Eur Urol 2002; 42(2): 93– 103.
27. Čermák A. Biopsie prostaty – současná strategie, kde, kolik, jak odebírat vzorky? In: Karcinom prostaty od A do Z. Brno: Urologická klinika FNB 2011; 7.
28. Jones JS, Zippe CZ. Office‑based prostate biopsy. Local anesthesia and strategy to improve cancer detection. 99th Annual Meeting AUA 2004; Postgrad Course: 7.
29. Loeb S, Carter HB, Berndt SI et al. Complications after prostate biopsy: data from SEER‑ Medicare. J Urol 2011; 186(5): 1830– 1834. doi: 10.1016/ j.juro.2011.06.057.
30. NCCN clinical practice guidelines in oncology. Prostate cancer early detection. NCCN Practice GuidelinesTM 2012; version: 2.2012: 15.
31. Andriole GL, Crawford ED, Grubb RL 3rd et al. Mortality results from a randomized prostate‑ cancer screening trial. N Engl J Med 2009; 360(13): 1310– 1319. doi: 10.1056/ NEJMoa0810696.
32. Schröder FH, Hugosson J, Roobol MJ et al. Screening and prostate‑ cancer mortality in a randomized European study. N Engl J Med 2009; 360(13): 1320– 1328. doi: 10.1056/ NEJMoa0810084.
33. Hugosson J, Carlsson S, Aus G et al. Mortality results from the Göteborg randomised population‑-based prostate‑ cancer screening trial. Lancet Oncol 2010; 11(8): 725– 732. doi: 10.1016/ S1470‑ 2045(10)70146‑ 7.
34. Pacík D. Karcinom prostaty pro praktického onkologa, urologa i rodinného lékaře. 1. ed. Praha: We Make Media s. r. o. 2007.
35. Belej K. Screening karcinomu prostaty, Onkologie 2009; 3(6): 351– 356.
36. Heidenreich A, Bastian PJ, Bellmunt J et al. Guidelines on prostate cancer. European Association of Urology 2013. Available from: http:/ / www.uroweb.org/ gls/ pdf/ 09_Prostate_Cancer_LR.pdf.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2014 Issue 2
Most read in this issue
- Active approach to prostate cancer detection – what is reasonable and what may cause harm
- Prostate cancer – from hormonal dependency to castration resistant cancer
- Transrectal high-intensity focused ultrasound for the treatment of localized prostate cancer
- Erectile dysfunction and its treatment – pharmacological and clinical profile of avanafil