Biologická léčba idiopatických střevních zánětů
Dátum publikácie: 26. 10. 2016
Definice:
- Idiopatické střevní záněty (IBD) jsou skupinou chronických imunitně podmíněných zánětlivých onemocnění postihujících primárně gastrointestinální trakt.
- Řadíme sem Crohnovu nemoc, ulcerózní kolitidu a tzv. indeterminovanou kolitidu.
Patogeneze:
- Jednoznačná příčina je nejasná.
- Genetická predispozice s polygenním typem dědičnosti.
- Porucha slizniční imunoregulace a ztráta tolerance vůči normální střevní mikroflóře u predisponovaných osob.
Epidemiologie:
- Významný vzestup incidence v ekonomicky vyspělých zemích Evropy a Severní Ameriky se zřetelným severojižním a západovýchodním gradientem.
- Incidence v ČR 3–5 případů na 100 000 obyvatel.
- Prevalence v ČR kolem 40 pacientů na 100 000 obyvatel.
Klasifikace:
Ulcerózní kolitida (UC) je nespecifický hemoragicko-katarální zánět postihující téměř vždy sliznici konečníku a šířící se kontinuálně v rámci vývoje nemoci orálním směrem s možností postižení celého tračníku. Průběh onemocnění je u většiny nemocných charakterizován obdobími relapsů a remisí. U třetiny nemocných pozorujeme chronicky aktivní průběh s trvalými projevy zánětlivé aktivity.
Crohnova nemoc (CN) je chronický, nespecifický, transmurální, granulomatózní zánět trávicí trubice postihující segmentálně nebo plurisegmentálně zejména terminální ileum a oblast ileocekálního přechodu. Často bývá postižen i tračník a konečník. Byly popsány i netypické lokalizace téměř ve všech částech trávicí trubice (tenké střevo, žaludek, jícen i dutina ústní). Téměř vždy se lokalizace zánětu vzájemně kombinují.
Indeterminovaná kolitida (IC) je zánět tračníku, který představuje zvláštní klinickou jednotku vyskytující se častěji u dětí než dospělých a nesplňující jednoznačně kritéria UC ani CN. Klinický obraz je různorodý, blíží se spíše UC, příměs krve ve stolici však bývá poměrně vzácně.
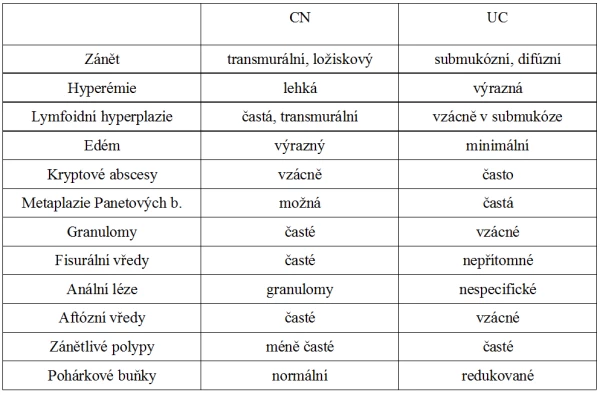
Rozdíly v patologickoanatomickém obraze CN a UC:
Léčba IBD
S ohledem na indikace, léčebné strategie a dosažené cíle se medikamentózní léčba IBD počátkem nového tisíciletí změnila. Bylo to nejen v důsledku zavedení nových biologických léků do běžné klinické praxe. Změnily se také cíle léčby, dosažení klidové neboli asymptomatické fáze nemoci bylo vystřídáno cílem, který je označován jako trvalá hluboká remise. Pacient nemá subjektivně žádné obtíže, není ale přítomna ani zánětlivá aktivita choroby detekovatelná laboratorně či endoskopicky. Zavedení biologické léčby u řady nemocných s nejtěžšími formami střevních zánětů přineslo mnoho pozitivního včetně navození dlouhodobé hluboké remise, snížení potřeby chirurgických výkonů i minimalizace vzniku nevratných strukturálních změn a umožnilo vést kvalitní osobní a sociální život včetně snížení invalidity a dlouhodobé pracovní neschopnosti.
„Konvenční“ terapie IBD
IBD nejsou definitivně vyléčitelné žádnou medikamentózní terapií. Naštěstí více než polovina nemocných s IBD má lehčí formu nemoci s nízkou aktivitou klinickou, laboratorní i endoskopickou. Pouze menší část nemocných vyžaduje podávání imunosupresivní či biologické léčby. Podle cílů je potřeba medikamentózní léčbu rozdělit na indukční a udržovací. Indukční léčba má za cíl co nejrychleji snížit aktivitu zánětu a potlačit příznaky onemocnění, dlouhodobá udržovací léčba má zabránit návratu symptomů a projevů IBD. Lékem první volby zůstává mesalazin (případně sulfasalazin), který je vhodný pro nemocné s mírnou a střední aktivitou střevního zánětu. Může být podáván v lokálních lékových formách (čípky, nálevy, pěny) i perorálně ve formě tablet nebo granulí. Příznivou terapeutickou odpověď je možno očekávat v téměř polovině případů. Alternativou salicylátu je budesonid, kortikoid s lokálním účinkem podávaný ve formě tablet s řízeným uvolňováním. Pokud dojde k navození remise, pokračujeme u nemocných s UC v udržovací léčbě mesalazinem, případně imunosupresivy. Další léčebnou možností je podání přípravků ovlivňujících složení mikrobiální střevní flóry – antibiotik (ciprofloxacin, metronidazol, rifampicin) – po dobu 2–6 týdnů či probiotik.
Jestliže takto nedojde k navození remise, je potřeba podat kortikoidy nebo kombinaci léčiv, případně zvážit aplikaci biologické léčby (BL). Glukokortikoidy, zejména prednison a methylprednisolon, jsou stále bohatě využívány pro svůj výrazný protizánětlivý efekt v lokální či systémové formě, včetně možnosti parenterální aplikace. Jeví se jako ideální prostředek k navození remise, naopak v udržovací fázi léčby jsou neúčinné a při dlouhodobém užívání a po opakovaném vysazování se začnou naplno manifestovat závažné nežádoucí účinky. Asi čtvrtina nemocných je primárně rezistentní na léčbu glukokortikoidy (kortikorezistence) a polovina těch nemocných, kteří primárně velmi dobře odpověděli na léčbu steroidy, zůstává na této terapii závislá (kortikodependence). To jsou z velké části následně kandidáti BL.
Jako imunosupresiva jsou v udržovací léčbě IBD stále více užívány azathioprin, 6-merkaptopurin a methotrexát (u CN). Jsou určeny k systémovému podávání ve formě tablet. Musíme ale vzít v potaz, že více než 10 % nemocných imunosupresivní léčbu nesnáší a nástup terapeutického účinku je velmi dlouhý (několik týdnů až měsíců). Zjistíme, že z této terapie v dlouhodobém horizontu profituje méně než polovina kortikodependentních nemocných. Takže i při použití všech dostupných prostředků konvenční medikamentózní léčby nejsou její výsledky příliš povzbudivé, především u nemocných s CN. Méně než polovina nemocných, u kterých byla navozena remise medikamenty, je v průběhu dalších dvou let v remisi a v období desetiletém zůstává v remisi jen desetina nemocných. Cyklosporin A je stále ještě okrajově užíván jako záchranná terapie u nemocných s fulminantním typem UC.
Biologická léčba IBD
Právě neuspokojivé výsledky konvenční terapie IBD vedly k hledání dalších možností léčby, které by byly schopny cíleně zasáhnout do zánětlivého procesu, případně ovlivnit i přirozený průběh onemocnění. BL představuje v současnosti nejúčinnější způsob léčby IBD. Kromě nesporného přínosu je však BL spojena s problémy, mezi něž patří především ekonomická náročnost léčby a riziko závažných nežádoucích účinků. Je třeba si také uvědomit, že více než čtvrtina nemocných na BL vůbec neodpoví (primární nonrespondéři) a dlouhodobá účinnost je limitována ztrátou odpovědí v průběhu udržovací léčby (sekundární nonrespondéři). Proto by BL měla být podávána jen těm nemocným, u kterých lze předpokládat, že z ní budou dlouhodobě profitovat. Je potřeba dosáhnout maximální léčebné a ekonomické efektivity a co nejvíce minimalizovat rizika nežádoucích účinků. Cílem BL je co nejdříve dosáhnout klidové fáze střevního onemocnění a umožnit úplné vysazení kortikosteroidů. Hlavní indikací k zahájení BL jsou střední a především vysoká aktivita střevního zánětu, kortikodependentní a kortikorezistentní průběh onemocnění a těžké mimostřevní projevy vázané na aktivitu IBD u nemocných, kteří adekvátně neodpověděli na konvenční medikamentózní terapii. Jak již bylo uvedeno, aplikace BL může být spojena s řadou závažných nežádoucích účinků a komplikací. Proto je potřeba respektovat kontraindikace podávání BL, mezi něž patří zejména těžká alergická reakce na aplikaci léčiva, aktivní infekce či sepse, náhlá příhoda břišní, absces bez předchozí sanace, demyelinizační onemocnění, závažná kardiální insuficience nebo maligní onemocnění v průběhu posledních pěti let. V posledním desetiletí se zcela zásadně změnily principy a strategie podávání BL. Od původního, epizodického podávání jedné až tří dávek BL v době vzplanutí nemoci přes přemosťující podávání několika dávek BL spolu s imunosupresivy až k současnému, řízenému dlouhodobému podávání. Příslibem do budoucnosti je zahájení BL v době stanovení diagnózy s možností modifikace průběhu onemocnění. Pro tuto „top-down strategy“ však zatím nemáme dostatek vědeckých dat ani finančních prostředků. Dosavadní výsledky omezeného počtu klinických pozorování prokazují bezpečnost podávání BL u gravidních pacientek. Jelikož monoklonální protilátky aktivně prostupují placentární bariérou od šestého měsíce gravidity, doporučuje se ukončit BL na konci druhého trimestru gravidity. Do současnosti proběhlo ve světě mnoho klinických zkoušek a studií s preparáty BL u IBD. Zkoušeno bylo nebo studie stále probíhají u více než 50 molekul s různými výsledky. V současné době je v České republice pro léčbu IBD povolen infliximab, adalimumab, golimumab (jen pro UC) a nově vedolizumab. Další látky BL, jejichž dosavadní výsledky v léčbě IBD jsou příslibem pro budoucnost, jsou uvedeny níže.
Infliximab
Infliximab (IFX) je chimérická lidská/myší monoklonální IgG1 protilátka namířená proti TNF-α. Je využíván nejen v gastroenterologii, ale i revmatologii a dermatologii. Do klinické praxe v léčbě IBD byl zaveden téměř před 20 lety. V Evropě a České republice byl IFX v roce 1999 povolen pro léčbu CN a v roce 2006 pro léčbu UC. Od roku 2007 je povolen k terapii dětských pacientů s CN starších šesti let. Do současnosti byly tímto preparátem na celém světě léčeny téměř dva miliony nemocných s revmatoidní artritidou, psoriázou, ankylozující spondylitidou, CN a UC. Proto jsou data o účinnosti i nežádoucích projevech léčby nejrozsáhlejší a nejlépe zdokumentované. Aplikace IFX v dávce 5–10 mg/1 kg hmotnosti probíhá prostřednictvím intravenózní infuze, která by měla trvat nejméně 2 hodiny. Preparát vykazuje velkou afinitu k TNF-α a váže nejen volný cytokin, ale uvolňuje i ten, co byl již navázán na receptor, čímž se výrazně zvyšuje jeho protizánětlivý účinek. Během indukční fáze léčby aplikaci dvakrát opakujeme ve dvou- a čtyřtýdenním intervalu. V případě příznivé odpovědi na indukci pokračujeme v udržovací fázi v aplikacích v osmitýdenních intervalech. Pro zavedení do klinické praxe měly význam výsledky studií ACCENT I (luminální typ CN), ACCENT II (fistulující typ CN) a ACT 1, ACT 2 (UC). Význam IFX pro léčbu dětských pacientů s CN potvrdila studie REACH. V porovnání s dospělými pacienty jsou výsledky léčby IFX významně lepší. Toto zatím nebylo spolehlivě vysvětleno, nicméně IFX je podáván dětským pacientům v časnějších stadiích nemoci, kdy ještě nevznikly hrubé strukturální změny trávicí trubice a děti nejsou dlouhodobě vystaveny zhoršujícím vlivům zevního prostředí. Ukazuje se, že terapie IFX by měla probíhat dlouhodobě, především v prvním půlroce společně s imunosupresivní terapií thiopuriny. Studie SONIC u CN a SUCCES u UC potvrdily, že zejména u naivních pacientů přináší tato kombinace nejlepší výsledky.
Biosimilární infliximab
Současně s originálními molekulami BL byly vyvíjeny i jejich kopie, biologicky podobná (biosimilární) léčiva. Po vypršení patentu originálních přípravků a schválení regulační autoritou jsou biosimilars zaváděna do klinické praxe. Biosimilární IFX byl schválen SÚKLem pro léčbu IBD od 6. 11. 2013 a od počátku roku 2014 jsou v ČR dostupné dva biosimilární IFX s obchodními názvy Remsima a Inflectra. Jejich efektivita a bezpečnost byly ověřeny v revmatologii, ale vzhledem k podobným farmakokinetickým vlastnostem lze očekávat i stejné výsledky klinické v léčbě nemocných s IBD. Dávkování a způsob podávání jsou totožné s originálním IFX.
Adalimumab
Adalimumab (ADA) je rekombinantní, plně humánní monoklonální protilátka třídy IgG1, zaměřená proti TNF-α. Vazba na solubilní i membránově vázané TNF-α se děje s vysokou afinitou a specificitou a blokuje tím jeho interakci s buněčnými receptory. Přípravek je aplikován podkožně většinou jedenkrát za dva týdny v dávce 40 mg. Úvodní dávka je s ohledem na rychlost očekávaného léčebného účinku BL 80–160 mg. Z místa aplikace se resorbuje poměrně pomalu a maximální koncentrace v plazmě dosahuje za 48 hodin, biologická dostupnost je kolem 76 %. Výhodou tohoto preparátu je plně humánní struktura molekuly, což má význam hlavně pro nemocné s předchozí alergickou reakcí na IFX. Po náležitém zaškolení může aplikaci provádět sám pacient v domácím prostředí. Pro ověření efektivity ADA a zavedení do klinické praxe léčby CN měly význam především výsledky rozsáhlých klinických studií CLASIC-1, CLASIC-2 a CHARM. Dosažené výsledky nejsou v porovnání s IFX tak přesvědčivé, na druhou stranu je ale třeba poznamenat, že výrazně horších výsledků bylo dosaženo u nemocných s vyšší tělesnou hmotností a u nemocných, kteří byli již v minulosti léčeni IFX a většinou u nich tato léčba selhala. V budoucnu patrně bude třeba dávku ADA modifikovat a nemocným s UC s tělesnou hmotností nad 80 kg podávat dávku vyšší.
Golimumab
Golimumab je kompletně humánní IgG protilátka pro subkutánní aplikaci proti TNF-α. Vykazuje výhodnější farmakokinetické vlastnosti, indukční dávka je 200 mg v týdnu 0 a 100 mg v týdnu 2. Udržovací léčba je 50 mg aplikovaných 1× měsíčně. Účinnost golimumabu v léčbě nemocných s UC potvrdila studie PURSUIT. Preparát je povolen pouze k léčbě nemocných s UC od roku 2013.
Vedolizumab
Vedolizumab je specifická protilátka proti α4β7 integrinovým receptorům na povrchu leukocytů znemožňující jejich vazbu na endoteliální buňky. Specificita k receptoru α4β7 zajišťuje jeho cílené působení jen v oblasti trávicí trubice. V současné době ještě probíhá klinické testování dlouhodobé účinnosti a bezpečnosti u nemocných s CN i UC a dosavadní výsledky jsou i v těchto oblastech velmi slibné, i přes intravenózní aplikaci léčiva především bezpečnostní profil. Preparát je indikován u nemocných s UC i CN, u nichž buď nastala neadekvátní odpověď na konvenční terapii nebo na antagonistu tumor nekrotizujícího faktoru alfa, nebo došlo ke ztrátě odpovědi na léčbu, nebo u těch, kteří uvedenou léčbu netolerují. Lék však dosud nemá stanovenou úhradu, a tudíž musí být o výjimečnou úhradu nákladů individuálně požádán plátce zdravotní péče.
Další prostředky BL dosud nepovolené pro léčbu IBD v ČR
Certolizumab pegol (Cimzia) je pegylovaný Fab fragment imunoglobulinu vázající se na solubilní membránový receptor TNF-α. Preparát je dosud povolen k léčbě CN v USA a ve Švýcarsku. Lék je účinný především u luminální formy CN a aplikuje se jednou měsíčně podkožně. Nástup účinku je pomalejší, proto by mohl být využit především v udržovací fázi léčby v kombinaci s IFX nebo ADA. Další výhodou je, že lék neprochází placentární bariérou, a proto je příslibem i v léčbě gravidních IBD pacientek v celém průběhu těhotenství.
Natalizumab (Tisabri, Antegren) je humanizovaná monoklonální protilátka IgG4 zaměřená na adhezivní molekulu α4β1 integrin, zabraňující migraci leukocytů z kapilárního řečiště do tkáně. Dlouhodobý léčebný efekt pro nemocné s CN byl v několika klinických studiích velmi slibný. Studie však musely být zastaveny pro závažné nežádoucí účinky, mimo jiné i úmrtí několika nemocných v souvislosti s progresivní multifokální leukoencefalopatií. Následný pečlivý rozbor všech pacientů, kteří participovali v klinických studiích s natalizumabem, další nežádoucí účinky nepotvrdil. Lék je celosvětově užíván především v léčbě roztroušené sklerózy a od roku 2009 je povolen i k léčbě CN v USA. O registraci v Evropě pro léčbu IBD se neuvažuje, protože bude patrně zcela nahrazen novou generací této skupiny léčiv, vedolizumabem.
Trichuris suis (TSO) je celosvětově rozšířená hlístice, která parazituje v trávicím traktu zvířat, pro člověka je zcela neškodná. Dosavadní pozorování potvrdila, že přítomnost Trichuris suis v trávicím traktu člověka obnovuje imunitní rovnováhu, a tak může potlačit neadekvátní autoimunní reakce. V několika menších klinických studiích bylo s velmi slibnými výsledky vyzkoušeno opakované podání koktejlu vajec Trichuris suis nemocným s CN. Nicméně k registraci pro léčbu IBD dosud nedošlo.
Indikace k zahájení biologické léčby
Crohnova nemoc
Hlavní indikací pro zahájení BL je selhání „konvenční terapie“, tedy aminosalicylátů, kortikosteroidů a imunosupresiv, u nemocných se střední a zejména vysokou aktivitou CN. Další indikací jsou secernující perianální píštěle nereagující na terapii antibiotiky a imunosupresivy v kombinaci s chirurgickým zákrokem. Před podáním BL je nutno vyloučit absces, v případě jeho přítomnosti je potřeba zajistit jeho drenáž. Pro léčbu ostatních píštělí je efektivita BL výrazně nižší, enterovezikální píštěl do močových cest je důvodem k operačnímu řešení. U nemocných, u nichž není možno v průběhu 3 měsíců snížit dávku prednisonu pod 10 mg (kortikodependence), je také BL jednoznačně indikována. U pacientů s očekávaným vysokým rizikem nepříznivého vývoje nemoci není nutné postupně vyčkávat na selhání jednotlivých preparátů „konvenční terapie“ a je vhodná časně akcelerovaná BL v kombinaci s imunosupresivy. BL je vhodná před chirurgickým výkonem k dosažení slizničního zhojení a velmi slibné jsou i dosažené výsledky klinických studií s aplikací BL jako pooperační profylaxe u vysoce rizikových nemocných.
Ulcerózní kolitida
U nemocných se střední nebo vysokou aktivitou UC, kteří nereagují na běžnou terapii nebo tuto léčbu netolerují nebo mají při této terapii vážné nežádoucí účinky, je indikováno podání BL. Také pro aplikaci BL jsou indikovaní kortikodependentní nemocní. IFX je možné užít jako „záchrannou“ terapii u nemocných s fulminantním průběhem UC, kteří neodpovídají na 3–5denní intravenózní aplikaci kortikosteroidů v dávce nejméně 1 mg/kg. V současné době je IFX v dávce 10 mg/kg v této indikaci preferován před cyklosporinem A.
Doporučená screeningová vyšetření před zahájením BL
U pacientů léčených anti-TNF-α hrozí riziko reaktivace některých závažných infekcí. Před zahájením BL je nutno provést vyšetření na latentní TBC (rtg. plic, Mantoux II a/nebo Quantiferon test, případně T-Spot). Průkaz latentní TBC není jednoznačnou kontraindikací pro podávání BL. Pacientovi však musí být před zahájením BL podána profylaktická antituberkulózní terapie v součinnosti s odborným lékařem TRN. Pacient musí být i během dlouhodobého podávání BL sledován stran rizika reaktivace latentní TBC. Dále by všichni kandidáti BL měli být vyšetřeni na přítomnost HBV infekce (sérologicky), CMV infekce (imunohistochemické vyšetření bioptického vzorku) a Clostridium difficile (vyšetření vzorku stolice na průkaz klostridiového toxinu A i B).
Podávání biologické léčby, monitorace pacientů
Od roku 2006 je BL v České republice podávána v rámci 45 center biologické léčby IBD (z toho 11 center je pro dětské pacienty s IBD). Centra jsou proporcionálně rozmístěna při gastroenterologických pracovištích větších lůžkových zdravotnických zařízení po celé republice, tak aby aplikace BL byla dostupná pro veškerou populaci. Průměrně je v každém centru léčeno 50–100 nemocných s IBD. Tato centra jsou adekvátně vybavena materiálně i personálně, tak aby byla zajištěna především bezpečnost nemocných. Vzhledem k riziku alergické reakce provádí aplikaci BL lékař nebo vyškolený IBD nelékařský personál, který je seznámen s nežádoucími účinky terapie, jež se mohou projevit během aplikace nebo těsně po jejím ukončení. V každém centru musí být zajištěna dostupnost anesteziologa a monitorovaného lůžka na jednotce intenzivní péče. Infuzní alergické reakce se vyskytují asi u 15 % nemocných léčených IFX, bývají anafylaktoidního typu. V případě alergické reakce je nutno ihned přerušit infuzi, podat systémově působící glukokortikoidy a antihistaminika, případně, dle klinického stavu a charakteru reakce, podat další terapii za průběžného sledování vitálních funkcí. Těžká alergická reakce je důvodem k ukončení léčby IFX, v případě lehčí reakce se doporučuje před každou další aplikací IFX podat parenterálně systémově působící kortikosteroidy v dávce odpovídající 200 mg hydrokortizonu a aplikaci infuze zpomalit. Alergické reakce opožděného typu se objevují do 10 dnů od podání infuze IFX. Projevují se bolestmi kloubů, svalů, horečkou a únavou. Léčba spočívá opět v podávání systémových kortikoidů v dávce závislé na charakteru a intenzitě potíží. Pokud se objeví tato reakce, je vhodné pacienta převézt na jinou formu BL. Po třech aplikacích BL, před zahájením udržovací fáze BL, je třeba zhodnotit odpověď nemocného na BL. Lékař centra provede podrobné klinické a laboratorní vyšetření, u nemocných s UC je vhodné i vyšetření endoskopické. Pro pokračování terapie jsou vhodní jen nemocní, u kterých prokazatelně došlo ke zlepšení klinického, laboratorního a případně i endoskopického nálezu. Nemocní v remisi, kteří přešli do dlouhodobé udržovací fáze BL, se musejí v pravidelných (maximálně osmitýdenních) intervalech podrobit kontrolním vyšetřením. Toto je nezbytné i pro nemocné na dlouhodobé terapii ADA, kteří si lék aplikují sami doma. V každém centru BL je podrobně vedena databáze pacientů s registrací nežádoucích účinků a monitorováním efektivity terapie.
Intenzifikace BL, přechod mezi jednotlivými preparáty BL
Každý rok dochází přibližně u 10 % pacientů na dlouhodobé udržovací terapii k selhávání léčby. V tomto případě se považuje za nejvýhodnější stanovit úroveň hladiny léčiva a případné protilátky. Při nálezu nízké hladiny léčiva je vhodná u selhávající terapie intenzifikace BL, a to zkrácením intervalu mezi jednotlivými aplikacemi, případně navýšením dávky léčiva. V případě IFX je možno interval mezi aplikacemi zkrátit na 6 týdnů a dávku navýšit na 10 mg/kg hmotnosti nemocného. U ADA lze zkrátit interval mezi aplikacemi na jeden týden, pro zvýšení dávky na 80 mg zatím neexistují přesvědčivá data. V případě dostatečné hladiny léčiva, případně vysoké hladiny protilátek je indikován přechod na jiný preparát BL. Také závažná alergická reakce nebo jiný projev nesnášenlivosti jsou důvodem k přechodu na jiný preparát BL. Ostatní důvody (ekonomické či přání pacienta) nejsou vhodné pro přechod k jinému preparátu BL. Jak potvrdily publikované výsledky studie SWITCH, jiné než medicínské důvody přechodu na jiný preparát vedou paradoxně ke zhoršení zdravotního stavu a eskalaci ekonomických nákladů u nemocných s IBD na BL.
Nežádoucí účinky BL
BL je rizikovým faktorem infekčních komplikací a zejména manifestace oportunních infekcí. Riziko infekcí stoupá především u nemocných na kombinované imunosupresivní terapii (kortikoidy, imunosupresiva, BL). Dalšími rizikovými faktory jsou věk nad 55 let, závažná přidružená onemocnění a poruchy výživy. Nejčastěji se setkáváme s nákazou pneumokoky, herpesviry a mykotickými infekcemi. Při důsledně prováděném screeningu na TBC není výskyt manifestní TBC výrazně vyšší u nemocných na BL než v ostatní populaci. Všem nemocným před zahájením BL by mělo být doporučeno očkování proti infekci Streptococcus pneumoniae. Očkování živými vakcínami je u nemocných na BL kontraindikováno. Neživé vakcíny je možno podávat bez omezení, ale jejich efektivita může být snížena a je vhodné ji sérologicky zkontrolovat. Kožní komplikace při BL jsou poměrně časté. Bývají pozorovány infekční (bakteriální, virové i mykotické) i různé neinfekční kožní projevy. Většinou bývají mírné s velmi dobrou odpovědí na lokální terapii. K závažnějším patří manifestace psoriariformních erupcí a nebezpečí exacerbace preexistující psoriázy, velmi vzácná je leukocytoklastická vaskulitida. V průběhu BL dochází poměrně často k indukci tvorby autoprotilátek (ANA, anti-dsDNA). Naštěstí se ve většině případů jedná jen o laboratorní odchylku. Jen u malé části pacientů se v průběhu BL vyvine obraz polékového systémového lupusu (SLE) s bohatou revmatologickou symptomatologií. Manifestace SLE je důvodem k ukončení BL, což ve většině případů vede k ústupu symptomatologie. Zvýšené riziko vzniku solidních nádorů u nemocných na BL nebylo prokázáno. U několika desítek mladých mužů léčených současně thiopuriny a IFX byl popsán hepatosplenický T-lymfom, vysoce maligní onemocnění s velmi špatnou prognózou.
PRAKTICKÉ TIPY A DOPORUČENÍ
- Léčbu IBD obvykle zahajuje a vede odborný gastroenterolog.
- Nemocní s těžším a chronicky aktivním průběhem onemocnění jsou léčeni a sledováni na odborném pracovišti zabývajícím se léčbou IBD s dostupností erudovaného chirurga a dalších odborníků v problematice IBD.
- Biologická léčba je podávána u nejtěžších forem onemocnění ve specializovaných centrech biologické léčby IBD na pracovištích III. typu, která jsou adekvátně technicky i personálně vybavena.
- Lukáš M., Bortlík M. Etiologie a patogeneze ulcerózní kolitidy. Stále více otazníků než jasných odpovědí. Gastroenterologie a hepatologie 2011; 65 (2): p. 56–64.
- Lukáš M. Farmakoterapie idiopatických střevních zánětů. Prakt. lék, 2009, 5, č. 2, s. 121–124.
- Hanauer S. B., Feagan B. G., Lichtestein, G. R., et al. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet 2002, 359 (9317) p. 1541–1549.
- Sands B. E., Blank M. A., Diamond R. H., et al. Maintance infliximab does not reset in increased abscess development in fistulizing Crohn’s disease: results from the ACCENT II study. Aliment Pharmacol Ther 2006, 23 (8), p. 1127–36.
- Travis S. P. L., Stange E. F., Léman M., et al: European evidence-based Consensus on the management of ulcerative colitis: Current management. Journal of Crohn’s and Colitis 2008; 2, p. 24–62.
- Hyams J., Crandall W., Kugathasan S., et al. Induction and maintenance infliximab therapy for the treatment of moderate to severe Crohn’s disease in children. Gastroenterology, 2007, 132, p. 863–873.
- Colombel J. F., Sandborn W. J., Reinisch W., et al. Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Engl J Med 2010, 362 (15), p. 1383–1395.
- Panaccione R., Ghos S., Middleton S., et al. Infliximab, Azathioprine, or Infliximab+Azathioprine for Treatmen of Moderate to Severe Ulcerative Colitis, The Succes Trial. Gastroenterology 2011, 140, p. 134.
- Hanauer S., Sandborn W. J., Rutgeerts P., et al. Human anti-tumor necrosis factor monoclonal antibody (adalimumab) in Crohn’s diasease: the CLASSIC-I trial. Gastroenterology 2006, 130 (2), p. 323–333.
- Loftus E. V., Johnson S. J., Wang S. T., et al. Risk-benefit analysis of adalimumab versus traditional non-biologic therapies for patiens with Crohn’s disease. Inflamm Bowel Dis 2011, 17 (1), p. 127–140.
- Colombel J. F., Sandborn W. J., Rutgeerts P., et al. Adalimumab for maintenance of clinical response and remission in patiens with Crohn’s disease: the CHARM trial. Gastroenterology 2007, 132 (1), p. 52–65.
- Sandborn W. J., Feagan B. G., Marano C., et al. Subcutaneous Golimumab Maintains Clinical Response in Patients with Moderate-to-Severe Ulcerative Colitis. Gastroenterology 2014, 146, p. 96–109.
- Lukáš M. Obecné principy biologické léčby u IBD. In: Pavelka K., Arenberger P., Lukáš M. et al. Biologická léčba zánětlivých autoimunních onemocnění. Grada Publishing, Praha 2014.
- Bortlík M., Ďuricová D., Kohout P., et al. Doporučení pro podávání biologické terapie u idiopatických střevních zánětů: třetí aktualizované vydání. Gastroent Hepatol 2016; 66 (1), p. 12–22.
- Van A. G., Vermiere S., Ballet V., et al. Switch to adalimumab in patiens with Crohn’s disease controlled by maintenance infliximab: prospective randomised SWITCH trial. Gut 2012, 70 (1), p. 11–27.
- Stehlík J., Mareš K., Lukáš M., et al. Doporučení pro vakcinaci nemocných s Crohnovou chorobou a ulcerózní kolitidou na imunosupresivní a biologické léčbě. Čes. a slov. gastroent. a hepatol. 2010; 64, p. 40–48.
- Duricova D., Bortlik M., Komarek V., et al. Skin Complications During Therapy with anti-TNF a Preparations: Experience of a Single Centre. Gastroenterology 2010, 138, p. 763.
- Sica G. S., Biancone L. Surgery for inflammatory bowel disease in the era of laparoscopy. World J Gastroenterol 2013; 19 (16): 2445–2448.
Bol pre Vás kurz prínosný? Radi by ste sa k nemu vyjadrili? Napíšte nám − Vaše názory a postrehy nás zaujímajú. Zverejňovať ich nebudeme, ale radi Vám na ne odpovieme.
