-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Bimekizumab vs. adalimumab v terapii středně závažné až závažné plakové psoriázy
12. 8. 2022
Bimekizumab je humanizovaná monoklonální protilátka IgG1 selektivně inhibující interleukiny 17A a 17F pro terapii středně závažné až závažné ložiskové psoriázy u dospělých, u nichž je indikovaná systémová léčba. Klinická studie fáze III BE SURE se soustředila na porovnání účinnosti a bezpečnosti bimekizumabu a inhibitoru tumor nekrotizujícího faktoru alfa (TNF-α) adalimumabu, který v současnosti představuje jeden ze základních pilířů systémové terapie.
Úvod
V recentních výzkumech byly identifikovány další klíčové prozánětlivé cytokiny v patogenezi psoriázy, a to interleukiny (IL) 17A, 17F a 23. IL-17A a IL-17F tvoří homodimery a heterodimery, které působí synergicky s TNF-α na stimulaci zánětlivých pochodů. Některé publikované výzkumy naznačují superioritu inhibitorů IL-17A vůči inhibitorům TNF-α v rámci kontroly zánětlivých procesů u psoriázy.
Bimekizumab je humanizovaná monoklonální protilátka IgG1 selektivně inhibující homodimery i heterodimery interleukinů 17A a 17F vedoucí k inhibici všech tří dimerických izoforem (17A/17A, 17A/17F, 17F/17F). V publikovaných klinických studiích fáze III (BE VIVID, BE READY a BE RADIANT) byla prokázána signifikantní klinická účinnost bimekizumabu v porovnání s placebem, inhibitorem IL-23 ustekinumabem a inhibitorem IL-17A secukinumabem. Klinická studie fáze III BE SURE se potom soustředila na porovnání účinnosti a bezpečnosti bimekizumabu a inhibitoru TNF-α adalimumabu.
Metodika, průběh a cíle studie
Multicentrické dvojitě zaslepené studie fáze III BE SURE se zúčastnili pacienti se středně těžkou až těžkou plakovou psoriázou ve věku ≥ 18 let. Zařazeni byli nemocní se skóre PASI (Psoriasis Area and Severity Index) ≥ 12, s plochou tělesného povrchu postiženou psoriázou ≥ 10 % a hodnotou skóre IGA (Investigator's Global Assessment) ≥ 3. Studie byla provedena v 77 klinických centrech v 9 zemích, přičemž doba trvání studie činila 56 týdnů.
Pacienti byli po úvodním screeningovém vyšetření rovnoměrně randomizováni v poměru 1 : 1 : 1 k terapii bimekizumabem v dávce 320 mg podávaným subkutánně 1× za 4 týdny, k terapii bimekizumabem v dávce 320 mg podávaným subkutánně 1× za 4 týdny až do 16. týdne terapie a následně každých 8 týdnů do 56. týdne terapie nebo k terapii adalimumabem v dávce 40 mg podávaným subkutánně každé 2 týdny až do 24. týdne terapie s následným přeřazením k terapii bimekizumabem v dávce 320 mg podávaným subkutánně 1× za 4 týdny až do 56. týdne terapie.
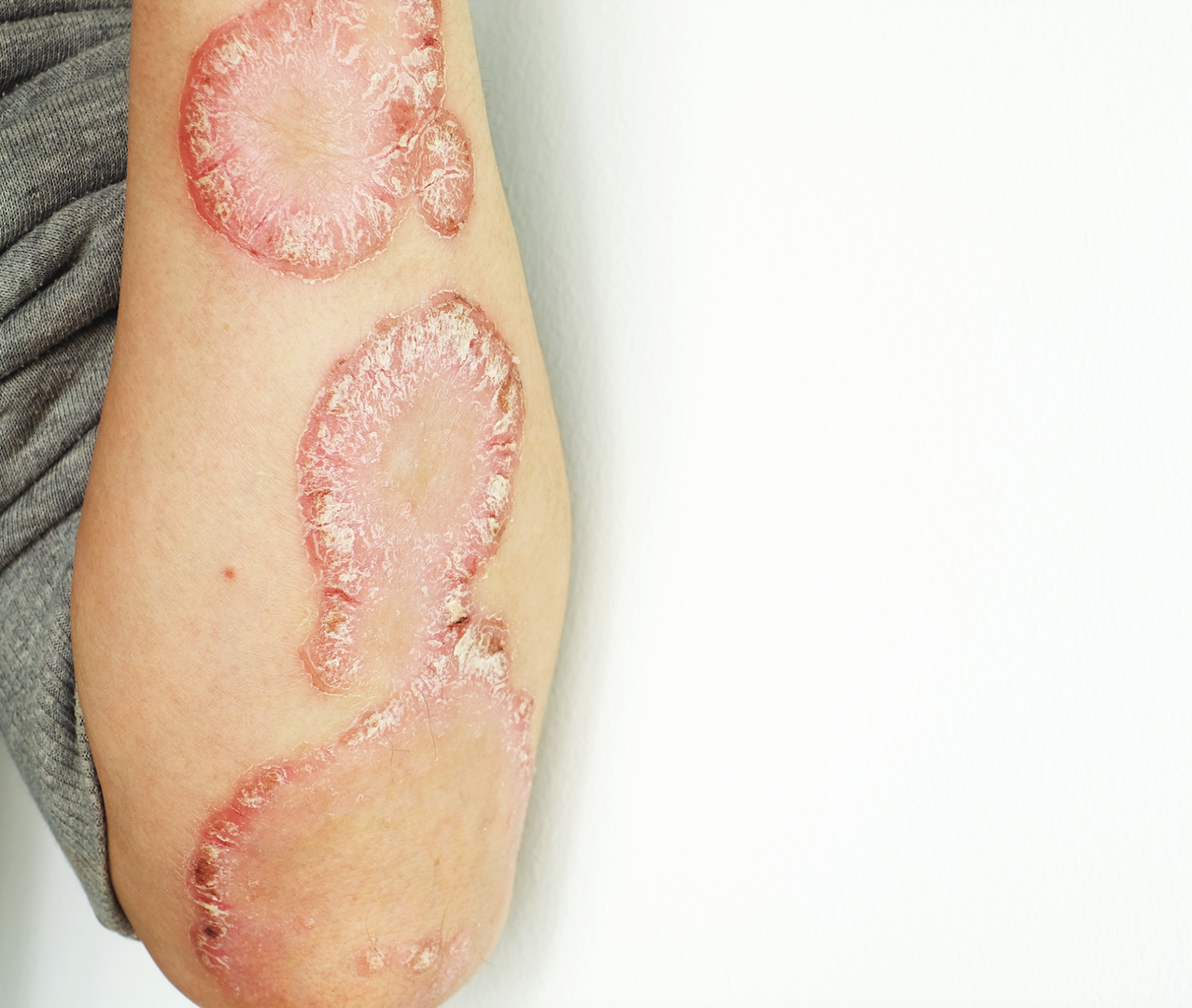
Primárními cíli byly podíl pacientů s ≥ 90% redukcí ve skóre PASI (PASI 90) a podíl pacientů se skóre IGA 0 a 1 (čistá a téměř čistá kůže) v 16. týdnu terapie. Sekundárním cílem bylo zhodnocení dalších parametrů účinnosti a bezpečnosti terapie. Analýza primárních cílů studie zkoumala noninferioritu terapie bimekizumabem s hraniční hodnotou −10 procentních bodů a následně hodnotila superioritu léčby.
Výsledky
Celkem 614 pacientů prošlo screeningovým vyšetřením a 478 z nich bylo zařazeno do studie (158 do první skupiny, 161 do druhé skupiny a 159 do třetí skupiny). Základní demografické a klinické charakteristiky se mezi skupinami signifikantně nelišily. Průměrný věk pacientů činil 44,9 roku, průměrné skóre PASI při vstupu do studie bylo 19,8.
V 16. týdnu terapie bylo dosaženo primárního cíle studie v rámci PASI 90 u 86,2 % pacientů na bimekizumabu v porovnání s 47,2 % na adalimumabu (upravený rozdíl rizik [RD] 39,3 %; 95% interval spolehlivosti [CI] 30,9–47,7; p < 0,001 pro noninferioritu a superioritu). Skóre IGA 0 a 1 bylo v 16. týdnu terapie dosaženo u 85,3 % pacientů na bimekizumabu a u 57,2 % na adalimumabu (upravený RD 28,2 %; 95% CI 19,7–36,7; p < 0,001 pro noninferioritu a superioritu).
Skóre PASI 100 bylo v 16. týdnu terapie dosaženo u 60,8 % pacientů na bimekizumabu a u 23,9 % na adalimumabu (upravený RD 37 %; 95% CI 28,6–45,3; p < 0,001). U pacientů na bimekizumabu bylo v porovnání s adalimumabem také dosaženo signifikantně lepších výsledků v dalších sekundárních cílových parametrech studie, a to například v rámci skóre PASI 75 po 4 týdnech terapie, PASI 100, PASI 90 a IGA 0 a 1 po 24 týdnech terapie.
V rámci skupiny primárně léčené adalimumabem bylo v 24. týdnu terapie pozorováno skóre PASI 90 u 51,6 % pacientů, přičemž po přeřazení k terapii bimekizumabem bylo v 56. týdnu terapie pozorováno u 81,8 % pacientů. U 62 % pacientů, u nichž nebylo dosaženo zlepšení PASI 90 po 24 týdnech terapie adalimumabem, pak bylo dosaženo léčebné odpovědi PASI 100 po přeřazení k terapii bimekizumabem.
Celkový výskyt nežádoucích příhod a závažných nežádoucích příhod byl ve všech skupinách obdobný. U pacientů na bimekizumabu byly v porovnání s adalimumabem pozorovány častěji nežádoucí příhody v podobě orální kandidózy (převážně mírné až středně těžké) a průjmů. Mezi další běžné nežádoucí příhody u pacientů na bimekizumabu patřily infekce horních cest dýchacích a arteriální hypertenze.
Závěr
Z výsledků studie vyplynula noninferiorita a superiorita bimekizumabu v porovnání s adalimumabem (v rámci 16týdenní terapie) v parametrech redukce symptomů a klinických příznaků středně těžké až těžké plakové psoriázy, s vyšší frekvencí výskytu nežádoucích příhod v podobě orální kandidózy a průjmů.
(holi)
Zdroj: Warren R. B., Blauvelt A., Bagel J. et al. Bimekizumab versus adalimumab in plaque psoriasis. N Engl J Med 2021; 385 (2): 130–141, doi: 10.1056/NEJMoa2102388.
Páčil sa Vám článok? Radi by ste sa k nemu vyjadrili? Napíšte nám − Vaše názory a postrehy nás zaujímajú. Zverejňovať ich nebudeme, ale radi Vám na ne odpovieme.
Štítky
Dermatológia Detská dermatológia Detská reumatológia Reumatológia Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




