-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Muž s nebolestivým ikterem, anemickým syndromem a stenokardiemi – kazuistika
A man with painless jaundice, anaemia and intermittent chest pain – case report
A sixty six-year old man with a history of arterial hypertension and excellent quality of life was successfully treated for community-acquired pneumonia with an empirical antibiotic in the outpatient setting. However he developed painless jaundice, progressive dyspnoea and intermittent chest pain about two weeks later. He sought his GP who immediately referred him to the regional hospital. Next, he was transferred to the Teaching Hospital in Pilsen due to a worsening condition shortly after the ambulatory examination. The case report describes and discusses the complicated course and management of a rare disease.
Keywords:
autoimmune haemolytic anaemia – anaemic syndrome – acute coronary syndrome
Autori: Karvunidis Thomas; Chvojka Jiří; Ledvinová Lenka; Raděj Jaroslav; Danihel Vojtěch; Novák Ivan; Matějovič Martin
Pôsobisko autorov: JIP, I. interní klinika, Fakultní nemocnice a Lékařská fakulta Plzeň
Vyšlo v časopise: Anest. intenziv. Med., 26, 2015, č. 1, s. 17-22
Kategória: Intenzivní medicína - Kazuistika
Súhrn
66letý hypertonik bez jiných závažných komorbidit a s výbornou kvalitou života prodělal komunitní infekci dolních cest dýchacích/plic. Empirická antibiotická léčba řízená jeho praktickým lékařem vedla k postupnému zlepšení stavu, ústupu obtíží a kontrole infekce. Přibližně po čtrnácti dnech jej však opět vyhledal pro nebolestivý nápadný ikterus, postupně progredující námahovou až klidovou dušnost a intermitentní bolesti na hrudi. Vzhledem k zjevné závažnosti aktuálního zdravotního stavu byl neprodleně odeslán k ambulantnímu vyšetření do regionální nemocnice a odtud ještě týž den k hospitalizaci do Fakultní nemocnice v Plzni. Kazuistika popisuje a diskutuje komplikovaný průběh a management relativně vzácného onemocnění.
Klíčová slova:
autoimunitní hemolytická anémie – anemický syndrom – akutní koronární syndromKAZUISTIKA
Šedesátišestiletý hypertonik s léčenou hypotyreózou, benigní hyperplazií prostaty, dosud velmi aktivní, v dobré kondici a s výbornou kvalitou života byl akutně přijat na interní oddělení regionální nemocnice pro přibližně dva dny trvající nebolestivý ikterus, rychle progredující námahovou dušnost a intermitentní tlakové bolesti na hrudi. Asi 14 dní před popsanými obtížemi nemocný prodělal komunitní pneumonii, která byla úspěšně léčena praktickým lékařem antibiotikem (ampicilin/klavulonát), NSAID (ibuprofen) a paracetamolem.
Při přijetí do regionální nemocnice se nemocný (180 cm, 101 kg) prezentoval ikterem, bolestmi na hrudi charakteru stenokardií, absencí klidové dušnosti, byl plně při vědomí, lucidní, hypertenzní (TK 180/60 mm Hg), s mírnou tachykardií(TF 94/min), normální saturací (SpO2 97% na vzduchu) a febrilní (TT 38,1 °C). Na vstupním EKG byly registrovány naznačené deprese ST úseku ve svodech I, II, a VL a V3–6. Předozadní RTG plic prokazoval normální nález, rovněž USG břicha bylo bez patologie na orgánech dutiny břišní a retroperitonea. Laboratorně dominovala anémie (Hb 82 g/l), hyperbilirubinémie (celkový bilirubin 92 µmol/l), elevace markerů myokardiálního poškození (troponin I 0,31 µg/l) a systémové infekce (CRP 72 mg/l a PCT 0,78 µg/l). Současně byla pozorována výrazná aglutinace erytrocytů s přítomností 38 % retikulocytů a s pozitivitou přímého i nepřímého aglutinačního testu (Coombsův test). Krevní skupina byla stanovena jako A1 Rh pozitivní. Vzhledem k suspektnímu rozvíjejícímu se akutnímu koronárnímu syndromu a nejasné hemolytické anémii byl nemocný ještě týž den transportován do Fakultní nemocnice Plzeň.
Při příjmovém vyšetření na interní ambulanci byl nemocný ikterický, s bolestmi na hrudi tlakového charakteru, bez klidové dušnosti, plně při vědomí (GCS 4-5-6), orientovaný všemi kvalitami, normotenzní (110/60 mm Hg), bez tachykardie(TF 90/min), s relativně dobrou oxygenací (SpO2 95% při oxygenoterapii obličejovou polomaskou s průtokem O2 4 l/min) a afebrilní (TT 36,2 °C). Kontrolní EKG vyšetření ukázalo další zhoršení vstupního nálezu s jednoznačnými depresemi ST úseků ve výše zmiňovaných svodech. Laboratorní screening také potvrdil progresi hemolýzy s významnou hyperbilirubinémií, elevací laktátdehydrogenázy (LD) a snížením haptoglobinu. Současně došlo k dalšímu zvýšení TnI (0,90µg/l) a markerů systémového zánětu (CRP a PCT). Vzhledem k extrémní hemolýze již nebylo možné vyšetřit krevní obraz ani stanovit krevní skupinu. Analyzátor krevních plynů (GEM 4000™) umožnil alespoň orientační stanovení hemoglobinu (Hb 67 g/l) k určení tíže anémie. Nebyla přítomna koagulopatie. S ohledem na významnou hemolýzu, anémii s projevy anemického syndromu včetně probíhající akutní ischemie myokardu (akutního koronárního syndromu – AKS) a současnou systémovou infekci byl nemocný přijat na JIP I. interní kliniky Fakultní nemocnice Plzeň.
Léčba na JIP byla vedena ve třech paralelních liniích. První spočívala v neodkladné podpůrné léčbě – ke korekci anémie byly opakovaně podány deleukotizované erytrocytární resuspenze ohřáté bezprostředně před aplikací na tělesnou teplotu ve vodní lázni. Dále jsme pokračovali v oxygenoterapii a intermitentní neinvazivní ventilaci (NIV – CPAP/PSV). Druhá linie léčby spočívala v léčbě akutních komplikací. Vzhledem k přítomné systémové infekci – pravděpodobně infekci dýchacích cest/pneumonii – byla zahájena empirická antibiotická léčba (meropenem + klaritromycin). Etiologie nebyla zcela jednoznačná. Jediným identifikovaným potenciálním patogenem byla Klebsiella oxytoca ve stěru z horních cest dýchacích. Terapie akutního koronárního syndromu (vrcholový TnI 98,84µg/l) spočívala v úvodu ve zvyklé farmakoterapii. Další vývoj EKG (progrese změn ST úseků), dynamika kardiomarkerů (TnI 6,69…98,84 µg/l) a echokardiografický nález nové hypokineze až akineze apikální poloviny septa, anterosepta a spodní stěny levé komory srdeční byly přes významný podíl sekundární etiologie AKS indikací ke koronarografickému vyšetření s následnou PCI kritické ostiální stenózy RIA s implantací jednoho konvenčního metalického stentu (2. den hospitalizace). Základem vlastní léčby autoimunitní hemolytické anémie s prokázanými chladovými protilátkami bylo udržování nemocného v teple, zejména akrálních částí končetin, aplikace všech intravenózně podávaných léků, infuzí i krevních derivátů ohřátých na normální tělesnou teplotu. S ohledem na tíži hemolýzy a anémie vedoucí až k orgánovému poškození byla k rychlé eliminaci autoprotilátek (aglutininů) zvolena plazmaferéza (PF) s výměnou jednoho objemu plazmy nemocného za proceduru s náhradou albuminem a krystaloidy. Celkem proběhly tři PF – druhý, čtvrtý a šestý den od přijetí na JIP. Byla zahájena imunosuprese systémovým kortikosteroidem (prednison 1 mg/kg/den).
Dalšími detailními vyšetřeními byla opakovaně potvrzena spontánní aglutinace erytrocytů při pokojové teplotě, byly prokázány antierytrocytární (auto)protilátky třídy IgM (chladové aglutininy), byl pozitivní přímý aglutinační test (Coombsův) pro C3 složku komplementu, což potvrzovalo vstupní pracovní diagnózu autoimunitní hemolytické anémie s chladovými protilátkami.
Po sedmi dnech byla již hemolýza uvedenými léčebnými postupy kontrolována, nedocházelo k další anemizaci, významně klesl i titr chladových protilátek (aglutininů) – obrázek 1. Neobjevily se žádné komplikace prodělané myokardiální léze a infekce byla uvedenou ATB léčbou kontrolována. Osmý den hospitalizace byl nemocný přeložen k další péči na Hematologicko-onkologické oddělení FN Plzeň, kde bylo dále pokračováno v kortikoterapii v postupně se snižující dávce. Současně byla vyšetřením kostní dřeně vyloučena hematologická malignita. Dále byl pacient přeložen na Kardiologické oddělení FN Plzeň k již elektivní PCI ACD; byl implantován jeden metalický a jeden lékový stent. Následně, po celkem 48 dnech hospitalizace byl nemocný propuštěn v dobrém stavu do domácí a ambulantní péče bez známek hemolýzy. Za cca 3 měsíce byl opět hospitalizován na kardiologickém oddělení a byla provedena další elektivní PCI reziduálních stenóz RIA a RD II s implantací lékových stentů do obou intervenovaných lokalit. Na rozvoji akutního koronárního syndromu se dominantně podílelo preexistující aterosklerotické postižení koronárních tepen (koronarografie: až 90% ostiální stenóza RIA, významná bifurkační stenóza RIA-RDII, chronický kolateralizovaný uzávěr magistrální tepny ACD ve střední třetině), současná anémie a v neposlední řadě i změny reologických vlastností krve v přítomnosti cirkulujících erytrocytů s navázanými multimery autoreaktivních IgM a komplementu a erytrocytárních aglutinátů.
Obr. 1. Vývoj laboratorních parametrů v čase 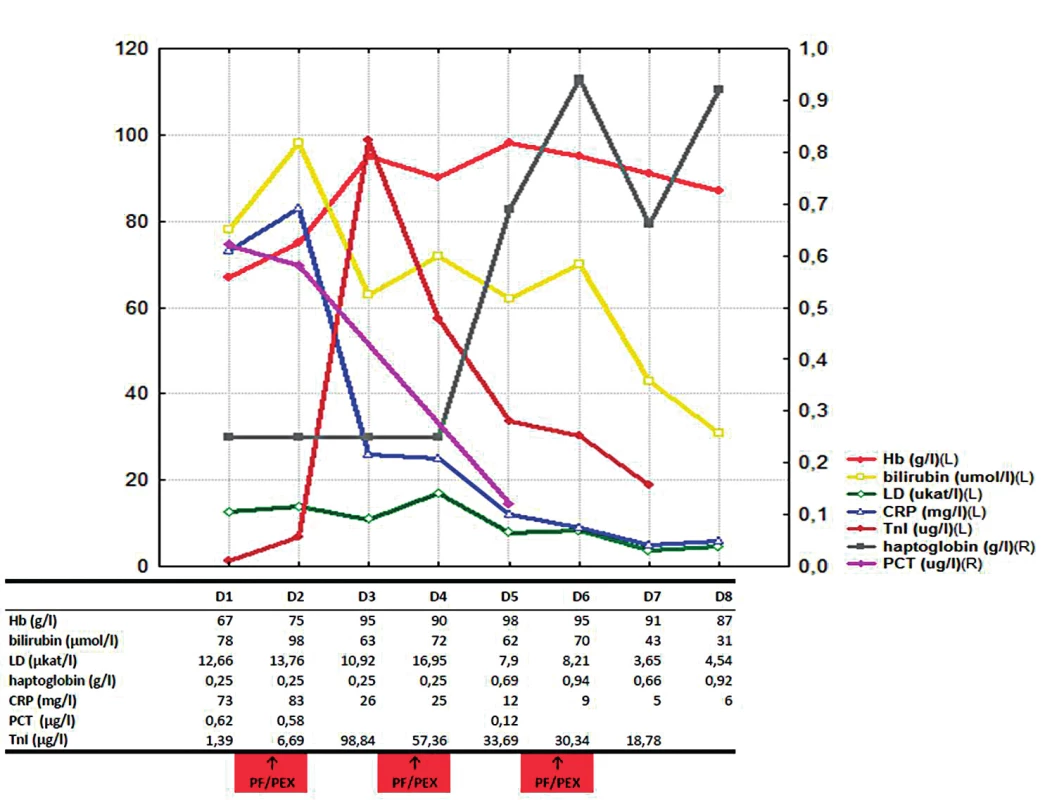
KOMENTÁŘ A DISKUSE
Autoimunitní hemolytická anémie (AIHA) je patologickým stavem charakterizovaným imunitně podmíněnou destrukcí erytrocytů. Vazba protilátek namířených proti některému z membránových antigenů erytrocytů vede k intravaskulární hemolýze aktivací komplementu, či k zániku červených krvinek s navázanou protilátkou v monocyto-makrofágovém systému jater a sleziny. Klinická manifestace je zejména závislá na typu protilátek. Nejčastěji se můžeme u AIHA setkat se dvěma typy autoprotilátek. IgM protilátky interagují s polysacharidovými antigeny na povrchu membrány erytrocytů při teplotách nižších, než je tělesná teplota. Nazýváme je „chladové protilátky“. Autoprotilátky třídy IgG naproti tomu reagují s proteinovými ligandy v membráně erytrocytů při tělesné teplotě. Velmi raritně lze detekovat protilátky třídy IgA, které mohou indukovat hemolýzu oběma výše uvedenými způsoby [1, 2].
Detekce protilátek je standardně prováděna pomocí přímého aglutinačního testu (Coombsův test, direct antiglobulin test; DAT). Obecným principem testu je přidání protilátek proti Fc fragmentu lidských imunoglobulinů k promytým erytrocytům pacienta. Tyto monoklonální protilátky jsou specifické pro jednotlivé třídy imunoglobulinů i pro C3d složku komplementu. V případě přítomných autoprotilátek navázaných na povrchové antigeny erytrocytů dojde k jejich aglutinaci s pozitivním výsledkem testu (obr. 2).
Obr. 2. Přímý (Coombsův) aglutinační test (upraveno; GNU Free Documentation License, Wikimedia Commons) 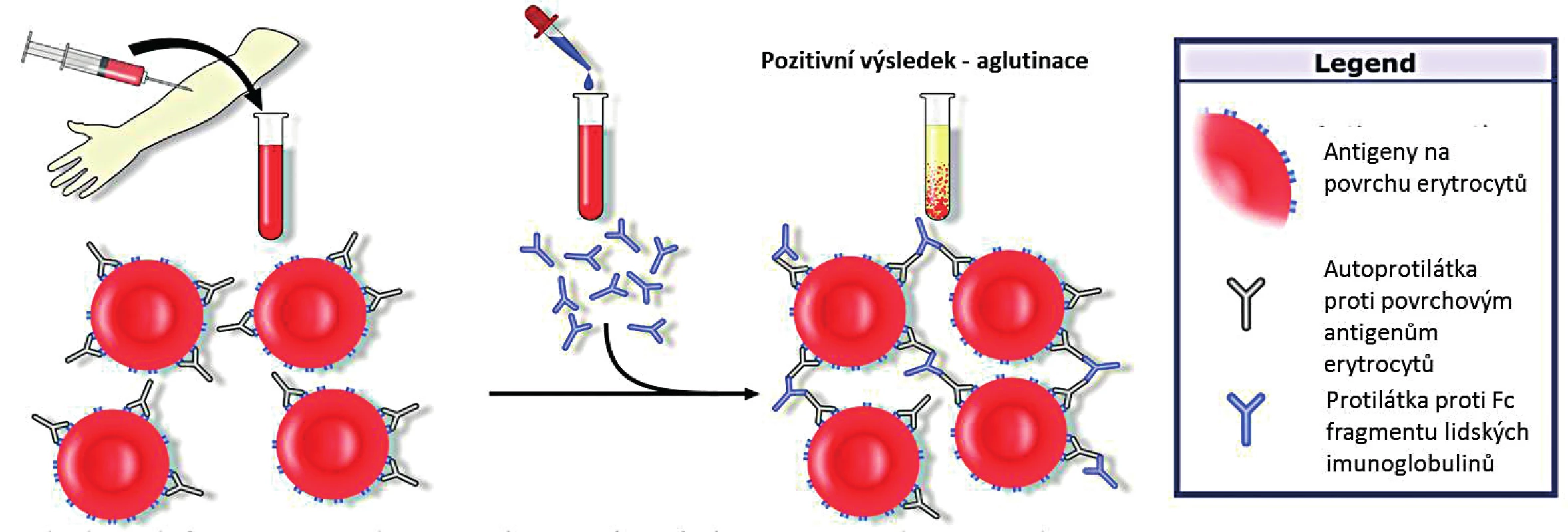
Autoimunitní hemolytická anémie s chladovými protilátkami (AIHA – cold agglutinin disease; AIHA-CAD) je vzácným onemocněním postihujícím dominantně ženy v sedmé dekádě života. Incidence se pohybuje okolo 1 : 1 000 000 případů za rok [1, 2]. Je charakterizována produkcí autoprotilátek téměř výhradně třídy IgM, velmi vzácně jsou detekovány chladové aglutininy tříd IgA a IgG. Patologická produkce těchto autoreaktivních protilátek bývá přítomna v souvislosti s proběhlou systémovou infekcí nemocného či v souvislosti s nádorovým onemocněním. Nejčastěji bývá produkce chladových protilátek pozorována v průběhu infekce/pneumonie způsobené Mycoplasma pneumoniae a infekční mononukleózy (virus Epstein-Barrové). Méně často provází produkce těchto autoprotilátek i jiné virové infekce (chřipka A H1N1, HBV, parvovirus B19 aj.) a bakteriální onemocnění (Listeria monocytogenes, Salmonella gastroenteritis, Mycobacterium spp. aj.) [3,4]. Ve většině případů postinfekční AIHA-CAD je titr protilátek nízký a hemolýza velmi slabá. Vrchol v jejich produkci je přibližně po dvou až třech týdnech od počátku infekce a jejich produkce vymizí po dvou až třech měsících. Tyto postinfekční autoreaktivní protilátky bývají oligoklonální. Stavy s produkcí chladových protilátek tvoří celé spektrum nemocí od „benigní“ AIHA-CAD až po vysoce agresivní maligní lymfomy. Podle studované populace bývá hematologická malignita u AIHA-CAD přítomna až v 64–78 % případů [5,6]. V těchto případech bývají autoprotilátky většinou monoklonální [7].
Tíže výsledné hemolýzy závisí na několika faktorech:
- a) na titru protilátek („lineární“ závislost);
- b) na nejvyšší teplotě, při které ještě dochází k interakci protilátek a jejich ligandů v membráně erytrocytů (tepelná amplituda) [8] – čím vyšší teplota, případně se blížící teplotě tělesné, tím větší pravděpodobnost rozvoje hemolýzy in vivo;
- c) na míře inhibice vazby autoprotilátek složkou komplementu C3d – čím menší schopnost inhibice, tím významnější hemolýza a
- d) na schopnosti autoprotilátek fixovat komplement – protilátky, které nejsou schopny vázat složky komplementu, vedou k aglutinaci erytrocytů zejména v akrálních částech těla (kryoprecipitace) bez hemolýzy a anemizace.
Nemocní s AIHA-CAD se prezentují příznaky plynoucími z aglutinace a hemolýzy erytrocytů. Nejčastějšími jsou: anémie (35 %), akrocyanóza (24 %), únavnost (21 %), slabost a námahová dušnost (7 %) a hemoglobinurie (3 %). Málo častým steskem je bolest či diskomfort při polykání studené potravy či tekutin [6].
Diagnóza AIHA-CAD spočívá v syntéze anamnézy, klinického stavu a laboratorních vyšetření. Nespecifickými příznaky jsou anémie a laboratorní známky hemolýzy (nekonjugovaný bilirubin, zvýšení laktátdehydrogenázy, pokles haptoglobinu, schistocyty, hemoglobinurie, zvýšení retikulocytů). Specificky pro AIHA-CAD svědčí detekce chladových protilátek třídy IgM a pozitivní výsledek DAT (Coombsova testu).
V rámci diferenciální diagnózy je třeba zvážit paroxyzmální noční hemoglobinurii (PNH), pro kterou jsou však typické autoprotilátky třídy IgG. Dále také polékovou autoimunitní hemolytickou anémii, u níž však nebývají přítomny chladové protilátky [9]. A konečně také Raynaudův fenomén, respektive nemoc při přítomnosti autoprotilátek se schopností aglutinace, nikoliv však vazby a aktivace komplementu a tedy intravaskulární destrukce erytrocytů a hemolýzy (kryoprotilátky, kryoprecipitace; viz výše).
Léčba AIHA-CAD spočívá zejména v zabránění prochladnutí. V tomto smyslu je potřeba vést péči u lůžka nemocného i případné intervenční, respektive operační výkony u těchto nemocných [10, 11]. Také aplikované intravenózní roztoky, včetně krevních derivátů, musí být kontrolovaně ohřáté na teplotu blížící se teplotě tělesné. Opatrnosti je třeba při fyzikálním chlazení nemocných s AIHA-CAD a současným horečnatým onemocněním, jelikož toto může vést k indukci/zhoršení hemolýzy až periferním gangrénám[12, 13]. Dalším z režimových opatření u nemocných s AIHA-CAD, kteří mají v důsledku setrvalé konzumpce nízké hladiny složek komplementu, je podávání krevních derivátů resuspendovaných v náhradních roztocích. Dárcovská krevní plazma, běžně používaná jako vehikulum těchto derivátů, totiž obsahuje komplement, a může tak hemolýzu u příjemce spustit či zhoršit [14]. Současně s uvedenými opatřeními by měla probíhat léčba případně asociovaného onemocnění. Dosažení remise (hematologické) malignity ve většině případů znamená i ukončení produkce autoprotilátek a remisi AIHA-CAD.
V případech mírného průběhu AIHA-CAD postačí výše uvedená opatření. U závažné hemolýzy vedoucí až k poškození orgánů lze zvážit systémovou imunosupresi cyklofosfamidem či kortikosteroidem, ačkoliv efekt této léčby je velmi sporný a nelze očekávat dosažení stabilní remise onemocnění. Pokud již zvolíme léčbu kortikosteroidem, je lépe v úvodu užít vyšší dávky (pulzní podání) k inhibici fagocytózy opsonizovaných erytrocytů. Evidence tohoto postupu je však malá a diskutabilní [15, 16]. Na druhou stranu rituximab (monoklonální protilátka anti-CD20) vede k terapeutické odpovědi u 79–83 % případů [6, 17, 18, 19, 20]. Současně lze v těchto případech k rychlé (ale dočasné) eliminaci autoreaktivních protilátek použít plazmaferézu (PF) [6]. Obecným doporučením pro dávku PF je preskripce 1–1,5násobku objemu krevní plazmy jednou za dva až tři dny v celkem třech až pěti procedurách. Východiskem je skutečnost, že přibližně 75 % autoreaktivních protilátek třídy IgM je lokalizováno intravaskulárně, a může být tedy tímto postupem odstraněno[21, 22]. Postavení a efekt léčby refrakterní AIHA-CAD pomocí rekombinantního interferonu alfa (INF-α) či ekulizumabu (inhibitor komplementu, anti-C5) není v současnosti dostatečně podložen studiemi a zkušenostmi [20, 23].
ZÁVĚR
Tato kazuistika prezentuje případ autoimunitní hemolytické anémie s chladovými protilátkami s významnou anémií, anemickým syndromem a orgánovým postižením ve smyslu demaskování dosud latentního onemocnění koronárních tepen s akutním infarktem myokardu. Popisuje a následně diskutuje zvolenou léčebnou strategii.
Práce byla podpořena Programem rozvoje vědních oborů Univerzity Karlovy (PRVOUK – projekt P36), MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806), CZ.1.05/2.1.00/03.0076 Evropský fond pro regionální rozvoj (Biomedicínské centrum LF Plzeň, UK v Praze).
Do redakce došlo dne 2. 9. 2014.
Do tisku přijato dne 20. 11. 2014.
Adresa pro korespondenci:
MUDr. Thomas Karvunidis, PhD.
JIP, I. interní klinika FN a LF v Plzni, UK v Praze
Alej Svobody 80
304 60 Plzeň
Zdroje
1. Bass, G. F., Tuscano, E. T., Tuscano, J. M. Diagnosis and classification of autoimmune hemolytic anemia. Autoimmun Rev., 2014, 13, p. 560–564.
2. Chaudhary, R. K., Das, S. S. Autoimmune hemolytic anemia: from lab to bedside. Asian J. Transfus. Sci., 2014, 8, p. 5–12.
3. Wu, B., Rong, R. Cold agglutinin syndrome with severe haemolytic anaemia in a patient diagnosed of disseminated tuberculosis and concomitant Mycoplasma pneumoniae infection. Transfus. Med., 2012, 22, p. 151–152.
4. Karunarathne, S., Weerasinghe, S., Govindapala, D., Fernando, H., Jayarathne, B. Cold autoimmune haemolytic anae-mia secondary to Epstein Barr virus infection presenting with peripheral gangrene; case report. Thromb. J., 2012, 10, p. 10–14.
5. Crisp, D., Pruzanski, W. B-cell neoplasms with homogeneous cold-reacting antibodies (cold agglutinins). Am. J. Med., 1982, 72, p. 915–922.
6. Swiecicki, P. L., Hegerova, L. T., Gertz, M. A. Cold agglutinin disease. Blood, 2013, 122, p. 1114–1121.
7. Randen, U., Troen, G., Tierens, A. et. al. Primary cold agglutinin-associated lymphoproliferative disease: a B-cell lymphoma of the bone marrow distinct from lymphoplasmacytic lymphoma. Haematologica, 2014, 99, p. 497–504.
8. Hopkins, C., Walters, T. K. Thermal amplitude test. Immuno-hematology, 2013, 29, p. 49–50.
9. Arndt, P. A., Garratty, G. The changing spectrum of drug-induced immune hemolytic anemia. Semin. Hematol., 2005, 42, p. 137–144.
10. Agarwal, S. K., Ghosh, P. K., Gupta, D. Cardiac surgery and cold-reactive proteins. Ann. Thorac. Surg., 1995, 60, p. 1143–1150.
11. Beebe, D. S., Bergen, L., Palahniuk, R. J. Anesthetic management of a patient with severe cold agglutinin hemolytic anemia utilizing forced air warming. Anesth. Analg., 1993, 76, p. 1144–1146.
12. Talisman, R., Lin, T. J., Soroff, H. S., Galanakis, D. Gangrene of the back, buttocks, fingers, and toes caused by transient cold agglutinemia induced by a cooling blanket in a patient with sepsis. Surgery, 1998, 123, p. 592–595.
13. Kalra, A., Singh, K., Sahoo, M., Mahant, T. S. Cold agglutinin disease setected during open heart surgery. Indian. J. Hematol. Blood. Transfus., 2014, 30, p. 62–63.
14. Ulvestad, E. Paradoxical haemolysis in a patient with cold agglutinin disease. Eur. J. Haematol., 1998, 60, p. 93–100.
15. Schreiber, A. D., Herskovitz, B. S., Goldwein, W. Low-titer cold-hemagglutinin disease. Mechanism of hemolysis and response to corticosteroids. N. Engl. J. Med., 1977, 296, p. 1490–1494.
16. Lahav, M., Rosenberg, I., Wysenbeek, A. J. Steroid-responsive idiopathic cold agglutinin disease: a case report. Acta Haematol., 1989, 81, p. 166–168.
17. Lee, E. J., Kueck, B. Rituxan in the treatment of cold agglutinin disease. Blood, 1998, 92, p. 3490–3491.
18. Berentsen, S., Ulvestad, E., Langholm, R. et al. Primary chronic cold agglutinin disease: a population based clinical study of 86 patients. Haematologica, 2006, 91, p. 460–469.
19. Berentsen, S. How I manage cold agglutinin disease. Br. J. Haematol., 2011, 153, p. 309–317.
20. Adam, Z., Pejchalová, A., Chlupová, G. et al. Nemoc chladových aglutininů nereagující na léčbu glukokortikoidy a na léčbu rituximabem. Jaký postup zvolit pro III. linii léčby? Popis případu a přehled literatury. Vnitr. Lek., 2013, 59, p. 828–840.
21. Kaplan, A. A. Therapeutic plasma Exchange: core curriculum 2008. Am. J. Kidney. Dis., 2008, 52, p. 1180–1196.
22. Schwartz, J., Winters, J. L., Padmanabhan, A. et al. Guidelines on the use of therapeutic apheresis in clinical practice-evidence-based approach from the Writing Commitee of the American Society for Apheresis: the sixth special issue. J. Clin. Apher., 2013, 28, p. 145–284.
23. Roeth, A., Huettmann, A., Rother, R. P. et al. Long-term efficacy of the complement inhibitor eculizumab in cold agglutinin disease. Blood, 2009, 113, p. 3885–3886.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Na konci volebního období…Článek Kongres ČSARIMČlánek ESPA 2014Článek Plánované akce na rok 2015Článek KALENDÁŘ NADCHÁZEJÍCÍCH AKCÍ
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2015 Číslo 1- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Muž s nebolestivým ikterem, anemickým syndromem a stenokardiemi – kazuistika
- Utajená příčina hypotenze – kazuistika
- Kaudální blokáda pod ultrazvukovou kontrolou
- Sledování a monitorování dýchání a ventilace
- Faktory regulující kontraktilitu myokardu, Anrepův a Bowditchův efekt
- Konsenzuální stanovisko k multimodálnímu monitorování v neurointenzivní péči
- Opatrovník a zástupný souhlasu pacientů v intenzivní péči
-
Kdo je kdo v anesteziologii a intenzivní medicíně
Doc. MUDr. Bořivoj Dvořáček, CSc. - Zpráva o XXI. kongresu ČSARIM
- Kongres ČSARIM
- Na konci volebního období…
- ESPA 2014
- Výzva sekce porodnické anestezie a analgezie
- Plánované akce na rok 2015
- Volby ČSARIM pro volební období 2015–2018
- KALENDÁŘ NADCHÁZEJÍCÍCH AKCÍ
- Nabídka Německé společnosti anesteziologie a intenzivní medicíny
- 16th Annual NATA Symposium on Patient Blood Management, Haemostasis & Thrombosis
- Perioperační hypotermie u plánovaných terapeutických a diagnostických výkonů
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Kaudální blokáda pod ultrazvukovou kontrolou
- Perioperační hypotermie u plánovaných terapeutických a diagnostických výkonů
- Opatrovník a zástupný souhlasu pacientů v intenzivní péči
- Utajená příčina hypotenze – kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



