-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Hormonální substituční terapie, ateroskleróza a význam časné intervence
Hormone replacement therapy, atherosclerosis and importance of early intervention
Hormone replacement therapy (HRT) is the most effective therapy of acute climacteric syndrome and prevention of osteoporosis. When starting treatment within 10 years of menopause, i.e., before the onset of irreversible changes in the vessel wall and nervous tissues, it is a window of opportunity to prevent atherosclerosis and dementia. At a later start, on the contrary, it worsens these processes.
Keywords:
Atherosclerosis – hormone replacement therapy – timing of therapeutic intervention
Autori: Tomáš Fait 1,2; Michal Vrablík 3
Pôsobisko autorov: Gynekologicko-porodnická klinika 2. LF UK a FN Motol 1; Katedra zdravotních studií VŠP Jihlava 2; Centrum preventivní kardiologie, III. interní klinika – endokrinologie a metabolismu 1. LF UK a VFN v Praze 3
Vyšlo v časopise: AtheroRev 2023; 8(1): 45-50
Kategória: Přehledové práce
Súhrn
Hormonální substituční terapie (HRT) je nejúčinnější léčbou vazomotorických potíží akutního klimakterického syndromu a prokazatelně brání ztrátám kostní hmoty a frakturám. Při zahájení léčby do 10 let od nástupu menopauzy má ochranný vliv i v oblasti aterosklerózy a demence, při pozdějším startu naopak tyto procesy zhoršuje.
Klíčová slova:
ateroskleróza – hormonální substituční terapie – časování léčby
Úvod
Hormonální substituční terapie (HRT – Hormone Replacement Therapy) je nejúčinnější léčbou vazomotorických potíží akutního klimakterického syndromu, genitourinárního syndromu a prokazatelně brání ztrátám kostní hmoty a frakturám. Pro tato tvrzení jsou data natolik silná, že stojí i v závěrech posledního doporučení Severoamerické menopauzální společnosti (NAMS – The North American Menopause Society) z roku 2022 [1].
U žen mladších 60 let, resp. do 10 let od nástupu menopauzy bez známých kontraindikací HRT je její přínos větší než rizika jak v léčbě vazomotorických příznaků, tak v prevenci ztráty kostní hmoty. Pozdější zahájení léčby již není tak výhodné vzhledem k vyššímu riziku ischemické choroby srdeční (ICHS), cévní mozkové příhody, tromboembolické nemoci a demence [2].
Dlouhodobé užívání je vyhrazeno pro ženy s perzistentním vazomotorickým syndromem. U žen s genitourinárním syndromem bez indikace k systémové HRT, kterým nepomáhají volně prodejné přípravky, je doporučována nízkodávkovaná vaginální estrogenní léčba, případně vaginální dehydroepiandrostendion nebo perorální ospemifen [3].
Rizika hormonální léčby se liší dle typu, dávky, délky užívání, aplikační cesty, času zahájení a užitého progestinu. Léčba by měla být individualizována s pravidelným přehodnocováním přínosů a rizik [4].
Nejde jen o kvalitu života
Symptomatologii akutního klimakterického syndromu dominují návaly horka následované pocením. Podle studie SWAN (Study of Women´s health Across the Nation) se jedná o dva syndromy – vazomotorický a psychosomatický. Organické (subakutní) – změny kožní, urogenitální a změny tělesné hmotnosti – a metabolické (chronické) – lipidové spektrum, osteoporóza – mohou již vést k poškození zdraví. Označují se též jako estrogen - deficitní metabolický syndrom [5].
Obecně se uvádí, že vegetativní symptomy snižují kvalitu života, ale neohrožují zdraví ženy. Recentní studie ukazují, že tyto příznaky jsou významným rizikovým faktorem pro kardiovaskulární systém ženy [6].
Návaly horka pozoruje 70 % žen v perimenopauze, kolem 60. roku již jen 30 % žen a po 70. roku jen 9 %. Průměrně trvají 7,4 roku. Začínají pocitem horka či pálení a šíří se z oblasti hlavy kaudálně, následuje záchvat pocení, někdy se přidávají bolesti hlavy či palpitace. Průměrně trvají 3–4 minuty s rozmezím od několika sekund do 60 minut. Existují výrazně mezikulturální a interindividuální rozdíly v míře návalů ovlivněné pravděpodobně stylem života, genetickou výbavou, nadváhou či kouřením. Neléčené návaly ovlivňují kvalitu života, narušují spánek a negativně ovlivňují náladu, jsou ale současně rizikovými faktory pro hypertenzi a endoteliální dysfunkci [7].
V souboru více než 11 000 žen sledovaných po 14 let bylo u žen s návaly horka prokázáno dvojnásobné riziko ICHS. Jako příčinný mechanizmus se jeví spojení návalů s vyšším krevním tlakem, změnou lipidového spektra, zvýšením inzulinové resistence a zánětlivých markerů [8]. Na MRI mozku bylo u žen s návaly horka zjištěno větší množství hyperdenzních ložisek v bílé hmotě, což je spojeno s trojnásobným rizikem cévní mozkové příhody a dvojnásobným rizikem demence [9].
Hormonální terapie
Jako u každého léku i u HRT je třeba dodržovat její indikace (tab. 1) i kontraindikace (tab. 2). Stávající doporučení pro užívání HRT doporučují zahájit léčbu nejnižší účinnou dávkou [10].
Tab. 1. Indikace hormonální substituční terapie 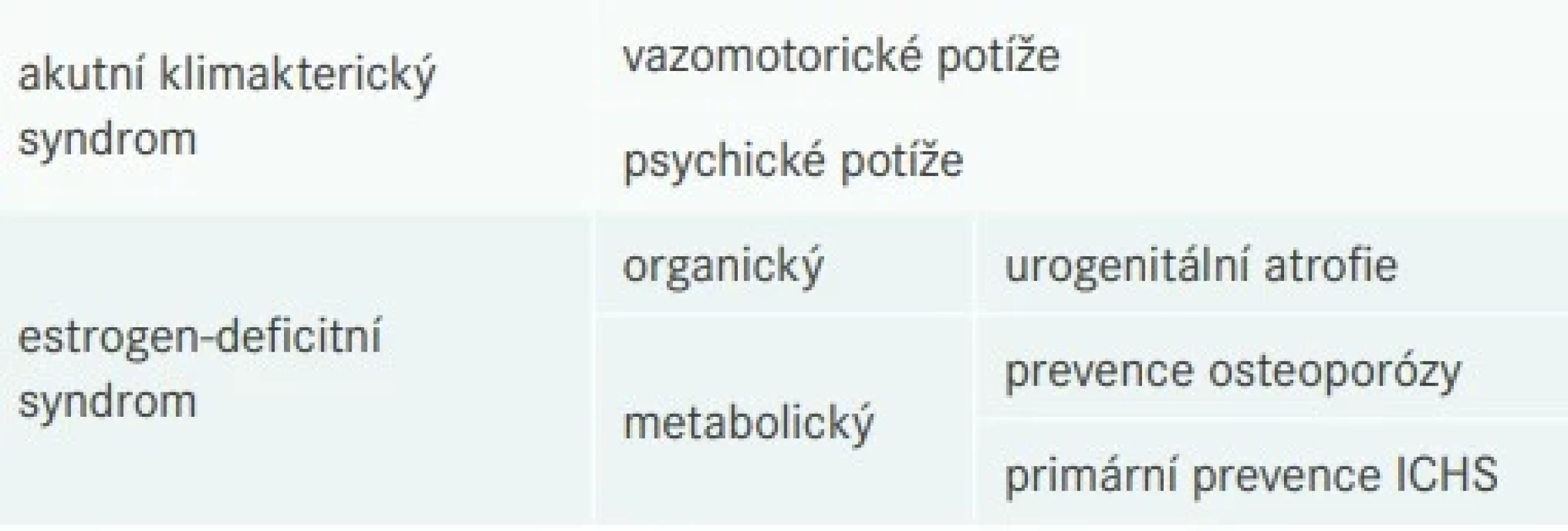
Tab. 2. Kontraindikace systémového podání HRT 
Preparáty obsahující nízkou dávku jsou prokazatelně účinné v léčbě akutního klimakterického syndromu u postmenopauzálních žen [11,12] i v prevenci postmenopauzální osteoporózy [13].
Nízké dávky jsou neutrálnější k některým vedlejším účinkům HRT zejména ke zvyšování mamografické denzity [14] a výskytu nepravidelného krvácení [15,16].
HRT zlepšuje náladu a příznivě působí i na deprese spojené s menopauzou. Kognitivní funkce zlepšuje HRT jen při časném startu (critical window hypothesis, healthy cell bias hypothesis). Při zahájení až ve věku nad 65 let naopak zvyšuje riziko demence. Stejná závislost platí i pro Alzheimerovu nemoc [17] a ICHS [18,19].
Riziko karcinomu prsu závisí na dávce estrogenu, užitém progestinu i délce užívání HRT. Ani zde však nenacházíme důvod k atributivnímu ukončení podávání HRT u žen v 65 letech života. Zvýšené riziko karcinomu prsu při dlouhodobém užívání kombinované hormonální substituční terapie je velmi malé. Přesto je stále jednou z nejvýznamnějších příčin odmítání HRT ze strany lékařů i laiků, které prokazatelně poškozuje zdraví ženy [20].
Z hlediska rizika karcinomu prsu i tromboembolické nemoci se mikronizovaný progesteron a dydrogesteron jeví jako neutrálnější než ostatní gestageny [21,22].
Teoretický podklad vlivu HRT na aterosklerózu
Nedostatek estrogenů v menopauze vede k proaterogenním změnám (tab. 3). Exogenně podávané estrogeny jsou schopny pozitivně ovlivnit aterogenezi, agregaci destiček i cévní tonus (tab. 4).
Tab. 3. Metabolický menopauzální syndrom 
HDL-C – HDL-cholesterol LDL-C – LDL-cholesterol TG – triglyceridy Tab. 4. Mechanizmy příznivého vlivu estrogenů na aterosklerózu 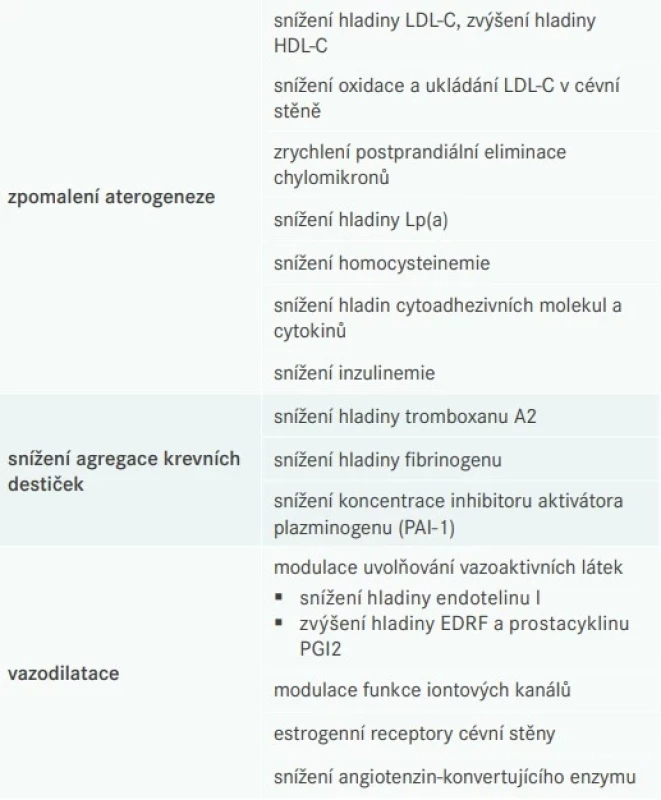
EDRF – relaxační faktor odvozený od endotelu/Endothelium-Derived Relaxing Factor HDL-C – HDL-cholesterol LDL-C – LDL-cholesterol Lp(a) – lipoprotein a PAI – inhibitor aktivátoru plazminogenu 1/Plasminogen Activator Inhibitor 1 Ženy ve věku 20–50 let mají mnohem příznivější lipidový profil než muži stejného stáří – nižší plazmatický LDL-cholesterol (LDL-C) a VLDL-cholesterol (VLDL-C) a vyšší HDL-cholesterol (HDL-C). Menopauza je spojena s negativními změnami lipidového profilu, zejména vzestupem LDL-C a naopak poklesem HDL-C (lipoproteiny vysoké denzity) [23].
Byl jednoznačně prokázán význam hypercholesterolemie (studie MRFIT, Framinghamská studie) i hypertriglyceridemie (studie PROCAM) jako nezávislých rizikových faktorů ICHS [24–26].
Estrogeny snižují hladinu LDL-C zvýšením jeho jaterní clearance cestou zvýšení počtu LDL-receptorů na povrchu hepatocytu, zvyšují koncentraci apolipoproteinu A1 a HDL-C a ovlivňují aktivitu hepatální lipázy. Užívání progestinů vede k útlumu pozitivního efektu estrogenů na lipidový profil úměrně androgenicitě daného preparátu. Estrogenní substituční terapie u postmenopauzálních žen snižuje plazmatický lipoprotein Lp(a) stejně jako kombinovaná estrogen/gestagenní léčba. Perorální estrogeny vyvolávají zvýšení syntézy VLDL-triglyceridů indukcí syntézy apolipoproteinu B100 v játrech. Byly popsány případy akutní pankreatitidy u žen s hypertriglyceridemií, kterým byly podány perorální konjugované equinní estrogeny. Transdermální estrogeny snižují hladiny triglyceridů (TG) nebo jsou k nim neutrální [23].
Randomizovaná dvojitě slepá placebem kontrolovaná multicentrická studie PEPI (Postmenopausal Estrogen/Progestin Intervention) prokázala v 3letém sledování snížení LDL-C o 20 % (0,37–0,46 mmol/l) bez ohledu na zvolený režim HRT. Sledovala 875 žen rozdělených do 5 skupin: placebo, CEE (konjugované equinní estrogeny), CEE + 10 mg medroxyprogesteronacetát (MPA) sekvenčně, CEE +2,5 mg MPA kontinuálně, CEE + 200 mg progesteron sekvenčně. Dále u všech substitučních režimů došlo k lehkému vzestupu HDL-C o 0,03–0,11 mmol/l a TG o 0,13–0,15 mmol/l. V placebové skupině se zvýšila hladina fibrinogenu o 0,1g/l a poklesla hladina HDL-C o 0,03 mmol/l [27].
Samsioe et al porovnali výsledky 5 randomizovaných multicentrických dvojitě slepých studií s 2 127 postmenopauzálními pacientkami. Skupiny užívaly transdermálně estradiol 50 g/den oponovaný kontinuálně nebo sekvenčně 140, 250 nebo 400 mg noretisteronacetátu. V prvních 2 studiích byl ve všech kombinacích sledován pokles celkového cholesterolu (T-C), LDL-C i HDL-C. V kontrolní skupině užívající pouze transdermální estradiol byl zaznamenán vzestup HDL-C. Stejně v obou skupinách byl sledován pokles TG oproti vzestupu v kontrole. V třetí skupině s kontinuálním podáním gestagenu ve srovnání k perorální kombinaci estradiol + noretisteron byl v obou skupinách sledován pokles T-C, LDL-C, HDL-C i TG bez změny poměru frakcí cholesterolu, stejně jako v dalších 2 studiích, které sekvenční a kontinuální transdermální režimy porovnávaly s placebem [28].
Studie srovnávající podávání HRT s hypolipidemiky u žen s dyslipidemií jednoznačně prokazují superioritu hypolipidemik [29].
Premenopauzální ženy mají sklon k periferní (gynoidní) distribuci tělesného tuku, zatímco centrální (androidní) distribuce tuku je nalézána převážně u mužů a postmenopauzálních žen. Ukazuje se, že právě androidní distribuce tělesného tuku je spojena s rostoucím rizikem ICHS. Podíl androidního tuku je pozitivně korelován s plazmatickými TG a negativně s HDL-C. Androidní tuk je též v pozitivní korelaci s inzulinovou rezistencí. Estrogenní léčba upřednostňuje typ gynoidní distribuce tuku, který je spojen se sníženým rizikem ICHS [30].
Estrogeny jsou vazoaktivní látky, které působí snížení cévní rezistence zvířecí i lidské arterie. Estrogeny způsobují rychlé uvolnění oxidu dusnatého aktivací NO-syntázy prostřednictvím estrogenových receptorů, inhibují průnik kalciových iontů do hladkých svalových buněk přímým působením na membránu nebo L-typ kalciových kanálů, ovlivňují expresi genů prostacyklin-syntázy a NO-syntázy. U postmenopauzálních žen s mírnou hypertenzí, která se objevila v menopauze, substituce estrogeny může vyvolat snížení systémového tlaku těmito mechanizmy.
Estrogen indukuje kalcium-dependentní syntázy oxidu dusnatého v buňce a zpomaluje rozvoj ateromů inhibicí proliferace buněk hladkého svalstva. Stimuluje proliferaci endoteliálních buněk, je účinným antioxidantem lipidů, přičemž oxidované lipidy inhibují oxid dusnatý [31].
V menopauze se zvyšuje hladina prokoagulačního faktoru VII, fibrinogen a hladina tkáňového aktivátoru plazminogenu, což ukazuje na rostoucí nebezpečí arteriální trombózy v důsledku hyperkoagulačního stavu. Inhibitor aktivovaného plazminogenu (PAI-1), látka která negativní koreluje s fibrinolýzou, je též u postmenopauzálních žen zvýšena [32].
Aterogenní potenciál homocysteinu je znám z klinického obrazu autosomálně recesivně dědičné homocystinurie (Hcy > 500 mmol/l). Mírné deficity funkce enzymů, nutriční nedostatek kyseliny listové, vitaminu B12 a B6 vedou k mírné hyperhomocysteinemii (normální hodnoty do 15 mmol/l), která je spojena s 3–20násobným zvýšením rizika infarktu myokardu. Homocystein pravděpodobně stimuluje vznik volných radikálů vedoucích k oxidaci LDL. Bylo zjištěno signifikantní zvýšení homocysteinu po menopauze. Podání HRT snižuje homocysteinemii do premenopauzálních hodnot [33].
Na druhé straně perorálně podávané estrogeny zvyšují hladiny hsCRP, což může být marker nestability ateromového plátu [34].
Klinické studie vlivu HRT na aterosklerózu
V metaanalýze epidemiologických studií provedených do roku 1995 Grodsteinová a Stampfer zjišťují RR pro uživatelky HRT 0,65 a pro současné uživatelky dokonce 0,49 oproti ženám, které nikdy HRT neužívaly [35].
V prospektivní studii 121 700 vdaných zdravotních sester (Nurses’ Health Study) probíhající od roku 1976 metodou dotazníků zasílaných každé 2 roky HRT snižuje riziko ICHS u zdravých žen nezávisle na délce podávání či dávce estrogenu. U žen s ICHS krátkodobá HRT zvyšuje riziko a teprve dlouhodobé užívání přináší s sebou snížení rizika [36].
Studie HERS (Heart and Estrogen/progestin Replacement Study) měla ověřit účinek HRT v sekundární prevenci ICHS. Jednalo se o randomizovanou dvojitě slepou prospektivní studii, do které bylo zařazeno 2 × 1 380 žen s ICHS a poměrně vysokým průměrným věkem 67 let. Jedné skupině bylo podáváno 0,625 mg CEE (konjugované equinní estrogeny) + 2,5 mg MPA (medroxyprogesteronacetát) kontinuálně, druhé placebo. V průběhu 4,1 roku trvání studie se nesnížil výskyt koronárních příhod. V prvním roce trvání studie bylo dokonce v léčené skupině pozorováno více koronárních příhod než ve skupině placebové. Méně koronárních příhod se objevilo až ve 4. roce sledování. Nulový až negativní účinek HRT v sekundární prevenci ICHS kontrastuje s příznivým ovlivněním lipidového spektra (snížení LDL-C o 11 % a vzestup HDL-C o 10 %). Na základě výsledků autoři nedoporučují zahajovat HRT v rámci sekundární prevence ICHS, nepovažují však za nutné její přerušení při manifestaci ICHS [37].
Odpůrci studie HERS jí vyčítají nejen vysoký průměrný věk zkoumaných žen, ale i krátkou dobu trvání studie. Předpokládané signifikantní snížení rizika uživatelek HRT se však neobjevilo ani při prodloužení sledování na 6,8 roku ve studii HERS II [38]. Ani dodatečná reanalýza výsledků studie HERS v 86 znacích neidentifikovala žádnou podskupinu účastnic, u které by HRT bylo jednoznačně prospěšné [39]. Výsledky HERS i reanalýzy přináší stále stejnou informaci: Není účelné zahajovat 10–20 let po menopauze hormonální substituční terapii ve snaze o sekundární prevenci ICHS.
Studie PHASE (Papworth HRT Atherosclerosis) byla prospektivní randomizovaná studie s užitím transdermálního estradiolu a transdermální sekvenční kombinace estradiol + noretisteron. Zařazeno bylo 255 postmenopauzálních (průměrný věk 67 roku) pacientek s angiograficky prokázanou ICHS (více než 50% stenóza v jedné z koronárních arterií), 131 byla podávána HRT a 121 pacientek tvořilo kontroly. Průměrná doba sledování byla 30,8 měsíce. Studie ukázala zvýšení rizika pro ženy zahajující HRT s rozvinutou aterosklerózou i pro transdermální terapii (RR 1,49; CI 0,93–2,36; p = 0,11) [40].
Do studie WAVE (Women´s Angiographic Vitamin and Estrogen) bylo v 7 centrech zařazeno 423 postmenopauzálních žen s koronární stenózou 15–75 % potvrzenou koronarografií. Ženy byly rozděleny do 4 skupin. Jednu dvojici tvořily ženy léčené 0,625 mg CEE (u žen s dělohou + 2,5 mg MPA) a bez léčby. Druhou dvojici tvořily ženy léčené antioxidačními vitaminy – 2krát denně 400 IU vitamin E + 500 mg vitamin C – a ženy bez léčby. Kontrolní angiogram byl proveden za 2,8 roku. Zúžení koronárních arterií se zhoršilo o 0,047 mm/rok ve skupině s HRT a o 0,024 mm/rok v kontrolní skupině. Ve vitaminové skupině rovněž o 0,044 mm/ rok a v její kontrolní skupině o 0,28 mm/rok. Ve skupině s HRT zemřelo 14 pacientek (proti 8) s hazard ratio 1,8, ve skupině s vitaminy 16 (proti 6) s hazard ratio (HR) 2,8. Koronární příhody včetně úmrtí prokazují ve skupině s HRT zvýšené riziko (HR 1,9; 26 vs 15) stejně jako ve skupině s vitaminy (HR 1,5; 26 vs 18) [41].
Rovněž studie EPAT (Estrogen in the Prevention of Atherosclerosis Trial) sledovala účinek 1 mg 17β-estradiolu na tloušťku medie karotid. Zde ovšem podmínkou zařazení do studie byla nepřítomnost ztluštění intimy a normální nebo medikací korigované hodnoty lipidového spektra. Bylo zařazeno 222 žen starších 45 let, měření byla prováděna v 6měsíčních intervalech po dobu 2 let. Ve skupině žen užívajících estradiol byla progrese subklinické aterosklerózy o 0,0017 mm/ rok nižší ve srovnání s placebem. Tento rozdíl nebyl patrný ve skupině žen užívajících hypolipidemika. Tato studie na rozdíl od výše uvedených sledovala vliv estradiolu na ověřeně zdravou cévní stěnu, tedy ve skutečné primární prevenci [42].
Studie Women´s Health Initiative (WHI) byla prezentována jako dlouho očekávaná studie o vlivu HRT na primární prevenci ICHS. Do studie byly v letech 1993–1998 zařazovány ženy ve věku 50–79 let minimálně 6 měsíců po menopauze. Po minimálně 3měsíčním přerušení léčby bylo zařazeno i 26 % žen, které již HRT užívaly.
Větev s estrogen-gestagenní substitucí ve složení 0,625 mg CEE a 2,5 mg MPA byla po 5,2 roku trvání studie předčasně ukončena pro převahu nepříznivých účinků léčby nad placebem. V souboru 8 506 uživatelek a 8 102 kontrol bylo zjištěno zvýšení rizika karcinomu prsu, ICHS, cévní mozkové příhody a tromboembolie. Preventivní vliv na zlomeniny krčku kosti stehenní, karcinom endometria a kolorektální karcinom nepostačil v této studii k vyvážení negativ. Jiné faktory spojené s estrogenním deficitem (urogenitální trofika, kvalita života pacientky, subjektivní spokojenost) nebyly sledovány [43].
Pro zahájení primární prevence ICHS se průměrný věk 63,2 jeví poměrně vysoký a vysoká procentuální přítomnost faktorů ovlivňujících ICHS (34 % BMI > 30, 50 % abúzus nikotinu, 4,4 % diabetiček, 6,9 % uživatelek hypolipidemik, 20 % uživatelek aspirinu) i samotné anamnézy ICHS (4,4 %) je zarážející.
Také estrogenní větev studie WHI byla uzavřena předčasně po 6,8 (5,7–10,7) roku s odůvodněním, že další pokračování již nepřináší nové údaje, není sice překročeno žádné stanovené riziko, ale riziko ICHS se nesnižuje. V estrogenní větvi WHI bylo v letech 1993–1998 randomizováno 10 739 zdravých žen. Z nich užívalo 0,625 mg CEE 5 310 žen a placebo 5 429 žen. Zařazeno bylo 48 % léčených hypertoniček, 7,7 % diabetiček, 7,4 % uživatelek statinů, 19,4 % žen užívajících aspirin i 4,1 % žen s anamnézou ICHS. Opět zarazí široké věkové rozmezí od 50 do 79 let a nulové údaje o indikaci k zahájení terapie. Zajímavé jsou příznivé trendy při časném startu terapie. Ve věkové skupině 50–59 let se na rozdíl od vyšších věkových kategorií nezvyšuje riziko ICHS při užívání HRT [44].
KEEPS (Kronos Early Estrogen Prevention Study) je 4letá, randomizovaná, dvojitě slepá a placebem kontrolovaná klinická studie zdravých žen s průměrným věkem 52 let (42–58 let) do 3 let od menopauzy v době randomizace. Zařazeno bylo 727 žen do 3 větví studie – první s perorálním podáváním CEE v dávce 0,45 mg denně, druhou s transdermální aplikací 50 μg estradiolu denně a placebovou. V obou hormonálních větvích bylo proti placebu zaznamenáno zlepšení návalů, nočního pocení, nálady, sexuality a kostní denzity. Perorální CEE na rozdíl od transdermálních estrogenů zvyšovaly HDL-C, snižovaly LDL-C, ale současně zvyšovaly hladinu TG. Transdermální estradiol byl k lipidovému spektru neutrální, ale zlepšoval citlivost na inzulin (HOMA-IR, poměr glukózy a hladin inzulinu). Ani perorálně ani transdermálně podávané estrogeny neovlivňovaly tlak krve a rozvoj aterosklerózy v karotidách. Rozdíl proti placebu nebyl zjištěn ani ve výskytu nežádoucích účinků (karcinom prsu, karcinom endometria, infarkt myokardu, cévní mozková příhoda, tromboembolická nemoc) [45].
Do studie DOPS (Danish Osteoporosis Prevention Study) bylo zařazeno 1 006 zdravých časně postmenopauzálních žen nebo žen s akutním klimakterickým syndromem ve věku 45–58 let. Z nich 502 užívalo HRT a 504 bylo bez léčby. Sledování příčin úmrtí, kardiovaskulárních nemocí a nádorů trvalo 16 let. To je 10 000 ženských roků léčby a 20 000 ženských roků sledování. 10leté užívání bylo spojeno s 52% poklesem úmrtí na kardiovaskulární příhody, aniž by došlo ke zvýšení výskytu nádorových onemocnění (tab. 5). Prokázáno bylo snížení psychických potíží akutního klimakterického syndromu (anxieta, deprese, napětí).
Tab. 5. Výsledky 10letého podávání HRT 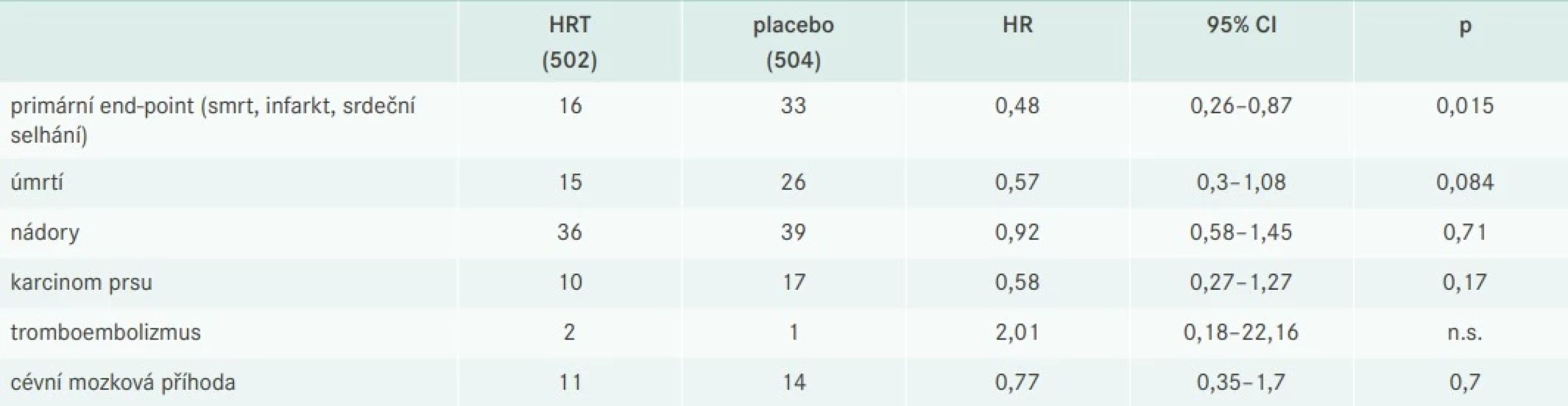
V klinické praxi na základě těchto studií nepodáváme HRT v sekundární ani primární prevenci ICHS. Nicméně si při časném startu můžeme být jisti bezpečností v této oblasti. Výjimkou je podávání ženám s předčasným ovariálním selháním, u nichž podávání HRT minimálně do průměrného věku menopauzy (50 let) jednoznačně přináší nejen ochranu před osteoporózou, ale i aterosklerózou [46].
Závěr
Hormonální substituční terapie je při transdermální aplikaci neutrální k lipidovému profilu, při perorální zvyšuje hladiny HDL-cholesterolu, ale současně i hladiny triglyceridů. Také na většinu markerů aterosklerózy působí příznivě či neutrálně s výjimkou hsCRP, jehož hladina se při perorální aplikaci zvyšuje. Pokud ještě nejsou známky aterosklerózy patrny, dokáže HRT oddalovat její nástup.
To platí i pro klinické projevy. Pokud je HRT podávána ženám mladým (do 10 let od přechodu), je k riziku aterosklerózy neutrální nebo dokonce působí protektivně.
doc. MUDr. Tomáš Fait, Ph.D.
Zdroje
1. NAMS Position Statement: The 2022 Hormone Therapy Position Statement. Menopause 2022; 29(7): 767–794. Dostupné z DOI: <http://dx.doi. org/10.1097/GME.0000000000002028>.
2. Salpeter SR, Cheng J, Thabane L et al. Bayesian metaanalysis of hormone therapy and mortality in younger postmenopausal women. Am J Med 2009; 122(11): 1016–1022.e1. Dostupné z DOI: <http://dx.doi.org/ 10.1016/j.amjmed.2009.05.021>.
3. Fait T. Hormone replacement therapy: latest developments and clinical practice. Drugs in Context 2019; 8 : 212551. Dostupné z DOI: <http://dx.doi. org/10.7573/dic.212551>.
4. Santoro N, Epperson CN, Mathews SB. Menopausal symptoms and their management. Endocrinol Metab Clin North Am 2015; 44(3): 497–515. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ecl.2015.05.001>.
5. Avis NE, Crawford SL, Greendale G et al. Study of Women´s Health Across the Nation. JAMA Intern Med 2015; 175(4): 531–539. Dostupné z DOI: <http://dx.doi.org/10.1001/jamainternmed.2014.8063>.
6. Biglia N, Cagnacci A, Gambacciani M et al. Vasomotor symptoms in menopause: a biomarker of cardiovascular disease risk and other chronic diseases? Climacteric 2017; 20(4): 306–312. Dostupné z DOI: <http://dx.doi. org/10.1080/13697137.2017.1315089>.
7. Thurston R, Chang Y, Barinas-Mitchel E et al. Physiologically assessed hot flashes and endothelial function among midlife women. Menopause 2017; 24(8): 886–893. Dostupné z DOI: <http://dx.doi.org/10.1097/ GME.0000000000000857>.
8. Herber-Gast B, Brown WJ, Mishra GD. Hot flushes and night sweats are associated with coronary heart disease risk in midlife: a longitudinal study. BJOG 2015; 122(11): 1560–1567. Dostupné z DOI: <http://dx.doi. org/10.1111/1471–0528.13163>.
9. Thurston RC, Aizenstein HJ, Derby CA et al. Menopausal hot flashes and white matter hyperintensities. Menopause 2016; 23(1): 27–32. Dostupné z DOI: <http://dx.doi.org/10.1097/GME.0000000000000481>.
10. Notelovitz M, Lenihan JP, McDermont M et al. Initial 17-estradiol dose for treating vasomotor symptoms. Obstet Gynekol 2000; 95(5): 726–731. Dostupné z DOI: <http://dx.doi.org/10.1016/s0029–7844(99)00643–2>.
11. Panay N, Ylikorkala O, Archer DF et al. Ultra-low-dose estradiol and norethisteron acetate: effective menopausal symptom relief. Climacteric 2007; 10 : 120–131. Dostupné z DOI: <http://dx.doi. org/10.1080/13697130701298107>.
12. Stevenson JC, Durand G, Kahler E et al. Oral ultra-low dose continuous combined hormone replacement therapy with 0,5 mg 17-estradiol and 2,5 mg dydrogesterone for the treatment of vasomotor symptoms. Maturitas 2010; 67(3): 227–232. Dostupné z DOI: <http://dx.doi.org/10.1016/j. maturitas.2010.07.002>.
13. Gambacciani M, Cappagli B, Ciaponi M et al. Ultra low-dose hormone replacement therapy and bone protection in postmenopausal women. Maturitas 2008; 59(1): 2–6. Dostupné z DOI: <http://dx.doi.org/10.1016/j.maturitas. 2007.10.007>.
14. Lundström F, Bydgeson M, Svane G et al. Neutral effect of ultra-low - -dose continuous combined estradiol and norethisterone acetate on mammographic breast density. Climacteric 2007; 10(3): 249–256. Dostupné z DOI: <http://dx.doi.org/10.1080/13697130701385805>.
15. Sturdee DW, Archer DF, Rakov V et al. Ultra-low-dose continuous combined estradiol and norethisterone acetate: improved bleeding profile in postmenopausal women. Climacteric 2008; 11(1): 63–73. Dostupné z DOI: <http://dx.doi.org/10.1080/13697130701852390>.
16. Bergeron C, Nogales FF, Rechberger T et al. Ultra-low dose continuous combined hormone replacement therapy with 0.5mg 17beta-oestradiol and 2.5mg dydrogesterone: protection of the endometrium and amenorrhoea rate. Maturitas 2010; 66(2): 201–205. Dostupné z DOI: <http://dx.doi.org/ 10.1016/j.maturitas.2010.03.007>.
17. Koire A, Joffe H, Buckley R. Replacement in the Prevention and Treatment of Cognitive Decline, Dementia, and Cognitive Dysfunction of Depression. Harv Rev Psychiatry 2022; 30(4): 215–222. Dostupné z DOI: <http://dx.doi.org/10.1097/HRP.0000000000000339>.
18. Kim J, Chang JH, Jeong MJ et al. A systematic review and metaanalysis of effects of menopause hormone therapy on cardiovascular diseases. Sci Rep 2020; 10(1): 20631. Dostupné z DOI: <http://dx.doi.org/10.1038/ s41598–020–77534–9>.
19. Fait T, Vrablik M. Coronary heart disease and hormone replacement therapy – from primary and secondary prevention to the window of opportunity. Neuro Endocrinol Lett 2012; 33(Suppl 2): 17–21.
20. Tan DA, Dayu AR. Menopausal hormone therapy: why we should no longer be afraid of the breast cancer risk. Climacteric 2022; 25(4): 362 – 368. Dostupné z DOI: <http://dx.doi.org/10.1080/13697137.2022.20357 11>.
21. Ruan X, Mueck AO. Primary choice of estrogen and progesteron as components of HRT. Climacteric 2022; 25(5): 443–452. Dostupné z DOI: <http://dx.doi.org/10.1080/13697137.2022.2073811>.
22. Fournier A, Berrino F, Clavel-Chapelon F. Unequal risks for breast cancer associated with different hormone replacement therapies: results from the E3N cohort study. Breast Cancer Res Treat 2008; 107(1): 103–111. Dostupné z DOI: <http://dx.doi.org/10.1007/s10549–007–9523-x>.
23. Collins P, Rosano G, Casey C et al. Management of cardiovascular risk in peri-menopausal woman. Eur Heart J 2007; 28(16): 2028–2040. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehm296>.
24. Szklo M. Heart disease: the MRFIT test. J Public Health Policy 1983; 4(1): 5–7.
25. Gordon T, Kannel WB, Hjortland MC et al. Menopause and coronary heart disease. The Framingham StudyAnn Intern Med. 1978; 89(2): 157 – 161. Dostupné z DOI: <http://dx.doi.org/10.7326/0003–4819–89–2-157>.
26. Schulte H, Cullen P, Assmann G. Obesity, mortality and cardiovascular disease in the Münster Heart Study (PROCAM). Atherosclerosis 1999; 144(1): 199–209. Dostupné z DOI: <http://dx.doi.org/10.1016/s0021 – 9150(99)00055–6>.
27. [The Writing Group for the PEPI Trial]. Effect of estrogen or estrogen/ progestin regimens on heart disease factors in postmenopausal women. The Postmenopausal Estrogen/Progestin Interventions (PEPI) Trial. JAMA 1995; 273(3): 199–208.
28. Samsioe G. HRT and cardiovascular disease. Ann N Y Acad Sci 2003; 997 : 358–372. Dostupné z DOI: <http://dx.doi.org/10.1196/ annals.1290.039>.
29. Seed M. The choice of hormone replacement therapy or statin therapy in the treatment of hyperlipidemic postmenopausal women. Atheroscler Suppl 2002; 3(1): 53–63. Dostupné z DOI: <http://dx.doi.org/10.1016/ s1567–5688(01)00009–5>.
30. Gambacciani M, Ciaponi M, Cappagli B et al. Body weight, body fat distribution, and hormonal replacement therapy in early postmenopausal women. J Clin Endocrinol Metab1997; 82(2): 414–417. Dostupné z DOI: <http://dx.doi.org/10.1210/jcem.82.2.3735>.
31. Prazny M, Fait T, Vrablik M. Effect of early estrogen replacement therapy on microvascular reactivity in patients after bilateral ovarectomy. Neuro Endocrinol Lett 2007; 28(4): 496–501.
32. Fait T, Vrablík M, Zizka Z et al. Changes in Haemostatic Variables Induced by Estrogen Replacement Therapy: Comparison of Transdermal and Oral Methods of Administration in Cross-over Designed Study. Gynecol Obstet Invest 2008, 65(1): 47–51. Dostupné z DOI: <http://dx.doi. org/10.1159/000107492>.
33. Kaprál A, Hyánek J, Fait T et al. Homocystein, ovarektomie a estrogenní substituční terapie. Klin Biochem Metab 2003; 11/32(4): 226–230.
34. Fait T, Vrablík M, Koštířová M. Vliv různých aplikačních forem estrogenní substituční terapie na hladiny C-reaktivního proteinu. Čas Lék Čes 2006; 145(7): 571–574.
35. Grodstein F, Stampfer MJ. Estrogen for women at varying risk of coronary disease. Maturitas 1998; 30(1): 19–26. Dostupné z DOI: <http:// dx.doi.org/10.1016/s0378–5122(98)00055–3>.
36. Grodstein F, Stampfer MJ, Colditz GA et al. Postmenopausal hormone therapy and mortality. N Engl J Med 1997; 336(25): 1769–1775. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM199706193362501>.
37. Hulley S, Grady D, Bush M. Randomised trial of estrogen plus progestin for secondary prevention of coronary heart desease in postmenopausal women. JAMA 1998; 280(7): 605–613. Dostupné z DOI: <http://dx.doi. org/10.1001/jama.280.7.605>.
38. Grady D, Herrington D, Bittner V et al. Cardiovascular disease outcomes during 6.8 years of hormone therapy: Heart and Estrogen/progestin Replacement Study follow-up (HERS II). JAMA 2002; 288(1): 49–57. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.288.1.49>.
39. Furberg CD. To whom do the research findings apply? Heart 2002; 87(6): 570–574. Dostupné z DOI: <http://dx.doi.org/10.1136/heart.87.6.570>.
40. Clarke SC, Kelleher J, Lloyd-Jones H et al. A study of hormone replacement therapy in postmenopausal women with ischaemic heart disease: the Papworth HRT atherosclerosis study. BJOG 2002; 109(9): 1056–1062. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1471–0528.2002.01544.x>.
41. Hsia J, Alderman EL, Verter Jl et al. Women´s angiographic vitamin and estrogen trial. Control Clin Trials 2002; 23(6): 708–727. Dostupné z DOI: <http://dx.doi.org/10.1016/s0197–2456(02)00237>.
42. Karim R, Mack WJ, Lobo RA et al. Determinants of the effect of estrogen on the progression of subclinical atherosclerosis: Estrogen in the Prevention of Atherosclerosis Trial. Menopause 2005; 12(4): 366–373. Dostupné z DOI: <http://dx.doi.org/10.1097/01.GME.0000153934.76086.A4>.
43. Rossouw JE, Anderson GL, Prentice RL et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized controlled trial. JAMA 2002; 288(3): 321–333. Dostupné z DOI: <http://dx.doi.org/10.1001/ jama.288.3.321>.
44. Anderson GL, Limacher M, Assaf AR et al. [WHI Steering Commitee]. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women’s Health Initiative randomized controlled trial. JAMA 2004; 291(14): 1701–1712. Dostupné z DOI: <http://dx.doi.org/10.1001/ jama.291.14.1701>.
45. Kling JM, Lahr BA, Bailey KR et al. Endothelial function in women of the Kronos Early Estrogen Prevention Study. Climacteric 2015; 18(2): 187–197. Dostupné z DOI: <http://dx.doi.org/10.3109/13697137.2014.986719>.
46. Rejnmark L, Vestergaard P, Tofteng CL et al. Response rates to oestrogen treatment in perimenopausal women: 5-year data from the Danish Osteoporosis Prevention Study (DOPS). Maturitas 2004; 48(3): 307–320. Dostupné z DOI: <http://dx.doi.org/10.1016/j.maturitas.2004.03.009>.
Štítky
Angiológia Diabetológia Interné lekárstvo Kardiológia Praktické lekárstvo pre dospelých
Článek Editorial
Článok vyšiel v časopiseAthero Review
Najčítanejšie tento týždeň
2023 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Vareniklin jako pomocník v léčbě nikotinismu i u psychiatrických pacientů
-
Všetky články tohto čísla
- Editorial
- 95. percentil LDL-cholesterolu v české populaci: studie Czech post-MONICA
- Dlhodobá bezpečnosť liečby alirokumabom – ďalšie poznatky zo štúdie ODYSSEY OUTCOMES
- Kardiovaskulární riziko: od významu přes stanovení po komunikaci s pacientem
- Lipitenzia: nové možnosti kombinovanej liečby
- Jak na to, aby léčba byla rychlejší než ateroskleróza
- RNA-interference – nový perspektivní směr ve vývoji léků
- Hormonální substituční terapie, ateroskleróza a význam časné intervence
- Rešerše zajímavých článků ze zahraniční literatury
- 26. kongres o ateroskleróze – opět prezenčně!
- Athero Review
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Jak na to, aby léčba byla rychlejší než ateroskleróza
- Kardiovaskulární riziko: od významu přes stanovení po komunikaci s pacientem
- Lipitenzia: nové možnosti kombinovanej liečby
- 95. percentil LDL-cholesterolu v české populaci: studie Czech post-MONICA
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



