-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Biologická a nebiologická eliminační léčba akutního selhání jater Experimentální práce na velkém laboratorním zvířeti
Biological and Non-biological Elimination Therapy of Acute Liver Failure. Experimental Study on Large Laboratory Animal
Background.
Development of biological and non–biological artificial liver devices in the previous 20 years enabled effective treatment of acute liver failure (ALF) of patients waiting for liver transplantation or for spontaneous liver parenchyma regeneration. Aim of the study was the evaluation of the effectiveness of biological (BAL – bioartificial liver) and non–biological (FPSA – Fractionated plasma separation and adsorption) methods in the treatment of experimental ALF on large laboratory animal.Methods and Results.
Surgical model of ALF with liver devascularization in pigs (weight 25–40 kg) was provided following monitoring of ALF markers (AST, ALT, bilirubin, ammoniac, glycaemia, INR) including intracranial pressure (ICP). Control group included animals without treatment of ALF. Results of both experimental groups were compared and statistically worked-out with that of controls by T-test and Mann-Whitney non–parametric test by EXCEL and QUATRO. BAL group: 10 pigs (weight 30 ± 5 kg) with ALF were treated by BAL with isolated hepatocytes. When plasma bilirubin was compared, significant differences (p < 0.05) in 6 and 9 hours interval were found favouring BAL group (18.1 vs. 13.1, 22.9 vs. 13.2 mmol/l). The value of ICP in both groups was no significant. Prometheus group: 14 pigs weight 35 kg (35 ± 5 kg) with the identical ALF were treated by Prometheus (FPSA). Level of serum bilirubin in experimental group when compared to control group was significantly lower (p < 0.01) at 6 hour interval 12.81 ± 6.54 vs. 29.84 ± 9.99 at 9 hour 11.94 ± 4.14 vs. 29.95 ± 12.36 and at 12 hour 13.88 ± 6.31 vs. 26.10 ± 12.23 mmol/l. No significant difference in serum ammonia level was found. ICP was significantly different from 9 hour to 12 hour interval in favour of FPSA group (p < 0.01): 9 hour 19.1 ± 4.09 vs. 24.1 ± 2.85, 10 hour 21.9 ± 3.63 vs. 25.1 ± 2.19, 11 hour 22.5 ± 3.98 vs. 26.3 ± 3.50 and 12 hour 24.0 ± 4.66 vs. 29.8 ± 5.88 mm Hg.Conclusions.
Significant improvement of bilirubin and ICP levels resulting from the treatment with fractionated plasma separation and adsorption (Prometheus) were observed in the case of experimental ALF. Except the bilirubin levels, bioartificial liver provided by O. liver Performer with isolated hepatocytes did not bring any significant improvement of laboratory markers, including ICP.Key words:
acute liver failure, large laboratory animal, bioartificial liver, FPSA, monitoring.
Autori: M. Ryska 1,2; E. Lásziková 2,3; T. Pantoflíček 1,2; E. Kieslichová 4
; O. Ryska 2,5; J. Pražák 6; E. Koblihová 1,2; J. Skibová 4
Pôsobisko autorov: Chirurgická klinika 2. LF UK a ÚVN, Praha 1; Centrum buněčné terapie a tkáňových náhrad 2. LF UK, Praha 2; Oddělení anesteziologie a resuscitace ÚVN, Praha 3; IKEM, Praha 4; Chirurgická klinika 1. LF UK a IPVZ ILF, FN Na Bulovce, Praha 5; Klinika anesteziologie, resuscitace a intenzivní péče 2. LF UK a FNM, Praha 6
Vyšlo v časopise: Čas. Lék. čes. 2008; 147: 367-375
Kategória: Původní práce
Súhrn
Východisko.
V posledních 20 letech dochází k rozvoji biologických i nebiologických eliminačních metod, které by umožňovaly efektivně léčit nemocného s akutním jaterním selháním v době, kdy čeká na transplantaci jater či po dobu, kdy dojde ke spontánní regeneraci jaterního parenchymu. Cílem práce je zhodnotit účinky biologické (BAL – Bioartificial liver) a nebiologické (FPSA – Fractionated plasma separation and adsorption) eliminační metody u ASJ v experimentu na velkém laboratorním zvířeti.Metody a výsledky.
Provedení chirurgického devaskularizačního modelu ASJ u prasete váhy 25–40 kg a následné monitorace markerů ASJ (AST, ALT, bilirubin, amoniak, glykémie, Quickův test) včetně intrakraniálního tlaku (ICP). Vytvoření kontrolní skupiny bez léčby ASJ. Výsledky obou experimentálních skupin jsme porovnali se skupinou kontrolní a statisticky zpracovali pomocí t-testu a Mann-Whitneyovým neparametrickým testem použitím tabulátoru EXCEL a QUATRO. Skupina BAL: 10 prasat váhy 30 kg (30 ± 5 kg) s ASJ jsme napojili na bioreaktor s izolovanými hepatocyty. Při srovnání léčené a neléčené skupiny jsme pozorovali rozdíl pouze v sérových koncentracích bilirubinu, kdy v 6. a 9. hodině byl statisticky významný (p < 0,05) ve prospěch skupiny BAL (18,1 vs. 13,1, 22,9 vs. 13,2 mmol/l). Hodnoty ICP se v průběhu experimentu statisticky významně nelišily. Skupina Prometheus: u 14 prasat váhy 35 kg (35 ± 5 kg) jsme k léčbě ASJ použili přístroj Prometheus (FPSA). Hladina bilirubinu byla v experimentální skupině oproti kontrolní signifikantně nižší v 6. hodině 12,81 ± 6,54 vs. 29,84 ± 9,99, v 9. hodině 11,94 ± 4,14 vs. 29,95 ± 12,36 a ve 12. hodině 13,88 ± 6,31 vs. 26,10 ± 12,23 mmol/l. Signifikantní rozdíl u hodnot amoniaku jsme nenašli. Hodnoty ICP se statisticky významně lišily od 9. hodiny po 12 hodinu ve prospěch skupiny léčené FSPA (p < 0,01): 9. hodina 19,1 ± 4,09 vs. 24,1 ± 2,85, 10. hodina 21,9 ± 3,63 vs. 25,1 ± 2,19, 11. hodina 22,5 ± 3,98 vs. 26,3 ± 3,50, 12. hodina 24,0 ± 4,66 vs. 29,8 ± 5,88 mm Hg sloupce.Závěry.
Na chirurgickém devaskularizačním modelu akutního selhání jater jsme v experimentu na velkém laboratorním zvířeti prokázali signifikantní snížení bilirubinu a ICP při použití metody FPSA – frakcionované plazmatické separace a adsorpce – přístrojem Prometheus. Biologická eliminace pomocí přístroje Oliver Performer s bioreaktorem s izolovanými hepatocyty vyjma koncentrace bilirubinu neprokázala signifikantní změny hodnot laboratorních ukazatelů ani ICP.Klíčová slova:
akutní jaterní selhání, velké laboratorní zvíře, bioartificial liver, FPSA, monitorace.Přežívání nemocných s akutním selháním jater (ASJ) dosahuje v závislosti na progresi encefalopatie a výskytu infekčních komplikací při konzervativní terapii pouhých 10–40 % (1). Ortotopická transplantace jater (TJ) je nejefektivnější metodou, která zlepšuje přežití nemocného s ASJ. U části nemocných však může dojít k regeneraci jaterní tkáně, a to i při destrukci více než 80 % hepatocytů (2). Regenerace vede k plnému uzdravení. V době, po kterou pacient čeká na TJ, či dochází ke spontánní regeneraci, je pacient akutně ohrožen na životě. Současné možnosti jak pacienta přes toto období převést (tzv. „bridging therapy“) jsou limitovány. Proto v posledních 20 letech dochází k rozvoji biologických i nebiologických eliminačních metod, které by umožňovaly efektivnější bridging, a tím zlepšily šanci nemocného s ASJ přežít.
Cílem našeho sdělení je srovnat léčebnou efektivitu biologické a nebiologické eliminační léčby ASJ. Práce vznikla na základě studií autorů s použitím obou metod na experimentálním chirurgickém modelu ASJ na velkém laboratorním zvířeti (3–9).
POUŽITÉ METODY
I. Experimentální chirurgický model ASJ
V experimentu jsme použili chirurgický model ASJ u prasete váhy 25–40 kg. Metodu, kterou jsme použili k vyvolání ASJ, tj. Provedení chirurgické devaskularizace jater s portokavální anastomózou (PCA), monitoraci hemodynamiky i laboratorních parametrů, jsme detailně popsali v předchozích publikacích (3–6).
Vedení pooperačního období
Po chirurgické devaskularizaci jater jsme prase zahřívali a ventilovali směsí kyslíku se vzduchem s FiO2 0,5. Intravenózně jsme podávali analgosedaci farmaky s převážně mimojaterní cestou eliminace: kombinaci propofolu v úvodní dávce 6 mg/kg/hod. (Recofol, Leiras, Finsko), fentanylu v úvodní dávce 2 μg/kg/min (fentanyl torrex, Torrex Pharma GmbH, Wien, Rakousko) a medetomidinu v úvodní dávce 3 μg/kg/hod. (Domitor, Phizer, USA). Podle potřeby jsme podávali krystaloidní a koloidní roztoky. Noradrenalin (Noradrenalin, Léčiva, ČR) a bolusové dávky furosemidu (Furosemid, Hoechst-Biotika, SR) jsme výjimečně odávali k udržení hemodynamické stability a diurézy.
Ventilace, monitorace vnitřního prostředí a markerů ASJ
U analgosedovaných zvířat byla umělá plicní ventilace vedena buď objemově (VCV) nebo tlakově (PCV) s cílem udržet normoventilaci (paCO2 4,6–5,3 kPa). V pravidelných intervalech jsme vyhodnocovali parametry acidobázické rovnováhy (pH, paO2, paCO2, laktát) s možností včasného zjištění a ovlivnění hypoxémie a hyperkapnie. Zároveň jsme kontinuálně monitorovali parametry hemodynamiky, SpO2, ETCO2 a hodinovou diurézu. V pravidelných intervalech jsme odebírali krevní vzorky ke stanovení hodnot iontů, glykémie, krevního obrazu, parametrů hemokoagulace, jaterních testů a sérového kreatininu.
Monitorace ICP
Monitoraci intrakraniálního tlaku (ICP) jsme zahájili ihned po operaci zavedeným intraparenchymovým čidlem (fy Codman, Johnson and Johnson, USA). Za sterilních kautel jsme po návrtu protnuli dura mater pomocí punkční jehly a zavedli čidlo do frontálního laloku. Monitoraci hodnot ICP jsme prováděli po celou dobu operace, rozvoje ASJ a eliminační léčby až do doby exitu zvířete. Kontinuálně jsme monitorovali tělesnou teplotu zvířat a udržovali ji na fyziologické hladině.
Nástup ASJ
Nástup ASJ jsme zaznamenali v čase poklesu glykémie pod hodnoty 3,5 mmol/l (normální hodnota 4,0–6,9 mmol/l). Tento moment byl počátkem otevření tzv. terapeutického okna a napojením na eliminační přístroj. Normoglykémii jsme v dalším průběhu terapie udržovali adekvátní infuzí roztoku 40% glukózy.
II. Experimentální skupiny
A. Biologická eliminační metoda léčby ASJ (skupina BAL)
Izolace hepatocytů
Pro izolaci porcinních hepatocytů jsme zvolili metodu jaterní perfuze s následnou centrifugací (7, 10). Suspenzi hepatocytů jsme filtrovali a postupně třikrát centrifugovali rychlostí 500 otáček za minutu při stálém chlazení na 4 oC (obr. 1). Získali jsme 80 g buněčné suspenze zředěné v celkovém objemu 200 ml. Po obarvení metylénovou modří jsme pod mikroskopem při zvětšení 150–300× změřili a zhodnotili viabilitu hepatocytů (obr. 2).
Obr. 1. Suspenze izolovaných hepatocytů po opakované centrifugaci 
Obr. 2. Izolované hepatocyty, mikrofotografie 
Naplnění a zapojení bioreaktoru
Bioreaktor využívá metodu perfuze plazmy organizmu s ASJ přes živé izolované hepatocyty s předpokladem jejich detoxikační a syntetické funkce, tj. vytvoření podpůrného systému biologických „umělých jater“. Naplnili jsme jej suspenzí hepatocytů, které jsme předtím promyli 2000 ml fyziologického roztoku a odvzdušnili. Poté jsme jej uložili do termoboxu při teplotě 4 oC až do doby jeho zapojení do terciálního okruhu přístroje O. liver Performer firmy Rand (Itálie) těsně po nástupu ASJ u experimentálního zvířete (obr. 3).
Obr. 3. Přístroj O. liver Performer (fy Rand, Itálie) se zapojením bioreaktoru 
B. Nebiologická eliminační metoda léčby ASJ (skupina FPSA)
Frakcionovaná plazmatická separace a adsorpce, její zapojení
K provedení nebiologické eliminační metody jsme použili přístroj Prometheus firmy Fresenius, Německo (obr. 4). Přístroj provádí detoxikaci organizmu frakcionovanou plazmatickou separací a adsorpcí – FPSA (Fractionated plasma separation and adsorption) a umožňuje eliminovat jak toxické substance rozpuštěné ve vodě, tak i toxiny vázané na albumin. Albumin s vázanými toxiny je přímo transportován na místo, kde jsou toxiny odstraněny. Není potřeba dodávat do systému lidský albumin a proces není limitován disociací z albuminu a difuzí tak, jak je tomu u předchozího nebiologického podpůrného přístroje MARS (molecular adsorbent recirculating system) (11).
Obr. 4. Přístroj Prometheus napojený na krevní oběh laboratorního zvířete s ASJ 
Přístroj Prometheus má tzv. „Albu flow filtr“ s polysulfonovou membránou neutrálního pryskyřičného adsorbéru Prometh 01, umožňující adsorpci žlučových kyselin, aromatických aminokyselin, fenolických substancí a toxinů. Druhý adsorbér, Prometh 02, vychytává negativně nabité ligandy (nekonjugovaný bilirubin). Ve vodě rozpustné substance jsou odstraňovány hemodialýzou (12).
Krev zvířete je krevní pumpou vedena z pravé femorální tepny do Albu Flow filtru, ve kterém je separován albumin a na něj vázané substance. Albumin je odtud veden sekundárním okruhem do adsorbéru Prometh 01 a Prometh 02 a po zbavení navázaných substancí je vrácen zpět do krve. Poté je krev vedena do dialyzátoru (HiFlux), který odstraní toxické látky rozpuštěné ve vodě. Očištěná krev je cestou levé femorální žíly vrácena do těla zvířete. Jako antikoagulans jsme použili heparin nebo citrát sodný.
Statistické zpracování výsledků
Získané hodnoty laboratorních vyšetření v průběhu léčby ASJ připojením na BAL či na FPSA jsme porovnali s parametry kontrolní skupiny zvířat, u které bylo vyvoláno ASJ a která nebyla na eliminaci napojena (3). Získané údaje jsme statisticky zpracovali pomocí t-testu a Mann-Whitneyovým neparametrickým testem použitím tabulátoru EXCEL a QUATRO.
Prohlášení
Předoperační přípravu, operaci a pooperační péči jsme prováděli v souladu se zákonem § 12 vyhlášky č.311/97 Sb., o chovu a využití pokusných zvířat s povolením etické komise IKEM pro experimenty na zvířatech.
Výsledky
1. Skupina BAL
U 10 zvířat váhy 30 kg (30 ± 5 kg) se ASJ rozvinulo v průměru za 2 hod. 7 min (48 min. – 3 hod. 16 min). Léčba napojením na BAL byla zahájena v průměru po 2 hod. 21 min (1 hod. – 3 hod. 45 min) od operace a trvala v průměru 5 hod. 43 min (3 hod. 25 min – 8 hod. 10 min). V tabulce 1 je uvedeno srovnání hodnot laboratorních ukazatelů ASJ zvířat léčených pomocí BAL s kontrolní skupinou (3) s vyznačenými odchylkami a zhodnocením významnosti změn. Ze statistického zpracování hodnot laboratorních ukazatelů ASJ obou skupin vyplývá, že významného rozdílu bylo dosaženo pouze v koncentraci bilirubinu, kdy v 0. hodině jsou průměrné hodnoty v obou skupinách prakticky totožné (3,1 vs. 3,8mmol/l), ve 3. hodině je rozdíl statisticky významný (p<0,05) v neprospěch skupiny s BAL (9,8 vs. 17,7 mmol/l) a rozdíl hodnot v 6. a 9. hodině je statisticky významný (p<0,05) ve prospěch skupiny BAL (18,1 vs. 13,1, 22,9 vs. 13,2). Rozdíl hodnot ve 12. hodině je opět statisticky nevýznamný (22,8 vs. 16,2 mmol/l).
Tab. 1. Srovnání laboratorních ukazatelů průběhu ASJ léčeného pomocí BAL a bez léčby (3) 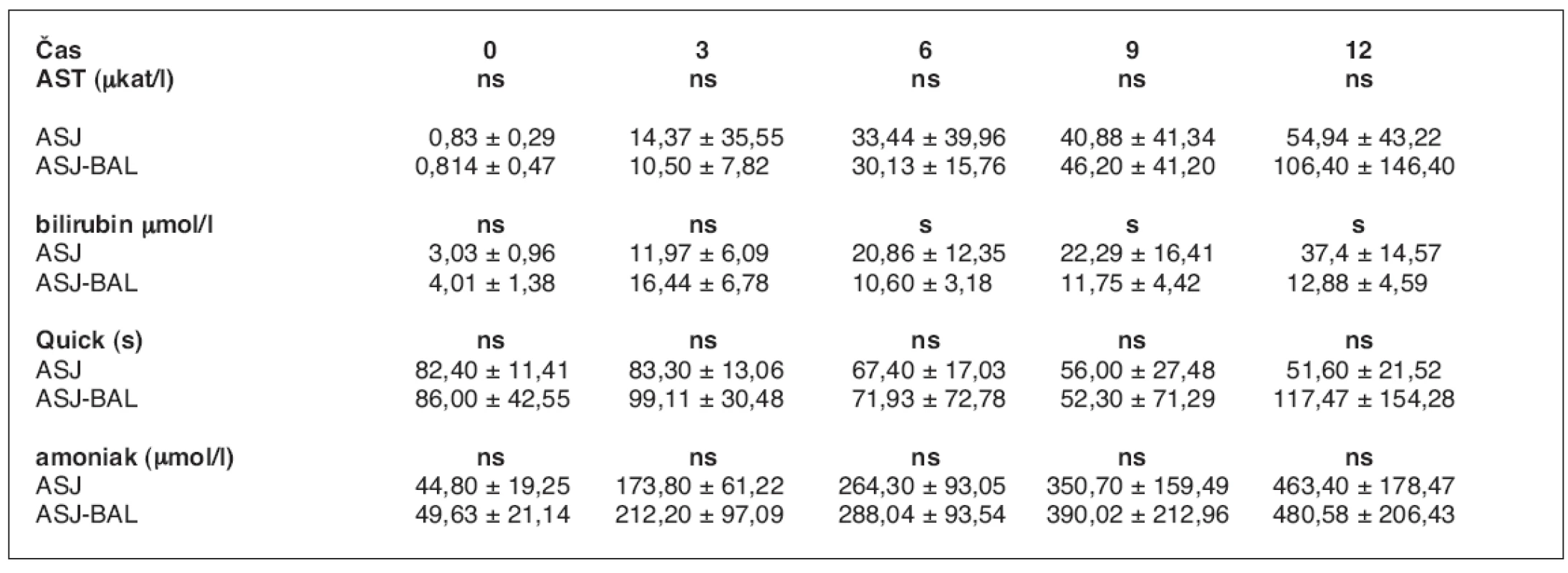
ns – neliší se, p > 0,05; s – statisticky významný rozdíl, p < 0,05 Počáteční viabilita hepatocytů při plnění bioreaktoru dosahovala v průměru 85,0 ± 4,5 %. Viabilitu izolovaných hepatocytů v bioreaktoru v průběhu léčby jsme posuzovali ze změřené průměrné hodnoty parciálního tlaku kyslíku při průchodu bioreaktorem (tab. 2). Rozdíl je signifikantně významný v 1.–3. a 5. hodině perfuze (p < 0,05), ve 4. a 6. hodině je signifikantně nevýznamný. Srovnání ICP je v průběhu ASJ statisticky nevýznamné (tab. 3, graf 1).
Tab. 2. Průměrné parciální tlaky kyslíku před bioreaktorem a za ním v průběhu perfuze (v mm Hg sloupce) 
Graf 1. Srovnání hodnot ICP ve skupině zvířat s ASJ léčeným pomocí BAL a v kontrolní skupině (3) v mm Hg sloupce 
Tab. 3. Srovnání hodnot ICP ve skupině zvířat s ASJ léčeným pomocí BAL a v kontrolní skupině (3) v mm Hg sloupce 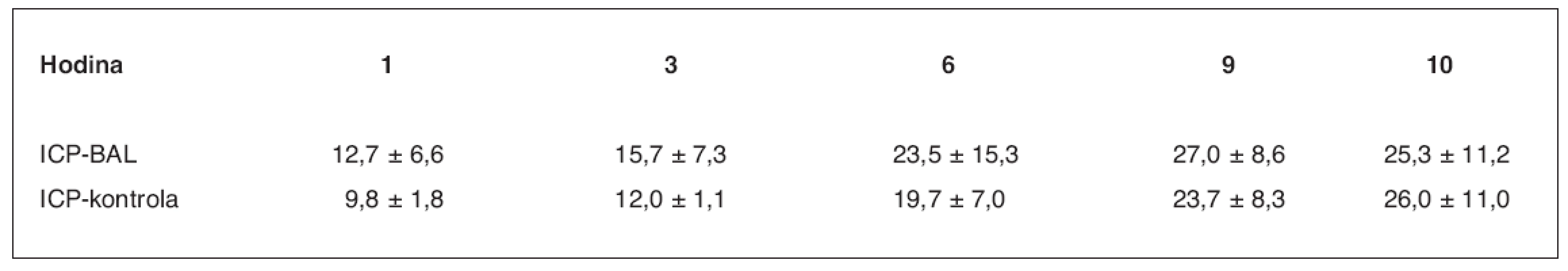
2. Skupina Prometheus
U 14 prasat průměrné váhy 35 kg (35 ± 5) s ASJ jsme v průměru po 3 hodinách 17 minutách od operace (rozmezí: 2 hod. 15 min – 4 hod. 20 min) zahájili léčbu FPSA. Ta trvala průměrně 5 hod. 54 min (rozmezí: 5 hod. 45 min – 6 hod.).Při eliminační terapii byl pro snížení srážlivosti krve použit u poloviny prasat heparin, u druhé poloviny citrát sodný. V tabulce 4 je uvedeno srovnání laboratorních hladin amoniaku a bilirubinu v séru zvířat s ASJ léčených pomocí FPSA a bez léčby se zhodnocením významnosti rozdílu včetně mediánu hodnot. Hladina bilirubinu se v experimentální skupině oproti kontrolní signifikantně lišila od 6. do 12. hodiny ve prospěch skupiny s léčbou FPSA (p < 0,05): v 6. hodině 12,81 ± 6,54 vs. 29,84 ± 9,99, v 9. hodině 11,94 ± 4,14 vs. 29,95 ± 12,36 a ve 12. hodině 13,88 ± 6,31 vs. 26,10 ± 12,23 mmol/l. Statisticky signifikantní rozdíl ve srovnání laboratorních hodnot hladin amoniaku mezi kontrolní a experimentální skupinou nebyl nalezen. Hodnoty ICP ve skupině léčené pomocí FPSA a ve skupině kontrolní se v průběhu experimentu statisticky významně lišily od 9. hodiny po 12 hodinu ve prospěch skupiny léčené FPSA (p < 0,05): 9. hodina 19,1 ± 4,09 vs. 24,1 ± 2,85, 10. hodina 21,9 ± 3,63 vs. 25,1 ± 2,19, 11. hodina 22,5 ± 3,98 vs. 26,3 ±3,50, 12. hodina 24,0 ± 4,66 vs. 29,8 ± 5,88 mm Hg sloupce (tab. 5, graf 2). Hodnoty dalších laboratorních hodnot – AST, ALT, kreatininu, albuminu a Quick – se v obou skupinách zvířat signifikantně nelišily a v tabulce výsledků je proto neuvádíme.
Tab. 4. Srovnání hodnot hladin amoniaku a bilirubinu ve skupině zvířat s ASJ léčeným FPSA a v kontrolní skupině (3) – průměr se směrodatnou odchylkou, hodnota mediánu a významnost rozdílu 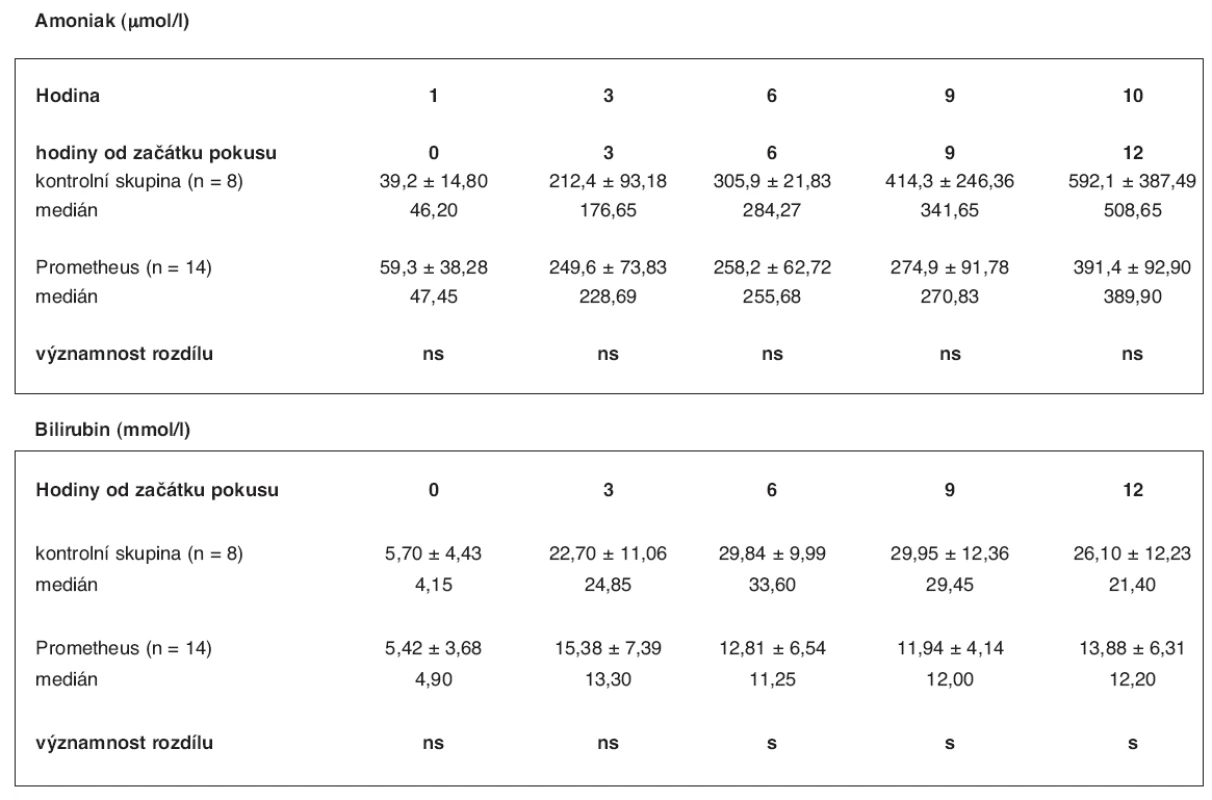
ns – neliší se, p > 0,05; s – statisticky významný rozdíl, p < 0,05 Tab. 5. Srovnání hodnot ICP ve skupině zvířat s ASJ léčeným FPSA a v kontrolní skupině – průměr se směrodatnou odchylkou, hodnota mediánu a významnost rozdílu 
ns – neliší se, p > 0,05; s – statisticky významný rozdíl, p < 0,05 Graf 2. Křivky ICP u laboratorního zvířete s ASJ léčených FPSA a u kontrolní skupiny bez léčby (hodina 1 je 1 hod. po operačním výkonu, nikoliv po nástupu ASJ) 
Diskuze
Akutní selhání jater, často nazývané vzhledem k rychlému nepříznivému vývoji pro pacienta fulminantní, je poměrně řídce se vyskytující syndrom s vysokou mortalitou. Ta závisí na věku pacienta: U mladších je 65–70 %, u starších až 90 % (14). Zatímco u menší části nemocných dojde k regeneraci jaterního parenchymu, a tím ke spontánnímu přežití, u větší části nemocných rozvoj onemocnění nepříznivě pokračuje (2). Za příznaků multiorgánového selhání pacient většinou zmírá na ireverzibilní poškození mozku při zhoršující se perfuzi mozkové tkáně a narůstajícím ICP nad normálních 10–15 torrů (15). Zajištění dostatečného mozkového perfuzního tlaku (CPP= cerebral perfusion pressure) představuje jeden ze základních cílů strategie léčby nemocných s edémem mozku a jeho hodnota má být 70 torrů. Při hodnotách pod 50 torr dochází k poruše perfuze s postupným rozvojem hypoxického cytotoxického edému. Při dalším poklesu CPP postupně dochází k zástavě mozkové cirkulace a k ireverzibilním změnám mozkové tkáně s následnou smrtí mozku. Při udržení MAP (Mean arterial pressure – střední arteriální tlak) v mezích normy je právě narůstající ICP fatálním faktorem porušení mozkové tkáně.
U těchto nemocných je jedinou účinnou léčbou urgentní TJ. Té se však příjemce nemusí dočkat. Významné procento nemocných zemře na čekací listině. K překlenutí kritického období, kdy vlastní játra nejsou schopna zajistit bazální metabolické potřeby organismu nemocného („bridging therapy)“ byla navržena od 50. let minulého století celá řada postupů a zkonstruována řada eliminačních přístrojů. Od prosté hemodialýzy a výměnné krevní transfuze, přes perfuzi krve přes živá prasečí či lidská kadaverózní játra, plazmaferézu, hemoperfuzi pomocí aktivního uhlí až k současným sofistikovaným biologickým či nebiologickým eliminačním přístrojům (16, 45).
Vlastní experiment
K experimentu jsme použili námi vyvinutý experimentální model u prasete, který prokázal standardní nástup ASJ po provedené jaterní devaskularizaci a portokavální anastomóze (3).
K prokázání účinnosti jak biologické, tak i zvolené nebiologické metody, jsme hodnotili hladiny markerů ASJ, především ICP. A to za situace, kdy jsme udržovali MAP při zajištění adekvátní oxygenace, mozkové a systémové perfuze v mezích normy tak, abychom minimalizovali arteficiální ovlivnění ICP. Také tělesnou teplotu (TT), jako faktor ovlivňující mozkovou perfuzi, jsme uměle udržovali v mezích normy.
Z biologických eliminačních možností jsme zvolili bioreaktor naplněný živými porcinními hepatocyty, z nebiologických pak nejnovější systém FPSA s délkou terapie 6 hodin v obou případech tak, jak je doporučována v klinice (17–23, 36–42).
Měření hodnot ICP při posuzování účinnosti eliminačních metod pak považujeme za zásadní vzhledem ke skutečnosti, že především ovlivnění této hodnoty by mělo mít finálně vliv na hodnocení účinnosti metody v léčbě ASJ jak v experimentu (32), tak i v klinice (34).
Biologická eliminace
Jednou z možnosti eliminační léčby ASJ, která byla vyzkoušena jak experimentálně (17, 18), tak i klinicky (19–23), je použití tzv. bioartificiálních jater (BAL). Využívá perfuzi plazmy přes izolované živé hepatocyty. Randomizovaná multicentrická studie provedená týmem profesora Demetriou (24) prokázala potencionální léčebný benefit u nemocných s ASJ. Neprokázala však prodloužení života takto léčených nemocných. Obdobně vyznívá hodnocení ostatních provedených studií (25).
Ve studii jsme použili izolované čerstvé porcinní hepatocyty, třídimenziální bioreaktor s extrakorporálním podpůrným systémem přístroje O. liver performance fy Rand s plazmafiltrací, hemofiltrací a integrovaným oxygenátorem (7). Bioreaktor byl v souladu s výrobcem naplněn 200 ml suspenze obsahující 80 gramů izolovaných hepatocytů. V průběhu pokusu jsme monitorovali laboratorní ukazatele ASJ, parametry hemodynamiky a ICP stejný způsobem, jaký jsme použili u kontrolní skupiny (3–6).
K volbě uvedených komponentů BAL nás nutily především následující důvody:
- snadná dostupnost živých čerstvých porcinních hepatocytů,
- relativní jednoduchost jejich izolace s dosažením vysoké viability,
- provedení pilotního pokusu, jež by byl srovnatelný s již publikovanými výsledky experimentálních studií,
- volba metody, která by mohla být srovnávána s již publikovanými klinickými studiemi a potencionálně aplikovatelná v klinickém experimentu.
Po provedení izolace dosahovala průměrná viabilita hepatocytů 85 %. Tuto hodnotu jsme považovali v souladu s literárními údaji za dostatečnou (10, 17–20, 32, 33). Získaná data konsumpce kyslíku v krvi při průchodu bioreaktorem potvrdila, že v průběhu perfuze si hepatocyty životaschopnost uchovaly prvních 5 hodin. Šestou hodinu se jejich viabilita rychle snižovala. Množství použitých hepatocytů k náplni bioreaktoru není u různých autorů totožné a pohybuje se řádově od 109 po 1010 bez závislosti na váze experimentálního zvířete (17–20, 32, 33).
V některých experimentálních studiích autoři prokazují snížení hladin amoniaku, koncentrace bilirubinu a ICP u skupiny léčených BAL (17, 18, 32, 33). Nicméně tyto studie nejsou srovnatelné jak typem animálního modelu ASJ (např. resekce jater u Cuervas-Monse či hepatektomie u Sosefa), tak i typem eliminační metody (např. kombinace BAL s dialýzou u Sheila) (18, 19, 29). Z námi naměřených hodnot laboratorních ukazatelů ASJ ve skupině BAL a z jejich srovnání s kontrolní skupinou lze učinit následující závěry:
- Aktivita AST, koncentrace amoniaku a hodnota Quickova testu se signifikantně nelišily v obou skupinách.
- Koncentrace bilirubinu byla signifikantně nižší v 6.a v 9. hodině ve skupině BAL.
- Naměřené hodnoty ICP se v obou skupinách signifikantně nelišily, i když po 9. hodině nelze trend naměřených hodnot posuzovat pro blížící se ukončení experimentu.
Naše výsledky je možné srovnat s výsledky některých experimentálních studií na velkých laboratorních zvířatech (26–31). Skutečnost, proč jsme v naší sestavě nedosáhli literárně uváděného signifikantního zlepšení většiny laboratorních ukazatelů ASJ a hodnot ICP, je možné vysvětlit řadou faktorů: Přežívání hepatocytů v bioreaktoru nedosahovalo požadovaných 6 hodin, použité množství hepatocytů v suspenzi mohlo být vzhledem k váze experimentálního zvířete s ASJ nedostatečné, monitorace byla prováděna po omezenou dobu.
Na straně druhé jsme přesvědčeni, že námi použitý devaskularizační model ASJ (3) se na rozdíl od modelů hepatektomovaných zvířat (29) velmi blíží klinickému průběhu ASJ s vyplavením vazoaktivních substancí a ostatních toxických látek z nekrotických částí jater do oběhu nemocného. Naše výsledky jsou v souladu s výsledky provedené randomizované klinické studie léčby ASJ pomocí BAL (24).
Nebiologická eliminace
Z nebiologických metod klinické uplatnění nalezl v devadesátých letech minulého století systém MARS (11). Nověji se začal uplatňovat systém FPSA (Prometheus) (12). Klinické zkušenosti s přístrojem Prometheus potvrzují bezpečnost léčby ASJ a efektivitu při odstranění na albumin vázaných toxinů a ve vodě rozpustných substancí. Rifai se spoluautory (35) jako první na 11 nemocných s ASJ prokázal signifikantní snížení sérové hladiny konjugovaného bilirubinu, žlučových kyselin, amoniaku, cholinesterázy, kreatininu a urey. Také v prospektivní studii na 10 nemocných nezaznamenal komplikace metody při dvou po sobě následujících minimálně 4 hodiny trvajících eliminacích (36). V randomizované studii s malým počtem nemocných s ASJ Aleman se spoluautory (37) porovnali vliv albuminové dialýzy (MARS) a FPSA (Prometheus) na hemodynamiku a vazoaktivní látky u nemocných s ASJ u chronického alkoholického poškození jater. Oba postupy prokázaly srovnatelný vliv na hemodynamiku a hladinu vazoaktivních látek, ve snížení hladiny bilirubinu byl úspěšnější Prometheus. Stadlbauer se spoluautory (38) u pacientů s totožnou diagnózou prokázali, že cytokiny jsou eliminovány oběma přístroji srovnatelně, nicméně jejich hladina v séru ovlivněna není. In vivo provedená kvantifikace srovnání obou eliminačních metod prokázala na 8 nemocných signifikantně vyšší clearence jak albuminových ligandů, tak i ve vodě rozpustných substancí u MARS. Nekonjugovaný bilirubin byl eliminován pouze FPSA (39). Z 31 nemocného zařazeného v klasifikaci UNOS-1 (extra-urgentní indikace k TJ) použili Prometheus s dobrými výsledky v rámci „bridging therapy“ u 8 nemocných Nyckowski se spoluautory (40). I z dalších publikovaných studií (41, 42) vyplývá zlepšení biochemických markerů ASJ.
V naší experimentální skupině jsme léčbu FPSA zahájili v průměru 3 hod. 17 minut po provedení devaskularizace. Hodnoty transamináz, Quickova testu, kreatininu a albuminu nebyly v obou skupinách signifikantně rozdílné. Za zásadní považujeme signifikantní rozdíly v hladinách bilirubinu, které jsme dosáhli od 6. hodiny po zahájení léčby. Hodnoty amoniaku byly také u experimentální skupiny výrazně nižší, nicméně významnost rozdílu obou skupin jsme statisticky neprokázali. Příčinu vidíme v příliš velkých hodnotách SD u kontrolní skupiny. Za nejvýznamnější považujeme prokázání signifikantního vlivu FPSA na snížení ICP, který na rozdíl od kontrolní skupiny nepřekročil hodnotu 25 mm Hg sloupce a nedostal se na úroveň, při které již hrozí poškození mozkové tkáně (15). V současné dostupné literatuře jsme tato měření provedená v experimentu nenašli.
Jedním z problematických součástí léčby Prométheem je zajištění správné antikoagulační terapie (13). Její absence může vyústit ve srážení krve v okruhu Prométhea, ke snížení efektivity léčby a zvyšování celkových nákladů. V případě našeho pokusu jsme použili u 7 prasat jako antikoagulans heparin, u druhých 7 prasat citrát sodný. Samotný heparin má minimální antikoagulační účinky. Jeho antikoagulační účinek je zprostředkován antitrombinem (vzniká komplex s heparinem a následně trombinem). Léčbu heparinem jsme monitorovali pomocí aktivovaného koagulačního testu (ACT). Prodloužení ACT je úměrné hladině heparinu. Účinky heparinu jsme rušili před návratem do systémové cirkulace infuzí protaminu. Byli jsme si vědomi, že při poklesu AT III pod 60 % se snižuje efekt heparinu.
Citrát sodný svým chelačním účinkem způsobuje významné snížení ionizovaného kalcia v krvi, a tím hlubokou antikoagulaci. Dávku citrátu sodného jsme nastavili dle monitorace hodnot ionizovaného kalcia. Před návratem do systémové cirkulace bylo nutné ionizované kalcium, snížené ztrátou vápníku přes hemofiltr a vazbou na nemetabolizovaný citrát v oběhu, korigovat infúzí kalcia (CaCl2).
Srovnání obou eliminačních metod
Biologická a nebiologická eliminační léčba ASJ se principiálně výrazně liší. Zatímco biologická eliminace využívá perfuzi plazmy organismu s ASJ přes bioreaktor vyplněný izolovanými živými hepatocyty (BAL) s předpokladem jejich detoxikační a syntetické funkce, u nebiologické metody jde o vyvázání oxických složek, tj. o pouhou detoxikaci. Experimentální i klinické studie prokázali účinnost BAL ve snížení hodnot markerů ASJ (17, 18, 32, 33), nicméně klinická randomizovaná studie neprokázala prodloužení přežívání nemocných s ASJ (24) a předpokládaný klinický rozvoj metody se fakticky zastavil.
U FPSA doposud randomizované studie provedeny nebyly a účinnost metody se hodnotí na víceméně kazuistických zkušenostech (35–42). Z těchto důvodů jsme přistoupili k naší experimentální studii (43).
U obou metod jsme použili identický chirurgický model ASJ (3). Jak v experimentálních, tak i v kontrolní skupině bez léčby jsme monitorovali nástup ASJ po devaskularizaci jater a vytvoření PCA. V souladu s literaturou jsme nepovažovali změny v hodnotě transamináz za směrodatné (44). U experimentálního ASJ jsme udržovali veličiny (CPP, TT a paCO2) mající vliv na ICP ve fyziologických mezích. Hodnoty markerů ASJ jsme u obou experimentálních skupin porovnávali s výsledky kontrolní skupiny. K signifikantnímu poklesu bilirubinu došlo v průběhu eliminační terapie u obou skupin, k signifikantnímu snížení ICP pouze u skupiny FPSA.
Pokud srovnáme technickou náročnost obou metod, považujeme BAL ve srovnání s FPSA za obtížnější vzhledem k delší přípravě zahájení léčby (izolování hepatocytů s udržováním jejich vysokého procenta viability). Obě metody vyžadují poměrně náročnou přípravu provádějícího týmu. Naše zkušenosti jsou v souladu se současným trendem upřednostňujícím nebiologické eliminační postupy.
Zkratky
ACT – activated coagulation test (aktivovaný koagulační test)
ASJ – akutní selhání jater
BAL – bioartificial liver (biologická „umělá játra“)
CPP – cerebral perfusion pressure (mozkový perfuzní tlak)
ETCO2 – end-tidal CO2 (koncentrace oxidu uhličitého ve vydechovaném vzduchu na konci výdechu)
FiO2 – fractional concentration of oxygen in inspired gas (frakční koncentrace kyslíku ve vdechované směsi)
FPSA – fractionated plasma separarion and adsorption (frakcionovaná plazmatická separace a adsorpce)
ICP – intracranial pressure (intrakraniální tlak)
MAP – mean arterial pressure (střední arteriální tlak)
MARS – molecular adsorbent recirculating system (molekulární adsorbující recirkulační systém)
paCO2 – partial pressure CO2 (parciální tlak CO2 v arteriální krvi)
PCA – portocaval anastomosis (portokavální anastomóza)
PCV – pressure control ventilation (tlakově řízená ventilace)
TJ – transplantace jater
SpO2 – pulzní oxymetrie = perkutánně měřená saturace hemoglobinu kyslíkem v %
VCV – volume control ventilation (objemově řízená ventilace)
V nácviku izolace hepatocytů jsme velmi ocenili pomoc paní prof. MUDr. Z. Červenkové CSc. z LF UK v Hradci Králové. Dále patří poděkování panu J. Čápovi z IKEM za předání poznatků při práci s Prometheem a panu prim. MUDr. B. Jurenkovi (ARO ÚVN Praha) za cenné rady týkající se ventilace a monitorace laboratorních zvířat.
Práce byla uskutečněna s podporou výzkumného centra LN00A065 – Centrum buněčné terapie a tkáňových náhrad, a s podporou rozvoje a výzkumu 9140.
prof. MUDr. Miroslav Ryska Csc.
Chirurgická klinika 2. LF UK a ÚVN
U Vojenské nemocnice 1200, 160 00 Praha 6
fax: +420 973 202 898, e-mail: miroslav.ryska@uvn.cz
Zdroje
1. Trey, C., Davidson, C. S.: The management of fulminant hepatic failure. Prog. Liver. Dis., 1970, 3, s. 282–298.
2. Panek, L., Andreasen, B., Tygstrup, N.: Galactosamine elimination capacity as a prognostic index in patients with fulminant hepatic failure. Gut, 1980, 17, s. 959–964.
3. Ryska, M., Kieslichová, E., Pantoflíček, T. et al.: Devascularization Surgical Model of Acute Liver Failure in Minipigs. Eur. Surg. Res., 2004, 36, s. 179–184.
4. Ryska, M., Kieslichová, E., Pantoflíček, T. et al.: Chirurgický model akutního selhání jater u laboratorního miniprasete. Čes. Slov. Gastroent. Hepatol., 2004, 58, s. 83–88.
5. Ryska, M., Kieslichová, E., Pantoflíček, T. et al.: Model akutního selhání jater u miniprasete z hlediska chirurga a anesteziologa. Rozhl. Chir., 2004, 83, s. 436–442.
6. Kieslichová, E., Ryska, M., Pantoflíček, T. et al.: Hemodynamic Parameters in a Surgical Devascularization Model of Fulminant Hepatic Failure in the Minipig. Phys. Res., 2005, 54, s. 485–490.
7. Ryska, M., Kieslichová, E., Pantoflíček, T. et al.: Bioeliminace v léčbě akutního selhání jater v experimentu na velkém laboratorním zvířeti. Čes. Slov. Gastroent. Hepatol., 2006, 60, s. 157–162.
8. Ryska, M., Lásziková, E., Pantoflíček, T. et al.: Prometheus v léčbě akutního selhání jater v experimentu na velkém laboratorním zvířeti. Čes. Slov. Gastroent. Hepatol., 2007, 61, s. 297–303.
9. Ryska, M., Laszikova, E., Pantoflicek, T. et al.: Prometheus Significantly Decreases Intracranial Pressure on Acute Liver Failure. Experimental Study. ESR (in press).
10. Selen, P. O.: Preparation of isolated rat liver cells. Methods Cell Biol. 1976, 13, s. 29–83.
11. Stange, J., Ramlow, W., Mitzner, S. et al.: Dialysis against a recycled albumin solution enables the removal of albumin-bound toxins. Artur Organs, 1993, 17, s. 809–813.
12. Falkenhage, D., Strobl, W., Vogt, G. et al.: Fractionated plasma separation and absorption systém: a novel systém for blood purification to remove albumin bound substance. Artur Organs, 1999, 23, s. 81–86.
13. Monchi, M., Berghmans, D., Ledoux, D. et al.: Citrate vs. heparin for anticogulation in continuous venovenous hemofiltration: a prospective randomized study. Intensive care med., 2004, 30, s. 260–265.
14. Hoofnagle, J. H., Carithers, R. L., Shapiro, C. et al.: Fulminant hepatic failure: summary of a workshop. Hepatology, 1995, 21, s. 240–252.
15. Detry, O., De Roover, A., Honoré, P. et al.: Brain edema and intracranial hypertension in fulminant elativ failure: pathophysiology and management. World J. Gastroenterol., 2006, 12, s. 7405–7412.
16. Williams, R.: The elusive goal of liver suport-quest for the Holy Gril. Clin. Med., 2006, 6, s. 482–487.
17. Flendrig, L. M., Calise, F., Di Florio, E. et al.: Significantly improved survival time in pigs with complete liver ischemia treated with a novel bioartificial liver. Int. J. Artif. Organs, 1999, 22, s. 701–708.
18. Cuervas-Mons, V., Colás, A., Rivera, J. A. et al.: In vivo efficacy of a bioartificial liver improving spontaneous recovery from fulminant hepatic failure: a controlled study in pigs. Transplantation, 2000, 69, s. 337–344.
19. Sheil, A. G. R., Sun, J., Wang, L. et al.: A biodialysis systém for liver support tested in a porcine hepatic failure model. Aust. N Z J Surg., 2000, 70, s. 127–131.
20. Gerlach, J. C., Encke, J., Hole, O. et al.: Bioreactor for a large scale hepatocyte in vitro perfusion. Transplantation, 1994, 58, s. 984–988.
21. Horslen, S. P., Hammel, J. M., Fristoe, L. W. et al.: Extracorporeal liver perfusion using human and pig livers for acute liver failure. Extracorporeal liver perfusion using human and pig livers for acute liver failure. Transplantation, 2000, 70, s. 1472–1478.
22. Levy, M. F., Crippin, J., Sutton, S. et al.: Liver allotransplantation after extracorporeal hepatic support with transgenic (hCD55/hCD59) porcine livers. Clinical results and lack of pig-to-human transmission of the porcine endogenous retrovirus. Transplantation, 2000, 69, s. 272–280.
23. Rozga, J., Holzman, M. D., Ro, M. S. et al.: Development of a hybrid bioarteficial liver. Artif. Organs, 1993, 21, s. 502–511.
24. Demetriou, A. A., Brown, R. S., Busuttil, R. W. et al.: Prospective, randomized, multicenter, controlled trial of a bioartificial liver in treating acute liver failure. Ann. Surg., 2004, 239, s. 660–670.
25. Hayes, P. C., Lee, A.: What progress with artificial livers? Lancet, 2001, 358, s. 1286–1287.
26. Flendrig, L. M., Calise, F., Di Florio, E. et al.: Significantly improved survival time in pigs with complete liver ischemia treated with a novel bioartificial liver. Int. J. Artif. Organs, 1999, 22, s. 701–708.
27. Cuervas-Mons, V., Colás, A., Rivera, J. A. et al.: In vivo efficacy of a bioartificial liver improving spontaneous recovery from fulminant hepatic failure: a controlled study in pigs. Transplantation, 2000, 69, s. 337–344.
28. Borra, M., Galavotti, D., Bellini, C. et al.: Advanced technology for extracorporeal liver support systém devices. Int. J. Artif. Organs., 2002, 25, s. 939–949.
29. Sosef, M. N., Abrahamse, L. S. L., Van de Kerkhove, M. P. et al.: Assesment of the AMC-bioartificial liver in the anhepatic pig. Transplantation 2002, 73, s. 204–209.
30. Naka, S., Takeshita, K., Yamamoto, T. et al.: Bioartificial liver support systém using porcine hepatocytes entrapped in a three-dimensional hollow fiber module with collagen gel: an evaluation in the swine acute liver failure model. Artif. Organs, 1999, 23, s. 822–828.
31. Sheil, A. G., Sun, J., Mears, D. C. et al.: Positive biochemical effects of a bioartificial liver support system (BALSS) in a porcine fulminant hepatic failure (FHF) model. Int. J. Artif. Organs, 1998, 21, s. 43–48.
32. Khalili, T. M., Navarro, A., Ting, P. et al.: Bioartificial liver treatment prolongs survival and lowers intracranial pressure in pigs with fulminant hepatic failure. Artif. Organs., 2001, 25, s. 566–570.
33. Sheil, A. G., Sun, J., Mears, D. C. et al.: Positive biochemical effects of a bioartificial liver support system (BALSS) in a porcine fulminant hepatic failure (FHF) model. Int. J. Artif. Organs, 1998, 21, s. 43–48.
34. O’Grady, J. G., Alexander, G. J., Hayllar, K. M. et al.: Early indicators of prognosis in fulminant hepatic failure. Gastroenterology, 1989, 97, s. 439–445.
35. Rifai, K., Ernst, T., Kretschmer, U. et al.: Prometheus – a new extracorporeal system for the treatment of liver failure. J. Hepatol., 2003, 39, s. 984–990.
36. Rifai, K., Ernst, T., Kretschmer, U. et al.: The Prometheus device for extracorporeal support of combined liver and renal failure. Blood Purif, 2005, 23, s. 298–302.
37. Aleman, W., Wolker, A., Evenepoel, P. et al.: Effect of the molecular adsorbent recirculating systém and Prometheus device on systemic haemodynamics and vasoactive agents in patiens with acute-on-chronic alcoholic liver failure. Crit care, 2006, 10, R108(do:10.1186/cc4985).
38. Stadlbauer, V., Krisper, P., Signet B et al.: Effect of extracorporeal liver support by MARS and Prometheus on serum cytokines in acute-on-chronic liver failure. Crit care, 2006, 10, R169(do:10.1186/cc5119).
39. Krisper, P., Haditsch, B., Stauber, R. et al.: In vivo quantification of liver dialysis: comparison of albumin dialysis and fractionated plasma separation. J. Hepatology, 2005, 43, s. 451–457.
40. Nyckowski, P., Skwarek, A., Zieniewicz, K. et al.: Orthotopic liver transplantation for fulminant hepatic failure. Transplant. Proc., 2006, 38, s. 219–220.
41. Evenepoel, P., Aleman, W., Wolker, A. et al.: Detoxifying capacity and kinetics of Prometheus – a new extracorporeal systém for the treatment of liver failure. Blood Purif., 2005, 23, s. 349–358.
42. Santoro, A., Faenza, S., Mancini, E. et al.: Prometheus systém: a technological support in liver failure. Transplant. Proc., 2006, 38, s. 1078–1082.
43. Sheil, A. G. R., Sun, J., Wang, L. et al.: A biodialysis system for liver support tested in a porcine hepatic failure model. Aust. N Z J Surg., 2000, 70, s. 127–131.
44. Carraro, P., Burighel, D., De Silvestro, G. et al.: Early prognostic biochemical indicators of fulminant hepatic failure. Int. J. Clin. Lab. Res., 1998, 28, s. 196–199.
45. Horak, J., Horky, J., Rabl, M.: Haemoperfusion through activeted charcoal in dogs with fulminant liver failure. Digestion, 1980, 20, s. 22–30.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Expoziční test ve stanovení diagnózy potravinové alergie – orální alergický syndrom
- Nová funkce C3d komplementové komponenty
- Změny v genové expresi během inzulínové rezistence a „diabezity“ v inzulín-senzitivních tkánícha možnosti jejich regulace
- Migrace různých typů lymfocytů ve tkáni
- Biologická a nebiologická eliminační léčba akutního selhání jater Experimentální práce na velkém laboratorním zvířeti
- Vztah inzulínové rezistence a množství viscerálního tuku
- Využitie profilov génovej expresie k stanoveniu odpovedi k neoadjuvantnej konkomitantnej chemorádioterapii u pacientov s karcinómom rekta: pilotná štúdia
- Poruchy chování u sedmiletých dětí – výsledky studie ELSPAC3. Vývoj v období po narození*
- Je stanovení sérového kreatininu vždy věrohodné? Úskalí preanalytické fáze
- Pokrok v lékařství: Oč se máme snažit a co máme omezovat?*
- Toll-like receptory a jejich generická variabilita při streptokokové pneumonii
- Prof. R. čihák – anatom a embryolog – 80. výročí narození
- Série seminářů „nová legislativa“ programu PACE oslovila i lékaře
- Medical Fair
- Před úsvitem, po ránu
- Základy klinické farmakologie
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Expoziční test ve stanovení diagnózy potravinové alergie – orální alergický syndrom
- Je stanovení sérového kreatininu vždy věrohodné? Úskalí preanalytické fáze
- Vztah inzulínové rezistence a množství viscerálního tuku
- Pokrok v lékařství: Oč se máme snažit a co máme omezovat?*
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



