-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Moderní trendy v radioterapii
Modern trends in radiotherapy
Radiotherapy is a dynamically developing field of cancer treatment. Advances in radiotherapy are significantly related to new knowledge in radiobiology, the introduction of new systems in radiodiagnostics and radiation therapy planning. The technical development of irradiation systems over the last 10 years has greatly improved the quality of radiation therapy. The constant aim of modern radiation therapy is to minimize the toxicity of radiotherapy while maintaining the therapeutic effect. With the development of radiotherapy, however, the issue of so-called financial toxicity of various radiation techniques and disproportionate increase in treatment spending, regardless of cost-effectiveness.
Keywords:
radiotherapy – Radiosurgery – brachytherapy – modern techniques
Autori: Pavel Šlampa
Pôsobisko autorov: Klinika radiační onkologie MOÚ a LF MU, Brno
Vyšlo v časopise: Čas. Lék. čes. 2020; 159: 261-267
Kategória: Přehledový článek
Súhrn
Radioterapie je dynamicky se vyvíjející obor léčení zhoubných nádorů. Pokrok radioterapie významně souvisí s novými poznatky v radiobiologii, zaváděním nových systémů v radiodiagnostice a v plánování léčby zářením. Technický vývoj ozařovacích systémů za posledních 10 let nesmírně zvýšil kvalitu léčby zářením. Trvalým cílem moderní léčby zářením je minimalizovat toxicitu radioterapie při zachování terapeutického účinku. S rozvojem radioterapie se však objevuje a k diskusi zůstává problematika tzv. finanční toxicity různých ozařovacích technik a neúměrný nárůst výdajů na léčbu bez ohledu na její nákladovou efektivitu.
Klíčová slova:
radioterapie – radiochirurgie – brachyterapie – moderní techniky
ÚVOD
Léčba zářením, radioterapie (lépe však náplň oboru vystihuje název radiační onkologie), je klinický obor, který v posledních 5–10 letech prošel v naší republice významnou přístrojovou obměnou. Každé komplexní onkologické centrum dnes disponuje moderní ozařovací technikou využívající lineární urychlovače s fotonovým a elektronovým zářením jako základní zdroje ionizujícího záření. Je potěšující, že máme v léčebném repertoáru i možnost léčby protonovým svazkem, moderní systémy pro radiochirurgické výkony a vyspělou techniku pro brachyterapii. V následujícím textu chci upozornit na novinky v moderní radioterapii, které jsou (nebo budou) dostupné v naší republice.
RADIOTERAPIE ŘÍZENÁ OBRAZEM (IGRT)
Tato speciální technika ozařování využívá zobrazovacích metod v ozařovně před ozařováním nebo v jeho průběhu. Pro správné ozáření je totiž důležité, aby pacient na ozařovacím stole ležel pokaždé v naprosto stejné poloze jako při plánování ozařování. Odchylky polohy v průběhu ozáření mohou vznikat např. i malým pohybem, náplní orgánů (močový měchýř, konečník), dýcháním. Velmi zjednodušeně IGRT (image-guided radiotherapy) zajišťuje přesné zaměření svazků na ozařovači. Během ozařování je pravidelným snímkováním kontrolována poloha pacienta, zda nedochází k významným odchylkám.
Používají se rtg snímky pořízené přímo lineárním urychlovačem, jež se ukládají do systému a porovnávají s digitální rekonstrukcí snímků z CT vyšetření při plánování radioterapie. U novějších přístrojů vybavených přídavným rtg zdrojem můžeme pacienta vyšetřit výpočetní tomografií přímo pod ozařovacím přístrojem (cone beam CT). Vždy je hodnocena jak jednotlivá velikost odchylky nastavení, tak i systematická chyba, přičemž na základě těchto parametrů lze provést korekci srovnávacích značek umístěných na pacientovi, respektive na fixační masce. V případě léčby protonovým svazkem či gama nožem probíhá kontrola obrazem mimo ozařovací přístroj (1, 2).
RADIOTERAPIE S MODULOVANOU INTENZITOU (IMRT)
Radioterapeutická technika IMRT (intensity-modulated radiotherapy) cíleně kopíruje nepravidelný tvar ozařovaného objemu. Tvarováním ozařovaného pole se moduluje i intenzita svazku a dochází tak k dalšímu zlepšení distribuce dávky (např. šetření míchy při ozařování krku nebo konečníku při ozařování prostaty). Zároveň lze dosáhnout i rozdílného rozložení dávky v ozařovaném objemu. Navíc získáme prudký dávkový spád do okolí, lépe chránící okolní zdravé tkáně.
Dozimetrický přínos modulace dávkového rozložení pomocí IMRT se projevuje především u radioterapie nádorů nosu, paranazálních dutin a baze lební, tedy lokalit, které bylo dříve velice obtížné dávkově homogenně pokrýt, aniž by současně nebyly ozářeny okolní rizikové orgány. Další přednost z dozimetrického hlediska představuje možnost omezit ozáření velkých slinných žláz s cílem snížit riziko pozdní xerostomie (suchost v ústech). S výhodou se technika využívá i při ozařování prostaty, kdy je před zářením šetřen konečník, nebo při ozařování gynekologických nádorů nebo konečníku, kdy jsou šetřena střeva a močový měchýř (1, 3).
RADIOTERAPEUTICKÁ TECHNIKA VMAT
Jedná se o formu výše zmíněné IMRT, kdy se k modulaci intenzity svazku záření (přesněji fluence) pomocí lamel kolimátoru (systém lamel v hlavici přístroje upravující tvar ozařovaného pole) přidává ještě modulovaný pohyb ramene (gantry) urychlovače, modulace dávkového příkonu a u nejmodernějších přístrojů také dynamická změna polohy clon (jaw tracking).
Expozice probíhá za současného pohybu ramene, a hovoříme tak o objemově modulované radioterapii kyvem – volumetric-modulated arc therapy (VMAT), dříve nazývané též IMAT (intensity-modulated arc therapy). S pomocí této techniky lze dosáhnout vysoce konformního prozáření cílového objemu (nádoru) a zároveň zajistit potřebný strmý spád dávky do okolí, aby bylo zajištěno maximální šetření zdravých tkání.
Nezanedbatelným přínosem je také rychlost dodání potřebné dávky záření (vysoký dávkový příkon). Zkrácení doby potřebné pro ozáření se projeví nejen komfortem pro pacienty, ale snižuje se také pravděpodobnost pohybu pacienta během expozice, a tím i riziko nepřesného ozáření. Dalšími pozitivními efekty tohoto způsobu radioterapie jsou zkrácení čekací doby a zvýšení využitelnosti přístroje.
Kvalitativně ještě vyšší formou VMAT je HyperArc radioterapie, která navíc využívá synchronizovaný pohyb ozařovacího stolu s pohybem ramene lineárního urychlovače. Tato technika nonkoplanárního plánování a ozařování tak dosahuje ještě efektivnější radioprotekce v okolí cílového objemu a je vhodná pro stereotaktickou radioterapii a radiochirurgii (1, 2).
PROTONOVÁ TERAPIE
Spektrum léčebných modalit stále výrazněji obohacuje protonová terapie. Poprvé byla klinicky použita v roce 1954 (Berkeley) a v současnosti je na světě v klinickém provozu 70 center, ve výstavbě asi 30 dalších. Protonová terapie svými fyzikálními a radiobiologickými charakteristikami slibuje významné zlepšení léčby ionizujícím zářením, její lokální kontrolu a snížení postradiačních komplikací. Na druhé straně protonová terapie v sobě skrývá rizika, která nelze úplně vyloučit – můžeme je pouze zmírnit hlubokou znalostí fyzikálních a radiobiologických zákonitostí absorpce nabitých částic v biologickém objektu.
Mezi uváděné výhody protonové terapie ve srovnání s terapií fotonovou patří:
- specifický průběh křivky hloubkové dávky;
- možnost přizpůsobení šířky Braggova peaku (SOBR – spread-out Bragg peak) rozměrům cílového objemu nádoru;
- snížení integrální dávky, hypersenzitivity a bystander efektu a následné omezení výskytu sekundárních malignit;
- vyšší radiobiologická účinnost (RBE) protonového svazku ve srovnání s fotonovou terapií.
Mezi rizika protonové radioterapie patří:
- vysoká citlivost na tkáňové nehomogenity (náplň střev, tělních dutin, skelet, cysty apod.);
- nepřesnosti plynoucí z pohybu cílového objemu a kritických orgánů;
- nepřesnosti plynoucí z rozdílu fyzikální a biologické dávky.
Ve vztahu k posledně uvedenému bodu experimenty ukázaly, že RBE urychlených protonů není konstantní, ale mění se v rozsahu od 1,07 do 1,3, s maximem v distální oblasti Braggova peaku; RBE je komplexní funkce parametrů alfa/beta, energie a LET (lineárního přenosu energie) protonů. Tyto vlivy dosud nejsou zahrnuty do výpočtu ozařovacího plánu.
Vývoj protonové terapie dlouhodobě brzdí vysoké finanční náklady. Výdaje na protonové zařízení se dvěma ozařovnami jsou cca 2,5násobné oproti zařízení se dvěma lineárními urychlovači. Předpokládá se však, že cena bude – spolu s technickým rozvojem – postupně klesat. Současný trend v protonové terapii představuje výstavba malých „singl“ ozařoven jako součásti velkých center fotonové radioterapie.
Protonová terapie bude výhledově dominovat v léčbě vybraných dětských nádorů, nádorů mozku, páteře a jiných nádorových lokalit, které zpravidla nelze zcela vyléčit pomocí fotonové terapie. Nicméně se neočekává, že by se protonová terapie v budoucnu stala převažující a základní modalitou v radiační onkologii vzhledem ke svým limitujícím faktorům uvedených výše v textu. Také kontrola polohy pacienta na ozařovacím lůžku (IGRT) u protonové terapie není na takové úrovni jako u fotonové terapie. Metody radiochirurgie protonovým svazkem se zatím zkouší v klinických studiích (1, 4, 5, 6).
GAMA NŮŽ
Tento ozařovací systém je historicky nejstarší metodou radiochirurgického ozařování malých ložisek intrakraniálně. Tedy ozáření vysokou dávkou, která má letální účinek, ovšem i na zdravé tkáně v okolí nádoru, proto musí být léčba provedena velice přesně. Pracoviště gama nože v Praze patří mezi mezinárodně vysoce uznávaná centra.
V současné době existují na trhu 3 typy Leksellova gama nože (model 4C, model Perfexion a model Icon). Model 4C patří ke starším systémům, jež mají jiné uspořádání zdrojů než modernější Perfexion a Icon. Leksellův gama nůž Perfexion, komerčně dostupný od roku 2006, reprezentuje zcela nový systém s opět vylepšeným uspořádáním radioaktivních zdrojů. Disponuje celkem 192 zdroji 60Co rozmístěnými v cylindrickém kolimátoru. Toto uspořádání se zcela odlišuje od předchozích typů U, B, C a 4C, kde byla geometrie hemisférická. Primární a sekundární kolimátory předchozích systémů nyní nahradil jediný masivní kolimátor z wolframu.
Kolimační prstenec z wolframu o tloušťce 120 mm je rozdělen do celkem 8 identických částí, tzv. sektorů, z nichž každý obsahuje celkem 72 kolimátorů (24 pro 4mm, 24 pro 8mm a 24 pro 16mm svazek záření). Velikost svazku pro každý sektor je měněna automaticky, a to posunem celkem 24 zdrojů 60Co nad kolimačním prstencem.
Nejnovější systém potom představuje Leksellův gama nůž Icon (obr. 1). Radiační jednotka, robotický stůl a veškeré další parametry se shodují se systémem Perfexion popsaným výše, systém Icon v sobě ovšem integruje i zobrazovací jednotku cone beam CT (CBCT) a infračervenou kameru pro pozorování a kontrolu polohy pacienta během léčby. Kromě upevnění pacienta prostřednictvím stereotaktického rámu můžeme fixaci provést rovněž pomocí snímatelné masky, jež při frakcionaci představuje pro pacienty větší komfort než nasazování stereotaktického rámu. Kontrola polohy pacienta před ozářením pomocí CBCT a následná korekce polohy přináší rovněž možnost léčby extrakraniálních lézí, ovšem stále s omezením přibližně do úrovně krční páteře. Systém Icon byl uveden na trh teprve v roce 2015 a v současné době je umístěn i v Nemocnici Na Homolce v Praze (1).
Obr. 1. Leksellův gama nůž Icon 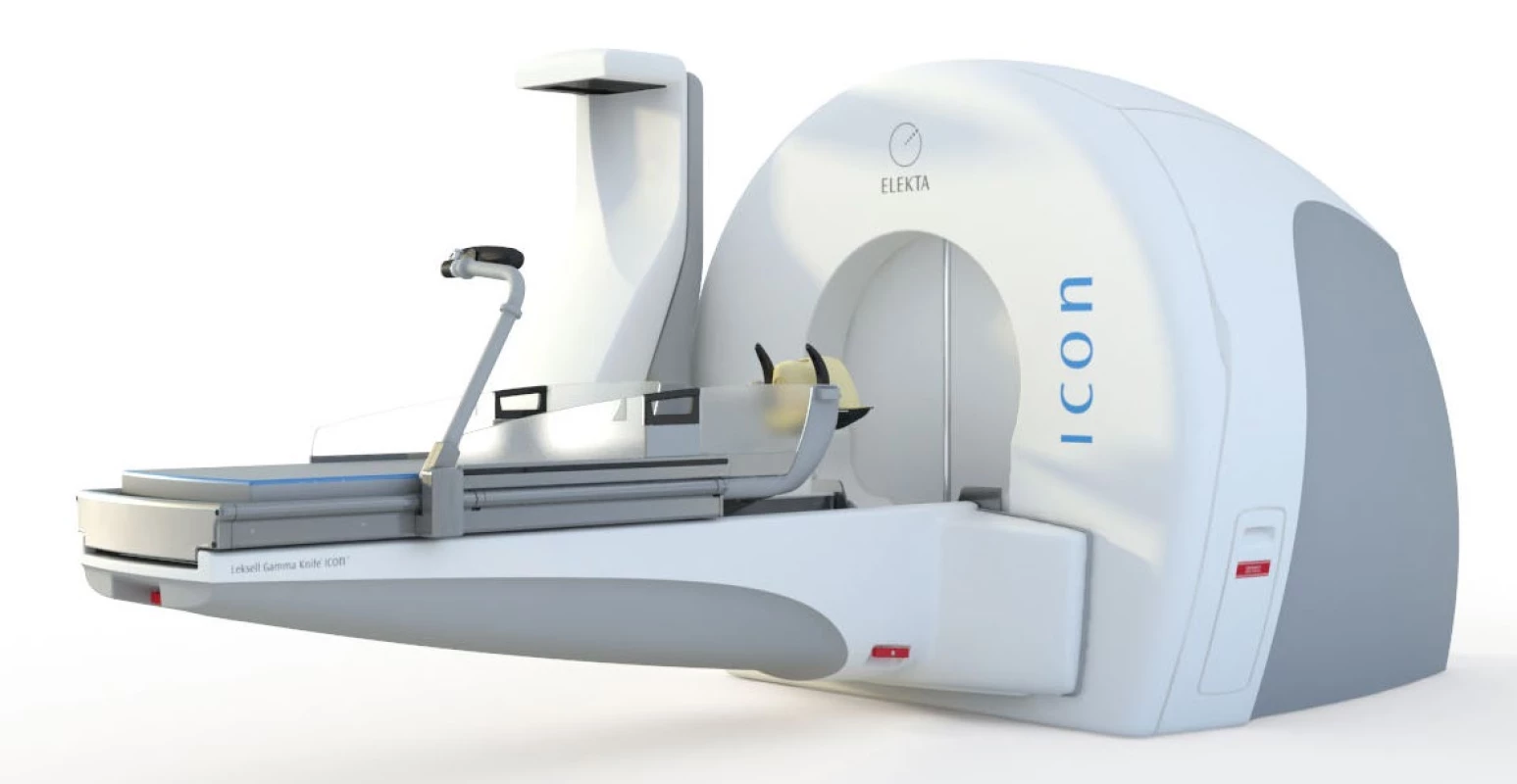
TOMOTERAPIE
Tomoterapie je forma rotační fotonové radioterapie charakteristická vysoce konformními distribucemi dávky s integrovanou třírozměrnou IGRT prostřednictvím (v současné době) megavoltážního CT. Princip techniky spočívá v umístění malého megavoltážního lineárního urychlovače na rotující gantry podobným způsobem jako u kilovotážního rentgenového zdroje klasického diagnostického CT. V této konfiguraci poskytovala tomoterapie jako jedna z prvních technologií moderní třírozměrným obrazem řízenou radioterapii (IGRT). Její výhody se projevují především při velkoobjemové radioterapii (obr. 2).
Obr. 2. Izodózní rozložení při tomoterapii u velkoobjemového ozařování 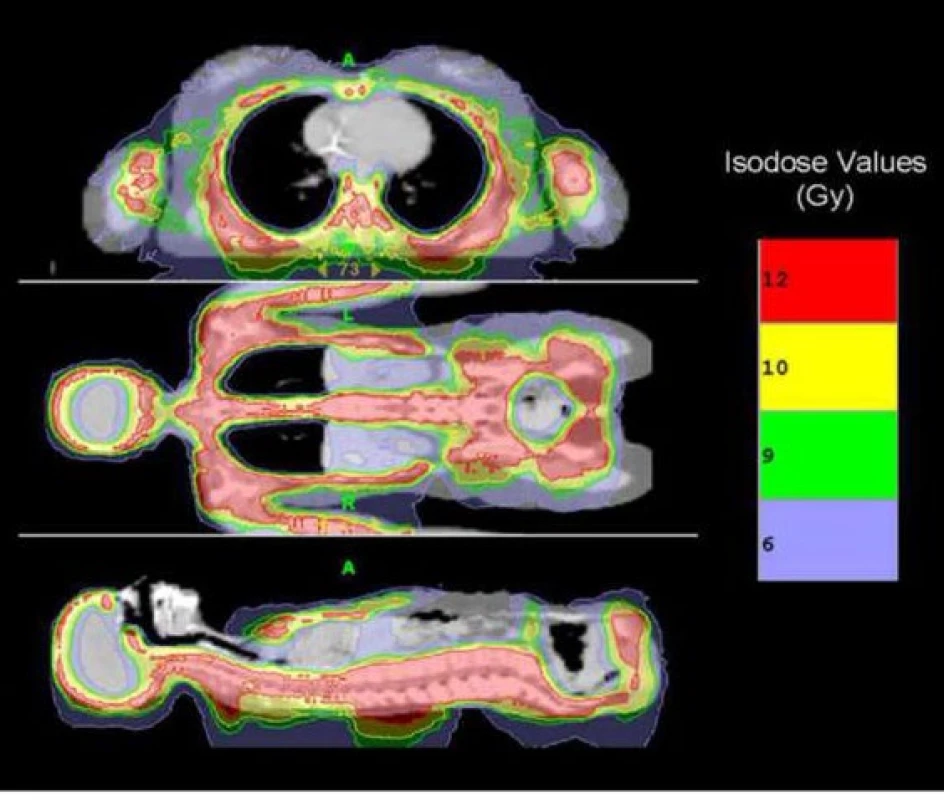
Radioterapie byla obecně vyvinuta s důrazem na homogenitu dávky v tumoru. Tomoterapie spočívá v sekvenčním doručení dávky do tumoru, tj. dílčí části tumoru jsou ozařovány postupně tak, jak vysoce modulované svazky postupují a doručují dávku napříč cílovým objemem.
S tím souvisejí 2 důležité aspekty:
- Navazování polí: Při navazování přidružených polí obecně existuje nebezpečí podzáření či přezáření v důsledku omezené přesnosti výpočtu a fyzikální realizace přidružených polí.
- Pohyb tumoru: V důsledku pohybu tumoru (např. při dýchání) vzniká geometrická nejistota dílčího pole vůči tumoru, respektive změna geometrie pole–tumor při přechodu od jednoho pole k druhému. Tento fenomén je znám pod názvem interplay effect.
První problém je u tomoterapie redukován použitím helikálního pohybu, stejně jako u helikálního CT. Klinický efekt druhého problému se zmenšuje se zvyšujícím se počtem frakcí, a to průměrováním částečně přezářených a podzářených oblastí tumoru. Vzhledem k nesynchronizovanému začátku ozařování a fázi, frekvenci a amplitudě dýchání je velmi nepravděpodobné, že při každé frakci bude stejná část tumoru vystavena stejnému přezáření či podzáření (1).
CYBERKNIFE
CyberKnife je robotický systém nesoucí lineární urychlovač speciálně uzpůsobený pro účely stereotaktické radioterapie a radiochirurgie na mobilním rameni. Urychlovačem vyrobené fotony o energii 6 MeV vytvářejí prostřednictvím superpozice několika stovek tenkých svazků z různých směrů strmý spád dávky. Díky preciznímu a kontinuálnímu snímání pozice pacienta, resp. vlastního ložiska, lze během ozařování minimalizovat zasažený objem, a tím výrazně snížit vedlejší účinky. Zároveň přístroj umožňuje dodat do cílového objemu několikanásobně vyšší dávku v jedné frakci než konvenční radioterapie. Léčba je neinvazivní a ozařovat lze i několik ložisek najednou. Aplikuje se zpravidla v 1–5 frakcích. Relativní nevýhodou systému je délka ozáření, zpravidla 20–30 minut.
Základní prvek tohoto přístroje představuje robotické rameno, na kterém je umístěn lineární urychlovač. Obdobné rameno podpírá ozařovací lůžko, které nastavuje a následně upravuje polohu pacienta. Hovoří se o tzv. 6D polohování, jelikož robotické rameno umožňuje jak translační pohyb v osách x, y, z, tak i všechny tři rotace.
CyberKnife má na výběr přes 3 tisíce poloh sférické plochy, tzv. uzlů, ze kterých dochází k vlastnímu ozařování. Z každého uzlu může robot „zamířit“ do požadované oblasti svazek záření, jehož velikost lze regulovat změnou apertury kolimátoru Iris (fixní kolimátory jsou dnes již využívány výjimečně, nejmodernější verze sytému navíc využívají vícelamelový kolimátor). Superpozicí několika desítek až stovek ozařovacích svazků se vytváří strmý spád dávky. Ozařovací metoda je tedy neizocentrická, jelikož každý svazek může být zacílen do zcela jiného místa.
Ověření polohy cílového objemu zajišťují dva rentgenové zdroje instalované u stropu ozařovny z každé strany léčebného lůžka. Detektory jsou situovány pod lůžko na podlahu tak, aby svazky záření z rentgenových zdrojů procházely vždy skrze cílový objem a mohly být registrovány na protilehlém detektoru – tím lze určit okamžitou pozici ložiska. Když se pozice nádoru změní, ozařování se přeruší a robotické rameno upraví svou polohu tak, aby svazek záření mířil opět do cílového objemu, jak bylo naplánováno. Dle anatomicko-topografických poměrů v okolí cílového objemu, respektive jejich stability v čase je nutné vhodně zvolit systém pro precizní řízení obrazem (1).
FLASH RADIOTERAPIE
Mnoho výzkumníků spolupracuje na vývoji inovací v radioterapii a zlepšení léčebných výsledků u zhoubných nádorů. účinnost ozařování může nepochybně vylepšit také flash radioterapie. Princip metody spočívá v ultrarychlém dodání dávky záření (fotonového, elektronového, protonového) do cílového objemu (1000–10 000× rychleji než standardní urychlovač). V současné době probíhají první klinické studie, ale již experimenty ukázaly přednosti této techniky, především s ohledem na radioprotekci zdravých tkání (významné snížení rizika vzniku pozdních ireverzibilních poradiačních fibróz) při zachování protinádorové účinnosti (1).
INTRAKRANIÁLNÍ STEREOTAKTICKÁ RADIOTERAPIE A RADIOCHIRURGIE
Intrakraniální stereotaktická radioterapie a radiochirurgie je speciální ozařovací technika, kterou se cíleně ozařují malé objemy intrakraniálních nádorových ložisek. Při vhodné velikosti a uložení nádoru v mozku se s výhodou využívá ozařování vysokými dávkami záření, v krajním případě potom ozáření jednou jedinou, velice vysokou dávkou fotonového záření. V tomto případě pak léčba probíhá – na rozdíl od klasické několikatýdenní radioterapie – v průběhu jednoho dne a napodobuje tak chirurgický výkon (radiochirurgie).
Při stereotaktické radioterapii a radiochirurgii nabývá extrémní důležitosti přesnost ozáření, protože musíme zajistit, že vysoká dávka záření spojená s těmito ozařovacími technikami zasáhne nádor, a nikoliv okolní zdravou tkáň. Absorbovaná dávka způsobí nekrózu zasaženého ložiska, ne však ihned jeho vymizení.
Dříve používaný systém invazivní fixace do stereotaktického rámu (napevno připevněného speciálními šrouby do hlavy) dnes nahrazuje speciální maska a otisková fixace horní čelisti se srovnatelnou přesností. Použití masky je navíc bezpečnější a pacienty více akceptované. Tato moderní fixace pacienta dosahuje ekvivalentní přesnosti invazivní fixace (obr. 3 a 4). Celý proces přesného nastavení polohy pacienta se historicky nazývá stereotaktickým.
Dříve se rozlišovala stereotaktická radioterapie (SRT – stereotactic radiotherapy), kde je celková dávka rozdělena do několika frakcí, a radiochirurgie (SRS – stereotactic radiosurgery), při níž probíhá expozice jednorázově. V současnosti se tento terminologický rozdíl stírá (1, 2).
Obr. 3. Fixace pacienta stereotaktickou maskou pro radiochirurgii 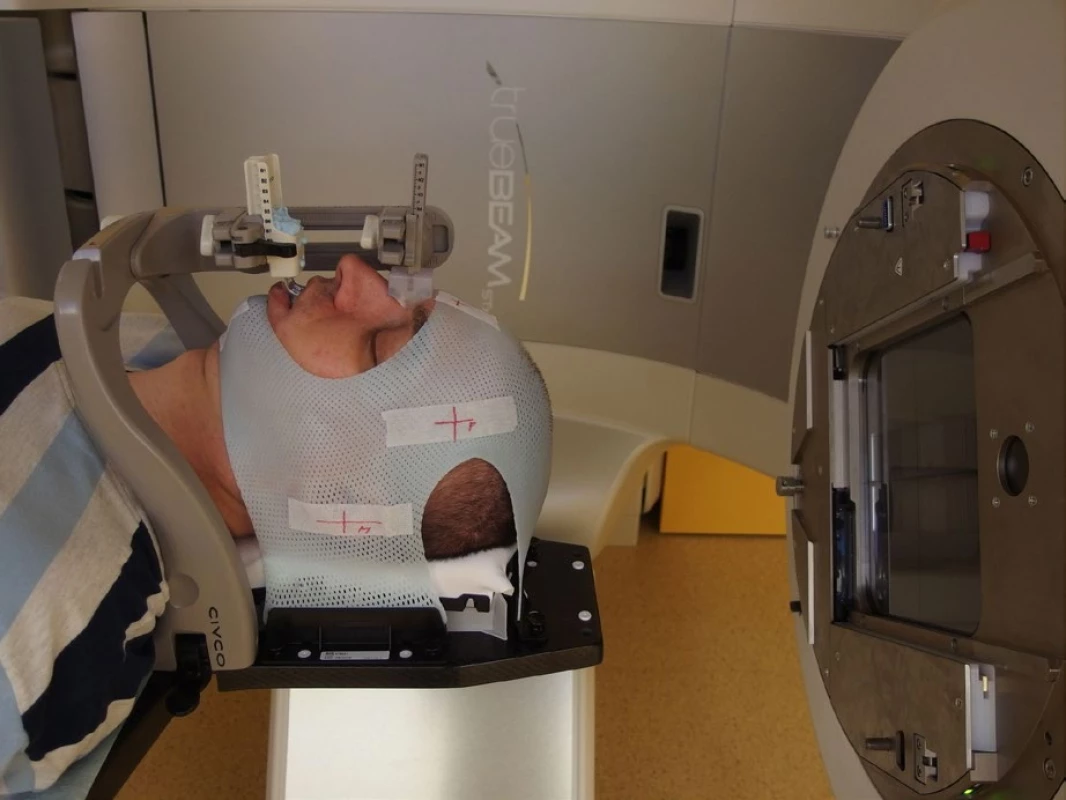
Obr. 4. Izodózní plán nonkoplanární techniky radiochirurgie s využitím lineárního urychlovače a fixace stereotaktickou maskou 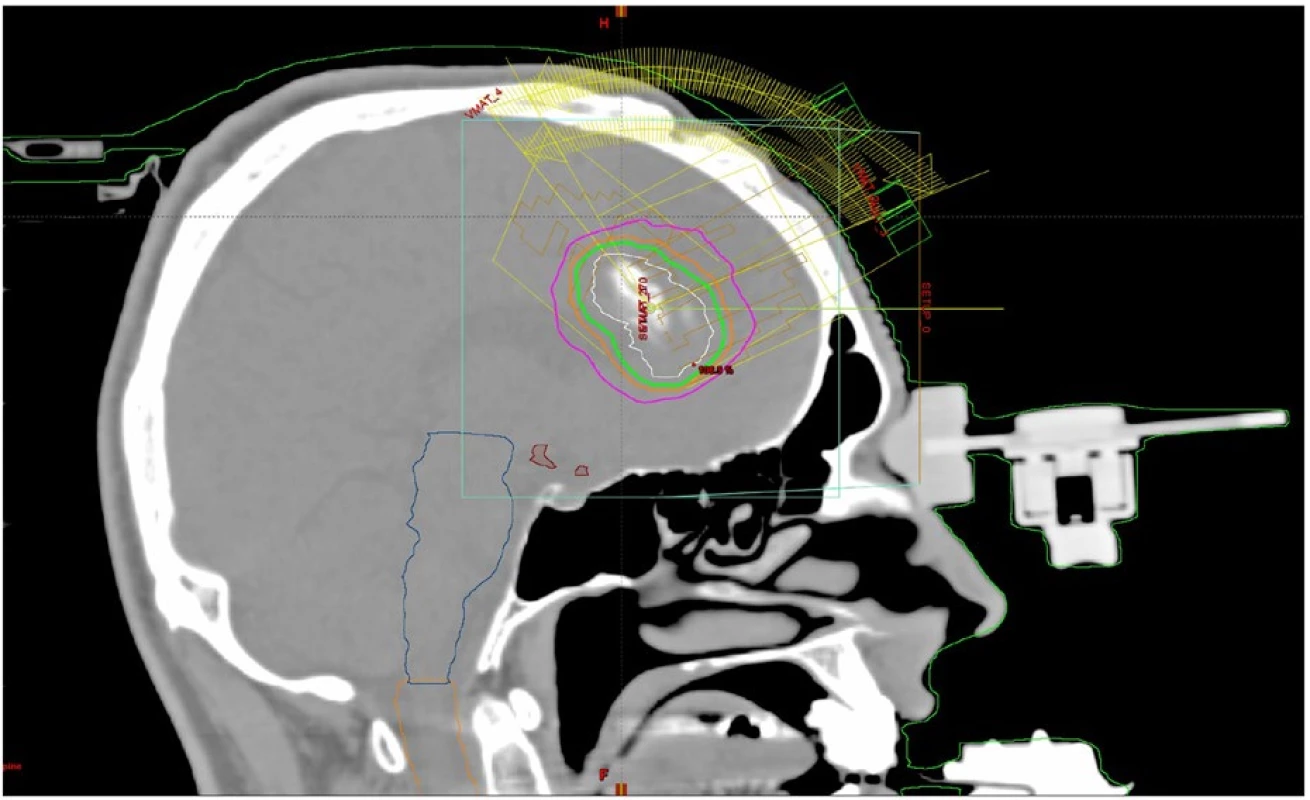
EXTRAKRANIÁLNÍ STEREOTAKTICKÁ RADIOTERAPIE (RADIOCHIRURGIE)
Extrakraniální stereotaktická radioterapie/radiochirurgie využívá k léčbě nádorových ložisek velmi přesné aplikace vysokých dávek záření v malém počtu frakcí (1–5). V praxi se pro tuto metodu léčby vžilo označení pomocí zkratek SBRT či SABR (odvozených z anglických názvů stereotactic body radiotherapy/stereotactic ablative radiotherapy) a její rozvoj umožnila lepšící se vybavenost radioterapeutických pracovišť (moderní fixace pacientů, svazky záření „šité na míru“ stereotaxi, možnosti prostorové navigace svazků na cíl, přesná a rychlá aplikace dávky atd.).
Při odpovídajícím přístrojovém vybavení lze tuto metodu v dnešní době využít při léčbě nádorových ložisek v plících, játrech, dutině břišní, pánvi či skeletu. Dlouhodobý lokální efekt řadí tento způsob léčby mezi výkony radikální i přesto, že v řadě případů se jedná v širším slova smyslu o paliaci (léčba metastatických ložisek). V řadě indikací má však SBRT/SABR jednoznačně kurativní potenciál (primární plicní tumory atd.).
Technika SBRT/SABR se standardně provádí lineárním urychlovačem (X-nůž) nebo systémy z něj odvozenými (robotický urychlovač CyberKnife, tomoterapie a další). Nezbytnou součástí uvedených přístrojů je možnost obrazové navigace (IGRT – radioterapie řízená obrazem). Aplikovaná dávka se pohybuje až v desítkách Gy, např. 3 × 18–20 Gy, 5 × 11–12 Gy nebo jednorázově 1 × 10–30 Gy. Takto vysoké dávky záření koncentrované do malého cílového objemu překonávají buněčnou radiorezistenci, přímo nekrotizují exponované buňky, a dosahují tak maximálního letálního účinku. Nekrotizovaná tkáň se následně během několika měsíců fibroticky mění.
Vysoká přesnost doručení dávky umožňuje ozáření cílových objemů nacházejících se v těsné blízkosti radiosenzitivních orgánů (např. míchy, ledvin, tenkého střeva apod.). Další indikací SBRT/SABR jsou nádory v již dříve ozářeném terénu nebo primárně radiorezistentní. Přesnosti léčby je dosaženo zvýšenou úrovní fixace pacienta (maska, rám, vakuová dlaha, stlačení žaludeční krajiny atd.) a kontrolou jeho polohy (využití obrazové navigace, aplikace a sledování zlatých zrn, CT vyšetření urychlovačem přímo na ozařovacím stole – cone beam CT, sledování dýchacích pohybů – 4D CT plánování atd.). Dohromady tyto zlepšovací technologie umožňují plánování velmi malých bezpečnostních lemů, což při použití vysoce konformních technik radioterapie s velkým dávkovým spádem zaručuje minimální poškození přilehlých zdravých tkání.
Extrakraniální stereotaktická radioterapie představuje velmi efektivní a výborně tolerovanou metodu lokální léčby nádorových onemocnění s minimem vedlejších účinků (1, 7, 8).
SIMULTÁNNÍ INTEGROVANÝ BOOST (SIB)
Pro princip navýšení dávky v určitém menším objemu za současného ozařování dalších struktur (většího objemu) nižšími dávkami se používá pojem simultánní integrovaný boost. Technikou SIB se zvyšuje dávka v podobjemu s nejvyšším rizikem recidivy (makroskopický tumor, lůžko tumoru), např. mozkovna je celá ozařována 3 Gy, ale v místě ložiska (metastáza, tumor) je dávka navýšena na 4 Gy.
V blízkosti kritických struktur může plánovací systém naopak naplánovat snížení dávky na úroveň tolerance daného orgánu k záření, což moderní ozařovací přístroje dokáží aplikovat. Je však nutná pečlivá, nejlépe denní kontrola nastavení pomocí IGRT systémů (1, 2).
ŘÍZENÉ DÝCHÁNÍ PŘI OZAŘOVÁNÍ PRSU
Součástí léčby po operaci prsu pro zhoubný nádor je i ozařování. Vzhledem k cílové lokalitě představuje důležitou součást tvorby ozařovacího plánu kontrola (ne)ozáření srdce, přičemž i samy pacientky chtějí znát vliv záření na srdce. Radioterapie se připravuje pomocí CT vyšetření, díky kterému je umístění srdce dobře viditelné. Záření lze následně zacílit tak, aby procházelo jen prsem a srdce co nejvíce míjelo (obr. 5a). V případě použití moderních urychlovačů tak ženy obdrží v oblasti srdce tak malou dávku záření, že pro ně v tomto směru nepředstavuje žádné riziko poškození.
U menší části žen se však srdce nalézá natolik blízko prsu, že jím část záření prochází (obr. 5b). V takovém případě lze použít ozařování v nádechu (obr. 5c), během kterého se srdce dostane do bezpečné vzdálenosti. Aby ozáření probíhalo pouze v nádechu, urychlovač se opakovaně vypíná a spouští synchronně s dechem. Nádech (polohu hrudníku) kontroluje speciální snímací zařízení položené na hrudníku. Tímto způsobem radioterapie dosahují lineární urychlovače obdobné radioprotekce srdečního svalu jako protonové ozařování. Složitější systémy kontrolují ozařování v nádechu měřením přímo vdechovaného objemu vzduchu (1, 2).
Obr. 5. Řízené dýchání při ozařování prsu:
a) Srdce je vzdálené od prsu, nehrozí žádné riziko, standardní 3D technika radioterapie fotony lineárního urychlovače.
b) Srdce leží v blízkosti prsu a část záření skrz něj prochází, proto lékař rozhodne o ozařování v nádechu.
c) Ozařování v nádechu („řízené dýchání“) – na ozařovacím plánu je patrné výrazné zlepšení ve smyslu ochrany srdce před zářením.
Barevné linie v obrázcích: růžová barva – srdce; modrá linie – objem ozařovaného prsu; barevná plocha – ozářená oblast.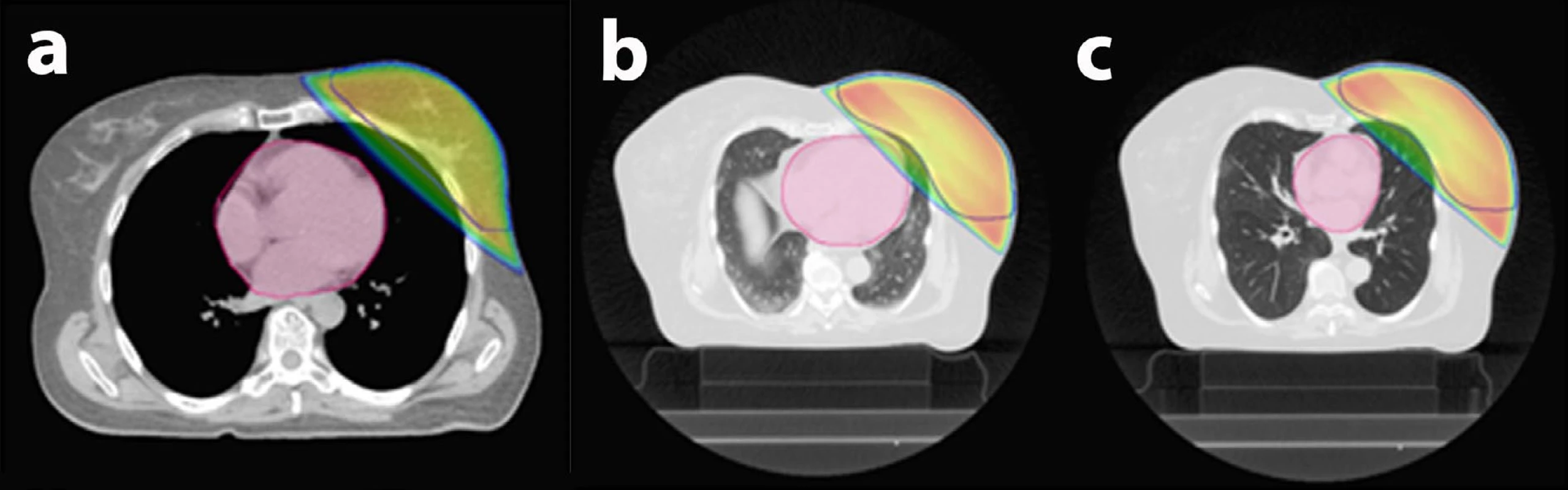
SYSTÉM CATALYST (SIGR)
Systém Catalyst (SIGR – surface image-guided radiation therapy) umožňuje sledovat povrch těla pacienta před zahájením ozařování i v jeho průběhu. Jelikož pracuje ve viditelné části elektromagnetického spektra a nevyužívá ionizujícího záření, neznamená jeho použití pro pacienta další radiační zátěž. Catalyst tak nabízí snadnější a přesnější polohování pacientů, zvýšení jejich bezpečnosti během ozařování a zároveň redukuje přídavné dávky ze zobrazovacích systémů.
Jelikož Catalyst monitoruje povrch těla pacienta, přináší jeho použití výhody zejména při ozařování prsu a končetin. Obr. 6 ukazuje polohovaní pacientky před ozářením levého prsu. Systém kontinuálně snímá obraz pacienta, průběžně jej srovnává s obrazem referenčním (typicky kontura těla z plánovacího CT) a zpětně na pacienta promítá barevný obraz zvýrazňující nevyhovující oblasti – červeně pozitivní odchylky a žlutě odchylky negativní. Radiologický asistent tak přímo vidí změny v poloze těla od žádané ozařovací pozice, což polohování pacienta významně usnadňuje.
Kontrola polohy pacienta probíhá nejen před zahájením ozařování, ale i v jeho průběhu. Catalyst tak neustále kontroluje stálost polohy a v případě její náhlé změny (např. kvůli zakašlání) vedoucí k překročení zadaných tolerancí ozařování pozastaví (1).
Obr. 6. Systém Catalyst – polohování před ozařováním levého prsu 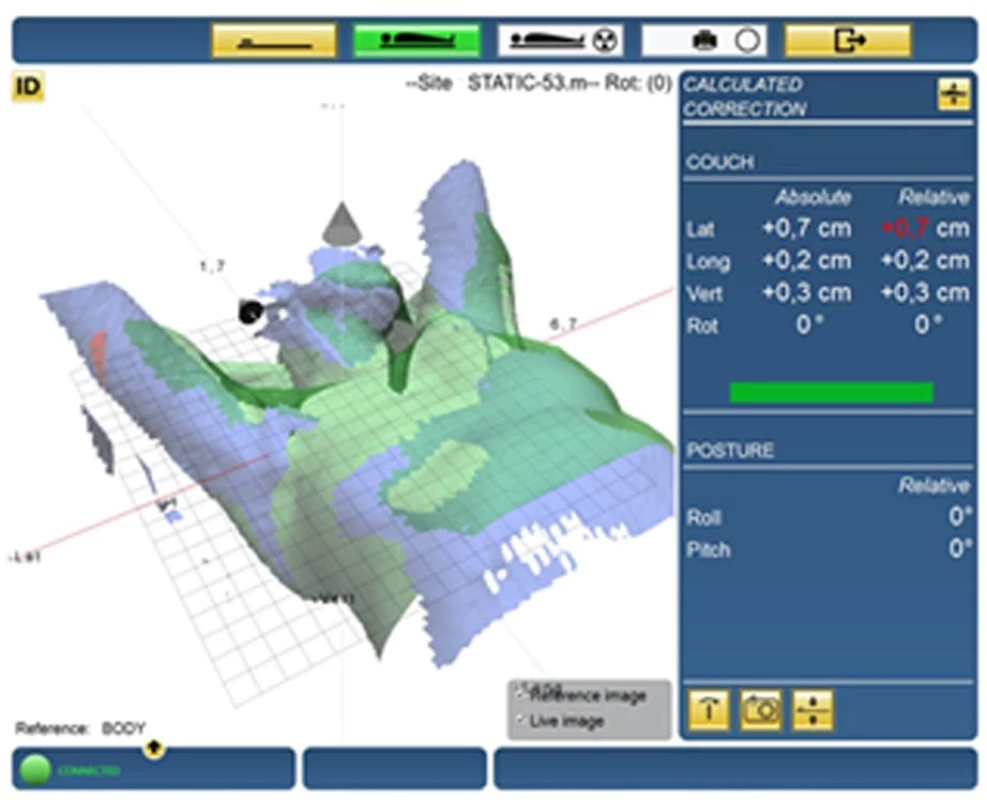
AKCELEROVANÉ OZÁŘENÍ NÁDORU PRSU BRACHYTERAPIÍ
Léčba zhoubného nádoru prsu je kombinovaná. Po operačním výkonu, při kterém je odstraněna část prsu s nádorem, většinou následuje (mimo jiné) pooperační ozáření s cílem snížit riziko recidivy. Pooperační ozáření v nižších stadiích choroby může být provedeno formou ozáření pouze oblasti původního uložení nádoru – tzv. lůžka nádoru, kde je riziko největší.
Samostatná intersticiální brachyterapie představuje jednu z metod ozáření v místě lůžka nádoru prsu. Brachyterapií rozumíme tzv. vnitřní ozařování, kdy se do daného objemu tkáně či orgánu zavádí radioaktivní zářič. Standardně jde o iridiový zdroj s průměrem cca 1 mm a délkou 5 mm. Výhoda této metody spočívá v akceleraci léčby zkracující dobu jejího trvání přibližně na 4–5 dnů oproti 5–7 týdnům při standardní zevní radioterapií lineárním urychlovačem.
Samostatnou intersticiální brachyterapii zahajuje zavedení plastikových trubiček (vodičů radioaktivního zdroje) do místa původního uložení (lůžka) nádoru, jež probíhá v celkové anestézii. Plastikové trubičky jsou ohebné a zůstávají po celou dobu ozařování v prsu (obr. 7a, b), takže v dalším průběhu výkonu již není anestézie nutná. Samotné ozařování potom probíhá 2× denně celkem 4–5 dnů. Při každém ozařování se vodiče zdrojů záření připojí k přístroji, který automaticky zavede tyto zdroje do požadovaného objemu prsu. Zdroje záření tudíž cíleně exponují pouze lůžko nádoru (s bezpečnostním lemem), čímž se snižuje ozáření okolních zdravých tkání (kůže, podkoží, plíce, srdce aj.). Ozařování trvá asi 5 minut a většinou se provádí v 8 frakcích, 2× denně. Bezprostředně po poslední expozici jsou katétry z prsu odstraněny prostým vytažením; tento výkon je nebolestivý. Léčba samostatnou intersticiální brachyterapií vyžaduje hospitalizaci v době trvání přibližně 10 dnů. Se stejným léčebným efektem a nižšími pozdními následky přitom nahradí léčbu zevní radioterapii.
Nově se do praxe zavádějí systémy, které lůžko nádoru prsu ozařují již na operačním sále přenosnými urychlovači (Mobetron, Intrabeam aj.). Tímto způsobem se navyšuje dávka skutečně na místo, kde byl nádor umístěn – toto ozáření je potom zpravidla doplněno zevní radioterapií celého prsu (9).
Obr. 7. Brachyterapie:
a) Zavedené vodiče pro iridiový zdroj u akcelerované parciální brachyterapie karcinomu prsu.
b) Izodózní plán akcelerované parciální brachyterapie po operačním odstranění nádoru prsu.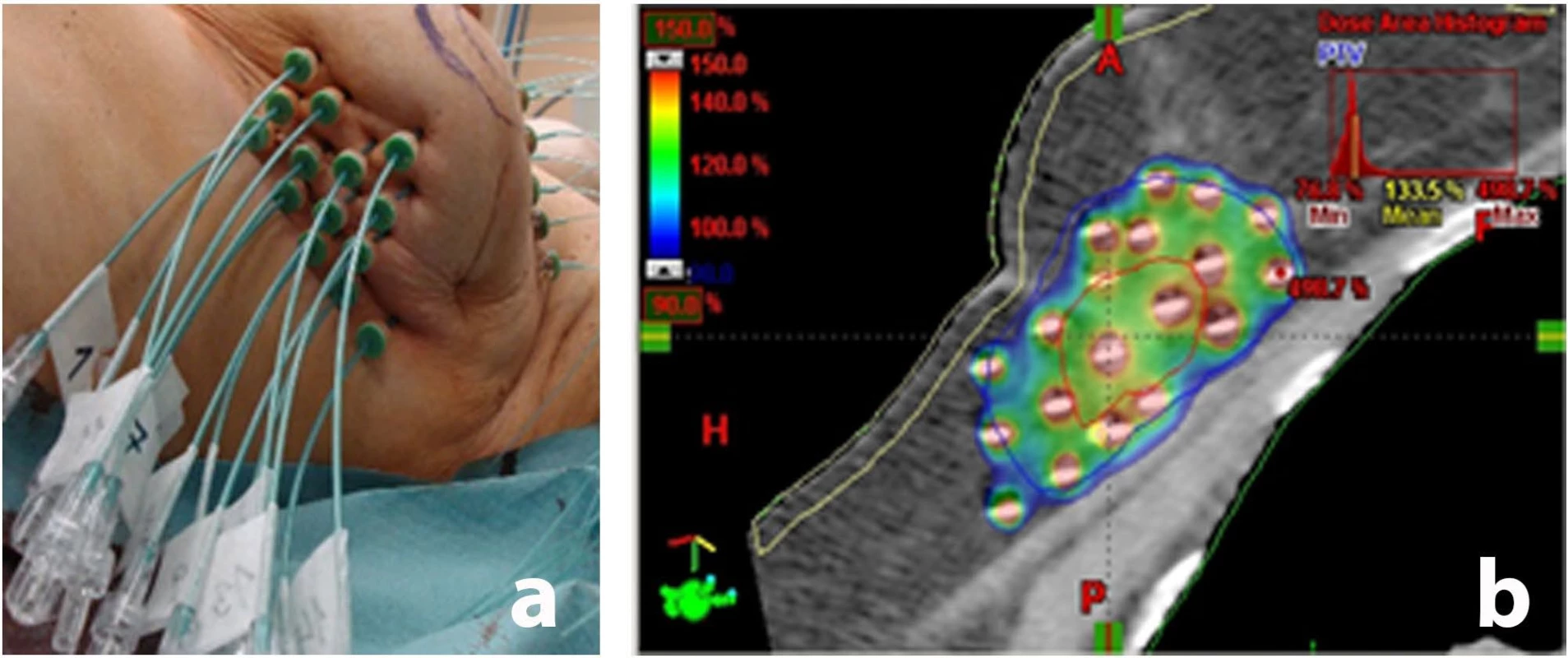
DALŠÍ MOŽNOSTI RADIOTERAPIE
Další zvyšování konformity ozáření počítá mj. s širším využitím konceptu adaptivní radioterapie, tzn. zohledněním změny velikosti a tvaru cílových objemů a rizikových struktur v průběhu frakcionované radioterapie, projevujícím se přizpůsobením ozařovacího plánu zjištěným změnám.
V současnosti již standardně disponujeme a v praxi využíváme značné množství tímto směrem orientovaných technologií, jejichž komplexní výčet jde ovšem nad rámec tohoto sdělení. Níže uvedený přehled proto zahrnuje jen ty nejvýznamnější:
- Zpřesnění ozáření pohyblivých cílových objemů s využitím 4D CT (tj. CT korelovaného s dýchacími pohyby): S pomocí 4D CT jsou cílové objemy určeny a ozářeny přesně i v případě změny jejich polohy při dýchání. Též lze ozařovat jen v určité fázi dechového cyklu s využitím automatické monitorace dechových pohybů.
- Hadronová terapie: K přesnějšímu a případně i efektivnějšímu ozáření nádorů může výrazně přispět rozvoj radioterapeutických technik využívajících nové druhy ionizujícího záření korpuskulární povahy (podle RBE lze dělit na lehčí částice, tj. protony, neutrony a α-částice, a těžké částice, tj. uhlíkové, neonové, křemíkové a argonové ionty). Tyto typy záření vykazují fyzikálně výhodnější průběh depozice energie ve tkáni, konformnější dávkovou distribuci (Braggův peak), a tudíž i efektivnější šetření okolních zdravých tkání. Korpuskulární záření potom (kromě protonů) díky vysokému LET (lineární přenos energie, u neutronů definován nepřímo) charakterizuje i výrazně vyšší relativní biologická efektivita (RBE) ve srovnání se zářeními fotonového charakteru (hodnota RBE udává, kolikrát efektivita incidentního záření s ohledem na určitý biologický dopad, např. zabíjení buněk, převyšuje efektivitu stejné dávky konvenčního záření X nebo gama; jde tedy o poměr dávek záření referenčního a incidentního, jež způsobují stejné biologické důsledky). Účinek korpuskulárního záření s vysokým LET navíc mnohem méně než v případě záření fotonového závisí na okysličení nádoru (hypoxie) a případně i přítomnosti různých mutací (p53 atd.) v genomu nádorových buněk.
- Rozvíjející se využití MRI (+ PET) v plánovacích vyšetřeních ve fúzi s CT snímky. Nejmoderněji přichází v úvahu také využití kontroly nastavení pacienta dle MRI vyšetření přímo na ozařovně MRI lineárního urychlovače.
- Permanentní aplikace radioaktivních zrn v brachyterapii: U nádorů prostaty nízkého rizika se tato technika jeví jako vhodná alternativa pro pacienty staršího věku, neboť se pojí s pouze jednorázovým invazivním výkonem (1, 10–13).
ZÁVĚR
Vzhledem k fyzikálním charakteristikám ozařovacích svazků (fotony, protony, elektrony, neutrony ad.) nelze dosáhnout nulových hodnot záření v tkáních přilehlých cílovému objemu. Cílem moderní léčby zářením je minimalizovat toxicitu radioterapie při zachování terapeutického účinku. S rozvojem radioterapie se však objevuje a k diskusi zůstává problematika tzv. finanční toxicity různých ozařovacích technik, tzn. neúměrný nárůst výdajů na léčbu bez ohledu na její nákladovou efektivitu. Jedná se o jakousi analogii s moderními přípravky cílené protinádorové léčby a imunoterapie, kde je pojem finanční toxicita rovněž nově zaváděn a musí být brán v potaz v každodenní diagnosticko-terapeutické rozvaze.
Adresa pro korespondenci:
prof. MUDr. Pavel Šlampa, CSc.
Klinika radiační onkologie
Masarykův onkologický ústav
Žlutý kopec 7, 656 53 Brno
Tel.: 543 131 127, 543 131 116
e-mail: slampa@mou.cz
Zdroje
- Šlampa P a kol. Radiační onkologie. Maxdorf, Praha, 2020.
- Šlampa P. Žlutý kopec. Historie léčby zářením v Brně na Žlutém kopci. Maxdorf, Praha, 2018.
- Šlampa P, Petera J a kol. Radiační onkologie. Galén, Karolinum, Praha, 2007.
- Kahalley LS, Peterson R, Ris MD et al. Superior intellectual outcomes after proton radiotherapy compared with photon radiotherapy for pediatric medulloblastoma. J Clin Oncol 2020; 38 : 454–461.
- Langendijk JA, Boersma JL, Rasch CRN et al. Clinical trial strategies to compare protons with photons. Semin Radiat Oncol 2018; 28 : 79–87.
- Petera J. Kontroverze protonové terapie u nádorů centrální nervové soustavy. Klinická onkologie 2018; 31 : 24–27.
- Burkoň P, Slávik M, Kazda T et al. Ablative dose stereotactic body radiation therapy for oligometastatic disease: a prospective single institution study. Neoplasma 2019; 66 : 315–325.
- Yeung R, Hamm J, Liu M et al. Institutional analysis of stereotactic body radiotherapy (SBRT) for oligometastatic lymph node metastases. Radiat Oncol 2017; 12 : 105.
- Schäfer R, Strnad V, Šlampa P et al.; Groupe Européen de Curiethérapie of European Society for Radiotherapy and Oncology (GEC-ESTRO). Quality of life in patients treated with accelerated partial breast irradiation using multicatheter interstitial brachytherapy versus whole-breast irradiation: 5-year results from the randomized, phase 3, non-inferiority GEC-ESTRO trial. Lancet Oncol 2018; 19 : 834–844.
- Hamming-Vrieze O, van Kranen SR, Heemsbergen WD et al. Analysis of GTV reduction during radiotherapy for oropharyngeal cancer: Implications for adaptive radiotherapy. Radiother Oncol 2017; 122 : 224–228.
- Havránková R (ed.). Klinická radiobiologie. Grada, Praha, 2020.
- Jefferson T, Formoso G, Venturelli F et al. Hadrontherapy for cancer. An overview of HTA reports and ongoing studies. Recenti Prog Med 2019; 110 : 566–586.
- Wang C et al. Artificial intelligence in radiotherapy treatment planning: present and future. Technol Cancer Res Treat 2019; 18 : 1533033819873922.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Úvodem
- Editorial
- Klíčové momenty v historii československé radiobiologie
- Biologické účinky ionizujícího záření
- Moderní trendy v radioterapii
- Reparace DNA v buňkách nádorů hlavy a krku a možnosti využití monitorování tohoto procesu pro odhad radiorezistence jednotlivých nádorů a výběr optimální primární léčby
- Trendy ve farmakologické stimulaci regenerace ionizujícím zářením poškozeného savčího organismu
- Biologická dozimetrie a moderní (-omické) metody
- Pokroky ve výzkumu poškození a reparace DNA v buňkách vystavených různým druhům ionizujícího záření v éře superrozlišovací optické mikroskopie
- Principy a výhledy vakcinace proti viru SARS-CoV-2
- Stáří není nemoc: Vývoj hladiny ochranných protilátek proti koronaviru SARS-CoV-2 u seniorů z Domova Břevnice
- Roční období, vitamin D a COVID-19
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Principy a výhledy vakcinace proti viru SARS-CoV-2
- Roční období, vitamin D a COVID-19
- Stáří není nemoc: Vývoj hladiny ochranných protilátek proti koronaviru SARS-CoV-2 u seniorů z Domova Břevnice
- Biologické účinky ionizujícího záření
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



