-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Ochorenia štítnej žľazy matky a hypotrofia plodu
Thyroid Disease in the Pregnancy and Hypotrophy of Newborns
The aim:
The aim of this study was to compare thyroidal status of mothers who delivered newborns with hypotrophy and mothers with healthy newborns.Type of the study:
One-time cross-sectional study.Setting:
3rd internal clinic FN LP, Košice.Methods:
We examined 56 mothers with hypotrophic newborns and 76 mothers with healthy newborns. The protocol included anamnesis, basic physical examination, ultrasonography of the thyroid, assessment of the mother’s plasma fT4, TSH and anti-TPO levels, and comparison of the birth weight and birth length of the newborns. The results were statistically processed by PC programs StatsDirect 2.6.2 and MS Excel 2000.Results:
The thyroid volume was significantly greater in mothers with hypotrophic newborns as in the control group (p<0.001). The birth weight and birth length was significantly lower in hypotrophic newborns (p<0.0001 resp. p<0.0001). Mothers with hypotrophic newborns had significantly higher TSH levels (p<0.0001) and higher anti-TPO levels (p<0.0001) as mothers in the control group. We found no differences in the fT4 levels in these groups.Conclusion:
Thyroid disease of the mother can contribute to the hypotrophy of the newborns.Key words:
thyroid, hypotrophy, IUGR, autoantibodies
Autori: V. Vargová 1; V. Mechírová 2; M. Pytliak 3; M. Tajtáková 2
Pôsobisko autorov: III. interná klinika FN LP a UP JŠ, Košice, prednosta doc. MUDr. P. Mitro, PhD. 1; I. interná klinika FN LP a UP JŠ, Košice 2; Ústav pre bakalárske a magisterské štúdiá, LF UP JŠ, Košice 3
Vyšlo v časopise: Ceska Gynekol 2008; 73(1): 41-46
Súhrn
Cíl:
Cílem autorů bylo tyreologicky vyšetřit a porovnat matky, kterým se narodilo hypotrofické dítě, a matky, kterým se narodil zdravý novorozenec.Typ studie:
Jednorázová průřezová studie.Název a sídlo pracoviště:
III. interní klinika FN LP, Košice.Metodika:
Vyšetřili jsme 56 matek, kterým se narodilo hypotrofické dítě a 76 matek s fyziologickými novorozenci. Vyšetřovací protokol zahrnoval důkladné anamnestické a základní fyzikální vyšetření, ultrazvukové vyšetření štítné žlázy, stanovení fT4, TSH a anti-TPO protilátek a porovnání porodní délky a hmotnosti novorozenců. Výsledky byly zpracovány statisticky pomocí programů StatsDirect 2.6.2 a MS Excel 2000.Výsledky:
Celkový objem štítné žlázy byl signifikantně vyšší v skupině s výskytem hypotrofie novorozenců jako v kontrolní skupině (p<0,001). Porodní hmotnost i porodní délka byly v skupině s hypotrofií signifikantně nižší než v kontrolní skupině (p<0,0001 a p<0,0001). Matky s hypotrofickými novorozenci měly signifikantně vyšší koncentrace TSH (p<0,0001) než matky zdravých novorozenců. Koncentrace fT4 v porovnávaných skupinách nebyly signifikantní rozdíly.Závěr:
Choroby štítné žlázy matky se pravděpodobně spolupodílejí na vzniku hypotrofie novorozenců.Klíčové slova:
štítná žláza, hypotrofie, autoprotilátkyÚVOD
Intrauterinný rast a vývin sa z časového hľadiska delí na tri obdobia – blastómové, embryonálne a fetálne. Najintenzívnejší rast je počas vnútromaternicového obdobia, pričom rast plodu do dĺžky je najintenzívnejší v prvej polovici gravidity a zvyšovanie hmotnosti je pomerne rovnomerné počas celého tehotenstva [23].
Jednou zo závažných komplikácií vo vývoji plodu je hypotrofia plodu.
Hypotrofia plodu sa definuje ako nešpecifický karenčný stav plodu, ktorý sa prejavuje zaostávaním samotného rastu, poruchami výživy i metabolizmu a chronickou hypoxiou plodu. V klinickej praxi sa hypotrofia plodu definuje predovšetkým zaostávaním hmotnosti plodu pod dolnú hranicu normálneho rozptylu v príslušnom gestačnom veku. Na základe uvedeného môže byť hypotrofický novorodenec narodený predčasne, ale aj v normálnom termíne. Okrem názvu hypotrofia plodu sa v literatúre používa aj názov intrauterinná rastová retardácia – IURR, ev. anglický názov intrauterine growth retardation – IUGR. Niektoré literárne pramene pokladajú tieto termíny za synonymum, iné poukazujú na určité rozdiely v týchto názvoch [23].
Je dôležité odlíšiť nedonosené alebo predčasne narodené dieťa od hypotrofického novorodenca. Nedonosené alebo predčasne narodené dieťa je narodené pred 37. týždňom tehotenského veku. Nedonosených novorodencov podľa dĺžky trvania gravidity a hmotnosti považujeme za ľahko, stredne alebo ťažko nedonosených. Ľahko nedonosený novorodenec má hmotnosť od 2000 do 2499 gramov v závislosti od dĺžky zrenia v maternici. Stredne nedonosený novorodenec má hmotnosť nad 1500 g a vývoj trval 32 až 35 týždňov. Ťažko nedonosený novorodenec má hmotnosť pod 1499 gramov a gestačný vek pod 31 týždňov. Hypotrofický novorodenec má hmotnosť nižšiu ako by mala byť pri danom gestačnom veku. Dĺžka hypotrofických novorodencov je bližšia gestačnému veku ako ich hmotnosť, ktorá je pod hodnotou udávanou v rastových tabuľkách. Hypotrofickí novorodenci majú častejšie poruchy prispôsobovania sa nárokom na život mimo maternice a ich zdravotné riziko je podobné ako pri nedonosených novorodencoch [5, 18].
Na rast a vývin plodu negatívne vplývajú mnohé faktory. Novorodenci z prvého tehotenstva bývajú ľahší ako ďalší súrodenci. Veľkosť novorodencov je ovplyvnená aj rasovo, národnostne a geneticky (nízke matky majú približne o 8 % nižšie deti ako matky vyššie a ťažšie). Menší novorodenci sa rodia veľmi mladým a starším matkám, ako aj pri viacpočetných graviditách. Podiel dedičnosti a prostredia na kolísaní pôrodnej hmotnosti sa udáva takto: dedičná konštitúcia matky 20 %, dedičná konštitúcia plodu 18 %, zdravotný stav a výživa matky pred počatím 16 %, zdravotný stav a výživa matky počas gravidity 8 %, počet predchádzajúcich pôrodov 7 %, vek matky 1 % a rôzne intrauterinné vplyvy 30 % [24, 29].
Existuje celá rada príčin a faktorov, ktoré môžu viesť k hypotrofizácii plodu.
Príčiny možno rozdeliť z viacerých hľadísk:
- Príčiny zo strany matky.
- Príčiny zo strany plodu.
- Príčiny zo strany placenty.
- Ostatné príčiny.
Prehľad najčastejších príčin predčasných pôrodov a hypotrofie plodu uvádza tab. 1.
Tab. 1. Najčastejšie príčiny predčasných pôrodov a hypotrofie plodu. 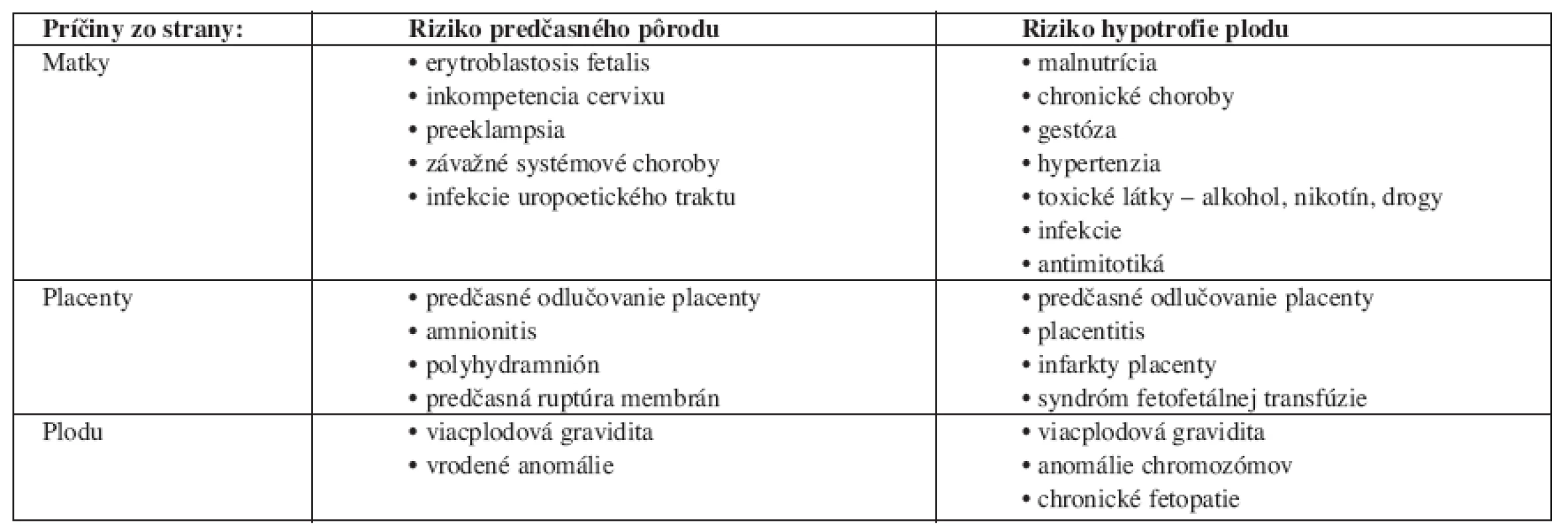
Zdroj: Voľne podľa Čech a kol. [5]
Autoimunitné ochorenia sú choroby imunitného systému, pri ktorých sú imunitné reakcie organizmu zamerané proti vlastným tkanivám a orgánom. Tieto ochorenia môžu postihovať jedno tkanivo alebo orgán (orgánovo špecifické), alebo môže ísť o celkové ochorenie, ktoré postihuje viacero orgánov a tkanív (orgánovo nešpecifické alebo systémové).
Vplyv autoagresívnych protilátok na vznik hypotrofie plodu bol potvrdený vo viacerých štúdiách, aj keď mechanizmus vzniku hypotrofie plodu nie je presne objasnený [12].
Autoimunitné ochorenia štítnej žľazy matky a hypotrofia plodu
Autoimunitné ochorenia štítnej žľazy v tehotenstve sú spojené s vyšším rizikom potratov a hypotrofie plodov [3]. V gravidite sa môžu autoimunitné ochorenia štítnej žľazy prvýkrát manifestovať (najmä na podklade zvýšených nárokov na funkciu štítnej žľazy v tomto období), alebo sa priebeh už existujúceho ochorenia môže zhoršiť alebo zlepšiť. Na vývoj plodu má vplyv nielen prítomnosť autoprotilátok, ktoré sa dostávajú cez fetoplacentárnu bariéru, ale aj hypotyreóza či hypertyreóza matky i samotného plodu. Najčastejšími autoimunitnými tyreopatiami v gravidite sú Hashimotova tyreoiditída a Gravesova-Basedowova choroba a obvykle sú spojené s poruchou funkcie štítnej žľazy, a to buď v zmysle hypo - alebo hypertyreózy [22].
1. Hypotyreóza (vrátane subklinickej formy) sa v gravidite vyskytuje asi v 2,5 % (najčastejšie na podklade Hashimotovej tyreoiditídy) a môže viesť k pôrodným a neonatálnym poruchám. Hypotyreóza v tehotenstve si zvyčajne vyžaduje zvýšenie substitučnej dávky tyreoidálnych hormónov. Postpartálna hypotyreóza matiek bola popísaná asi v 50 % matiek s pozitivitou antityreoidálnych protilátok počas gravidity. Aj Hashimotova tyreoiditída matiek vedie k vyššiemu riziku vzniku hypotyreózy plodu. Austrálski autori popisujú trojnásobne vyššie riziko hypotrofie u plodov matiek s Hashimotovou tyreoiditídou oproti zdravej kontrolnej skupine. Ani v tomto prípade nie je známy presný mechanizmus vzniku intrauterinnej rastovej retardácie [1, 8, 14].
Britskí autori sledovali výskyt autoprotilátok anti-TPO a anti-TG v kohorte homozygótnych a dizygótnych dvojčiat. Homozygótne dvojčatá mali signifikantne vyššiu prevalenciu anti-TG ako dizygótne. Diskonkordancia bola aj v pôrodnej hmotnosti – v homozygótnych pároch malo dvojča s pozitívnymi autoprotilátkami signifikatne nižšiu pôrodnú hmotnosť [21].
Vplyv autoprotilátok proti štítnej žľaze na vývoj plodu bol popísaný aj na zvieracom modele. Plody a placenty myší, ktoré boli imunizované tyreoglobulínom boli signifikantne menšie, ako v kontrolnej skupine. Rovnako bol v tejto skupine nájdený aj menší počet embrií než v kontrolnej skupine [6].
2. Neliečená hypertyreóza pri Gravesovej-Basedowovej chorobe vedie nielen k neonatálnej hypertyreóze, ale aj k vzniku hypotrofie plodu. Dokladuje to mnoho kazuistík, keď matky liečené tyreostatikami tak, aby dosiahli normálne alebo iba mierne zvýšené koncentrácie fT4 porodili fyziologických novorodencov, kým u neliečených alebo zle liečených matiek bolo pozorované vyššie riziko intrauterinnej rastovej retardácie a hypotrofie. Aj ďalšia retrospektívna štúdia potvrdila vplyv hypertyreózy matky na vývoj plodu, a to najmä v 3. trimestri gravidity, kedy dochádza k najrýchlejšiemu nárastu hmotnosti. Výskyt hypotrofie plodu u matiek s hypertyreózou pri Graves-Basedowovej chorobe práve počas 3. trimestra bol 22,9 %, čo bolo signifikantne vyššie ako 9,8 % v skupine eutyreóznych žien [19].
Talianski autori popísali intrauterinný a postnatálny status novorodenca matky s Hashimotovou tyreoiditídou, ktorá nasadala na predchádzajúcu Gravesovu-Basedowovu chorobu a v 3. trimestri sa opäť stala hypotyreóznou. Matka mala vysoké koncentrácie TBII antityreoidálnych protilátok. Za účelom vylúčenia fetálnej tyreoidálnej dysfunkcie boli opakovane kordocentézou získavané vzorky fetálnej krvi (v 21., 27. a 32. týždni gravidity). Transplacentárny prenos TBII bol pozorovaný už v 21. týždni gravidity, aj keď v tomto období ešte nebola prítomná žiadna zmena fetálnej tyreoidálnej funkcie. V ďalších sledovaných týždňoch však už bol výrazný vzostup TBII sprevádzaný klinickými prejavmi hypertyreózy u matky a rozvojom rastovej retardácie plodu [13, 15].
V predloženej práci sme porovnali tyreologický status matiek, ktorým sa narodil hypotrofický novorodenec oproti kontrolnej skupine matiek so zdravými novorodencami. Našim cieľom bolo zistiť, či sa môžu poruchy štítnej žľazy v gravidite spolupodieľať na vzniku hypotrofie ev. IURR plodu.
SÚBOR A METODIKA
Dohromady sme vyšetrili 132 matiek s priemerným vekom 31,94 Ī 6,34 rokov, 56 matiek s hypotrofickými novorodencami a 76 matiek so zdravými novorodencami. Vyšetrenia a odbery materiálu boli realizované na I. internej klinike FN LP a LF UP JŠ v Košiciach. Biochemické analýzy zabezpečovalo RIA laboratórium na Americkej triede 17 v Košiciach. Získané údaje boli štatisticky spracované na Ústave lekárskej informatiky UPJŠ v Košiciach. Pred zaradením do súboru podpísali všetky pacientky informovaný súhlas. Vyšetrovací protokol zahŕňal dôkladné anamnestické a základné fyzikálne vyšetrenie, štandardné ultrazvukové vyšetrenie štítnej žľazy (Esaote Technos MPX 7,5 MHz lineárnou sondou), stanovenie fT4 (IRMA - Immunotech), TSH (IRMA - Immunotech), anti-TPO (IRMA - Diagnostic Systems Laboratories) a porovnanie pôrodnej hmotnosti a dĺžky novorodencov. Výsledky boli spracované štatisticky pomocou programov StatsDirect 2.6.2 a MS Excel 2000.
VÝSLEDKY
Pri porovnaní matiek s hypotrofickými novorodencami oproti kontrolnej skupine sme zistili:
Anamnestická analýza: Z anamnestických údajov bol zistený signifikantne častejší výskyt ochorení štítnej žľazy v skupine matiek s plodmi s hypotrofiou oproti kontrolnej skupine, rovnako ako aj vyšší výskyt tyreopatií v rodinách týchto matiek. V tejto skupine sme našli aj signifikantne viac bývalých i súčasných fajčiarok.
Fyzikálne vyšetrenie: Ani v jednej zo skupín nebola palpačne zistená struma ani iné závažnejšie.
USG štítnej žľazy: Pri porovnávaní veľkosti štítnej žľazy, zistenej pri ultrazvukovom vyšetrení, sme zistili signifikantne väčší objem štítnej žľazy v skupine matiek, ktorým sa narodil hypotrofický novorodenec (13,50 Ī 4,11 vs. 8,52 Ī 2,91 ml, p<0,001) (graf 1).
Analýza výsledkov laboratórnych parametrov (TSH, fT4, anti-TPO): Pri porovnaní skupiny matiek s hypotrofickými plodmi voči kontrole sme našli signifikantný rozdiel v koncentráciách TSH (2,04 Ī 0,9 vs. 1,47 Ī 1,32 mIU/l, p<0,01) (graf 2).
Graf 2. Koncentrácie TSH v skupinách 
Koncentrácie fT4 neboli štatisticky významne rozdielne pri porovnaní skupiny matiek s novorodencami s hypotrofiou a kontrolnou skupinou (13,91 Ī 3,23 vs. 14,42 Ī 3,31 pmol/l, p=0,1). Koncentrácie anti-TPO protilátok boli signifikantne vyššie pri v skupine matiek s hypotrofickými novorodencami (67,78 Ī 20,58 vs. 18,73 Ī 7,84 IU/ml, p<0,0001) (graf 3).
Graf 3. Koncentrácie anti-TPO protilátok v sledovaných skupinách 
Pôrodné parametre: Pôrodná hmotnosť bola podľa očakávania významne nižšia v skupine matiek s hypotrofickými novorodencami (2557,10 Ī 181,70 vs. 3720,25 Ī 419,80 g, pvětšínež0,0001). Pôrodná dĺžka bola taktiež signifikantne menšia v skupine s hypotrofiou (47,37 Ī 1,933 vs. 50,171 Ī 1,22, p=0,001).
DISKUSIA
Hormóny štítnej žľazy sú nevyhnutné pre správny vývoj plodu, najmä vývoj CNS a diferenciáciu iných tkanív. Plod je prakticky počas celého tehotenstva závislý od transplacentárneho prísunu tyreidálnych hormónov od matky. Preto sú ochorenia štítnej žľazy matky často spojené s rôznymi embryopatiami a poruchami v postpartálnom období [9].
Okrem ovplyvnenia funkcie štítnej žľazy, či už v zmysle možnej hypotyreózy alebo hypertyreózy, je pre väčšinu prípadov autoimunitných tyreopatií charakteristická prítomnosť autoprotilátok proti štítnej žľaze [16].
Aj keď jednoznačne preukázateľná úloha tyreoidálnych protilátok nebola dokázaná, predsa ich pozitivita jej jedným z najzrejmejších markerov imunitnej dysregulácie s následnou tyreoidálnou dysfunkciou a negatívnym dopadom na vývoj plodu.
Mnohí autori uvažujú, že okrem následkov zmenených koncentrácií tyreoidálnych hormónov, je u žien s autoimunitným ochorením štítnej žľazy prítomný určitý „autoimunitný fenomén“ reprezentujúci sekundárny znak predispozície na autoimunitné ochorenia, ktoré takisto vplývajú negatívne na vývoj plodu [25, 27].
Antityreoidálne protilátky sú prítomné aj u zdravej populácie a ich frekventnejší výskyt u žien počas ich reprodukčných rokov nasvedčuje, že imunologické faktory môžu hrať úlohu v reprodukčnom procese fertilizácie, implantácie a placentárneho vývoja [2].
Vzťah medzi ochoreniami štítnej žľazy matky a vývojom plodu bol pozorovaný, sledovaný a dokázaný množstvom štúdií a popísaný mnohými autormi.
Ochorenia štítnej žľazy matky teda negatívne ovplyvňujú vývoj plodu a sú spojené so zvýšeným výskytom potratov, hypotrofie resp. intrauterinnej rastovej retardácie a s nimi súvisiacou zvýšenou neonatálnou morbiditou i mortalitou [25, 26].
Hypotrofia plodu je závažným medicínskym problémom so zvýšeným rizikom morbidity a mortality novorodencov a je najčastejšou príčinou mŕtvo narodených detí. Sledovať fetálny vývoj a rastovú krivku plodu a v prípade potreby čím skôr odhaliť príčinu rastovej retardácie a následne rýchlo začať liečbu má veľký význam pre ďalší vývoj plodu [7, 10].
Je otázny podiel samotnej nerozpoznanej hypotyreózy alebo hypertyreózy matky, ev. podiel protilátok prechádzajúcich fetoplacentárnou bariérou a viažúcich sa na štítnu žľazu plodu. Avšak, aj po vývine fetálnej štítnej žľazy okolo 17.-19. týždňa gravidity, je stále rozhodujúca úloha tyreoidálnych hormónov matky [17].
V súlade so závermi prevažnej väčšiny literárnych údajov sme v skupine s hypotrofickými plodmi zistili vysoko signifikantne vyššie koncentrácie anti-TPO protilátok oproti kontrolnej skupine. S tým pravdepodobne súvisel aj signifikantne väčší objem štítnej žľazy.
Pôrodná hmotnosť aj dĺžka v skupine s hypotrofickými plodmi bola prirodzene vysoko signifikantne nižšia ako v kontrolnej skupine.
Vo väčšine štúdií, ktoré porovnávali koncentrácie TSH u matiek s hypotrofickými novorodencami oproti matkám s fyziologickými novorodencami boli koncentrácie TSH signifikantne vyššie v skupine matiek s hypotrofickými plodmi [20, 27]. V súlade s tým sú aj naše výsledky, keď ženy s hypotrofickými plodmi mali signifikantne vyššie koncentrácie TSH než ženy v kontrolnej skupine.
ZÁVER
Vzhľadom na to, že je dokázaný priamy kauzálny vzťah medzi autoimunitnými ochoreniami štítnej žľazy ako aj inými autoimunitnými ochoreniami a poruchami vo vývoji plodu, je vhodné zaradiť vyšetrenie štítnej žľazy do spektra základných vyšetrení počas gravidity. Vyšetrenie by malo byť realizované čo najskôr po zistení gravidity ev., pri plánovanej gravidite ešte pred otehotnením. Ideálne by bolo vykonať vyšetrenie štítnej žľazy u všetkých tehotných žien. Nevyhnutné je ale u všetkých žien s akýmkoľvek ochorením štítnej žľazy, ako aj s inými autoimunitnými ochoreniami, vrátane diabetes mellitus 1. typu.
Odporúčaný postup vyšetrenia:
V gravidite alebo pred otehotnením:
1. trimester:
Stanovenie koncentrácie anti-TPO, TSH, fT4 a orientačné palpačné vyšetrenie štítnej žľazy gynekológom. Podľa zisteného nálezu ďalší postup:
- Normálny nález – substitúcia jódu 150-200 Ķg/d.
- Patologické TSH alebo anti-TPO, alebo suspektný palpačný nález – odoslať k endokrinológovi.
- Pozitívne anti-TPO a normálne TSH a fT4 – zopakovať vyšetrenie v 2. aj v 3. trimestri.
3. trimester:
Kontrolné TSH a fT4 (u anti-TPO pozitívnych matiek u endokrinológa)
- Normálny nález – substitúcia jódu 150-200 Ķg/d.
- Patologické TSH, fT4 alebo suspektný palpačný nález – odoslať k endokrinológovi, ktorý rozhodne o liečebnom postupe.
Po pôrode 3. a 9. mesiac:
Kontrolné stanovenie TSH, fT4. U všetkých anti-TPO pozitívnych matiek s normálnou funkciou štítnej žľazy kontrola endokrinológom, keďže prítomnosť latentnej tyreoiditídy predstavuje 50% riziko popôrodnej tyreoididtídy [11].
Samozrejmosťou ostáva neonatálny skríning kongenitálnej hypotyreózy, a to nielen stanovením koncentrácie fT4 ale aj stanovením koncentrácie TSH supersenzitívnou IRMA metódou.
MUDr. Viola Vargová, PhD.
III. interná klinika FN LP a UP JŠ
Rastislavova 43
040 01 Košice
Slovenská republika
eamil: viola_mechirova@yahoo.com
Zdroje
1. Blazer, S., Moreh-Waterman, Y., Miller-Lotan, R., et al. Maternal hypothyroidism may affect fetal growth and neonatal thyroid function. Obstet Gynecol, 2003, 102, 2, p. 232-241.
2. Bussen, S., Steck, T., et al. Increased prevalence of thyroid antibodies in euthyroid women with a history of reccurent in-vitro fertilization failure. Hum Reprod, 2000, 15, p. 545-548.
3. Bussen, SS., Steck, T. Thyroid antibodies and their relation to antithrombin antibodies, anticardiolipin antibodies and lupus coagulant in women with reccurent spontaneus abbortions (antithyroid, anticardiolipin and antithrombin autoantibodies and lupus anticoagulant in habitual aborters). Eur J Obstet Gynecol Reprod Biol, 1997, 74, 2, p. 139-143.
4. Cohen, SB., Goldenberg, M., Rabinovici, J., et al. Anticardiolipin antibodies in fetal blood and amniotic fluid derived from patients with antiphoslipid syndrome. Hum Reprod, 2000, 15, p.1170-1172.
5. Čech, E., Hájek, Z., Maršál, K., a kol. Porodnictví. Praha: Grada Publishing, 1999, s. 165-174.
6. Davisson, RL., Hoffman, DS., Butz, GM., et al. Discovery of a spontaneus genetic mouse model of preeclampsia. Hypertension, 2002, 39, p. 337-342.
7. Deorari, AK., Aggarwal, R. Management of infants with intra-uterine growth restriction. Indian J Ped, 2001, 68, p. 1155-1157.
8. Fisher, DA. Euthyroid low thyroxine (T4) and triiodothyronine (T3) states in prematures and sick neonates. Pediatr Clin North Am, 1990, 37, p. 1297-1312.
9. Glinoer, D. The regulation of thyroid function in pregnancy: pathways of endocrine adaptation from physiology to pathology. Endocr Rev, 1997, 18, p. 404-415.
10. Chatelain, P. Children born with intrauterine growth retardation (IUGR) or small for gestational age (SGA): long term growth and metabolic consequences. Endocr Reg, 2000, 33, p. 33-36.
11. Kaplan, MM. Monitoring thyroxine treatment during pregnancy. Thyroid, 1992. 2, p. 147-154.
12. Kitridou, RC. The fetus in systemic lupus erythematosus. In: Wallace, DJ., Hahn, BH., et al.: Dubois@ lupus erythematosus. 5th Ed. Baltimore: Williams & Wilkins, 1997, p. 1003-1021.
13. Klein, RZ., Carlton, EL., et al. Thyroid function in very low birthweight infants. Clin Endocrinol, 1997, 47, p. 411-417.
14. Klein, RZ., Mitchell, ML. Maternal hypothyroidism and child development. Horm Res, 1999, 52, p. 55-59.
15. Kohn, LD., Suzuki, K., Hoffman, WH., et al. Characterisation of monoclonal thyroid atimulating and thyrotropin binding inhibiting autoantibodies from a Hashimoto@s patient whose children had intrauterine and neonatal thyroid disease. J Clin Endocrinol Metab, 1997, 82, p. 3998-4009.
16. Langer, P. Patofyziológia ochorení štítnej žľazy matky v gravidite. Ochorenia štítnej žľazy v gynekologickej praxi, 1998, s. 16-17.
17. Lazár, I., Ostró, A., Dankovčík, R., et al. Skríning tyreopatií v I. trimestri gravidity. Reprodukčná medicína : zborník z vedeckej konferencie s medzinárodnou účasťou pri príležitosti 10. výročia založenia Centra asistovanej reprodukcie pri II. gynekologicko-pôrodníckej klinike LF UPJŠ a FN L. Pasteura / Editori: R. Hredzák, A. Ostró, J. Kačmárik, 2005, S. 87-88.
18. Lukačin, Š. Hypotrofia plodu, www.levret.cz, stránka postgraduálneho vzdelávania v gynekológii a pôrodníctve.
19. Millar, LK., Wing, DA., Leung, AS., et al. Low birth weight and preeclampsia in pregnancies complicated by hyperthyroidism. Obstet Gynecol, 1994, 84. 6, p.946-949.
20. Peiker, G., Glockner, R., Michels, W., et al. Serum concentrations of iodine, thyroxine (T4), triiodothyronine (T3), thyrotropin (TSH) and insulin-like growth factor 1 (IGF-1) during the last trimester of pregnancy, during labour, and in early puerperium of women with normal pregnancy or with intrauterine growth retardation (IUGR). J Obstet Gynecol, 1997, 17, 4, p. 340-343.
21. Phillips, DIW., Osmond, C., Baird, J., et al. Is birthweight associated with thyroid autoimunity? A study in twins. Thyroid, 2002, 12, 5, p. 377-380.
22. Raetti, G., Persani, L., Cortellazi, A., et al. Transplacental passage of antithyroid autoantibodies in pregnant woman with autoimmunne disease. Prenat Diagn. 1999, 19, p. 468-471.
23. Resnik, R. Intrauterine growth restriction. Obstet Gynecol, 2002, 99, p. 490-496.
24. Rohl, J., Huston-Presley, L. Factors associated with fetal growth and body composition as measured by ultrasound. Am J Obstet Gynecol, 2001, 6, p. 185-187.
25. Rushworth, FH., Backos, L., et. al. Prospective pregnancy outcome in untreated recurrent miscarries with thyroid antibodies. Hum Reprod, 2000, 7, p. 1637-1639.
26. Sher, G., Maassarani, G., Zouves, C., et al. The use of combined heparin/aspirin and immunoglobulin G therapy in the treatment of in vitro fertilization patients with antothyroid antibodies. Am J Reprod Immunol, 1998, 39, p. 223-225.
27. Stagnaro-Green, AS., Roman, SH., et al. A prospective study of lymphocyte-initiated immunosuppresion in normal pregnancy: Evidence of T-cell etiology for postpartum thyroid dysfunction, J Clin Endocrinol Metab, 1992, 74, p. 645-653.
28. Thorpe-Beeston, JG., Nicolaides, K., Snijders, JM. Thyroid function in small for gestation age fetuses. Obstet Gynecol, 1991, 77, p. 701-706.
29. Whittle, MJ. Fetal growth retardation causes and effects. Contemp Rev Obstet Gynecol, 1994, 162, p. 1168-1170.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2008 Číslo 1- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Rodičovské postoje a socioemoční vývoj dětí počatých po ICSI
- Děti narozené po intracytoplazmatické injekci spermie: Faktory neplodnosti, průběh těhotenství a porodu, perinatální období
- Vrozené vývojové vady, zdravotní stav a somatický vývoj dětí narozených po intracytoplazmatické injekci spermie
- Náplň předporodních kurzů z hlediska přípravy ke kojení
- Ochorenia štítnej žľazy matky a vrodené vývojové chyby plodu
- Psychomotorický a kognitivní vývoj dětí narozených po mimotělním oplodnění metodou intracytoplazmatické injekce spermie
- Ochorenia štítnej žľazy matky a hypotrofia plodu
- Abdominální sakrokolpopexe – jednoduchá a stále aktuální metoda léčby prolapsu poševního pahýlu?
- Nádor ovaria jako komplikace diagnostiky extraintestinálního gastrointestinálního stromálního tumoru – dvě kazuistiky
- Syndrom kaudální regrese – dvě kazuistiky
- Doporučený postup vaginální estrogenní terapie
- Volby výboru Sekce gynekologie dětí a dospívajících České gynekologické a porodnické společnosti ČLS JEP (září 2007)
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Syndrom kaudální regrese – dvě kazuistiky
- Abdominální sakrokolpopexe – jednoduchá a stále aktuální metoda léčby prolapsu poševního pahýlu?
- Vrozené vývojové vady, zdravotní stav a somatický vývoj dětí narozených po intracytoplazmatické injekci spermie
- Ochorenia štítnej žľazy matky a hypotrofia plodu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




