-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam chromozomálních změn ve vztahu k prognostickým faktorům u zhoubných nádorů vaječníku a děložního hrdla
Importance of Chromosomal Changes Correlated to Prognostic Factors in Ovarian and Cervical Malignant Tumors
Objective:
The aim of the study was to estimate genetic changes detected in ovarian and cervical cancer cells, in correlation with other available clinical and histopathological parameters, with impact upon cancer prognosis.Design:
Original article.Setting:
Department of Gynecology and Obstetrics, First Faculty of Medicine, Charles University in Prague and General Teaching Hospital, Prague.Methods:
Sixty patients with ovarian cancer and twenty patients with cervical cancer were included in the study. A histopathologist examined the tumor samples in order to define the histological type and grade. MIB-1 and p53 were estimated using an immunohistochemical method. For genetic testing, both conventional and molecular methods were applied (direct culture and a G-banding technique, the FISH method with whole chromosome painting probes, and the CGH method). The results were submitted to statistical evaluation, using analysis of variances and χ² test.Results.
Numerical and structural chromosomal aberrations were detected in more than 63% of the examined ovarian cancer cases and 29% of examined cervical cancer cases. Ovarian cancer patients with extensive chromosomal rearrangements were significantly younger. The most typical findings in ovarian cancer cells were amplifications 1q, 3q, 20q; and deletions 4p, 4q, 18p, 18q, 19q. The most typical findings in cervical tumor cells were amplifications 3q, 5p; and deletions 13q and isochromosome 5p. Some of the less frequent findings in our study were deletion 22q in 36% of all ovarian cancer samples, as well as amplifications of chromosome 2 and deletions of chromosome 10, 11p, 21q in cervical cancer cells. The activity of proliferative marker MIB-1 was significantly higher in women with a high p53 HSCORE (p < 0.01).Conclusions.
Chromosomal rearrangements, different for ovarian and cervical cancer, have been found, including several rare findings. The significant importance of genetic alterations and the activity of proliferative markers, including common correlations with an unfavorable outcome in ovarian tumors of younger women were found.Key words:
ovarian cancer, cervical cancer, chromosomal rearrangements, prognostic factors
Autori: N. Jančárková 1; M. Krkavcová 2; M. Janashia 2; P. Freitag 1; J. Dušková 3; D. Cibula 1
Pôsobisko autorov: Gynekologicko–porodnická klinika 1. LF UK a VFN, Praha, Onkogynekologické centrum, přednosta prof. MUDr. A. Martan, DrSc. 1; Ústav biologie a lékařské genetiky 1. LF UK a VFN, Praha, přednostka doc. MUDr. M. Kohoutová, CSc. 2; Ústav patologie 1. LF UK a VFN, Praha, přednosta prof. MUDr. C. Povýšil, DrSc. 3
Vyšlo v časopise: Ceska Gynekol 2008; 73(2): 79-86
Súhrn
Cíl studie:
Vyhodnocení výskytu, významu a vztahů mezi genetickými změnami, histopatologickými a klinickými charakteristikami cervikálních a ovariálních karcinomů.Typ studie:
Původní práce.Pracoviště:
Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha.Metodika:
Do studie bylo zahrnuto 60 pacientek s ovariálním karcinomem a 20 pacientek s cervikálním karcinomem. U nádorových vzorků byl určen histologický typ a nádorová diferenciace, dále byl proveden imunohistochemický průkaz p53 a proliferačního markeru MIB-1. Genetické a molekulárně-genetické vyšetření zahrnovalo konvenční karyotypizaci, G-pruhování, FISH metodu za použití malovacích sond, CGH metodu. Získana data včetně klinických byla statisticky vyhodnocena pomocí variační analýzy a χ² testu.Výsledky:
Numerické a strukturální aberace byly detekovány u více než 63 % ovariálních karcinomů a 29 % cervikálních karcinomů. Pacientky s ovariálním karcinomem a nalezenou rozsáhlou chromozomální přestavobu byly signifikantně mladší. Byly zaznamenány typické nálezy pro ovariální karcinom: amplifikace 1q, 3q, 20q, delece 4p, 4q, 18p, 18q, 19q. Pro cervikální karcinom byly typickým nálezem amplifikace 3q, 5p, delece 13q a izochromozom 5p. Ve studii byly dále zjištěny méně často popisované nálezy: delece 22q u 36 % případů ovariálních karcinomů, amplifikace chromozomu 2 a delece chromozomů 10, 11p a 21q u cervikálních karcinomů. Aktivita proliferačního markeru MIB-1 byla signifikantně vyšší u žen s vysokým p53 HSCORE.Závěr:
Byly nalezeny chromozomální přestavby, včetně několika vzácných nálezů, rozdílné pro ovariální i cervikální karcinomy. Byl zjištěn signifikantní význam genetických alterací a aktivity proliferačních markerů u mladších žen s ovariálním karciomem.Klíčová slova:
ovariální karcinom, cervikální karcinom, chromozomální přestavby, prognostické faktoryÚVOD
Zhoubné nádory ovaria patří mezi nejčastější příčiny úmrtí na gynekologické zhoubné nádory a představují přibližně 30 % všech nádorů ženské reprodukční soustavy. Ve více než 75 % případů je toto onemocnění diagnostikováno v pokročilých stadiích. Nejsou definované přednádorové stavy. Neexistuje efektivní screening. I přes vysoké procento léčebných odpovědí na primární léčbu dochází u více než 80 % případů k recidivám. Ročně je ve světě diagnostikováno přibližně 190 000 nových případů ovariálního karcinomu, 114 000 žen v souvislosti s tímto onemocněním umírá.
Ovariální nádory se ve většině případů vyskytují u žen sporadicky, bez pozitivní rodinné anamnézy. Maligní transformace je zde vyvolána pouze somatickými mutacemi. V nádorové tkáni mohou být mutovány jak protoonkogeny, tak tumor-supresorové geny nebo mutátorové geny. Jenom malá část karcinomů ovaria (5–10 %) je geneticky podmíněna. Celkové pětileté přežití žen se zhoubným nádorem ovaria (pro všechna stadia) představuje v Evropě 32 %, u pokročilých stadií ovšem nepřekračuje 20 %.
Karcinom děložního hrdla představuje druhý nejčastější zhoubný nádor u žen v celosvětovém měřítku. Ročně je diagnostikováno přibližně 470 000 nových případů onemocnění, 230 000 žen v souvislosti s tímto onemocněním umírá. Pětiletého přežití dosahuje až 70 % žen, v rozvojových zemích pouze 40 % žen [40].
I přesto, že existují dobře definovaná, relativně dlouho se vyvíjející a léčitelná předstadia a poměrně spolehlivé a dostupné metody jejich detekce (kolposkopie, onkologická cytologie), velký počet nádorů je diagnostikován v pokročilých stadiích. Incidence nádoru v České republice je mnohem vyšší než v jiných vyspělých zemích.
Genetické a molekulárně biologické markery u solidních nádorů představují nový prvek v klinické onkologii posledních let. Jejich význam spočívá v tom, že umožňují hlubší poznání nádoru samotného a jeho charakteristik. Implementace těchto poznatků jak směrem diagnostickým, tak i směrem terapeutickým by měla vést k uplatnění preciznějších a více individualizovaných postupů v oblasti detekce, screeningu, predikce, prognózy a také monitorování aktivity nádorového onemocnění.
Prognostické faktory jednotlivých nádorových onemocnění můžeme rozdělit do tří skupin:
- faktory týkající se nádoru (histopatologická klasifikace včetně nádorové diferenciace, rozsah anatomického postižení a z něho vyplývající stadium onemocnění, molekulárně biologické charakteristiky);
- faktory týkající se hostitele, tj. pacienta (vrozené demografické charakteristiky – věk, celkový stav – performance status, přidružené choroby, psychosociální reakce na nádorové onemocnění);
- faktory týkající se prostředí, ve kterém se pacient nachází (socioekonomická úroveň, výběr, kvalita a dostupnost zdravotní péče).
Některé prognostické faktory lze zároveň zařadit do více skupin. Vyhodnocení dostupných prognostických faktorů umožňuje předpovědět pravděpodobný vývoj nádorového onemocnění. Jednotlivé faktory přitom mají různou vypovídací hodnotu a lze je z tohoto hlediska rozdělit do skupin zásadního významu, doplňkového významu a do skupiny nových a slibných prognostických faktorů [10].
V předkládané studii jsou prezentovány výsledky projektu zaměřeného na vyhodnocení výskytu a vztahů mezi genetickými změnami, proliferačními a biochemickými markery, histopatologickými a klinickými charakteristikami cervikálních a ovariálních karcinomů.
SOUBOR PACIENTEK A METODIKA
Do studie bylo zahrnuto 60 pacientek s ovariálním karcinomem a 20 pacientek s cervikálním karcinomem.
Vzorky primárních nádorů vaječníku a děložního hrdla byly získávány při chirurgickém zákroku (laparotomii) či biopsií u inoperabilních nádorů v průběhu tří let. Zaznamenávány byly veškeré klinické informace a výsledky laboratorních vyšetření, včetně nádorového markeru CA 125 u pacientek s ovariálním karcinomem.
Vzorek nádoru byl vyšetřen histopatologem, s cílem určení histologického typu a nádorové diferenciace. Dále byl proveden imunohistochemický průkaz p53 a proliferačního markeru MIB-1 metodou podle Mc Cartyho, což je semikvantitativní postup beroucí v úvahu procento pozitivních nádorových buněk a intenzitu pozitivity kvantifikovanou do čtyř stupnů (tj. negativní, pozitivní slabě, pozitivní distinktně, pozitivní silně), s vyčíslením tzv. HSCORE pomocí systému obrazové analýzy LUCIA [28].
Ke zjišťování chromozomální nestability nádorových buněk bylo použito cytogenetického vyhodnocení karyotypu s použitím počítačové analýzy obrazu. Při přípravě chromozomových preparátů bylo použito jak přímého zpracování, tak i krátkodobé kultivace, s následným konvenčním zpracováním a G-pruhováním.
K upřesnění aberací byla na některé konkrétní mitózy po jejich zhodnocení použita metoda FISH (fluorescenční in situ hybridizace), včetně celochromozomových sond. Princip hybridizační metody je založen na schopnosti jednořetězcové DNA (sondy) vázat se s komplementárními úseky cílové DNA. Preparáty se sondami označenými fluorochromy je možné po hybridizaci vyhodnotit na fluorescenčním mikroskopu vybaveném příslušnými filtry. K upřesnění strukturálních přestaveb je potřebné použít malovací sondy, takže tato metoda vyžaduje kvalitní mitózy získané po předchozí krátkodobé kultivaci.
Při fluoroscenční in situ hybridizaci (FISH) byly použity celochromozomové malovací sondy, v souladu s postupem doporučeným výrobcem (Vysis Inc., USA).
Preparáty byly vyhodnoceny pomocí fluorescenčního mikroskopu Olympus BX 51.
Další použitou metodou byla CGH (komparativní genomová hybridizace). Tato metoda je založena na in situ hybridizaci odlišně značené celkové genomové nádorové DNA a referenční genomové DNA metafázických chromozomů. Poměr intenzity fluorescence nádorové a referenční DNA měřený v každém lokusu udává numerické změny v DNA. Z izolované nádorové DNA lze tak přímo detekovat nebalancované přestavby (amplifikace, delece) všech chromozomů bez náročné předchozí kultivace, metoda ovšem neodhalí balancované přestavby (translokace, inverze). Další předností metody je minimální množství vyizolované DNA. Izolace DNA byla provedena pomocí QIAamp® DNA Mini Kit (Qiagen Inc., USA), podle postupu doporučeného výrobcem, při samotné hubridizaci bylo využito reagencií fy Vysis Inc., USA, v souladu s doporučením výrobce. Pro počítačovou obrazovou analýzu byl použit software LUCIA-CGH (Laboratory Imaging, Česká republika). Preparáty byly vyhodnoceny pomocí fluorescenčního mikroskopu Olympus BX 51.
Ve studii byly porovnávány jednotlivé metody – konvenční karyotypizace (navzdory limitacím stále používaná i v dnešní době) s přímým zpracováním a krátkodobou kultivací a metody molekulárně-cytogenetické, tj. fluorescenční in situ hybridizace a komparativní genomová hybridizace. Srovnání bylo zaměřené na výtěžnost, časovou náročnost, finanční zatíženost a neúspěšnost [21, 41].
Při popisu chromozomů a karyotypů jsme respektovali mezinárodní nomenklaturu (ISCN 1995), v souladu se závaznou mezinárodní normou [30].
Cílem statistického zpracování bylo vyhodnotit vztahy sledovaných kvantitativních a kvalitativních parametrů ve skupinách cervikálních i ovariálních karcinomů, s důrazem na vztahy chromozomálních přestaveb k ostatním parametrům.
V obou skupinách, tj. ovariálních i cervikálních karcinomů, jsme při statistickém zpracování využili analýzu rozptylu a test chí-kvadrát (χ2 ).
Zpracování ve skupině ovariálních karcinomů bylo následující:
- Testování kvantitativních proměnných (věk, CA125 před léčbou, MIB-1, p53) pomocí analýzy rozptylu (ANOVA) s dělením do skupin podle 9 kvalitativních parametrů: stadium (I, II, III, IV), histologie (endometroidní, mucinózní, serózní adenokarcinom), grading (G1, G2, G3), operační reziduum (ne, ano), lymfadenektomie - LE (ano-, ano+), léčebná odpověď – response rate RR (CR – complete response, PR – partial response, PD – progression of disease), CA125 po léčbě (negativní, pozitivní), p53 (negativní, pozitivní), přestavba (žádná, malá, velká).
- Testování výše uvedených kvalitativních parametrů mezi sebou testem závislosti χ2.
Zpracování ve skupině cervikálních karcinomů bylo následující:
Testování kvantitativních proměnných (věk, MIB-1, p53) pomocí analýzy rozptylu (ANOVA) s dělením do skupin podle 6 kvalitativních parametrů: stadium (I, II, III, IV), histologie (dlaždicový, dlaždicový nerohovějící, dlaždicový rohovějící), grading (G1, G2, G3), léčebná odověď – response rate RR (CR – complete response, PR – partial response, PD – progression of disease), přestavba (ano-velká , ne) a p53 (negativní, pozitivní).
Testování výše uvedených kvalitativních parametrů mezi sebou testem závislosti χ2.
Počet statisticky vyhodnocených případů byl u jednotlivých paramaterů odlišný – klinické informace, histologické nálezy včetně nádorové diferenciace byly k dispozici u všech pacientek. Imunohistochemické vyšetření (MIB-1 HSCORE, p53 HSCORE) nebylo provedeno v několika případech z důvodu špatné fixace tkáně určené pro toto zpracování. V důsledku technických závad, nedostatečného množství nádorové tkáně a v některých případech i neúspěšné kultivace, chromozomální přestavby byly hodnoceny u 20 pacientek ve skupině cervikálních karcinomů a u 47 pacientek ve skupině ovariálních karcinomů.
Konvenční cytogenetická karyotypizace byla úspěšná u 17 pacientek (85 %) ve skupině cervikálních karcinomů a u 35 pacientek ze 40 testovaných (87,5 %) ve skupině ovariálních karcinomů. FISH metoda byla aplikována zároveň u 6 pacientek (30 %) s předchozí úspěšnou konvenční karyotypizací ve skupině cervikálních karcinomů a také u 6 pacientek (10 % z celé skupiny) ve skupině ovariálních karcinomů, rovněž s předchozí úspěšnou konveční karyotypizací. CGH metoda byla uplatněna u 4 pacientek (20 %) ve skupině cervikálních karcinomů i u 12 pacientek (20 %) s neúspěšnou konvenční karyotypizací ve skupině ovariálních karcinomů. Koncentrace DNA byla extrémně nízká u 13 pacientek ze skupiny ovariálních karcinomů, tyto případy byly vyloučeny z genetického testování.
Veškeré tyto údaje byly kompletně zohledněny při statististickém zpracování.
Vyšší počet diploidních nádorů v našem souboru může souviset se způsobem odběru nádorové tkáně, kdy makroskopicky zjevný tumor obsahuje také podstatnou fibrózní složku s klonem buněk s normálním karyotypem. Předkládané výsledky byly získány pomocí metod cytogenetických i molekulárně-cytogenetických. FISH metoda byla použita ke specifikaci genetických alterací v případech úspěšných kultivací, CGH metoda byla použita tam, kde kultivace byly neúspěšné. Počet studovaných mitóz se pohyboval od 3 do 28. Cílem bylo vyhodnotit všechny nalezené mitózy – v případech patologických nálezů jsme hodnotili všechny mitózy, v případech normálních nálezů jsme hodnotili 30 mitóz.
VÝSLEDKY
Věk pacientek ve skupině ovariálních karcinomů se v době diagnózy pohyboval od 39 do 81 let (medián 61 let). Rozdělení podle stadií a histologie je uvedeno v tabulce 1.
Tab. 1. Charakteristika skupiny ovariálních karcinomů (FIGO stadium, histologie, grading) 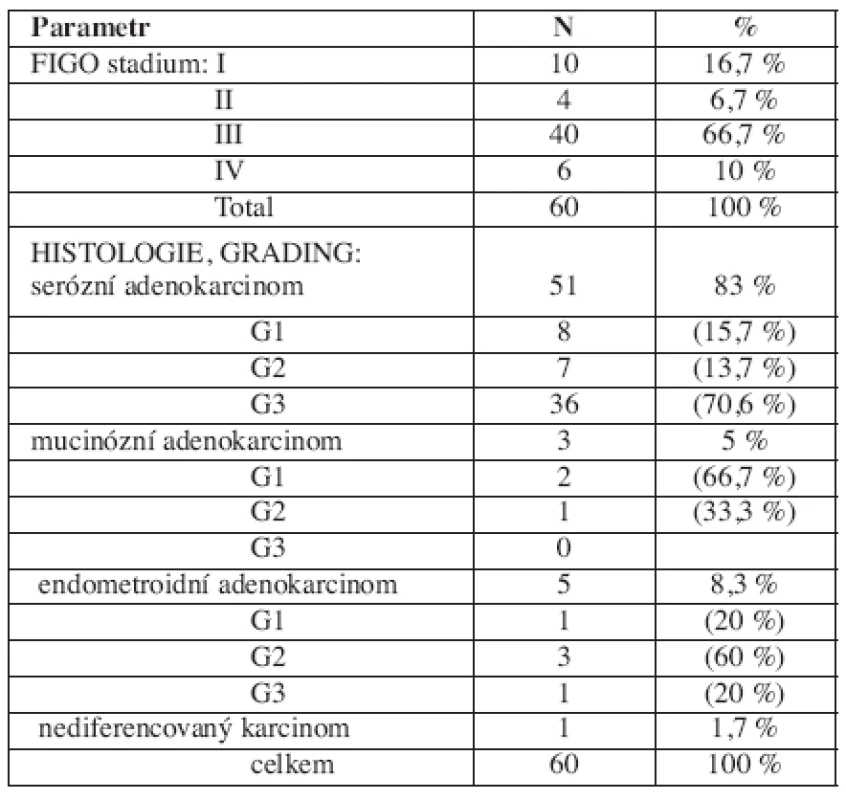
Tři pacientky ze skupiny ovariálních karcinomů byly vyšetřeny na přítomnost mutace genů BRCA1, 2, výběr pacientek se řídil příslušnými metodickými pokyny [4]. Mutace BRCA1 genu byla přítomna u jedné pacientky.
Pacientky ve skupině cervikálních karcinomů byly v době diagnózy ve věku od 39 do 84 let (medián 52 let). Rozdělení podle stadií onemocnění a histologických nálezů, včetně gradingu je uvedeno v tab. 2.
Tab. 2. Charakteristika skupiny cervikálních karcinomů (FIGO stadium, histologie, grading) 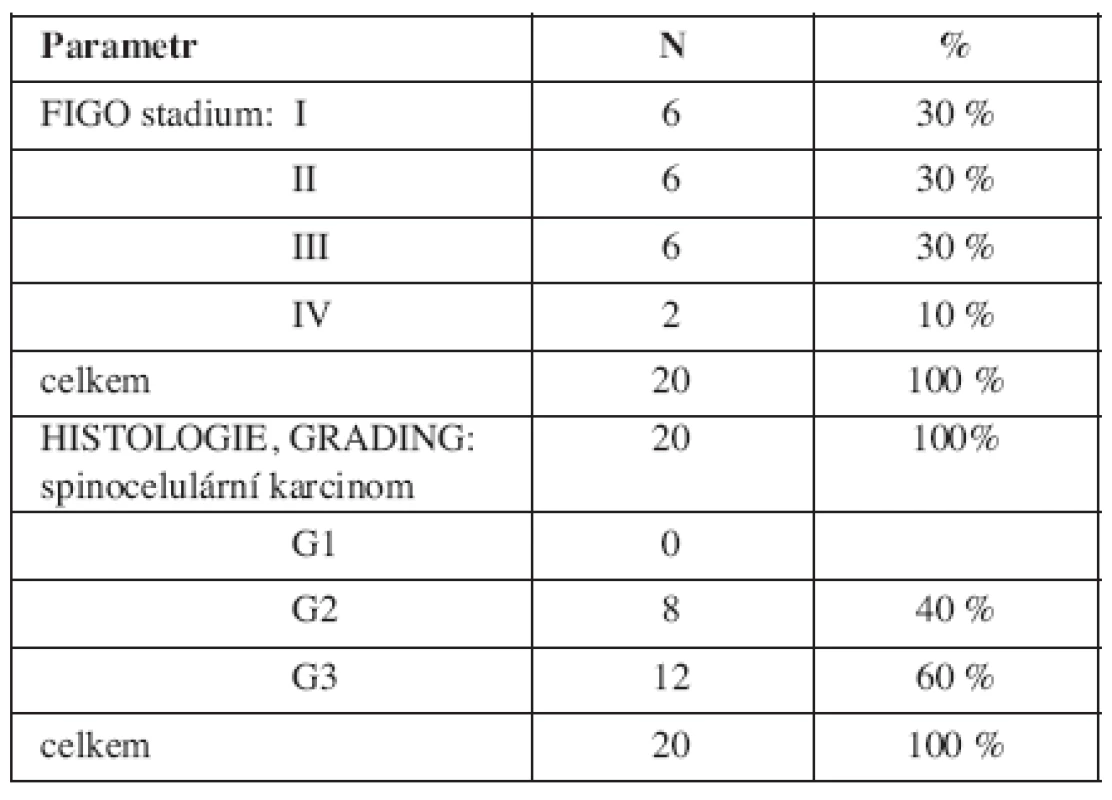
Numerické a strukturální aberace byly nalezeny u více než 69 % ovariálních nádorových buněk a 29 % cervikálních nádorových buněk. Počet chromozomů se pohyboval od 63 do 85 u ovariálních nádorových buněk, od 44 do 82 u cervikálních nádorových buněk. Při použití metody CGH byly delece častějším nálezem než amplifikace, což může souviset se skutečností, že delece určitých chromozomů odrážejí roli tumor supresorových genů umístěných ve specifických oblastech.
Amplifikace, typické pro skupinu ovariálních karcinomů, byly nalezeny na chromozomech 1q – 17 případů (36,2 %), 3q – 8 případů (17 %) a 20q – 8 případů (17 %).
Delece 22q byla nalezena v 17 případech (36,2 %), tento nález je podle dostupné lietaratury poměrně vzácný. Izolovaná balancovaná translokace t(10;15) byla nalezena ve dvou případech (4,3 %). Nález byl přítomen ve všech vyšetřovaných buňkách, konstituční translokace byla vyloučena vyšetřením periferní krve. Ostatní nálezy se vyskytovaly v méně než 5 % případů: amplifikace 8q, 11q, 17q, 19q, 12p, 12q, 5p, 5q, 6p, 6q, 21q; delece 16q, 17q, 11p, 11q, 13q, 12p, 5q, 9q, 2p, 2q, Xp, 1q, 15q. Ve 32 % případů byly nalezeny rozsáhlé změny, počet aberantních chromozomů přesahoval sedm. Ve 37 % případů byl nalezen diploidní karyotyp.
Ve skupině ovariálních karcinomů jako statisticky významné se podařilo prokázat pro kvantitativní proměnné:
- Ženy s dg. stadiem I byly statisticky významně (p<0,01) starší (74) než ženy se stadii II, III, IV (59, 61, 60).
- Ženy s gradingem G1 měly statisticky významně (p<0,05) nižší hodnotu MIB-1 (141) oproti ženám s G2 (209) a G3 (195).
- Ženy s gradingem G1 měly statisticky významně (p<0,05) nižší hodnotu p53 (126) oproti ženám s G2 (236) a G3 (173).
- Ženy s pozitivním nálezem p53 měly statisticky významně (p<0,001) vyšší průměrnou hodnotu MIB-1 (217) oproti ženám s negativním p53 (157).
- Ženy s velkou chromozomální přestavbou byly statisticky významně (ale jen p<0,1) mladší (54) oproti ženám s malou (60) a žádnou přestavbou (66).
Pro kvantitativní parametry se podařilo prokázat statisticky významnou závislost mezi:
- Stadium CA a grading (p<0,001).
- Stadium CA a operační reziduum (p<0,001).
- Stadium CA a LE (lymfadenektomie (ano-, ano+) (p<0,05).
- Histologie a grading (p<0,05).
- Grading a operační reziduum (p<0,001).
- Grading a RR (response rate) (p<0,01).
- Grading a p53 (neg. , poz.) (p<0,01).
- Operační reziduum a LE (lymfadenektomie) (p<0,05).
- Operační reziduum a RR (response rate) (p<0,05).
- Operační reziduum a CA125 (p<0,05).
- RR (response rate) a CA125 (p<0,001).
Mezi ostatními zbývajícími dvojicemi parametrů se statisticky významnou závislost nepodařilo prokázat.
Nejčastějšími nálezy ve skupině cervikálních karcinomů byly amplifikace 3q, které byly prokázány ve 12 případech (60 %) a izochromozom 5p v 8 případech (40 %). Méně častými nálezy byly: amplifikace 5p – 4 případy (20 %), delece 13q a 2q ve 4 případech (20 %). Rozsáhlé numerické a strukturální přestavby byly typickými nálezy u pokročilých cervikálních karcinomů: amplifikace 3p v 8 případech (40 %), 5p ve 4 případech (20 %), 20p ve 4 případech (20%), 22q ve 4 případech (20 %) a delece 13q ve 4 případech (20 %), 6q ve 4 případech (20%) a izochromozom 5p v 8 případech (40 %). Ve vyšetřovaných případech v naší studii byly nalezeny dále vzácné amplifikace chromozomu 2p a 2q, a také delece chromozomů 10p, 10q, 11p a 21q.
Ve skupině cervikálních karcinomů jako statisticky významné se podařilo prokázat pro kvantitativní proměnné:
- Ženy s dg. stadiem IV (ale byly jen 2) byly statisticky významně (p<0,01) starší (80) než ženy se stadii I, II, III, (55, 51, 54).
- Ženy s gradingem G2 měly statisticky významně (pouze p<0,1) vyšší hodnotu p53 (136) oproti ženám s G3 (110).
Mezi všemi možnými dvojicemi 6 kvalitativních parametrů se statisticky významnou závislost nedařilo prokázat.
To neznamená, že závislost není; může být, ale nepodařilo se ji prokázat, především pro velmi malý celkový počet žen s karcinomem cervixu, a tím i v jednotlivých kategoriích sledovaného parametru.
Vzhledem k tomu, že studie byla zaměřena na genetické změny v nádorových buňkách, naše pozornost byla soustředěna na možné vztahy mezi chromozomálními přestavbami a výše zmíněnými parametry kvantitativní a kvalitativní povahy.
Skupinu pacientek s ovariálním karcinomem jsme rozdělili podle výskytu chromozomálních aberací na tři skupiny – s žádnými aberacemi, s malým počtem aberací (1–7), s velkým počtem aberací (více než 7). Tyto tři skupiny byly korelovány s věkem, stadiem, histologickým typem, gradingem, léčebnou odpovědí (RR – response rate), hladinou CA 125, MIB-1 HSCORE a p53 HSCORE, ponechaným chirurgickým reziduem a přítomností metastáz v lymfatických uzlinách. I přes některé pozitivní náznaky, žádné statisticky významné závislosti, kromě již zmíněných výše, nalezeny nebyly.
Ve skupině pacientek s cervikálním karcinomem jsme rozlišovali dvě podskupiny – s přítomností nebo nepřítomností chromozomálních přestaveb. Žádné statisticky významné závislosti mezi genetickými nálezy a proměnnými, jak kvalitativní, tak kvantitativní povahy, nalezeny nebyly.
Nebyla vyhodnocena korelace mezi výskytem genetických alterací a dobou celkového přežití, vzhledem ke krátké době sledování některých pacientek účastnících se studie (jeden rok).
Průměrné hodnoty MIB-1 HSCORE byly podobné jak ve skupině ovariálních, tak i cervikálních karcinomů (187,8; 209,3). Průměrná hodnota p53 HSCORE byla signifikantně vyšší v buňkách ovariálních karcinomů ve srovnání s buňkami cervikálních karcinomů (180,5; 119,2). Zdá se, že p53 HSCORE je důležitějším markerem než MIB-1 HSCORE, což vyplývá i z výsledků korelací obou parametrů s kvantitativními a kvalitativními proměnnými v obou skupinách.
Genetické alterace ve skupině cervikálních karcinomů jsou méně extenzivní ve srovnání se skupinou ovariálních karcinomů. Může to souviset se způsobem odběru nádorové tkáně, menším počtem pacientek ve skupině, zároveň však také s odlišným způsobem cervikální karcinogeneze.
DISKUSE
Předpokládá se, že znalost genetického profilu nádoru a některých jeho dalších molekulárně biologických charakteristik by měla přispět k predikci průběhu a prognózy nádorového onemocnění, zároveň přispět i k individualizaci léčebných modalit a monitoraci aktivity nádorového procesu.
Cytogenetické nálezy u cervikálních karcinomů, jak byly referovány z různých laboratoří, odhalily celou řadu strukturálních a numerických aberací, primární aberace však stále není známá.
Amplifikace v cervikálních nádorových buňkách jsou nejčastěji popisovány na chromozomech 1q, 3q, 5p, 8q, 17q a 20q, delece na chromozomech 2q, 3p, 4p, 6q, 11q, 13q, 17q, 18q a Xq. Aberace byly nalezeny v nádorech různých stadií, včetně premaligních lézí – CIN (cervikální intraepiteliální neoplazie). Tato skutečnost může souviset s vyšším maligním potenciálem těchto lézí a vysokou pravděpodobností jejich přechodu do invazivních karcinomů [3, 29, 42, 48].
Nejčastěji popisovaným nálezem v cervikálních nádorových buňkách je amplifikace 3q (3q24-3q28), stejně jako v buňkách premaligních lézí a lézí s inicální invazí. Je to oblast genu hTR pro RNA-telomerázu s významen pro imortalizaci buněk ve smyslu genetického markeru pro předpověď rizika. Nadbytek 3q je typickým nálezem u žen s premaligní lézí, která později přešla do invazivního karcinomu [12, 16, 17, 18]. Horší prognóza onemocnění cervikálním karcinomem je spojena se ztrátou tumor supresorového genu na chromozomech 3p, 9p, 11p a 18q [16, 17]. Delece 3p je dalším typickým nálezem v buňkách invazivního metastazujícího cervikálního karcinomu [11].
Význam a asociace inaktivovaného tumor supresorového genu p53 (17p13.3) v rozvoji cervikálního karcinomu předpokládá koexistenci HPV (human papilloma virus) infekce, i když samotná přítomnost infekce není dostatečným faktorem k rozvoji nádoru. Nebyla nalezena specifická genetická alterace asociovaná s HPV infekcí [19]. Horší průběh onemocnění bývá spojován s přítomností delecí 11p a 18q [46]. Dalším typickým nálezem detekovaným v buňkách cervikálních karcinomů je přítomnost izochromozomu 5p [1].
Nejčastěji se vyskytujícím nálezem, zjištěným v naší studii, byla amplifikace chromozomů 3q, 5p a delece 13q. Toto zjištění koresponduje s výsledky ostatních studií. Pokročilá stadia byla spojena s výskytem vyššího počtu chromozomálních aberací, v naší studii tento nález nebyl statisticky významný.
V naší studii jsme také zaznamenali vzácnou deleci chromozomu 10 a další vzácný nález – amplifikaci chromozomu 2 v časném stadiu cervikálního karcinomu (IB).
Počet publikovaných prací věnujících se molekulárně biologickému pozadí ovariálního karcinomu se v posledních letech stále zvyšuje a vzhledem k jeho málo objasněné etiopatogenezy je mu věnována stále důkladnější pozornost.
Celá řada prací je věnována výzkumu mutací genů BRCA1/2, jejichž role u dědičných karcinomů prsu a ovaria je dnes již dobře známá. Role těchto genů u sporadických karcinomů, kterých je většina, není tak docela jasná. U žen - nosiček mutovaného genu BRCA1 – se karcinom ovaria obvykle objevuje v mladším věku ve srovnání s ostatními ženami. Podle závěrů některých studií se zdá, že přítomnost mutovaného genu BRCA1 je spojena s lepším přežitím u pokročilých ovariálních karcinomů. V naší studii byla mutace genu BRCA1 prokázána u jedné pacientky, pacientka s diagnostikovaným onemocněním karcinomu ovaria ve stadiu IVB přežívá více než 5 let.
Amplifikace typické pro epiteliální ovariální nádorové buňky jsou popisovány na chromozomech 1q, 3q, 8q a 20q, delece se vyskytují především na chromozomech 4q, 13q, 16q a 18q. Typickým nálezem u pokročilých stadií je ztráta chromozomu 4. Za aberace spojené s horší prognózou jsou pokládány amplifikace 6p, 7q, 13q a delece 15q, 17p, 18q a 21q [22, 37, 43] Při nadbytku 6p je popisován častější výskyt chemorezistence [34].
Dalším významným nálezem u chemorezistentních nádorů je ztráta 13q32.1 a 8p21.1, tyto nálezy by mohly být potenciálním prediktivním markerem [25].
Byly nalezeny vztahy mezi počtem aberací a dobou celkového přežití, vyšší počet chromozomálních přestaveb je často spojen s dalším nepříznivým faktorem, kterým je nádorová diferenciace. Pacientky s tumory obsahujícími méně než 7 aberací mají delší dobu celkového přežití [45].
Inaktivace tumor supresorových genů se vyskytuje častěji než aktivace onkogenů, není zcela jasné, zda je to důsledek použitých laboratorních metod, či více obvyklého kroku v karcinogenezi. Srovnání časných stadií s pokročilými odhalilo rozdíly mezi oběma skupinami: delece se vyskytují u časných stadií častěji než amplifikace. Typické delece jsou následující: 2q, 4q, 5q, 6q, 13q a 18q. Na druhé straně, amplifikace jsou daleko častějším nálezem u pokročilých stadií – na chromozomech 3q, 8q, 11q, 12p, 17q a 20q [27, 36].
Poměrně častý nález izochromozomu 5p u některých tumorů je popisován u ovariálních tumorů spíše vzácně [32].
Rozdílné histologické typy nejsou spojovány se specifickými aberacemi; komplexní aberace jsou vzácné u mucinózních a endometroidních karcinomů. Méně aberací je popisováno u dobře diferencovaných nádorů, zatímco komplexní přestavby jsou typické pro nediferencované tumory. Serózní tumory v pokročilých stadiích obsahují dvojnásobné množství aberací ve srovnání s tumory nižších stadií [23, 24, 35]. Větší riziko recidiv je spojováno s výskytem amplifikací 1p, 10p, 20q a delecí 5q [20].
Nádory s nízkým maligním potenciálem a invazivní karcinomy se liší přítomností rozdílných aberací. Toto může souviset s faktem, že se jedná o dvě rozdílné subpopulace ovariálních nádorů [2, 14, 39].
Nejčastější aberace nalezené u borderline tumorů jsou ztráta chromozomů 17, 20q a 18p, nadbytek 12p13-q23 a nadbytek chromozomu 8 s podobnou frekvencí jako u invazivních tumorů. Není zcela jasné, zda-li tyto aberace jsou markerem časných serózních karcinomů, či ukazatelem potenciálu k progresi a rozvoji malignity v podskupině borderline tumorů [31].
Obecně srovnání borderline tumorů, benigních tumorů a maligních tumorů ukazuje, že border line tumory mají blíže k benigním než k maligním tumorům [15]. Srovnání primárních a metastatických nádorů odhalilo více aberací ve skupině primárních nádorů [8].
Cytogenetické vyšetření ovariálních nádorů v naší studii odhalilo přítomnost celé řady komplexních přestaveb, fragmentovaných chromozomů a telomerických fúzí. Počet genetických přestaveb byl signifikantně vyšší ve skupině mladších žen, i přes malý počet zkoumaných žen tento fakt může mít význam z hlediska možné predikce maligního potenciálu vyšetřovaných nádorů.
Věk není jednoznačně pokládán za nezávislý prognostický faktor, podle literárních údajů věk pacientek koreluje s delší dobou celkového přežití - toto ovšem nejspíše souvisí s vyšším počtem výskytu časných stadií, lepším PS a možnostmi radikálního chirurgického výkonu u mladších pacientek [6].
V naší studii nebyly nalezeny další korelace mezi rozsahem chromozomálních nálezů a p53 HSCORE, stadiem onemocnění, histologickým typem, léčebnou odpovědí či poklesem CA125 po léčbě. Signifikantní korelace byly nalezeny pouze mezi několika parametry histopatologického a klinického charakteru. Aktivita proliferačního markeru MIB-1 byla signifikantně vyšší u žen s vysokým p53 HSCORE.
Aktivita protilátky Ki-67 byla prokázána jako signifikantní prediktor přežití také českými autory [44]. Typ mutací genu p53 je dalším předpokládáným faktorem ovlivňujícím dobu celkového přežití u pacientek léčených pro pokročilý serózní adenokarcinom ovaria [9].
Na druhé straně, v obou námi zkoumaných skupinách byly zjištěny některé vzácnější nálezy – delece chromozomů 11p, 21p a amplifikace chromozomu 2 v buňkách cervikálních karcinomů, izolovaná balancovaná translokace t(10;15) a amplifikcae 1p, delece 19q delece 22q v buňkcáh ovariálních karcinomů. Interpretace těchto nálezů je zatím kontroverzní, je důvodem ke zkoumání uvedených aberací na molekulární úrovni.
Snaha o definování genového profilu nádorů s vysokým maligním potenciálem a molekulárním předpokladem k mestastázování, recidivám či chemorezistenci, je patrna z celé řady prací, které se této problematice věnují. Nadměrná exprese genů kódujících růstové faktory, jejich receptory a regulační proteiny bývá spojována s vyšším maligním potenciálem, a to také u některých nádorů histologicky hodnocených jako borderline.Validace těchto nálezů je předopokladem k jejich implementaci do klinické praxe prediktivní onkologie [5, 13, 33, 38, 44].
ZÁVĚR
Analýzy provedené u 20 nádorů cervixů odhalily několik chromozomálních aberací. Nejčastěji byly zaznamenány amplifikace na chromozomech 3q a 5p, dále delece 13q. Tyto nálezy jsou v souladu s nálezy popsanými v literatuře. Nález většího množství chromozomálních aberací byl sice zaznamenán u pokročilejších stadií, nebyl však statisticky průkazný. Byl zachycen zajímavý nález výrazné delece chromozomu 10, která je v literatuře uváděná ojediněle a unikátní nález amplifikace chromozomu 2 v raném stadiu onemocnění.
Analýzy provedené u 60 nádorů ovaria zaznamenaly řadu chromozomálních přestaveb od izolované balancované translokace t(10;15) ve dvou případech až po složité strukturální přestavby pokročilých stadií zachycených cytogeneticky. Pacientky s velkou chromozomální přestavbou byly statisticky významně mladší. CGH analýzou byly častěji nalezeny delece než amplifikace. Byly zaznamenány charakteristické amplifikace pro ovariální karcinom na chromozomech 1q, 3q a 20q, dále delece na chromozomech 4, 18 a 19q. Ve 36 % případů byla zaznamenána delece 22q, která je v litaratuře popisována ojediněle.
U cervikálních karcinomů se v námi testovaném souboru testováním kvantitativních proměnných (věk, MIB-1 HSCORE a p53 HSCORE) pomocí analýzy rozptylu (ANOVA) s dělením do skupin podle 6 kvalitativních parametrů (stadium, histotyp, grading, response rate, genetická přestavba a p53) podařilo jako statisticky významné prokázat korelace mezi věkem, stadiem, gradingem a p53.
U ovariálních karcinomů se v námi testovaném souboru testováním kvantitativních proměnných (věk, hodnota CA 125 před léčbou, MIB-1 HSCORE, p53 HSCORE) pomocí analýzy rozptylu (ANOVA) s dělením do skupin podle 9 kvalitativnéch parametrů (stadium, histotyp, grading, operační reziduum, provedení lymfadenektomie, response rate, pokles CA 125 po léčbě, p53, genetická přestavba) jako statisticky významné podařilo prokázat korelace mezi stadiem, věkem, gradingem, MIB-1, p53, velikostí chromozomální přestavby. Předložené výsledky představují projekt systematicky se věnující výzkumu chromozomálních aberací u gynekologických zhoubných nádorů a jejich korelaci s dostupnými parametry molekulárně biologické a klinické povahy.
Při srovnání nálezů u cervikálních a ovariálních karcinomů byly zjištěny rozdílné nálezy jak z kvantitativního, tak kvalitativního hlediska, což podporuje tezi o rozdílech v karcinogenezi těchto zhoubných nádorů.
Statistickým vyhodnocením sledovaných kvantitativních proměnných byly mezi některými z nich prokázané jako statisticky významné výše popsané závislosti.
Bylo zjištěno, že ovariální karcinomy mladších žen se vyznačují významnějšími nálezy jak na úrovni cytogenetických změn, tak i z hlediska aktivity proliferačních markerů, což obvykle koreluje s horším klinickým průběhem.
Získané poznatky z cytogenetiky gynekologických maligních nádorů představují východisko pro podrobnější výzkum na molekulární úrovni.
Práce vznikla za podpory grantu IGA NH/7659-3 MZ ČR a VZ MSMT 0021620808.
MUDr. Natalie Jančárková
Gynekologicko-porodnická klinika
1. LF UK a VFN
Apolinářská 18
128 08 Praha 2
Zdroje
1. Allen, DG., White, DJ., Hutchins, AM., et al. Progressive genetic aberrations detected by comparative genomic hybridization in squamous cell cervical cancer. Br J Cancer, 2000, 83, p. 1659-1663.
2. Arnold, N., Hagele, L., Walz, L., et al. Overpresentation of 3q and 8q material and loss of 18q material are recurrent findings in advanced human ovarian cancer. Genes Chromosomes Cancer 1996, 16, p. 46-54.
3. Atkin, NB. Cytogenetics of carcinoma of the cervix uteri: a review. Cancer Genet Cytogenet, 1997, 95, 1, p. 33-39.
4. Bartoňková, H., Foretová, L., Helmichová, E., et al. Doporučené zásady péče o nemocné s nádory prsu a vaječníku a zdravé osoby se zárodečnými mutacemi genů BRCA1 a BRCA2. Klin Onkol, 2003, 16, 1, s. 28-34.
5. Biade, S., Marinucci, M., Schick, J., et al. Gene expression profiling of human ovarian tumors. Br J Cancer, 2006, 95, 8, p. 1092-1100.
6. Bozas, G., Dimopoulos. MA., Kastritis, E., et al. Young age is associated with favorable characteristics but is not an independent prognostic factor in patients with epithelial ovarian cancer : a single institution experience. Oncology, 2006, 70, 4, p. 265-272.
7. Dellas, A., Torhorst, J., Jiang, F., et al. Prognostic value of genomic alterations in invasive cervical squamous cell carcinoma of clinical stage IB detected by comparative genomic hybridization. Cancer Res, 1999, 59, p. 3475-3479.
8. Fishman, A., Shalom-Paz, E., Fejgin, M., et al. Comparing the genetic changes detected in the primary and secondary tumor sites of ovarian cancer using comparative genomic hybridization. Int J Gynecol Cancer, 2005, 15, p. 261-266.
9. Gadducci, A., Di Cristofano, C., Zavaglia, M., et al. P53 gene status in patients with advanced serous epithelial ovarian cancer in relation to response to paclitaxel - plus platinum-based chemotherapy and long-term clinical outcome. Anticancer Res, 2006, 26, 1B, p. 687-693.
10. Gospodarowicz, MK., Henson, DE., Hutter, RVP., eds. Prognostic factors in cancer. 2nd ed. New York: Wiley-Liss, 2001.
11. Guo, Z., Hu, X., Afink, G., et al. Comparison of chromosome 3p deletions between cervical precancers synchronous with and without invasive cancer. Int J Cancer, 2000, 86, p. 518-523.
12. Harris, CP., Lu, XY., Narayan, G., et al. Comprehensive molecular cytogenetic characterization of cervical cancer cell lines. Genes Chromosomes Cancer, 2003, 36, 3, p. 233-241.
13. Hartmann, LC., Lu, KH., Linette, GP., et al. Gene expression profiles predict early relapse in ovarian cancer after platinum-paclitaxel chemotherapy. Clin Cancer Res, 2005, 11, 6, p. 2149-2155.
14. Hauptmann, S., Denkert, C., Koch, I., et al. Genetic alterations in epithelial ovarian tumors analyzed by comparative genomic hybridization. Hum Pathol, 2002, 33, p. 632-641.
15. Helou, K., Padilla-Nash, H., Wangsa, D., et al. Comparative genome hybridization reveals specific genomic imbalances during the genesis from benign through borderline to malignant ovarian tumors. Cancer Genet Cytogenet, 2006, 170, 1, p. 1-8.
16. Heselmeyer-Haddad, K., Janz, V., Castle, PE., et al. Detection and genomic amplification of the human telomerase gene (TERC) in cytologic specimens as a genetic test for the diagnosis of cervical dysplasia. Am J Pathol, 2003, 163, p. 1405-1416.
17. Heselmeyer-Haddad, K., Sommerfield, K., White, NM., et al. Genomic amplification of the human telomerase gene (TERC) in pap smears predicts the development of cervical cancer. Am J Pathol, 2005, 166, 4, p. 1229-1238.
18. Heselmeyer, K., Macville, M., Schrock, E., et al. Advanced-stage cervical carcinomas are defined by a recurrent pattern of chromosomal aberrations revealing high genetic instability and a consistent gain of chromosome arm 3q. Genes Chromosomes Cancer, 1997, 19, p. 233-240.
19. Hidalgo, A., Schewe, C., Petersen, S., et al. Human papilloma virus status and chromosomal imbalances in primary cervical carcinomas and tumor cell lines. Eur J Cancer, 2000, 36, p. 542-548.
20. Hu, J., Khanna, V., Jones, MM., Surti, U. Comparative study of primary and recurrent serous ovarian carcinomas: comparative genomic hybridization analysis with a potential application for prognosis. Gynecol Oncol, 2003, 89, p. 369-375.
21. Huang, NF., Gupta, M., Varghese, S., et al. Detection of numerical chromosomal abnormalities in epithelial ovarian neoplasmas by fluorescence in situ hybridization (FISH) and a review of the current literature. Appl Immunohistochem Mol Morphol, 2002, 10, 2, p. 187-193.
22. Iwabuchi, H., Sakamoto, M., Sakunaga, H., et al. Genetic analysis of benign, low-grade and high-grade ovarian tumors. Cancer Res, 1995, 55, p. 6172-6180.
23. Kiechle, M., Jacobsen, A., Schwarz-Boeger, U., et al.Comparative genomic hybridization detects genetic imbalances in primary ovarian carcinomas as correlated with grade of differentiation. Cancer, 2001, 91, p. 534-540.
24. Kim, GJ., Kim, JO., Hong, EK., et al. Detection of genetic alterations in Korean ovarian carcinomas by degenerate oligonucleotide primed polymerase-chain reaction – comparative genomic hybridization. Cancer Genet Cytogenet, 2003, 147, p. 23-27.
25. Kim, SW., Kim, JW., Kim, YT., et al. Analysis of chromosomal changes in serous ovarian carcinoma using high-resolution array comparative genomic hybridization: Potential predictive markers of chemoresistant disease. Genes Chromosomes Cancer, 2006, 46, 1, p. 1-9.
26. Kirchhoff, M., Rose, H., Petersen, BL., et al. Comparative genomic hybridization reveals a recurrent pattern of chromosomal aberrations in severe dysplasia/carcinoma in situ of the cervix and in advanced-stage cervical carcinoma. Genes Chromosomes Cancer, 1999, 24, p. 144-150.
27. Mark, HF., Afify, AM., Werness, BA., et al. Trisomy 8 in stage I and stage III ovarian cancer detected by FISH. Exp Mop Pathol, 1999, 66, 1, p. 76-81.
28. Mc Carty, KS. Jr., Miller, LS., Cox, EB., et al. Estrogen receptor analyses: Correlation of biochemical and immunohistochemical methods using monoclonal antireceptor antibodies. Arch Pathol Lab Med, 1985, 109, p. 716-721.
29. Mian, C., Bancher, D., Kohlberger, P., et al. Fluorescence in situ hybridization in cervical smears: detection of numerical aberrations of chromosomes 7, 3, X and relationship to HPV infection. Gynecol Oncol, 1999, 75, p. 41-46.
30. Mitelman, F. (ed). An International System for Human Cytogenetic Nomenclature. Basel: S. Karger, 1995.
31. Osterberg, L., Akeson, M., Levan, K., et al. Genetic alterations of serous borderline tumors of the ovary compared to stage I serous ovarian carcinomas. Cancer Genet Cytogenet, 2006, 167, 2, p. 103-108.
32. Panani, AD., Roussos, C. Non-random chromosomal changes in ovarian cancer: i(5p) a novel recurrent abnormality. Cancer Letters, 2006, 235, 1, p. 130-135.
33. Santin, AD., Zhan, F., Bellone, S., et al. Gene expression profiles in primary ovarian serous papillary tumors and normal ovarian epithelium: identification of candidate molecular markers for ovarian cancer diagnosis and therapy. Int J Cancer, 2004, 112, 1, p. 14-25.
34. Santos, GdaC., Zielenska, M., Prasad, M., Squire, JA. Chromosome 6p amplification and cancer progression. J Clin Pathol, 2007, 60, p. 1-7.
35. Sham, JS, Tang, TC., Fang, Y., et al. Recurrent chromosome alterations in primary ovarian carcinomas in Chinese women. Cancer Genet Cytogenet, 2002, 133, p. 39-44.
36. Shridhar, V., Lee, J., Pandita, A., et al. Genetic analysis of early - versus late-stage ovarian tumors. Cancer Res, 2001, 61, p. 5895-5904.
37. Sonoda, G., Palazzo, J., du Manoir, S., et al. Comparative genomic hybridization detects frequent overexpression of chromosomal material from 3q26, 8q24 and 20q13 in human ovarian carcinomas. Genes Chromosomes Cancer, 1997, 20, 4, p. 320-328.
38. Spentzos, D., Levine, DA., Kolia, S., et al. Unique gene expression profile based on pathological response in epithelial ovarian cancer. J.Clin Oncol, 2005, 23, 31, p. 7911-7918.
39. Staebler, A., Heselmeyer-Haddad, K., Bell, K., et al. Micropapillary serous carcinoma of the ovary has distinct patterns of chromosomal imbalances by comparative genomic hybridization compared with atypical proliferative serous tumors and serous carcinomas. Hum Pathol, 2002, 33, p. 47-52.
40. Stewart, BW., Kleihues, P. World Cancer Report. Lyon: IARCPress, 2003.
41. Teixeira, NR. Combined classical and molecular cytogenetic analysis of cancer. Eur J Cancer, 2002, 38, 12, p. 1580-1584.
42. Thein, A., Trkova, M., Fox, M., Parrington, J. The application of comparative genomic hybridization to previously karyotyped cervical cancer cell lines. Cancer Genet Cytogenet, 2000, 116, p. 59-65.
43. Tibiletti, MA., Bernasconi, B., Taborelli, M., et al. Genetic and cytogenetic observations among different types of ovarian tumors are compatible with a progression model underlying ovarian tumorigenesis. Cancer Genet Cytogenet, 2003, 146, p. 145-153.
44. Tomsová, M., Melichar, B., Sedláková, I., Nová, M. Prognostické markery u ovariálního karcinomu – retrospektivní studie. Čes Patol, 2005, 41, 2, s. 51-59.
45. Umayahara, K., Numa, F., Inokuma, A., et al. Genetic alterations related to lymph node metastasis and peritoneal dissemination in epithelial ovarian cancer. Oncol Rep, 2002, 9, p. 1115-1119.
46. Umayahara, K., Numa, F., Suehiro, Y., et al. Comparative genomic hybridization detects genetic alterations during early stages of cervical cancer progression. Genes Chromosomes Cancer, 2002, 33, p. 98-102.
47. Wamunyokoli, FW., Bonome, T., Lee, JY., et al. Clin Cancer Res, 2006, 12, 3, p. 690-700.
48. Zimonjic, DB., Simpson, S., Popescu, NC., DiPaolo, JA. Molecular cytogenetic of human papillomavirus-negative cervical carcinoma cell lines. Cancer Genet Cytogenet, 1995, 82, 1, p. 1-8.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2008 Číslo 2- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Poranění velkých cév v gynekologické endoskopii
- Význam sonografie a hysteroskopie u suspektních nálezů na endometriu menopauzálních žen
- Vliv idiopatického střevního zánětu na interval potřebný pro početí pacientek
- Císařský řez a anální inkontinence
- Indukce potratů ve II. trimestru na Gynekologicko porodnické klinice FN na Bulovce
- Adrenokortikálne choroby v gravidite
- NOVÉ KNIHY
- Výsledky kombinované léčby endometriózy v šestiletém období (2001-2007) na oddělení gynekologie a minimálně invazivní chirurgie Nemocnice Na Homolce Praha
- NOVÉ KNIHY
- Mrtvorozenost v České republice v roce 2005II. Vzájemné vztahy některých evidovaných údajů
- Perzistující trofoblastická nemoc v Centru pro trofoblastickou nemoc v ČR v letech 1955 – 2007
- Význam chromozomálních změn ve vztahu k prognostickým faktorům u zhoubných nádorů vaječníku a děložního hrdla
- Význam metylace v genomu lidského papillomaviru 16 u karcinomu děložního hrdla
- Monofolikulární vývoj – cíl indukce ovulace folitropinem beta pro intrauterinní inseminaci
- Hladiny prostaglandinu E2 , (PGE2) v ovulačním hlenu u spontánně potrácejících pacientek
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Indukce potratů ve II. trimestru na Gynekologicko porodnické klinice FN na Bulovce
- Perzistující trofoblastická nemoc v Centru pro trofoblastickou nemoc v ČR v letech 1955 – 2007
- Význam sonografie a hysteroskopie u suspektních nálezů na endometriu menopauzálních žen
- Adrenokortikálne choroby v gravidite
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



