-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Srovnání hladin prolaktinu, fT3 a fT4 ve folikulární tekutině žen s poruchou plodnosti a zdravých plodných dárkyň oocytů
Comparison of prolactin, free T3 and free T4 levels in the follicular fluid of infertile women and healthy fertile oocyte donors
Objective:
Follicular fluid (FF) provides an important microenvironment for the development of oocytes. The biochemical composition of the FF plays critical role in the oocyte competence. The aim of our study was to compare the levels of selected hormones in FF of infertile women and healthy fertile oocyte donors.Design:
Retrospective comparative study.Setting:
Department of Histology and Embryology, Faculty of Medicine in Pilsen, Charles University in Prague; Department of Gynecology and Obstetrics, Charles University and University Hospital in Pilsen; Institute of Reproductive Medicine and Endocrinology, IVF Centers Prof. Zech, Plzeň.Methods:
Levels of prolactin, free T3 and free T4 hormones in the FF of 146 women were analyzed. We have analysed FF of 74 infertile patients (mean age 31 years, SD = 4.65) and 72 healthy fertile oocyte donors (mean age 26 years, SD = 4.44). Only blood free samples were studied after pooling of all FF samples each patient. Levels of hormones were determined using ECLIA method (Electro-Chemi-Luminiscent Immunoassay) on the Cobas e411.Results:
Results showed statistically significantly higher levels of prolactin (p=0.0006) and free T4 hormone (p=0.0246) in FF of infertile women in comparison to the group of healthy fertile oocyte donors.Conclusion:
Our study confirms the presence of prolactin and thyroid hormones in FF and it can be suggested that they play a key role in the regulation of reproductive processes. The study of FF from donors and their detailed comparison with infertile patients with various gynaecological causes of infertility has great value for better understanding of regulatory mechanisms of fertility.Key words:
follicular fluid, prolactin, free T4, infertility, donor oocytes.
Autori: M. Čedíková 1,2; V. Babuška 3; D. Rajdl 4; N. H. Zech 5; V. Kališ 6; M. Králíčková 1,2,6
Pôsobisko autorov: Ústav histologie a embryologie, LF UK, Plzeň, přednostka doc. MUDr. M. Králíčková, Ph. D. 1; Biomedicínské centrum, LF UK, Plzeň, vědecký ředitel doc. MUDr. M. Štengl, Ph. D. 2; Ústav lékařské chemie a biochemie, LF UK, Plzeň, přednosta prof. MUDr. J. Racek, DrSc. 3; Ústav klinické biochemie a hematologie, LF UK a FN, Plzeň, přednosta prof. MUDr. J. Racek, DrSc. 4; Institut reprodukční medicíny a endokrinologie, IVF Centra Prof. Zech, Plzeň, přednosta univ. prof. dr. med. N. H. Zech 5; Gynekologicko-porodnická klinika, LF UK a FN, Plzeň, přednosta doc. MUDr. Z. Novotný, CSc. 6
Vyšlo v časopise: Ceska Gynekol 2012; 77(5): 471-476
Súhrn
Cíl studie:
Folikulární tekutina (FT) zajišťuje charakteristické a nezastupitelné mikroprostředí, které ovlivňuje vývoj oocytu. Biochemické složení FT má zásadní vliv na vývojový potenciál vajíčka. Cílem naší práce bylo srovnání hladin vybraných hormonů v FT žen s poruchou plodnosti a zdravých plodných dárkyň oocytů.Typ studie:
Retrospektivní komparativní studie.Název a sídlo pracoviště:
Ústav histologie a embryologie, LF UK a FN v Plzni; Gynekologicko-porodnická klinika FN a LF UK v Plzni; Institut reprodukční medicíny a endokrinologie, IVF Centra Prof. Zech, Plzeň.Metodika:
Hladiny prolaktinu, volného T3 (fT3) a volného T4 (fT4) hormonu byly analyzovány v FT u obou sledovaných skupin. Celkem jsme vyšetřili 146 žen – 74 pacientek léčených pro neplodnost (průměrný věk 31 let, SD = 4,65) a 72 zdravých plodných žen, dárkyň oocytů (průměrný věk 26 let, SD = 4,44). U každé ženy byly použity vzorky FT bez příměsi krve a ze všech folikulů dohromady, tedy ze společného poolu. Hladiny hormonů byly stanoveny pomocí metodiky ECLIA (elektrochemiluminiscenční imunoanalýza) na přístroji Cobas e411.Výsledky:
Výsledky analýz prokázaly statisticky signifikantně vyšší hladiny prolaktinu (p = 0,0006) a volného T4 hormonu (p=0,0246) u žen s poruchou plodnosti oproti skupině zdravých plodných dárkyň oocytů.Závěr:
Naše studie potvrzuje přítomnost prolaktinu a tyroideálních hormonů ve FT a naznačuje jejich klíčovou roli v regulaci reprodukčních procesů. Další studium dárkyň oocytů a jejich podrobnější srovnání s neplodnými pacientkami s různými gynekologickými příčinami poruch plodnosti bude přínosem pro objasnění patofyziologických mechanismů regulujících plodnost.Klíčová slova:
folikulární tekutina, prolaktin, volný T4, neplodnost, dárkyně ovocytů.ÚVOD
V současné době trpí neplodností 10–15 % párů v reprodukčním věku. Ačkoli se metody léčby neustále zdokonalují, přibližně 10 % párů nepomůže k otěhotnění žádná z metod asistované reprodukce. Dokonalejší pochopení regulačních procesů reprodukce umožní v budoucnu zvyšování úspěšnosti léčby neplodnosti, a to nejen metodami asistované reprodukce. Z toho důvodu je jednou z cest snaha o lepší pochopení a identifikaci faktorů, jež regulují vývojový potenciál oocytu.
Folikulární tekutina (FT) zajišťuje charakteristické a nezastupitelné mikroprostředí, ve kterém dochází k vývoji oocytu. Na jejím vzniku se podílí jednak přestup složek krevní plazmy přes folikulární bariéru a zároveň sekreční aktivita buněk téky a granulózy [7]. Biochemické složení FT hraje zásadní roli pro kvalitu oocytu, zvláště pro jeho schopnost fertilizace a následný vývoj embrya.
Ačkoliv hodnocení kvality oocytu při léčbě neplodnosti metodami asistované reprodukce dnes nejčastěji probíhá metodami založenými na morfologické klasifikaci folikulu, komplexu cumulus – oocyt, polárního tělíska nebo dělicího vřeténka [19], experimentálně (a také mnohými retrospektivními studiemi) bylo prokázáno, že pro stanovení vývojového potenciálu bude možno využívat nejrůznější biochemické a molekulárně biologické markery. Mezi vhodné indikátory kvality oocytu byly v literatuře v minulosti zařazeny některé tzv. vnitřní markery – charakter mitochondrií oocytu či aktivita glukóza-6-fosfátdehydrogenázy 1 v cytoplazmě, ale také faktory zevní (apoptóza folikulárních buněk či hodnoty některých působků v séru – např. rodiny TGFß, anti-mülleriánského hormonu, inhibinu B atd.) [1, 2, 3, 4, 6, 8, 12, 13, 17, 18, 20, 21].
V ose hypotalamus-hypofýza-gonády / štítná žláza probíhají vzájemné interakce před otěhotněním i v průběhu těhotenství – jednak přímým působením tyroidních hormonů na ovaria a dále nepřímo skrze vliv na sex hormon-binding globulin (SHBG), prolaktin a gonadotropin-releasing hormon.
Prolaktin je hormon syntetizovaný adenohypofýzou a k jeho vylučování do oběhu dochází intermitentně. Cílovým orgánem pro jeho působení je mléčná žláza. Je tvořen 198 aminokyselinami, jeho molekulová hmotnost je přibližně 22–23 kDa a v séru se vyskytuje ve třech různých formách. Biologicky a imunologicky aktivní monomerická forma převažuje (asi 80 %), 5–20 % tvoří biologicky neaktivní forma dimeru a 0,5–5 % je přítomno jako tetramer, který má slabou biologickou aktivitu. Zvýšené hladiny prolaktinu mají inhibiční účinky na steroidogenezi ovarií a rovněž na produkci a sekreci hypofyzálních gonadotropinů. Během těhotenství narůstá koncentrace prolaktinu pod vlivem zvyšující se produkce estrogenu a progesteronu.
Hyperprolaktinémie může být příčinou poruch fertility u mužů i žen. Stanovení prolaktinu je užíváno při diagnostice anovulárního cyklu, hyperprolaktinemické amenorey a galaktorey, gynekomastie a azoospermie. Prolaktin je také stanovován při podezření na karcinom prsu a podvěsku mozkového.
Trijodtyronin je jedním z hormonů štítné žlázy přítomným v séru. Hlavní část celkového trijodtyroninu je vázána na transportní proteiny (tyroxin vázající protein, TBG), prealbumin, albumin) a aktivní formou je pak volný trijodtyronin (fT3). Hormon štítné žlázy tetrajodtyronin (tyroxin, T4) je fyziologickou částí regulační smyčky štítné žlázy s vlivem na celý metabolismus.
Sérové hladiny prolaktinu i hormonů tyroideálních prokazatelně ovlivňují ovariální funkce, nicméně v literatuře není zatím popsáno, jak souvisí hladiny těchto hormonů v FT s ovariální činností, či dokonce plodností ženy.
Obě formy, volný trijodtyronin i tetrajodtyronin, byly detekovány ve FT [21], ale jejich význam pro vývoj a kvalitu oocytu nebyl zatím objasněn.
SOUBOR ŽEN A METODIKA
Studovaný soubor tvořilo 146 žen, z toho bylo 74 pacientek (průměrný věk 31 let, SD = 4,65) léčených pro neplodnost v Institutu reprodukční medicíny a endokrinologie – IVF Centra Prof. Zech. Kontrolní skupinu tvořilo 72 zdravých plodných žen, dárkyň oocytů (průměrný věk byl 26 let, SD = 4,44). Všechny sledované ženy měly normální hladiny prolaktinu i hormonů štítné žlázy v krvi. Po detailním seznámení s problematikou a po podpisu informovaného souhlasu byla ženám odebírána FT v době odběru oocytů v průběhu jejich léčby neplodnosti metodami asistované reprodukce. Vyšetřovány byly tzv. pooly FT, tedy směs ze všech folikulů, u nichž nedošlo ke kontaminaci krví v průběhu odběru oocytů. Ve FT byly stanoveny hladiny prolaktinu, volného T3 a volného T4. Metoda stanovení hormonů prolaktinu a volného T3 a T4 byla založena na sendvičovém principu elektrochemiluminiscenční imunoanalýzy (ECLIA) s využitím kitů Prolactine II, kitem FT3 a FT4 (ROCHE Diagnostics, ČR) na přístroji Cobas e411.
Stanovení Elecsys Prolactin II využívá dvě monoklonální protilátky, speciálně směrované proti lidskému prolaktinu a metoda stanovení volného T3 i volného T4 využívající testu Elecsys FT3 a FT4 je založena na využití specifické protilátky proti T3 a T4, které jsou obě značené ruteniovým komplexem.
Tato studie byla schválena etickou komisí LF UK v Plzni a všechny pacientky podepsaly informovaný souhlas.
Statistické hodnocení
Výsledky byly statisticky hodnoceny pomocí Wilcoxonova neparametrického testu (nepárová varianta) a dále analýzou rozptylu (ANOVA, post hoc analýza pomocí Tukeyovy metody mnohonásobného porovnávání). Hodnoty p < 0,05 byly považovány za statisticky signifikantní.
VÝSLEDKY
Porovnávány byly hladiny prolaktinu, volného T3 a volného T4 ve skupinách žen léčených pro neplodnost a kontrolních plodných dárkyň oocytů. Z tabulky 1 a grafů 1 a 3 je zřejmé, že u neplodných žen byly naměřeny signifikantně vyšší hladiny prolaktinu (p = 0,0006) i fT4 hormonu (p = 0,0246), avšak koncentrace fT3 se mezi skupinami významně nelišily (graf 2).
Graf 1. Srovnání hladin prolaktinu u skupiny neplodných a kontrol 
Graf 2. Srovnání hladin volného T3 hormonu u skupiny neplodných a kontrol 
Graf 3. Srovnání hladin volného T4 hormonu u skupiny neplodných a kontrol 
Tab. 1. Hladiny prolaktinu, volného T3 a volného T4 ve folikulární tekutině neplodných žen a kontrolní skupiny zdravých dárkyň oocytů (hodnoty jsou uvedeny jako medián a interkvartilové rozpětí) 
Protože plodnost žen je silně ovlivněna věkem a protože naše skupiny plodných a neplodných se liší věkovým složením, porovnali jsme hladiny hormonů mezi plodnými a neplodnými ženami ve stejných věkových obdobích. Mezi skupinami plodných a neplodných žen ve věkovém rozmezí 20 až 29 let je statisticky signifikantní rozdíl v hladinách prolaktinu v FT (p = 0,026*) a mezi skupinami ve věkovém rozmezí 30-39 let je statisticky signifikantní rozdíl v hladinách prolaktinu (p = 0,0256) i fT4 (p = 0,0175). Výsledky jsou shrnuty v tabulce 2.
Tab. 2. Hladiny prolaktinu, volného T3 a volného T4 ve folikulární tekutině neplodných žen a kontrolní skupiny zdravých dárkyň oocytů v závislosti na věku (hodnoty jsou uvedeny jako medián a interkvartilové rozpětí) 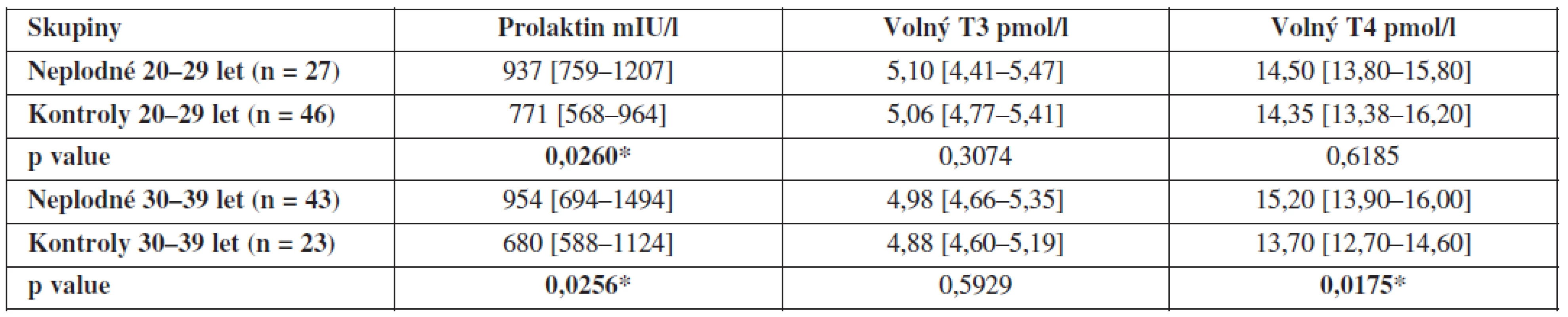
Dále jsme porovnali hladiny hormonů uvnitř obou skupin v závislosti na věku, ty se však již signifikantně neliší – výsledky jsou shrnuty v tabulkách 3 a 4.
Tab. 3. Hladiny prolaktinu, volného T3 a volného T4 ve folikulární tekutině neplodných žen v závislosti na věku (hodnoty jsou uvedeny jako medián a interkvartilové rozpětí) 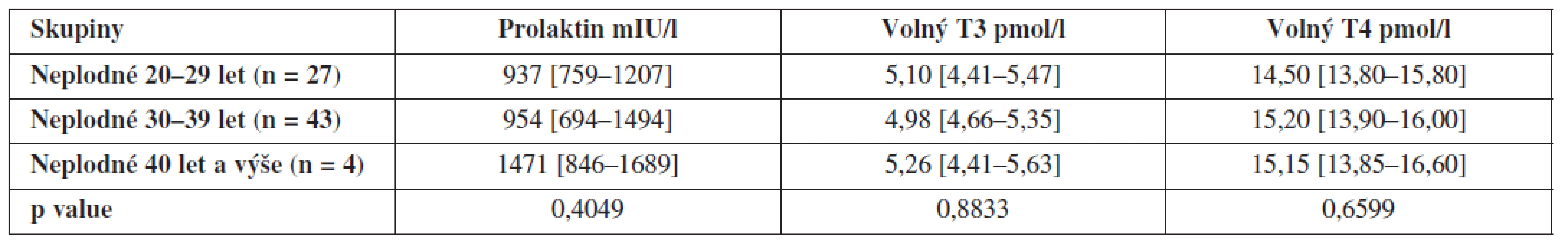
Tab. 4. Hladiny prolaktinu, volného T3 a volného T4 ve folikulární tekutině kontrolní skupiny zdravých dárkyň oocytů v závislosti na věku (hodnoty jsou uvedeny jako medián a interkvartilové rozpětí). 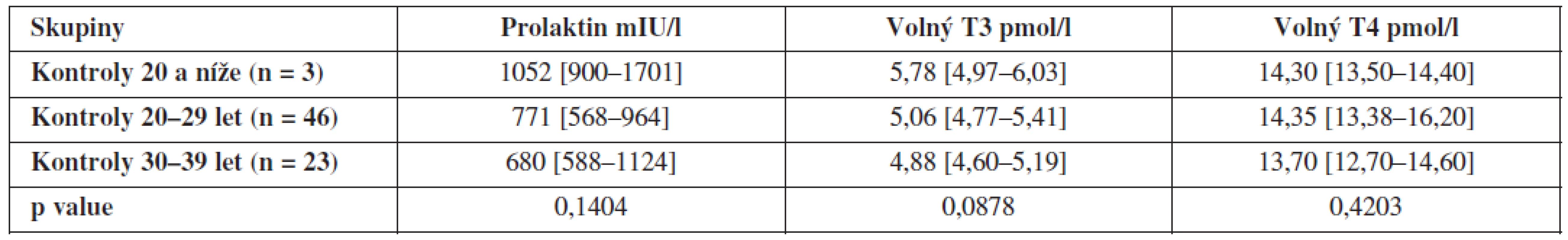
DISKUSE
Role prolaktinu v FT nebyla plně vysvětlena a v literatuře neexistují ani dostatečná data o vztahu k hladinám prolaktinu v séru [10, 11]. Skutečnost, že zdravé plodné dárkyně mají signifikantně nižší hladiny prolaktinu v FT, nehledě na věkovou skupinu, v níž hladiny sledujeme, naznačuje, že prolaktin bude pravděpodobně významným regulačním faktorem pro vývojový potenciál oocytu. Poznání patofyziologického mechanismu, kterým prolaktin k regulaci přispívá, opět může vést ke zvýšení individualizace léčby neplodnosti.
Náš překvapivý nález statisticky signifikantně vyšších hladin fT4 hormonu u neplodných žen se podle našeho mínění odvíjí od faktu, že mnoho našich pacientek, jež byly léčeny pro neplodnost a analyzovány v této studii, mělo podle anamnestických údajů diagnostikovánu subklinickou hypotyreózu a užívalo substituční terapii. V našich podmínkách je screening tyroideálních dysfunkcí doporučován široké škále pacientek léčených pro neplodnost – všem s anamnézou hyper - či hypotyroideální poruchy, ženám s diabetem typu 1 či s jakoukoliv jinou autoimunitní poruchou, ženám po léčbě maligního onemocnění s prodělanou radioterapií v oblasti hlavy či krku atd. Tyroideální onemocnění před otěhotněním i v průběhu těhotenství vyžaduje speciální management s ohledem na změny tyroideálních funkcí v těhotenství [16]. Ačkoliv se v současné době endokrinology doporučený postup pravděpodobně velmi blíží optimálnímu nastavení substituční terapie, další poznání toho, jak se hladiny fT4 promítají ze séra do FT a jak pak tyto hladiny ovlivňují vývojový potenciál oocytu, jistě může přispět k ještě citlivějšímu a více personalizovanému způsobu léčby.
Vztahy sérových hormonálních hladin a hladin hormonů v FT jsou komplexní a jejich regulace i role jsou doposud ne zcela jasné [5, 9, 14]. Další studium dárkyň oocytů a jejich podrobnější srovnání s neplodnými pacientkami s různými gynekologickými příčinami poruch plodnosti bude přínosem pro objasnění patofyziologických mechanismů regulujících plodnost a také ovlivňujících úspěšnost při léčbě neplodnosti.
ZÁVĚR
Naše studie potvrzuje přítomnost prolaktinu a tyroideálních hormonů v FT a naznačuje jejich klíčovou roli v regulaci reprodukčních procesů. Neplodné ženy mají statisticky významně vyšší hladiny PRL v FT. Hormonální složka FT hraje významnou úlohu ve vývoji oocytu, a proto kompletní znalost biochemického složení FT a poznání role jednotlivých složek bude v budoucnu hrát roli v poznání zatím nejasných patofyziologických mechanismů neplodnosti i faktorů, jež ovlivňují úspěšnost její léčby.
Naše předložené výsledky jsou založeny na analýzách poolů FT, hodláme je ale dále zpřesnit sledováním hladin prolaktinu v monofolikulárních vzorcích. Hladiny prolaktinu budeme dále kolerovat s dosaženými pregrancy rate, čímž by se prolaktin ve FT mohl stát jedním z prognostických markerů.
Tato studie je podporována projektem OP VaVpI PO 2 Biomedicínské centrum CZ.1.05/2.1.00/03.0076, grantem GA UK 696212 a projekty specifického vysokoškolského výzkumu (SVV 264 808 a 264 804).
MUDr. Miroslava Čedíková
Ústav histologie a embryologie LF UK
Karlovarská 48
301 00 Plzeň
e-mail: miroslava.cedikova@lfp.cuni.cz
Zdroje
1. Anifandis, G., Koutselini, E., Stefanidis, I., et al. Serum and follicular fluid leptin levels are correlated with human embryo quality. Reproduction, 2005, 130, 6, p. 917–921.
2. Asimakopoulos, B., Koster, F., Felberbaum, R., et al. Intrafollicular and circulating concentrations of leptin do not predict the outcome in IVF-ICSI cycles. Reprod Sci, 2009, 16, 1, p. 113–119.
3. Asimakopoulos, B., Abu-Hassan, D., Metzen, E., et al. The levels of steroid hormones and cytokines in individual follicles are not associated with the fertilization outcome after intracytoplasmic sperm injection. Fertil Steril, 2008, 90, 1, p. 60–64.
4. Asimakopoulos, B., Nikolettos, N., Papachristou, DN., et al. Follicular fluid levels of vascular endothelial growth factor and leptin are associated with pregnancy outcome of normal women participating in intracytoplasmic sperm injection cycles. Physiol Res, 2005, 54, 3, p. 263–270.
5. Baka, S., Malamitsi-Puchner, A. Novel follicular fluid factors influencing oocyte developmental potential in IVF: a review. Reprod Biomed Online, 2006, 12, 4, p. 500–506.
6. Forges, T., Monnier-Barbarino, P., Alberto, JM., et al. Impact of folate and homocysteine metabolism on human reproductive health. Hum Reprod Update, 2007, 13, 3, p. 225–238.
7. Fortune, JE. Ovarian follicular growth and development in mammals. Biol Reprod, 1994, 50, 2, p. 225–232.
8. Fried, G., Remaeus, K., Harlin, J., et al. Inhibin B predicts oocyte number and the ratio IGF-I/IGFBP-1 may indicate oocyte quality during ovarian hyperstimulation for in vitro fertilization. J Assist Reprod Genet, 2003, 20, 5, p. 167–176.
9. Gürbüz, B., Yalti, S., Ficicioglu, C., TasĢdemir, S. The relation of serum and follicular fluid leptin and ovarian steroid levels in response to induction of ovulation in in vitro fertilization cycles. Eur J Obstet Gynecol Reprod Biol, 2005, 118, 2, p. 214–218.
10. Kamel, MA., Zabel, G., Bernart, W., et al. Comparison between prolactin, gonadotrophins and steroid hormones in serum and follicular fluid after stimulation with gonadotrophin-releasing hormone agonists and human menopausal gonadotrophin for an in-vitro fertilization programme. Hum Reprod, 1994, 9, 10, p. 1803–1806.
11. Lebedeva, IY., Denisenko, YY., Lebedev, VA., Kuzmina, TI. Prolactin in follicular fluid and intracellular store calcium in follicular cells are related to morphological signs of ovarian follicle atresia in cows: work in progress. Theriogenology, 1998, 49, 3, p. 509–519.
12. Lédée, N., Lombroso, R., Lombardelli, L., et al. Cytokines and chemokines in follicular fluids and potential of the corresponding embryo: the role of granulocyte colony-stimulating factor. Hum Reprod, 2008, 23, 9, p. 2001–2009.
13. Lewicka, S., von Hagens, C. Hettinger, U., et al. Cortisol and cortisone in human follicular fluid and serum and the outcome of IVF treatment. Hum Reprod, 2003, 18, 8, p. 1613–1617.
14. Park, DW., Yang, KM. Hormonal regulation of uterine chemokines and immune cells. Clin Exp Reprod Med, 2011, 38, 4, p. 179–185.
15. Patel, SS., Bamigboye, V. Hyperprolactinaemia. J Obstet Gynaecol, 2007, 27, 5, p. 455–459.
16. Poppe, K., Velkeniers, B., Glinoer, D. The role of thyroid autoimmunity in fertility and pregnancy. Nat Clin Pract Endocrinol Metab, 2008, 4, 7, p. 394–405.
17. Salmassi, A., Acil, Y., Schmutzler, AG., et al. Differential interleukin-6 messenger ribonucleic acid expression and its distribution pattern in eutopic and ectopic endometrium. Fertil Steril, 2008, 89, 5, Suppl, p. 1578–1584.
18. Salmassi, A., Schmutzler, AG., Schaefer, S., et al. Is granulocyte colony-stimulating factor level predictive for human IVF outcome? Hum Reprod, 2005, 20, 9, p. 2434–2440.
19. Wang, Q., Sun, QY. Evaluation of oocyte quality: morphological, cellular and molecular predictors. Reprod Fertil Dev, 2007, 19, 1, p. 1–12.
20. Wunder, DM., Guibourdenche, J., Birkhäuser, MH., Bersinger, NA. Anti-Müllerian hormone and inhibin B as predictors of pregnancy after treatment by in vitro fertilization/intracytoplasmic sperm injection. Fertil Steril, 2008, 90, 6, p. 2203–2210.
21. Wakim, AN., Polizotto, SL., Buffo, MJ., et al. Thyroid hormones in human follicular fluid and thyroid hormone receptors in human granulosa cells. Fertil Steril, 1993, 59, 6, p. 1187–1190.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článek Obezita a mužská neplodnost
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2012 Číslo 5- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Chromozom 21 – specifické mikroRNA v mateřské cirkulaci: zhodnocení jejich významu pro screening Downova syndromu u plodu
- Srovnání různých typů pásek v léčbě inkontinence moči u gerontologických pacientek
- Výsledky operační léčby sestupu přední poševní stěny s použitím polypropylenové síťky
- Ektopická gravidita při IUS (Mirena) – kazuistika
- Cévní endotelový růstový faktor u pacientek s karcinomem ovaria
- Gitelmanův syndrom v těhotenství - těžká hypokalémie s příznivou perinatální prognózou
- Vývoj a změny incidencí vrozených vad u narozených dětí v České republice
- Prenatální diagnostika vrozených vad v ČR – patnáctileté období
- HE4 - biomarker ovariálního karcinomu
- Obezita a mužská neplodnost
- Rodičky užívající alkohol, tabák a nelegální drogy
- Nová možnost v léčbě pokročilého ovariálního karcinomu
- Srovnání hladin prolaktinu, fT3 a fT4 ve folikulární tekutině žen s poruchou plodnosti a zdravých plodných dárkyň oocytů
- Výskyt Chlamydia trachomatis při léčbě neplodnosti
- Metoda redukce odlesku v kolposkopii
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Výsledky operační léčby sestupu přední poševní stěny s použitím polypropylenové síťky
- HE4 - biomarker ovariálního karcinomu
- Ektopická gravidita při IUS (Mirena) – kazuistika
- Výskyt Chlamydia trachomatis při léčbě neplodnosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



