-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
ERAS protokol u onkogynekologických operací
ERAS protocol in gynecologic oncology
Objective: To summarize current knowledge of the ERAS protocol in gynecologic oncology surgery.
Design: Review article.
Settings: Department of Obstetrics and Gynecology, University Hospital Ostrava, Ostrava, Department of Obstetrics and Gynecology, University of Ostrava, Ostrava.
Methods: Literature review, PubMed and Medline databases were used to search relevant literature from 1995 to 2019.
Conclusion: ERAS (Enhanced Recovery after Surgery) is a perioperative treatment program based on evidence-based medicine. Guidelines consist of pre-operative, perioperative and post-operative care items. Implementation of the ERAS protocol leads to a decrease in complications up to 40% and a reduction in hospitalization by up to 30%, thereby reducing overall costs without increasing the number of rehospitalizations. Multidisciplinary cooperation not only with anesthesiologists and consultant surgeons, but also with nutritional specialists and nurses is crucial.
Keywords:
ERAS protocol – gynecologic oncology surgery
Autori: S. Bajsová 1,2; Jaroslav Klát 1,2
Pôsobisko autorov: Gynekologicko-porodnická klinika FN, Ostrava, přednosta doc. MUDr. O. Šimetka, Ph. D., MBA 1; Gynekologicko-porodnická klinika, Ostravská univerzita, Ostrava, přednosta doc. MUDr. O. Šimetka, Ph. D., MBA 2
Vyšlo v časopise: Ceska Gynekol 2019; 84(5): 376-385
Kategória: Přehledový článek
Súhrn
Cíl práce: Shrnutí současných znalostí o ERAS protokolu v onkogynekologii.
Typ studie: Přehledový článek.
Název a sídlo pracoviště: Gynekologicko-porodnická klinika FN, Ostrava; Gynekologicko-porodnická klinika, Ostravská univerzita, Ostrava.
Metodika: Literární přehled, byly použity databáze PubMed a Medline k vyhledání relevantních prací publikovných v letech 1995–2019.
Závěr: ERAS (Enhanced Recovery after Surgery) protokol je program perioperační péče založený na medicíně založené na důkazech (evidence-based medicine). Doporučené postupy se skládají z jednotlivých kroků předoperační, perioperační a pooperační péče. Implementace ERAS protokolu vede k poklesu komplikací až o 40 % a ke zkrácení délky hospitalizace až o 30 %, a tím k celkovému snížení nákladů bez nárůstu počtu rehospitalizací. Stěžejní je multioborová spolupráce nejenom s anesteziology a konzultujícími chirurgy, ale i s nutričními specialisty a především se středním zdravotním personálem.
Klíčová slova:
ERAS protokol – onkogynekologické operace
ÚVOD
Historie ERAS (Enhanced Recovery after Surgery) protokolu sahá do 90. let 20. století, kdy Henrik Kehlet poukázal na potřebu multimodálního přístupu, který by minimalizoval chirurgickou stresovou reakci, a tím vedl ke snížení nežádoucích následků operační léčby, rychlejšímu zotavení, snížení pooperační morbidity a celkovému snížení nákladů [23]. Následně zavedl do klinické praxe první kroky multimodálního rehabilitačního postupu, kterými byly efektivní epidurální a spinální analgetizace, časná obnova příjmu per os, časná mobilizace a laparoskopická operativa. Jedny z prvních výsledků publikoval již v roce 1999 [24]. V roce 2001 byla založena studijní skupina ERAS a v roce 2005 byl na základě medicíny založené na důkazech vytvořen první protokol pro pacienty podstupující kolorektální operační výkon. Doporučené postupy pro onkogynekologickou operativu byly publikovány společností ERAS v roce 2015 [31, 32] s následnou aktualizací v únoru 2019 [33]. Skládají se z jednotlivých kroků předoperační, perioperační a pooperační péče. Od fast-track chirurgických postupů se odlišují zaměřením nejen na rychlost zotavení, ale především na kvalitu péče.
PŘEDOPERAČNÍ PÉČE
Edukace
Poskytnutí dostatečných informací pacientce i členům rodiny je pro průběh léčby zásadní. Cílem je poskytnout komplexní informace o předoperační přípravě, chirurgických i anesteziologických postupech, obvyklém průběhu hospitalizace, podmínkách propuštění a předpokládaném dalším postupu léčby. Je-li pravděpodobný výkon na střevě s následnou stomií, je vhodné kontaktovat stomickou sestru a pacientku i členy rodiny začít připravovat na péči o stomii již před samotnou operací. Pacientka je informována také o způsobu hodnocení bolesti a možnostech analgetizace. Všechny tyto informace snižují obavy, bolest, úzkost, nauzeu, urychlují zotavení a zkracují délku hospitalizace [31]. Edukovat je doporučeno slovně i písemnou formou. Letáky, obrázky a písemné informace pacientku na operaci lépe připraví, ve srovnání s pouze ústní edukací je potvrzeno rychlejší zotavení, ale například i menší spotřeba analgetik [3].
Optimalizace zdravotního stavu
Diagnostikovat anémii, dekompenzovaný nebo dosud nezjištěný diabetes a zjistit anamnestické údaje o kouření a abúzu alkoholu je potřeba již při prvním kontaktu s pacientkou [31]. Na některých pracovištích se zavedeným ERAS protokolem je tento krok ve spolupráci s odesílajícími lékaři zahájen ještě před samotnou indikací k operačnímu výkonu.
Anémie bývá zjištěna před plánovanou operací až u třetiny pacientů [5]. Její léčba preparáty železa před operací snižuje rizika plynoucí z anémie samotné, ale také z případné transfuzní léčby, kam řadíme plicní komplikace, sepsi, komplikované hojení rány nebo časnější rekurence nádorového onemocnění [13, 17, 30].
Dekompenzovaný diabetes je spojen s vyšším rizikem pooperačních komplikací. Vyšší riziko je u pacientů s dříve nezjištěnou hyperglykémií než u pacientů se známým diabetem. Hyperglykémie ale nemá být důvodem k odložení operace [31].
Kuřáci mají vyšší riziko kardiovaskulárních a plicních komplikací, kouření také nepříznivě ovlivňuje hojení ran [48]. Ke statisticky významnému snížení rizika infekčních komplikací dochází, pokud se přestane kouřit alespoň čtyři týdny před operací [43].
Abstinence alkoholu je doporučena také po dobu nejméně čtyř týdnů před operací, vede ke snížení množství pooperačních komplikací, ale nemá vliv na délku hospitalizace nebo mortalitu [38].
Prehabilitace
Prehabilitace jako samostatný krok je novinkou v onkogynekologickém ERAS protokolu. Je definována jako proces kontinuální péče, probíhající v čase mezi diagnózou a začátkem léčby. Cílem prehabilitace je optimalizovat zdravotní i psychický stav před nadcházející zátěží, a tím umožnit zvládnutí stresové události, místo snahy jej později obnovovat [33]. Součástí je zlepšení fyzické zdatnosti aerobním i silovým tréninkem, zlepšení nutričního stavu, abstinence alkoholu, kouření a kroky vedoucí k omezení psychického stresu. I zde je důležitý časový faktor, ale již tři týdny by měly být dostačující ke zlepšení svalové síly a vytrvalosti [33, 51].
Střevní příprava
Předoperační střevní příprava se stala v druhé polovině 20. století nedílnou součástí kolorektální chirurgie. Cílem je omezit kontaminaci operační rány, a tím snížit riziko pooperační infekce. Použití osmoticky aktivních látek však vede k dehydrataci pacientů a způsobuje v předoperačním období značný dyskomfort.
Součástí původního ERAS protokolu pro onkogynekologické operace bylo doporučení nepoužívat rutinní mechanickou střevní přípravu, a to ani u pacientek s plánovanou resekcí střeva [31]. Doporučení vycházelo z review 18 randomizovaných klinických studií s celkem více než 5000 pacienty, které nepotvrdily statisticky významný rozdíl v počtu infekcí a leaku anastomóz u pacientů se střevní přípravou nebo bez ní [19]. Takové výsledky potvrdily i následující review a metaanalýzy [8, 39].
Otázka ideální střevní přípravy je stále aktuální vzhledem k práci potvrzující efekt nevstřebatelných perorálních antibiotik. Jejich podání ve srovnání s pouze mechanickou střevní přípravou vede k signifikantně kratší délce hospitalizace a menšímu počtu rehospitalizací [45]. Kombinace antibiotik a mechanické střevní přípravy ale nepřináší žádné další výhody. Pro srovnání perorálních antibiotik s postupem bez střevní přípravy jsou k dispozici pouze retrospektivní studie, které potvrzují signifikantně méně komplikací včetně leaku anastomózy při podání antibiotik [33]. V aktuální verzi doporučeného postupu byla z názvu vypuštěna „mechanická“ část střevní přípravy. Je doporučeno střevní přípravu ve formě perorálních antibiotik omezit na pacientky s plánovanou resekcí tlustého střeva. Nadále platí doporučení nepodávat střevní přípravu před laparoskopickými výkony a ani před laparotomickými výkony za podmínky dodržení ERAS protokolu [33]. Protikladem ERAS protokolu je doporučený postup Americké společnosti kolorektálních chirurgů, jehož součástí je mechanická střevní příprava společně s podáním perorálních antibiotik [29].
Předoperační lačnění a příjem sacharidů
Příjem čirých tekutin je doporučen do dvou hodin a lehké stravy do šesti hodin před zahájením anestezie [31]. Tento postup je v souladu s doporučením České společnosti anesteziologie, resuscitace a intenzivní medicíny k omezování příjmu tekutin a stravy v souvislosti s anesteziologickou péčí z roku 2011 [10]. Podávání sacharidových nápojů (PreOp, případně sportovní izotonické nápoje) před operačním výkonem snižuje pooperační inzulinovou rezistenci, pomáhá udržet svalovou sílu a hmotnost [37]. Podání diabetikům je bezpečné, ale zatím není dostatek dat, aby bylo součástí platných doporučení [21]. Omezení lačnění společně s podáním sacharidových nápojů příznivě ovlivňuje metabolickou odpověď organismu na chirurgický stres, nedochází k rozvoji katabolické reakce [33].
Premedikace
Není doporučeno rutinně podávat dlouhodobě působící sedativa pro jejich efekt na pooperační zotavení. Podání krátkodobě působících anxiolytik nemá vliv na propuštění do ambulantní péče, ale ještě čtyři hodiny po výkonu můžou být negativně ovlivněny motorické funkce, tedy i vertikalizace a per os příjem. Jejich rutinní podání není doporučeno [31, 47].
Prevence trombembolismu
Hluboká žilní trombóza (VTE) je diagnostikována u pacientů s nádorovým onemocněním dvakrát až osmkrát častěji než v běžné populaci. Nejvyšší riziko, až 30%, je u pacientek s rakovinou vaječníků [4, 18]. Rizikovými faktory jsou anamnéza VTE, imobilizace, operace v předchozích 30 dnech, kardiální a respirační selhání, sepse, BMI vyšší než 30, těhotenství, hormonální léčba, histologický typ clear cell karcinomu, věk nad 70 let, centrální žilní katétry, pokročilé stadium onemocnění, operace v malé pánvi, podání chemoterapie a známý hyperkoagulační stav [33, 41]. Prevence VTE ve formě mechanické (odstupňovanými kompresními punčochami nebo pneumatickými kompresními přístroji) a farmakologické (nízkomolekulárním nebo nefrakcionovaným heparinem) je indikována u všech pacientek které podstupují operaci trvající déle než 30 minut. Měla by být zahájena před operací a pokračovat po celou dobu hospitalizace [33]. Při zahájení farmakologické profylaxe před operací je potřeba se řídit doporučeními uvedenými v SPC konkrétních preparátů. Zavedení i vynětí spinálního i epidurálního katétru by mělo vzhledem k riziku vzniku neuroaxiálního hematomu následovat nejméně 12 hodin po podání profylaktické dávky a 24 hodin po podání terapeutické dávky při použití nadroparinu i enoxaparinu. U rizikových pacientek a pacientek s pokročilým karcinomem vaječníků je doporučeno pokračovat ve farmakologické profylaxi po dobu 28 dní po operaci [6, 14, 33]. Zvýšené riziko VTE je také u pacientek podstupujících neoadjuvantní a adjuvantní chemoterapii, doporučení pro pacientky v těchto případech ale zatím chybí [33].
PERIOPERAČNÍ PÉČE
Prevence infekce v místě operačního výkonu
Infekce v místě operačního výkonu (IMOV), v zahraniční literatuře označována termínem Surgical site infection, je definována jako infekce operační rány nebo operovaného orgánu, která vznikne do 30 dnů od operace [33]. Po onkogynekologických operacích je incidence IMOV vysoká, dochází k ní až u 30 % pacientek [35]. V aktuální verzi ERAS protokolu byla kapitola antimikrobiální profylaxe a kožní dezinfekce rozšířena na soubor doporučení zahrnující antibiotickou profylaxi, dezifekci kůže, udržení tělesné teploty, omezení drénů a korekce hyperglykémie. Jejich zavedení vede k výraznému snížení frekvence IMOV, a to i v centrech s jejich již primárně nízkou incidencí [34].
Antibiotická profylaxe
Doporučenou profylaxí před hysterektomií je podání cefalosporinů první generace k pokrytí kožní flóry. V případě operace na střevě je doporučeno přidání antibiotik s anaerobním spektrem účinku [33]. Antibiotika podáváme intravenózně 30–60 minut před incizí, při dřívějším, ale i pozdějším podání je riziko infekce vyšší [31, 33, 49]. U obézních pacientek (BMI > 35 nebo váha > 100 kg) se dávka navyšuje. Je doporučeno podání opakovat podle poločasu konkrétního antibiotika (v případě cefazolinu po třech hodinách) a při krevní ztrátě > 1500 ml [31].
Kožní dezinfekce
Cílem dezinfekce kůže je minimalizovat množství kožní bakteriální flóry. Je doporučena koupel nebo sprcha večer, případně ráno před operací s použitím antimikrobiálního mýdla s chlorhexidinem [31]. Odstranění ochlupení při přípravě operačního pole nesnižuje riziko IMOV, naopak holení žiletkou riziko infekce vzhledem k drobným poraněním kůže zvyšuje. Pokud je holení nutné, doporučuje se odstranit ochlupení zastřihnutím ráno v den výkonu [31, 44]. K dezinfekci kůže operačního pole je doporučeno použít alkoholový roztok chlorhexidinu, který ve srovnání s dezinfekčním roztokem s povidone-jodinem snižuje riziko IMOV až o 40 % [11].
Prevence hypotermie
Při hypotermii dochází k periferní vazokonstrikci, a tím k hypoxii tkáně, je ovlivněn poločas eliminace léčiv, zhoršena koagulace a dochází k třesu, který výrazně zvyšuje spotřebu kyslíku. Prevence hypotermie snižuje mimo jiné i riziko IMOV [28]. K udržení tělesné teploty lze použít vyhřívané podložky, přikrývky a zahřáté infuzní roztoky. Kroky k udržení tělesné teploty se doporučuje zahájit již před operačním výkonem [33].
Omezení používání drénů a sond
Pooperační drenáž dutiny břišní se obvykle používá ke kontrole krvácení, prevenci vzniku lymfokély a k časné diagnostice dehiscence anastomózy jak střevní, tak např. ureterální. Nejsou k dispozici ale žádná data, která by tento postup podporovala. Používání drénů (peritoneálních ani subkutánních) nemá vliv na snížení frekvence IMOV, od jejich použití by tedy mělo být upuštěno [33]. Rutinní použití drénů není doporučeno ani v případě rozsáhlých resekcí střev nebo urologických výkonů, snad jen s výjimkou cystektomie [36, 9]. Rutinní použití se nedoporučuje ani v případě nazogastrické sondy, její zavedení zvyšuje riziko pneumonie a nesnižuje riziko IMOV ani leaku anastomózy a vede k výraznému dyskomfortu [52, 33]. Výjimkou je použití nazogastrické sondy k dekompresi žaludku při laparoskopických a robotických výkonech, při extubaci by však sonda měla být odstraněna [33].
Korekce hyperglykémie
Hyperglykémie v perioperačním období u diabetických i nediabetických pacientů bývá spojena s vyšším rizikem IMOV [27], ale také vyšší mortalitou, celkově horším klinickým stavem a delší hospitalizací [32]. Vzhledem k vysoké prevalenci nediagnostikovaných diabetiků v populaci by měl být screening diabetu součástí každého předoperačního vyšetření [33]. U všech pacientů je doporučeno udržovat hladinu glykémie v perioperačním období pod 11,1 mmol/l [7]. Při korekci glykémie je potřeba vyvarovat se hypoglykémie, protože oba extrémy, jak hypoglykémie, tak hyperglykémie jsou spojeny s vyšší morbiditou. Právě vyšší výskyt hypoglykémie při intenzivní inzulinové terapii byl důvodem, proč bylo od tohoto postupu ustoupeno a cílovou hladinou glykémie je poměrně benevolentních 10–11,1 mmol/l [32].
Standardní anesteziologický protokol
K vedení celkové anestezie je doporučena medikace s minimálním reziduálním anestetickým efektem, rychlou obnovou kognitivních funkcí a nezpůsobující pooperační nauzeu a zvracení (PONV). Vhodným lékem k úvodu do celkové anestezie je pro rychlý nástup účinku, krátkou eliminaci a antiemetický účinek propofolum. Celková anestezie může být vedena inhalačními anestetiky nebo jako totální intravenózní anestezie kontrolovanou infuzí propofolu. V případě inhalační anestezie se doporučuje krátkodobě působící sevofluran a desfluran [33]. Vzhledem k vysokému riziku PONV při gynekologických laparoskopických operacích je doporučeno vynechat oxid dusný a podat profylakticky antiemetika [16]. Regionální anestezie je jedním ze základů ERAS protokolu, snižuje stresovou reakci organismu a umožňuje redukovat množství podaných anestetik i opioidů [33].
Prevence pooperační nauzey a zvracení
Pooperační nauzea a zvracení je častou pooperační komplikací, zvracení se vyskytuje až u 30 % a nauzea až u 80 % pacientů po chirurgických výkonech [31]. Pacienty bývá vnímána jako jedna z nejhorších pooperačních komplikací, horší než např. bolesti operační rány [25]. PONV je příčinou delší hospitalizace na dospávacích pokojích a jednotkách intenzivní péče, pacienty ohrožuje mimo jiné aspirací, dehydratací a rozvojem elektrolytové dysbalance. Rizikovými faktory pro vznik PONV u dospělých jsou ženské pohlaví, anamnéza PONV, nekuřáci, mladší věk, celková anestezie a použití inhalační anestezie, léčba pooperační bolesti opioidy, délka anestezie, gynekologické výkony a laparoskopie. Riziko rozvoje PONV je možné určit např. podle Apfela, jeden bod je přiřazen ženám, nekuřákům, při anamnéze PONV a při použití opioidů pooperačně. Při jednom bodu je riziko rozvoje PONV 20 %, s každým dalším bodem o 20 % narůstá [16]. Profylaktická antiemetická terapie by měla být podána všem pacientům, kteří podstupují břišní operaci a jsou jim podána emetogenní anestetika a analgetika a všem pacientům se středním a vysokým rizikem PONV. K dispozici je několik farmakologických skupin antiemetik: antagonisté 5HT3 receptorů (ondansetron, granisetron atd.), antagonisté NK-1 receptorů (aprepitant – Emend, casopitant, rolapitant), steroidy (dexametason, metylprednison), butyferony (haloperidol), antihistaminika (dimenhydrinát, meklizin), anticholinergika, fenotiaziny a jiná farmaka (propofolum, mirtazapin, gabapentin, midazolam). Je vhodné podat profylakticky dvojkombinaci antiemetik, pokud tato profylaxe selže, tak k léčbě PONV použít antiemetikum jiné lékové skupiny [31]. Mezi další metody používané k omezení výskytu PONV patří např. hypnóza nebo akupunktura.
Miniinvazivní operační techniky
Miniinvazivní operativa ve srovnání s otevřeným přístupem snižuje stresovou i zánětlivou odpověď organismu na chirurgickou léčbu, a tím splňuje jeden ze základních principů ERAS. Při miniinvazivních operačních výkonech je obecně menší spotřeba opioidů, dřívější vertikalizace i propuštění, a to i bez zavedení ERAS protokolu. I proto u těchto výkonů není vliv ERAS protokolu tak zřejmý jako u laparotomických výkonů [33]. Doporučuje se preferovat minimálně invazivní operační techniky, a to včetně vaginální operativy. Případným omezením v indikaci tohoto operačního přístupu je kromě technického vybavení, zkušeností operatéra a zdravotního stavu pacientky onkologická bezpečnost. Zatímco v případě nádorového onemocnění děložního těla jsou rizika rekurence shodná jako u laparotomického výkonu, od miniinvazivní léčby nádorového onemocnění děložního hrdla se pro horší onkologické výsledky ustupuje [46, 40]. V případě laproskopické operativy ovariálního karcinomu probíhá intenzivní výzkum [2].
Perioperační infuzní léčba a hemodynamická monitorace
Nadbytek intravenózních tekutin může způsobit nejen pooperační ileus, nevolnost a zvracení, ale je spojen i s vyšším rizikem kardiovaskulárních a respiračních komplikací a vyšší mortalitou. Vede také ke zvýšenému otoku tkání s následnou hypoxií tkáně, a tím negativně ovlivňuje hojení ran včetně střevních anastomóz [25, 42]. Také hypovolémie je spojena s řadou komplikací, může vést k akutnímu renálnímu selhání, sepsi nebo pooperačnímu deliriu [33]. K tekutinám je proto potřeba přistupovat jako k lékům a stejně je i dávkovat. Peroperační podání tekutin by mělo být vedeno formou cílené tekutinové terapie a optimální perfuze orgánů zajištěna intravenózními roztoky a inotropní terapií [26, 33]. Pooperačně při nekomplikovaném průběhu je doporučeno maximální dávkování infuzní terapie 1,2 ml/kg/hod a infuzní terapii ukončit do 12–24 hodin po operaci. Oligurii 20 ml/hod lze považovat za normální odpověď organismu na operační zátěž a sama o sobě by neměla být důvodem k navýšení infuzní terapie [32].
POOPERAČNÍ PÉČE
Výživa
Hladovění zdravé neoperované osoby se odlišuje od lačnění v perioperačním období zánětlivou a metabolickou stresovou reakcí organismu na samotnou operaci. Pro správné hojení a obnovení funkce orgánů je nutná adekvátní metabolická odpověď, která však vyžaduje přiměřený nutriční stav pacienta [50]. Obvyklá strava by měla být obnovena do 24 hodin po operaci. Časná obnova per os příjmu vede k rychlejšímu návratu střevní peristaltiky, zkracuje délku hospitalizace a není zatížena vyšším rizikem komplikací. Častější je pouze nauzea, ale ne zvracení a není potřeba zavádět nazogastrickou sondu. Pacientky časnou obnovu příjmu velmi dobře tolerují [32]. Je doporučena dieta s vysokým obsahem bílkovin 1,5–2,0 g aminokyselin/kg/den a energie 25–30 kcal/kg/den [33]. Toto doporučení je ve shodě s doporučením České onkologické společnosti pro nutriční podporu onkologických nemocných.
Prevence paralytického ileu
Pooperační paralytický ileus způsobuje výrazný dyskomfort, prodlužuje hospitalizaci a mimo jiné vede také k opakovaným hospitalizacím. Frekvence pooperačního ileu je po onkogynekologických operací vysoká. Nejvyšší riziko, a to až 40%, je u pacientek, které podstoupily resekci střeva při debulkingovém výkonu pro karcinom vaječníků. Tuto vysokou frekvenci můžeme snížit pod 10 % zavedením ERAS programu, a to zejména časným obnovením per os příjmu, udržením normovolémie, analgetizací s omezením opioidů, ale také pokud pacientka po operaci pije kávu a žvýká žvýkačky [33]. Alvimopan, periferní m-antagonista opioidních receptorů blokující nežádoucí účinky opioidů na střevní peristaltiku u nás není dostupný. Efekt pití kávy na obnovu peristaltiky byl potvrzen randomizovanou studií, kdy byla pacientkám káva podávána třikrát denně od prvního pooperačního dne. Příjem kávy byl pacientkami dobře tolerován, nevyskytly se žádné komplikace související s pitím kávy (standardně byly 48 hodin po operaci podávány H2-blokátory) a k obnově peristaltiky došlo v signifikantně kratším čase než u kontrolní skupiny [20]. Z původního nadšení z prevence ileu žvýkáním žvýkaček sešlo, protože nebyl potvrzen jasný benefit této metody při plně zavedeném ERAS protokolu [12]. Nicméně stejně jako v případě pití kávy se jedná o levnou, dobře dostupnou a dobře tolerovanou metodu a na řadě pracovištích je součástí protokolů perioperační péče.
Derivace moči
Cílem pooperační derivace moči je monitorace množství moči a prevence retence. Nejčastějšími způsoby derivace v pooperačním období jsou permanentní močový katétr a punkční epicystostomie. Jako nejvhodnější doba extrakce močového katétru po nekomplikované hysterektomii se jeví šest hodin po operaci, kdy je ve srovnání s okamžitou pooperační extrakcí katétru nebo extrakcí 24 hodin po operaci nejméně komplikací, retence moči i močových infekcí [1]. V případě radikálních hysterektomií s předpokladem několikadenní derivace moči je vhodnějším způsobem derivace moči punkční epicystostomie pro menší frekvenci močových infekcí ve srovnání s permanentním katétrem [32].
Pooperační léčba bolesti
Nedostatečná léčba bolesti po gynekologických výkonech negativně ovlivňuje kvalitu života, je spojena s vyšším počtem komplikací, prodlužuje hospitalizaci a zvyšuje náklady [33]. Již před operací je třeba pacientky edukovat, vysvětlit důvody pro omezení opioidů a stanovit cíle analgetické terapie. Bolesti by neměly omezovat spánek, hluboký nádech ani rehabilitaci, nelze ale slíbit zcela bezbolestný průběh rekonvalescence. Je doporučeno podávat nesteroidní antiflogistika, paracetamol, gabapentin a dexametason a využít jejich synergického působení ke snížení spotřeby opioidů za hospitalizace i po propuštění do ambulantní péče. Analgetizaci je vhodné zahájit již před operací. Pooperačně je preferováno per os podání u všech pacientek s obnoveným příjmem [33]. Z technik svodné anestezie je doporučena incizionální analgezie bupivakainem, která je bez vedlejších systémových účinků. Hrudní epidurální anestezie má poměrně vysoké procento selhání a může způsobit hypotenzi vyžadující vazopresory. Stejně jako u TAP (transversus abdomnis plane) bloku zde ale hraje hlavní roli zkušenost konkrétního pracoviště. Analgetizace by měla být nastavena podle potřeb konkrétních pacientů. Intenzita bolesti, a tedy i adekvátní analgetizace může být u menších výkonů podceněna a pacientky po malých „nebolestivých“ výkonech můžou paradoxně trpět většími bolesti než pacientky po velkých laparotomických výkonech [22].
Časná vertikalizace
Výhodami časné vertikalizace je pokles výskytu TEN i plicních komplikací způsobených hypoventilací při delším pobytu na lůžku, snížení inzulinové rezistence, menší svalová atrofizace a celkové zkrácení hospitalizace. Podmínkou pro včasnou vertikalizaci je dostatečná analgetizace, včasné ukončení infuzní léčby, derivace moči a extrakce drénů [32]. Zatím neexistuje přesná definice časné mobilizace, obvykle ale zahrnuje první vertikalizaci v den operace a postupné navýšení času tráveného mimo lůžko na osm hodin druhý pooperační den. K následné kontrole a vyhodnocení dat se k monitoraci používají například fitness náramky sledující aktivitu [53]. Pacientkám je potřeba pohybovou aktivitu ordinovat stejně jako např. léky a dohlížet na splnění. V prvních pooperačních dnech se jedná o zvýšenou zátěž pro ošetřovatelský personál, ale včasná mobilizace umožní dřívější soběstačnost a v následujících pooperačních dnech se čas strávený péčí o pacientku výrazně snižuje.
Propuštění do ambulantní péče
Pacientky jsou při zavedeném ERAS protokolu propouštěny do domácí péče na začátku rekonvalescence. Po laparoskopických hysterektomiích to může být již v den operace [15], tedy dříve, než se může projevit většina pooperačních komplikací. Je potřeba mít jasně stanoveny podmínky pro propuštění a důkladně informovat pacientky a členy rodiny o možných komplikacích, jejich příznacích a léčbě. Lze tak předejít zbytečným kontrolám v nemocnici krátce po propuštění a rehospitalizacím [33]. Časným propuštěním rostou nároky na edukaci, ale i na spolupráci pacientek. Součástí protokolů některých pracovišť je pravidelný telefonický kontakt s ERAS sestrou zaměřený na průběh rekonvalescence a včasnou diagnostiku komplikací.
ERAS protokol je přehledně v tabulce 1.
Tab. 1. ERAS protokol u onkogynekologických operací 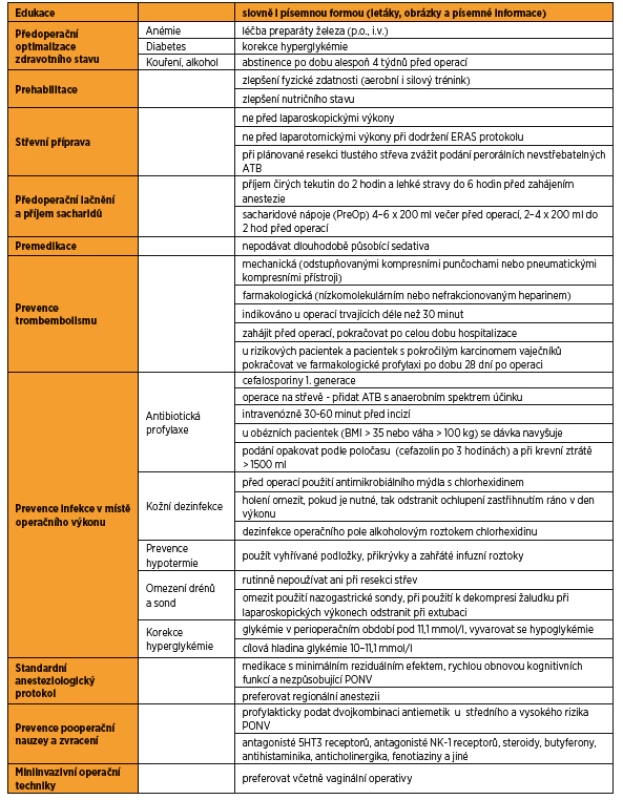

Převzato z Guidelines for pre- and intra-operative care in gynecologic/oncology surgery: Enhanced Recovery After Surgery (ERAS®) Society recommendations — Part I, Part II a 2019 update ZÁVĚR
Podíl jednotlivých kroků na celkovém úspěchu ERAS protokolu nelze stanovit, jeho přínos je v komplexnosti. Některé kroky lze zavést samostatně, například analgetizaci nebo časnou vertikalizaci. Ale v případě infuzní léčby je třeba dodržet omezení lačnění před operací, jinak může omezení infuzní terapie vést až k akutnímu renálnímu selhání. Samotné zavedení ERAS protokolu do klinické praxe je proces časově i organizačně náročný. Je potřeba intenzivní mezioborová spolupráce s anesteziology a chirurgy, změna organizace práce a zapojení ošetřovatelského personálu. Konkrétní protokol musí také odpovídat možnostem pracoviště. Po zavedení protokolu je nutno průběžně provádět audity, které pomůžou sledovat adherenci k protokolu a identifikovat slabá místa. I přes jasný benefit vyplývající z jeho zavedení ERAS protokol dosud není na většině onkogynekologických centrech v ČR zaveden.
Práce vznikla za podpory grantu SGS05/LF/2018-2019.
MUDr. Sylva Bajsová
Gynekologicko-porodnická klinika FN
17. listopadu 1790/5
708 52 Ostrava-Poruba
e-mail: sylva.bajsova@fno.cz
Zdroje
1. Ahmed, MR., Sayed Ahmed, WA., Atwa, KA., Metwally, L. Timing of urinary catheter removal after uncomplicated total abdominal hysterectomy: a prospective randomized trial. Eur J Obstet Gynecol Reprod Biol [online], 2014, 176, p. 60–63. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0301211514001092
2. Alletti, SG., Bottoni, C., Fanfani, F., et al. Minimally invasive interval debulking surgery in ovarian neoplasm (MISSION trial-NCT02324595): a feasibility study. American Journal of Obstetrics and Gynecology [online]. 2016, 214(4), 503.e1–503.e6 Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0002937815022279
3. Angioli, R., Plotti, F., Capriglione, S., et al. The effects of giving patients verbal or written pre-operative information in gynecologic oncology surgery: a randomized study and the medical-legal point of view. European Journal of Obstetrics & Gynecology and Reproductive Biology [online]. 2014, 177, p. 67–71. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0301211514001948
4. Bakhru, A. Effect of ovarian tumor characteristics on venous thromboembolic risk. Journal of Gynecologic Oncology [online]. 2013, 24(1). Dostupné z: https://synapse.koreamed.org/DOIx.php?id=10.3802/jgo.2013.24.1.52
5. Baron, DM., Hochrieser, H., Posch, M., et. al. Preoperative anaemia is associated with poor clinical outcome in non-cardiac surgery patients. British Journal of Anaesthesia [online]. 2014, 113(3), p. 416–423. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0007091217317658
6. Bergqvist, D., Agnelli, G., Cohen, AT., et.al. Prolonged prophylaxis against venous thromboembolism with enoxaparin in patients undergoing cancer surgery: long-term survival analysis. Phlebology: The Journal of Venous Disease [online]. 2016, 21(4), p. 195–198 Dostupné z: http://journals.sagepub.com/doi/10.1258/026835506779115753
7. Berríos-Torres, SI., Umscheid, CA., Bratzler, DW., et al. Centers for Disease Control and Prevention Guideline for the Prevention of Surgical Site Infection, 2017. JAMA Surgery [online]. 2017, 152(8). Dostupné z: http://archsurg.jamanetwork.com/article.aspx?doi=10.1001/jamasurg.2017.0904
8. Cao, F., Li, J., Li, F. Mechanical bowel preparation for elective colorectal surgery: updated systematic review and meta-analysis. International Journal of Colorectal Disease [online]. 2012, 27(6), p. 803–810. Dostupné z: http://link.springer.com/10.1007/s00384-011-1361-y
9. Cerantola, Y., Valerio, M., Persson, B., et al. Guidelines for perioperative care after radical cystectomy for bladder cancer: Enhanced Recovery After Surgery (ERAS®) society recommendations. Clinical Nutrition [online]. 2013, 32(6), p. 879–887. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0261561413002549
10. Česká společnost anesteziologie, resuscitace a intenzivní medicíny ČLS JEP. Doporučení pro omezování příjmu tekutin a stravy před anesteziologickou péčí, Verze 1.5. (27.8.2011) Dostupné z: https://www.csarim.cz/content/uploads/2018/11/doporuceni-pro-omezovani-prijmu-tekutin-a-stravy-pred-anesteziologickou-peci-2011.pdf.
11. Darouiche, RO., Wall, MJ., Itani, KM., et al. Chlorhexidine-alcohol versus povidone-iodine for surgical-site antisepsis. New England Journal of Medicine [online]. 2010, 362(1), p. 18–26. Dostupné z: http://www.nejm.org/doi/abs/10.1056/NEJMoa0810988
12. de Leede, EM., van Leersum, NJ., Kroon, HM., et al. Multicentre randomized clinical trial of the effect of chewing gum after abdominal surgery. British Journal of Surgery [online]. 2018, 105(7), 820–828. Dostupné z: http://doi.wiley.com/10.1002/bjs.10828
13. de Oliveira, GS., Schink, JC., Buoy, C., et al. The association between allogeneic perioperative blood transfusion on tumour recurrence and survival in patients with advanced ovarian cancer. Transfusion Medicine [online]. 2012, 22(2), p. 97–103. Dostupné z: http://doi.wiley.com/10.1111/j.1365-3148.2011.01122.x
14. Felder, S., Rasmussen, MS., King, R., et al. Prolonged thromboprophylaxis with low molecular weight heparin for abdominal or pelvic surgery. Cochrane Database of Systematic Reviews [online] Dostupné z: http://doi.wiley.com/10.1002/14651858.CD004318.pub3
15. Gale, J., Thompson, C., Lortie, KJ., et al. Early Discharge after Laparoscopic Hysterectomy: a Prospective Study. Journal of Obstetrics and Gynaecology Canada [online]. 2018, 40(9), p. 1154–1161. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S1701216317309854
16. Gan, TJ., Diemunsch, P., Habib, AS., et al. Consensus Guidelines for the Management of Postoperative Nausea and Vomiting. Anesthesia & Analgesia [online]. 2014, 118(1), p. 85–113. Dostupné z: https://insights.ovid.com/crossref?an=00000539-201401000-00013
17. Glance, LG., Dick, AW., Mukamel, DB., et al. Association between intraoperative blood transfusion and mortality and morbidity in patients undergoing noncardiac surgery. Anesthesiology [online]. 2011, 114(2), p. 283–292. Dostupné z: http://anesthesiology.pubs.asahq.org/Article.aspx?doi=10.1097/ALN.0b013e3182054d06
18. Greco, PS., Bazzi, AA., McLean, K., et.al. Incidence and timing of thromboembolic events in patients with ovarian cancer undergoing neoadjuvant chemotherapy. Obstetrics & Gynecology [online]. 2017, 129(6), p. 979–985. Dostupné z: http://Insights.ovid.com/crossref?an=00006250-201706000-00004
19. Güenaga, KF., Matos, D., Wille-Jørgensen, P. Mechanical bowel preparation for elective colorectal surgery. Cochrane Database of Systematic Reviews [online]. 2011. Dostupné z: http://doi.wiley.com/10.1002/14651858.CD001544.pub4
20. Güngördük, K., Özdemir, İA., Güngördük, Ö., et.al. Effects of coffee consumption on gut recovery after surgery of gynecological cancer patients: a randomized controlled trial. American Journal of Obstetrics and Gynecology [online]. 2017, 216(2), 145.e1–145.e7. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0002937816309140
21. Joshi, GP., Kehlet, H. Procedure-specific pain management. Anesthesiology [online]. 2013, 118(4), p. 780–782. Dostupné z: http://anesthesiology.pubs.asahq.org/Article.aspx?doi=10.1097/ALN.0b013e31828866e1
22. Kehlet, H. Multimodal approach to control postoperative pathophysiology and rehabilitation. British Journal of Anaesthesia [online]. 1997, 78(5), p. 606–617. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0007091217399890
23. Kehlet, H., Mogensen, T. Hospital stay of 2 days after open sigmoidectomy with a multimodal rehabilitation programme. British Journal of Surgery [online]. 1999, 86(2), p. 227–230. Dostupné z: http://doi.wiley.com/10.1046/j.1365-2168.1999.01023.x
24. Laffin, MR., Li, S., Brisebois, R., et al. The Use of a Pre-operative Carbohydrate Drink in Patients with Diabetes Mellitus: A Prospective, Non-inferiority, Cohort Study. World Journal of Surgery [online]. 2018, 42(7), p. 1965–1970. Dostupné z: http://link.springer.com/10.1007/s00268-017-4413-9
25. Macario, A., Weinger, M., Carney, S., Kim, A. Which clinical anesthesia outcomes are important to avoid? The perspective of patients. Anesthesia & Analgesia [online]. 1999, 89(3). Dostupné z: https://insights.ovid.com/crossref?an=00000539-199909000-00022
26. Makaryus, R., Miller, TE., Gan, TJ. Current concepts of fluid management in enhanced recovery pathways. British Journal of Anaesthesia [online]. 2018, 120(2), p. 376–383. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0007091217539768
27. Martin, ET., Kaye, KS., Knott, C., et al. Diabetes and risk of surgical site infection: a systematic review and meta-analysis. Infection Control & Hospital Epidemiology [online]. 2016, 37(01), p. 88–99. Dostupné z: https://www.cambridge.org/core/product/identifier/S0899823X15002494/type/journal_article
28. Melling, AC., Ali, B., Scott, EM., Leaper, DJ. Effects of preoperative warming on the incidence of wound infection after clean surgery: a randomised controlled trial. The Lancet [online]. 2001, 358(9285), p. 876–880. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0140673601060718
29. Migaly, J., Bafford, AC., Francone,TD., et al. The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the Use of Bowel Preparation in Elective Colon and Rectal Surgery. Diseases of the Colon & Rectum [online]. 2019, 62(1), p. 3–8. Dostupné z: http://Insights.ovid.com/crossref?an=00003453-201901000-00002
30. Musallam, KM., Tamim, HM., Richards, T., et al. Preoperative anaemia and postoperative outcomes in non-cardiac surgery: a retrospective cohort study. The Lancet [online]. 2011, 378(9800), 1396–1407. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0140673611613810
31. Nelson, G., Altman, AD., Nick, A., et al. Guidelines for pre - and intra-operative care in gynecologic/oncology surgery: Enhanced Recovery After Surgery (ERAS®) Society recommendations - Part I. Gynecologic Oncology. Elsevier, 2016/02/01, 140(2), p. 313–322. Dostupné z: https://doi.org/10.1016/j.ygyno.2015.11.015
32. Nelson, G., Altman, AD., Nick A., et al. Guidelines for postoperative care in gynecologic/oncology surgery: Enhanced Recovery After Surgery (ERAS®) Society recommendations - Part II. Gynecologic Oncology. Elsevier, 2016/02/01, 140(2), p. 323–332. Dostupné z: https://doi.org/10.1016/j.ygyno.2015.12.019
33. Nelson, G., Bakkum-Gamez, J, Kalogera, E., et al. Guidelines for perioperative care in gynecologic/oncology: Enhanced Recovery After Surgery (ERAS) Society recommendations – 2019 update. International Journal of Gynecologic Cancer [online]. 2019, ijgc;ijgc-2019-000356v1 Dostupné z: http://ijgc.bmj.com/lookup/doi/10.1136/ijgc-2019-000356
34. Nelson, R., Edwards, S., Tse, B. Prophylactic nasogastric decompression after abdominal surgery. Cochrane Database Syst Rev 2007, Cochrane Database of Systematic Reviews [online]. 2007(3).
35. Nguyen, JMV., Sadeghi, M., Gien, LT., et al. Impact of a preventive bundle to reduce surgical site infections in gynecologic oncology. Gynecologic Oncology [online]. 2019, 152(3), p. 480–485. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0090825818312198
36. Nugent, EK., Hoff, JT., Gao, F., et al. Wound complications after gynecologic cancer surgery. Gynecologic Oncology [online]. 2011, 121(2), p. 347–352. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0090825811000709
37. Nygren, J., Thacker, J., Carli, F., et al. Guidelines for Perioperative Care in Elective Rectal/Pelvic Surgery: Enhanced Recovery After Surgery (ERAS®) Society Recommendations, World J Surg (2013) 37 : 285. https://doi.org/10.1007/s00268-012-1787-6
38. Nygren, J., Thorell, A., Ljungqvist, O. Preoperative oral carbohydrate therapy. Current Opinion in Anaesthesiology [online]. 2015, 28(3), p. 364–369. Dostupné z: http://content.wkhealth.com/linkback/openurl?sid=WKPTLP:landingpage&an=00001503-201506000-00022
39. Oppedal, K., Møller, AM., Pedersen, B., Tønnesen, H. Preoperative alcohol cessation prior to elective surgery. Cochrane Database of Systematic Reviews [online]. Dostupné z: http://doi.wiley.com/10.1002/14651858.CD008343.pub2
40. Pineda, CE., Shelton, AA., Hernandez-Boussard, T., et al. Mechanical bowel preparation in intestinal surgery: a meta-analysis and review of the literature. Journal of Gastrointestinal Surgery [online]. 2008, 12(11), p. 2037–2044. Dostupné z: http://link.springer.com/10.1007/s11605-008-0594-8
41. Ramirez, PT., Frumovitz, M., Pareja, R., et al. Minimally invasive versus abdominal radical hysterectomy for cervical cancer. New England Journal of Medicine [online]. 2018, 379(20), p. 1895–1904. Dostupné z: http://www.nejm.org/doi/10.1056/NEJMoa1806395
42. Saadeh, FA., Norris, L., O‘Toole, S., Gleeson, N. Venous thromboembolism in ovarian cancer: incidence, risk factors and impact on survival. European Journal of Obstetrics & Gynecology and Reproductive Biology [online]. 2013, 170(1), p. 214–218. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0301211513002637
43. Silva, JM., de Oliveira, AMRR., Nogueira, FA., et al. The effect of excess fluid balance on the mortality rate of surgical patients: a multicenter prospective study. Critical Care [online]. 2013, 17(6). Dostupné z: http://ccforum.biomedcentral.com/articles/10.1186/cc13151
44. Sørensen, LT. Wound healing and infection in surgery. Archives of Surgery [online]. 2012, 147(4). Dostupné z: http://archsurg.jamanetwork.com/article.aspx?doi=10.1001/archsurg.2012.5
45. Tanner, J., Norrie, P., Melen, K. Preoperative hair removal to reduce surgical site infection. Cochrane Database of Systematic Reviews [online] Dostupné z: http://doi.wiley.com/10.1002/14651858.CD004122.pub4
46. Toneva, GD., Deierhoi, RJ., Morris, M., et al. Oral antibiotic bowel preparation reduces length of stay and readmissions after colorectal surgery. Journal of the American College of Surgeons [online]. 2013, 216(4), p. 756–762. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S1072751512014445
47. Walker, JL., Piedmonte, MR., Spirtos, NM., et al. Recurrence and Survival After Random Assignment to Laparoscopy Versus Laparotomy for Comprehensive Surgical Staging of Uterine Cancer: Gynecologic Oncology Group LAP2 Study. Journal of Clinical Oncology [online]. 2012, 30(7), p. 695–700. Dostupné z: http://ascopubs.org/doi/10.1200/JCO.2011.38.8645
48. Walker, KJ., Smith, AF. Premedication for anxiety in adult day surgery. Cochrane Database of Systematic Reviews [online]. Dostupné z: http://doi.wiley.com/10.1002/14651858.CD002192.pub2
49. Warner, DO. Helping surgical patients quit smoking: why, when, and how. Anesthesia & Analgesia [online]. 2005, 101(2), p. 481–487 Dostupné z: http://Insights.ovid.com/crossref?an=00000539-200508000-00033
50. Weber, WP., Marti, WR., Zwahlen, M., et al. The timing of surgical antimicrobial prophylaxis. Annals of Surgery [online]. 2008, 247(6), p. 918–926. Dostupné z: https://insights.ovid.com/crossref?an=00000658-200806000-00003
51. Weimann, A., Braga, M., Carli, F., et al. ESPEN guideline: Clinical nutrition in surgery. Clinical Nutrition [online]. 2017, 36(3), p. 623–650. Dostupné z: https://linkinghub.elsevier.com/retrieve/pii/S0261561417300638
52. West, MA., Wischmeyer, PE., Grocott, MPW. Prehabilitation and nutritional support to improve perioperative outcomes. Current Anesthesiology Reports. 2017, 7(4), p. 340–349. Dostupné z: https://doi.org/10.1007/s40140-017-0245-2
53. Wolk, S., Meißner, T., Linke, S., et al. Use of activity tracking in major visceral surgery – the Enhanced Perioperative Mobilization (EPM) trial: study protocol for a randomized controlled trial. Trials [online]. 2017, 18(1). Dostupné z: http://trialsjournal.biomedcentral.com/articles/10.1186/s13063-017-1782-1
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2019 Číslo 5- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- Deložní leiomyomy s bizarními jádry: analýza 37 prípadu po laparoskopické ci otevrené myomektomii
- Účinnost dienogestu v terapii klinických symptomů endometriózy rektovaginálního septa
- Profylaktická oboustranná balonková okluze ilických arterií během císařského řezu u Svědkyně Jehovovy
- Akutní apendicitida v šestinedělí
- Ruptura dělohy v graviditě
- Heterotopická gravidita Vitální intrauterinní gravidita týden 12+4, vitální tubární gravidita týden 11+4
- Současné možnosti predikce předčasného porodu
- Screening preeklampsie v I. trimestru těhotenství
- Přeměna mezenchymálních a epiteliálních buněk – vliv na funkci a receptivitu endometria
- ERAS protokol u onkogynekologických operací
- Syndrom Mayer-Rokitansky-Küster-Hauser – ageneze dělohy a pochvy: aktuální znalosti a terapeutické možnosti
- Anatomie a biomechanika musculus levator ani
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Syndrom Mayer-Rokitansky-Küster-Hauser – ageneze dělohy a pochvy: aktuální znalosti a terapeutické možnosti
- ERAS protokol u onkogynekologických operací
- Screening preeklampsie v I. trimestru těhotenství
- Ruptura dělohy v graviditě
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



