-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Poruchy příjmu potravy v ambulanci gynekologa pro děti a dospívající
Eating disorders in the ambulance of pediatric and adolescence gynecology
Objective: To present a comprehensive overview of the female adolescent population focused on physical development and reproductive healthcare.
Methods: A summary of available literature using our own experience with the treatment of patients with eating disorders.
Conclusion: Approximately 0.5% of adolescents suffer from eating disorders (EDs) in the Czech Republic. EDs have the highest incidence during adolescence, it is a period when growth spurt, bone mineralization and reproductive organ development occur. EDs have a significant negative effect on development and can irreversibly lead to its impairment.
Keywords:
anorexia nervosa – bulimia nervosa – body mass index (BMI) – densitometry – Bone density – amenorrhea – oligomenorrhea – Atrophy
Autori: Poncová R.; Skřenková J.; Michael Fanta
Pôsobisko autorov: Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Ceska Gynekol 2021; 86(1): 46-53
Kategória: Přehledový článek
doi: https://doi.org/10.48095/cccg202146Súhrn
Cíl: Podat souhrnný přehled poruch příjmu potravy v adolescentní ženské populaci a upozornit na jejich možné dopady na správný tělesný vývoj v tomto věkovém období z hlediska gynekologa.
Metodika: Zpracování dostupné literatury s využitím zkušeností naší ambulance s poskytováním dispenzární a léčebné péče u pacientek s poruchou příjmu potravy.
Závěr: Poruchy příjmu potravy se vyskytují v České republice přibližně u 0,5 % adolescentní populace, přičemž dívky jsou postiženy 10× častěji. Poruchy příjmu potravy (PPP) mají nejvyšší incidenci v době dospívání, kdy dochází k růstovému spurtu, k mineralizaci kostí a rozvoji funkce reprodukčních orgánů. PPP mají na vývoj významně negativní vliv, a mohou tak nenávratně vést k jeho postižení, proto je třeba se těmito onemocněními zabývat.
Klíčová slova:
mentální anorexie – mentální bulimie – BMI – denzitometrie – kostní denzita – amenorea – oligomenorea – atrofizace
Úvod
Mezi poruchy příjmu potravy (PPP) patří všechna psychogenně navozená maladaptivní jídelní chování, která vedou k neadekvátní regulaci tělesné hmotnosti s dopadem na celkový zdravotní stav a psychosociální fungování. Obecně se jedná o formy hypothalamické dysfunkce, které se objevují nejčastěji v období dospívání. PPP se rozvíjí jako důsledek komplexního působení biologických, psychických i sociálních faktorů a pro účinnou léčbu je nutné jejich komplexní posouzení. PPP patří mezi nejčastější chronická somatická onemocnění, která se projevují v dospívání, a zároveň nejzávažnější psychická onemocnění, která mohou končit smrtelně. Ve světě se udává celoživotní prevalence PPP mezi ženami 5,9 % [1].
Podle diagnostického a statistického manuálu mentálních poruch z roku 2013 (DSM-V) rozdělujeme PPP na šest základních skupin (tab. 1):
- První je mentální anorexie, a to restriktivního typu, kdy dívka hubne především restrikcí potravy, nebo purgativního typu, u kterého převažuje excesivní cvičení.
- Další hlavní skupinou je mentální bulimie, kdy je fáze přejídání střídána s fází hladovění u restriktivního typu, nebo naopak převažuje vyvolávání zvracení a nadužívání laxativ či diuretik u purgativního typu.
- Třetí skupinou jsou restriktivní poruchy příjmu potravy (ARFID – avoidant restrictive food intake disorder), které se týkají především dětské populace, kdy děti postupně vyřazují ze svého jídelníčku skupiny „nezdravých“ potravin, až dojde k výraznému kalorickému deficitu.
- Čtvrtou skupinou PPP je záchvatovité přejídání (BED – binge eating disorder).
- Pátým druhem PPP je pika, při které má postižený neovladatelnou chuť na nejedlé věci, jako např. papír, hlína, dřevo, vlna atd.
- Poslední skupinou je ruminace, která se vyznačuje opakovanou regurgitací již spolykané a natrávené potravy ze žaludku zpět do úst. Jednotlivé skupiny PPP v sebe často přecházejí nebo se vzájemně kombinují [2].
Tab. 1. Rozdělení poruch příjmu potravy podle DSM-V.
Tab. 1. Distribution of eating disorders according to DSM-V.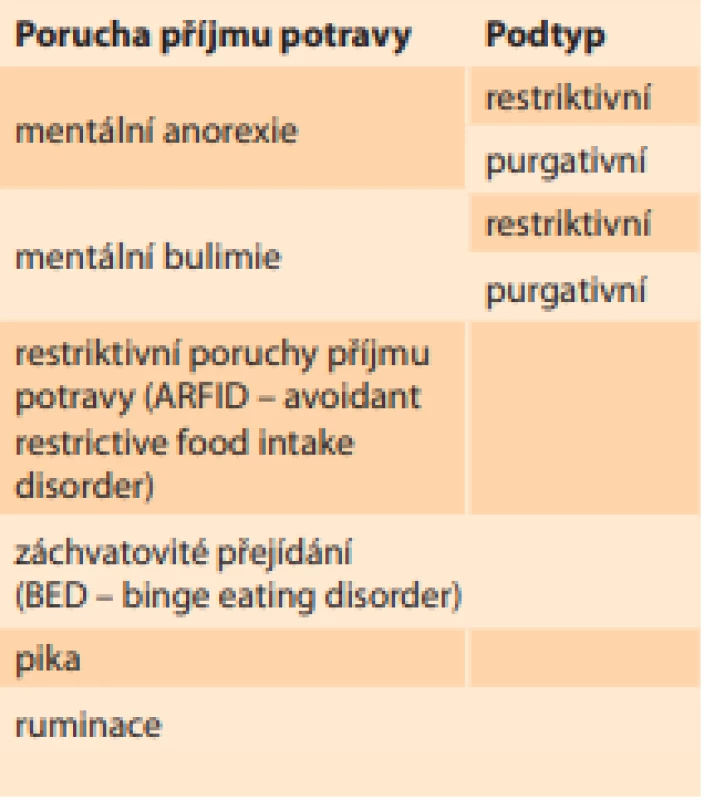
Mezi kritéria mentální anorexie (MA) z roku 2013 patří restrikce příjmu potravy, která vede k úbytku hmotnosti, dále je to strach ze vzrůstu tělesné hmotnosti nebo chování, které brání jejímu přírůstku, ačkoli má daný jedinec podváhu, a posledním kritériem je zkreslené vnímání své hmotnosti a tvaru postavy, nepatřičný vliv hmotnosti na sebehodnocení nebo popření zdravotní závažnosti nízké tělesné hmotnosti. Mezi kritéria diagnózy MA od roku 2013 již nepatří amenorea [3].
Mentální anorexie jako diagnóza byla definována již roku 1694 britským lékařem Richardem Mortonem. Celkově se jedná o velmi poddiagnostikované onemocnění. Dle statistik je MA třetí nejčastější psychiatrické onemocnění vyskytující se v období puberty. V posledních letech pozorujeme růst incidence i prevalence. Již mezi lety 1957 a 1984 udávají Spojené státy americké vzestup incidence ze 4 nových případů na 16 za rok/100 000 osob. V ČR je postiženo asi 0,5 % dospívajících v poměru ženy: muži 10 : 1, s prvním vrcholem mezi 13. a 14. rokem a druhým vrcholem mezi 17. a 18. rokem věku [4].
Dle indexu tělesné hmotnosti (BMI –body mass index) rozděluje Světová zdravotnická organizace (WHO) MA na čtyři stupně:
- mírná forma s BMI ≥ 17 kg/m2;
- střední s BMI 16–16,99 kg/m2;
- závažná s BMI 15–15,99 kg/m2;
- extrémní s BMI ≤ 15 kg/m2.
Udává se, že normální obsah tělesného tuku u žen je 20–30 % a u mužů 8–25 %, tyto hodnoty přirozeně rostou s věkem, i když hmotnost zůstává stejná. Při stejném BMI mají ženy o 12 % tuku více než muži. BMI je považován za nejlepší ukazatel pro klinické účely [5].
U pacientek s MA se setkáváme se znaky malnutrice a jejich následky. Pacientky jsou celkově v hypometabolickém a hypotermickém stavu a s tím souvisí další příznaky, které u nich pozorujeme. Často se objevuje bradykardie, hypotenze a akrocyanóza. Pacientky vlivem malnutrice celkově chřadnou, často zvrací nebo mají zácpu. U pacientek s MA pozorujeme hematomy nad obratli a pánevními kostmi, dále se objevuje lanugo, a to především na zádech. Důsledkem kachexie mají pacientky sníženou svalovou sílu, pozorujeme obtížnější hojení ran, zhoršení orgánových a systémových funkcí. Pokud onemocnění vznikne v období puberty, hrozí u pacientek zástava růstu a vývoje.
Patofyziologie
Malnutrice je základním patofyziologickým bodem vzniku bludného kruhu mentální anorexie. U pacientek s MA vzniká porucha nutričního stavu organizmu, kdy dochází k relativnímu nebo absolutnímu nedostatku živin či k poruše metabolizmu živin. Postupným úbytkem tukové tkáně dochází k poklesu hladiny adipokinu leptinu. Hladina leptinu tedy koreluje i s hmotností, resp. BMI pacientek. Leptin má vliv na funkci hypothalamu. Při snížené hladině leptinu dochází k blokaci uvolňování hypothalamických hormonů [6]. Hladina růstového hormonu (STH) je sice u pacientek s MA zvýšená, ale vlivem downregulace jeho receptorů je funkce výrazně potlačena a rozvíjí se rezistence k jeho působení [7]. STH funguje především přes mediátor IGF-1 (insulin-like growth factor 1), jehož sekrece se sekundárně snižuje. Hladina IGF-1 je na rozdíl od hladiny STH stabilní, proto lze hladinu IGF-1 lépe kvantifikovat. IGF-1 má za normálních okolností pozitivní vliv na vylučování tyrosinkinázy, u pacientek s MA tedy dochází k sekundární hypotyreóze. IGF-1 dále zvyšuje zabudovávání sulfátu do chrupavek, a tím stimuluje jejich růst, má stimulační vliv na hematopoezu, na tvorbu ovariálních steroidů a proliferaci a diferenciaci myoblastů. I to je jedním z důvodů, proč u pacientek pozorujeme snížené hodnoty hemoglobinu [8]. Mezi další patologie, které pozorujeme v laboratorních vyšetřeních, patří zvýšený cholesterol (celkový, HDL – high density lipoprotein), což je vysvětlováno vyšší endogenní syntézou v době nedostatku exogenního příjmu.
Tělo vystavené malnutrici je v neustálém metabolickém stresu, mimo jiné se objevují časté hypoglykemie. Proto dochází ke zvýšené sekreci kortikoliberinu, který snižuje syntézu orexigenního neuropeptidu Y. Ten za normálních okolností vydává mozku signál, že tělo má hlad.
Z pohledu gynekologické endokrinologie je MA charakterizována sekundárním hypogonadotropním hypogonadizmem vznikajícím na základě primární hypothalamické poruchy – narušení charakteru pulzatilní sekrece gonadoliberinu (GnRH – gonadotropin-releasing hormone). K poruše reprodukčních funkcí dochází obvykle při snížení podílu tukové hmoty pod kritickou hladinu 20 %. Sekrece gonadotropinů je narušena dříve než u ostatních hypofyzárních hormonů, protože zajištění možnosti reprodukce nepatří mezi základní životní funkce, na něž si tělo zásobní energii ponechává. Opět se objevuje prepubertální vzorec GnRH testu, kdy po podání gonadoliberinu roste výrazněji hladina folikuly stimulujícího hormonu (FSH) než hladina luteinizačního hormonu (LH). Porucha funkce ovariální osy je reverzibilní, ale její restituce je po nárůstu hmotnosti opožděna.
Důvodem návštěvy gynekologické ambulance pro děti a dospívající u pacientek s PPP bývá retardace pohlavního dospívání v pubertě nebo porucha menstruačního cyklu v adolescenci. Retardací rozumíme absenci rozvoje sekundárních pohlavních znaků ve věku 13 let, prodlouženou dobu mezi prvními známkami dospívání k fázi zralosti (menarche) na 5 let a více, malý vzrůst oproti růstové predikci či infantilní vzhled. Retardace pohlavního dospívání je často spojena s primární amenoreou (hranicí menarche je 15 let věku), ale vzhledem k věkovému rozmezí, kdy se MA obvykle manifestuje, přicházejí dívky s PPP nejčastěji pro sekundární amenoreu (90 dní a více) či oligomenoreu (35 dní a více). Pacientky bývají odeslány pediatrem pro absenci menstruace či poruchu menstruačního cyklu nebo přicházejí bez doporučení na žádost rodičů.
K rozvoji sekundární amenorey dochází až ve 30 % při poklesu hmotnosti o 10–15 % oproti ideální hmotnosti, která je definována jako optimální hmotnost jedince k dané výšce, při které se očekává maximální délka života [9]. Ve vztahu k BMI se ideální hmotnost pohybuje mezi BMI 20 a 25 kg/m² [10]. Pro amenoreu je zásadní úbytek tukové hmoty. Po realimentaci se spontánní návrat cyklické funkce ovaria a menstruace opožďuje, u 30 % dokonce amenorea dlouhodobě přetrvává i po přírůstku hmotnosti. V izraelské prospektivní studii sledovali obnovu menstruačního cyklu u dívek po léčbě MA v závislosti na podílu tukové hmoty, která byla měřena pomocí bioimpedance. Jako cut-off hodnotu pro obnovu pravidelného menstruačního cyklu stanovili 21,2 %. U třetiny pacientek během sledovaného období nedošlo k obnově cyklu ani po dosažení požadované hmotnosti. Pacientky s restitucí cyklu průměrně začaly menstruovat za 2 měsíce po dosažení přírůstku hmotnosti, tyto pacientky zvýšily hmotnost a podíl tukové hmoty signifikantně více oproti pacientkám bez obnovy menses. Stejný trend potvrdilo i hormonální vyšetření, pacientky s obnovou cyklu měly po léčbě vyšší hladinu FSH a LH než před léčbou (p < 0,01) oproti druhé skupině (p < 0,06) [11]. Hypoestrinní stav je spojen s atrofizací zevního genitálu, ochabnutím prsou a hypoplazií dělohy. V ultrazvukovém obraze je děloha rozměrově menší, proporčně takového typu, do kterého dospěla v době rozvoje PPP (adultního, virginózního, pubertálního), s nízkým endometriem. Ovaria jsou bez známek rozvoje folikulárního aparátu. V hormonální cytologii odebrané z horní třetiny pochvy mikroskopicky pozorujeme epitel jako v dětském klidovém období a v mikrobiálním obraze poševním nenalézáme Döderleinovy laktobacily (MOP 0).
Závažným problémem estrogenního deficitu u dívek s MA je dopad na metabolizmus kostí, který je negativně ovlivněn na několika úrovních. Estrogeny působí preventivně proti endosteální resorpci, jež je u pacientek v hypoestrinním stavu zvýšená. Nedostatek estrogenů vede ke zvýšení osteoklastogeneze a osteoblastogeneze, a tím pádem ke zvýšení kostního obratu. Životnost osteoklastů resorbující kost se zvyšuje, a naopak je podpořena apoptóza osteoblastů a osteocytů. Pokud se onemocnění objeví v období adolescence, kdy kost fyziologicky roste nejvíce, hrozí, že se kost nebude správně mineralizovat a tento stav může být již permanentní. Denzitometrické vyšetření nedokáže počínající úbytek mineralizace odhalit. Kost je postižena dříve, než lze odchylky rozpoznat na zobrazovacích vyšetřeních. Ačkoli u pacientek s MA celkově dochází k úbytku tukové tkáně, adipozita kostní dřeně se zvyšuje [8]. U velmi podvyživených pacientek s BMI < 11 nastává kompletní výměna za tuk, i proto dochází k poruše krvetvorby. U pacientek s MA je postižena struktura kosti trabekulární i kortikální. Bylo zjištěno, že obnova menstruačního cyklu vede predominantně ke zvýšení denzity trabekulární kosti (např. páteře) a naopak navýšení hmotnosti vede ke zvýšení denzity především kortikální kosti (např. kyčle). Více než 90 % žen s MA má T-score < –1 SD (směrodatné odchylky); 40 % žen má T-score < –2,5 SD. U adolescentek má více než 50 % Z-score < –1 SD (pozn. T-score je srovnání s referenčními parametry u žen do 30 let, Z-score je srovnání s průměrnou populací) [12]. Každý pokles SD o 1 zvyšuje riziko zlomeniny přibližně dvojnásobně [13]. Obecně jsou tedy ženy s MA ohroženy osteoporózou a mají o 60 % vyšší riziko fraktury [14].
Rizikové faktory
Mentální anorexie je multifaktoriálně podmíněné psychiatrické onemocnění, které vzniká při nepříznivé kombinaci biologických, psychologických, rodinných a sociokulturních faktorů. Podle italské studie z roku 2015 byl zjištěn jako rizikový faktor vzniku PPP předčasný porod a hypoxie plodu [15]. Ženské pohlaví je obecným rizikem vzniku PPP, u žen je pravděpodobnost rozvoje PPP 10× vyšší než u mužů. Dalším rizikovým faktorem je pubertální věk, kdy u dívek dochází k fyziologické změně ukládání tuků a ke změnám postavy. Obecně rizikový je jakýkoli kritický komentář ze strany rodiny či okolí dívky týkající se tělesného vzhledu. U dívek s lehkou nadváhou někdy bývá počátek hubnutí okolím pozitivně oceňován, proto jej dívka dožene do extrémů.
Mezi další rizikové faktory patří závažná rodinná situace, jakou je např. rozvod rodičů. Dále jsou to nevhodné jídelní a dietní postoje mezi matkami anorektiček, obezita a diety v rodině, psychiatrické onemocnění v rodině, také deficit rodičovské péče nebo nadměrně vysoké očekávání rodičů – dívky na sebe často chtějí pouze upoutat jejich pozornost. Výskyt PPP pozorujeme mezi sourozenci v rozmezí mezi 3–10 % [16]. Mezi rizikové faktory vzniku MA patří také určité osobnostní rysy a psychiatrické příznaky – úzkost, kognitivní rigidita, vyhýbavé chování, perfekcionizmus, vytrvalost, obsedantní rysy, negativní sebehodnocení, deprese a vědomé autoagresivní chování [17]. Asociaci s jinými psychiatrickými onemocněními potvrzuje i výsledek studie publikované v roce 2017 prováděné na 3 500 pacientkách s MA a 11 000 kontrolách, kdy byl nalezen signifikantní rozdíl lokusu na chromozomu 12, který je zároveň asociován se schizofrenií a depresí [18]. MA jsou ohroženy především skupiny, kde je extrémní štíhlost vyžadována, a to modelky, baletky, gymnastky a vrcholové sportovkyně. Obecně mívají pacientky s MA výborný školní prospěch, spoustu koníčků a zájmů.
V rámci hledání odpovědi na etiologii MA proběhl výzkum oblasti kortikolimbické dráhy pomocí funkční magnetické rezonance, kdy bylo potvrzeno, že u pacientek s MA vydává přední insula (integrující smyslové aspekty jídla) signifikantně slabší odpověď na sacharózu – je tedy předpoklad, že „hladové signály“ nejsou u pacientek adekvátně rozpoznány [19].
Diagnostika
Hlavním klíčem správné diagnostiky je anamnéza, odebíráme ji spolu se zákonným zástupcem pacientky; v rodinné anamnéze se zaměříme i na věk menarche matky, případně sestry, a výšku rodičů k predikci vzrůstu pacientky. Cíleně se ptáme na předčasné projevy ischemické choroby srdeční (ICHS) a tromboembolických projevů, výskyt trombofilních mutací, psychiatrických onemocnění v rodině, včetně event. PPP u sourozenců. V osobní anamnéze pátráme po endokrinních poruchách, autoimunitních onemocněních či onemocněních gastrointestinálního systému, které samy o sobě nebo sekundárně mohou vést k amenoree, pokud nám tyto informace nezpracoval již odesílající pediatr či jiný dětský odborník (gastroenterolog, alergolog atd.). V gynekologické anamnéze se ptáme na rozvoj sekundárních pohlavních znaků a počátek puberty ve vztahu k věku dívky. Zajímá nás menstruační cyklus pacientky, kdy a při jaké hmotnosti a výšce se objevilo menarche, ptáme se standardně na délku cyklu, dobu a intenzitu krvácení, bolesti při menstruaci. U nynějšího onemocnění zjišťujeme dobu počátku hubnutí, event. spouštěcí moment, stravovací návyky, pohybovou aktivitu, jestli hubnutí provázely průjmy či zvracení, zda nedošlo k náhlé zástavě růstu a při jaké hmotnosti přestala menstruovat.
Při celkovém vyšetření hodnotíme vývoj sekundárních pohlavních znaků dle Tannera. U premenarcheálních dívek můžeme při již částečně vyvinutých prsou a zjevném vývoji ochlupení diagnostikovat retardaci pohlavního dospívání. Menses se za normálních okolností objeví do dvou let od telarche či rok po dosažení maximální růstové rychlosti. Za kritickou hmotnost pro menarche se uvádí 47,8 ± 0,5 kg při alespoň 17 % tělesného tuku [20,21]. Na dívkách postmenarcheálních je vlivem úbytku tukové tkáně obvyklé ochabnutí prsou, prsa jsou malá, ale dle Tannera již na stupni vývoje IV–V (tab. 2). Dále pozorujeme celkovou kachektizaci, již zmíněné lanugo, hematomy nad obratli, případně akrocyanózu.
Tab. 2. Hodnocení vývoje prsou podle Tannera. Tab. 2. Evaluation of breast development according to Tanner. 
Následně provádíme komplexní gynekologické vyšetření přizpůsobené věku pacientky. Již pohledem hodnotíme stav estrogenizace zevních rodidel. Pokračujeme vyšetřením v zrcadlech či vaginoskopií u pacientek před koitarché. Vaginoskopie je endoskopická metoda, při které zavádíme do pochvy dle prostupnosti hymenu vhodný tubus s mandrénem. Ten po zavedení vyjmeme, připojíme zdroj studeného světla s lupovou optikou a prohlédneme čípek a poševní stěny. Zároveň lze provést odběry na mikroskopické či mikrobiologické vyšetření. Při vysunování tubusu prohlédneme poševní sliznici. Dále provádíme bimanuální rektoabdominální, resp. vaginoabdominální (po koitarché) palpační vyšetření. Určujeme proporcionalitu dělohy, její velikost, tvar, konzistenci, pohyblivost, bolestivost a vztah k orgánům malé pánve. Po stranách palpujeme děložní adnexa a posuzujeme dno Douglasova prostoru. Vyšetření zakončujeme sonografií malé pánve, u virginálních dívek nejčastěji přes stěnu břišní při naplněném močovém měchýři, u ostatních vaginální sondou [22].
Z dalších vyšetřovacích metod vždy doplňujeme vyšetření hormonální poševní cytologie [23]. Nátěr odebíráme valivým pohybem vatovou štětičkou z horní třetiny pochvy a stejným mechanizmem nanášíme na podložní sklíčko. Poté preparát zafixujeme, obarvíme trichromem podle Papanicolaua, Shorra a Pekárka a prohlížíme pod mikroskopem se 100–200násobným zvětšením. Hormonální cytologie je nebolestivá, šetrná, rychlá, levná metoda, proveditelná i při krvácení. Přímo svědčí o reakci estrogendependentní tkáně, tedy vaginální sliznice, na endogenní nebo exogenně podávané estrogeny, a to s maximálně dvoudenním zpožděním. Nízkou hladinu estrogenů v organizmu prezentuje nízká sliznice v pochvě tvořená bazálními a parabazálními buňkami s velkým bledým jádrem a úzkým lemem namodralé cytoplazmy. Se zvyšující se hladinou estrogenů přibývají vrstvy postupně se zvětšujících intermediálních buněk s naopak zmenšujícím se, sytěji zbarveným jádrem. Vysoké hladiny estrogenů jsou charakterizovány superficiálními velkými izolovanými plachtovitými buňkami s malým sytým jádrem s okolní bohatou cytoplazmou. S poklesem hladiny estrogenů buňky ztrácejí turgor a přehýbají se, mačkají, krepatí – tento stav nazýváme spádovými změnami. Procentuální poměr jednotlivých buněk vypovídá o míře estrogenizace poševní sliznice a znázorňujeme jej v několika indexech:
- karyopyknotický (KI – poměr superficiálních a intermediálních buněk);
- eozinofilní (EI – poměr eozinofilních a cyanofilních buněk);
- maturační (poměr parabazálních: intermediálních: superficiálních buněk).
Vlivem progesteronu buňky střádají glykogen, mají nepravidelné okraje, jsou stočené do „kornoutů“, shlukují se. Hodnotíme index svinování a shlukování. V praxi porovnáváme, zda cytologický nález odpovídá fázi menstruačního cyklu, tedy rané, střední a pozdní proliferaci nebo sekrečním změnám. Výsledek slouží pro optimalizaci dávky hormonů použitých k léčbě a ke kontrole jejich účinku [22].
Ve spolupráci s pediatrem, dětským endokrinologem a dalšími odborníky provádíme antropometrická vyšetření – hodnotíme růstovou křivku, kostní věk, BMI, procento tělesného tuku, event. indikujeme vyšetření kostní denzity (BMD). Ke zjištění aktuální BMD máme k dispozici několik metod – kvantitativní počítačová tomografie (QCT), magnetická rezonance, kvantitativní ultrasonografie. Pro svou jednoduchost a interpretovatelnost se nejvíce v klinické praxi využívá denzitometrie neboli DEXA/DXA (dual-energy X-ray absorptiometry). Výsledek denzitometrie [g/cm2] srovnáváme s denzitometrií jiných mladých zdravých pacientů, kdy určujeme směrodatnou odchylku (SD) od očekávaného průměru (T-skóre) nebo s výsledkem pacientů stejného věku, pohlaví a výšky (Z-skóre). Především v populaci < 20 let by mělo být Z-skóre preferováno. U mladých pacientů využíváme ke zjištění BMD především celotělové DXA a DXA bederní páteře [24]. Úbytek kostní tkáně, který se projeví na denzitometrickém vyšetření, je někdy jediným argumentem, který matky těchto pacientek přesvědčí, že má jejich dcera závažný problém.
Pokud dívka přichází do ambulance pro amenoreu, indikujeme základní hormonální vyšetření – zjištění hladiny FSH, LH, estradiolu, progesteronu, androgenů, prolaktinu, TSH, fT4, fT3, IGF-1, kortisolu, případně provádíme GnRH test.
Vždy musí být vyloučena v rámci diferenciální diagnostiky jiná závažná etiologie hubnutí a dalších závažných symptomů jako je bradykardie, zvracení, anemie nebo hypoproteinemické otoky.
Z toho důvodu je součástí vyšetřovacího algoritmu gastroenterologické, oční, neurologické a kardiologické vyšetření, ultrazvuk břicha a rentgen hrudníku. Doporučuje se další laboratorní vyšetření – krevní obraz, stanovení hladiny trasferinu a feritinu, C-reaktivní protein (CRP), vyšetření jaterních enzymů, amylázy, ledvinných funkcí, iontogram, hladina cholesterolu, albuminu, prealbuminu, celkové bílkoviny a imunoglobulinů. Standardně se vyšetřuje moč, stolice na okultní krvácení a parazity. Při vyloučení organického onemocnění následuje psychologické a psychiatrické vyšetření.
Léčba
K léčbě je nutné přistupovat komplexně, multioborově. Léčba je obvykle dlouhodobá, u pacientek s MA trvá průměrně 6 let a často je velmi obtížná na spolupráci s pacientkou a rodinou. Léčbu můžeme nazvat kauzální pouze ve smyslu psychologické a psychiatrické péče, ale jinak je symptomatická. V léčbě se využívá primárně psychoterapie; farmakoterapie není léčbou první volby, ale v prevenci relapsu mentální anorexie byla prokázána účinnost selektivních inhibitorů zpětného vychytávání serotoninu [25].
Důležitým faktorem správné léčby je realimentace. S realimentací se postupně zlepšuje i psychický stav pacientek. Proto je správná nutriční terapie spolu s psychologickou terapií základem léčby. Stran nutrice je doporučována výživná a pestrá strava s postupným zvyšováním kalorického příjmu, přičemž stravování by mělo probíhat s dohledem, aby nedocházelo k manipulaci s jídlem. Pacientky jsou poučeny o zapisování jídelníčku, aby jej bylo možné zpětně hodnotit. Pokud pacientky režim dodržují a začnou přibývat na hmotnosti, je možné i ambulantní sledování. Naopak hospitalizace se doporučuje při výrazném poklesu hmotnosti, nebo pokud se hmotnost ambulantně nezvyšuje, nebo má-li pacientka známky hypometabolického stavu, to znamená např. bradykardii, hypotenzi, hypotermii nebo trpí výrazným depresivním syndromem. Hospitalizace může být vhodná i v případech patologické rodinné interakce [26].
Přístup gynekologa je vždy přísně individuální. Jeho zapojení do týmu pečujícího o dívku a případná medikace má především symptomatický a adjuvantní charakter. Při léčbě je nutná spolupráce s rodinou. Žádná z forem hormonální substituce neovlivňuje kauzálně nutriční změny pacientek. Substituce je pouze léčbou symptomatickou, kterou můžeme zabránit dalšímu úbytku kostní hmoty a regresi rozvoje estrogendependentních tkání. Pacientky substituujeme po dohodě s ostatními ošetřujícími lékaři, především ošetřujícím pediatrem. Má-li pacientka s primární amenoreou nízký vzrůst a ještě otevřené růstové štěrbiny a je léčena růstovým hormonem, je potřeba dávky estrogenu titrovat opatrně, tzn. provádět pouze tzv. miniestrogenizaci. Při této formě léčby podáváme pouze tak malé dávky estrogenů, které nezpůsobí viditelný klinický efekt na reprodukční soustavě a nevedou k uzavření růstových kostních štěrbin, ale naopak vedou k podpoře přirozeného růstu a k postupnému rozvoji sekundárních pohlavních znaků. Na začátku léčby se dávky pohybují okolo 100 µg estradiolu za den s postupným navyšováním dle klinického stavu. Takto malé dávky je možno nechat připravit magistraliter. Tato fáze substituční léčby je nutná především k podpoře celkového růstu. Při cílové výšce je dalším krokem postupné navyšování dávek estrogenů až do dosažení plné estrogenizace poševní sliznice, která se prokáže funkční cytologií. Snahou dětského gynekologa je šetrnou podpůrnou léčbou postupně dosáhnout pubertálního rozvoje a navození menstruačního cyklu. U pacientek s rizikem tromboembolizmu je vhodné před nasazením léčby konzultovat hematologa.
V roce 2012 byly publikovány výsledky efektu podávání fyziologických dávek estrogenů na kostní denzitu u pacientek s MA ve srovnání s placebem. Dívky > 15 let byly léčeny transdermálně 100 µg 17â-estradiolem (cyklicky s gestageny) a mladší dívky perorálním ethinyl-estradiolem v dávce 3,75–11,25 µg, která se postupně zvyšovala během 18 měsíců. Z-score bylo zvýšeno u obou skupin léčených dívek ve srovnání s kontrolní skupinou [27].
Přípravky hormonální antikoncepce nejsou v tomto věku lékem volby pro inhibiční vliv na hypothalamo-hypofyzo-ovariální osu. V minulosti bylo publikováno několik studií dokazujících, že suprafyziologické dávky hormonů podávané formou orální antikoncepce nevedou u pacientek s MA ke zvýšení kostní denzity [28,29].
V minulosti proběhla i studie, která srovnávala efekt podávání rekombinantního IGF-1 a perorální antikoncepce, kdy samotné podávání COC (combined oral contraception) nemělo signifikantní vliv na nárůst BMD. Při samotném podávání rekombinantního IGF-1 již byl prokázán signifikantní nárůst kostní denzity, ale největšího efektu bylo dosaženo při kombinaci aplikace rekombinantního IGF-1 a užívání perorální antikoncepce [30,31].
Pacientku substituujeme dle trendu hmotnosti, tzn. pokud pacientka zvyšuje hmotnost, dávky léčiv postupně snižujeme, dále dávku titrujeme dle stavu estrogen dependentních tkání (hormonální cytologie, ultrazvukové vyšetření, funkční testy). Dle výsledků klinických studií bychom měli upřednostňovat transdermální formu podání [7], která má ale limitaci právě v titraci dávky. V roce 2020 byla publikována studie z Bostonu na efekt transdermálně podávaného estradiolu v dávce 45 µg/den spolu s levonorgestrelem 15 µg/den u pacientek s MA. Během šesti měsíců bylo zaznamenáno zvýšení kostní denzity bederní páteře o 2 % a zároveň snížení adipozity kostní dřeně o 13,9 % [32]. Za hranici podílu tukové hmoty k pravidelnému menstruačnímu cyklu se uvádí 22 % [21].
Léčba bisfosfonáty je u dětí určena jen pro symptomatickou osteoporózu. V minulosti proběhla studie s podáváním alendronátu, kdy u pacientek na léčbě došlo ke zvýšení denzity kostní hmoty oproti pacientkám dostávajícím placebo (p = 0,02). Největší efekt na zvýšení denzity však měl hmotnostní přírůstek, pro bederní páteř bylo p < 0,001 [33].
Rizika do budoucna
Rozvoj MA v adolescenci může zabránit přirozenému vývoji osobnosti a dozrání orgánových systémů. Přes poruchu funkce osy hypothalamus-hypofýza-ovarium a s tím související anovulací, prohlubující se v amenoreu, rezultující v hypoplazii dělohy může vést MA až ke sterilitě. U pacientek s bulimií se častěji objevuje syndrom polycystických ovarií [6]. V roce 2018 na populaci Utahu srovnávali paritu a věk rodiček mezi jednotlivými skupinami žen s PPP (n = 1 576) a zdravou kontrolní skupinou. Ve zdravé skupině rodilo téměř 50 % žen, oproti tomu u žen s PPP to bylo jen 20 %. Mezi jednotlivými PPP nebyly signifikantní rozdíly. Ženy s MA rodily první dítě ve věku 26,4 let oproti běžné populaci, kde ženy rodily ve věku 24,1 let (p < 0,001). Dále porovnali rozdíly mezi sourozenci (n = 503), kdy žena s PPP měla paritu 0,34 oproti sestře 0,64 (p < 0,001), zdravá populace měla paritu 1,3 [34]. Z norského registru novorozenců bylo zjištěno, že pacientky s PPP mají horší perinatální výsledky. Ženy s mentální anorexií mají vyšší riziko porodu malého plodu (SGA) – OR 2,7 (odds ratio). Ženy s mentální bulimií mají OR 1,7, že těhotenství bude ukončeno císařským řezem. Obecně všechny ženy s PPP mají OR 3,1 nízkého Apgar skóre v 5. min života novorozence [35]. Ve švédské studii také potvrdili, že ženy s PPP rodí menší děti (p < 0,01) s menším obvodem hlavičky (p < 0,001) [36]. V londýnské studii se zase zabývali perinatálními výsledky pacientek s mentální bulimií a zjistili, že OR je 2,8 pro spontánní potrat, předčasný porod nebo poporodní depresi [37].
Z psychosociálního hlediska mohou mít dívky problém se zařazením a uplatněním ve společnosti, ale při úpravě hmotnosti většinou dochází k úpravě doprovodných psychopatologických rysů.
Celkově je třeba zdůraznit, že 5 % anorektických dívek umírá. Ženy, které se nevyléčí, se průměrně dožívají 33 let – v této době umírá asi 20 % nemocných [38]. Pacientky jsou ohroženy kardiovaskulárními komplikacemi, a to sinusovou bradykardií, hypotenzí, systolickou dysfunkcí, prolapsem mitrální chlopně, dokonce může nastat náhlé kardiovaskulární selhání způsobené metabolickým rozvratem [39]. Ze zkušeností vyplývá, že negativními prognostickými faktory jsou nízký BMI na počátku i při ukončení léčby, doba trvání nemoci a rozvoj onemocnění v pozdějším věku. Horší prognózu mají i dívky, které trpí dalším přidruženým psychiatrickým onemocněním nebo u kterých se jednotlivé PPP kombinují, či pacientky, které již mají somatické následky.
Závěr
Poruchy příjmu potravy jsou vážnými psychiatrickými onemocněními, která mohou končit fatálně. Prvním klinickým projevem může být opožďování pohlavního dospívání, oligomenorea či amenorea, které pacientku přivedou do ambulance gynekologa, jenž by měl v rámci diferenciální diagnostiky na souvislost s PPP myslet a zajistit pacientce další odbornou péči v rámci multidisciplinární spolupráce.
Obdrženo/Submitted: 7. 12. 2020
Přijato/Accepted: 8. 1. 2021
doc. MUDr. Michael Fanta, Ph.D.
Gynekologicko-porodnická klinika
1. LF UK a VFN v Praze
Apolinářská 18
128 51 Praha 2
Zdroje
1. Hudson JI, Hiripi E, Pope HG Jr et al. The prevalence and correlates of eating disorders in the National Comorbidity Survey Replication. Biol Psychiatry 2007; 61 (3): 348–358. doi: 10.1016/j.biopsych.2006.03.040.
2. American psychiatric association. Diagnostic and statistical manual of mental disorders (DSM-5). 5th ed. Arlington, VA: American Psychiatric Pubblishing 2013 : 991.
3. Forman SF et al. Eating disorders: overview of epidemiology, clinical features and diagnosis. In: Waltham MA. UpToDate 2016. [online]. Available from: https: //www.uptodate.com/contents/eating-disorders-overview-of-epidemiology-clinical-features-and - diagnosis.
4. Papežová H et al. Anorexie, bulimie a psychogenní přejídání: interdisciplinární a transdiagnostický pohled (Edice postgraduální medicíny). Praha: Mladá fronta 2018.
5. Katzmarzyk PT, Srinivasan SR, Chen W et al. Body mass index, waist circumference and clustering of cardiovascular disease risk factors in a biracial sample of children and adolescents. Pediatrics 2004; 114 (2): e198–e205. doi: 10.1542/peds.114.2.e198.
6. Kimmel MC, Ferguson EH, Zerwas S et al. Obstetric and gynecologic problems associated with eating disorders. Int J Eat Disord 2016; 49 (3): 260–275. doi: 10.1002/eat.22483.
7. Misra M, Klibanski A. Endocrine consequences of anorexia nervosa. Lancet Diabetes Endocrinol 2014; 2 (7): 581–592. doi: 10.1016/ S2213-8587 (13) 70180-3.
8. Thorton D, Gordon CM. Restrictive eating disorders and skeletal health in adolescent girls and young women. Calcif Tissue Int 2017; 100 (5): 449–460. doi: 10.1007/s00223-016-0164-0.
9. Shab B, Sucher K, Hollenbeck CB. Comparison of ideal body weight equations and published height-weight tables with body mass index tables for healthy adults in the United States. Nut Clin Pract 2006; 21 (3): 312–319. doi: 10.1177/0115426506021003312.
10. Fleisher LA. Anesthesia and uncommon diseases. 6th ed. Philadelphia: Elsevier Saunders 2012 : 215–224.
11. Latzer IT, Kidron-Levy H, Stein D et al. Predicting menstrual recovery in adolescents with anorexia nervosa using body fat percent estimated by bioimpedance analysis. J Adolesc Health 2019; 64 (4): 454–460. doi: 10.1016/j.jadohealth.2018.10.008.
12. Kanis JA, McCloskey EV, Johansson H et al. A reference standard for the description of osteoporosis. Bone 2008; 42 (3): 467–475. doi: 10.1016/j.bone.2007.11.001.
13. Marshall D, Johnell O, Wedel H. Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. BMJ 1996; 312 (7041): 1254–1259. doi: 10.1136/bmj.312.7041.1254.
14. Schorr M, Klibanski A. Anorexia nervosa and bone. Curr Opin Endocr Metab Res 2018; 3 : 74–82. doi: 10.1016/j.coemr.2018.01.002.
15. Tenconi E, Santonastaso P, Monaco F et al. Obstetric complications and eating disorders: a replication study. Int J Eat Disord 2015; 48 (4): 424–430. doi: 10.1002/eat.22304.
16. Krch F. Poruchy příjmu potravy. Praha: Grada Publishing 1999.
17. Vavrušová R. Specifické aspekty mentální anorexie z pohledu dětské a dorostové gynekologie. Prakt Gyn 2008; 12 (3): 172–179.
18. Duncan L, Yilmaz Z, Gaspar H et al. Significant locus and metabolic genetic correlations revealed in genome-wide association study of anorexia rervosa. Am J Psychiatry 2017; 174 (9): 850–858. doi: 10.1176/appi.ajp.2017.16121 402.
19. Oberndorfer TA, Frank GK, Simmons AN et al. Altered insula response to sweet taste processing after recovery from anorexia and bulimia nervosa. Am J Psychiatry 2013; 170 (1): 1143–1151. doi: 10.1176/appi.ajp.2013.11111 745.
20. Hořejší J, Kosová H et al. Dětská gynekologie. 2 vyd. Praha: Mladá fronta 2019.
21. Baker ER. Body weight and the initiation of puberty. Clin Obstet Gynecol 1985; 28 (3): 573–579. doi: 10.1097/00003081-198528030-00013.
22. Skřenková J. Postmenarcheal irregularities in menstrual cycle in adolescent girls. Čas Lék čes 2018; 157 (7): 343–349.
23. Dušková J, Goldová B, Matiášková L et al. Contribution of hormonal cytology in girls and adolescents to reproductive health: a traditional technique monitoring recent problems. Acta Cytol 2017; 61 (2): 125–132. doi: 10.1159/000470898.
24. Bachrach LK, Gordon CM, Section on Endocrinlogy. Bone densitometry in children and adolescents. Pediatrics 2016; 138 (4): e20162398. doi: 10.1542/peds.2016-2398.
25. Holtkamp K, Konrad K, Kaiser N et al. A retrospective study of SSRI treatment in adolescent anorexia nervosa: insufficient evidence for efficacy. J Psychiatr Res 2005; 39 (3): 303–310. doi: 10.106/j.jpsychires.2004.08.001.
26. Kocourková J, Koutek J. Mentální anorexie s raným začátkem, diagnostika a terapie. Čes-slov Pediat 2018; 73 (5): 320–323.
27. Misra M, Katzman D, Miller KK et al. Physiologic estrogen replacement increases bone density in adolescent girls with anorexia nervosa. J Bone Miner Res 2011; 26 (10): 2430–2438. doi: 10.1002/jbmr.447.
28. Golden NH, Lanzkowsky L, Schebendach J et al. The effect of estrogen-progestin treatment on bone mineral density in anorexia nervosa. J Pediatr Adolesc Gynecol 2002; 15 (3): 135–143. doi: 10.1016/s1083-3188 (02) 00 145-6.
29. Klibanski A, Biller BM, Schoenfeld DA et al. The effects of estrogen administration on trabecular bone loss in young women with anorexia nervosa. J Clin Endocrinol Metab 1995; 80 (3): 898–904. doi: 10.1210/jcem.80.3.7883 849.
30. Grinspoon S, Thomas L, Miller K et al. Effects of recombinant human IGF-I and oral contraceptive administration on bone density in anorexia nervosa. J Clin Endocrinol Metab 2002; 87 (6): 2883–2891. doi: 10.1210/jcem.87.6.8 574.
31. Strokosch GR, Friedman AJ, Wu SC et al. Effects of an oral contraceptive (norgestimate/ethinyl estradiol) on bone mineral density in adolescent females with anorexia nervosa: a double-blind, placebo-controlled study. J Adolesc Health 2006; 39 (6): 819–827. doi: 10.1016/j.jadohealth.2006.09.010.
32. Resulaj M, Polineni S, Meenanghan E et al. Transdermal estrogen in women with anorexia nervosa: an exploratory pilot study. JBMR Plus 2020; 4 (1): e10251. doi: 10.1002/jbm4.10251.
33. Golden NH, Iglesias EA, Jacobson MS et al. Alendronate for the treatment of osteopenia in anorexia nervosa: a randomized, double-blind, placebo-controlled trial. J Clin Endocrinol Metab 2005; 90 (6): 3179–3185. doi: 10.1210/jc.2004-1659.
34. Tabler J, Utz RL, Smith KR et al. Variation in reproductive outcomes of women with histories of bulimia nervosa, anorexia nervosa, or eating disorder not otherwise specified relative to the general population and closest-aged sisters. Int J Eat Disord 2018; 51 (2): 102–111. doi: 10.1002/eat.22827.
35. Eik-Nes TT, Horn J, Strohmaier S et al. Impact of eating disorders on obstetric outcomes in a large clinical sample: a comparison with the HUNT study. Int J Eat Disord 2018; 51 (10): 1134–1143. doi: 10.1002/eat.22916.
36. Koubaa S, Hällström T, Lindholm C et al. Pregnancy and neonatal outcomes in women with eating disorders. Obstet Gynecol 2005; 105 (2): 255–260. doi: 10.1097/01.AOG.0000 148265.90984.c3.
37. Morgan JF, Lacey JH, Chung E. Risk of postnatal depression, miscarriage, and preterm birth in bulimia nervosa: retrospective controlled study. Psychosom Med 2006; 68 (3): 487–492. doi: 10.1097/01.psy.0000221265.43407.89.
38. Papežová H. Spektrum poruch příjmu potravy. Praha: Grada Publishing 2010 : 424.
39. Jáuregui-Garrido B, Jáuregui-Lobera I. Sudden death in eating disorders. Vasc Health Risk Manag 2012; 8 : 91–98. doi: 10.2147/VHRM.S28652.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2021 Číslo 1- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Editorial
- Aspekty výběru embryí a jejich příprava pro vznik lidských embryonálních kmenových buněk určených k humánní terapii
- Zvýšení sérových hladin S100–A11 a AIF-1 u pacientek s dysplazií děložního hrdla
- Zvýšení sérových hladin S100–A11 a AIF-1 u pacientek s karcinomem hrdla děložního a postižením lymfatických uzlin
- Smoking in women with chronic vaginal discomfort is not associated with decreased abundance of Lactobacillus spp. but promotes Mobiluncus and Gardnerella spp. overgrowth – secondary analysis of trial data including microbiome analysis
- Kombinovaná peripartálna separácia symfýzy a sakroiliakálneho kĺbu
- Myomatóza děložních rudimentů u pacientky s Mayer-Rokitansky-Küster-Hauser syndromem
- Aktuální etické aspekty léčby absolutního uterinního faktoru neplodnosti pomocí transplantace dělohy
- Poruchy příjmu potravy v ambulanci gynekologa pro děti a dospívající
- Nežádoucí účinky PARP inhibitorů
- 30. sympozium asistované reprodukce s mezinárodní účastí a 19. česko-slovenská konference reprodukční medicíny, 10.–11. listopadu 2020, Brno
- Osobní vzpomínka na MUDr. Karla Nouzu, DrSc.
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nežádoucí účinky PARP inhibitorů
- Kombinovaná peripartálna separácia symfýzy a sakroiliakálneho kĺbu
- Aspekty výběru embryí a jejich příprava pro vznik lidských embryonálních kmenových buněk určených k humánní terapii
- Poruchy příjmu potravy v ambulanci gynekologa pro děti a dospívající
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



