-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Výskyt autoimunitních onemocnění po aplikaci biologických léků
Occurence of autoimmune diseases following the biological treatment
Biological therapy of chronic inflammatory, rheumatic, gastroenterological and dermatological diseases has revolutionized the treatment of these conditions. The number of patients treated with biologicals as well as the range of indications for this therapy is still growing. Although this treatment is relatively safe, adverse events may occur including development of autoimmune disorders. These autoimmune diseases may be divided into autoimmune systemic diseases and organ specific autoimmune diseases. Systemic lupus erythematosus (SLE) and vasculitides are among the most frequently induced systemic autoimmune diseases, whereas demyelinating diseases of the central nervous system (CNS) and peripheral neuropathy, interstitial lung disease and autoimmune hepatitis represent the organ specific group. Autoimmune diseases are most frequently induced by anti-TNF agents. Drug induced lupus usually manifests with consitutional symptoms, skin and joint involvement, haematological abnormalities and serositis. Nephritis and CNS involvement are less common. Anti-TNF induced SLE patients are ANA positive in 100% and anti dsDNA positive in 90%, whereas in classical drug induced SLE and idiopathic SLE, anti dsDNA positivity occurs less frequently. Antinuclear antibodies (ANA) are typical for classical drug induced SLE (occurs in 95%), less frequent in TNF induced SLE (57%) and least frequent in idiopathic SLE (25–40%). The treatment of drug induced SLE consists of discontinuation of TNF therapy in mild cases and mandatory use of corticosteroids and immunosuppressive therapy in more severe cases. The prognosis is good; the portion of patients with persistent disease is approximately 13%. In this review article, the author included two case reports describing patients with drug induced lupus from the Institute of Rheumatology in Prague including their treatment. Patients with skin vasculitis dominated the group of vasculitis patients with 88%, whereas renal involvement and peripheral neuropathy were rare. Conclusion: It is necessary to consider the possibility of drug induced autoimmune disease following a biological therapy when forming a differential diagnosis, and to take adequate therapeutic actions. In most cases, discontinuation of anti-TNF therapy is sufficient, whereas in more severe cases, introduction of immunosuppressive treatment is mandatory.
Key words:
autoimmune disease, anti-TNF therapy, drug induced systemic lupus erythematosus
Autori: K. Pavelka; K. Jarošová
Pôsobisko autorov: Revmatologický ústav a Klinika revmatologie 1. LF UK Praha
Vyšlo v časopise: Čes. Revmatol., 19, 2011, No. 1, p. 4-10.
Kategória: Přehledné články
Súhrn
Biologická léčba chronických, zánětlivých, revmatických, gastroenterologických a kožních onemocnění znamená revoluci v této léčbě. Stále přibývá pacientů léčených biologiky i indikací této léčby. Tato léčba je celkem bezpečná, ale mohou vznikat některé nežádoucí účinky, mezi které patří i indukce autoimunitních nemocnění. Tato autoimunitní onemocnění se dají rozdělit na skupinu autoimunitních onemocnění systémových a druhou skupinu orgánově specifických. Mezi nejčastější indukovaná onemocnění patří systémový lupus erytematodes (SLE) a vaskulitidy, z orgánově specifických pak demyelinizační onemocnění centrálního nervového systému (CNS) a periferní neuropatie, dále pak intersticiální plicní onemocnění a autoimunní hepatitidy. Nejčastější výskyt indukovaných onemocnění je po anti TNF preparátech. Léky indukovaný lupus většinou probíhá jako celkové onemocnění s příznaky kožními a kloubními, hematologickými abnormalitami a serozitidou. Naopak výskyt nefritidy a postižení CNS systému jsou méně časté. U anti TNF indukovaného SLE mají pacienti ve 100 % pozitivní ANA a v 90 % pozitivní anti dsDNA, zatímco u klasického léky indukovaného SLE i idiopatického SLE je výskyt anti dsDNA méně častý. Antinukleární protilátky jsou typické pro klasický léky indukovaný SLE (výskyt 95 %), méně časté pro TNF indukovaný SLE (57 %) a nejméně časté u idiopatického SLE (25-40 %). Léčba léky indukovaného SLE spočívá ve vysazení anti TNF preparátu v lehčích případech, u těžší formy onemocnění je nutné použít kortikosteroidy a imunosupresivní léky. Prognóza onemocnění je dobrá, počet pacientů s trvalým onemocněním je kolem 13 %. Autor vložil do přehledné publikace dvě kazuistiky pacientů z Revmatologického ústavu v Praze s léky indukovaným lupusem, včetně jejich léčby. V publikované skupině pacientů s vaskulitidou dominovali pacienti s kožní vaskulitidou 88 %, postižení ledvin a periferní neuropatie byla vzácnější. Závěr. Na možnost vzniku léky indukovaného autoimunitního onemocnění po aplikaci biologických léků je diferenciálně diagnosticky myslet a zaujmout adekvátní terapeutický postup. Ve většině případů spočívá ve vysazení anti TNF léčby, v těžších případech je nutné nasadit imunosupresivní léčbu.
Klíčová slova:
autoimunitní onemocnění, anti TNF léčba, léky indukovaný systémový lupus erytematodesBiologické léky přinesly zcela novou kvalitu do léčby revmatoidní artritidy a spondylartritid. Rychle a mohutně potlačují zánětlivou aktivitu, zmenšují bolest, ztuhlost a zlepšují funkci a kvalitu života nemocných (1). Navíc zpomalují rentgenovou progresi onemocnění (2). Tolerance těchto léků je akceptabilní, jak ukázaly randomizované, klinické studie a jejich otevřené extense, dále pak data z registrů biologické léčby v posledních 10 letech (3). Mezi nejčastější nežádoucí účinky biologické léčby patří infekce včetně tuberkulózy a oportunních infekcí, alergické a lokální reakce, pancytopenie a aplastická anémie, kardiovaskulární projevy a vznik autoimunitních onemocnění včetně demyelinizačních onemocnění. Častější výskyt lymfomů a solidních nádorů jednoznačně potvrzen nebyl (4).
Autoimunitní onemocnění indukovaná biologickými léky patří mezi méně časté nežádoucí účinky této léčby. Zdrojem informací jsou především publikované kazuistiky a některé registry (5). Relativně málo je známo o klinickém významu těchto indukovaných autoimunitních onemocnění a jejich optimální léčbě.
Biologických léků užívaných v běžné klinické praxi je dnes několik. Největší skupinu tvoří léky blokující TNF alfa, dále IL-1, IL-6, léky vyvolávající depleci B buněk a aktivaci T buněk blokádou kostimulace. Zdaleka nejvíce dat z dlouhodobé léčby je k dispozici o blokátorech TNF alfa.
Klasifikace autoimunitních onemocnění
Autoimunitní onemocnění po aplikaci biologických léků byly popsány nejprve po infliximabu u revmatoidní artritidy (6). Od té doby byl popsán vznik autoimunitních onemocnění po řadě dalších biologických léků. S tím, jak přibývají další revmatologické i nerevmatologické indikace biologické léčby, přibývá exponovaných pacientů ale i indukovaných onemocnění. Je určitým paradoxem, že pro řadu autoimunitních onemocnění je právě lék, který ho vyvolal, používán k jeho léčbě.
Nejčastějším autoimunitním onemocněním je systémový lupus erytematodes (SLE) a vaskulitidy (7). Největší publikovaný soubor pak tvoří 800 případů ze španělského registru (8). Casals v této práci rozdělil autoimunitní onemocnění indukovaná biologickými léky na skupinu autoimunitních onemocnění, kam zařadil léky indukovaný SLE, vaskulitidy, antifosfolipidový syndrom a sarkoidózu. Druhou skupinu pak tvoří orgánově specifická autoimunitní onemocnění, mezi které řadíme neuritidu optiku, demyelinizační onemocnění typu roztroušené sklerózy, periferní neuropatii, zánětlivé oční onemocnění a autoimunitní hepatitidu (tab. 1).
Tab. 1. Nejčastější autoimunitní onemocnění asociovaná s biologickými léky dle Casalse a spol. (18). 
Pozn.: číslo v závorce udává počet popsaných případů v souboru 800 pacientů skupiny BIOGEAS Mechanismus vzniku léky indukovaného autoimunitního onemocnění
Mechanismus vzniku polékových autoimunitních onemocnění není jasný. Nejvíce experimentálních poznatků, které umožnily návrhy určitých hypotéz, je pro indukci SLE. Hypotéza „cytokinového posunu“ říká, že farmakologická blokáda TNF alfa potlačuje produkci Th1 cytokinů, přičemž stimuluje produkci Th2 cytokinů, jako je IL-10 a IFN gama. Tento posun v rovnováze cytokinů může indukovat kaskádu reakcí vedoucí finálně k produkci autoprotilátek a vzniku SLE (9). Další hypotéza je založená na předpokladu, že inhibice TNF alfa může interferovat s apoptózou a ovlivňovat odstraňování nukleárního debris a tak podporovat vznik anti ds DNA a dalších antinukleárních protilátek (10). Podobně TNF alfa indukovaná apoptóza zralých cytotoxických T buněk je důležitý mechanismus pro ukončování T lymfocyty řízených odpovědí. Anti TNF terapie může interferovat s tímto procesem a umožňovat vznik antinukleárních protilátek (11). Alternativně může inhibice cytotoxických T buněk anti TNF léčbou redukovat eliminaci autoprotilátky produkujících B buněk (12). Další hypotéza se zabývá otázkou nálezu detekce nukleárních antigenů v plasmě pacientů po zahájení anti TNF léčby. Zvýšení těchto plasmatických hladin nukleosomů může přispívat k prolomení tolerance a vzniku antinukleosomálních protilátek, které silně korelují s přítomností ANA u anti TNF léčených pacientů (13).
Léky indukovaný lupus erytematodes
Léky indukovaný lupus byl poprvé popsán po léčbě sulfadiazinem v roce 1945 (14) a od té doby byl publikován vznik SLE po více než 80 substancích. Původně byl popsán jako mírnější forma než je primární lupus, která odeznívá se skončením léčby indukujícím lékem. Jednotná klasifikační kritéria pro léky indukovaný SLE nejsou používána. Nejpřísnější jsou kritéria ACR, která vyžadují splnit 4/11 diagnostických kritérií pro SLE (15) a navíc vznik lupusu během expozice danému léku. Některé skupiny používají širší kritéria např.: splnění 1–2 diagnostických kritérií pro SLE, adekvátní a pokračující expozici danému léku a odeznění příznaků po skončení léčby daným lékem (16).
Postmarketinkové studie tří registrovaných anti TNF léků zjistily incidenci léky indukovaného SLE v 0,19–0,22 % po infliximabu, 0,18 % po etanerceptu a 0,10 % po adalimumabu (17). Nicméně prevalence léky indukovaného SLE v randomizovaných studiích je vyšší, když bylo identifikováno 14 pacientů (0,76 %) u 1842 pacientů zařazených do 17 studií. Zjištěné rozdíly mezi jednotlivými studiemi byly také částečně ovlivněny použitými kritériemi. Ramos Casals ve španělském registru popsal skupinu 140 pacientů s léky indukovaným SLE. Klinický obraz léky indukovaného SLE byl jasně odlišný od idiopatického SLE. Výskyt nejzávažnějších SLE projevů, především renálních a CNS byl u léky indukovaného SLE nižší. Williams a spol. ve své práci srovnala klinické rysy publikovaných souborů z USA, Velká Británie, Španělska a Francie (18). Většina pacientů ve francouzském souboru (12 pacientů) s plně vyvinutým SLE měla horečku nebo systémové příznaky (75 %), z dalších příznaků se vyskytovaly kožní vyrážka, artritida, hematologické abnormality, sérozitida (25 %) a myozitida (33 %). Žádný z pacientů neměl nefritidu. Antinukleární protilátky se vyskytly ve 100 % pacientů, anti ds DNA v 92 %, antifosfolipidové v 50 %, anti ENA ve 42% a antihistonové protilátky 17 % (17). Klinický obraz se v zásadě shodoval s klinickým obrazem v registru americkém (18) a španělském (19). Skupina americká, která čítala 33 pacientů s léky indukovaným SLE, byla také srovnána se skupinou s léky indukovaným SLE. Systémové příznaky jako horečka, malátnost, artralgie, myalgie a pleuritida byly stejně časté v obou skupinách, zatímco kožní postižení bylo častější ve skupině léky indukovaného než idiopatického SLE (72 % vs. 9–27 %). V této americké studii se lišily léky indukovaný a idiopatický SLE rovněž v autoprotilátkovém profilu. Klasický SLE, byl jak je dobře známo, silně asociovaná s ANA (více než 99 %) a antihistonovými protilátkami (více než 95 %), zatímco anti ds DNA byly málo časté (méně než 1 %). Zatímco u léky indukovaného SLE byly antihistonové protilátky přítomny pouze v 57 %, anti ds DNA byly pozitivní v 90 % (20) (tab. 2).
Tab. 2. Autoprotilátkový profil u pacientů s hlášením léky indukovaným lupusem po anti TNF terapii podle Williamse a spol. (19). 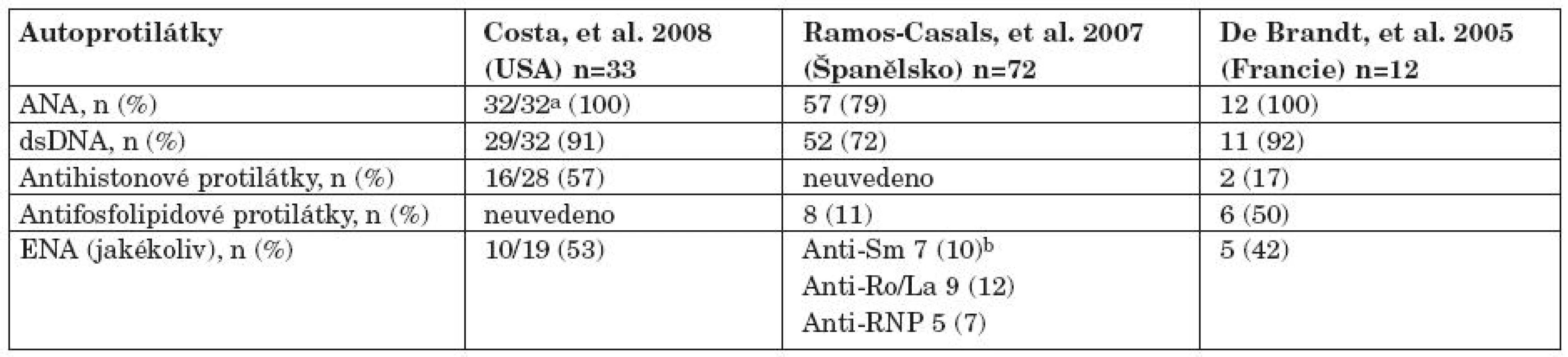
Léčba léky indukovaného systémového lupus erytematodes
Doporučení pro prevenci léky indukovaného SLE po anti TNF léčbě zatím neexistuje. Vznik SLE je předcházen tvorbou autoprotilátek (21). Bylo tedy uvažováno o tom, že by současná aplikace DMARD, konkrétně MTX mohla snižovat vznik autoprotilátek a tím i vznik SLE. I když je přímé srovnání mezi studiemi obtížné, protože většina pacientů byla léčena současně s anti TNF methotrexátem, data z klinických studií s infliximabem nepotvrzují fakt, že by léčba MTX byla protektivní (10).
Léky indukovaný SLE dobře odpovídá na vysazení anti TNF léčby. Ve španělském registru BIOGEAS (7) odezněly příznaky SLE po vysazení anti TNF v 94 % případů (21). Čtyřicet procent pacientů vyžadovalo léčbu kortikosteroidy a 12 % vyžadovalo dodatečnou imunosupresivní léčbu MTX, leflunomidem, azathioprinem, mykofenolátem a cyklofosfamidem (21). Na základě získaných zkušeností navrhuje skupina BIOGEAS rozdělit léky indukovaný SLE na skupinu lehkou (kožní, kloubní všeobecné příznaky) a skupinu těžkou (plicní, renální a neurologické postižení). U skupiny lehké navrhla pracovní skupina vysazení anti TNF. K možnosti znovu nasazení anti TNF po odeznění příznaků se skupina nevyjádřila. Nicméně u skupiny těžké pracovní skupina navrhla okamžité vysazení anti TNF a zahájení imunosupresivní léčby kortikosteroidy a event. dalšími imunosupresivy (21).
Dvě kazuistiky pacientů s léky indukovaným SLE z Národního registru ATTRA
Prvním případem je 37letý muž, u kterého byla před devíti lety diagnostikována ankylozující spondylitida. Kromě spondylitidy měl pacient od začátku i periferní artritidu. Je HLA B 27 pozitivní a má jasnou sakroiliitidu. Od roku 2003 do roku 2008 byl léčen sulfasalazinem a nesteroidními antirevmatiky. Pro zvýšenou klinickou i laboratorní aktivitu byl v 8/2008 zaveden na léčbu infliximabem v běžných dávkách 5 mg/kg/6 týdnů. Již po třech měsících se dostal do remise onemocnění a jeho CRP bylo 2 mg/l. Z plného zdraví náhle v 5/2010 dostal horečky až 38,5 st., suchý kašel, bolesti na prsou a byl dušný. Na rentgenu byl zjištěn bilaterální fluidothorax (obr. 1), na echokardiografickém vyšetření pak perikarditida. Došlo též k exacerbaci artritidy. V laboratoři se objevily autoprotilátky (ANA 1 : 640 a anti ds DNA 1 : 640), reaktanty akutní fáze byly rovněž vysoké (FW 78/h, CRP 110 mg/l). Pacient splnil kritéria léky indukovaného SLE. Vzhledem k výrazné polyserozitidě byla zahájena léčba středně vysokými dávkami glukokortikoidů, konkrétně 32 mg Medrolu denně. Stav se upravil po 8 týdnech k normě. V současné době je na udržovací dávce Medrolu 4 mg denně, NSA užívá výjimečně a jeho stav je dobrý. Otázkou zůstává, jakou léčbu eventuálně nasadit při nové exacerbaci spondylitidy či artritidy. Otázka bezpečnosti nové léčby anti TNF preparáty u těchto pacientů nebyla zatím zodpovězena. A rovněž není jasné, zda-li je výhodnější zvolit jiný anti TNF preparát nebo podat původní, který měl jinak velmi dobrý efekt.
Obr. 1. Bilaterální fluidotorax na rtg snímku u pacienta s léky indukovaným SLE po léčbě infliximabem. 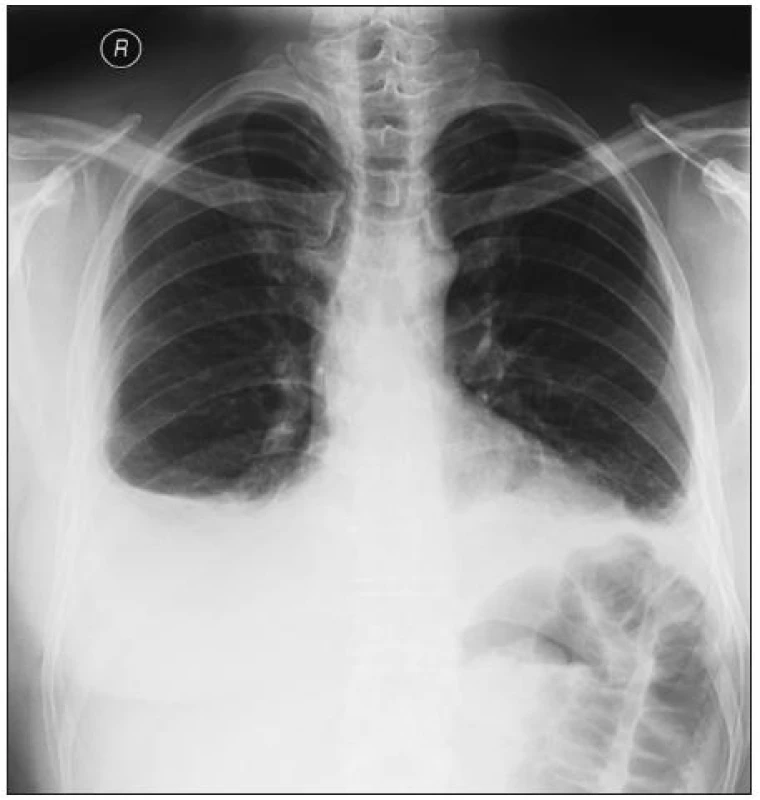
Druhým případem je 55letá žena s patnáctiletou anamnézou revmatoidní artritidy, RF pozitivní a anti CCP pozitivní, rentgenově mírně erozivní (st. II.). Nemocná byla léčena v letech 1999–2000 antimalariky, v letech 2002–2003 sulfasalazinem, od roku 2003 dodnes pak metotrexátem. Pro přetrvávající polyartritidu byl v roce 2003 nasazen s dobrým efektem infliximab. V roce 2004 byl však infliximab vysazen kvůli alergickému exantému. V roce 2004 pak byl nasazen etanercept, který vedl k remisi onemocnění. V listopadu 2007 se objevily výrazné celkové příznaky (únavnost, horečka), exacerbovala artritida, ale především vznikla výrazná alopecie, pro kterou musela nemocná několik měsíců nosit paruku. V laboratoři se objevily autoprotilátky (ANA 1 : 320, anti ds DNA 1 : 320). Byl diagnostikován léky indukovaný SLE. Terapeuticky byl nasazen prednison v dávce 20 mg denně s postupnou detrakcí. V 9/2008 byla zahájena léčba rituximabem v dávce 1000 mg i.v. první a patnáctý den. Efekt léčby byl velmi dobrý. Další série rituximabem byla pak v 6/2009 a v 2/2010. Efekt opět velmi dobrý a rovněž tak snášenlivost. Výměna anti TNF preparátu za biologický lék s jiným mechanismem účinku se osvědčila.
Vaskulitidy
Biologické léky byly s úspěchem použity při léčbě vaskulitid a je určitým paradoxem, že byly popsány i případy biologickými léky indukované vaskulitidy (22). Největší skupinu léky indukovaných vaskulitid publikovala španělská iniciativa BIOGEAS (7, 8, 18). Celkem bylo popsáno 139 pacientů, z nichž až na 2 případy (rituximab, abatacept), byli všichni po anti TNF léčbě. Pět pacientů (4 %) bylo diagnostikováno s vaskulitidou splňující kritéria dle ACR. Klinické spektrum vaskulitid bylo sice široké, ale nejčastějším případem byla kožní vaskulitida (88 %). Druhým nejčastějším symptomem bylo postižení ledvin (18 pacientů), třetím periferní neuropatie (14 pacientů). Rovněž bylo hlášeno šest případů s postižením CNS a tři se systémovým postižením plic.
Proč někteří pacienti vyvinuli systémovou vaskulitidu dle kritéria ACR, někteří závažnou vaskulitidu s postižením vnitřních orgánů a většina pak benigní kožní vaskulitidu, není jasné.
Argumentů pro významnou asociaci anti TNF léčby s vaskulitidou může být celá řada. Jednak jde o časovou koincidenci zahájení léčby a vzniku vaskulitidy, dále pak o zmizení vaskulitidy po skončení léčby anti TNF. V 75 % případů se vaskulitida zhoršila nebo recidivovala po opakování expozice anti TNF léku. Rovněž byla popsána vaskulitida v místě vpichu etanerceptu, která se pak šířila dále.
Antifosfolipidový syndrom
Asociace mezi biologickými léky a antifosfolipidovým syndromem (APS) je nejasná. Několik studií se věnovalo výskytu nově vzniklých antifosfolipidových protilátek po zahájení biologické léčby (23). Celkem bylo popsáno 42 pacientů s klinickými charakteristikami APS syndromu vzniklými po zahájení biologické léčby, přičemž až na tři případy byly všechny po léčbě anti TNF preparáty. Klinické příznaky APS syndromu představovaly ve 30 případech trombotické příhody, závažnou trombocytopenii v 8 případech a tromboflebitidu ve 4 případech (18).
Demyelinizační onemocnění
Demyelinizační onemocnění byla popsána v postmarketinkovém sledování bezpečnosti a jako jednotlivé kazuistiky. Metaanalýza randomizovaných studií a postmarketinkové sledování ukazují prevalenci mezi 0,05 % – 0,20 % (18). O mechanismu vzniku těchto onemocnění po aplikaci anti TNF léků existují dvě hypotézy. První z nich hovoří o tom, že zánětlivá revmatická onemocnění (např. RA) mají vysokou zánětlivou aktivitu perse (s vysokými hladinami TNF alfa), která může podporovat vznik demyelinizačních lézí. Druhá hypotéza hovoří o tom, že neurologická onemocnění vzniklá během anti TNF léčby mohou představovat případy pacientů s latentním neurologickým onemocněním k jehož demaskování došlo během imunosupresivní léčby. Demyelinizační onemocnění mohou být rozdělena na centrální a periferní neuropatie tak, jak navrhl Stübgen (tab. 3).
Tab. 3. Demyelinizační neurologická onemocnění (podle Stübgena a spol.) (26). 
Pozn.: Čísla v závorce jsou počty hlášených pacientů. Demyelinizační onemocnění postihující CNS systém
Řada studií původně ukazovala na důležitou úlohu TNF alfa při vzniku zánětlivých demyelinizačních onemocnění centrálního nerovového systému (CNS) a na potenciál anti TNF léčby v terapii roztroušené sklerózy. Nicméně v devadesátých letech byl popsán nečekaný a paradoxní efekt (24). Byly popsány zvýšené počty lézí pacientů s roztroušenou sklerózou (RS) léčených infliximabem a v roce 1999 pak byl proveden pokus s lenerceptem (rekombinační TNF receptor), který ukázal zvýšené riziko exacerbace RS v porovnání s placebem (25). Dnes bylo popsáno celkem 175 případů demyelinizačních CNS onemocnění po zahájení anti TNF léčby (optická neuritida ve 123, RS u 55) (18).
Demyelinizační onemocnění postihující periferní nervy
Po anti TNF léčbě indukované neuropatie jsou méně časté. Lze je klasifikovat např. podle Stubgena (26). Zatím bylo popsáno celkem 44 pacientů. Nejčastějším onemocněním této skupiny je Guillain-Barré syndrom (20 případů), multifokální motorická neuropatie (11 případů), chronická zánětlivá, demyelinizační polyradikuloneuropatie (6 případů), axonální polyneuropatie (5 případů) a Lewisův-Summerův syndrom (2 případy). U 5 pacientů byla diagnóza podpořena nálezem sérových antigangliosidových protilátek.
Intersticiální plicní onemocnění
Celkem bylo popsáno 118 případů intersticiálního plicního onemocnění, přičemž až na tři případy šlo vždy o anti TNF indukované onemocnění (18). Dvě třetiny pacientů ale byly léčeny současně methotrexátem. Může tedy být vyslovena hypotéza, že anti TNF preparáty mohou potencovat pulmonální toxicitu MTX. Při skríninku pacientů na anti TNF léčbu je vhodné u pacientů provádět rentgenové vyšetření plic a v indikovaných případech i spirometrii k odhalení latentního intersticiálního plicního onemocnění a to zvláště u pacientů, kteří dostávají MTX. V poslední době se hovoří i o pulmonární toxicitě leflunomidu.
Autoimunní hepatitida
Autoimunní hepatitida je jedním z posledních popsaných anti TNF indukovaným onemocněním (7). Celkem bylo popsáno 19 případů. Je zajímavé, že většina případů byla popsána po infliximabu (79 %) a často u pacientů se spondylartritidami (47 %). Biopsie jater byla provedena u 14/19 pacientů a v 10 případech byla nálezem autoimunní hepatitida, ve 2 případech cholestatická hepatitida dále jeden případ akutní toxické hepatitidy a granulomatózní hepatitidy.
Průběh a prognóza indukovaných autoimunitních onemocnění
Indukovaná autoimunitní onemocnění se mohou vyskytnout kdykoliv v průběhu léčby biologickými léky. U největší publikované skupiny 498 pacientů byl průměrný čas do vzniku indukovaného onemocnění 40 týdnů od začátku léčby anti TNF (18) s rozptylem jednoho dne až 7 let. Většina případů vznikla mezi jedním měsícem a jedním rokem léčby.
Průběh indukovaného imunitního onemocnění byl znám u 428 případů a byl příznivý, když ke kompletnímu uzdravení došlo u 72 % pacientů, ke zlepšení nebo částečnému uzdravení u 15 % pacientů a k žádnému uzdravení u 13 % pacientů. Nejhorší prognóza byla u intersticiálního plicního onemocnění (uzdravení v 63 % případů), zánětlivého očního onemocnění (uzdravení v 63 % případů) a demyelinizačního CNS onemocnění (uzdravení 70 %).
Léčba indukovaných autoimunitních onemocnění
Skupina BIOGEAS navrhuje stratifikovat pacienty podle příznaků na lehčí a těžší skupinu. Skupina lehčí je definována jako pacienti s příznaky celkovými, kožními a kloubními. Skupina těžší pak s příznaky plicními, renálními, CNS případně postižením jiných orgánů (21).
Při léčbě skupiny lehčí je navrženo jako opatření vysazení anti TNF léku. Není jednoznačně uzavřeno, zda-li je doporučováno po odeznění znovu anti TNF nasadit.
Při léčbě skupiny těžší je nutné vysadit trvale anti TNF lék, nasadit kortikosteroidy a eventuálně i imunosupresivní léky. Doporučení Britské revmatologické společnosti doporučuje vysadit anti TNF léčbu, ale nespecifikuje další terapeutický postup (27).
Závěr
Počet pacientů léčených biologickými léky stále vzrůstá a rozšiřují se i indikace této léčby. S přibýváním pacientů ale vzniká více tzv. léky indukovaných onemocnění. V rámci monitorování bezpečnosti této léčby je nutné v rámci diferenciální diagnózy myslet i na léky indukovaná onemocnění. Přes dobrou prognózu, kdy většina indukovaných onemocnění odezní po vysazení léku, je nutné počítat s nutností aplikace kortikosteroidů a eventuálně dalších imunosupresivních léků u části pacientů.
Tato publikace vznikla za podpory Výzkumných záměrů MZ ČR č. MZO 00023728
Prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Zdroje
1. Smolen J, Aletaha D, Koller M, et al. New therapies for treatment for rheumatoid arthritis. Lancet 2007; 370 : 1861-74.
2. Aletaha D, Furovits J, Breedveld JC, et al. Rheumatoid arthritis joint progression in sustained remission is determined by disease activity levels preceding the period of radiographic assessment. Arthritis Rheum 2009; 60 : 1242-52.
3. Saag K, GuTeng GC, Patkar NM, et al. American College of Rheumatology 2008 Recommendations for the use of nonbiologic and biologic disease modifying antirheumatic drugs in rheumatoid arthritis. Arthritis Rheum 2008;59 : 762-784.
4. Baeclund E, Iliadou A, Askling J, et al. Association of chronic inflammation, not its treatment with increased lymphoma risk in rheumatoid arthritis. Arthritis Rheum 2006; 54 : 692-701.
5. Zink A, Askling J, Dixon WG, et al. European biologicals registry: methodology, selected results and perspectives. Ann Rheum Dis 2009; 68 : 1240-1246.
6. Charles PJ, Smeenk RJ, De Jong J, et al. Assessment of antibodies to double – stranded DNA in rheumatoid arthritis patients following treatment with infliximab, a monoclonal antibody tu tumor necrosis factor alpha. findings in open label randomized placebo controlled trials. Arthritis Rheum 2000; 43 : 2383-90.
7. Ramos Casals M, Brito-Zeron P, Muňoz S, et al. BIOGEAS study Group. A systematic review of the off label use of biological therapies in systematic autoimmune diseases. Medicine (Baltimore) 2008; 87 : 345-364.
8. Ramos Casals M, Brito-Zeron P, Soto MJ, et al. Autoimmune diseases induced by TNF targeted therapies. Best Pract Res Clin Rheumatol 2008; 22 : 847-861.
9. Gonnet Gracia C, Barnatehe T, Richez J, et al. Antinuclear antibodies, anti ds DNA and C4 complement evolution in rheumatoid arthritis and ankylosing spondylitis treated with TNF blockers. Clin Exp Rheumatol 2008; 26 : 401-407.
10. Erikkson C, Engstrand S, Sudquist KG, et al. Autoantibody formation in patients rheumatoid arthritis treated with anti TNF. Ann Rheum Dis 2005; 64 : 403-407.
11. Zheng L, Fisher G, Miller R, et al. Induction of apoptosis in mature T cells by tumor necrosis factor. Nature 1995; 377 : 348-51.
12. Sarzi Putini P, Atzeni F, Capsoni F, et al. Drug induced lupus erythematodes. Autoimmunity 2005; 38 : 507-518.
13. Benucci M, Saviola G, Balardi P, et al. Anti-nucleosome antibodies as prediction factor of development of autoantibodies during therapy with three different TNF alpha blocking agents in rheumatoid arthritis. Clin Rheumatol 2008; 27 : 91-95.
14. Hoffman BJ. Sensitivity to sulfadiazine resembling acute disseminated lupus erythematosus. Arch Dermatol Syph 1945; 51 : 190-192.
15. Tan EM, Cohen AS, Fries JF, et al. The 1982 revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1982; 25 : 1271-7.
16. Vasoo S. Drug induced lupus: an update. Lupus 2006; 15 : 757-61.
17. De Bandt M, Sibilia J, Loet X, et al. Rheumatismes et inflammation. Systemic lupus erytematosus induced by anti tumour necrosis factor alpha therapy: a French national survey. Arthritis Res Ther 2005;7 : 45-51.
18. Ramos Casals MR, Perez Alvarez R, Diaz –Lagares C, et al. Autoimmune diseases induced by biological agents. A double-edged sword? Autoimmunity reviews 2010; 9 : 188-193.
19. Williams EL, Gadola S, Edwards CH. Anti TNF induced lupus. Rheumatology 2009; 48 : 716-720.
20. Costa MF, Said NR, Zimmermann B. Drug induced lupus due to anti-tumor necrosis factor alfa agents. Semin Arthritis Rheum 2008;37 : 381-387.
21. Ramos Casal MF, Brito-Zeron P, Muňoz S et al. Autoimmune diseases induced by TNF-targeted therapies. Analysis of 233 cases. Medicine 2007; 86 : 242-251.
22. Ramos Casals M, Brito - Zeron P, Cuadrado MJ et al. Vasculitis induced by tumor necrosis factor-targeted therapies. Curr Rheumatol Rep 2008; 10 : 442-448.
23. Jonsdotirr T, Forslid J, van Vollenhoven A, et al. Treatment with tumor necrosis factor alpha antagonist in patients with rheumatoid arthritis induces cardiolipin antibodies. Ann Rheum Dis 2004; 63 : 1075-1078.
24. van Oosten BW, Barkhof F, Truyen L, et al. Increased MRI activity and immune activation in two multiple sclerosis patients treated with the monoclonal anti-tumor necrosis factor antibody cA2. Neurology 1996; 47 : 1531-4.
25. TNF neutralization in MS: results of a randomized, placebo controlled multicenter study. The Lenercept Multiple Sclerosis Study group and The University of British Columbia MS/MRI Analysis Group. Neurology 1999; 53 : 57-65.
26. Stübgen JP. Tumor necrosis factor-alpha antagonists and neuropathy. Muscle Nerve 2008; 37 : 281-292.
27. Ledingham J, Deighton C, British Society of Rheumatology Standards.Guidelines and Audit Working Group. (SGAWG). Update on the British Society of Rheumatology guidelines for prescribing TNF blockade in adults with rheumatoid artrhritis. Rheumatology 2005; 44 : 157-163.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2011 Číslo 1- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
Najčítanejšie v tomto čísle- Sine syndrómy v klinickom obraze dermatomyozitídy
- Výskyt autoimunitních onemocnění po aplikaci biologických léků
- Průběh systémového lupus erytematodes v graviditě
- Třeboňské revmatologické dny 5.–7. 1. 2011
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



