-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Experimentální modely systémové sklerodermie – cesta k poznání a léčbě neléčitelné nemoci?
Experimental models of systemic sclerosis – a tool to understand and treat an incurable disease?
Systemic sclerosis (SSc) is a rare, chronic connective tissue disease affecting the skin, vessels, musculoskeletal system and internal organs. Despite advances in pharmacotherapy of organ manifestation and new knowledge about the pathogenesis of SSc, there is still no effective treatment of this serious disease. The aim of this review is to introduce traditional, most commonly used experimental animal models of SSc, clarify their basic pathomechanism, describe the advantages and limitations and outline their use in preclinical tests of potential therapeutic agents with subsequent clinical trials in patients with SSc.
KEY WORDS:
Systemic sclerosis, experimental models, biological therapy, small molecules
Autori: H. Štorkánová; M. Tomčík
Pôsobisko autorov: Revmatologický ústav a Revmatologická klinika 1. LF UK
Vyšlo v časopise: Čes. Revmatol., 23, 2015, No. 2, p. 59-68.
Kategória: Přehledné články
Súhrn
Systémová sklerodermie (SSc) je vzácné, chronické systémové onemocnění pojiva postihující kůži, cévy, pohybové ústrojí a vnitřní orgány. Přes pokroky ve farmakoterapii orgánových manifestací a nové poznatky o patogenezi SSc dosud neexistuje účinná léčba tohoto závažného onemocnění. Cílem tohoto přehledového článku je představit tradiční, nejčastěji používané zvířecí experimentální modely SSc, objasnit jejich základní patomechanismy, popsat výhody a limitace a nastínit jejich využití v preklinické fázi testování potenciálních terapeutických agens s následným klinickým hodnocením u pacientů se SSc.
KLÍČOVÁ SLOVA:
Systémová sklerodermie, experimentální modely, biologická terapie, malé molekulyÚvod
Systémová sklerodermie (SSc) je vzácné, chronické systémové onemocnění pojiva postihující kůži, cévy, pohybové ústrojí a vnitřní orgány. Název tohoto onemocnění je odvozen z řeckých slov „scleros“ a „derma“ – tuhá kůže a byl prvně použit Gintracem v roce 1847. První zmínka o tuhé kůži, na které nelze vytvořit řasu, však pochází již od Hippokrata asi 400 let př. n. l. SSc postihuje častěji ženy, začíná obvykle ve středním věku a celková doba přežití je zkrácená – 10 let přežívá 70 % pacientů. I přes pokroky ve farmakoterapii orgánových manifestací a nové poznatky o patogenezi SSc dosud neexistuje účinná léčba tohoto závažného onemocnění [1]. I když jsou již delší dobu známé asociace mezi některými vnějšími vlivy, především sloučeniny křemíku a organická rozpouštědla, etiologie SSc dosud nebyla dostatečně objasněna. Možnost bioptického odebrání vzorků postižené tkáně u pacientů se SSc, zejména formou kožní biopsie, pomohla velkou mírou k objasnění patogeneze tohoto onemocnění. Pomocí histologické analýzy bioptických vzorků tkání v různém průběhu onemocnění byly identifikovány tři základní patologické procesy a jejich vzájemná časová souslednost – vaskulopatie, zánět a fibróza. První patologické změny lze detekovat na úrovni mikrocirkulace, kde poškození endotelu vede k rozvoji zánětu pomocí aktivace buněk vrozené a posléze i získané imunity, které produkují profibrotické cytokiny – zejména TGFβ (transformující růstový faktor beta), CTGF (tkáňový pojivový růstový faktor) a PDGF (destičkový růstový faktor), jejichž působením dochází k aktivaci rezidentních fibroblastů, zvýšené produkci složek extracelulární matrix (ECM) a přestavbě funkční tkáně ve fibrotickou tkáň. Fibrotická fáze patogeneze SSc a její závažnost a rozsah určují morbiditu a mortalitu tohoto onemocnění [2]. Materiál z kožních biopsií rovněž umožnil analýzu genové a proteinové exprese, epigenetických modifikací a signálních drah různých cílových molekul. Jejich potenciální význam v patogenezi SSc však musí být vždy nejprve testován a potvrzen, nežli lze vůbec uvažovat o možném léčebném využití těchto kandidátních molekul. Pro tyto účely lze použít in vitro experimenty na tkáňových a buněčných kulturách izolovaných z bioptovaných tkání pacientů se SSc a zdravých jedinců anebo in vivo experimenty za pomoci zvířecích experimentálních modelů Ssc [3]. Dnes existuje celá řada zvířecích modelů SSc, nicméně žádný z dostupných modelů nenapodobuje kompletní rozsah patologických procesů a klinických manifestací lidské SSc. Každý model pomáhá objasnit určité patologické mechanismy, napodobuje jen určité aspekty lidské SSc a má své výhody a limitace. Proto musí být volba vhodných zvířecích modelů pro analýzu cílových genů pečlivě zvážena a výsledky studií kandidátních molekul terapie na nich prováděných opatrně interpretovány [4]. Jelikož je kožní fibróza dominantním a častým rysem u většiny pacientů se SSc, stal se tento patologický proces nejen východiskem, ale i klíčovým bodem pro většinu experimentálních modelů. S rozvojem vědeckého poznání a technologií byly vyvinuty i modely s dominantním postavením imunity a zánětu, vaskulopatie a patologických procesů v jednotlivých orgánech – zejména plicích. Nicméně u většiny modelů lze nalézt překryv zmíněných patologických mechanismů i současné postižení vícero typických orgánů. Cílem tohoto přehledového článku je představit tradiční, nejčastěji používané zvířecí experimentální modely SSc, objasnit jejich základní patomechanismy, popsat jejich výhody a limitace a nastínit jejich využití v preklinické fázi testování potenciálních terapeutických agens s následným klinickým hodnocením u pacientů se SSc.
Tab. 1. Přehled nejpoužívanějších zvířecích modelů SSc a zastoupení patogenetických mechanismů charakteristických pro SSc. (Upraveno podle Beyer C. et al., 2010) sclGvHD, Chronická sklerodermatózní reakce štěpu proti hostiteli; Tsk-1, Tight skin-1 myši; Fra-2, Fra-2 transgenní myši; UCD-200/206; kuřata linie UCD-200 a UCD-206; TBRICA; Cre-ER, TBRICA; Cre-ER myši 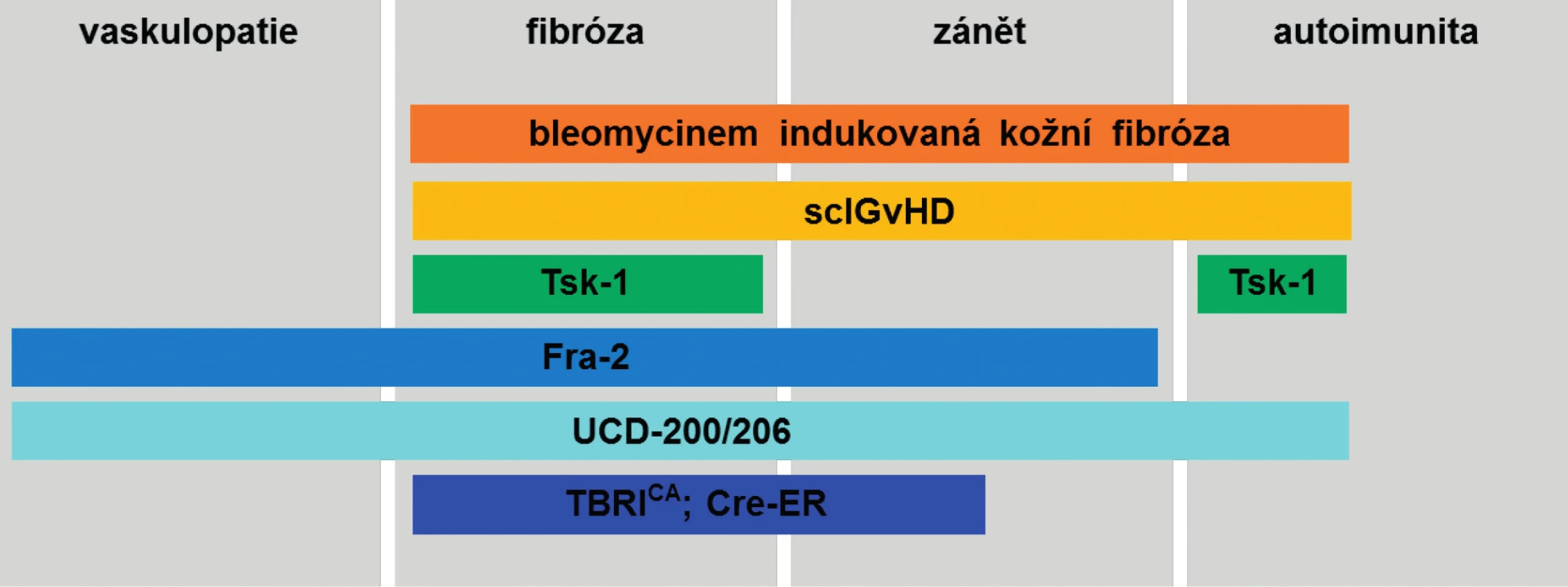
Bleomycinem indukovaná kožní fibróza
Tento model je široce používaným in vivo modelem napodobujícím zánětlivé změny přítomné v časné fázi SSc. Bleomycin byl původně izolován ze Streptomyces verticillus a používá se v léčbě různých typů nádorů [5]. Vysoké dávky bleomycinu však mají vedlejší účinky – vyvolávají plicní postižení a fibrózu a dokonce i kožní změny podobné SSc. Proto se bleomycin používá v myších modelech jak u plicní, tak u kožní fibrózy. Opakované subkutánní injekce v definované oblasti po dobu 4 týdnů vedou k dermální fibróze, která přetrvává i 6 týdnů po ukončení jejich podávání [6]. Kromě zánětlivého infiltrátu a rozvoje fibrózy v postižené kůži dochází rovněž k mírnému postižení plic a fibróze a jsou také přítomny antinukleární protilátky (ANA), anti-Scl-70, anti-U1 RNP a antihistonové protilátky, což svědčí i pro systémové postižení u tohoto modelu [7]. Bleomycin indukuje v kůži produkci kyslíkových radikálů, vede k postižení buněk endotelu a jiných typů buněk a k expresi adhezních molekul. Ta má za následek zvýšenou infiltraci postižené kůže leukocyty, T i B lymfocyty, makrofágy, eozinofily a žírnými buňkami. Zánětlivý infiltrát uvolňuje zvýšené množství profibrotických a prozánětlivých cytokinů (TGFβ, PDGF, MCP 1, IL-4, IL-6 a IL-13), které aktivují rezidentní fibroblasty a ty produkují nadměrné množství složek ECM vedoucí ke kožní fibróze [8]. Výhodou tohoto modelu je, že je dobře zdokumentován a popsán, lze jej aplikovat u četných kmenů myší a je snadný na obsluhu. Limitací je fakt, že je uměle indukovaný, nedochází u něj k výraznému systémovému postižení a dochází zde k nadhodnocení antifibrotického účinku protizánětlivých agens [4].
Chronická sklerodermatózní reakce štěpu proti hostiteli (SclGvHD)
Chronická reakce štěpu proti hostiteli (GvHD, graft-versus-host-disease) se vyskytuje u 40–60 % dlouhodobě přežívajících pacientů po transplantaci hematopoetických buněk. Sklerodermatózní (SclGvHD) a cytotoxický typ jsou dvě hlavní formy chronické GvHD [9]. SclGvHD je fibrotizujícím typem a jeho klinické příznaky jsou podobné s manifestacemi časné zánětlivé fáze difúzní formy SSc. Indukce SclGvHD u myší se provádí standardním způsobem – hematopoetické buňky jsou transplantovány subletálně ozářeným BALB/c myším, nebo modifikovaným způsobem [hematopoetické buňky jsou transplantovány imunodeficientním RAG-2 (recombinase activating gen-2) myším] [10]. V obou případech se jedná o transplantaci hematopoetických buněk dárce příjemci s identickým MHC (hlavní histokompatibilní komplex), ale nestejnými vedlejšími histokompatibilními antigeny, což po rekonstituci hematopoézy indukuje u příjemce SclGvHD se zánětem a fibrózou kůže, plic, jater, ledvin, gastrointestinálního traktu a příušních žláz. Kromě zánětu a fibrózy je zde rovněž přítomna produkce autoprotilátek proti nukleárním antigenům. V patogenezi chronické SclGvHD hrají klíčovou roli aloreaktivní CD4 T lymfocyty [11–15]. Výhodou tohoto modelu je opět dobrá dokumentace a systémové manifestace. Nevýhoda spočívá v potřebě sofistikovaných technik a zkušeností a v problematickém zacházení s imunokompromitovanými myšmi [4].
Tight skin – 1 myši (Tsk-1)
Jedná se o autozomálně dominantní mutaci – tandemovou duplikaci v genu pro fibrillin 1, který je důležitým regulátorem signální kaskády TGFβ a fibrogeneze. Zatímco dominantní homozygoti zemřou již v průběhu gestace, u heterozygotních myší (značeny Tsk-1) vede tato mutace k hyperplazii a ztluštění podkoží a fasciální vrstvy kůže bez markantního ztluštění samotné dermis. Obdobně dochází v lidské kůži pacientů se SSc k hyperplazii podkožní fascie a atrofii tukové tkáně. Tsk-1 myší produkují i autoprotilátky (anti-Scl-70, anti-RNA-polymeráza I, anti-dsDNA) [16–20]. Fibróza u těchto myší vzniká na podkladě nadměrné produkce ECM aktivovanými fibroblasty při aktivaci signální kaskády TGFβ. Přesný mechanismus však dosud nebyl objasněn. Na progresi fibrózy u Tsk-1 myší se podílí zvýšená exprese CD19, chronická aktivace B lymfocytů vedoucí ke zvýšené sekreci IL-6 a žírné buňky. Tyto mechanismy se uplatňují i u progrese SSc. Tsk-1 myši se běžně používají jako model napodobující pozdější fázi SSc nezávislou na zánětlivém infiltrátu [21]. Výhodou tohoto modelu je dobrá dokumentace a endogenní aktivace fibroblastů podobná SSc. Limitací je nedostatečně objasněný molekulární mechanismus, chybění vaskulárního fenotypu, dominantní histologické změny v hypodermis a některé další změny jako například emfyzém a kyfóza, které nejsou součástí SSc u lidí [4].
UCD-200 a UCD-206 kuřata
Linie UCD-200 byla původně izolována na Kalifornské univerzitě z Leghornských kuřat, u kterých byly pozorovány atrofické abnormality hřebene. Tato linie má systémové manifestace podobné příznakům SSc [22]. Kožní postižení hřebene, krku a zad se projevuje jako otok, změny podobné Raynaudovu fenoménu, ztráta adnex a ztuhnutí kůže vedoucí k nekróze. U 20 % kuřat se vyskytují ischemické léze prstů. Dochází rovněž k postižení vnitřních orgánů zejména jícnu, srdce, plic a ledvin a zvýšené mortalitě [22, 23]. Histopatologické změny jsou podobné těm změnám u SSc a zahrnují mohutný perivaskulární mononukleární infiltrát a depozice složek ECM aktivovanými fibroblasty, známky obliterativní vaskulopatie a apoptózy buněk endotelu se ztrátou funkčních kapilár [22]. UCD-200 kuřata také produkují autoprotilátky – zejména antinukleární, anti-centromérové, anti-fosfolipidové, revmatoidní faktor a protilátky proti buňkám endotelu [23, 24]. Kuřata linie UCD-206 jsou podobná kuřatům linie UCD-200, ale může se u nich vyvinout ještě závažnější orgánové postižení [25]. Výhodou tohoto modelu je výrazné systémové postižení pokrývající téměř kompletní patologické spektrum a průběh nemoci podobný SSc u lidí. Limitací je ptačí genetické pozadí, které omezuje molekulární studie a zejména velice náročný a finančně nákladný chov [4].
Fra-2 transgenní myši
Fra-2 je členem rodiny transkripčních faktorů zvaných AP1 (activator protein 1), které regulují buněčnou proliferaci, zánět a hojení ran [26]. Zvýšená exprese Fra-2 byla popsána také pacientů se SSc, konkrétně v myofibroblastech, buňkách endotelu a hladkého svalu, což svědčí pro potenciální význam Fra-2 v patogenezi SSc [27, 28]. Zvýšená exprese Fra-2 u myší vede k rozvoji systémového zánětu a fibrózy, hlavně v kůži a plicích. Pro Fra-2 transgenní myši je rovněž typický vaskulární fenotyp charakterizovaný zvýšenou apoptózou buněk endotelu a následnou závažnou ztrátou funkčních malých tepen kůže a plic. Histologické změny proliferativní vaskulopatie v plicích myší se podobají plicní arteriální hypertenzi u SSc. Plicní fibróza a plicní arteriální hypertenze pak vedou k plicní insuficienci a zvýšené mortalitě myší [27–29]. Výhodou tohoto modelu je integrace charakteristických vaskulárních a fibrotických manifestací a podobný průběh se SSc u lidí, u které je rovněž zvýšená exprese Fra-2. Nevýhodou zůstává nedostatečná charakterizace tohoto modelu a chybění autoimunity [4].
TBRICA; Cre-ER myši
Pro účely výzkumu různých genů in vivo v prostředí se zvýšeně aktivovanou signální kaskádou TGF-β, jakožto centrálního profibrotického cytokinu v patogenezi SSc, byl vyvinut myší model s mutovanou formou TGF-β receptoru prvního typu (TBRICA) ve fibroblastech, která vede k jeho setrvalé aktivaci bez závislosti na ligandu TGF-β. Specifické exprese jen ve fibroblastech bylo docíleno pomocí transkripčního enhanceru z genu pro kolagen proα2(I), který řídí expresi jen u fibroblastů a u žádných jiných buněčných typů [30–32]. Pokus o vytvoření TBRICA transgenních myší i přes specifickou expresi této mutace jen ve fibroblastech však nebyl úspěšný a myši zemřely již během gestace. Proto byl vyvinut model postnatální podmíněně setrvalé aktivace TBRICA pomocí tamoxifenem indukovatelného Cre/loxP systému [31], jenž vede k progresivní generalizované dermální fibróze s nadprodukcí kolagenu I. a III. typu a atrofii adnex. Je zde přítomné i ztluštění cévní stěny malých tepen plic, ledvin a nadledvin a také plicnice. Technická a ekonomická náročnost tohoto modelu vedla k zavedení alternativního řešení, kde je lokální kožní fibrózy dosaženo pomocí subkutánních injekcí s oslabeným adenovirem se setrvalou aktivací TBRICA, která již ale není omezena jen na fibroblasty [31]. Výhodou je dobře popsaný patomechanismus a umožnění detailní in vivo analýzy signální dráhy TGFβ ve fibroblastech. Limitací je jen minimální zastoupení zánětu a autoimunity [4].
Modely plicní fibrózy
U plicní fibrózy dochází k nahrazování původní funkční plicní tkáně vazivem a následnému zhoršení výměny dýchacích plynů. Patogeneze je charakterizována poškozením epitelu a hyperplazií buněk alveolů, nahromaděním zánětlivých infiltrátů, hyperplazií fibroblastů, ukládáním složek ECM a tvorbou jizev [33]. U SSc má intersticiální plicní postižení nejčastěji charakter NSIP (nespecifická intersticiální pneumonie) anebo UIP (běžná intersticiální pneumonie), či organizující se pneumonie s pozdějším vývojem do NSIP [2]. K nejčastěji využívaným experimentálním modelům plicní fibrózy patří indukce bleomycinem, oxidem křemičitým, fluroscein isothiokyanátem a ozářením.
Pro navození plicní fibrózy může být bleomycin podaný intratracheálně nebo intranasálně přímo do dýchacích cest, ale i prostřednictvím subkutánní, intraperitoneální nebo intravenózní aplikace. Princip působení bleomycinu je popsán u bleomycinem indukované kožní fibrózy [34]. Hlavní výhodou použití bleomycinu je dostupnost, snadné podání a prozatím nejpřesnější navození příznaků plicní fibrózy během 14–28 dní. Limitací tohoto modelu je skutečnost, že 28 dnů po intratracheální aplikaci dochází k ústupu fibrózy [34]. Mnohé studie již potvrdily, že etablovaná experimentální plicní fibróza je na rozdíl od lidské plicní fibrózy reverzibilní a po 6 týdnech zvíře jeví téměř normální plicní nález [35].
Kontaminace plic zvířecího modelu oxidem křemičitým způsobí vznik fibrotických uzlů a fibrózy, která se podobá lézím u lidí vystavených dlouhodobé inhalaci křemičitého prachu a částic aerosolu. Oxid křemičitý může být vpraven prostřednictvím aerosolu, intratracheálně nebo přes orofaryngeální aspiraci [33]. Indukce fibrózy spočívá v aktivaci makrofágů, které fagocytují křemičité částečky a začnou produkovat profibrotické cytokiny PDGF a TGFβ [34]. Fibrotická odpověď je závislá na konkrétním myším kmeni [36]. Největším přínosem tohoto modelu je, že křemičité částice nejsou z plic snadno odstranitelné a způsobují tak trvalé fibrotické podněty. Nevýhodou modelu je, že postrádá charakteristické známky UIP. Experiment je také časově a finančně náročný, neboť je potřeba vysoce specializovaného vybavení pro podání oxidu křemičitého prostřednictvím aerosolu a k rozvoji nemoci dochází až během 12. a 16. týdne po expozici [34].
Další chemickou látkou využívanou pro navození plicní fibrózy je fluorescein isothiokyanát (FITC). FITC je podáván přímo do dýchacích cest, kde působí jako hapten, který se naváže na protein přítomný v plicích, což vede ke vzniku nového trvalého antigenu a následné tvorbě protilátek [34]. Tohoto spojení je využíváno v imunofluorescenci pro lokalizace plicní fibrózy, která úzce koreluje s oblastmi výskytu navázaného FITC. Pokud jde o patogenezi, je FITC spojen s výskytem akutního poškození plic, rozvojem edému, zánětu a následným vývojem fibrózy [36]. Výhodou tohoto modelu je vizualizace onemocnění pomocí charakteristické zelené fluorescence. Plicní postižení se objeví během 14 –28 dnů a přetrvává po dobu nejméně 6 měsíců. Bohužel nemá charakteristický nález pro UIP [33].
Ozařování myších modelů také vede ke vzniku plicní fibrózy, bez použití chemických látek. Záření indukuje přímou buněčnou smrt pneumocytů I. a II. typu a následné nahromadění makrofágů v místě poškození. Aktivace makrofágů spouští produkci prozánětlivých a profibrotických cytokinů (TNFα, TGFβ), které se podílejí na vzniku fibrózy [34]. Zářením vyvolaná fibróza má nález charakteristický pro UIP projevy a může být použita jen na C57B1/6 myším modelu. Nevýhodou této metody je finanční a časová náročnost – třicetitýdenní interval od ozáření po rozvoj prvních příznaků [33].
Modely plicní arteriální hypertenze
Plicní arteriální hypertenze (PAH) je primární onemocnění plicních arteriol, způsobené proliferací a kontrakcí hladkých svalových buněk cévní stěny, které se u SSc může vyskytovat samostatně anebo provázet intersticiální plicní postižení [2]. K nejčastěji využívaným experimentálním modelům PAH patří model indukovaný semaxanibem s chronickou hypoxií, monokrotalinem a model athymických potkanů.
Chronická hypoxie, běžně navozena poloviční frakcí vdechovaného kyslíku (tj. FiO2 10%) po dobu 21 dnů, vede bohužel jen k mírné PAH, která je navíc reverzibilní (na rozdíl od lidské PAH), méně výrazná u myší než potkanů a u myší indukuje tvorbu perivaskulárního zánětlivého infiltrátu se sekrecí různých prozánětlivých cytokinů a chemokinů. Navození výraznější a ireverzibilní PAH je dosaženo současným podáváním semaxanibu (SU5416), inhibitoru tyrozin kináz a receptoru 1 (Flt) a 2 (KDR) pro VEGF (vaskulární endoteliální růstový faktor), který byl zpočátku vyvinut pro léčbu nádorových onemocnění [37]. SU5416 je inhibitor proliferace a spouštěč apoptózy buněk endotelu [38]. Paradoxně však dochází při blokaci VEGFR k expanzi buněk epitelu místo utlumení jejich proliferace. Vysvětlením je kompenzační mechanismus, kdy při inhibici VEGFR nastupují jiné růstové faktory (FGF, PDGF) zajišťující proliferaci buněk endotelu [38]. Tento model je nejčastěji využíván pro dostatečné porozumění mechanismu hyperproliferace buněk endotelu, což je charakteristické pro plexiformní léze PAH u lidí [39].
Monocrotalin (MCTP) je toxický alkaloid z rostliny Crotalaria spectabilis. Monocrotalin musí být in vivo aktivován jaterními oxidázami na reaktivní bifunkční složku MCTP, která vede k rozvoji vaskulárního postižení. Odpověď na MCTP závisí na zvířecím druhu, neboť se liší v jaterním metabolismu cytochromu P-450. Mezi preferované zvířecí modely patří potkan, kterému je MCTP vpraven buď subkutánně, nebo intraperitoneálně [40]. Subkutánní injekce MCTP indukují změny endotelu a proliferaci buněk hladkého svalstva v cévách, které se podílejí na rozvoji PAH během 3 týdnů [41]. Přesný mechanismus patogeneze PAH prostřednictvím MCTP není stále zcela objasněn. Možnou příčinou by mohlo být poškození endotelu, které spouští nekontrolovatelnou progresi těžké formy plicní hypertenze. Dalším podnětem ke vzniku PAH může být zvyšující se tlak v plicních arteriích a vaskulární remodelace vyvolávající nahromadění mononukleárních zánětlivých buněk v tunica adventitia. Model se využívá především při modelaci akutního postižení, které je snadno léčitelné, což je zcela odlišné od pacientů s PAH [40].
Dalším běžně užívaným modelem PAH jsou athymické potkany. Původním předpokladem bylo, že modely bez T lymfocytů (athymické nahé rnu/ rnu potkany) budou vykazovat menší zánětlivé reakce s méně výraznou PAH. Došlo však k pravému opaku a tyto modely rozvinuly daleko vyšší stupeň postižení. Zánět stěny plicní tepny je indukován aktivací makrofágů, B lymfocytů a přítomností anti-endoteliálních protilátek. Příčinou rozvoje těžší formy plicní hypertenze je nepřítomnost protizánětlivých regulačních T lymfocytů, což vysvětluje predispozice k PAH u athymických potkanů [38].
Testování biologických agens a malých molekul v preklinické a klinické fázi
Jedním z prvních dostupných biologických preparátů s prokázanými účinky u jiných systémových revmatických onemocnění, které byly zkoušené na preklinických modelech SSc, byla anti-TNF terapie. V in vitro experimentech převažoval přímý antifibrotický účinek samotného TNFα, kdežto v in vivo experimentech došlo naopak pomocí TNF inhibitorů k prevenci rozvoje fibrózy indukované bleomycinem, co lze částečně vysvětlit dominantní zánětlivou složkou v tomto modelu [42, 43]. Výsledky klinických hodnocení anti-TNF preparátů u SSc spíše podporují antifibrotickou roli samotného TNFα, soudě podle progrese fibrózy při anti-TNF terapii [44, 45]. Ani další studie neprokázala signifikantní zlepšení kožního skóre či plicních funkcí pomocí etanerceptu a infliximabu a pracovní skupina EUSTAR (EULAR Scleroderma Trials and Research) nedoporučila používání anti-TNF terapie u pacientů se SSc mimo rámec klinických hodnocení [46–48].
Role B-lymfocytů a jejich deplece byla rovněž zkoumána u experimentálních modelů SSc. Aplikace rituximabu třídenním Tsk-1 myším vedla k redukci kožní fibrózy, kdežto stejná aplikace starším, 56denním Tsk-1 myším žádnou změnu nevyvolala [49]. Podobné redukce kožní a plicní fibrózy indukované bleomycinem bylo dosaženo u myší s genetickou inaktivací CD19 [50]. Obě studie dokumentují spíše účinek deplece B-lymfocytů na redukci fibrózy v časné, zánětlivé fázi experimentální SSc. V klinickém hodnocení fáze 2 a v observační studii skupiny EUSTAR byly prokázány příznivé účinky rituximabu na redukci kožního skóre a zlepšení plicních funkcí, avšak tyto výsledky bude nutné potvrdit v randomizovaném klinickém hodnocení s placebem [51–56].
Dalším druhem terapie, který byl testován na myších modelech SSc, je interleukin(IL)-6. Četná in vitro data poukazují na zvýšenou produkci IL-6 SSc fibroblasty, na jeho důležitou roli jako induktora aktivace fibroblastů a produkce kolagenu a v neposlední řadě poukazují i na účinnou redukci syntézy kolagenu pomocí jeho inhibice [57–59]. V in vivo experimentech vedla inhibice IL-6 pomocí protilátek proti IL-6 receptoru k redukci kožní fibrózy v modelu bleomycinem indukované fibrózy a u chronické GvHD, kdežto u Tsk-1 myší nebylo pozorováno žádné zlepšení, což svědčí spíše pro antifibrotický efekt v časné zánětlivé fázi experimentální SSc [60–62]. První výsledky klinického hodnocení fáze 2/3 faSScinate hodnotícího účinnost tocilizumabu u 87 pacientů s aktivní difuzní formou SSc po 24 týdnech léčby byly prezentovány na kongresu ACR (American College of Rheumatology) v Bostonu – nedošlo k signifikantní redukci kožního skóre (jen trend zlepšení, p = 0,09), ale došlo k povzbudivé stabilizaci FVC (forsírované plicní kapacity) proti placebu. Výsledky po 48 týdnech by měly být prezentovány na příštím kongresu EULAR.
Tyrozinkinázy, jako například receptor pro PDGF (destičkový růstový faktor), představují další zajímavý cíl terapie SSc. Četná experimentální data prokazují antifibrotické účinky imatinib mesylátu – multikinázového inhibitoru (tlumí kinázy PDGFR, c-Abl, c-Kit). In vitro utlumil imatinib expresi prozánětlivých a profibrotickcýh genů i produkci kolagenu SSc fibroblasty [63, 64]. In vivo vedla terapie imatinibem k prevenci rozvoje kožní fibrózy indukované bleomycinem a u Tsk-1 myší, i k prevenci rozvoje plicní, renální a jaterní fibrózy a dále vedla i k léčbě etablované kožní fibrózy [63, 65]. Obdobné výsledky in vivo byly dosaženy dalšími inhibitory PDGFR dasatinibem a nilotinibem [66]. První slibné výsledky otevřeného klinického hodnocení s imatinibem u SSc demonstrující signifikantní zlepšení kožního skóre a FVC po 12 měsících, avšak s četnými nežádoucími účinky – zejména otoky, bohužel nebyly potvrzeny v dalších dvou randomizovaných, placebem kontrolovaných klinických hodnoceních, z nichž jedna byla ukončena pro časné četné nežádoucí účinky a druhá neprokázala signifikantní zlepšení kožního skóre a byla rovněž provázena četnými nežádoucími účinky [67–69].
Dalším zajímavým cílem antifibrotické terapie zkoumaným pomocí in vitro a in vivo experimentů u SSc je vazoaktivní malá molekula – stimulátor solubilní guanylátcyklázy (riociguat), který vedl k signifikantnímu zlepšení primárního cíle (šestiminutový walking test) po 16 týdnech terapie plicní arteriální hypertenze v klinickém hodnocení fáze 3 PATENT-1 a také ke splnění četných sekundárních cílů [70]. V in vitro experimentech vedla stimulace riociguatem k redukci syntézy kolagenu SSc fibroblasty v závislosti na dávce a v in vivo experimentech k prevenci rozvoje kožní fibrózy indukované bleomycinem u Tsk-1 myší, u modelu TBRICA a SclGvHD, ve kterém utlumil i gastrointestinální fibrózu. U bleomycinem indukované kožní fibrózy došlo i k redukci etablované fibrózy [71–73]. Účinnost riociguatu je právě hodnocena v klinickém hodnocení fáze 2 u pacientů se SSc (i v České republice), jejíž limitací mohou být nežádoucí účinky ve smyslu hypotenze, soudě podle výsledků studie PATENT-1.
Závěr
V současné době je k dispozici několik dobře charakterizovaných experimentálních modelů, pomocí kterých můžeme studovat různé patologické procesy SSc. Poznatky získané pomocí zvířecích modelů SSc mohou přinést nové informace a objasnit dosud nevysvětlené patogenetické mechanismy SSc. Zvířecí modely slouží rovněž jako slibný nástroj na vývoj a testování nových kandidátních molekul pro terapii SSc. Je potřebné zdůraznit, že žádný z momentálních experimentálních modelů neobsahuje všechny aspekty SSc. Většina zavedených modelů reprezentuje několik patogenetických mechanismů najednou a pro téměř všechny, vyjma několika zaměřených pouze na vaskulopatii, je charakteristická těžká tkáňová fibróza. Naopak jen pár modelů je vhodných pro studium poškození malých tepen. Proto je důležité si pečlivě zvolit vhodný model nebo kombinaci několika modelů před zahájením konkrétních in vivo experimentů (tabulka 1). Když je cílem analýza kompletní patogeneze nemoci, je vhodné upřednostnit modely, které napodobují široké spektrum patologií SSc, jako například Fra-2 transgenní myši nebo kuřecí linie UCD200/206. Pro testování nových antifibrotických agens je vhodné začít s dobře charakterizovanými modely – modely s bleomycinem pro zánětem indukovanou fibrózu a Tsk-1 myši pro fibrózu nezávislou na zánětu. V ideálním případě použít pro testování oba modely a ověřit pak účinnost na komplexnějším modelu – například u Fra-2 transgenních myších. V budoucnu může vést kombinace genetických a indukčních strategií k vytvoření experimentálních modelů, které přesněji a do větší míry napodobí SSc a mohou vést k objasnění podstatných patomechanismů a objevení univerzální účinné terapie SSc. Stávající modely však již nyní přispěly významnou mírou k preklinickému testování několika dostupných biologických agens a malých molekul, z nichž některé dosáhly slibných výsledků v prvních klinických hodnoceních a mohly by přinést lepší vyhlídky pacientům s touto dosud neléčitelnou nemocí.
Poděkování: Práce vznikla za podpory MZ ČR – Institucionální podpora, Koncepční rozvoj výzkumné organizace č. MZO 023728.
Adresa pro korespondenci:
MUDr. Michal Tomčík, Ph.D.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: tomcik@revma.cz
Zdroje
1. Gabrielli A, Avvedimento EV, Krieg T. Mechanisms of Disease: Scleroderma. New Engl J Med 2009 May 7; 360(19): 1989–2003.
2. Varga J, Abraham D. Systemic sclerosis: a prototypic multisystem fibrotic disorder. The Journal of clinical investigation 2007 Mar; 117(3): 557–567.
3. Denton CP, Black CM. Scleroderma--clinical and pathological advances. Best Pract Res Clin Rheumatol 2004 Jun; 18(3): 271–290.
4. Beyer C, Schett G, Distler O, Distler JH. Animal models of systemic sclerosis: prospects and limitations. Arthritis and rheumatism Oct; 62(10): 2831–2844.
5. Umezawa H, Ishizuka M, Maeda K, Takeuchi T. Studies on bleomycin. Cancer 1967 May; 20(5): 891–895.
6. Yamamoto T, Takagawa S, Katayama I, Yamazaki K, Hamazaki Y, Shinkai H, et al. Animal model of sclerotic skin. I: Local injections of bleomycin induce sclerotic skin mimicking scleroderma. J Investigative Dermatol 1999 Apr; 112(4): 456–462.
7. Yoshizaki A, Iwata Y, Komura K, Ogawa F, Hara T, Muroi E, et al. CD19 regulates skin and lung fibrosis via Toll-like receptor signaling in a model of bleomycin-induced scleroderma. Am J Pathol 2008 Jun; 172(6): 1650–1663.
8. Yamamoto T, Nishioka K. Cellular and molecular mechanisms of bleomycin-induced murine scleroderma: current update and future perspective. Exp Dermatol. 2005 Feb; 14(2): 81–95.
9. Vogelsang GB, Lee L, Bensen-Kennedy DM. Pathogenesis and treatment of graft-versus-host disease after bone marrow transplant. Annu Rev Med 2003; 54 : 29–52.
10. Ruzek MC, Jha S, Ledbetter S, Richards SM, Garman RD. A modified model of graft-versus-host-induced systemic sclerosis (scleroderma) exhibits all major aspects of the human disease. Arthritis Rheum 2004 Apr; 50(4): 1319–1331.
11. Jaffee BD, Claman HN. Chronic graft-versus-host disease (GVHD) as a model for scleroderma. I. Description of model systems. Cell Immunol 1983 Apr 1; 77(1): 1–12.
12. Claman HN, Jaffee BD, Huff JC, Clark RA. Chronic graft-versus-host disease as a model for scleroderma. II. Mast cell depletion with deposition of immunoglobulins in the skin and fibrosis. Cell Immunol 1985 Aug; 94(1): 73–84.
13. Howell CD, Yoder T, Claman HN, Vierling JM. Hepatic homing of mononuclear inflammatory cells isolated during murine chronic graft-vs-host disease. J Immunol 1989 Jul 15; 143(2): 476–483.
14. Levy S, Nagler A, Okon S, Marmary Y. Parotid salivary gland dysfunction in chronic graft-versus-host disease (cGVHD): a longitudinal study in a mouse model. Bone Marrow Transplant 2000 May; 25(10): 1073–1078.
15. Li J, Helm K, Howell CD. Contributions of donor CD4 and CD8 cells to liver injury during murine graft-versus-host disease. Transplantation 1996 Dec 15; 62(11): 1621–1628.
16. Siracusa LD, McGrath R, Ma Q, Moskow JJ, Manne J, Christner PJ, et al. A tandem duplication within the fibrillin 1 gene is associated with the mouse tight skin mutation. Genome Res 1996 Apr; 6(4): 300–313.
17. Green MC, Sweet HO, Bunker LE. Tight-skin, a new mutation of the mouse causing excessive growth of connective tissue and skeleton. Amer J Pathol 1976 Mar; 82(3): 493–512.
18. Menton DN, Hess RA, Lichtenstein JR, Eisen A. The structure and tensile properties of the skin of tight-skin (Tsk) mutant mice. J Invest Dermatol 1978 Jan; 70(1): 4–10.
19. Menton DN, Hess RA. The ultrastructure of collagen in the dermis of tight-skin (Tsk) mutant mice. J Invest Dermatol 1980 Mar; 74(3): 139–147.
20. Baxter RM, Crowell TP, McCrann ME, Frew EM, Gardner H. Analysis of the tight skin (Tsk1/+) mouse as a model for testing antifibrotic agents. Lab Invest 2005 Oct; 85(10): 1199–1209.
21. Saito E, Fujimoto M, Hasegawa M, Komura K, Hamaguchi Y, Kaburagi Y, et al. CD19-dependent B lymphocyte signaling thresholds influence skin fibrosis and autoimmunity in the tight-skin mouse. J Clin Invest 2002 Jun; 109(11): 1453–1462.
22. Gershwin ME, Abplanalp H, Castles JJ, Ikeda RM, van der Water J, Eklund J, et al. Characterization of a spontaneous disease of white leghorn chickens resembling progressive systemic sclerosis (scleroderma). J Exp Med 1981 Jun 1; 153(6): 1640–1659.
23. Wick G, Andersson L, Hala K, Gershwin ME, Selmi C, Erf GF, et al. Avian models with spontaneous autoimmune diseases. Adv Immunol 2006; 92 : 71–117.
24. Sgonc R, Gruschwitz MS, Dietrich H, Recheis H, Gershwin ME, Wick G. Endothelial cell apoptosis is a primary pathogenetic event underlying skin lesions in avian and human scleroderma. J Clin Invest 1996 Aug 1; 98(3): 785–792.
25. Sgonc R, Wick G. Pro - and anti-fibrotic effects of TGF-beta in scleroderma. Rheumatology (Oxford) 2008 Oct; 47 Suppl 5: v5–7.
26. Wagner EF, Eferl R. Fos/AP-1 proteins in bone and the immune system. Immunol Rev 2005 Dec; 208 : 126–140.
27. Reich N, Maurer B, Akhmetshina A, Venalis P, Dees C, Zerr P, et al. The transcription factor Fra-2 regulates the production of extracellular matrix in systemic sclerosis. Arthritis Rheum Jan; 62(1): 280–290.
28. Maurer B, Busch N, Jungel A, Pileckyte M, Gay RE, Michel BA, et al. Transcription factor fos-related antigen-2 induces progressive peripheral vasculopathy in mice closely resembling human systemic sclerosis. Circulation 2009 Dec 8; 120(23): 2367–2376.
29. Eferl R, Hasselblatt P, Rath M, Popper H, Zenz R, Komnenovic V, et al. Development of pulmonary fibrosis through a pathway involving the transcription factor Fra-2/AP-1. Proc Natl Acad Sci U S A 2008 Jul 29; 105(30): 10525–10530.
30. Bou-Gharios G, Garrett LA, Rossert J, Niederreither K, Eberspaecher H, Smith C, et al. A potent far-upstream enhancer in the mouse pro alpha 2(I) collagen gene regulates expression of reporter genes in transgenic mice. J Cell Biol 1996 Sep; 134(5): 1333–1344.
31. Sonnylal S, Denton CP, Zheng B, Keene DR, He R, Adams HP, et al. Postnatal induction of transforming growth factor beta signaling in fibroblasts of mice recapitulates clinical, histologic, and biochemical features of scleroderma. Arth Rheum 2007 Jan; 56(1): 334–344.
32. Denton CP, Zheng B, Shiwen X, Zhang Z, Bou-Gharios G, Eberspaecher H, et al. Activation of a fibroblast-specific enhancer of the proalpha2(I) collagen gene in tight-skin mice. Arth Rheum 2001 Mar; 44(3): 712–722.
33. Moore BB, Hogaboam CM. Murine models of pulmonary fibrosis. American journal of physiology Lung Cell Mol Physiol 2008 Feb; 294(2): L152–160.
34. Degryse AL, Lawson WE. Progress toward improving animal models for idiopathic pulmonary fibrosis. Ameri J Med Scien 2011 Jun; 341(6): 444–449.
35. Chung MP, Monick MM, Hamzeh NY, Butler NS, Powers LS, Hunninghake GW. Role of repeated lung injury and genetic background in bleomycin-induced fibrosis. Amer J Respir cell Mol Biol 2003 Sep; 29(3 Pt 1): 375–380.
36. B BM, Lawson WE, Oury TD, Sisson TH, Raghavendran K, Hogaboam CM. Animal models of fibrotic lung disease. American journal of respiratory cell and molecular biology. 2013 Aug; 49(2): 167–179.
37. Gomez-Arroyo J, Saleem SJ, Mizuno S, Syed AA, Bogaard HJ, Abbate A, et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. Amer J Physiol Lung Cell Mol Physiol 2012 May 15; 302(10): L977–991.
38. Nicolls MR, Mizuno S, Taraseviciene-Stewart L, Farkas L, Drake JI, Al Husseini A, et al. New models of pulmonary hypertension based on VEGF receptor blockade-induced endothelial cell apoptosis. Pulm Circul 2012 Oct; 2(4): 434–442.
39. Sakao S, Tatsumi K. The effects of antiangiogenic compound SU5416 in a rat model of pulmonary arterial hypertension. Respiration; international review of thoracic diseases 2011; 81(3): 253–261.
40. Stenmark KR, Meyrick B, Galie N, Mooi WJ, McMurtry IF. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American journal of physiology Lung Cell Molec Physiol 2009 Dec; 297(6): L1013–1032.
41. Firth AL, Choi IW, Park WS. Animal models of pulmonary hypertension: Rho kinase inhibition. Prog Biophysics Mol Biol 2012 Aug; 109(3): 67–75.
42. Koca SS, Isik A, Ozercan IH, Ustundag B, Evren B, Metin K. Effectiveness of etanercept in bleomycin-induced experimental scleroderma. Rheumatology 2008 Feb; 47(2): 172–175.
43. Mauviel A, Daireaux M, Redini F, Galera P, Loyau G, Pujol JP. Tumor necrosis factor inhibits collagen and fibronectin synthesis in human dermal fibroblasts. FEBS letters 1988 Aug 15; 236(1): 47–52.
44. Allanore Y, Devos-Francois G, Caramella C, Boumier P, Jounieaux V, Kahan A. Fatal exacerbation of fibrosing alveolitis associated with systemic sclerosis in a patient treated with adalimumab. Ann Rheum Dis 2006 Jun; 65(6): 834–835.
45. Ramos-Casals M, Perez-Alvarez R, Perez-de-Lis M, Xaubet A, Bosch X, Group BS. Pulmonary disorders induced by monoclonal antibodies in patients with rheumatologic autoimmune diseases. Amer J Med 2011 May; 124(5): 386–394.
46. Denton CP, Engelhart M, Tvede N, Wilson H, Khan K, Shiwen X, et al. An open-label pilot study of infliximab therapy in diffuse cutaneous systemic sclerosis. Ann Rheum Dis 2009 Sep; 68(9): 1433–1439.
47. Distler JH, Jordan S, Airo P, Alegre-Sancho JJ, Allanore Y, Balbir Gurman A, et al. Is there a role for TNFalpha antagonists in the treatment of SSc? EUSTAR expert consensus development using the Delphi technique. Clinical and experimental rheumatology. 2011 Mar-Apr; 29(2 Suppl 65): S40–45.
48. Lam GK, Hummers LK, Woods A, Wigley FM. Efficacy and safety of etanercept in the treatment of scleroderma-associated joint disease. J Rheumatol 2007 Jul; 34(7): 1636–1637.
49. Hasegawa M, Hamaguchi Y, Yanaba K, Bouaziz JD, Uchida J, Fujimoto M, et al. B-lymphocyte depletion reduces skin fibrosis and autoimmunity in the tight-skin mouse model for systemic sclerosis. Amer J Pathol 2006 Sep; 169(3): 954–966.
50. Komura K, Yanaba K, Horikawa M, Ogawa F, Fujimoto M, Tedder TF, et al. CD19 regulates the development of bleomycin-induced pulmonary fibrosis in a mouse model. Arth Rheumat 2008 Nov; 58(11): 3574–3584.
51. Bosello S, De Santis M, Lama G, Spano C, Angelucci C, Tolusso B, et al. B cell depletion in diffuse progressive systemic sclerosis: safety, skin score modification and IL-6 modulation in an up to thirty-six months follow-up open-label trial. Arth Res & Therapy 2010; 12(2): R54.
52. Daoussis D, Liossis SN, Tsamandas AC, Kalogeropoulou C, Kazantzi A, Sirinian C, et al. Experience with rituximab in scleroderma: results from a 1-year, proof-of-principle study. Rheumatology 2010 Feb; 49(2): 271–280.
53. Daoussis D, Liossis SN, Tsamandas AC, Kalogeropoulou C, Paliogianni F, Sirinian C, et al. Effect of long-term treatment with rituximab on pulmonary function and skin fibrosis in patients with diffuse systemic sclerosis. Clinic Experim Rheumat 2012 Mar-Apr; 30(2 Suppl 71): S17–22.
54. Lafyatis R, Kissin E, York M, Farina G, Viger K, Fritzler MJ, et al. B cell depletion with rituximab in patients with diffuse cutaneous systemic sclerosis. Arth Rheumat 2009 Feb; 60(2):578-583.
55. Smith V, Piette Y, van Praet JT, Decuman S, Deschepper E, Elewaut D, et al. Two-year results of an open pilot study of a 2-treatment course with rituximab in patients with early systemic sclerosis with diffuse skin involvement. J Rheumatol 2013 Jan; 40(1): 52–57.
56. Smith V, Van Praet JT, Vandooren B, Van der Cruyssen B, Naeyaert JM, Decuman S, et al. Rituximab in diffuse cutaneous systemic sclerosis: an open-label clinical and histopathological study. Ann Rheum Dis 2010 Jan; 69(1): 193–197.
57. Allanore Y, Saad M, Dieude P, Avouac J, Distler JH, Amouyel P, et al. Genome-wide scan identifies TNIP1, PSORS1C1, and RHOB as novel risk loci for systemic sclerosis. PLoS genetics. 2011 Jul; 7(7):e1002091.
58. Kadono T, Kikuchi K, Ihn H, Takehara K, Tamaki K. Increased production of interleukin 6 and interleukin 8 in scleroderma fibroblasts. J Rheumatol 1998 Feb; 25(2): 296–301.
59. Kawaguchi Y, Hara M, Wright TM. Endogenous IL-1alpha from systemic sclerosis fibroblasts induces IL-6 and PDGF-A. J Clinic Invest 1999 May; 103(9): 1253–1260.
60. Desallais L, Avouac J, Frechet M, Elhai M, Ratsimandresy R, Montes M, et al. Targeting IL-6 by both passive or active immunization strategies prevents bleomycin-induced skin fibrosis. Arth Res & Therapy 2014; 16(4): R157.
61. Kitaba S, Murota H, Terao M, Azukizawa H, Terabe F, Shima Y, et al. Blockade of interleukin-6 receptor alleviates disease in mouse model of scleroderma. Amer J Pathol 2012 Jan; 180(1): 165–176.
62. Le Huu D, Matsushita T, Jin G, Hamaguchi Y, Hasegawa M, Takehara K, et al. IL-6 blockade attenuates the development of murine sclerodermatous chronic graft-versus-host disease. J Invest Dermatol 2012 Dec; 132(12): 2752–2761.
63. Distler JH, Distler O. Imatinib as a novel therapeutic approach for fibrotic disorders. Rheumatology 2009 Jan; 48(1): 2–4.
64. Distler JH, Jungel A, Huber LC, Schulze-Horsel U, Zwerina J, Gay RE, et al. Imatinib mesylate reduces production of extracellular matrix and prevents development of experimental dermal fibrosis. Arth Rheumat 2007 Jan; 56(1): 311–322.
65. Akhmetshina A, Venalis P, Dees C, Busch N, Zwerina J, Schett G, et al. Treatment with imatinib prevents fibrosis in different preclinical models of systemic sclerosis and induces regression of established fibrosis. Arth Rheumat 2009 Jan; 60(1): 219–224.
66. Akhmetshina A, Dees C, Pileckyte M, Maurer B, Axmann R, Jungel A, et al. Dual inhibition of c-abl and PDGF receptor signaling by dasatinib and nilotinib for the treatment of dermal fibrosis. FASEB J. 2008 Jul; 22(7): 2214–2222.
67. Pope J, McBain D, Petrlich L, Watson S, Vanderhoek L, de Leon F, et al. Imatinib in active diffuse cutaneous systemic sclerosis: Results of a six-month, randomized, double-blind, placebo-controlled, proof-of-concept pilot study at a single center. Arth Rheumat 2011 Nov; 63(11): 3547–3551.
68. Prey S, Ezzedine K, Doussau A, Grandoulier AS, Barcat D, Chatelus E, et al. Imatinib mesylate in scleroderma-associated diffuse skin fibrosis: a phase II multicentre randomized double-blinded controlled trial. The British journal of dermatology. 2012 Nov; 167(5): 1138–1144.
69. Spiera RF, Gordon JK, Mersten JN, Magro CM, Mehta M, Wildman HF, et al. Imatinib mesylate (Gleevec) in the treatment of diffuse cutaneous systemic sclerosis: results of a 1-year, phase IIa, single-arm, open-label clinical trial. Ann Rheum Diseas 2011 Jun; 70(6): 1003–1009.
70. Shanmugam E, Jena A, George M. Riociguat: Something new in pulmonary hypertension therapeutics? J Pharmac & Pharmacotherapeutics 2015 Jan-Mar; 6(1): 3–6.
71. Beyer C, Reich N, Schindler SC, Akhmetshina A, Dees C, Tomcik M, et al. Stimulation of soluble guanylate cyclase reduces experimental dermal fibrosis. Ann Rheum Dis 2012 Jun; 71(6): 1019–1026.
72. Beyer C, Zenzmaier C, Palumbo-Zerr K, Mancuso R, Distler A, Dees C, et al. Stimulation of the soluble guanylate cyclase (sGC) inhibits fibrosis by blocking non-canonical TGFbeta signalling. Ann Rheum Dis 2014 Feb 23.
73. Dees C, Beyer C, Distler A, Soare A, Zhang Y, Palumbo-Zerr K, et al. Stimulators of soluble guanylate cyclase (sGC) inhibit experimental skin fibrosis of different aetiologies. Ann Rheum Dis 2015 Mar 27.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článek Ze života časopisu
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2015 Číslo 2- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
-
Péče o pacienty s nízkotraumatickou zlomeninou horního konce stehenní kosti.
II. Následná osteologická péče.
Doporučený postup České revmatologické společnosti, Společnosti pro metabolická onemocnění skeletu a České společnosti pro ortopedii a traumatologii - Experimentální modely systémové sklerodermie – cesta k poznání a léčbě neléčitelné nemoci?
- Podkožní infekce Scedosporium apiospermum s postižením loketního kloubu u pacienta s revmatoidní artitidou
- Ze života časopisu
-
Péče o pacienty s nízkotraumatickou zlomeninou horního konce stehenní kosti.
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Péče o pacienty s nízkotraumatickou zlomeninou horního konce stehenní kosti.
II. Následná osteologická péče.
Doporučený postup České revmatologické společnosti, Společnosti pro metabolická onemocnění skeletu a České společnosti pro ortopedii a traumatologii - Podkožní infekce Scedosporium apiospermum s postižením loketního kloubu u pacienta s revmatoidní artitidou
- Experimentální modely systémové sklerodermie – cesta k poznání a léčbě neléčitelné nemoci?
- Ze života časopisu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



