-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Podkožní infekce Scedosporium apiospermum s postižením loketního kloubu u pacienta s revmatoidní artitidou
Subcutaneous and elbow joint infection with Scedosporium apiospermum in a patient with rheumatoid arthritis
Rheumatoid arthritis (RA) is a chronic inflammatory systemic disease, which in its essence and treatment leads to a higher incidence of infections. We describe a rare case of a 63-year-old male patient with many years of history of RA (treated with corticosteroids and conventional synthetic disease-modifying antirheumatic drugs), who developed subcutaneous and joint infection caused by fungus Scedosporium apiospermum (perfect stage Pseudallescheria boydii) after fifteen years of RA. Fungal agent from indolent subcutaneous lesions on his left forearm and right arm was found on microscopic and microbiological examination. The patient subsequently underwent a six-month cyclical treatment with voriconazole, which was alternated several times with itraconazole and terbinafine. After several cycles of six-month treatment, usually after about a year, a relapse occurred with repeated manifestation in the subcutaneous tissue and finally percontinuitatem even in the joint. After seven years of repeated outbreaks of fungal infection the patient dies of a sudden death with a clinical picture of thromboembolic disease. Autopsy results did not show active infection or overt infectious focus. Scedosporium apiospermum is fibrous, saprophytic fungus with relatively low virulence that is ubiquitously present in the environment, including soil and aquatic ecosystems. It is one of the typical causes of subcutaneous mycoses, the presence of which is largely tied to the subtropical region. In case of an immunosuppressed patient, infection by S. apiospermum may develop into severe systemic infection. Clinical observation completes the set of possible infectious complications in patients with RA.
Key words:
Rheumatoid arthritis, subcutaneous infection, Scedosporium apiospermum, voriconazole
Autori: T. Soukup 1; V. Buchta 2; R. Kříž Záňová 1; T. Veleta 3; M. Tošovský 1; P. Bradna 1
Pôsobisko autorov: Univerzita Karlova v Praze, Lékařská fakulta a Fakultní nemocnice v Hradci Králové, II. interní gastroenterologická klinika 1; Univerzita Karlova v Praze, Lékařská fakulta a Fakultní nemocnice v Hradci Králové, Ústav klinické mikrobiologie 2; Fakultní nemocnice Hradec Králové, Oddělení urgentní medicíny 3
Vyšlo v časopise: Čes. Revmatol., 23, 2015, No. 2, p. 69-75.
Kategória: Kazuistika
Súhrn
Revmatoidní artritida (RA) je chronické zánětlivé systémové onemocnění, které svou podstatou i léčbou vede k vyššímu výskytu infekcí. Popisujeme raritní případ 63letého nemocného s mnohaletým trváním RA (léčeného glukokortikoidy a konvenčními syntetickými, chorobu modifikujícími léky), u kterého se po patnácti letech diagnózy RA rozvinula podkožní a kloubní infekce vyvolaná houbou Scedosporium apiospermum perfektní stadium Pseudallescheria boydii). Houbové agens bylo mikroskopicky a kultivačně prokázáno v indolentních podkožních lézích na levém předloktí a pravé paži. Pacient následně podstoupil cyklickou šestiměsíční léčbu vorikonazolem, několikrát vystřídanou itrakonazolem a terbinafinem. Po několika šestiměsíčních cyklech léčby došlo vždy přibližně po roce k relapsu s opětovnou manifestací v podkoží a nakonec per continuitatem i v kloubu. Po sedmi letech opakovaných vzplanutí mykotické infekce nemocný umírá náhlou smrtí pod obrazem tromboembolické nemoci. Výsledky pitvy neprokázaly aktivní infekci ani zjevný infekční fokus. Scedosporium apiospermum je vláknitá, saprofytická houba s relativně nízkou virulencí, která se ubikvitně vyskytuje v prostředí, včetně půdy a vodních ekosystémů. Patří mezi typické vyvolavatele subkutánních mykóz, jejichž výskyt je převážně vázaný na subtropické oblasti. V případě imunosuprese pacienta se může infekce S. apiospermum rozvinout v závažnou systémovou infekci. Klinické pozorování doplňuje soubor možných infekčních komplikací u pacientů s RA.
Klíčová slova:
Revmatoidní artritida, subkutánní infekce, Scedosporium apiospermum, vorikonazolÚvod
Revmatoidní artritida (RA) je chronické zánětlivé systémové onemocnění pojiva, které svou podstatou i léčbou vede k oslabení imunitního systému. To se projevuje zvýšenou vnímavostí pacientů k infekcím oproti běžné populaci (1), kteří jsou tak ohroženi opakovanými infekčními komplikacemi bakteriální, virové anebo mykotické etiologie (1). Klinicky se jedná zejména o častější infekce močového traktu, dýchacích cest, pneumonie, infekce měkkých tkání a kloubů (1, 2). Zvýšená náchylnost k infekcím u pacientů s RA je multifaktoriální, způsobená imunologickými poruchami spojenými s RA, užíváním imunosupresivních léků (2) a nejspíše i genetickou predispozicí (2). Populační studie identifikovaly rizikové faktory pro rozvoj infekce u RA jako jsou: vyšší věk, komorbidity, užívání glukokortikoidů, přítomnost některých prognostických markerů RA: revmatoidní faktory (RF), přítomnost revmatoidních uzlů, zvýšená sedimentace erytrocytů a redukce funkčních schopností nemocného při RA (1). Přestože obecně u mykotických infekcí převažuje v populaci kvasinková etiologie, u těžce imunosuprimovaných pacientů narůstá především incidence infekcí způsobených vláknitými houbami.
Popisujeme raritní případ nemocného s mnohaletým trváním RA, léčeného konvenčními syntetickými chorobu modifikujícími léky (csDMARDs) a glukokortikoidy, u kterého se vyskytly opakované infekční komplikace včetně infekce oportunní houbou Scedosporium apiospermum.
Popis případu
Ve věku 48 let (v roce 1996) byla nemocnému diagnostikována RA podle American College of Rheumatology (ACR) kritérií z roku 1987 (3). Latex fixačním testem byl prokázán vysoký titr RF ve třídě IgM 1 : 1280, současně byla zjištěna přítomnost protilátek proti cyklickému citrulinovanému peptidu (ACPA) 1205 U/ml.
Podle záznamu předchorobí nemocný trpěl algickou formou ischemické choroby srdeční, významnou mitrální insuficiencí a arteriální hypertenzí. Po dvou letech léčby glukokortikoidy se rozvinul sekundární diabetes mellitus a osteodenzitometricky byla prokázaná osteoporóza. Nemocný byl nekuřák, alkohol požíval příležitostně. V domácnosti choval psa a kočky. Rád a často pracoval na zahradě, do zahraničí necestoval.
Již od počátku nemoci měl pacient aktivní formu RA (DAS28 5,0). Iniciálně byl léčen methylprednisolonem 16 mg/den, methotrexátem 15 mg/týden se suplementací kyselinou listovou 20 mg týdně. Po třech letech byla pro nedostatečný efekt a výskyt opakovaných respiračních infekcí tato léčba zaměněna za cyklosporin 3,0 mg/kg. Po krátké době došlo k onemocnění infekční endokarditidou způsobenou Staphylococcus epidermidis. Léčba csDMARDs byla ukončena. Dlouhodobá léčba endokarditidy si vyžádala dlouhodobé upoutání na lůžko, narůstající aktivitu RA. Stav byl nakonec komplikován osteonekrózou hlavice kyčelního kloubu a následně ankylózou. Aktivita RA byla neúspěšně tlumena hydrochloroquinem 200 mg/den v kombinaci s methylprednisolonem 8 mg/den. Pokus o návrat methotrexátu v nízké dávce (10 mg/týden) nebyl z pohledu RA a výskytu respiračních infekcí úspěšný, došlo k vývoji revmatoidních uzlů. Celkem uspokojivý efekt na léčbu RA měla záměna methotrexátu za leflunomid, přestože gastrointestinální intolerance ve smyslu průjmů byla příčinou snížení obvyklé dávky na 10 mg/den.
V březnu 2006 (v 58 letech), po cca třech letech léčby leflunomidem, se objevily pomalu rostoucí podkožní rezistence na levém předloktí (obr. 1) a pravé paži lehce zaměnitelné za revmatoidní uzly. V říjnu 2006 se infiltrující ložiska rozšířila na 1. až 3. prst pravé ruky, na vnitřní stranu pravé paže, kde fluktuovala. Hlubší palpace na levém předloktí vyvolávala bolest. Pacient neměl horečku ani laboratorní známky zánětu (CRP 1,0 mg/l, leukocyty a diferenciální rozpočet při glukokortikoidní léčbě celkově 12,7×109, segmenty 80 %, monocyty 9 %, lymfocyty 9 %). Podle ultrazvukového vyšetření se jednalo o zahuštěnou tekutinovou kolekci s detritem 21×15×26mm. Byla provedena excize a histologické vyšetření prokázalo vazivovou tkáň nahrazenou z větší části smíšeně zánětlivou granulomatózní tkání, pěnitými makrofágy, ojediněle obrovskými mnohojadernými buňkami. Barvení podle Grocottta bylo negativní. Nález na předloktí se začal rozšiřovat, ultrazvukově bylo odhaleno ložisko 26×18mm, přecházející od lokte do blízkosti karpálního tunelu, v něm radiolog zjistil tři septa a echogenitu charakteru detritu. Byla opakovaně provedena punkce levého předloktí se získáním vazké jantarově žluté tekutiny (obr. 2). Cytologické vyšetření odhalilo přítomnost vláknité houby, která byla určena jako Scedosporium apiospermum. Ošetřující lékař po domluvě s mikrobiologem zahájil terapii itrakonazolem (200 mg/ den) po dobu 37 dní, která byla na základě výsledku citlivosti změněna od prosince 2006 na perorální vorikonazol v dávce 400 mg/den po 6 měsíců. To vedlo přechodně k vymizení podkožních rezistencí, ale přibližně v ročních intervalech se opakovaně na předloktí vyvíjela podkožní ložiska, tentokrát bez průkazu S. apiospermum. Přesto byla pravidelně, vzhledem k trvalé imunosupresi, prováděna cyklická léčba vorikonazolem (400 mg/na den) v několikaměsíční sekvenci, v mezidobích intermitentně udržovací léčba itrakonazolem. V roce 2009 byl nemocný přijat na lůžkové oddělení s febrilním stavem. Důvodem byla septická artritida pravého loketního kloubu s nálezem Salmonella enteritidis v synoviální tekutině a hemokultuře. Stav byl zvládnut antibiotickou léčbou.
Obr. 1. Fluktující podkožní rezistence předloktí způsobené infekcí <em>Scedosporium apiospermum</em>. 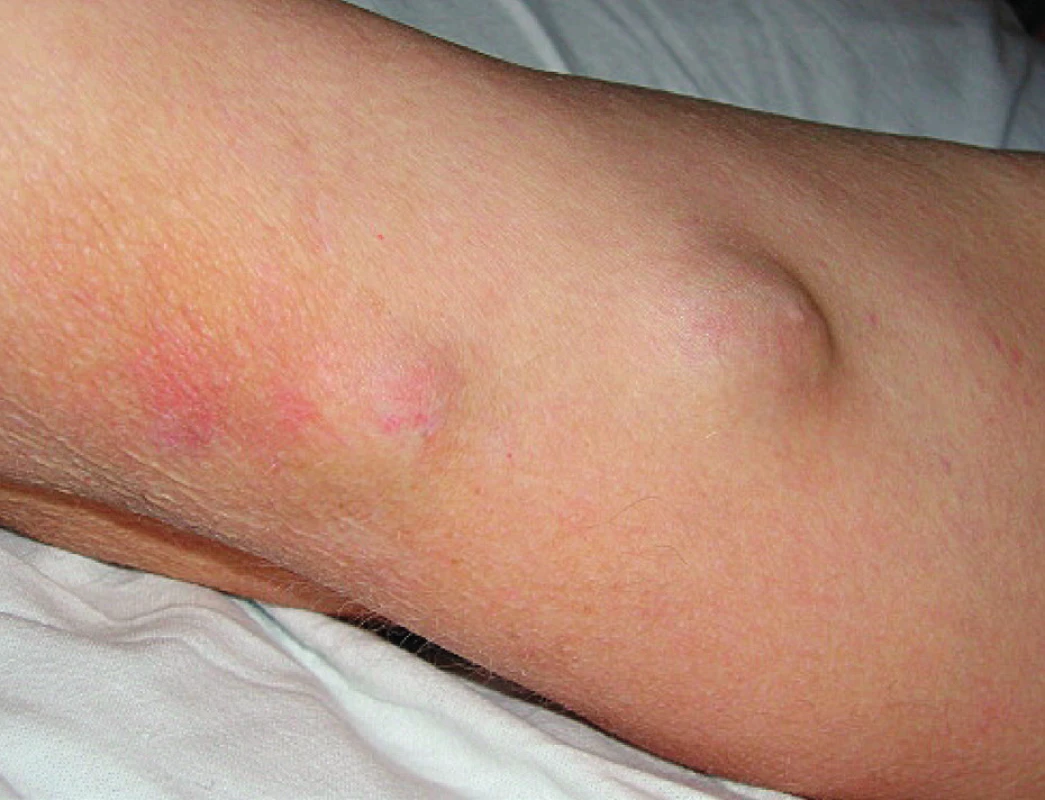
Obr. 2. Jantarově žlutá tekutina získaná z podkožní rezistence na předloktí v roce 2006. 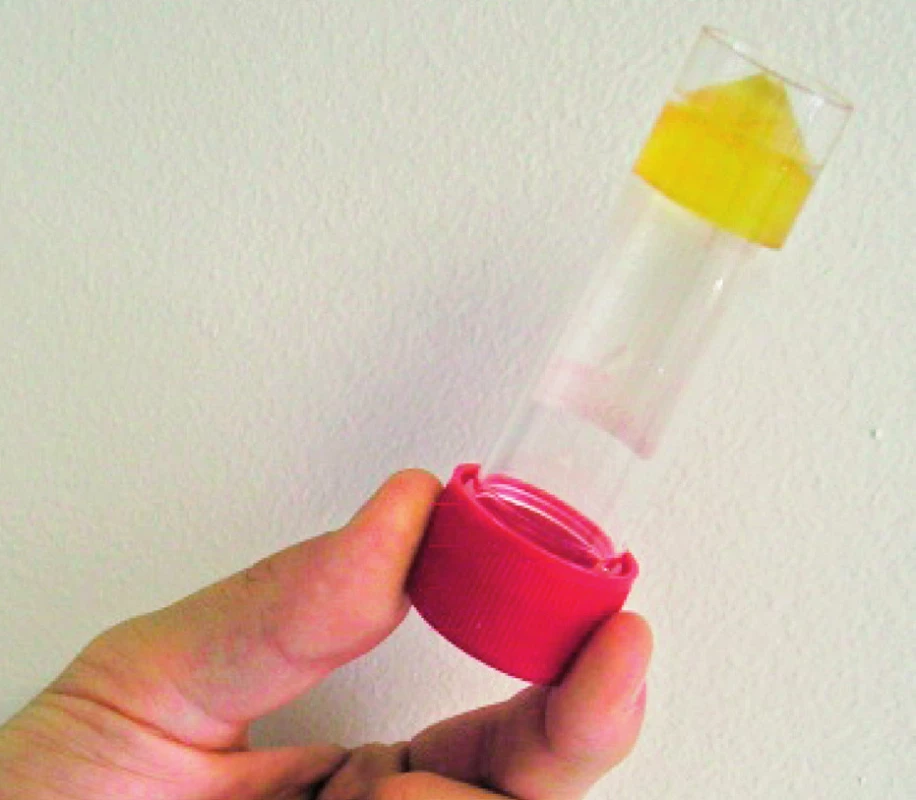
V červenci 2011 byl pacient přijat na naše oddělení pro bolesti zad a zároveň otok pravého lokte. Před přijetím neměl teploty, laboratorní známky zánětu byly středně zvýšené (FW 34/71 mm/h, CRP 33 mg/l, leukocyty 15,4×109/l). Ultrazvukové vyšetření pravého lokte prokázalo objemné intramuskulární ložisko smíšené struktury o velikosti 58×44×84mm, hyperechogenní, ostře ohraničené, pokračující do tekutinové náplně loketního kloubu s detritem. Power doppler ukázal synovitidu se známkami aktivity – hyperémií. To jasně indikovalo punkci burzy olekranonu. Při cytomorfologickém vyšetření synoviální tekutiny byla nalezena mykotická vlákna, určená opět jako S. apiospermum. Vzhledem k předchozím neúspěšným pokusům o eradikaci mykotické infekce byl v úvodní terapii vyzkoušen terbinafin (250 mg/den), následně provedena synovialektomie, vytětí burzy a resekce hlavičky radia. Podle stanovené citlivosti následoval switch na vorikonazol 400 mg/den na 6 měsíců. Plazmatickou koncentraci vorikonazolu v plazmě (1,08 mg/l) i v synoviální tekutině (0,20 mg/l) bylo možné považovat za terapeutickou, protože v obou případech byla vyšší než jeho minimální inhibiční koncentrace (MIC = 0,12 mg/l) u získaného izolátu houby. Kontrolní kultivace punktátu z oblasti pravého lokte po třech týdnech terapie již neprokázala mykotickou infekci.
V srpnu 2012 se rozvinula tekutinová kolekce na dorzu levé ruky. V bioptátu byla opět přítomna mykotická vlákna, což si vyžádalo opakování antimykotické kúry vorikonazolem. RA vzhledem k těmto okolnostem dospěla do IV. stadia podle Steinbrockera a připoutala nemocného k invalidnímu vozíku nebo francouzským holím (pro krátkodobou pohybovou aktivitu).
V říjnu 2013 nemocný náhle umírá pod obrazem masivní plicní embolizace. Provedená pitva neprokázala aktivní infekci ani zjevný infekční fokus.
Obr. 3. Kolonie izolátu <em>Scedosporium apiospermum</em> na Sabouraudově agaru (7 dnů, 37 °C) od našeho pacienta. 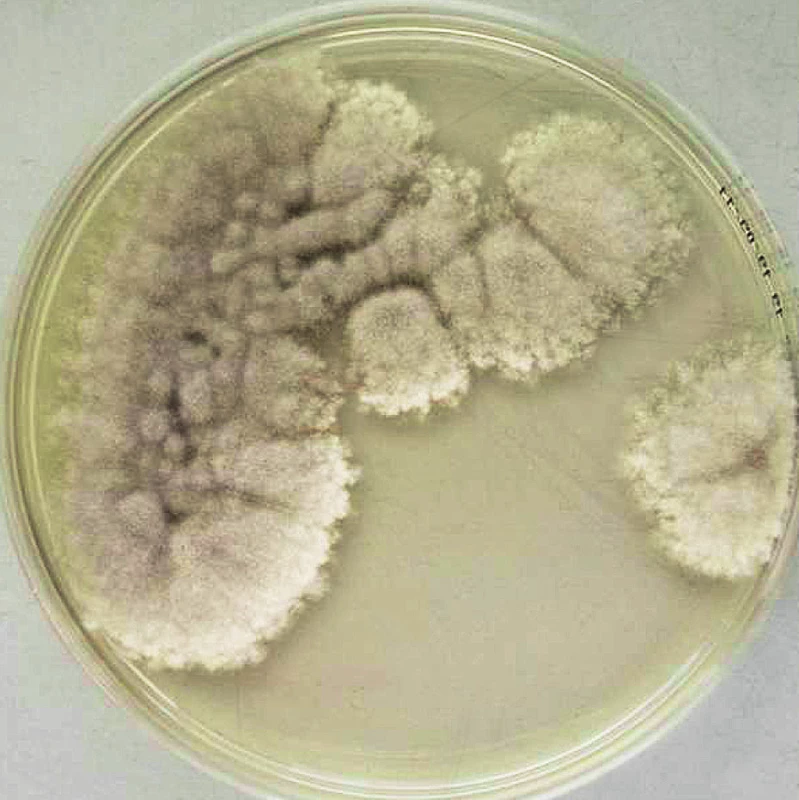
Obr. 4. Přehled léčby revmatoidní artritidy, projevů/aktivity revmatoidní artritídy, infekčních a neinfekčních komplikací léčby. MP – methyprednisolon; MTX – methotrexát; CSA – cyklosporin A; LEF – leflunomid; PLQ – hydrochloroquin; SAS – salazopyrin; DAS28 – disease activity score – 28 kloubů; U MTX jsou uvedeny týdenní dávky, u všech ostatních léků jsou uvedeny dávky denní. 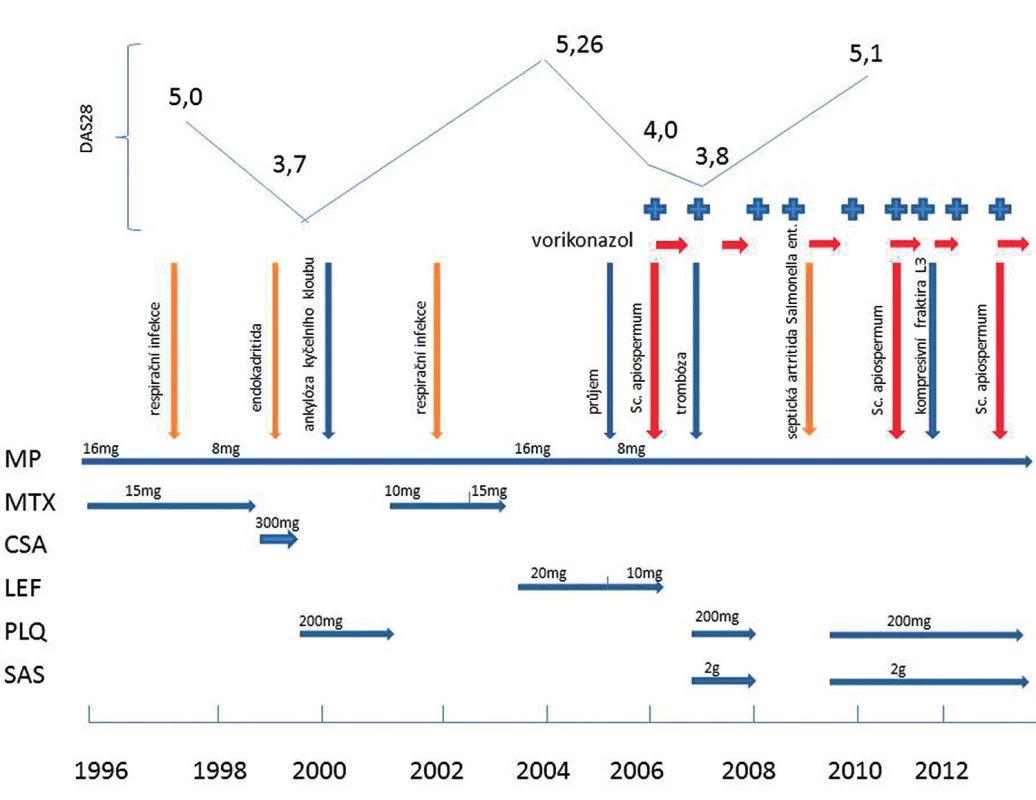
Diskuse
Na případu šedesátiletého pacienta s RA byl demonstrován vztah mezi rizikovými faktory a infekčními a jinými komplikacemi, včetně kardiálních komorbidit, sekundárního diabetes mellitus a nepříznivými prognostickými faktory RA (přítomnost RF, ACPA, revmatoidních uzlů, funkční omezení s nutností používání invalidního vozíku). Úvaha o implementaci infekce byla vedena směrem k drobnému poranění kůže předloktí při zahradnické práci, kterou sám nemocný považoval za pravděpodobnou a která odpovídá obvyklému způsobu šíření původců subkutánních mykóz, mezi které patogenní scedosporia patří (4).
Pokusy o imunomodulační terapii RA byly opakovaně komplikovány závažnými infekčními stavy (bakteriální endokarditida, salmonelová sepse, recidivující infekce dýchacích cest), což vedlo k postupné ztrátě kontroly průběhu RA, další invalidizaci nemocného a dalšímu zvyšování rizika infekčních nemocí.
Vzhledem k tomu, že v literatuře byly u rizikových pacientů popsány generalizace scedosporiové infekce (plíce, endokarditida), nelze vyloučit možnost rozvoje systémové mykózy v souvislosti s RA. S ohledem na to, že první průkaz scedosporia byl v roce 2006 a po několika cyklech léčby vorikonazolem docházelo k opakované manifestaci v podkoží (navzdory negativnímu mykologickému vyšetření) a nakonec prokazatelně i v kloubu, lze za nejpravděpodobnější považovat existenci fokusu v předloktí, kde houba odolávala eradikaci antimykotickou léčbou. Opakovaná reinfekce je velmi málo pravděpodobná. Při pitvě nebyly systémová infekce ani fokus prokázány.
Složitá je diskuse nad mírou invazivity terapie. Konzervativní léčba může být spojena s výskytem nežádoucích účinků a lékových interakcí u antimykotik, u kterých je nezbytné dlouhodobé podávání. Nezanedbatelná je ekonomická nákladnost léčby. Chirurgické řešení je radikálním výkonem, který má opodstatnění u solitérních lézí a který s sebou nese významné riziko sekundární infekce a velmi špatné hojení. V našem případě byla použita kombinace obou léčebných přístupů s uspokojivým výsledkem – podařilo se zabránit rozvoji systémové infekce (zejména v pokročilejším stadiu RA), nepodařila se kompletní mykologická eradikace, což vedlo k pravidelným relapsům. Patogenní scedosporia jsou variabilně citlivá k amfotericinu B (5), S. prolificans je dokonce panrezistentní, tj. odolný vůči všem ostatním antimykotikům. V současné době není známa ideální trvale účinná antifungální terapie tohoto patogena (5). Lékem volby je podobně jako u aspergilů nebo fusarií vorikonazol (6). Před zavedením moderních azolových antimykotik (ketokonazol, itrakonazol, flukonazol) se jako lék volby používal intravenózní mikonazol, ten je však dnes nedostupný (7, 8). Výsledky testování citlivosti potvrdily u našeho izolátu dobrou citlivost k vorikonazolu, čemu odpovídala i dobrá klinická odpověď. I když byly koncentrace v synoviální tekutině, resp. v plazmě vyšší než MIC, pravděpodobně nevedly k žádoucímu fungicidnímu efektu a úplné mykologické eradikaci.
Tab. 1. Přehled demografických a klinických dat pacientů s RA s podkožní infekcí Sc. apiospermum, upraveno podle Uenotsuchi a kol. (13). 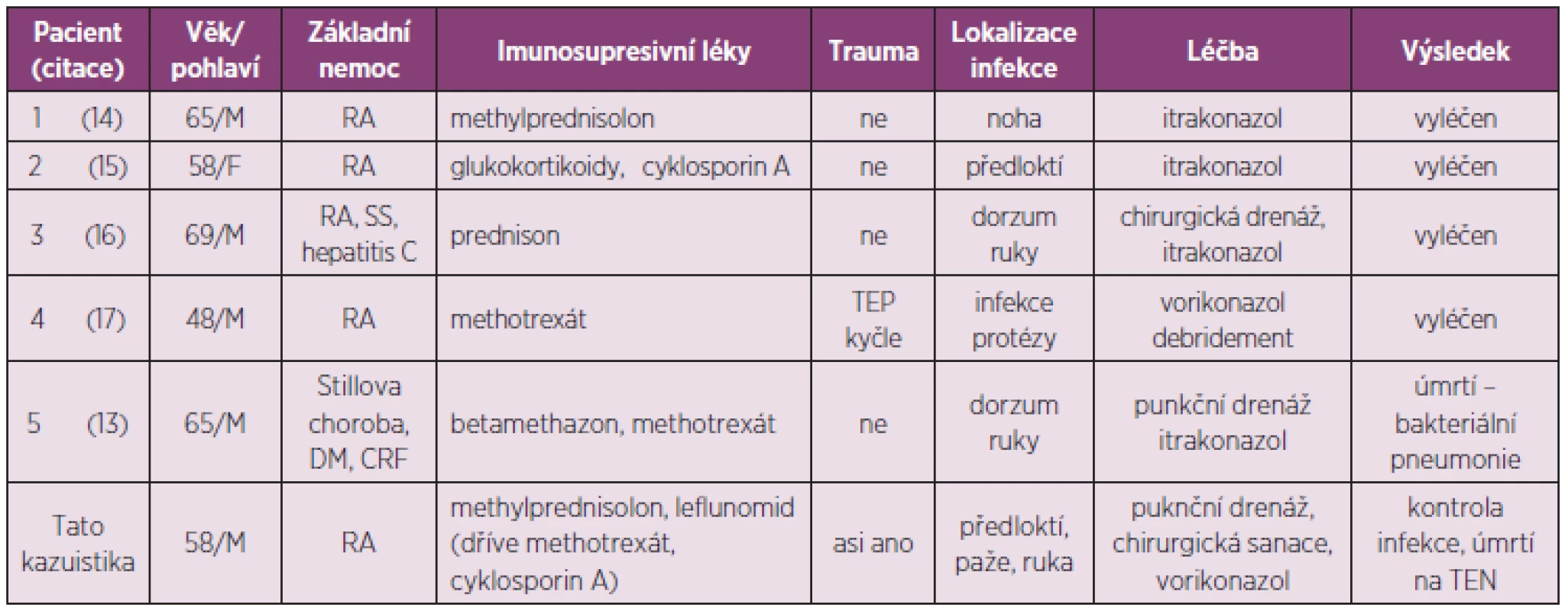
M – muž; F – žena; RA – revmatoidní artritida; SS – Sjögrenův syndrom; CRF – chronické renální selhání; DM – dermatomyositis; TEN – tromboembolická nemoc Pseudallescheria boydii (synonymum Allescheria boydii) je druh ubikvitní houby zařazené mezi Ascomycota (vřeckovýtrusné houby). Její asexuální (anamorfní) forma je S. apiospermum. Houba byla původně popsána americkým mykologem Corneliem Lottem v roce 1922 jako Allescheria. Izolát byl vykultivován od pacienta na nemocničním oddělení University of Texas, který se zřejmě nakazil traumatickou inokulací trnem do kotníku při běhu naboso 12 let předtím. Schopnost tolerovat minimální provzdušnění a vysoký osmotický tlak (4) umožňuje P. boydii růst v půdě a na různých přírodních substrátech, typicky však zejména ve stojatých a znečištěných vodách (9). Po tonutí v případě jejího výskytu se může rozvinout těžká pneumonie. Tato houba se běžně vyskytuje v mírném podnebí, ale hlavní těžiště jejího působení, tj. vyvolavatele podkožních mykóz, je v tropickém pásu (4). Infekce kůže a podkoží (mycetomy) představují hlavní, převládající klinickou formu (99 % infekcí) s typickým chronickým průběhem (9). Za normálních okolností se jedná o houbu s nízkou patogenitou, která vyžaduje traumatické poškození integumentů. U rizikových pacientů se můžeme setkat s jinými lokalizovanými a systémovými formami infekcemi vyvolanými zástupci Scedosporium (dříve pseudallescheriáza), které se obvykle prezentují v centrálním nervovém systému, plicích, kloubech a kostech v závislosti na predispozičních faktorech (5). Hlavními etiologickými agens jsou S. apiospermum a S. prolificans, druhé jmenované nevyvolává subkutánní infekce. Výskyt infekcí spojených s tímto patogenem je častější zejména v Austrálii a Španělsku, vzácně v ostatních oblastech. V případě diseminované infekce je u S. prolificans prognóza velmi špatná, protože je obvykle rezistentní ke všem antimykotikům. Mortalita se u tohoto druhu, ale rovněž u CNS infekcí vyvolaných S. apiospermum, běžně pohybuje nad 75 % navzdory léčbě amfotericinem B či moderními triazoly v monoterapii či v kombinaci.
Během posledních let počet reportů této infekce narůstá. Příčinou je nárůst imunosuprimovaných pacientů v souvislosti s širokým užíváním glukokortikoidů, imunosupresiv, onkologických léků a širokospektrých antibiotik (10–12). Ve Spojených státech byla incidence infekce způsobená S. apiospermum mezi lety 1993 a 1998 0,82/1 mil. obyvatel; do roku 2005 se zvýšila na 1,33 (4). Od roku 1998 byly popsány tři případy s kožní a podkožní manifestací infekce S. apiospermum u RA. Jeden z těchto pacientů měl sekundární Sjögrenův syndrom a HCV infekci. Všichni byli léčeni glukokortikoidy, jeden v kombinaci s cyklosporinem A. Vedle toho byl pozorován také zajímavý případ protetické infekce po náhradě kyčelního kloubu. Uenotsuchi a spol. popsal infekci S. apiospermum u pacienta se Stillovou chorobou u dospělých, polymyozitidou, po transplantaci ledvin, srdce, u plicní fibrózy, diabetes mellitus, u akutní leukémie, systémové sarkoidózy, renálního selhání a virové hepatitidy. Kromě pacientů s hematologickou malignitou byli nemocní setrvale léčeni glukokortikoidy a/nebo imunosupresivy (13).
Subkutánní forma se histologicky prezentuje ve formě sklerocií nebo bělavých granulí, které u systémových forem obvykle chybí (8). Branou vstupu systémové infekce je obvykle respirační trakt (5). Infekce může vést k artritidě, zánětu středního ucha, endokarditidě, zánětu vedlejších nosních dutin a dalším projevům (9). Masy hyf mohou tvořit „fungus balls“ v plicích (9), i když tyto ohraničené útvary se mohou také tvořit v jiných orgánech. Jsou obvykle vytvořeny z nekrotické tkáně vznikající z nodulárních infarktů a trombózy plicních cév s infekcí (4). Byly rovněž zjištěny infekce kloubů po traumatu, které mohou progredovat do osteomyelitidy. Popsány byly rovněž případy infekce kůže a rohovky (18).
Detekce a diagnostika infekcemi způsobenými S. apiospermum spoléhá na kultivační záchyt a histopatologické vyšetření vzorků tkání nemocných jedinců (4). V případě subkutánní manifestace je relativně specifický obraz podkožních lézí, zatímco systémová forma je klinicky nerozeznatelná od aspergilózy či fusariózy, pokud se nepodaří vykultivovat agens z biologického materiálu. Omezeným vodítkem je přítomnost rizikových faktorů spojených zejména s dlouhodobou a hlubokou imunosupresí, která se typicky projevuje lymfopenií či neutropenií, nápomocné mohou být sérové hladiny albuminu pod 30 g/l a neutropenie (19).
Závěr
S. apiospermum patří mezi typické vyvolavatele subkutánních mykóz, jejichž výskyt je převážně vázaný na subtropické oblasti. V případě imunosuprese pacienta se může rozvinout také závažná systémová infekce. Naše pozorování doplňuje soubor možných infekčních komplikací u pacientů s RA.
Rozvoj diagnostických metod, rozšířená léčba imunosupresivy, imunomodulancii a širokospektrými antibiotiky vedou k zvýšení incidence/prevalence neobvyklých infekcí.
Poděkování patří nelékařským zdravotním pracovníkům účastnícím se na této práci.
Podpořeno projektem Prvouk P37-08 (Karlova univerzita)
Adresa pro korespondenci:
MUDr. Tomáš Soukup, Ph.D.,
2. interní gastroenterologická klinika
Fakultní nemocnice Hradec Králové
Sokolská 581,
500 05 Hradec Králové
tel: 49 583 4761
e-mail: tomas.soukup@fnhk.cz
Zdroje
1. Doran MF, Crowson CS, Pond GR, O'Fallon WM, Gabriel SE. Predictors of infection in rheumatoid arthritis. Arthritis Rheum. 2002; 46 : 2294–300.
2. Hughes LB, Criswell LA, Beasley TM, et al. Genetic risk factors for infection in patients with early rheumatoid arthritis. Genes Immun. 2004; 5 : 641–7.
3. Arnett FC, Edworthy SM, Bloch DA, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum. 1988; 31 : 315–24.
4. Cortez KJ, Roilides E, Quiroz-Telles, F, et al. Infections Caused by Scedosporium spp. Clin Microbiol Rev 2008; 21 : 157–97. doi:10.1128/CMR.00039-07. PMID 18202441.
5. Dolin J, edited by Gerald LM, Bennett JE. Mandell, Douglas, and Bennett's principles and practice of infectious diseases. 5th ed.. Philadelphia: Churchill Livingstone; 2000.
6. Sedláček P. Terapie invazivních mykotických infekcí u imunosuprimovaných pacientů. Onkologie 2008; 2 : 186–90.
7. Ender PT, Dolan MJ. (1997). Pneumonia Associated with Near-Drowning. Clin Infect Dis. 1997; 25 : 896–907. doi:10.1086/515532. PMID 9356805.
8. Prober J, editor, Long S, Charles G, associate editors. Principles and practice of pediatric infectious disease. 4th ed. Edinburgh: Elsevier/Saunders; 2012.
9. de Hoog, GS, Guarro J, Gené J, Figueras MJ. Atlas of Clinical Fungi. 2nd ed. American Society for Mikrobiology; 2000.
10. Kusne S, Ariyanayanagam-Baksh S, Strollo DC, Abernethy J. Invasive Scedosporium apiospermum infection in a heart transplant recipient presenting with multiple skin nodules and a pulmonary consolidation. Transplant Infect Dis 2000; 2 : 194–6.
11. Liu YF, Zhao XD, Ma CL, Li CX, Zhang TS, Liao WJ. Cutaneous infection by Scedosporium apiospermum and its successful treatment with itraconazole. Clin Exp Dermatos 1997; 22 : 198–200.
12. Chaveiro MA, Vieira R, Cardoso J, Afonso A. Cutaneous infection due to Scedosporium apiospermum in an immunosuppressed patient. J Eur Acad Dermatol Venereol 2003; 17 : 47–9.
13. Uenotsuchi T, Moroi Y, Urabe K, et al. Cutaneous Scedosporium apiospermum infection in an immunocompromised patient and a review of the literature. Acta Derm Venereol 2005; 85 : 156-9.
14. Fays S, Di Cesare MP, Antunes A, Truchetlet F. Cutaneous and osteoarticular Scedosporium infection. Ann Med Interne 2002; 153 : 537–9.
15. Chaveiro MA, Vieira R, Cardoso J, Afonso A. Cutaneous infection due to Scedosporium apiospermum in an immunosuppressed patient. J Eur Acad Dermatol Venereol 2003; 17 : 47-9.
16. Ginter G, Petuschnig B, Pierer G, Soyer HP, Reischle S, Kern T, et al. Case report. Atypical cutaneous pseudallescheriosis refractory to antifungal agents. Mycoses 1999; 42 : 507–11.
17. Gottesman-Yekutieli T, Shwartz O, Edelman A, Hendel D, Dan M. Pseudallescheria boydii infection of a prosthetic hip joint--an uncommon infection in a rare location. Am J Med Sci. 2011; 342 : 250–3. doi: 10.1097/MAJ.0b013e31821f9691.
18. Kalkan Akçay E, Açıkgöz ZC, Can ME, Celikbilek N, Dereli Can G, Cağıl N. Fungal keratitis caused by Scedosporium apiospermum: first report from Turkey. Mikrobiyol Bul. 2013; 47 : 727–33.
19. Ajello L, Hay RJ. Topley & Wilson's Microbiology and Infectious Medical Mycology Vol 4. 9th ed. London: Arnold; 1997.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článek Ze života časopisu
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2015 Číslo 2- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
-
Péče o pacienty s nízkotraumatickou zlomeninou horního konce stehenní kosti.
II. Následná osteologická péče.
Doporučený postup České revmatologické společnosti, Společnosti pro metabolická onemocnění skeletu a České společnosti pro ortopedii a traumatologii - Experimentální modely systémové sklerodermie – cesta k poznání a léčbě neléčitelné nemoci?
- Podkožní infekce Scedosporium apiospermum s postižením loketního kloubu u pacienta s revmatoidní artitidou
- Ze života časopisu
-
Péče o pacienty s nízkotraumatickou zlomeninou horního konce stehenní kosti.
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Péče o pacienty s nízkotraumatickou zlomeninou horního konce stehenní kosti.
II. Následná osteologická péče.
Doporučený postup České revmatologické společnosti, Společnosti pro metabolická onemocnění skeletu a České společnosti pro ortopedii a traumatologii - Podkožní infekce Scedosporium apiospermum s postižením loketního kloubu u pacienta s revmatoidní artitidou
- Experimentální modely systémové sklerodermie – cesta k poznání a léčbě neléčitelné nemoci?
- Ze života časopisu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



