-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současné možnosti terapie entezitid
Current treatment options for enthesitis
Enthesitis is one of the basic clinical manifestations of spondyloarthritis. Initially, the pharmacological treatment of enthesitis was limited to local corticosteroid injections or continuous non-steroidal anti-rheumatic therapy, since efficacy of non-biologic DMARDs has never been conclusively proven. Over the past decade, several anti-TNFα agents such as infliximab, etanercept, golimumab or certolizumab have been evaluated in several studies. At the same time, it has been found that T lymphocytes in entheses (i.e. at the site of the attachment of the tendon and the bone) play an important role in the pathogenesis of spondyloarthritis. A major role in the development of spondyloarthritis is played by IL-23 and its receptor, which directly affect Th17 lymphocytes. These can be found in but are not limited to entheses, and produce cytokines such as IL-21, IL-22 and IL-17, which then contribute to the development of four pathological processes in spondyloarthropathies, such as pannus formation in the joints, development of osteitis and joint erosion, bone formation and development of psoriatic plaques. Efficacy in the treatment of enthesitis was demonstrated in ustekinumab, a monoclonal antibody against the p40 subunit of IL-12 and IL-23, as well as secukinumab, a fully human anti-IL-17A antibody. Other agents that have been shown to be effective in treating spondyloarthropathy are apremilast, an inhibitor of phosphodiesterase 4; limited data also exist for tofacitinib, a JAK-3 inhibitor. There are also studies ongoing with other IL-17 inhibitors, and partial results are known for ixekizumab. There is only limited data demonstrating the effect of physiotherapy in the treatment of enthesitis..
Key words:
Enthesitis, spondyloarthritis, anti-TNFα, anti - IL17, secukinumab, apremilast, tofacitinib
Autori: Š. Forejtová; M. Votavová
Pôsobisko autorov: Revmatologický ústav Praha
Vyšlo v časopise: Čes. Revmatol., 25, 2017, No. 3, p. 124-139.
Kategória: Přehledový článek
Súhrn
Entezitidy představují jeden ze základních klinických projevů spondyloartritid. Původně byla farmakologická léčba entezitid limitována na lokální aplikaci kortikoidů nebo kontinuální léčbu nesteroidními antirevmatiky, účinnost u nebiologických DMARDs dosud nikdy nebyla přesvědčivě prokázána. V posledním desetiletí byla v řadě studií ověřena účinnost u několika anti-TNFα preparátů, jako je infliximab, etanercept, golimumab nebo certolizumab. Současně bylo zjištěno, že důležitou úlohu v patogeneze spondyloartritid hrají T lymfocyty nacházející se v entezích, tedy v místě spojení mezi šlachou a kostí. Zásadní roli při rozvoji spondyloartritid pak hraje IL-23 a jeho receptor, které ovlivňují přímo lymfocyty Th17. Tyto se mimo jiné nacházejí právě v entezích a produkují cytokiny IL-21, IL-22 a IL-17, které pak přispívají k vývoji čtyř patologických pochodů u spondyloartropatií, jako je tvorba pannu v kloubu, vývoj osteitidy a erozí v kloubu, vytváření nových kostních formací i vývoj psoriatických plaků. Účinnost v léčbě entezitid pak byla prokázána u ustekinumabu, což je monoklonální protilátka proti podjednotce p40 IL-12 a IL-23, a dále u secukinumabu, což je plně humánní protilátka proti IL-17A. Další agens, u kterých byla prokázána účinnost při léčbě spondyloartropatií, představuje apremilast jako inhibitor fosfodiesteráty 4, limitovaná data má i tofacitinib, což je inhibitor JAK-3. Studie probíhají i u jiných inhibitorů pro IL-17, dílčí výsledky známe pro ixekizumab. Omezená data jsou i pro průkaz efektu fyzioterapie při léčbě entezitid.
Klíčová slova:
Entezitida, spondyloartritida, anti–TNFα, anti - IL17, secukinumab, apremilast, tofacitinibÚvod
Entezitidy patří k jedněm ze základních symptomů, které jsou typické pro celou skupinu spondyloartritid. U některých jedinců s různými typy spondyloartritid může být entezitida dokonce dominujícím příznakem onemocnění, který vede ke značnému funkčnímu omezení a ke snížení kvality života. V posledních letech bylo prokázáno, že enteze, což jsou konkrétně místa spojení mezi šlachou a kostí, hrají jednu z klíčových rolí v patogeneze vzniku spondyloartropatií, dokonce se začalo hovořit o entezi jako o „novém orgánu“.
V entezích se nachází unikátní populace T-lymfoctů, které jsou aktivovány interleukinem-23 (IL-23). Tyto lymfocyty po své aktivaci podporují vznik místního zánětu i kostní remodelaci, a to tvorbou prozánětlivých cytokinů, jako jsou IL-17 a IL-22, které pak dále mají vliv na tvorbu tumor nekrotizujícího faktoru (TNF) (obrázek 1). Následně pak dochází k vývoji čtyř patologických pochodů u spondyloartropatií, jako je tvorba pannu v kloubu, vývoj osteitidy a erozí, vytváření nových kostních formací, a dále u psoriázy vývoj psoriatických plaků (1). Spouštěcím faktorem pro vznik této kaskády může být mimo jiné i mikrotrauma, které vzniká následkem opakovaného biomechanického stresu. Mechanický stres v časném stadiu vyvolává destrukci povrchové chrupavky, následně pak dochází k cévní invazi a k zánětlivé cévní infiltraci, a to převážně makrofágy. Vzniká tak nová mikroanatomická situace, kdy se v těsné blízkosti nachází synoviální tkáň, subchondrální kost a kostní dřeň (2). Na zvířecích modelech bylo prokázáno, že následně dochází k tvorbě nových vaskulárních kanálů, které prochází skrze kost do přilehlého ligamenta, dále k destrukci subchondrální kosti a tvorbě mikrocyst (3). Bylo zjištěno, že vaskulární kanály umožňují vstup zánětlivé tkáně s následnou aktivací osteoklastů. V konečném důsledku pak dochází k tvorbě povrchových ostruh a kostních entezofytů.
Obr. 1. 
Upraveno podle Lories RJ, McInnes IB. Nature Medicine 2012;18:1018–19. Společně s mechanickým stresem hrají svoji úlohu exogenní bakterie, které aktivují imunitní systém, a to především u geneticky predisponovaných jedinců, u kterých hlavní histokompatibilní lokus kóduje produkci antigenu HLA-B27. Současné studie na zvířecích modelech předpokládají, že klíčovou roli při vývoji entezitid hraje autoimunitní proces, který je namířený proti versicanu, fibrokartilaginóznímu proteinu a BMP (bone morphogenetic protein) (2).
Léčba entezitid byla vždy dosti obtížná, neboť naše terapeutické možnosti byly v tomto směru dosud značně omezené. V důsledku nových poznatků o patogeneze vzniku entezitid se nám tak dostává i některých nových terapeutických možností.
Účinnost jednotlivých agens byla hodnocena v randomizovaných, placebem kontrolovaných klinických studiích, ve kterých byly používány různé entezitické indexy (tabulka 1) (4–16), zkušenosti jsou především ve studiích s psoriatickou artritidou (PsA).
Tab. 1. Entezitické indexy sledované v randomizovaných kontrolovaných studií u psoriatické artritidy (dle literatury 4). 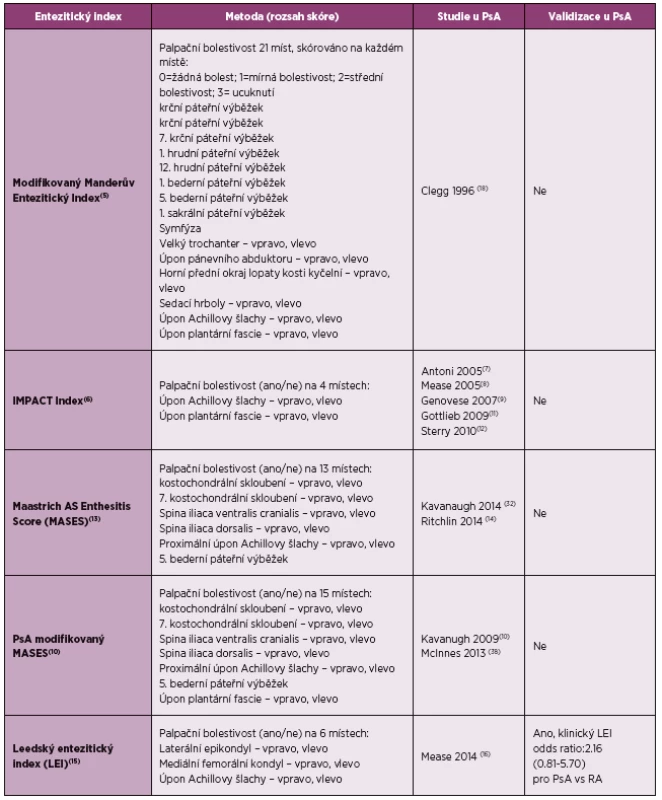
Farmakoterapie
Nesteroidní antirevmatika a konvenční DMARDs
Farmakologické možnosti léčby entezitid byly dlouhá léta velmi omezené. Lékem první volby jsou dosud nesteroidní antirevmatika (NSA), i když evidence založená na důkazech dosud chybí (17). V jedné randomizované klinické studii (tabulka 2) a v jedné malé otevřené studii se sulfasalazinem nebyla prokázána jeho účinnost při léčbě entezitid (18,19). V jediné placebem kontrolované studii, která sledovala účinnost methotrexátu v léčbě PsA, nebyly entezitidy hodnoceny (20). V otevřené fázi klinického hodnocení, kde byl porovnáván methotrexát v monoterapii oproti kombinované léčbě methotrexát + infliximab, nebyl nalezen vliv léčby methotrexátem na redukci daktylitid, zatímco ve skupině léčené kombinovanou léčbou byla průměrná redukce o 2 daktylitidy (p = 0,006). Při hodnocení entezitid nebyl zjištěn signifikantní rozdíl mezi oběma sledovanými skupinami [ve skupině léčené kombinovanou léčbou methotrexát + infliximab po dobu 16 týdnů byla průměrná redukce o 2 entezitická místa, zatímco ve skupině léčené pouze methotrexátem byla průměrná redukce o jedno entezitické místo (p = 0,082)]. Tímto byl nepřímo prokázán jistý efekt methotrexátu při terapii entezitid u PsA (21).
Tab. 2. Efekt léčby entezitid v randomizovaných klinických studiích u psoriatické artritidy (dle literatury 4). 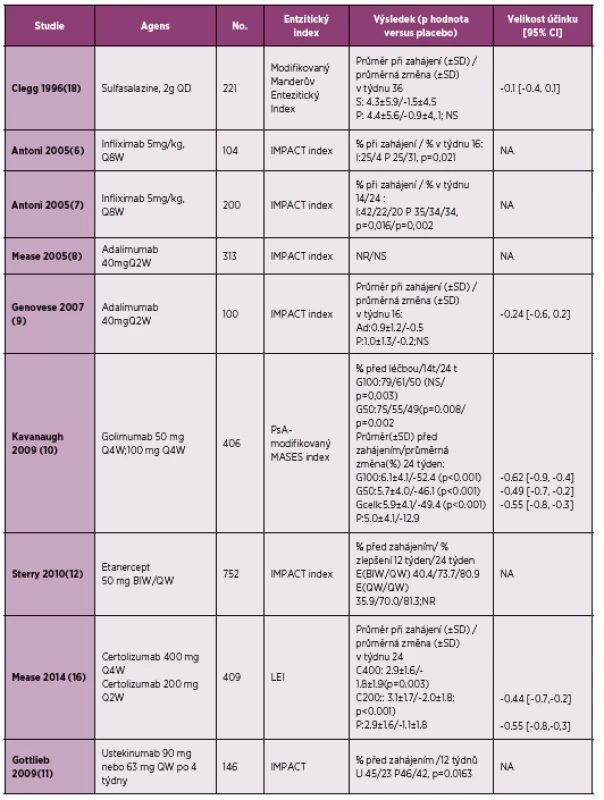
V multicentrické, placebem kontrolované studii, která hodnotila efekt leflunomidu v léčbě PsA, daktylitidy ani entezitidy nebyly sledovány (22). V prospektivní observační studii u 467 pacientů s psoriatickou artritidou leflunomid zlepšil skóre daktylitid po 24 týdnech podávání o 51,2 %, p < 0,001 (hodnoceno na čtyřbodové škále), enteze nebyly ve studii hodnoceny (23). Také v randomizované klinické studii, kde byla hodnocena efektivita kombinované léčby ciclosporinem + methotrexátem (24) v porovnání s monoterapií methotrexátem, nebyla hodnocena účinnost sledované terapie při léčbě entezitid.
Biologická léčba entezitid
Infliximab: Účinnost infliximabu v léčbě entezitid u 70 pacientů s ankylozující spondylitidou byla ověřena již ve 12týdenní studii, kdy byl podáván infliximab v obvyklém režimu v dávce 5 mg/kg. Bylo hodnoceno celkem 12 entezitických oblastí, přičemž byl zjištěn významný pokles počtu aktivních entezitid u pacientů léčených infliximabem v porovnání s placebem (graf 1) (25). Bylo zjištěno, že u pacientů léčených infliximabem došlo po 12 týdnech podávání infliximabu k poklesu průměrného počtu entezitid z 1,7 na 0,7, zatímco ve skupině léčené placebem byl pokles průměrného počtu entezitid z 2.0 na 1,6, p < 0,05.
Graf 1. Ovlivnění entezitid u AS při léčbě infliximabem, 12 týdnů, n=70 
Efekt infliximabu při léčbě entezitid u pacientů s psoriatickou artritidou byl hodnocen ve 2 klinických studiích (IMPACT 1 a 2). V těchto 2 studiích byl při sledování entezitid použit IMPACT index, který hodnotí palpační bolesti v místě úponu Achillovy šlachy a plantární fascie oboustranně. Procento pacientů s entezitidou bylo po léčbě infliximabem signifikantně menší než u pacientů, kteří byli léčeni placebem (14 % vs 31 %, p = 0,021 ve studii IMPACT 1 a 20 % vs 37 %, p = 0,002 ve studii IMPACT 2) (tabulka 2). Ve studiích nebyla podána zpráva o tom, jak došlo k průměrnému poklesu entezitického skóre u sledovaných jedinců (6, 7).
Adalimumab: Ve studii ATLAS u 315 pacientů s ankylozující spondylitidou byl mimo jiné prokázán i vliv adalimumabu na enteze [měřeno pomocí MASES indexu (Maastricht Ankylosing Spondylitis Entesitis Score)]. Během 24týdenního sledování byl u pacientů léčených adalimumabem v týdnu 24 průměrný pokles MASES o 3.0, zatímco po 2 letech podávání byl průměrný pokles o 3.8. V placebové větvi došlo po 24 týdnech k průměrnému poklesu MASES o 0,9 (26). Také v další studii byl sledován efekt adalimumabu u pacientů s ankylozující spondylitidou. Pacienti byli rozděleni do 2 větví podle toho, zda byli nebo nebyli před zahájením studie léčeni biologickou léčbou (infliximab nebo etanercept). V obou větvích byl před zahájením léčby průměrný počet postižených entezí roven 5. Bylo prokázáno, že u pacientů bez předchozí anti-TNFα léčby došlo během 12 týdnů podávání adalimumabu k poklesu počtu postižených entezí (index MASES) průměrně o 3, zatímco ve skupině s předchozí biologickou léčbou byl průměrný pokles roven 2 (27). Také ve studii u 1250 pacientů s ankylozující spondylitidou, u kterých se vyskytovaly současně entezitidy nebo periferní artritidy, došlo po podávání adalimumabu po dobu 12 týdnů k poklesu průměrného entezitického skóre MASES z 5 na 1. Zánět v oblasti úponu plantární fascie vymizel u 122 z celkového počtu 173 pacientů, kteří měli zánět úponu plantární facie před zahájením léčby (28). Účinnost adalimumabu u 165 pacientů s periferní spondyloartritidou bez psoriázy byla ověřena ve studii ABILITY-2. Bylo prokázáno, že průměrná změna entezitického skóre MASES ±SD byla po 12 týdnech podávání adalimumabu rovna -2,8 ± 3,9, zatímco ve skupině léčené placebebem byla změna skóre -1,5 ± 4,0, p = 0,008 (29).
Ve studiích s adalimumabem u pacientů s psoriatickou artritidou byl při hodnocení entezitid používán IMPACT index. Ve studii ADEPT není ve výsledcích uvedeno průměrné skóre (informativní cíl sledování) (8), ve druhé studii nebyla v 16. týdnu studie průměrná změna skóre signifikantně odlišná ve skupině léčené adalimumabem od placebové větve (9).
Golimumab: Také studie s golimumabem u pacientů s ankylozující spondylitidou (GO-RAISE), která hodnotila mimo jiné účinnost různých dávek golimumabu, měla za jeden cíl sledování i vliv na enteze (30). Ve studii byly hodnoceny 3 entezitické indexy: UCSF (University of California San Francisco Score), MASES a Berlin Score, ve kterém bylo sledováno celkem 15 předních a 12 zadních entezitických bodů. Při použití UCSF indexu bylo zjištěno signifikantní zlepšení ve týdnu 14 i 24 při dávce 100 mg s.c. á 4 týdny, zatímco u zbývajících indexů bylo zjištěno signifikantní zlepšení pouze v týdnu 14. Při stanovování velikosti účinku v týdnu 14, 24, a 52 byl efekt hodnocen jako malý nebo střední. UCSF se v této studii jevil jako nejsenzitivnější index, efekt golimumabu byl ovšem hodnocen také jako malý. Studie mimo jiné také prokázala, že hodnocení entezitid může být složitým problémem. Současně bylo zjištěno, že dávka 100 mg á 4 týdny může být vhodnou alternativou pro minoritní skupinu pacientů s AS, případně pro některé jedince s těžko ovlivnitelnými symptomy, jako jsou entezitidy (31).
U pacientů s psoriatickou artritidou byl hodnocen efekt golimumabu ve studii GO-REVEAL (32), kde byl použit PsA-modifikovaný MASES. Rozdíl průměrné změny entezitického indexu ve 24. týdnu podávání byl oproti placebu signifikantní pro dávku golimumabu 50 mg i 100 mg, stejně tak i pro obě dávky golimumabu dohromady (tabulka 3). Ve výsledcích studie GO-REVEAL po 5 letech sledování byl pokles MASES při dávce golimumabu 50 mg 1x za 4 týdny z úvodní hodnoty 5,7 ± 4,0 na 1,9 ± 3,3 a při dávce 100 mg 1x za 4 týdny z 6.1 ± 4,1 na 2,0 ± 3,4, rozdíl nebyl mezi oběma skupinami signifikantní (p = 0,072) (32).
Tab. 3. Hodnoty entezitického skóre před zahájením léčby po 14, 24 a 52 týdnech podávání golimumabu (dle literatury 30). 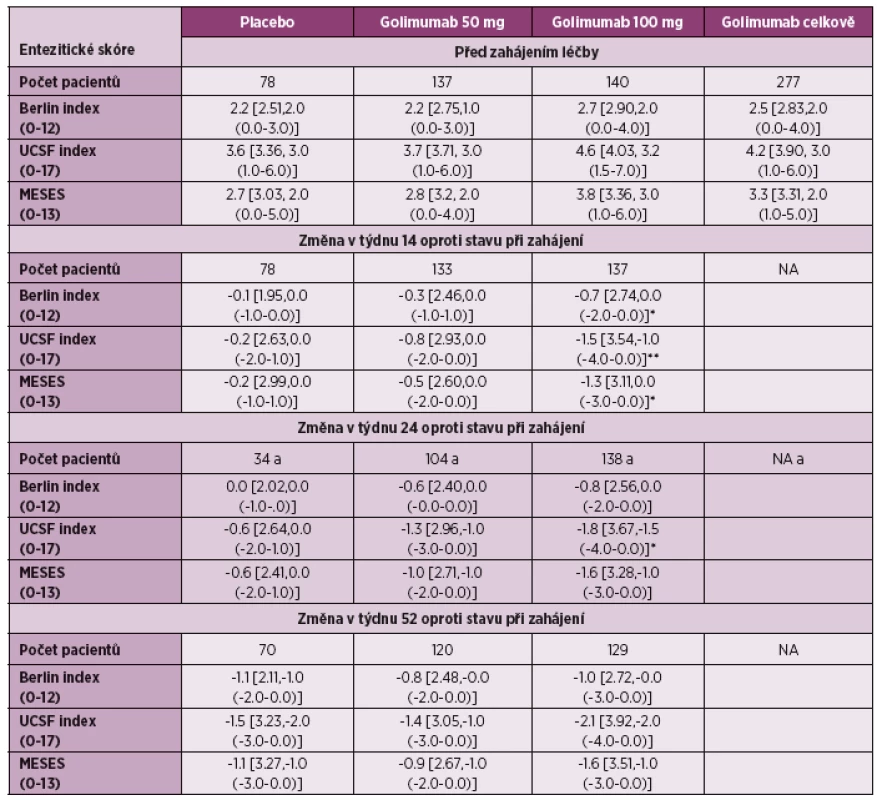
Data jsou prezentovaná jako průměr [SD, median (rozmezí mezi kvartily)] *p < 0,05 vs. placebo, **p < 0,01 vs. placebo a Vyjmutí pacienti, kteří splnili kritéria časné eskalace a změnili léčebný režim Etanercept: Mezi prvními studiemi, které se zabývaly vlivem biologické léčby na entezitidy, byla studie HEEL (34). Jednalo se o dvanáctitýdenní randomizovanou, dvojitě slepou, placebem kontrolovanou studii, která byla provedena u pacientů se spondyloartritidou (splňující Amorova kritéria). Pacienti měli přítomnou entezitidu Achillovy šlachy na MRI a museli být před zařazením léčeni alespoň 3 měsíce plnou dávku nesteroidních antirevmatik. Pacient ve studii byli léčeni etanerceptem v dávce 50 mg lx týdně nebo placebem (v poměru 1 : 1). Hodnocení aktivity entezitid bylo provedeno před zahájením a dále v týdnu 2, 4, 8, 12. Výsledky studie hodnocené dle pacientova globálního hodnocení aktivity (PGA) na vizuální analogové škále ukazují, že je již od 8. týdne jasný signifikantní rozdíl mezi oběma větvemi. Absolutní změna PGA mezi hodnotami před zahájením léčby a týdnem 12 vykazovala signifikantní rozdíl oproti placebu ve prospěch etanerceptu (-37,6 ± 22,0 vs -11,6 ± 22,0, p = 0,007 (graf 2). Absolutní změna MASES indexu mezi hodnotami před zahájením léčby a týdnem 12 se však u pacientů léčených etanerceptem nelišila od placeba (-0,55 ± 1,6 vs 0,13 ± 1,6, p = 0,296).
Graf 2. Studie HEEL: pacientovo globální hodnocení aktivity onemocnění, absolutní změny od začátku léčby v týdnu 2, 4, 8, 12 na VAS (vizuální analogová škála) 
V iniciální studii, která hodnotila účinnost etanerceptu v léčbě PsA, nebyly enteze hodnoceny (35). V observační studii PRESTA, kde byly srovnávány dva různé dávkovací režimy etanerceptu při léčbě PsA, nebyly zjištěny žádné rozdíly v procentu zlepšení entezitického indexu (IMPACT Index) mezi bezi oběma skupinami: 70 % a 80 % pacientů mělo zlepšení entezitického IMPACT indexu v týdnu 12 a 24. Ve studii nebyla srovnávací placebová větev (tabulka 2) (12).
Certolizumab: Ve studii u 409 pacientů s axiální SpA, kam byli zařazeni pacienti a non-radiografickou axiální SpA i ankylozující spondylitidou, nebyl vliv certolizumabu na entezitidy sledován (36, 37).
Ve studii s psoriatickou artritidou (RAPID-PsA) bylo prokázáno signifikantně větší zlepšení LEI (Leeds Enthesitis Index) u pacientů léčených certolizumabem v porovnání sw placebem. Do studie byli zařazeni jednak biologicky naivní pacienti, současně bylo v rámci této studie léčeno i 20 % pacientů, kteří byli před zařazením léčeni v anamnéze anti-TNFα terapií (16). Výsledky ukazuje tabulka 2, kdy bylo prokázáno signifikantní zlepšení po 24 týdnech podávání certolizumabu v dávce 200 mg každé 2 týdny i 400 mg každé 4 týdny.
Ustekinumab: V úvodní studii bylo procento pacientů se zlepšeným entezitickým indexem (IMPACT index) v týdnu 12 signifikantně větší ve skupině, která byla léčená ustekinumabem, než ve skupině léčené placebem (23 % vs 42 %, p = 0,016). Ve studiích P-SUMMIT 1 a 2 (38, 39), kde byly entezitidy hodnoceny pomocí PsA-modifikovaného indexu MASES, bylo signifikantní zlepšení oproti placebové větvi zjištěno pouze ve studii P-SUMMIT 1 pro skupinu léčenou ustekinumabem v dávce 90 mg a pro skupinu, kde byly hodnoceny obě dávky ustekinumabu dohromady. Ve studii P-SUMMIT 1 byla velikost účinku (ES) rovna -0,3 (95% CI – 0,5 až -0,1) ve skupině léčené ustekinumabem v dávce 90 mg, nebyl ovšem signifikantní účinek pro dávku 45 mg [ES = -0,19 (95% CI – 0,4 až 0)]. Pro skupinu, kde byly hodnoceny obě dávky společně, byl ES = -0,25 (95% CI – 0,4 až -0,1). Ve studii P-SUMMIT 2, která zahrnovala především pacienty léčené v minulosti anti-TNFα terapií (>60 %), se velikost účinku nikdy nelišila od 0 [ES byl -0,24 (95% CI – 0,5 až 0,3) ve skupině léčené ustekinumabem v dávce 90 mg, -0,19 (95% CI – 0,5 až 0,1) u pacientů léčených ustekinumabem 45 mg a konečně -0,22 (95% CI – 0,5 až 0,1) u skupiny, kde byly obě dávky hodnoceny společně].
V obou studiích P-SUMMIT bylo v týdnu 24 procento pacientů s entezitidou statisticky významně nižší u pacientů léčených ustekinumabem v porovnání s placebem. Ve studii P-SUMMIT 1 bylo procento pacientů s entezitidou v týdnu 24 následující: 61 % pro ustekinumab 90 mg, 69 % pro ustekinumab 45 mg, 81 % pro placebo, p ustekinumab vs placebo bylo 0,0002, respektive 0,0179. Ve studii P-SUMMIT 2 byl výskyt entezitid v týdnu 24 : 70 % pro ustekinumab 90 mg, 76 % pro ustekinumab 45 mg a 88 % pro placebo, p ustekinumab vs. placebo bylo p < 0,01, respektive p < 0,05.
Secukinumab: Účinnost secukinumabu při léčbě ankylozující spondylitidy byla hodnocena ve studiích MEASURE 1 a 2, v těchto studiích ovšem entezitidy nebyly cílem sledování (40).
Jeho účinnost u pacientů s psoriatickou artritidou byla ověřena ve dvou randomizovaných, dvojitě slepých, placebem kontrolovaných studiích fáze 3 (FUTURE 1) (41) a FUTURE 2 (42). Ve studii FUTURE 1 byla u pacientů léčených secukinumabem v úvodu podávána zaváděcí dávka intravenózního secukinumabu ve výši 10 mg/kg, a to v týdnu 0, 2 a 4, dále pak následovala terapie 75 nebo 150 mg secukinumabu subkutánně každé 4 týdny, 1/3 pacientů byla v úvodu léčena placebem. Ve studii FUTURE 2 dostávali pacienti úvodní dávku 75, 150 nebo 300 mg secukinumabu v týdnu 0, 1, 2 a 3 a nadále pak každé 4 týdny, a to počínaje týdnem 4.
Ve studii FUTURE 1 došlo ve 24. týdnu k vymizení entezitid u 121 z 225 pacientů (47,5 %), zatímco ve skupině léčené placebem došlo k vymizení entezitidy u 15 ze 117 pacientů (12,8 %), p < 0,05. Také ve studii FUTURE 2 byl hodnocen výskyt entezitid, a to u těch pacientů, kde byly entezitidy přítomny před zahájením léčby. K vymizení entezitid došlo u 76 ze 188 pacientů (40 %) ve skupině léčené secukinumabem a u 14 z 65 pacientů (22 %) ve skupině léčené placebem, ES (velikost účinku vs placebo) byla 2,56 (95% CI 1,3, 5,0), p = 0,9195. Účinnost na enteze byla prokázána i po 104 týdnech podávání (graf 3) (43).
Graf 3. Studie FUTURE 2: secukinumab 150 & 300 mg vliv na vymizení entezitid do 104. týdne léčby. 
*P < 0.0001; †P < 0.001; §P < 0.01 vs. placeboP-hodnoty v týdnu 24 adjustované mnohočetným testováním data jsou od subjektů, kteří měli symptomy před zahájením léčby. NRI – non responder imputation MI – multiple imputation Ixekizumab: Ve 24týdenní, dvojitě slepé, placebem a aktivní látkou (adalimumab) kontrolované studii SPIRIT-P1 u pacientů s psoriatickou artritidou byl také mimo jiné hodnocen i vliv na entezitidy, a to za použití LEI (Leeds Entesitis Index) (44). Pacienti byli randomizováni k subkutánní aplikaci placeba (n=106), adalimumabu s.c. á 2 týdny (n = 101), ixekizumabu 80 mg lx za 2 týdny (N = 103) a ixekizumabu 80 mg á 4 týdny (n = 102). Oba dávkovací režimy ixekizumabu zahrnovaly úvodní startovací dávku 160 mg. U pacientů, kteří měli před zahájením léčby přítomnou entezitidu, došlo v porovnání s placebem k signifikantně větší redukci LEI skóre v týdnu 12 pouze při dávce ixekizumabu 80 mg á 2 týdny (p = 0,038). Změna entezitického skóre nedosáhla statistické významnosti (p < 0,025), a to za použití mnohočetné analýzy. V týdnu 24 byla redukce entezitického skóre LEI numericky větší pro obě dávky ixekizumabu v porovnání s placebem (pro ixekizumab l x za 4 týdny byla redukce -1,3, p = 0,151, pro ixekizumab 1x za 2 týdny -1,4, p = 0,099, pro placebo byla redukce -0,8), rozdíl tedy nebyl statisticky významný. Mezi pacienty s LEI > 0 před zahájením léčby došlo při léčbě ixekizumabem ke kompletnímu vymizení všech entezitid (LEI = 0) u signifikantně většího množství pacientů (pro ixekizumab 1x za 4 týdny u 43 % a pro ixekizumab 1x za 2 týdny 39 % jedinců) v porovnání s placebem (19 %), p < 0,05.
Cílená DMARDs
Apremilast: Ve studii s apremilastem byla průměrná změna entezitického skóre MASES v týdnu 24 v porovnání s hodnotami před zahájením léčby statisticky signifikantně větší u pacientů léčených apremilastem v dávce 2x30 mg v porovnání s placebem [ES = - 0,3 (95% CI – 0,5, až 0,1)] (45). Při dávce 2x20 mg nebyly změny entezitického skóre signifikantní. Vliv na entezitidy přetrvával i po 156 týdnech podávání (graf 4 a), jak vyplývá ze studií PALACE 1–3 (45), kde byli léčeni pacienti, u kterých v minulosti selhala léčba alespoň 1 DMARDS, tak i ve studii PALACE 4, kde byli léčeni pacienti, kteří dosud nebyli léčeni DMARDs (graf 4b) (46, 47).
Graf 4a Studie PALACE 1–3: pacienti, kteří dosáhli MASES= 0 za 156 týdnů* 
Graf 4b Studie PALACE 4: pacienti, kteří dosáhli MASES= 0 za 156 týdnů* 
Tofacitinib: V recentně publikované studii byly zveřejněny nové výsledky dvanáctitýdenní studie s tofacitinibem 2, 5 a 10 mg dvakrát denně u pacientů s ankylozující spondylitidou (N = 207). Také v této studii byl sledován subset pacientů s výskytem entezitid v úvodu studie, přičemž u pacientů, kteří byli léčeni tofacitinibem v dávce 5 a 10 mg 2x denně, došlo k signifikantně větší redukci v hodnotě MASES v porovnání s placebem (48).
Lokální léčba glukokortikoidy
Léčba entezitid pomocí lokálně aplikovaných glukokortikoidů (GK) je v praxi běžně praktikována. Existuje ovšem opět velmi málo klinických studií, které by tuto problematiku sledovaly.
Bylo publikováno systematické review a metaanalýza kontrolovaných studií, které se zabývaly problematikou injekcí glukokortikoidů v místě tendinopatií (49). Do analýzy bylo zahrnuto celkem 36 studií provedených u lidí a 13 studií u zvířat. Bylo zjištěno, že v 6 studiích byla prokázána ztráta struktury kolagenu ve tkáních v místě vpichu a ve 3 studiích byla nalezena jeho nekróza. V 8 studiích pak byla zjištěna snížená proliferace fibroblastů a v 9 studiích jejich snížená viabilita. Snížení syntézy kolagenu bylo prokázáno v 17 studiích, ve 4 studiích došlo po injekci glukokortikoidů ke zvýšení infiltrace zánětlivými buňkami. Zvýšení buněčné toxicity bylo demonstrováno ve 3 studiích.
V 18 studiích pak byly hodnoceny mechanické vlastnosti šlach po aplikaci GK. Šest studií zde prokázalo snížení mechanických vlastností, tři prokázaly jejich zvýšení a u devíti studií nebyly zjištěny žádné změny. V metaanalýze dat z devíti studií, které hodnotily mechanické vlastnosti šlach po aplikaci GK, byla zjištěna signifikantní deteriorace těchto vlastností – velikost účinku byla rovna -0,67 (95% CI = 0,01 až -1,33). Autoři metaanalýzy dospívají k názoru, že lokální podávání glukokortikoidů má negativní vliv na buňky šlachy in vitro, včetně jejich viability a proliferace, a dále mají negativní vliv i na syntézu kolagenu. V důsledku toho dochází ke zhoršení mechanických vlastností šlachy. Lokální podávání glukokortikoidů tak může vést k dlouhodobému poškození šlachy. Limitací této studie však byla jednak různorodost glukokortikoidních přípravků, které byly ve studiích sledovány (dexamethazon, triamcinolon, metylprednisolon, hydrocortison a jejich různé kombinace), další nevýhodou byla i heterogenita míst, kam byly glukortikoidy aplikovány (Achillova šlacha, rameno, předloktí, peroneální/patellární šlachy). Diskutabilní je ovšem především to, že se jednalo hlavně o nezánětlivé tendinopatie, nikoliv jen entezopatie, většina tendinopatií měla jiný původ než zánětlivé revmatické onemocnění (17).
V jiné systematické review randomizovaných klinických studií byla hodnocena účinnost a bezpečnost podávání kortikosteroidů do oblasti tendinopatií (50), kdy byl doložen významný pokles bolesti ve srovnání s těmi, kde nebyla injekce aplikována. SMD ± SD (Standardised Mean Difference, Standardised Difference) bolesti byla při krátkodobém hodnocení (0–12 týdnů) rovna 1,44 (95% CI: 1,17 až 1,71), p < 0,0001. Při střednědobém pozorování (13–51 týdnů) byla diference -0,40, (95% CI: -0,67 až -0,14), p < 0,003, a při dlouhodobém pozorování (více než 52 týdnů) byla tato diference -0,31 (95% CI: -0,61 až -0,1) p = 0,05. Z výsledků studie tedy vyplývá, že ze střednědobého i dlouhodobého hlediska je preferováno peritendinózně kortikoidy neaplikovat. Také autoři tohoto review ovšem upozorňují na limitace studie, kdy byly porovnávány různé typy injekcí i různá místa aplikace.
Autoři další přehledové práce o aplikaci kortikoidů do oblasti Achillovy šlachy dospívají k názoru, že dosud riziko aplikace převažuje nad benefitem podávání (51), dle jejich názoru jsou třeba provést další klinická hodnocení k ověření tohoto názoru.
Recentní studie hodnotila ultrazvukem-asistovanou aplikaci GK do retro-kalkaneální burzy u pacientů se spondyloartritidou, kteří trpěli refrakterní tendinitou Achillovy šlachy (52). Byla sledována aplikace 20 mg methylprednisolonu celkem u 27 tendinitid Achillovy šlachy (u 18 pacientů). Pacienti byli hodnoceni před a 6 týdnů po aplikaci. Všichni pacienti udávali snížení bolesti (hodnoceno pomocí VAS-vizuální analogová škála, p < 0,0001), dále došlo ke snížení místních zánětlivých změn: dle ultrazvukového vyšetření byla zjištěna signifikantní redukce ztluštění šlachy (p < 0,0001), vaskularizace (p < 0,0001) a peritendinózního edému (p = 0,0001). Nebyly zjištěny nové kostní změny, jako jsou kostní eroze a entezofyty. Žádný pacient neprodělal rupturu Achillovy šlachy nebo jiné závažné komplikace provázející aplikaci glukokortikoidů. Autoři dospívají k závěru, že ultrazvuk se tak stává důležitým pomocníkem, který zvyšuje bezpečnost i účinnost lokálního podávání glukokortikoidů u pacientů s refrakterní tendinitidou Achillovy šlachy.
Fyzioterapie a entezopatie
Dle dostupné literatury dosud neexistují klinické studie, které by hodnotily efekt fyzikální léčby na entenzopatie u spondyloaritid. Máme zprávy o efektu fyzikální léčby na entezopatie a tendinopatie, kde ve většině případů etiologie jejich vzniku není specifikována, v řadě případů se jedná o tendinopatie vzniklé po úrazu nebo po přetížení. Kvalita studií je také velmi rozdílná, často byly provedeny u velmi malého množství pacientů, kontrola efektu placebem je ve studiích také ojedinělá (53).
V případě entezopatií užíváme léčebnou tělesnou výchovu zaměřenou na úpravu pohybových stereotypů, v indikovaných případech i techniky měkkých tkání. V posledních letech je nedílnou součástí léčby entezopatií i aplikace tejpovacích pásek. Z fyzikální léčby je používána magnetoterapie a elektroléčba, neexistují ovšem studie, které by prokazovaly jejich efekt. Také studie o užití ultrazvuku v léčbě entezitid nepřináší jednoznačné závěry (54, 55).
Existují systematická review, která hodnotí efekt nízkovýkonné laserové terapie (LLLT) u tendinopatií. Původní metaanalýza pro fyzikální intervence u laterální epokondylitidy lokte neprokázala vliv laserové terapie na průběh onemocnění (56). Další systematická review také hodnotila vliv LLLT na laterální tendinopatii lokte (tenisový loket). Analýza celkem 18 placebem-kontrolovaných studií prokázala, že laseroterapie přináší krátkodobou úlevu od bolesti a zlepšení funkčního omezení, a to jednak u pacientů, kteří byli léčeni pouze LLLT, ale i u těch, kde byl současně uplatňován cvičební režim (57).
Tumilty a kolektiv provedli metaanalýzu studií z 8 medicínských databází včetně databáze PEDro (Physiotherapy Evidence Database), která hodnotila vliv LLLT na jakoukoliv tendinopatii. Metodologická kvalita studií byla klasifikovaná jako vysoká (≥6 z desetistupňové škály PEDro ) nebo nízká (<6 na škále PEDro). Celkem pak bylo zahrnuto 21 studií, které splňovaly kritéria zařazení. 12 studií prokázalo pozitivní efekt, 13 studií bylo neprůkazných nebo neprokázalo žádný efekt. Dávky laserové terapie, které byly užívány ve 12 studiích s pozitivní efektem, prokazují jasné terapeutické okno, tyto studie by se tak mohly stát základem nových doporučení pro užití laseru při léčbě tendinopatií. Ve studiích u laterálních epikondylitid, které prokazovaly PEDro skóre ≥6, byla u účastníku po aplikaci LLLT síla stisku o 9,59 kg vyšší v porovnání s kontrolní skupinou. U účastníků s postižením Achillovy šlachy došlo ke snížení bolesti na 100 mm vizuální analogové škále o 13,6 mm (58).
Byly také provedeny randomizované klinické studie, které hodnotily efekt ultrazvukem vedené rázové vlny. K dispozici jsou především studie týkající se terapie plantární fascitidy. Jedna z prvních studií z roku 2002 neprokázala efekt rázové vlny v této oblasti (59). Výsledky multicentrické, randomizované, placebem kontrolované klinické studie naopak prokázaly dobrý účinek aplikace rázové vlny u chronické plantární fascitidy. Primárním cílem bylo sledování snížení bolestivosti v oblasti paty 3 měsíce po aplikaci, sekundárním cílem pak bylo hodnocení bezpečnosti podávání. Bolestivost byla hodnocena jednak nezávislým zaslepeným hodnotitelem pomocí algeziometru, kdy po 3 měsících po aplikaci rázové vlny došlo k redukci bolesti v průměru o 2,51 jednotek (měřeno na desetistupňové stupnici VAS – vizuální analogové škály), zatímco u kontrolní skupiny, která byla léčená placebem, byla redukce bolesti v průměru o 1,57 stupně (p = 0,045). Při subjektivním hodnocení pacientů došlo u ošetřené skupiny k průměrnému snížení bolesti o 3,39 jednotek na VAS, u placebové skupiny to bylo průměrně o 1,78 jednotek, p < 0,01. Ani po roce sledování po aplikaci nebyly pozorovány žádné závažné nežádoucí účinky po aplikaci (60).
Doporučení pro léčbu entezitid
V roce 2016 byla publikována dvoje doporučení pro léčbu PsA, a to jednak doporučení mezinárodní organizace EULAR (European League Against Rheumatism) a dále doporučení skupiny GRAPPA (Group for Research and Assessment of Psoriasis and Psoriatic Arthritis). Tato doporučení se částečně liší (obr. 2), přičemž rozdíly v pohledu jsou dány především rozdílem v zastoupení členů jednotlivých skupin. Zatímco do doporučení EULAR se promítá převážně pohled revmatologů, ve skupině GRAPPA je balancováno mezi pohledem dermatologů a revmatologů (61, 62). V publikaci skupiny GRAPPA z roku 2016 jsou doporučení pro jednotlivé léčivé přípravky rozděleny do několika skupin. Tzv. silná doporučení jsou založená na výsledcích randomizovaných klinických studií. Silná doporučení pro léčbu entezitid u PsA platí pro protilátky anti-TNFα a dále pro blokátory IL12/23. Podmínečná doporučení, kdy důkazy jsou založeny pouze na výsledcích malých otevřených studií, přičemž výsledky jsou publikovány pouze ve formě abstrakt, platí při léčbě entezitid pro NSA, fyzioterapii, lokální aplikace kortikosteroidů (a to se zvláštním upozorněním na to, že aplikace glukokortikoidů do místa nosných entezí může vést ke vzniku ruptury šlachy), dále inhibitory fosfodieasterázy PDE-4i a inhibitory IL-17 (Coates). Nejsou doporučení pro léčbu entezitid pomocí DMARDs, a to z důvodu nedostatečných důkazů o jejich účinnosti.
Obr. 2. Zjednodušené EULAR a GRAPPA algoritmy pro léčbu převážně entezitické formy PsA (dle literatury 61) 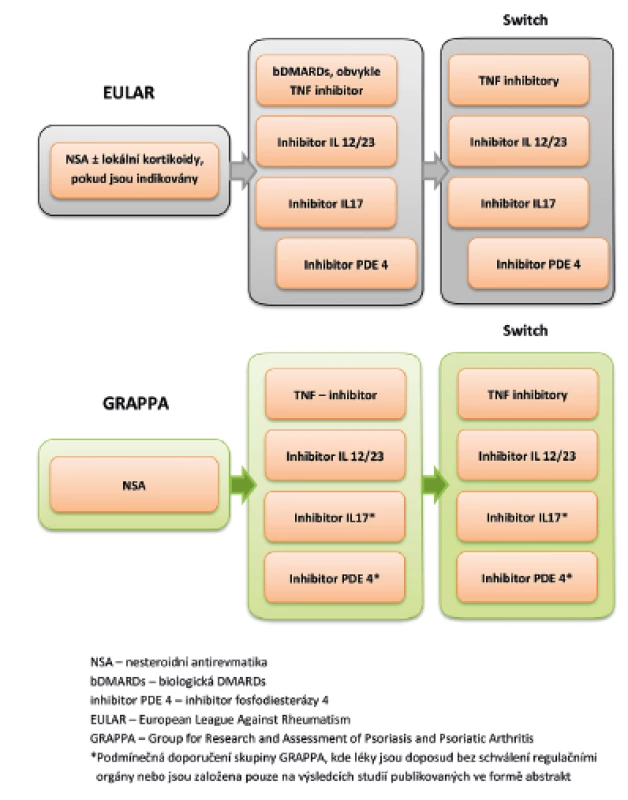
Nejnovější doporučení EULAR pro léčbu PsA se zabývají v jednom z 10 bodů i léčbou entezitid a daktylitid. U pacientů s aktivní entezitidou a s nedostatečnou odpovědí na NSA a lokální léčbu kortikoidy je indikováno podávání biologické léčby, dle dnešní praxe se doporučuje podávat TNF-inhibitory. Vzhledem k nedostatečným důkazům o efektivitě DMARDs v léčbě entezitid není v tomto případě nutné před zahájením biologické léčby podávat DMARDs (63, 64).
Také ACR (American College of Rheumatology) v loňském roce publikovala doporučení pro léčbu AS a nonradiografickou axiální spondyloartritidu (65, 66). U pacientů se stabilním axiálním postižením a dominujícími entezitidami navzdory léčbě NSA se podmínečně doporučuje lokální aplikace glukokortikoidů. Peritendinózní injekce k Achillově šlaše, ke šlaše pately a kvadricepsu se ovšem nedoporučuje, a to vzhledem k nebezpečí vzniku ruptury. Aplikaci do ostatních lokalit, jako je velký trochanter, pánevní pletenec, plantární fascie atd., je třeba zvažovat, a to na základě zhodnocení tíže symptomů, preference pacientů, možnostech biologické léčby nebo cílených DMARDs. Naopak v recentně publikovaných doporučeních ASAS/EULAR pro léčbu axiální spondyloartritidy nejsou speciální doporučení pro léčbu entezitid specifikována (67–69). Stejně tak v nově provedené systematické review literatury, týkající nefarmakologické léčby u pacientů s axiální SpA, byl v souladu s předchozími zprávami zjištěn pouze vliv pravidelného cvičení a edukace, nicméně neexistují z logických důvodů randomizované klinické studie, které by vliv cvičení a fyzioterapie prokázaly (53).
V letošním roce byla publikována i zpráva z pracovního semináře skupiny GRAPPA – OMERACT (Outcome Measures in Rheumatology), zabývající se PsA. Bylo zjištěno, že entezitidy byly sledovány pouze u necelých 60 % randomizovaných klinických studií a zhruba 45 % longitudinálních observačních studií (70). U axiální SpA jsou údaje v klinických studiích o vlivu léčby na entezitidy ještě méně časté. Nové poznatky o roli entezí v patogeneze spondyloartritid s sebou ovšem přináší i nové terapeutické možnosti těchto onemocnění. Entezitidy se tak stávají novým předmětem zájmu při vývoji nových léků pro terapii spondyloartritid. Lze proto předpokládat, že v následujících letech budeme mít i širší přehled o jejich účinnosti, a budeme tak moci naše pacienty s entezitidami i rychleji a účinněji léčit.
Poděkování:
Práce vznikla za podpory projektu 00023728 Ministerstva zdravotnictví ČR
adresa pro korespondenci:
MUDr. Šárka Forejtová
Revmatologický ústav,
Revmatologická klinika 1. LF UK
Na Slupi 4
128 50 Praha 2
e-mail: forejtova@revma.cz
Zdroje
1. Lories RJ, McInnes IB. Primed for inflammation: enthesis-resident T cells. Nature Medicine 2012; 7 : 1018–9.
2. Kehl AS, Corr M, Weisman MH. Entezitis. New insights into pathogenesis, diagnostic modalities and treatment. Arthritis Rheum 2016; 68 : 312–322.
3. Van Duivenvoorde LM, Dorris LM, Satumtira N, van Tok MN, Redlich K, Tak PP, et al. Relationship between inflammation, bone destruction, and osteoproliferation in the HLA-B27/human β2-mikroglobulin-transgenic rat model in spondyloarthritis. Arthritis Rheum 2012; 64 : 3210–9.
4. Orbai AM, Weitz J, Siegel EL, Siebert S, Savage LJ, et al. Systemic Review of Treatment Effectiveness and Outcome Measures for Enthesitis in Psoriatic Arthritis. J Rheumatol 2014; 41 : 2290–4.
5. Mander M, Simpson JM, Mc Lellan A, Walker D, Goodacre JA, Dick WC. Studies with an enthesitis index as a method of clinical assessment in ankylosing spondylitis. Ann Rheum Dis 1987; 46 : 197–202.
6. Antoni CE, Kavanaugh A, Kirkham B, Tunucu Z, Burmester GT, et al. Sustained benefits of infliximab therapy for dermatological and articular manifestation of psoriatic arthritis: Results from the Infliximab Multinational Psoriatic Arthritis Controlled Trial (IMPACT). Arthritis Rheum 2005; 52 : 1227–36.
7. Antoni CE, Krueger GG, de Vlam K, Birbara C, Beutler A, et al. Infliximab improves signs and symptoms of psoriatic arthritis. Results of the IMPACT 2 trial. Ann Rheum Dis 2005; 64 : 1150–7.
8. Mease PJ, Gladman DD, Ritchlin CT, Ruderman EM, Steinfeld SD, et al. Adalimumab for the treatment of patients with moderately to severely active psoriatic arthritis: Results of a double–blind, randomise, placebo-controlled trial. Arthritis Rheum 2005; 52 : 3279–89.
9. Genovese MC, Mease PJ, Thomson GT, Kivitz AJ, Perdok RJ, et al. Safety and efficacy of adalimumab in treatment of patients with psoriatic arthritis who had failed disease modifying antirheumatic drug therapy. J Rheumatol 2007; 34 : 1040–50.
10. Kavanaugh A, McInnes I, Mease P, Krueger GG, Gladman D, et al. Golimumab, a new human tumour necrosis factor antibody, administered every four weeks as a subcutaneous injection in psoriatic arthritis.: Twenty-four-week efficacy and safety results of a randomised, placebo–controlled study. Arthritis Rheum 2009; 60 : 976–86.
11. Gottlieb A, Menter A, Mendelsohn A, Shen YK, Li S, et al. Ustekinumab, a human interleukin 12/23 monoclonal antibody for psoriatic arthritis: Randomised, double–blind, placebo-controlled crossover trial. Lancet 2009; 373 : 633–40.
12. Sterry W, Ortonne JP, Kirkham B, Brocq O, Robertson D, et al. Comparison of two etanercept regimens for treatment of psoriasis and psoriatic arthritis: PRESTA randomised double blind multicentre trial. BMJ 2010; 340: c147.
13. Heuft–Dorenbosch L, Spoorenberg A, van Tubergen A, Landewe E, van ver Tempel H, et al. Assessment of enthesitis in ankylosing spondylitis. Ann Rheum Dis 2003; 62 : 127–32.
14. Ritchlin C, Rahman P, Kavanugh A, McInnes IB, Puig L, et al.Efficacy and safety of the anti–IL12/23 p40 monoclonal antibody, ustekinumab, in patients with active psoriatic arthritis despite conventional non-biological and biological anti-tumour necrosis factor therapy: 6-month and 1-year results of the phase 3, multicentre, double–blind, placebo–controlled, randomised PSUMMIT 2 trial. Ann Rheum Dis 2014; 73 : 990–9.
15. Healy PJ, Heliwell PS. Measuring clinical enthesitis in psoriatic arthritis.: Assessment of existing measures and development of an instrument specific to psoriatic arthritis. Arthritis Rheum 2008; 59 : 686–91.
16. Mease PJ, Fleischmann R, Deodhar AA, Wollenhaupt J, Khraishi M, et al. Effect of certolizumab pegol on signs and symptoms in patients with psoriatic arthritis: 24-week results of a Phase-3 double-blind randomised placebo-controlled study (RAPID-PsA). Ann Rheum Dis 2014; 73 : 48–55.
17. Sakkas LI, Alexiou I, Simopoulou T, Vlychou M. Enthesitis in psoriatic arthritis. Semin Arthritis Rheum 2013; 43 : 325–34.
18. Clegg DO, Reda DJ, Mejias E, Cannon GW, Taylor T, et al. Comparison of sulfasalazine and placebo in the treatment of psoriatic arthritis. A Department of Veterans Affairs Comparative Study. Arthritis Rheum 1996 : 39 : 2013–20.
19. Kumar N, Kay IJ, Walker DJ. The treatment of enthesitis in psoriatic arthritis. J Rheumatol 2004; 31 : 2311–2.
20. Kingsley GH, Kowalczyk A, Taylor H, Ibrahim F, Packham JC, et al. A randomized placebo controlled trial of methotrexate in psoriatic arthritis. Rheumatology 2012; 51 : 1368–77.
21. Baranauskaite A, Raffayová H, Kungurov NV, Kubanova A, Venalis A, et al. Infliximab plus methotrexate is superior to methotrexate alone in the treatment of psoriatic arthritis: the RESPOND study. Ann Rheum Dis 2012; 71 : 541–8.
22. Kaltwasser JP, Nash P, Gladman D, Rosen CF, Behrens F, et al. Efficacy and Safety od Leflunomide in the Treatment of Psoriatic Arthritis and Psoriasis. Arthritis Rheum 2004; 50 : 1939–50.
23. Behrens F, Finkenwirth C, Pavelka K, Stolfa J, Sipek – Dolnicar T, et al. Leflunomid in psoriatic arthritis: results from a large European prospective observational study. Arthritis Care Res (Hoboken) 2012; 65 : 464–70.
24. Fraser AD, van Kuijk AW, Westhovens R, Karim Z, Wakefield R, et al. A randomised, double blind, placebo controlled, multicentre trial of combination therapy with methotrexate plus ciclosporin in patients with active psoriatic arthritis. Ann Rheum Dis 2005; 64 : 859–64.
25. Braun J, Brandt J, Listing J, Zink A, Alten RG, et al. Treatment of active ankylosing spondylitis with infliximab: a randomised controlled multicentre trial. Lancet 2002; 359 : 1187–93.
26. Van der Heijde D, Schiff MH, Sieper J, Kivitz AJ, Wong RL, et al. Adalimumab effectiveness for the treatment of ankylosing spondylitis is maintained for up to 2 years: long-term results from the ATLAS trial. Ann Rheum Dis 2009; 68 : 922–9.
27. Rudwaleit M, Van Den Bosch F, Kron M, Kary S, Kupper H. Effectiveness and safety of adalimumab in patients with ankylosing spondylitis or psoriatic arthritis and history of anti-tumor necrosis factor therapy. Arthritis Research&Therapy 2010; 12: R117.
28. Rudwaleit M, Claudepierre P, Kron M, Kary S, Wong R, Kupper H. Effectiveness of adalimumab in patients with ankylosing spondylitis associated with enthesitis and peripheral arthritis. Arthritis Research &Therapy 2010; 12: R43.
29. Mease P, Sieper J, Van den Bosch F, Rahman P, Karunaratne PM, et al. Randomized Controlled Trial of Adalimumab in Patients with Nonpsoriatic Peripheral Spondyloarthritis. Arthritis Rheum 2015; 67 : 914–23.
30. Van der Heijde D, Braun J, Deodhar A, Inman RD, Xu S, et al.Comparison of three enthesitis indices in a multicentre, randomized, placebo-controlled trial of golimumab in ankylosing spondylitis (GO–RAISE). Rheumatology 2013; 52 : 321–5.
31. Braun J, Baraliakos X, Heldmann F, Kiltz U. Tumour necrosis factor alpha antagonist in the treatment of axial spondyloarthritis. Expert Opi Investig Drugs 2014; 23 : 647–59.
32. Kavanaugh A, Mease IP. Treatment of psoriatic arthritis with tumour necrosis factor inhibitors: Long-term outcomes including enthesitis and dactylitis with golimumab treatment in the long-term extension of a randomised, placebo-controlled study (GO-REVEAL). J Rheumatol (Suppl) 2012; 89 : 90–3.
33. Kavanaugh A, Mc Innes IB, Mease P, Krueger GG, Glademan D,et al. Clinical efficacy, radiographic and safety findings through 5 years of subcutaneous golimumab treatment in patients with active psoriatic arthritis: result from a long–term extension of randomised, placebo controlled trial (GO–REVEAL study). Ann Rheum Dis 2014; 73 : 1689–94.
34. Dougados M, Combe B, Braun J, Landewé R, Sibilia J, et al. A randomised, multicentre, double–blind, placebo-controlled trial of etanercept in adults with refractory heel enthesitis in spondyloarthritis: the HEEL trial. Ann Rheum Dis 2010; 69 : 1430–5.
35. Mease PJ, Goffe BS, Metz J, van der Stoep A, Finck B, et al. Etanercept in the treatment of psoriatic arthritis and psoriasis. A randomised trial. Lancet 2000; 356 : 385–90.
36. Landewe R, Braun J, Deodhar S, Dougados M, Maksymowych WP, et al. Efficacy of certolizumab pegol on signs and symptoms of axial spondyloarthritis including ankylosing spondylitis: 24-week results of a double-blind randomised placebo-controlled Phase 3 study. Ann Rheum Dis 2014; 73 : 39–47.
37. Sieper J, Landewe R, Rudwaleit M, van der Heijde D, Dougados M, et al. Effect of certolizumab pegol over ninety-six weeks in patients with axial spondyloarthritis. Arthritis Rheum 2015; 67 : 668–77.
38. McInnes IP, Kavanaugh A, Gottlieb AB, Puig L, Rahman P, et al. Efficacy and safety of ustekinumabin patients with active psoriatic arthritis: I year results of phase 3, multicentre, double-blind, placebo-controlled PSUMMIT 1 trial. Lancet 2013; 382 : 780–9.
39. Ritchlin C, Rahman P, Kavanaugh A, McInnes IB, Puig L, et al. Efficacy and safety of the anti–IL 22/23 p40 monoclonal antibody, ustekinumab, in patients with active psoriatic arthritis despite conventional non-biological and biological anti-tumour necrosis therapy: 6-month a 1-year results of the phase 3, multicentre, double–blind, placebo-controlled, randomised PSUMMIT 2 trial. Ann Rheum Dis 2014; 73 : 990–9.
40. Baeten D, Sieper J, Braun J, Baraliakos X, Dougados M, et al. Secukinumab, an Interleukin-17A Inhibitor, in Ankylosing Spondylitis. N Engl J Med 2015. 373 : 2534–48.
41. Mease PJ, McInnes IB, Kirkham B, Kavanaugh A, Rahman P et al. Secukinumab Inhibition of Interleukin-17A in Patients with Psoriatic Arthritis. N Engl J Med 2015. 373 : 1329–39.
42. McInnes I, Mease PJ, Kirkham B,Kavanaugh A, Ritchlin CT, et al. Secukinumab, a human anti–interleukin–17A monoclonal antibody, in patients with psoriatic arthritis (FUTURE 2): a randomised, double–blind, placebo-controlled, phase 3 trial. Lancet 2015; 386 : 1137–46.
43. McInnes IB, Mease PJ, Ritchlin CT, Rahman P, Gottlieb AB, et al. Secukinumab provides sustained improvements in the signs and symptoms of active psoriatic arthritis: 104 weeks results from a phase 3 trial. Arthritis Rheum 2016; 68 (suppl 10), abstract 2757.
44. Mease PJ, van der Heijde D, Ritchlin CT, Okada M, Cuchacovich RS, et al. Ixekizumab, an interleukin-17A specific monoclonal antibody, for the treatment of biologic–naive patients with active psoriatic arthritis: results from the 24-–week randomised, double-blind, placebo-controlled period of the phase III trial SPIRIT-P1. Ann Rheum Dis 2017; 76 : 79–87.
45. Kavanaugh K, Mease PJ, Gomez–Reino JJ, Adebajo AO, Wollenhaupt J, et al. Treatment of psoriatic arthritis in phase 3 randomised, place-controlled trial with apremilast, an oral phosphodiesterase 4 inhibitor. Ann Rheum Dis 2014; 73 : 1020–6.
46. Gladman D, Kavanaugh A, Gomez–Reino J, Wollenhaupt J, Cutolo M, et al. Apremilast treatment and long-term(156-week) improvements in enthesitis and dactylitis in patients with psoriatic arthritis: pooled analysis of a large database of 3 phase III, randomized, controlled trials. Arthritis Rheum 2016; 68 (suppl 10), abstract 1711.
47. Wells AF; Edwards CJ, Kivitz AJ, Bird P, Nguyen D, et al.Apremilast monotherapy as the first systemic treatment in DMARD-naive patients with psoriatic arthritis: 3-year treatment results. Arthritis Rheum 2016; 68 (suppl 10), abstract 1680.
48. van der Heijde D, Deodhar A, Wei JC, Drescher E, Fleishaker D, et al. Tofacitinib in patients with ankylosing spondylitis: a phase II, 16–week, randomised, placebo-controlled, dose-ranging study. Ann Rheum Dis 2017; 0 : 1–8.
49. Dean BJ, Lostis E, Oakley T, Rombach I, Morrey ME, Carr AJ The risks and benefits of glucocorticoid treatment for tendinopathy: a systematic review of the effects of local glucocorticoid on tendon. Semin Arthritis Rheum. 2014; 43 : 570–6.
50. Coombes BK, Bisset L, Vincenzino B. Efficacy and safety of corticosteroid injections and other injections for management of tendinopathy: a systemic review of randomized controlled trials. Lancet 2010; 376 : 151–67.
51. Metcalfe D, Achten J, Costa ML. Glucocorticoid injections in lesions of the Achilles tendon. Foot Ankle Int 2009; 30 : 661–5.
52. Srivastava P, Aggarwal A. Ultrasound-guided retro-calcaneal bursa corticosteroid injection for refractory Achilles tendinitis in patients with seronegative spondyloartropathy: efficacy and follow-up study. Rheumatol Int 2016; 36 : 875–80.
53. Regel A, Sepriano A, Baraliakos X, van der Heijde D, Braun J, et al. Efficacy and safety of non–pharmacological and non-biological pharmacological treatment: a systematic literature review informing the 2016 update of the ASAS/EULAR recommendations for the management of axial spondyloarthritis. RMD Open 2017, publikováno on-line.
54. Krukowska J, Wrona J, Sienkiewicz M, Czernicki J. A comparative analysis of analgesic efficacy of ultrasound and shock wave therapy in the treatment of patients with inflammation of the attachment of the plantar fascia in the course of calcaneal spurs. Arch Orthop Trauma Surg. 2016; 136 : 1289–96.
55. Murtezani A, Ibraimi Z, Vllasolli TO, Sllamniku S, Krasniqi S, Vokrri L. Exercise and Therapeutic Ultrasound Compared with Corticosteroid Injection for Chronic Lateral Epicondylitis: A Randomized Controlled Trial. Ortop Traumatol Rehabil 2015; 17 : 351–7.
56. Bisset L, Paungmali A, Vicenzino B, Beller E. A systemic review for lateral epicondylagia. Br J Sports Med 2005; 39 : 411–22.
57. Bjordal JM, Lopes–Martins R, Joensen J, Couppe Ch, Ljunggren AE, et al. A systemic review with procedural assessments and meta-analysis of Low Level Laser Therapy in lateral elbow tendinopathy (tennis elbow). BMS Musculoskeletal Disorders 2008; 9 : 1–15.
58. Tumilty S, Munn J, McDonough S, Hurley DA, Basford JR, Baxter GD. Low laser treatment of tendinopathy: a systemic review with misanalysis. Photomed Laser Surg 2010; 28 : 3–16.
59. Buchbinder R, Ptasznik R, Gordon J, Buchanan J, Prabaharan V, Forbes A. Ultrasound – Guided Extracorporeal Shock Wave Therapy for Plantar fasciitis. JAMA 2002; 288 : 1364–72.
60. Maley DS, Pressman MM, Assili A, Kline JT. York Shane Extracorporeal shockwave therapy versus placebo for the treatment of chronic proximal plantar fasciitis: results of a randomized, placebo-controlled, double blinded, multicenter intervention trial. Foot; &Ankle Surgery 2006; 45 : 196–210.
61. Gossec L, Coates LC, de Wit M, Kavanaugh A, Ramiro S, et al. Management of psoriatic arthritis in 2016: a comparison of EULAR and GRAPPA recommendations. Nat Rev Rheumatol. 2016; 12 : 743–50.
62. Coates LC, Kavanaugh A, Mease PJ, Soriano ER, Acosta-Felquer ML, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 treatment recommendations for Psoriatic Arthritis. Arthritis Rheum 2016; 68 : 1060–71.
63. Gossec L, Smolen JS, Ramiro S, de Vit M, Cutolo M, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016; 75 : 499–510.
64. Ramiro S, Smolen JS, Landewé R, van der Heijde D, Dougados M, et al. Pharmacological treatment of psoriatic arthritis: a systemic literature review for the 2015 update of the EULAR recommendations for the management of psoriatic arthritis. Ann Rheum Dis 2016; 75 : 490–8.
65. Ward MW, Deodhar A, Akl EA, Lui A, Ermann J, et al. American College of Rheumatology/Spondylitis Association of America/Spondyloarthritis Research and Treatment Network 2015 Recommendation for the Treatment of Ankylosing Spondylitis and Nonradiographic Axial Spondyloarthritis. Arthritis Rheum 2016; 68 : 282–98.
66. Taylor WJ, St. Clair EW. Shifting the goal post: treatment recommendations for ankylosing spondylitis and the newly defined condition of nonradiographic axial spondyloarthritis. Arthritis Rheum 2016; 68 : 265–9.
67. van der Heijde D, Ramiro S, Landewé R, Baraliakos X, Van den Bosch F, et al. 2016 update of the ASAS–EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017, publikováno on-line.
68. Sepriano A, Regel A, van der Heijde D, Braun J, Baraliakos X, et al. Efficacy and safety of biological and targeted–synthetic DMARDs: a systematic literature review informing the 2016 update of the ASAS/EULAR recommendations for the management of axial spondyloarthritis. RMD Open 2017, publikováno on-line.
69. Osman MS, Maksymowych WP. An update of the use of tumour necrosis factor alpha inhibitors in the treatment of ankylosing spondylitis. Expert Rev Clin Immunol. 2017; 13 : 125–31.
70. Orbai AM, de Wit M, Mease PJ, Callis Duffin K, Elmamoun M, et al. Updating the Psoriatic Arthritis (PsA) Core Domain Set: A Report from the PsA Workshop at OMERACT 2016. J Rheumatol. 2017, publikováno on-line.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2017 Číslo 3- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Výhody subkutánně podávaného methotrexátu
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
Najčítanejšie v tomto čísle- Současné možnosti terapie entezitid
- Vzdelávání všeobecných sester
- Nástin genetické architektury primární hyperurikémie a dny
- Kardiovaskulární komorbidity a ateroskleróza u systémového lupus erythematodes
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




