-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Hemostatické účinky oxidované celulosy
Hemostatic effects of oxidized cellulose
Oxidized cellulose ranks among nontoxic and biocompatible biopolymers. Oxidized regenerated cellulose (ORC) is manufactured from regenerated cellulose derived from wood pulp containing about 50% of cellulose. To obtain purified cellulose, it is necessary to decompose it in a chemical way and subsequently put it together to make “regenerated” cellulose. Thanks to its good hemostatic effects, high biosolubility and biodegradability, antioxidant and wound-healing properties, oxidized cellulose represents a suitable means for the therapy of bleeding conditions in various fields of medicine. In addition, the confirmed bactericidal effects of oxidized cellulose towards a wide spectrum of aerobic and anaerobic pathogens increase the therapeutic potential of this agent for use in clinical practice. At present there is a renewed interest in its wider use in clinical practice and in an improvement of the knowledge of its mechanisms of effects, which are tested in vitro, on animal models as well as in clinical studies. The present paper attempts to summarize the hitherto knowledge of hemostatic properties of oxidized cellulose and also to characterize other possible biological effects.
Key words:
oxidized cellulose – ORC – hemostatic agent – bleeding
Autoři: P. Kollár 1; P. Suchý 1; J. Muselík 2; Marika Bajerová 2
; P. Havelka 3; T. Sopuch 4
Působiště autorů: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav humánní farmakologie a toxikologie 1; Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků 2; Výzkumný ústav organických syntéz a. s., Pardubice 3; Synthesia, a. s., Pardubice – Semtín 4
Vyšlo v časopise: Čes. slov. Farm., 2008; 57, 11-16
Kategorie: Přehledy a odborná sdělení
Souhrn
Oxidovaná celulosa patří mezi netoxické a biokompatibilní biopolymery. Oxidovaná regenerovaná celulosa (ORC) se vyrábí z regenerované celulosy původem z dřevní buničiny, obsahující okolo 50 % celulosy. Pro dosažení čištěné celulosy je potřeba ji chemicky rozložit a následně spojit v „regenerovanou“ celulosu. Díky svým dobrým hemostatickým účinkům, vysoké biosolubilitě a biodegradabilitě, antioxidačním a rány-hojícím vlastnostem představuje oxidovaná celulosa vhodný prostředek při terapii krvácivých stavů v různých oblastech medicíny. Navíc, potvrzené baktericidní účinky oxidované celulosy vůči širokému spektru aerobních i anaerobních patogenů zvyšují terapeutický profil této látky pro použití v klinické praxi. V současnosti dochází k novému zájmu o její širší využití v klinické praxi a k prohlubování znalostí o mechanismech účinků, které jsou testovány in vitro, na zvířecích modelech i v klinických studiích s humánními subjekty hodnocení. Tato práce si klade za cíl shrnout dosavadní poznatky o hemostatických vlastnostech oxidované celulosy a charakterizovat také její další biologické účinky.
Klíčová slova:
oxidovaná celulosa – ORC – hemostatikum – krváceníV případě krvácení je přirozená hemostáza zajištěna prostřednictvím vaskulární kontrakce, krevními destičkami a koagulačními faktory. V situacích, kdy není možné čekat na spuštění fyziologických hemostatických procesů (zranění, operační výkony apod.), je potřeba použít aditivní metody pro dosažení stabilní krevní sraženiny. Vedle tepelné a mechanické metody hemostázy zde patří také použití chemických přípravků, resp. materiálů 1). Za posledních 50 let se prakticky nezměnily nejběžněji používané materiály pro lokální zástavu krvácení v chirurgii. Jsou to především fibrin, trombin, želatinová pěna, mikrofibrilární kolagen, kostní vosk (směs včelího vosku – 70 % a vazelíny – 30 %) a celulosa 2).
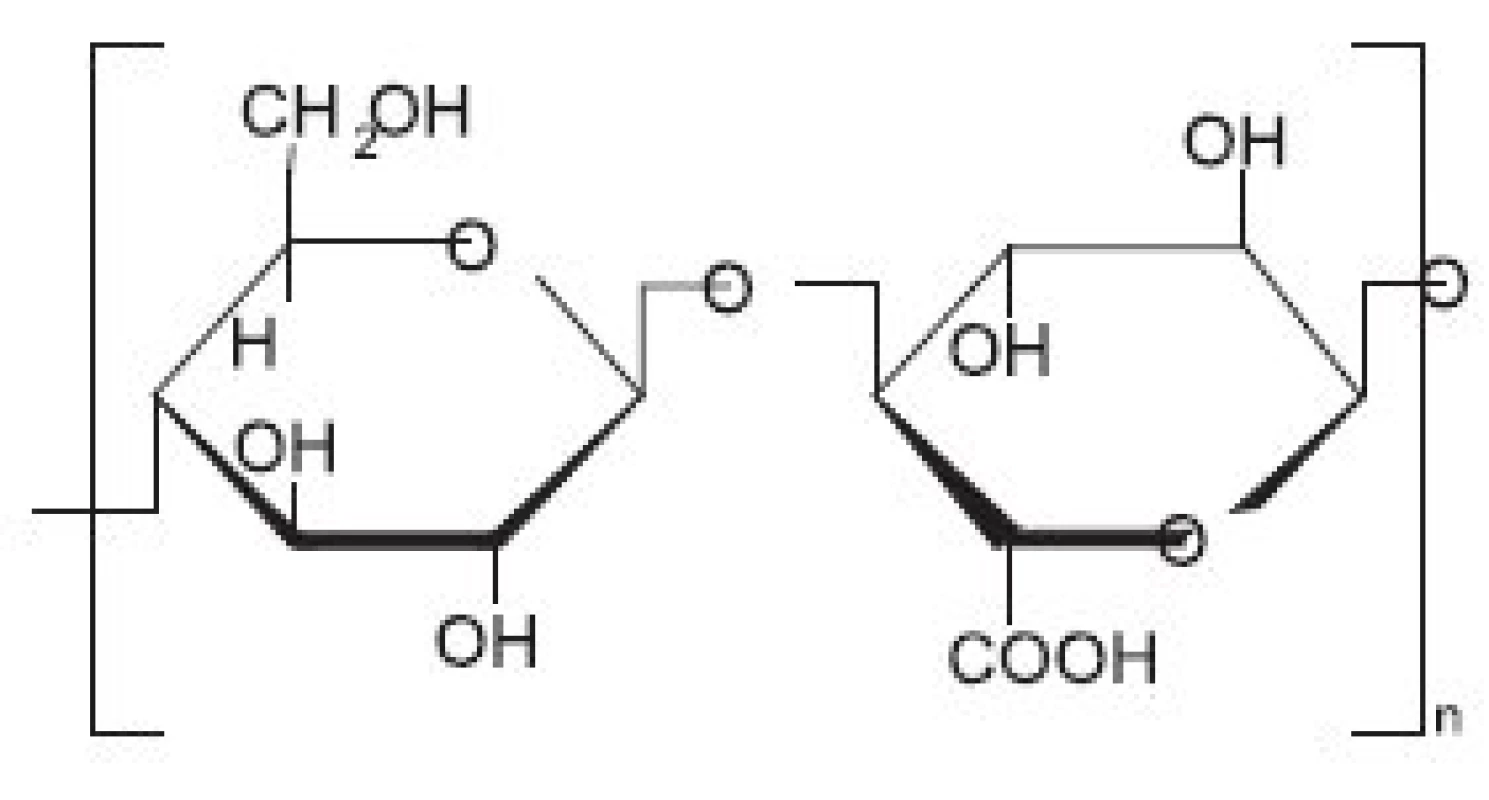
Celulosa patří mezi netoxické a biokompatibilní biopolymery (obr. 1). Chemickou obměnou hydroxylových skupin celulosy lze zvyšovat či snižovat její hydrofilitu, biostabilitu nebo biodegradabilitu. Oxidovaná celulosa je vytvářena působením par dýmavé kyseliny dusičné na chirurgickou gázu. Při tomto procesu dochází k oxidaci polymerního řetězce celulosy a vytváření kyseliny (cellulosic acid) 3). Biodegradace oxidované celulosy v organismu za pomocí makrofágů začíná přibližně za 18 hodin po jejím umístění do rány. Nicméně, přesný absorpční čas může být v konkrétním případě odlišný, neboť záleží na použitém množství aplikovaného materiálu, stupni saturace krví a stavu tkáňového podloží 4).
V medicíně je oxidovaná celulosa využívána především pro své hemostyptické vlastnosti, vykazuje však i jiné biologické účinky, zejména antioxidační a antibakteriální, a schopnost přispívat k regeneraci poškozené tkáně. Vedle použití v medicíně se oxidovaná celulosa uplatňuje také ve farmacii (inertní ingredient a nosič léků), nebo v jiných oblastech průmyslu (kosmetika, deodoranty pro absorpční vycpávky, lubrikanty pro chirurgické rukavice, sorbenty apod.).
V současnosti dochází k novému zájmu o její širší využití v klinické praxi a k prohlubování znalostí o mechanismech účinků, které jsou testovány in vitro, na zvířecích modelech i v klinických studiích.
Oxidovaná celulosa
Oxidovaná celulosa (OC) (jedná se o oxycelulosu, 6 karboxycelulosu obsahující další funkční skupiny, např. keto skupiny) byla do klinické praxe zavedena už v roce 1942 (obr. 2). Oxidovaná celulosa (OC) tedy představuje chemicky pozměněnou a depolymerizovanou formu celulosy, kdy při jejím vzniku dochází nejprve k jejímu rozpuštění a poté vytvoření kontinuálního vlákna 5). O několik let později (1960) byla vyvinuta tzv. oxidovaná regenerovaná celulosa (ORC), která se vyrábí z regenerované celulosy původem z dřevní buničiny, obsahující okolo 50 % celulosy. Pro dosažení čištěné celulosy je potřeba ji chemicky rozložit a následně spojit v „regenerovanou“ celulosu. ORC vzniká rozpouštěním čisté alfa-formy celulosy v alkalizovaných organických rozpouštědlech. Tento roztok je posléze protlačován přes zvlákňovací trysky do roztoku kyseliny, ve kterém celulosa regeneruje a vytváří spojité vlákno, které je splétané do jemné tkaniny, následně oxidované a upravené pro použití ve formě gázových proužků (stripů) 4). Takto upravená celulosa má významné využití především v kontrole krvácení z mnoha různých typů povrchů, ale může být také stlačena pod osteoplastický štěp a nahradit tak kostní vosk, nebo je možné její použití při prosakování krve z dury. Lze ji využít i při aplikaci přímo na povrch mozku k lepší kontrole krvácení z malých cév 6).
Obr. 2. Oxidovaná celulosa (oxycelulosa, 6-karboxycelulosa) 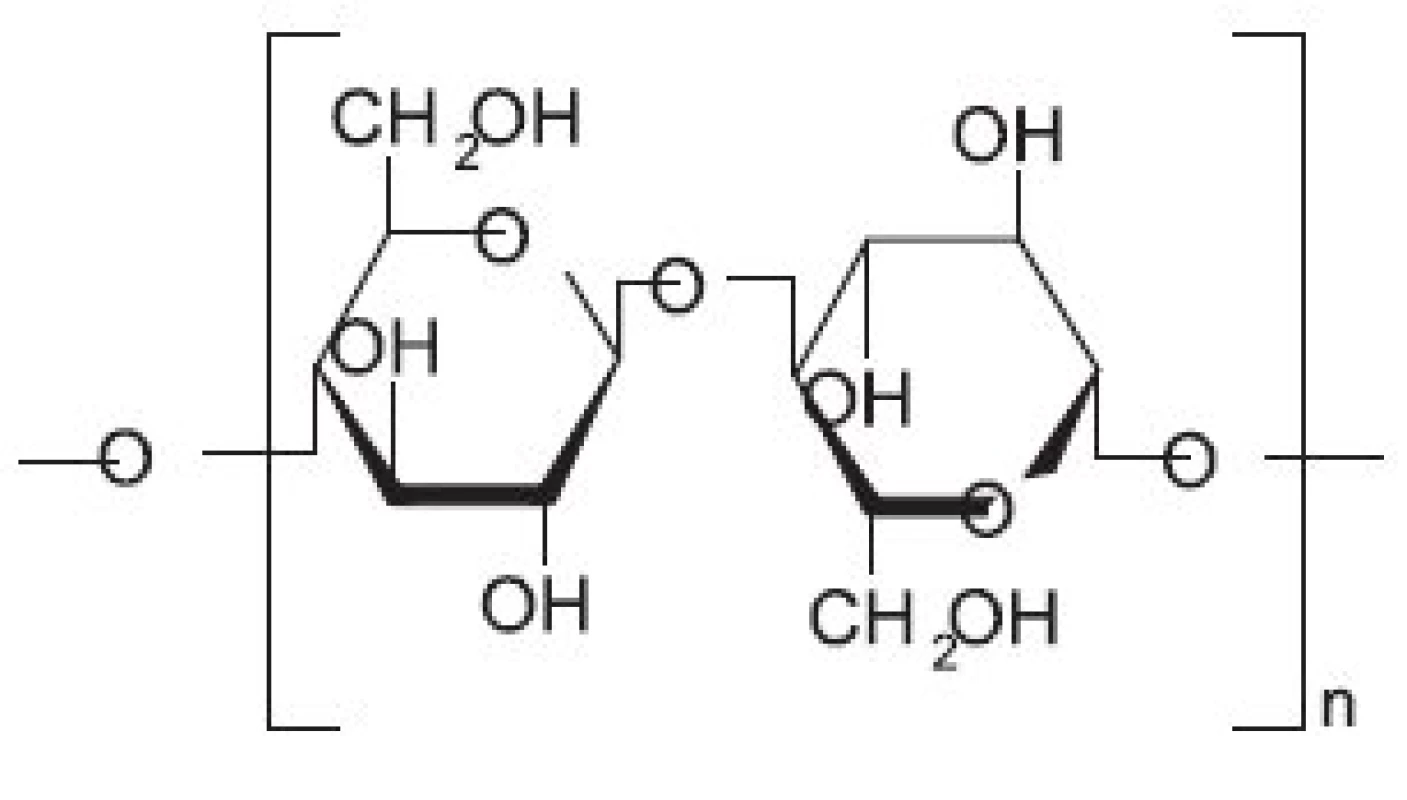
Schopnost biodegradace je důležitou vlastností OC a umožňuje její použití v klinické praxi řady lékařských oborů. Celulosa i její deriváty jsou samozřejmě substrátem enzymu celulasa (štěpí celulosu na jednodušší cukry), který se vyskytuje zejména u mikroorganismů, a nepodílí se tedy na biodegradačních procesech celulosy v lidském organismu. Studie provedené jak in vitro 7), tak in vivo 8) ukázaly, že mechanismus degradace OC zahrnuje chemickou depolymeraci, která je následovaná enzymatickou hydrolýzou zprostředkovanou endogenními glykosidasami makrofágů. Nejedná se tedy o pomalý systémový proces odbourávání OC, ale o rychlou a lokální biodegradaci realizovanou za pomoci buněk makrofágů. Autoři navíc zjistili, že oxidovaný polymer snadněji podléhá zkrácení řetězce za vzniku oligomerů, které jsou v prostředí krve nebo plazmy následně hydrolyzovány na menší fragmenty zahrnující kyselinu glukuronovou a glukosu.
Oxidovaná regenerovaná celulosa ve fibrilární formě není výrazně odlišná od jiných produktů odvozených od Surgicel celulosy, které jsou v současnosti dostupné v klinické praxi. Přesto se zdá, že by mohla mít určité výhody oproti standardním formám celulosy, a to především při léčbě cévního krvácení a prosakování krve z kortikálních povrchových oblastí po resekci tumoru 2). Další přednosti volně spojené, regenerované celulosy vycházejí z jejích fyzikálních vlastností. Ty totiž umožňují umístění OC v oblastech, kde se tento produkt rychle přizpůsobí povrchu příjemce, a tím vytvoří vhodnou, trojrozměrnou strukturu pro organizaci krevní sraženiny. Také se zdá, že oxidovaná celulosa je schopna navodit zástavu krvácení pomocí snížení pH, a vytvořit tak umělou sraženinu 9). Tato sraženina má nahnědlé zbarvení, což je dáno produkcí kyselého hematinu 10).
Oxidovaná celulosa nebo deriváty celulosy (jako například karboxymethylcelulosa) jsou již po řadu let používány ve formě savého tampónu z textilie nebo houby (přípravky s názvy: Surgicel (ORC), Gelitacel (OC), Benacel (OC) 11–13). Tyto formy přípravku se úspěšně používají například v léčbě mírného děložního krvácení v průběhu císařského řezu a při extrakcích v zubním lékařství 14). Pro terapii krvácení z malých cév a kapilár byla připravena hemostaticky účinná směs prášku oxidované celulózy s 20% vodným roztokem dextranu s názvem Oxycelodex 15). Mechanismus jeho hemostatického účinku je spojen se stimulací agregace destiček, která je následována tvorbou erytrocyt-hydroxycelulosových trombů, které vykazují adhezivní vlastnosti 16). V posledních letech byla připravena směs viskosy s mirabilitem (Glauberova sůl), což umožnilo připravit savý tampón, který vykazuje vysokou adsorpční kapacitu, dobré mechanické vlastnosti a schopnost zachovat tvar 17–19). Na trhu je mimo jiné k dispozici mikrodisperzní vápenato-sodná sůl oxidované celulosy (mdoc) nebo vápenatá sůl (Traumacel). Jde o biokompatibilní dobře resorbovatelné hemostyptikum, které se ve formě prášku používá k zástavě kapilárního a parenchymatózního krvácení.
Obecně se oxidované celulosy využívá v situacích, kdy selhává snaha o elektrokauterizaci krvácejícího místa, a tím docílení hemostatického účinku. Nejčastěji se jedná o urologické, gynekologické, všeobecné chirurgické, neurochirurgické a kolorektální lékařské zákroky.
Základní charakteristiky oxidované celulosy a dalších zástupců lokálních hemostatik ukazuje tabulka 1.
Tab. 1. Přehled lokálních hemostatických látek – upraveno podle 2) 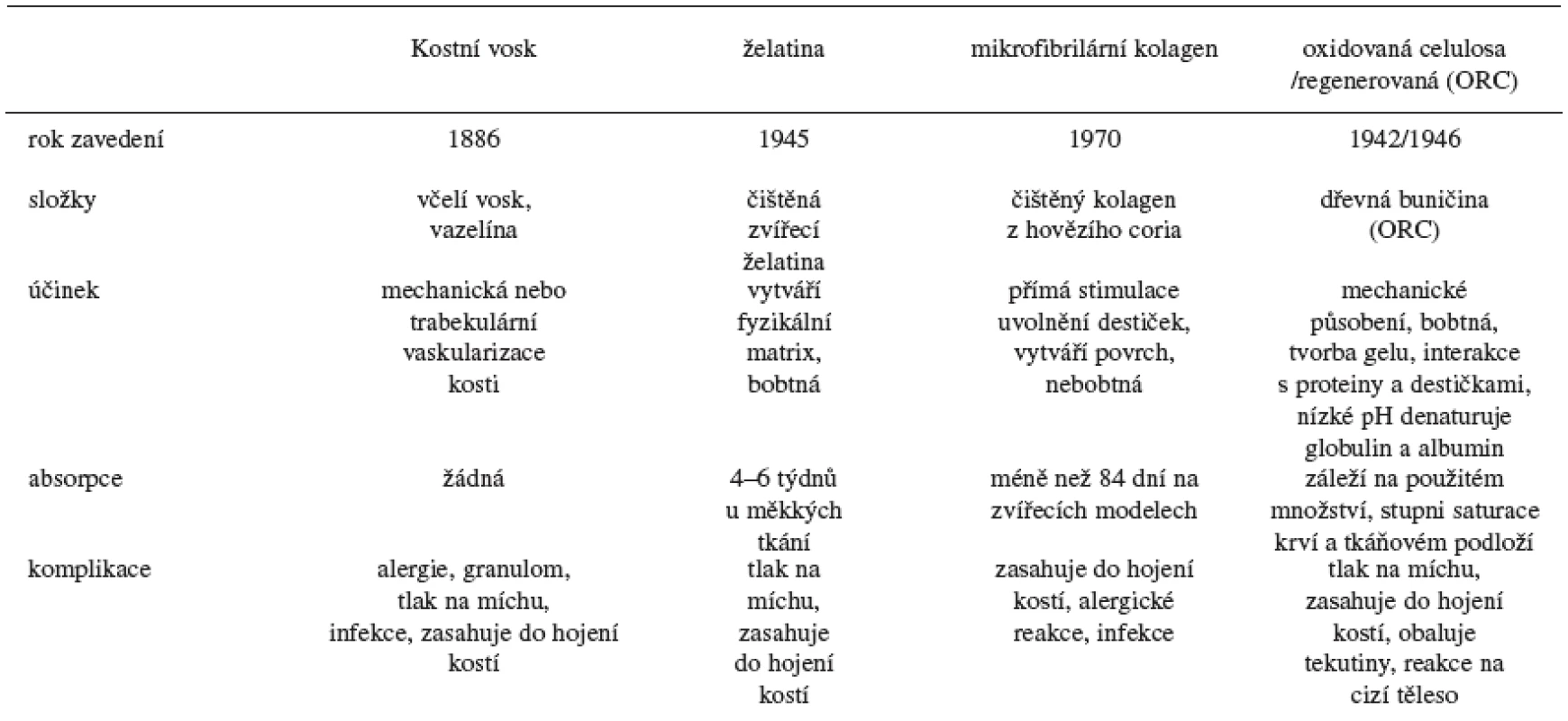
Hemostatické účinky
Přesný mechanismus hemostyptického působení celulosy a jejích derivátů však není dosud zcela znám. Znalosti mechanismu působení celulosy na hemostázu by bylo možno zpětně využít k cílené úpravě jejích hemostyptických vlastností.
Mechanismus účinku
Mnoho prací zabývajících se podrobným studiem mechanismů hemostatického působení oxidované celulosy pochází od českých autorů 10, 20, 21). Významně tak přispěli k objasnění tohoto mechanismu. Za použití turbidimetrie a stanovením serotoninu uvolněného z krevních destiček během jejich aktivace, zjišťovali aktivaci trombocytů oxidovanou celulosou. Výsledky ukázaly, že promyté destičky a promyté destičky s 0,2 % fibrinogenu nebyly celulosou aktivovány. Destičky resuspendované v normální plazmě byly aktivovány 2% oxidovanou celulosou. Závislost aktivace destiček na čase obsahovala lag fázi a následně rychlý nárůst koncentrace serotoninu. Délka lag fáze se u normální plazmy pohybovala od 5 do 10 minut. Aktivace destiček resuspendovaných v plazmě pacientů s deficiencí faktorů VIII, IX a XII měla lag fázi prodlouženou o 10–15 minut. Oproti tomu deficience faktoru XIII neměla vliv na aktivaci destiček oxidovanou celulosou. Z uvedených výsledků vyplývá, že celulosa neaktivuje krevní destičky přímo, ale prostřednictvím některých složek plazmy. K aktivaci destiček celulosou neslouží ani její interakce s fibrinogenem, který je v určité konformaci schopen interagovat s membránovými glykoproteiny klidových destiček. Na aktivaci krevních destiček celulosou se podle naměřených výsledků podílejí faktory iniciační fáze koagulační kaskády vedoucí k tvorbě trombinu.
Další zajímavé, do koagulační kaskády zasahující účinky oxidované regenerované celulosy ukázala práce na tkáňových kulturách lidských fibroblastů a mezoteliálních buněk 22). Bylo zjištěno, že vlivem ORC došlo ke zvýšení exprese aktivátoru tkáňového plazminogenu (tPA) u mezoteliálních buněk, a dále ke zvýšení poměru tPA – PAI-1 (inhibitor aktivace plazminogenu), což ukazuje na celkové zvýšení fibrinolytické aktivity. To má za následek rozpouštění fibrinu a hojení ran bez vzniku pooperačních srůstů.
Účinky na zvířecích modelech
Krvácení v průběhu operace, které se nedaří držet plně pod kontrolou, může způsobit život ohrožující komplikace. Schopnost kombinovaného preparátu s obsahem vankomycinu a ORC kontrolovat krvácení v oblasti parietální pleury navozené chirurgicky byla testována na třech experimentálních skupinách laboratorních králíků 23). Hodnotila se účinnost samotné ORC a její kombinace s vankomycinem proti kontrole. Výsledek pokusu ukázal, že intenzita krvácení ve skupině kombinující vankomycin s ORC byla menší ve srovnání s oběma dalšími skupinami.
V jiné práci byl hemostatický účinek oxidované celulosy potvrzen na laboratorních králících, u nichž byl navozen defekt obalu varlete, tvořeného tuhým vazivem 24). Kromě zástavy krvácení došlo vlivem oxidované celulosy k regeneraci a zhojení rány v průběhu 6 týdnů, a to bez vzniku reakce na cizí těleso.
Účinnost ORC při regeneraci chirurgicky navozeného defektu kyčelní kosti byla sledována u psů a porovnána s dalšími třemi lokálními hemostatickými látkami 25). Výsledky experimentu ukázaly, že účinnost mikrofibrilárního kolagenu, želatinové pěny i ORC byla v průběhu dvouměsíční kostní regenerace srovnatelná, zatímco kostní vosk byl v této indikaci nevhodný.
Komplikace a omezení
Použití hemostatických přípravků založených na celulose má určitá omezení. Nemohou být používána k vysušení a vyčištění po tom, co dojde k zástavě krvácení. Jakmile je ho dosaženo, doporučuje se hemostatika tohoto typu odstranit z místa obklopujícího poškozené tkáně (kosti, kostní dřeň, optické nervy a chiasma), jinak by mohlo dojít k nebezpečným kompresím těchto struktur. Tyto přípravky také nejsou určeny pro zástavu krvácení velkých cév 15).
Tři případy paraplegie po chirurgické operaci hrudníku, kde byla pro kontrolu krvácení použita ORC, byly zdokumentovány Brodbeltem et al. 26). Bylo zjištěno, že ORC prošla skrze intervertebrální foramen a způsobila tlak na míchu. Na základě těchto i jiných dat 27, 28) bylo doporučeno, že ORC by v případě jakýchkoliv intraspinálních a perispinálních procedur neměla být použita, respektive by mělo dojít k úplnému odstranění ORC ihned po zástavě krvácení.
Přestože oxidovaná celulosa patří mezi látky s velmi dobrou biokompatibilitou, může se při jejím použití také objevit nebezpečná reakce organismu na přítomnost cizího tělesa. Takové případy byly popsány například u pacientů s benigním nádorem mozkové pleny, kdy se po dvou a dvanácti měsících od odstranění intrakraniálního meningiomu objevila granulomatózní reakce na oxidovanou celulosu použitou při zástavě krvácení 29).
Další účinky oxidované celulosy
Oxidovaná celulosa vykazuje vedle účinků hemostatických také zajímavé antioxidační, antimikrobiální a rány-hojící vlastnosti 15).
Antioxidační účinky
Problémem chronických nehojících se ran může být tvorba exsudátů, obsahujících vysokou hladinu proteolytických enzymů, jako je například elastáza pocházející z polymorfonukleárních granulocytů (označovaná jako PMN elastáza), dále reaktivní formy kyslíku (ROS) nebo reaktivní formy dusíku (RNS). Tato nadprodukce proteolytických enzymů totiž vede ke sníženým koncentracím růstových faktorů a inhibitorů proteináz, což může mít za následek dysbalanci mezi degradačními pochody a procesy remodelace tkáně. Proto by snížení protein-degradačních enzymů a zhášení ROS a RNS v místě poškození tkáně mohlo výrazně podpořit léčbu špatně se hojících ran.
Ve studii, která se zaměřila na hodnocení antioxidačních vlastností oxidované regenerované celulosy, autoři porovnávali tuto schopnost jak samotné ORC, tak její kombinace s kolagenem v podmínkách in vitro 30). Cílem bylo nejen zjistit výše uvedené účinky ORC, ale také její schopnost ovlivnit koncentraci a aktivitu PMN elastasy v exsudátech chronických ran. Pomocí chemiluminescenčních, fluorescenčních a ELISA metod bylo zjištěno, že jak ORC samotná, tak její kombinace s kolagenem vykazovaly antioxidační aktivitu, a navíc dokázaly i snížit koncentraci a aktivitu PMN elastázy ve studovaných vzorcích.
Antibakteriální účinky
Jednou z hlavních výhod oxidované celulosy je její poměrně silný antibakteriální účinek vůči širokému spektru patogenních mikroorganismů, který byl potvrzený jak v in vitro studiích, tak in vivo 2). Bylo zjištěno, že ve srovnání s želatinovými hemostatickými preparáty byla oxidovaná celulosa antibakteriálně účinnější 2). Jiná práce srovnávala antibakteriální vlastnosti oxidované celulosy a mikrofibrilárního kolagenu na zvířecím modelu experimentálně navozeného subkutánního poranění s následnou kontaminací rány patogenem 31). Studie ukázala, že po inokulaci kmene Staphylococcus aureus do rány byl antimikrobiální účinek oxidované celulosy vyšší, než tomu bylo v případě mikrofibrilárního kolagenu.
Tento, v léčbě hojení krvácejících ran prospěšný účinek, je rychlý a zřejmě je dán snížením pH v místě aplikace. Mechanismus antibakteriálního účinku oxidované celulosy se vysvětluje schopností zvýšit kyselost prostředí obklopující bakterii, a tím umožnit přirozeným obranným mechanismům hostitele překonat infekční agens 1).
Uvedená vlastnost oxidované celulosy byla potvrzena také u mikroorganismů rezistentních vůči antibiotikům 32). Pro účely takového testování byla hodnocena účinnost ORC proti methicilin-rezistentním kmenům Staphylococcus aureus a Staphylococcus epidermidis, vankomycin-rezistentnímu Enterococcus, penicilin-rezistentnímu Streptococcus pneumoniae a nerezistentním kmenům Staphylococcus aureus a Pseudomonas aeruginosa. Výsledky ukázaly, že kmeny rezistentní vůči působení vybraných antibiotik zůstaly citlivými vůči antimikrobiálnímu působení ORC. Navíc se předpokládá, že díky snížení pH prostřednictvím ORC se ovlivní životaschopnost širokého spektra bakterií, přičemž tento účinek není mechanismus-specifický jako u používaných antibiotik, a tím by nemělo u bakterií dojít ke vzniku rezistence k pH efektu ORC.
Rányhojící vlastnosti
Za poslední rok se objevilo několik prací, které referují o dobrých hojících vlastnostech ORC nebo její kombinace s dalšími látkami při terapii špatně se hojících ran. Jedna z prací testovala tyto schopnosti obkladu ORC/kolagen u diabetických pacientů s chronickými vředy na dolních končetinách a porovnávala je s účinností autologních růstových faktorů 33). Po uplynutí 8 týdnů analýza výsledků ukázala, že u experimentální skupiny kombinující obklady ORC/kolagen s autologními růstovými faktory došlo k signifikantní redukci všech sledovaných ran oproti skupinám léčeným pouze ORC/kolagen nebo autologními růstovými faktory samostatně. Bylo konstatováno, že tyto proteasy-modulující obklady působí synergicky s autologními růstovými faktory a zvyšují jejich účinnost v terapii diabetických defektů dolních končetin. Potvrzení schopnosti kombinace ORC/kolagen chránit růstové faktory a granulaci tkání inhibičním působením proti proteázám vyskytujícím se v chronických ranách přináší také další práce z roku 2007 34).
Klinická studie provedená na 40 pacientech po rekonstrukční operaci různého typu hodnotila hojivé účinky ORC při léčbě ran donorových míst kožních štěpů. Práce ukázala, že rány hojící, antibakteriální, hemostatické a biodegradační vlastnosti ORC mohou zajistit využití této látky jako alternativní metody léčby ran donorových míst kožních štěpů 35).
ZÁVĚR
Látky s hemostatickými vlastnostmi jsou široce využívány v různých oblastech medicíny. Zatímco jednotlivé specifické vlastnosti těchto látek potřebné pro individuální použití mohou být rozdílné, z obecného pohledu mají pomoci koagulačnímu systému pacienta rychle vytvořit krevní sraženinu uzavírající vzniklé poranění.
Závěrem lze konstatovat, že díky svým dobrým hemostatickým účinkům, vysoké biosolubilitě a biodegradabilitě, antioxidačním a rány hojícím vlastnostem představuje oxidovaná celulosa vhodný prostředek při terapii krvácivých stavů v různých oblastech medicíny. Navíc, potvrzené baktericidní účinky OC vůči širokému spektru aerobních i anaerobních patogenů zvyšují terapeutický potenciál této látky pro použití v klinické praxi.
Práce byla realizovaná v rámci grantového projektu 2A 1TP1/073 Ministerstva průmyslu a obchodu ČR.
Došlo: 10. prosince 2007
Přijato: 2. ledna 2008
Adresa pro korespondenci:
PharmDr. Peter Kollár, Ph.D.
Farmaceutická fakulta VFU
Palackého 1/3, 612 42 Brno
e-mail: kollarp@vfu.cz
Zdroje
1. Wagner, W. R., Pachence, J. M., Ristich, J. et al.: J. Surg. Res., 1996; 66, 100–108.
2. Schonauer, C., Tessitore, E., Barbagallo, G. et al.: Eur. Spine J., 2004; 13 (Suppl. 1), S89–S96.
3. Raccuia, J. S., Simonian, G., Dardik, M. et al.: Am. J. Surg., 1992; 2, 234–238.
4. Oto, A., Remer, E. M., O’Malley, C. M. et al.: Am. J. Roentgenol., 1999; 6, 1481–4148.
5. Levy, M. L., Day D. J., Fukushima, T.: Neurosurgery, 1997; 41, 701–702.
6. Voormolen, J. H., Ringers, J., Bots, G. T. et al.: Neurosurgery, 1997; 20, 702–709.
7. Dimitrijevich, S. D., Tatarko, M., Gracy, R. W.: Carbohydr. Res., 1990; 2, 247–256.
8. Dimitrijevich, S. D., Tatarko, M., Gracy, R. W. et al.: Carbohydr. Res., 1990; 2, 331–341.
9. Achauer, B. M., Black, K.S., Grosmark, D.M. et al.: J. Microsurg., 1982; 3, 242–247.
10. Mášová, L., Ryšavá, J., Křížová, P. et al.: Sb. Lek., 2003; 2, 231–236.
11. Ryšavá, J., Mášová, L., Dyr, J. et al.: Čas. Lék. čes., 2002; 141, 50–53.
12. Stiluehll, R., Uitmor, I., Sehjferstejn, E.: RF Patent No. 2136319 (1999); Byull. Izobret., 1999; 25.
13. Kothbauer, K., Jallo, G., Siffert, J. et al.: J. Neurosurg., 2001; 3, 503–506.
14. Sharma, J., Malhotra, M., Pundir, P.: Int. J. Gynaec. Obstet., 2003; 3, 271–275.
15. Belozerskaya, G. G., Makarov, V. A., Zhidkov, E. A. et al.: Pharm. Chem. J., 2006; 7, 353–359.
16. Daurova, T. T., Andreev, S. D.: Klin. Khirurg. 1981; 1, 5–7.
17. Taniguchi, K., Kohno, I., Tanabe, R. et al.: Eur. Patent No. 1269951 A1 (2001).
18. Pendharkar, S. M.: Eur. Patent No. 1424085 A1 (2004).
19. Guo, J., Looney, D., Zhang, G. et al.: Eur. Patent No. 1378255 A2 (2003).
20. Ryšavá, J., Dyr, J. E., Homola, J. et al.: Sensors and Actuators B: Chemical, 2003; 1, 243–249.
21. Křížová, P., Mášová, L., Suttnar, J. et al.: J. Biomed. Mater. Res. A., 2007; 2, 274–280.
22. Gago, L. A., Saed, G., Elhammady, E. et al.: Fertil Steril., 2006; 86 (Suppl 4), 1223–1227.
23. Kanko, M., Liman, T., Topcu, S.: J. Invest. Surg., 2006; 5, 323–327.
24. El-Assmy, A., Eassa, W., El-Hamid, M. A. et al.: BJU Int., 2007; 5, 1098–1102.
25. Finn, M. D., Schow, S. R., Schneiderman, E. D.: J. Oral. Maxillofac. Surg., 1992; 6, 608–612.
26. Brodbelt, A. R., Miles, J. B., Foy, P. M. et al.: Ann. R. Coll. Surg. Engl., 2002; 2, 97–99.
27. Cherian, R. A., Haq, N.: Ind. J. Radiol. Imag., 1999; 2, 49–51.
28. Iwabuchi, S., Koike, K., Okabe, T. et al.: Surg. Today, 1997; 10, 969–970.
29. Sandhu, G. S., Elexpuru-Camiruaga, J. A., Buckley, S.: Br. J. Neurosurg., 1996; 6, 617–619.
30. Schönfelder, U., Abel, M., Wiegand, C. et al.: Biomaterials. 2005; 33, 6664–6673.
31. Scher, K. S., Coil, J. A. Jr.: Surgery, 1992; 3, 301–304.
32. Spangler, D., Rothenburger, S., Nguyen, K. et al.: Surg. Infect. (Larchmt.), 2003; 3, 255–262.
33. Kakagia, D. D., Kazakos, K. J., Xarchas, K. C. et al.: J. Diabetes Complications, 2007; 6, 387–391.
34. Hollister, C., Li, V. W.: Nurs. Clin. North. Am., 2007; 3, 457–465.
35. Uysal, A. C., Alagoz, M. S., Orbay, H. et al.: Ann. Plast. Surg., 2006; 1, 60–64.
Štítky
Farmácia Farmakológia
Článok vyšiel v časopiseČeská a slovenská farmacie

2008 Číslo 1-
Všetky články tohto čísla
- Hemostatické účinky oxidované celulosy
- Nové knihy
- Podvýživa a nevhodná výživa
- Vliv auxinů na růst a akumulaci skopoletinu v suspenzní kultuře Angelica archangelica L.
- Studium vlastností tablet z přímo lisovatelné maltosy
- Látky ovlivňující aktivitu kaspas
- ČASOPIS ČESKÁ A SLOVENSKÁ FARMACIE V ROCE 2008
- Antioxidační aktivita tinktur připravených z hlohových plodů a nati srdečníku
- POKROKY V LÉKOVÝCH FORMÁCH – PRACOVNÍ DEN SEKCE TECHNOLOGIE LÉKŮ ČFS JEP
- Signálne dráhy bunkovej proliferácie a smrti ako ciele potenciálnych chemoterapeutík
- Abstrakta z akcí ČFS v časopisu Česká a slovenská farmacie
- Ze zasedání výboru České farmaceutické společnosti
- Mezinárodní kongres historie farmacie
- Cena pro doc. RNDr. PhMr. Václava Ruska, CSc.
- Jubileum doc. RNDr. Ruženy Čižmárikovej, CSc.
- Životné jubileum prof. RNDr. Vladimíra Špringera, CSc.
- Nové knihy
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Signálne dráhy bunkovej proliferácie a smrti ako ciele potenciálnych chemoterapeutík
- Hemostatické účinky oxidované celulosy
- POKROKY V LÉKOVÝCH FORMÁCH – PRACOVNÍ DEN SEKCE TECHNOLOGIE LÉKŮ ČFS JEP
- Podvýživa a nevhodná výživa
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy