-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Optimalizácia extrakčnej metódy na stanovenie metadónu a jeho metabolitu EDDP v moči plynovou chromatografiou
Optimization of the extraction method for the determination of methadone and its metabolite EDDP in urine by gas chromatography
The present study aimed to develop a suitable extraction method for the determination of methadone and it’s metabolite EDDP in human urine by gas chromatography with a nitrogen–phosphorus detector (NPD). The extraction method was optimized in an effort to receive the most satisfactory yield of the mentioned compounds from human urine. The highest yields were obtained by alkaline extraction (~ pH 9) with dietylether. Proadiphene (PA) was used as the internal standard. The most efficient yields were determined as follows: 91 ± 5 % for methadone (MTD) and 86 ± 5 % for its metabolite EDDP. The detection limit (LOD) of MTD was 8 ng/ml, for EDDP 23 ng/ml, and the limit of quantification (LOQ) was 27 ng/ml of MTD and for EDDP 77 ng/ml. The accuracy of this method inter day was found for MTD 1.1–2.32 %, for EDDP 7.3–9.3 % and intra day for MTD it was 9.1–13.7 %, for EDDP 4.7–8.7 %. The suitability of the developed method was checked for routine monitoring of MTD and it’s metabolite EDDP in human urine for 5 different samples taken from methadone maintenance program.
Key words:
methadone (MTD) – 2-ethylidene-3,3-diphenyl-1,5-dimethylpyrrolidine (EDDP) – urine – GC/NPD
Autori: R. Horáková; J. Valentová; I. Pechová; F. Devínsky
Pôsobisko autorov: Univerzita Komenského Bratislava, Farmaceutická fakulta, Katedra chemickej teórie liečiv
Vyšlo v časopise: Čes. slov. Farm., 2008; 57, 265-268
Kategória: Původní práce
Súhrn
Cieľom práce bolo vypracovať extrakčnú metódu na stanovenie metadónu a jeho metabolitu EDDP v moči s použitím plynovej chromatografie (GC) vybavenej špecifickým dusíkovým detektorom (NPD). Extrakčná metóda bola optimalizovaná s cieľom získať čo najlepšiu výťažnosť stanovovaných zlúčenín z moču. Optimálne výsledky boli dosiahnuté alkalickou extrakciou (~ pH 9) s dietyléterom, kde ako vnútorný štandard bol použitý proadifén (PA). Stanovená bola výťažnosť extrakcie pre metadón (MTD) 91 ± 5 % a pre jeho metabolit EDDP 86 ± 5 %. Limit detekcie (LOD) pre MTD je 8 ng/ml moču, pre EDDP 23 ng/ml moču a limit kvantifikácie (LOQ) je pre MTD 27 ng/ml moču a pre metabolit EDDP 77 ng/ml moču. Presnosť metódy v rámci jedného dňa sa pohybovala pre MTD v rozmedzí 1,1–2,32 %, pre EDDP 7,3–9,3 % a presnosť metódy v rámci troch dní pre MTD bola 9,1–13,7 %, pre EDDP 4,7–8,7 %.Vhodnosť metódy pre rutinné monitorovanie metadónu a jeho metabolitu EDDP v moči bola overená na 5 vzorkách pacientov zúčastňujúcich sa metadónového udržiavacieho programu.
Kľúčové slová:
metadón (MTD) – 2-ethylidene-3,3-diphenyl-1,5-dimethylpyrrolidine (EDDP) – moč – GC/NPDÚvod
Metadón (MTD) ako jedna zo substitučných zlúčenín sa používa pri liečbe závislosti na opiátoch, no najmä na heroíne 1). Patrí medzi syntetické opiáty pôsobiace na μ a δ opioidné receptory 2).Stanovenie metadónu (4,4-difenyl-6-(N,N-dimetylamino)heptán-3-ónu) a jeho metabolitu 2 etylidén-1,5-dimetyl-3,3-difenylpyrolidínu (EDDP) v moči a ďalších biologických tekutinách je dôležitou súčasťou odvykacieho programu pri liečbe drogových závislostí. Pomáha pri optimalizácii terapeutickej dávky metadónu a pri kontrole liečby drogovo závislých pacientov. Metadónový udržiavací program bol po prvýkrát zahájený v USA v roku 1964 3). Metadón možno podávať intravenózne, ale aj perorálne v tekutej forme alebo v tabletkách. Má dlhodobý účinok, a preto ho stačí podávať liečeným pacientom 1×denne. Vyznačuje sa pomalým ustálením maximálnej hladiny v krvi (4 hodiny) a dlhým biologickým polčasom (10–18 hodín). Na trhu je známy pod firemnými označeniami Physepton, Polamidon, Macodin. Účinná dávka je determinovaná ako dávka primeraná na prevenciu abstinenčného syndrómu a pohybuje sa v rozmedzí od 60–700 mg/deň 4).
Metadón v organizme podlieha intenzívnej metabolizácii, pri ktorej okrem farmakologicky aktívneho metabolitu normetadónu (nachádza sa v krvi) vznikajú i inaktívne metabolity 2-etylidén-1,5-dimetyl-3,3-difenylpyrolidín (EDDP) a 2-etyl-5-metyl-3,3-difenyl-3-H-4,5-dihydropyrol (EMDP) (obr. 1) 5). Hlavný metabolit EDDP ako i EMDP sú vylučované močom a ich eliminácia spolu s metadónom je závislá od pH moču.
Obr. 1. Metabolizmus metadónu 5) 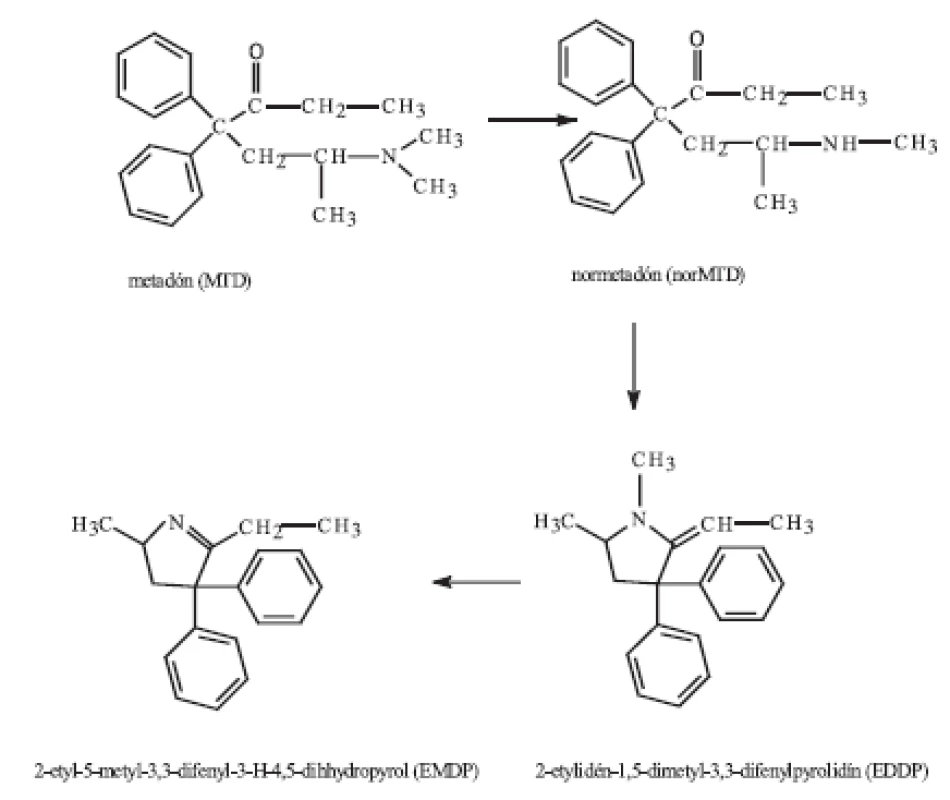
Stanovenie množstva metadónu ako i jeho metabolitov v biologických vzorkách si vyžaduje citlivú a špecifickú analytickú metódu. V súčasnosti publikované metódy zahŕňajú ako analytické metódy tenkovrstvovú chromatografiu (TLC) 6, 7), vysokoúčinnú kvapalinovú chromatografiu (HPLC) 8–10), plynovú chromatografiu (GC) 5, 11–17), v ktorej najčastejšie používanými detektormi sú plameňovo-ionizačný detektor (FID), detektor elektrónového záchytu (ECD), hmotnostný detektor (MSD), alebo termoionizačný dusíkovo-fosforečný detektor (NPD).
POKUSNA ČASŤ
Chemikálie
Metadónium chlorid bol od UNODC (Viedeň, Rakúsko) 2-etylidén-1,5-dimetyl-3,3-difenylpyrolidín (EDDP), proadifénium chlorid (vnútorný štandard 1 – IS 1) ako aj imipramínium chlorid (vnútorný štandard 2 – IS 2) boli od firmy Sigma (Steinheim, Germany), ich príslušné bázy boli pripravené v laboratóriu. Všetky ďalšie použité chemikálie a rozpúšťadlá boli analyticky čisté od firmy Merck (Darmstadt, Germany) a dietyléter od firmy Slavus (Bratislava, Slovensko), bol predestilovaný pred použitím.
Predúprava vzoriek
Na predúpravu vzoriek sa použili tri extrakčné metódy, označené A, B a C.
Metóda A
K 1 ml moču v zábrusových skúmavkách sa pridalo vypočítané množstvo metadónu (5 μg, 15 μg a 30 μg/ml), EDDP (15 μg, 25 μg a 50 μg/ml) a konštantné množstvo vnútorného štandardu (proadifénu, 15 μg/ml – IS 1 a imipramínu, 25 μg/ml – IS 2).
Do každej skúmavky sa pridalo 50 μl (5 mol/dm) vodného roztoku HCl, 0,5 ml (1 mol/dm) vodného roztoku K2CO3 a 5 ml zmesi hexán : izobutylalkohol (99 : 1, v/v). Obsah skúmaviek sa miešal 20 min na mechanickej trepačke a následne sa centrifugoval 10 minút pri 2500 ot/min. Vrchná organická vrstva sa odpipetovala do ďalšej skúmavky a odparila sa pod prúdom dusíka do sucha. Odparok sa kvantitatívne preniesol do vialky v 2× 500 μl metanolu.
Metóda B
K 1 ml moču v zábrusových skúmavkách sa pridalo vypočítané množstvo metadónu (5 μg, 15 μg a 30 μg/ml), EDDP (15 μg, 25 μg a 50 μg/ml), konštantné množstvo vnútorného štandardu (proadifénu, 15 μg ×ml – IS 1 a imipramínu, 25 μg/ml – IS 2), 1 ml 26% amoniaku a 5 ml chloroformu. Obsah skúmaviek sa následne premiešal 20 min na mechanickej trepačke a následne sa centrifugoval 10 minút pri 2500 ot/min. Po odpipetovaní hornej organickej vrstvy sa vodná vrstva opätovne extrahovala 5 ml chloroformu vyššie uvedeným postupom. Organické vrstvy sa spojili a vysušili bezvodým Na2SO4. Po odstránení sušidla sa z organickej vrstvy odparilo rozpúšťadlo pod prúdom dusíka a odparok sa preniesol do vialky v 2× 500 μl metanolu.
Metóda C
K 1 ml moču v zábrusových skúmavkách sa pridalo vypočítané množstvo metadónu (5 μg, 15 μg a 30 μg/ml), EDDP (15 μg, 25 μg a 50 μg/ml) a konštantné množstvo vnútorného štandardu (proadifénu, 15 μg/ml – IS 1 a imipramínu, 25 μg/ml – IS 2). Vzorka moču sa upravila 1 ml boraxového tlmivého roztoku na pH 9 a následne sa extrahovala 5 ml dietyléteru. Obsah skúmaviek sa miešal na mechanickej trepačke 20 min a centrifugoval 10 minút pri 2500 ot/min. Éterická vrstva sa premyla 0,5 ml destilovanej vody, vysušila sa bezvodým Na2SO4 a odparila sa do sucha pod prúdom dusíka. Odparok sa preniesol do vialky v 2× 500 μl metanolu.
Plynová chromatografia
Chromatografické analýzy boli uskutočnené na plynovom chromatografe HP 5890 Series II s NP detektorom v splitless režime.
Nosný plyn: hélium (tlak: 9,8 psi, prietok: 0,3 ml/min a rýchlosť: 30,0 cm/sec).
Zažíhacie plyny pre NPD: vodík, hélium a vzduch (prietoky: 20,0; 150,0 a 3,5 ml/min). Teplota injektora a NP detektora: 220 °C.
Kolóna: ULTRA 2 (12 m/0,2 mm/0,33 μm) so stacionárnou fázou tvorenou s 95 % dimetylsiloxánu a 5 % difenylsiloxánu.
Teplotný program GC: 100 °C – 1 min – 20 °C min – 300 °C – 2 min.
Celkový čas analýzy bol 13 minút. Vzorka sa dávkovala v objeme 1 μl.
VÝSLEDKY A DISKUSIA
Príprava vzoriek na analýzu tvorí často problémovú a kritickú časť analýzy liečiv a ich metabolitov. Najčastejšie používaným postupom na odstránenie nežiadúcich prímesí a látok zo vzorky nachádzajúcej sa v biologickom či inom materiály je extrakcia. Počas práce sa odskúšali tri metódy extrakcie kvapalina-kvapalina, tzv. liquid-liquid extrakcia (LLE) na stanovenie metadónu a jeho metabolitu EDDP v moči, označené ako metóda A, B a C. Na základe nameraných hodnôt štandardov a vzoriek moču boli vypočítané účinnosti extrakcie pre jednotlivé koncentrácie MTD a EDDP pre všetky tri extrakčné metódy. Pre lepšiu detegovateľnosť a citlivosť na GC/NPD sa pri validácii najlepšej extrakčnej metódy (metóda C) použil ako vnútorný štandard proadifén. Výsledky sú v tabuľke 1.
Tab. 1. Účinnosť extrakcií z kvapaliny do kvapaliny pre metadón a EDDP z moču (n = 5) 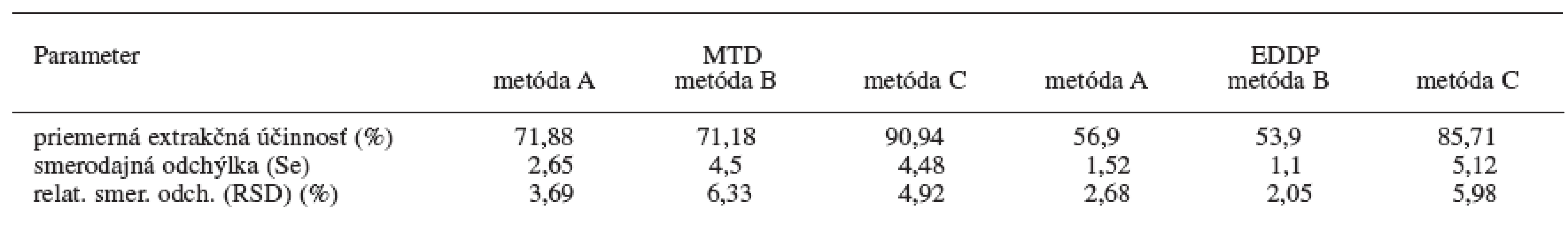
Z uvedených údajov (tab. 1) vyplýva, že najlepšie výsledky extrakčnej účinnosti pri daných koncentráciách MTD a EDDP za použitia proadifénu ako vnútorného štandardu sú pri extrakčnej metóde C, kde ako extrakčné činidlo sa použil dietyléter a na vysolenie analytu z moču chlorid sodný. U tejto metódy sa hodnotila následne presnosť a správnosť metódy pre stanovenie MTD a EDDP v moči pomocou GC/NPD v rámci jedného dňa a troch dní (tab. 2). Limitom detekcie pre MTD je 8 ng/ml moču a limitom kvantifikácie pre MTD je 27 ng/ml moču. Limitom detekcie pre EDDP je 23 ng/ml moču a limitom kvantifikácie pre MTD je 77 ng/ml moču. Relatívna štandardná odchýlka pre jednotlivé koncentrácie MTD je v rozsahu 1,10–2,32 % v rámci jedného dňa a 9,14–13,72 % troch dní. Relatívna štandardná odchýlka pre jednotlivé koncentrácie EDDP je v rozsahu 7,26 až 9,29 % v rámci jedného dňa a 4,72–8,73 % troch dní.
Tab. 2. Presnosť a správnosť metódy C 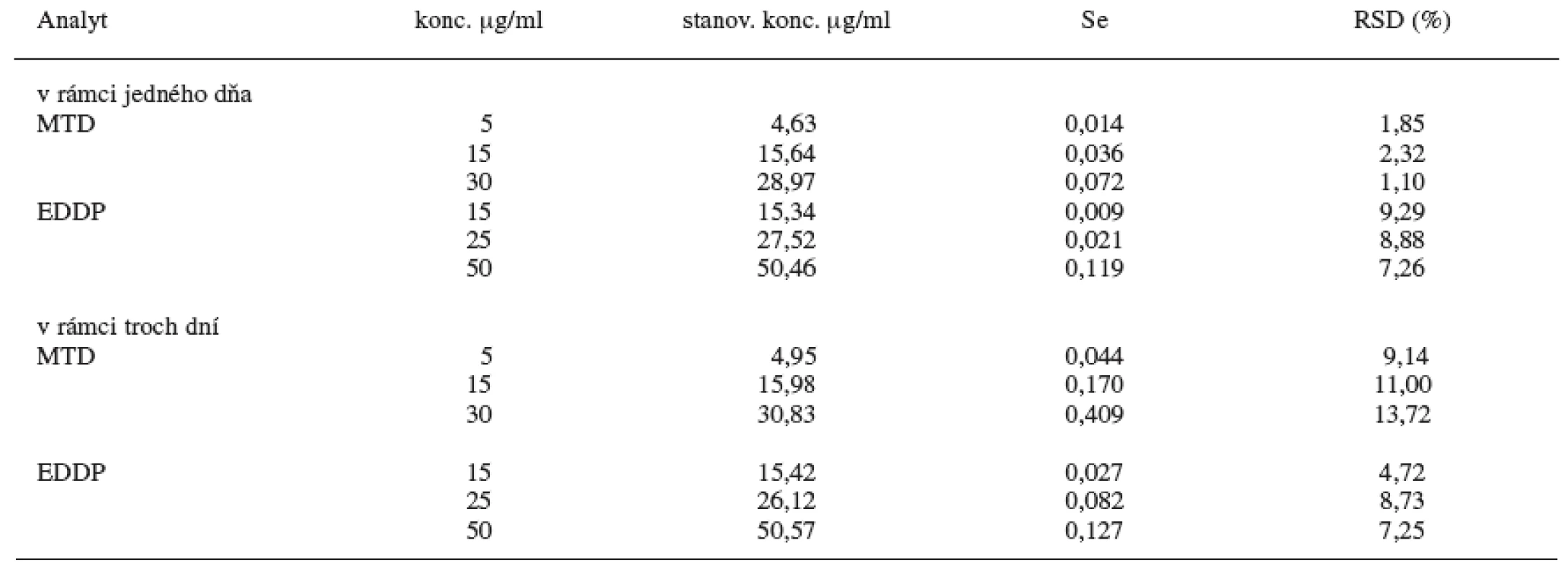
Podľa validačných parametrov vykazuje táto nami zvolená metóda na stanovenie metadónu a jeho metabolitu EDDP v moči pomocou GC/NPD správne a reprodukovateľné výsledky.
Pre stanovenie MTD a EDDP v moči pomocou GC/NPD bola získaná z použitého koncentračného rozsahu pre MTD 0,5–50,0 μg/ml moču a pre EDDP 1,0–50,0 μg/ml moču kalibračná krivka. Korelačné koeficienty získané pre MTD a pre EDDP sú:
MTD : y = 0,0966x + 0,0032 (R2 = 0,9994)
EDDP : y = 0,0331x + 0,0722 (R2 = 0,9925)
Metóda bola následne použitá na 5 náhodne vybraných reálnych vzoriek moču pacientov z Centra pre liečbu drogovej závislosti v Bratislave a na základe kalibračnej krivky boli stanovené koncentrácie MTD a EDDP liečených pacientov pri odvykacej kúre z drogovej závislosti na heroíne. Výsledky hladín MTD a EDDP v reálnych vzorkách moču pacientov sú uvedené v tabuľke 3.
Tab. 3. Hladiny MTD a EDDP v reálnych vzorkách moču pacientov z Centra pre liečbu drogovej závislosti v Bratislave 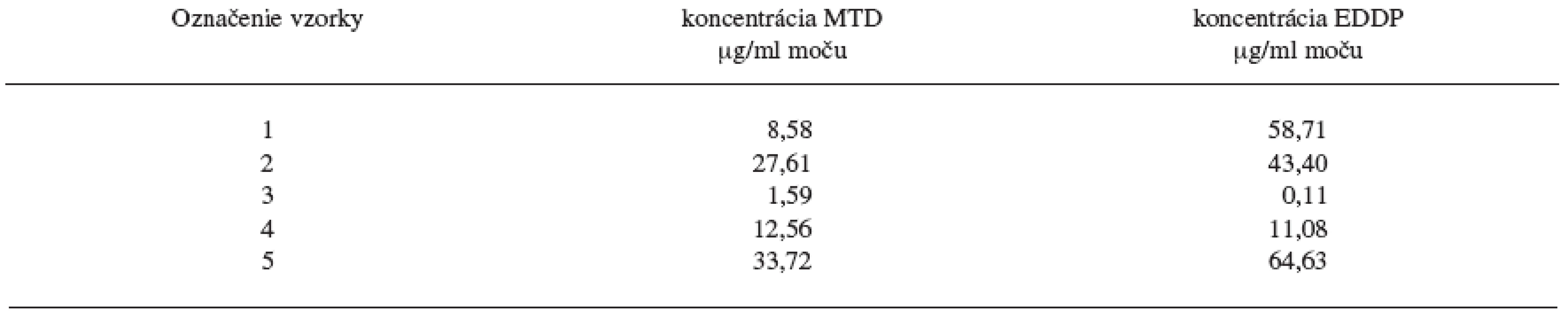
Ako môžeme vidieť z výsledkov reálnych vzoriek moču pacientov liečených z drogovej závislosti v Centre pre liečbu drogovej závislosti v Bratislave, extrakčná metóda C ako i následné stanovenie hladín MTD a EDDP v moči metódou GC/NPD je vhodné pre terapeutické stanovovanie vzoriek moču pacientov liečiacich sa z drogovej závislosti. Napriek veľkému rozptylu stanovených koncentrácii metadónu a jeho metabolitu EDDP v pacientských vzorkách moču je ešte stále stanovený obsah metadónu ako i EDDP v rozsahu stanovenia vytvorenej metódy na GC/NPD. Chromatografický záznam z GC/NPD vzorky moču pacienta 5 liečiaceho sa z drogovej závislosti pomocou substitučnej liečby metadónom je na obrázku 2.
Obr. 2. Chromatografický záznam vzorky moča pacienta 5 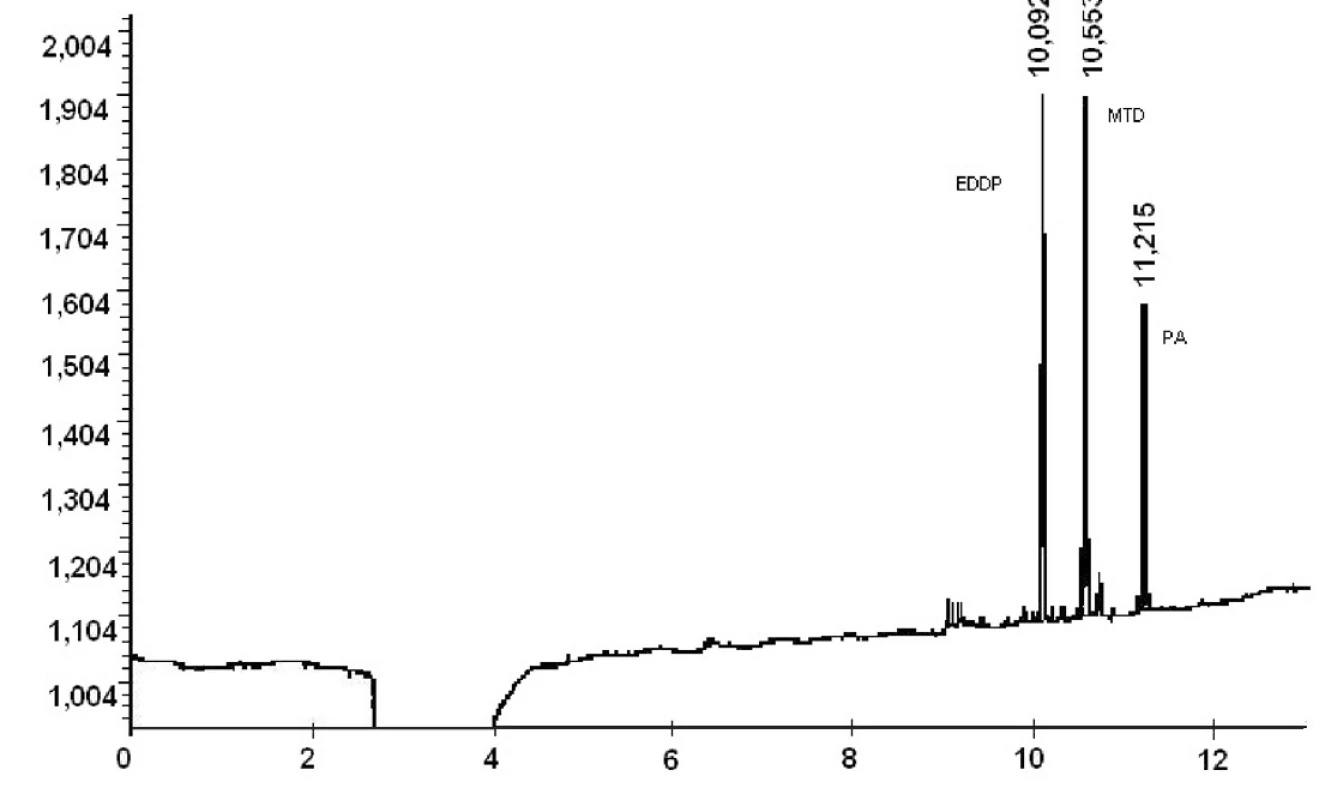
Táto práca bola riešená za podpory grantov VEGA č. 1/3416/06, 1/4300/07 a grantu APVV č. 20-030804.
Došlo 25. září 2008
Přijato 29. října 2008
Adresa pro korespondenci:
ing. Renáta Horáková
Katedra chemickej teórie liečiv FaF UK
Kalinčiakova 8, 832 32 Bratislava, Slovenská republika
e-mail: horakova@fpharm.uniba.sk
Zdroje
1. Pothier, J., Galand, N.: J. Chromatogr. A, 2005; 1080, 186–191.
2. Whelan, G., Lintzeris, N., McDonough, M. et al.: Methadone guidelines prescribers and pharmacists. 1. vydanie. Melbourne: State of Victoria, 2000; 7–15.
3. Kreek, M. J., Ann, N. Y.: Acad. Sci., 2000; 909, 186.
4. Eap, CH. B., Buclin, T., Bacmann, P.: Clin. Pharmacokinet., 2002; 41, 1153–1193.
5. Habrdová, V., Balíková, M.: Chem. Listy, 2002; 96, 1006–1009.
6. Misztal, G.: Acta Pol. Pharm., 1990; 47(5–6), 5–8.
7. Digiusto, E., Seres, V., Bibb, Z. A., Batey, R.: Addict. Behav., 1996; 21, 319–329.
8. Adams, P. S., Haines-Nutt, R. F.: J. Chromatogr., 1985; 329, 438–440.
9. Pierce, T. L., Murray, A. G. W., Hoff, W.: Science, 1992; 30, 443–447.
10. Choo, R. E., Murphy, C. M., Jones, H. E., Huestis, M. A.: J. Chromatogr. B, 2005; 814, 369–373.
11. Quintela, O., López, P., Bermejo, A.M., López-Rivadulla, M.: J. Chromatogr. B, 2006; 834, 188–194.
12. Müller, K.: Pharmazie, 1983; 38, 596–601.
13. Georgakopoulos, C. G., Kiburis, J. C.: Anal. Chem., 1991; 63, 2021–2004.
14. Schmidt, N., Still, R., Brune, K., Geisslinger, G.: Pharm. Research, 1993; 10 (3), 441–444.
15. Charotti, M., Marsili, R.: J. Microcol., 1994; 6, 577–580.
16. Balíková, M.: Remedia 1995; 5, 211–216.
17. Cooper, G. A. A., Oliver, J. S.: J. Anal. Toxicol., 1998; 22, 389–392.
Štítky
Farmácia Farmakológia
Článok vyšiel v časopiseČeská a slovenská farmacie

2008 Číslo 6-
Všetky články tohto čísla
- Vliv hlohového extraktu na funkci mitochondrií srdce
- Spotřeba hypolipidemik v České republice v letech 2000–2007
- Testování efektu 2’, 3, 4’-trihydroxychalkonu u experimentálního diabetes mellitus – pilotní studie
- Stanovení metoprololu a jeho metabolitu α-hydroxymetoprololu v séru metodou HPLC s fluorescenční detekcí
- Štúdium lokálnych anestetík Časť 185: Termodynamické parametre heptakaíniumchloridu v prostredí roztoku NaBr*
- Optimalizácia extrakčnej metódy na stanovenie metadónu a jeho metabolitu EDDP v moči plynovou chromatografiou
- Vliv koncentrace lipofilního nosiče na vlastnosti hydrofilně-lipofilních matricových systémů
- Možnosti ovplyvnenia liberácie alaptidu z dermálnych polotuhých liekov
- Ze zasedání Výboru České farmaceutické společnosti
- Zasedání Rady EUFEPS 2008
- RNDr. PhMr. Václav Mareš (6. září 1927–12. srpna 2008)
- KNIHY
- AUTORSKÝ REJSTŘÍK
- VĚCNÝ REJSTŘÍK
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Možnosti ovplyvnenia liberácie alaptidu z dermálnych polotuhých liekov
- Štúdium lokálnych anestetík Časť 185: Termodynamické parametre heptakaíniumchloridu v prostredí roztoku NaBr*
- Optimalizácia extrakčnej metódy na stanovenie metadónu a jeho metabolitu EDDP v moči plynovou chromatografiou
- Vliv koncentrace lipofilního nosiče na vlastnosti hydrofilně-lipofilních matricových systémů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



