-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Identifikace a stanovení citlivosti kvasinek rodu Candida vzhledem k optimalizaci uvolňování ciclopiroxolaminu z mukoadhezivních orálních tablet
Identification and susceptibility evaluation of Candida yeasts due to the optimization of ciclopiroxolamine release from mucoadhesive oral tablets
Oral candidosis represents a difficult and often recidivating complication in immunodeficient patients. Oral mucoadhesive tablets with prolonged release of a locally acting antifungal drug, e.g. ciclopiroxolamine, could contribute to their pharmacotherapy. For efficient therapy, the drug concentration present in oral cavity has to be determined, i.e. the drug content in the dosage form and its release have to be formed. The Theoretical Part of this paper aims to describe the basic characteristics of Candida yeasts and their induction of oral candidosis, to the possibilities of using standardized methods for detecting and determining their susceptibility to antifungal agents. The Experimental Part is focused on the establishment, identification and quantification of Candida species represented in 536 patients by cultivation on chromogenic agar. The microdilution and disc diffusion methods have been used for assessing the susceptibility of isolated and reference strains of yeasts to the antifungal drug – ciclopiroxolamine. The obtained results showed that 65.96% of candidosis are caused by Candida albicans, however the other tested species of Candida involve the disease only in minor part (C. tropicalis 12.76%, C. glabrata 10.64%, C. parapsilosis 10.64%). The microdilution method established the minimum inhibitory concentration for the reference strains of Candida to 2 μg/ml of ciclopiroxolamine for Candida glabrata, 1 μg/ml for Candida albicans and Candida tropicalis, and 0.5 μg/ml for Candida parapsilosis. Theoretical ciclopiroxolamine content in a tablet providing exceeding MIC for the tested species of Candida for 8–10 hours should lie, when considering all influencing factors, in the range of 25–50 mg with a release rate of 0.24 mg per hour at the minimum.
Key words:
oral candidosis – ciclopiroxolamine – microbiological establishment – pathogen susceptibility evaluation – oral mucoadhesive tablets
Autori: E. Mašková 1; J. Mašek 1,2; J. Gajdziok 1; M. Rabišková 1
Pôsobisko autorov: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků 1; Veterinární a farmaceutická univerzita Brno, Výzkumný ústav veterinárního lékařství, Oddělení farmakologie a toxikologie 2
Vyšlo v časopise: Čes. slov. Farm., 2010; 59, 79-86
Kategória: Původní práce
Súhrn
Orální kandidózy představují u imunodeficientních pacientů obtížně léčitelnou komplikaci s častými recidivami. Mukoadhezivní orální tablety s prodlouženým uvolňováním lokálně působícího antimykotika, např. ciclopiroxolaminu, by mohly přispět k jejich farmakoterapii. Pro efektivní terapii je nutné stanovit koncentraci léčiva, která musí být v ústní dutině zachována, tj. zjistit obsah v lékové formě a rychlost uvolňování léčivé látky z ní. Práce se v teoretické části zabývá základní charakteristikou kvasinek rodu Candida a jimi vyvolávanými orálními kandidózami, možnostmi použití standardizovaných metod k jejich průkazu a stanovení citlivosti na antimykotika. Experimentální část se zaměřuje na průkaz, identifikaci a kvantifikaci zastoupení druhu Candidy u 536 pacientů pomocí kultivace na chromogenním agaru. U izolovaných i referenčních kmenů kvasinek byla mikrodiluční a diskovou difuzní metodou hodnocena citlivost na ciclopiroxolamin. Ze zjištěných měření vyplynulo, že 65,96 % kandidových infekcí způsobuje kvasinka druhu Candida albicans, zatímco ostatní testované druhy se na vzniku tohoto onemocnění podílejí minoritní částí (C. tropicalis 12,76 %, C. glabrata 10,64 %, C. parapsilosis 10,64 %). Mikrodiluční metodou byla stanovena minimální inhibiční koncentrace pro referenční kmeny kandid na 2 μg/ml ciclopiroxolaminu u druhu Candida glabrata, na 1 μg/ml u Candida albicans a Candida tropicalis a 0,5 μg/ml u Candida parapsilosis. Teoretický obsah ciclopiroxolaminu v tabletě zajišťující překročení MIC pro testované druhy Candid po dobu 8–10 hodin by se při uvážení všech ovlivňujících faktorů měl pohybovat v rozmezí 25–50 mg s rychlostí uvolňování minimálně 0,24 mg/hodin.
Klíčová slova:
orální kandidózy – ciclopiroxolamin – mikrobiologický průkaz – stanovení citlivosti patogenu – mukoadhezivní orální tabletyÚvod
Mezi časté choroby dutiny ústní patří mykotická onemocnění způsobená patogeny rodu Candida. Orální kandidózy postihují zejména imunodeficientní pacienty včetně HIV pozitivních. U těchto pacientů se jedná o těžko léčitelnou komplikaci s častými recidivami. V současné době není v České republice registrována žádná léková forma s účinným léčivem pro lokální léčbu orálních kandidóz. Vhodnou lékovou formou by mohly být mukoadhezivní orální tablety obsahující lokálně působící antimykotikum, např. ciclopiroxolamin. Nosnou pomocnou látkou jsou mukoadhezivní polymery (karbomery, lektiny, hypromelosa, oxycelulosa, chitosan atd.), které tvorbou adhezivních viskózních hydrogelových vrstev na povrchu matricových tablet zajišťují jejich přilnutí k bukální sliznici i prodloužené uvolňování léčiva1–3). Rychlost uvolňování léčiva a jeho množství, tj. koncentrace v dutině ústní, jsou zásadní podmínkou pro úspěšnou farmakoterapii kandidóz. Z tohoto důvodu se jako první krok stanovily patogeny v ústní dutině u souboru pacientů a následně jejich citlivost na vybrané léčivo.
Ciclopiroxolamin
Ciclopiroxolamin (CP) je aminová sůl cyklohexyl-hydroxy-methyl-pyridonu (obr. 1). Jedná se o moderní širokospektré léčivo využívané k léčbě povrchových mykotických onemocnění4). CP je lipofilní látka o molekulové relativní hmotnosti 268,355, 6). Díky svým fyzikálně-chemickým vlastnostem penetruje snadno do kůže a nehtů7, 8). Je velmi málo toxický, není teratogenní, mutagenní ani kancerogenní. Jeho nežádoucí účinky jsou mírné. Jedná se zejména o pálení, svědění a lokální iritace7–10). Mechanismus účinku CP spočívá v tlumení celulárního příjmu látek nezbytných pro metabolismus a růst buňky. Ciclopiroxolamin navázáním na buněčné struktury a organely blokuje příjem esenciálních aminokyselin fenylalaninu a lysinu, draslíku a fosfátových iontů do buňky10, 11). Dochází i k poškození proteinů důležitých pro replikaci a reparaci DNA12). Tyto účinky jsou podpořeny chelatací a tvorbou málo rozpustných komplexů s trojmocnými ionty železa, důležitého kofaktoru bakteriálních a houbových enzymů4, 9, 10). Minimální inhibiční koncentrace (MIC) ciclopiroxolaminu pro Candida albicans i běžná dermatofyta se pohybuje v rozmezí od 0,98 do 3,9 μg/ml4, 11). Ciclopiroxolamin se dnes využívá v lokální terapii vaginálních a kožních kandidóz a dermatofytóz vyvolaných rody Candida,Epidermophyton, Microsporum, Trichophyton a Malassezia furfur včetně azolrezistentních kmenů C. glabrata, C. krusei a C. guilliermondi4, 11, 13). Účinek je fungistatický, při vyšší koncentraci též fungicidní a sporocidní. Kromě toho účinkuje antimikrobiálně na četné, klinicky relevantní grampozitivní i gramnegativní bakterie. Ciclopiroxolamin se aplikuje ve formě krémů a roztoků v terapii onychomykóz a vaginálních kandidóz (v České republice registrované přípravky Batrafen®, Dafnegin®)8).
Obr. 1. Chemická struktura ciclopiroxolaminu<sup>7</sup>) 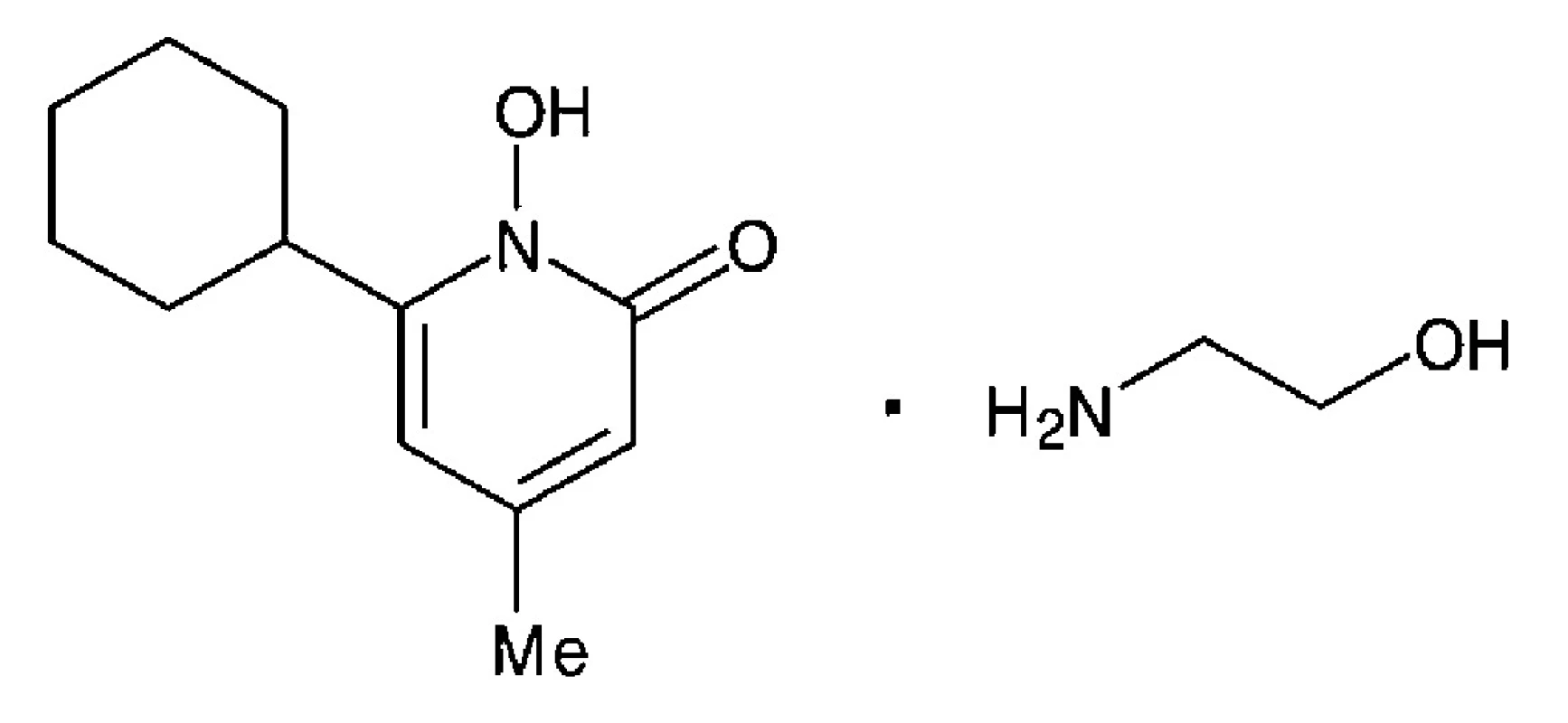
K novějším derivátům tohoto léčiva patří rilopirox, který působí mechanismem blokace dýchacího řetězce a tvorby stabilního komplexu se železem, kofaktorem enzymů důležitých pro metabolizmus určitých patogenů4, 11).
Rod Candida, kandidózy
K rodu Candida náleží kvasinkovité organismy patřící mezi nejběžnější houbové patogeny, způsobující lokální (kožní i slizniční) a u oslabených jedinců i systémové mykózy14). Mezi nejčastěji se vyskytující kvasinky patří Candida albicans, dále pak C. tropicalis, C. glabrata, C. krusei, C. parapsilosis, C. guilliermondii14–17). Kvasinky rodu Candida jsou podmíněnými patogeny nacházejícími se v dutině ústní, v pochvě, na pokožce a v plicích zdravých jedinců14, 18). Přemnožení kvasinek a vývoj onemocnění může vyvolat například podávání antibiotik nebo imunosupresiv15, 18). Základním morfologickým útvarem kvasinek je oválná grampozitivní buňka velikosti 3–6 μm. Za určitých podmínek se buňky kvasinek enormně protahují, ale svými konci zůstávají spojeny a vytváří řetízky – pseudohyfy (obr. 2)15, 19).
Obr. 2. Candida albicans: a) kvasinka jako oválná buňka, b) pseudohyfy<sup>19</sup>) 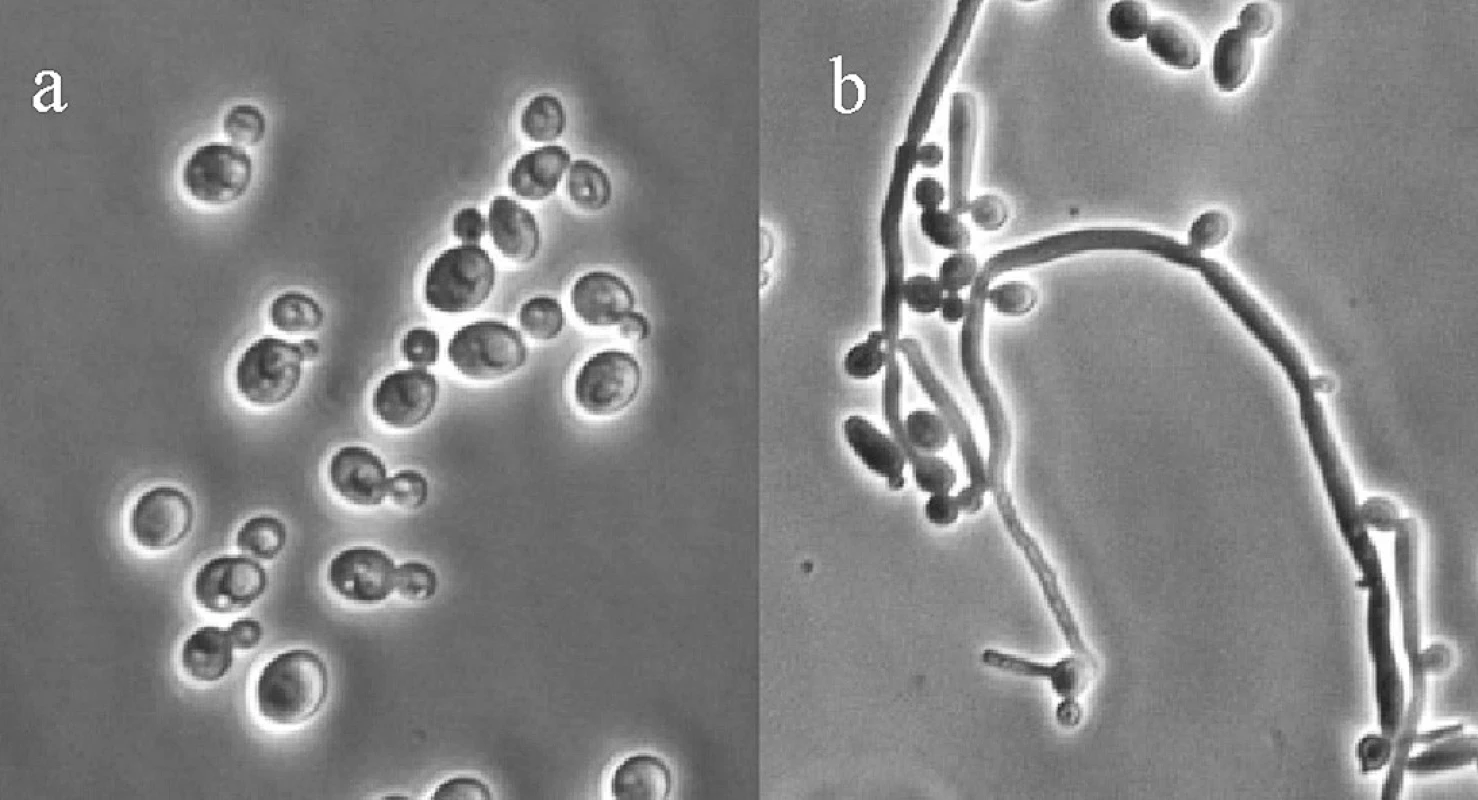
Kandidóza je akutní nebo subakutní infekce, při níž se vytváří léze v ústech (orální kandidóza), ve vagíně (vulvo-vaginální kandidóza), na pokožce a nehtech (onychomykózy), v průduškách nebo v plicích (broncho-pulmonální kandidóza). Příležitostně může způsobovat až otravu krve, zánět endokardu nebo zánět mozkových blan15–17, 19).
Orální kandidózy
V naprosté většině případů je orální kandidóza vyvolána kvasinkou Candida albicans. Ta je za normálních podmínek na ústní sliznici saprofytem, přítomným jen v malém množství14). Jako patogen se projeví oportunisticky při lokálním či celkovém narušení imunitního systému, kdy dochází k nefyziologickému zmnožení kvasinek15). U pacientů s těžkým imunodeficitem jsou orální kandidózy způsobeny Candidou crusei, kandidózy u pacientů po radiační terapii v oblasti krku vyvolává Candida glabrata. Nové druhy kvasinek (Candida dubliniensis nebo C. conspicua) byly popsány u pacientů s HIV14, 15).
Průkaz kandidóz probíhá přímo. K diagnostice sooru a poševní kandidózy stačí mikroskopie, ke zjištění citlivosti je nezbytná kultivace. Sabouraudův agar je postupně nahrazován chromogenními agary, na nichž Candida vyrůstá v typicky zbarvených koloniích. Zelené kolonie vytváří C. albicans, modré C. tropicalis, růžové s plstnatým povrchem C. parapsilosis a drobné, tmavě fialové C. glabrata (obr. 3)17).
Obr. 3. Kultivace rodu Candida na chromogenním agaru<sup>20</sup>) a – C. albicans, b – C. tropicalis, c – C. parapsilosis, d – C. glabrata, 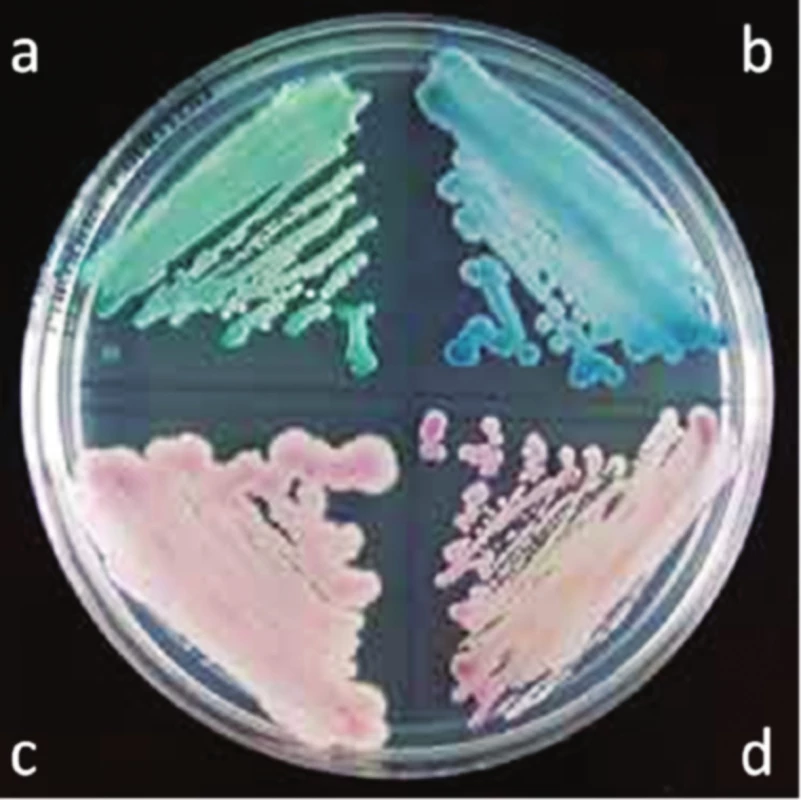
Léčba orálních kandidóz
U lehčích forem kandidóz stačí pouze lokální podávání antiseptik a imidazolových antimykotik. U těžších forem je třeba systémová léčba, a to zejména aplikací triazolových antimykotik – flukonazolu nebo itrakonazolu, či amfotericinu B nebo nystatinu18,19). Mezi další méně častá antimykotika v léčbě kandidóz patří karbamáty, morfolin, DNA analog 5-fluorocytosin a capsofungin18).
Mikrobiologické hodnocení citlivosti patogenů k antimykotikům
Účinnost protimikrobní látky na příslušný patogen můžeme stanovit pomocí dvou laboratorních hodnot – minimální inhibiční koncentrace a minimální baktericidní (fungicidní) koncentrace21). Se zvyšujícím se výskytem mykotických infekcí a stále rostoucím počtem antifungálních přípravků nabývá na významu stanovení in vitro citlivosti k antimykotickým látkám. Důvodem je i vyskytující se rezistence některých druhů patogenů a potřeba zvolit nejen vhodný preparát, ale také dávku v závislosti na citlivosti k danému antimykotiku. Poslední roky znamenaly velký pokrok ve standardizaci metod vhodných k testování in vitro citlivostí. Pro použití v klinické laboratoři je nezbytné zvolit jednoduchou a málo nákladnou metodu, která poskytuje dostatečně reprodukovatelné výsledky22).
Pro zjišťování a hodnocení citlivosti nebo rezistence metodou kvantitativní a kvalitativní se používají metody zavedené Standardized Antifungal Susceptibility Testing – Clinical Laboratory Standards Institute (CLSI), dříve National Committee for Clinical Laboratory Standards, Subcomittee for Antifungal Testing. Stejnými problémy se zabývá také European Committee for Antimicrobial Susceptibility Testing (EUCAST). Používají se i doporučení Národní referenční laboratoře17). Pro zjišťování antimykotické citlivosti metodou diluční CLSI doporučuje směrnice M27 A a M27-A2 a pro diskovou difuzní metodu určení antimykotické citlivosti M44-A. Ke stanovení citlivosti používáme též kvantitativní MIC (E-test) a semikvantitativní diluční metodu (Fungitest)17).
Mikrodiluční metody stanovení
CLSI (dokument M27-A2)
Jedná se o metodu kvantitativní, poskytující možnost stanovit minimální inhibiční koncentraci a umožňující dle hodnoty MIC zařadit testovaný izolát do kategorie citlivý (S), citlivý v závislosti na dávce (SDD – Susceptible Dose Dependent), rezistentní (R). Standard CLSI pro kvasinky (dokument CLSI M27-A2) určuje postup při testování citlivosti kvasinek rodu Candida a Cryptococcus neoformans s použitím média RPMI-1640 s glutaminem, bez bikarbonátů, obohaceného 0,2 % glukosy. Hustota očkovaného inokula je 0,5 McFarland, a inkubace probíhá při 35 °C 24-48 hodin pro Candida spp. a 48–72 hodin pro Cryptococcus neoformans. Hodnotí se stupeň zákalu dle určených kritérií16, 23–25).
EUCAST (dokument 7.1)
EUCAST vypracoval v roce 2002 návrh standardizovaného postupu pro testování citlivosti kvasinek k antimykotikům. Jako médium se použil RPMI-1640 s 2 % glukosy, inokulum obsahující 0,5 × 105 až 2,5 × 105 CFU (colony forming units)/ml a podmínky inkubace byly stanoveny na 35 °C a 24 hodin. Tyto postupy byly ověřeny ve studiích, kde se sledovala korelace s postupy CLSI a interlaboratorní reprodukovatelnost výsledku u ciclopiroxolaminu, terbinafinu, ketokonazolu, itrakonazolu a flukonazolu. I přesto, že doporučené postupy CLSI a EUCAST se liší v přípravě média (obohacení glukosou), v přípravě inokula, době inkubace i způsobu interpretace, je míra korelace mezi oběma metodami vysoká, a to zejména u ciclopiroxolaminu a terbinafinu16).
Disková difuzní metoda
Disková difuzní metoda umožňuje dle zóny inhibice růstu vytvořené kolem disku s antimykotickou látkou zařadit testovaný izolát také do kategorie citlivý (S), citlivý v závislosti na dávce (SDD), rezistentní (R)26). Metodika pro testování citlivosti kvasinek k flukonazolu diskovou difuzní metodou publikovaná v roce 1996 Barrym a Braunem27) byla následně ověřena v celosvětové studii infekčních nemocí a jejich původců (ARTEMIS) a v roce 2004 uznána CLSI jako standard M44-A 22, 28, 29). Pro testování je dle CLSI doporučen Mueller-Hintonův agar obohacený 2 % glukosy s 0,5 μg/ml methylenové modři. pH média má být v rozmezí 7,2–7,4, inokulum má dosahovat hustoty 0,5 McFarland, inkubace má probíhat při 35 °C 24 hodin, u některých druhů v případě slabého růstu i 48 hodin28, 29). Možnou alternativou je modifikovaný Sabouraudův glukosový agar (2% glukosa, 1% pepton, 2,5% agar, pH neupraveno), pro azolová chemoterapeutika s výjimkou 5-fluorocytosinu lze použít agar s kasitoninem nebo komerční půdu Antimycotic sensitivity agar firmy Hi-media. U testování citlivosti kvasinek se též využívá Asparaginový agar.
POKUSNÁ ČÁST
Materiál
Jako léčivá látka se v experimentální části práce použil ciclopiroxolamin (Hoechst-Biotika, SK) a antimykotické disky s obsahem 30 μg ciclopiroxolaminu (ITEST plus s r.o., CZ). Pro kultivaci kvasinek se použily mikrobiologické půdy a média: Sabouraudův agar (Imuna Pharm a.s., SK), CHROM Agar Candida (AscoMed, CZ), Mueller – Hintonův bujon (Hi Media, F), RPMI-1640 médium (Sigma Aldrich, USA) a asparaginový agar (Sigma Aldrich, USA). V pokusu se dále použilo rozpouštědlo dimethylsulfoxid (DMSO) (Kulich, CZ), fyziologický roztok (B. Braun Melsungen AG, Německo) a tenzid Tween 80 (Kulich, CZ).
Identifikace Candid
Jednotlivé kmeny kvasinek byly izolovány a identifikovány z klinického materiálu zpracovaného na Mikrobiologickém ústavu Fakultní nemocnice U svaté Anny v Brně. Z 536 vzorků odebraných pacientům z dutiny ústní od října 2007 do března 2008 bylo vykultivováno 47 kmenů Candid. Kvasinky se nejdříve nakultivovaly ve zkumavkách na šikmo nalitém Sabouraudově agaru v termostatu (BT 120, Chirana, CZ) při teplotě 27 °C po dobu 24–48 hodin. Vyžíhanou bakteriologickou kličkou bylo nabráno několik kolonií kvasinek, které se naočkovaly na Petriho misku s chromogenním médiem CHROM Agar Candida. Kultivace probíhala při 27 °C po dobu 24–48 hodin. Kvasinky narostlé na CHROM Agar Candida byly identifikovány na základě barvy kolonií (obr. 4).
Obr. 4. Identifikace izolátů a – C. albicans, b – C. glabrata, b – C. parapsilosis, d – C. tropicalis 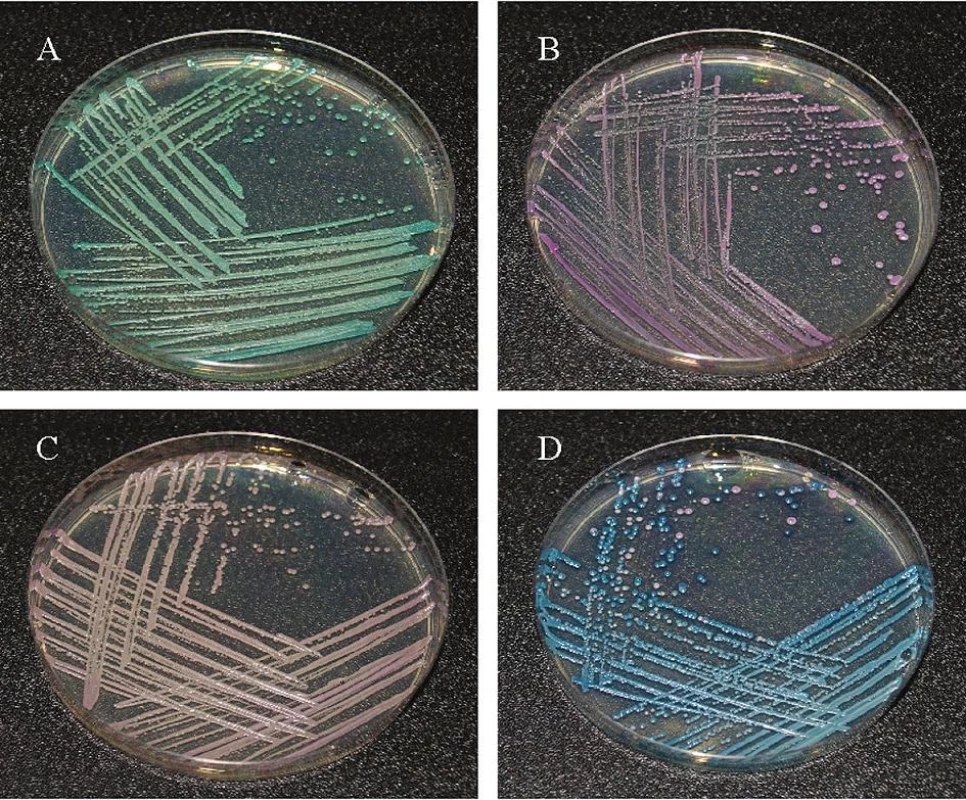
Mikrobiologické hodnocení citlivosti patogenů
Mikrodiluční metoda stanovení
a) Příprava inokula
Kvasinky se ze Sabouraudova selektivního agaru vyžíhanou bakteriologickou kličkou přenesly a nakultivovaly v Mueller-Hintonově bujonu v termostatu při teplotě 37 °C po dobu 2 hodin. Takto připravená suspenze se naředila na hustotu 0,5 Mc Farland. Hustota byla změřena pomocí densi-la-metru (Pliva-Lachema a.s., CZ).
b) Příprava roztoků
Všechny roztoky byly připraveny za aseptických podmínek. Roztok glukosy se připravil rozpuštěním glukosy (Kulich, CZ) ve fyziologickém roztoku (20 mg/ml) a přefiltroval přes filtr (Whatman, UK) o velikosti pórů 100 nm. Ciclopiroxolamin (Hoechst-Biotika, SK) se rozpustil v DMSO a také přefiltroval za sterilních podmínek.
c) Příprava mikrotitrační destičky
Do 96 jamkové sterilní plastové destičky (Gama group a.s., CZ) se za sterilních podmínek napipetovalo 100 μl RPMI-1640 média o pH 7 (s 0,2% roztokem glukosy). Ciclopiroxolamin se přidal v takovém množství, aby výsledná koncentrace v jednotlivých jamkách byla 0,008; 0,015; 0,031; 0,063; 0,125; 0,25; 0,5; 1; 2 a 4 μg/ml. Do jamek se nadávkovalo po 100 μl inokula o hustotě 0,5 Mc Farland a inkubovalo se v termostatu po dobu 48 hodin při 35 °C. Výsledky se hodnotily odečtením zákalu vizuálně. Jako minimální inhibiční koncentrace se hodnotila koncentrace ciclopiroxolaminu, při níž došlo k inhibici růstu, tedy jamka bez zákalu.
Disková difuzní metoda
a) Příprava inokula
Kvasinky se nakultivovaly ve zkumavce na šikmo nalitém Sabouradově agaru v termostatu při teplotě 27 °C po dobu 24–48 hodin. Vyžíhanou bakteriologickou kličkou bylo nabráno několik kolonií kvasinek a inokulováno do fyziologického roztoku s Tweenem 80 na hustotu 0,5 Mc Farland. Hustota byla změřena pomocí densi-la-metru.
b) Disková difuzní metoda
Kolonie testované čisté kultury kvasinek se suspendovala v 3 ml fyziologického roztoku s Tweenem 80 na hustotu cca 0,5 podle Mc Farlanda. Sterilním vatovým tampónem na špejli se nanesla suspenze rovnoměrně na povrch asparaginového agaru v Petriho misce. Sterilní jehlou byly aplikovány antimykotické disky s obsahem ciclopiroxolaminu (max. 6 disků na misku). Takto naočkovaná Petriho miska se inkubovala při 27 °C po dobu 24–48 hodin. Citlivý kmen vytvořil okolo disku inhibiční zónu o průměru doporučeném výrobcem. Odečtení inhibiční zóny se provádělo posuvným měřítkem. Pro ciclopiroxolamin má být velikost inhibiční zóny > 10 mm. Rostou-li kvasinky až k disku, nebo je-li zóna inhibice menší než hraniční hodnota, je kvasinka k příslušnému antimykotiku rezistentní.
Pro srovnání se použily referenční kmeny kvasinek: Candida albicans CCM 8261, Candida glabrata CCM 8270, Candida parapsilosis CCM 8260 a Candida tropicalis CCM 8264.
c) Statistické porovnání rozdílů v citlivosti jednotlivých kmenů Candid
Aby bylo možné říci, že průměrné hodnoty minimálních inhibičních zón u jednotlivých kmenů Candid se statisticky významně liší, je nutné výsledky podrobit statistickému zpracování. Pro posouzení, zda je rozdíl v citlivosti statisticky významný, je vhodné využít one tailed nepárový Studentův t-test. Nejprve bylo třeba ověřit, zda data v jednotlivých skupinách odpovídají normálnímu rozložení a rozptyly dat v jednotlivých skupinách se statisticky významně neliší. K tomu účelu se využil F-test. Statistické porovnání bylo provedeno v programu Prism 4.
Výsledky a diskuze
Identifikace kvasinek na chromogenní půdě
Z 536 vzorků odebraných pacientům z dutiny ústní ve Fakultní nemocnici U sv. Anny v Brně bylo v Mikrobiologickém ústavu nakultivováno 47 kmenů Candid, které byly identifikovány na chromogenním agaru dle barvy a charakteru kolonií (obr. 4). Největší procentuální zastoupení kolonií představovala Candida albicans (65,96 %), dále pak C. tropicalis (12,76 %), C. glabrata (10,64 %) a C. parapsilosis (10,64 %) (tab. 1).
Tab. 1. Procentuální zastoupení Candid v izolátech 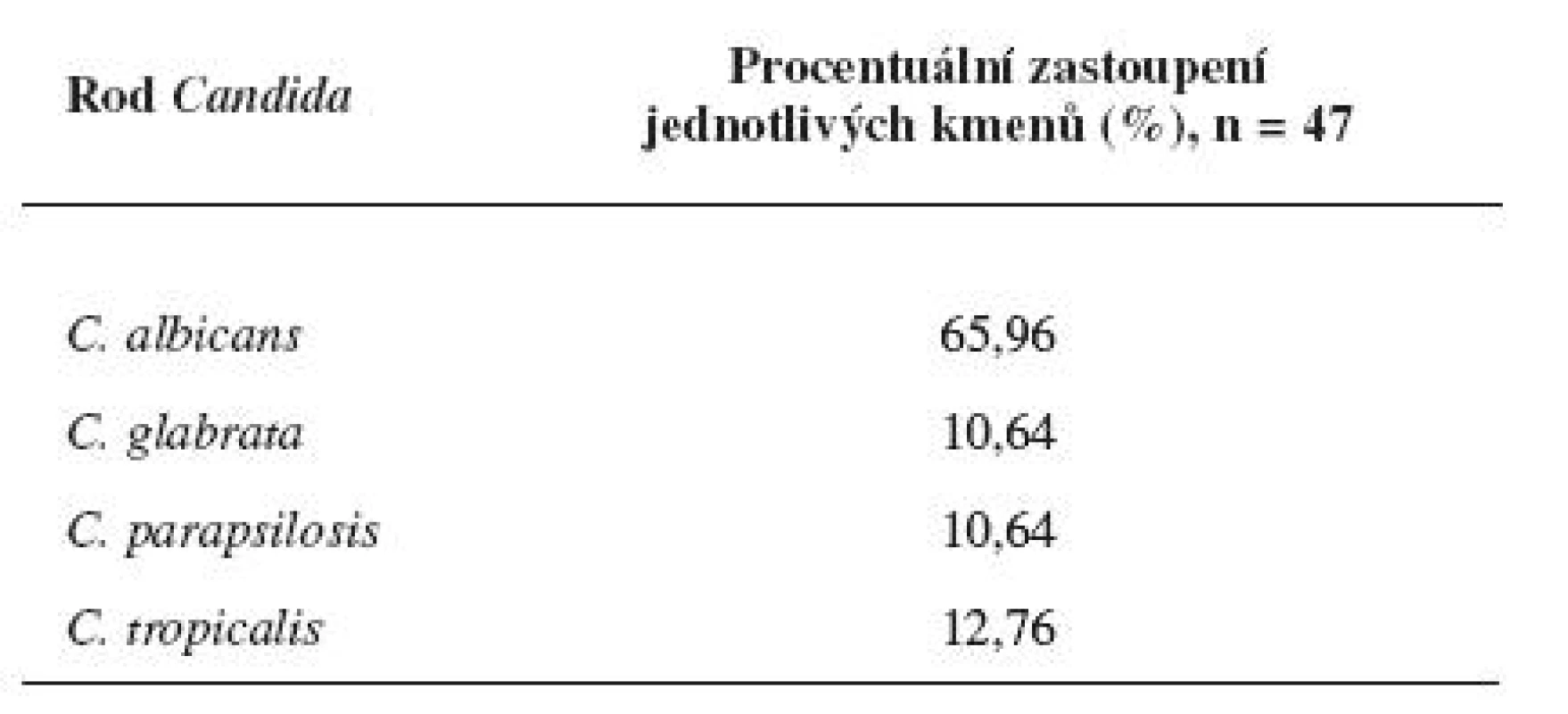
Stanovení citlivosti mikrodiluční metodou
Pomocí mikrodiluční metody na mikrotitrační destičce bylo možno stanovit minimální inhibiční koncentraci ciclopiroxolaminu na referenčních kmenech Candid (Candida albicans CCM 8261, Candida glabrata CCM 8270, Candida parapsilosis CCM 8260 a Candida tropicalis CCM 8264). Sledoval se zákal jednotlivých jamek, kde byl ciclopiroxolamin v koncentracích 0,008 až 4 μg/ml (tab. 2). Výsledná minimální inhibiční koncentrace ciclopiroxolaminu byla pro referenční kmen Candida albicans CCM 8261 stanovena na 1 μg/ml, pro referenční kmen Candida glabrata CCM 8270 2 μg/ml, Candida parapsilosis CCM 8260 0,5 μg/ml a Candida tropicalis CCM 8264 1 μg/ml (tab. 3). Výsledek koreluje s literárními údaji, které uvádějí MIC ciclopiroxolaminu v rozmezí od 0,98 do 3,9 μg/ml1, 8). Mikrodiluční metodou byla ověřena antimykotická účinnost ciclopiroxolaminu, který se následně použil do nalisovaných mukoadhezivních orálních tablet.
Tab. 2. Odečet minimální inhibiční koncentrace v 96 jamkové mikrotitrační destičce 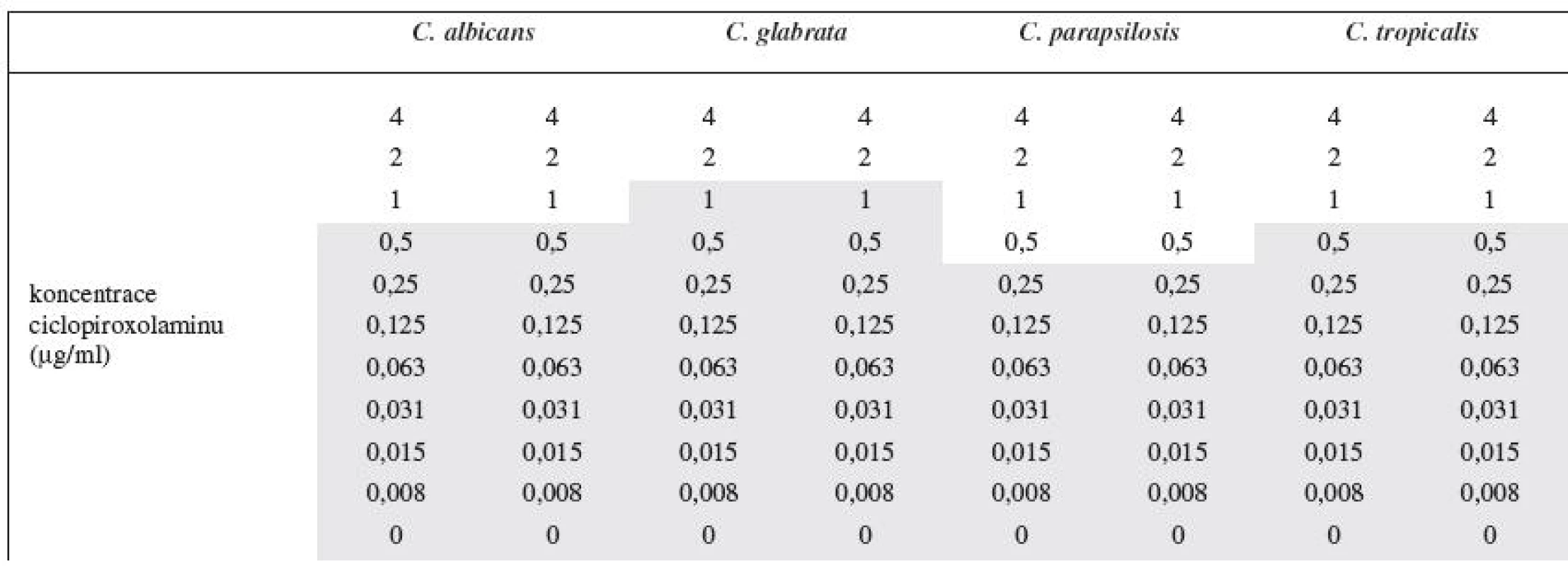
Ve vybarvených jamkách byl pozorován zákal, tedy růst. Tab. 3. Minimální inhibiční koncentrace ciclopiroxolaminu 
Hodnocení citlivosti patogenů diskovou difuzní metodou
Diskovou difuzní metodou na asparaginovém agaru se stanovila velikost inhibičních zón standardních disků s obsahem 30 μg ciclopiroxolaminu na jednotlivých izolovaných kmenech kvasinek – Candida albicans, C. glabrata, C. parapsilosis, C. tropicalis a referenčních kmenech: Candida albicans CCM 8261, Candida glabrata CCM 8270, Candida parapsilosis CCM 8260 a Candida tropicalis CCM 8264. Velikost referenční inhibiční zóny pro disky s obsahem ciclopiroxolaminu 30 μg je stanovena výrobcem na 10 mm. Pro referenční kmen Candida albicans CCM 8261 byla naměřena velikost inhibiční zóny 12,50 mm, průměrná hodnota pro izolované kmeny C. albicans byla 15,01 mm. Pro referenční kmen Candida glabrata CCM 8270 byla inhibiční zóna 12,70 mm, průměrná hodnota pro jednotlivé izoláty tohoto kmene pak 14,04 mm. Inhibiční zóna 14,70 mm odpovídala referenčnímu kmeni Candida parapsilosis CCM 8260, průměrná hodnota inhibiční zóny izolovaných kvasinek tohoto kmene byla 13,31 mm. Velikost inhibiční zóny pro referenční kmen Candida tropicalis CCM 8264 byla 10,50 mm, průměrná hodnota inhibiční zóny izolátu 14,92 mm (tab. 4, obr. 5). U všech vzorků, jakož i referenčních kmenů byla naměřena inhibiční zóna standardního disku s obsahem ciclopiroxolaminu vyšší než referenční hodnota uváděná výrobcem. Testované kmeny lze tedy hodnotit jako citlivé k ciclopiroxolaminu. Na základě statistického zpracování výsledků stanovení citlivosti k ciclopiroxolaminu jednotlivých kmenů Candid diskovou difuzní metodou se jako statisticky významná (hladina významnosti 95%) prokázala nižší citlivost izolátů Candida parapsilosis oproti Candida albicans a Candida tropicalis. Jiný statisticky významný rozdíl v citlivosti se neprokázal (tab. 5, tab. 6).
Tab. 4. Průměrné inhibiční zóny standardního disku s obsahem CP na kvasinkách 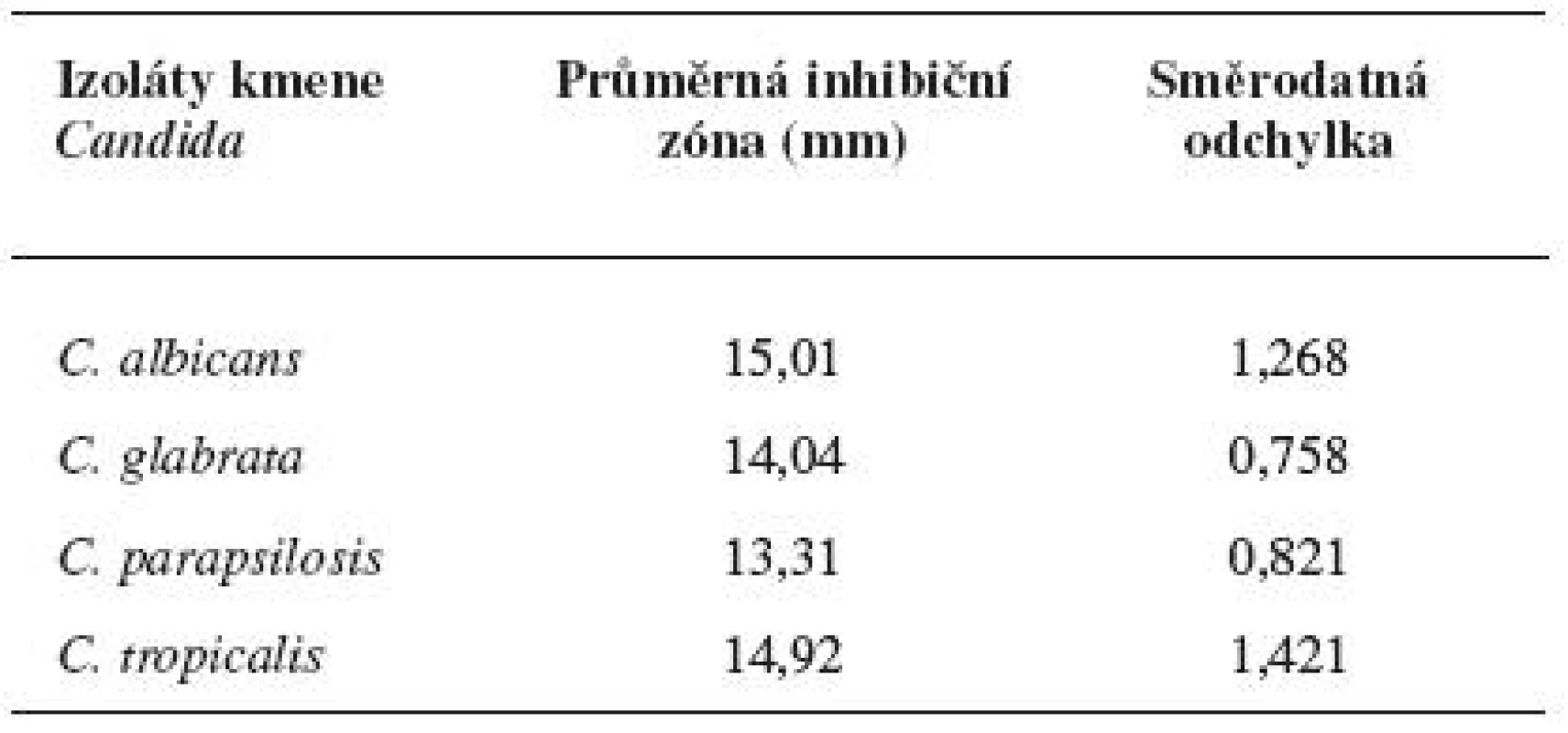
Tab. 5. Porovnání rozdílů variability rozptylů hodnot u jednotlivých kmenů (F-test) 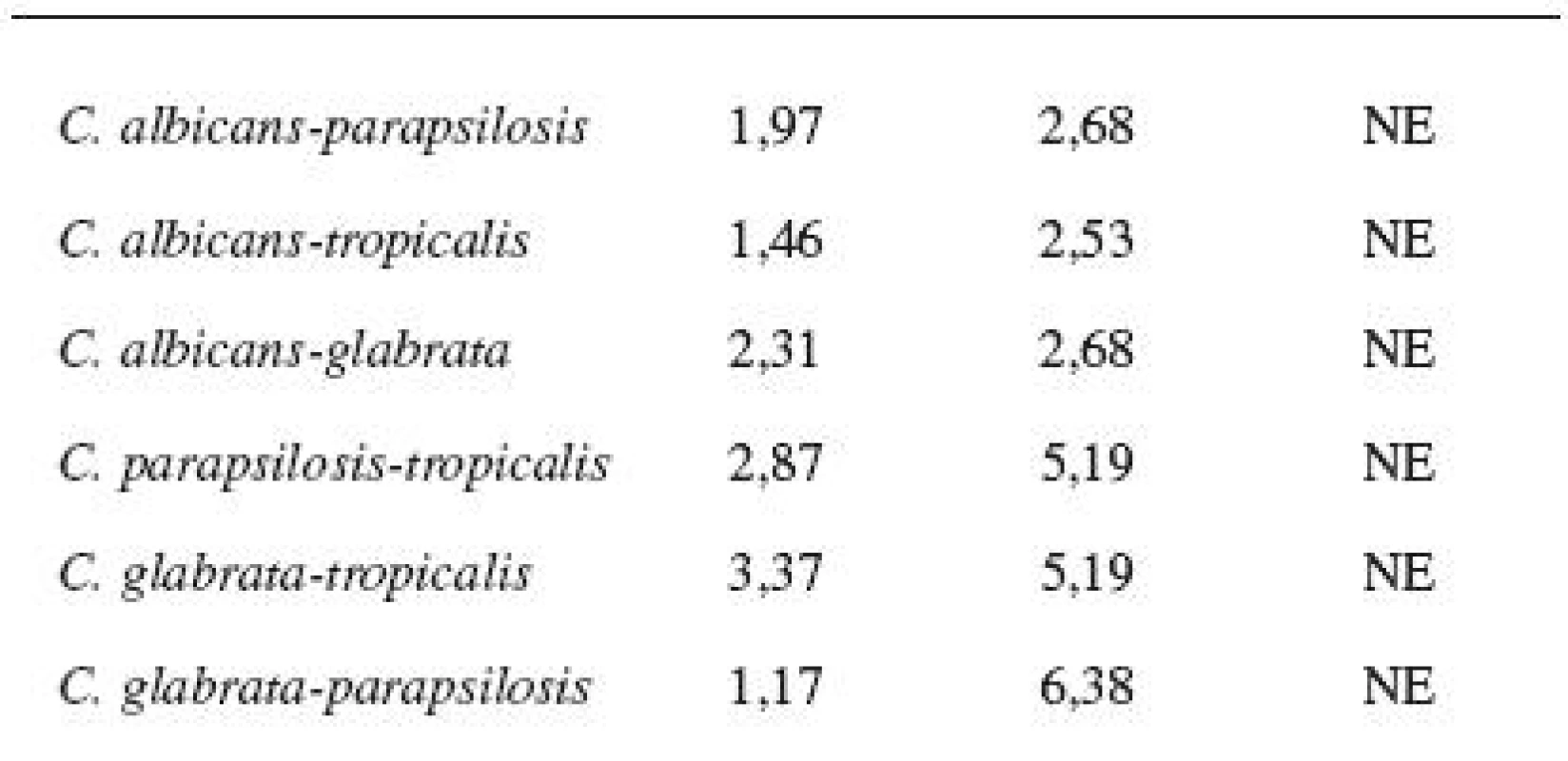
Tab. 6. Porovnání rozdílné citlivosti jednotlivých kmenů Candida (nepárový Studentův t-test) 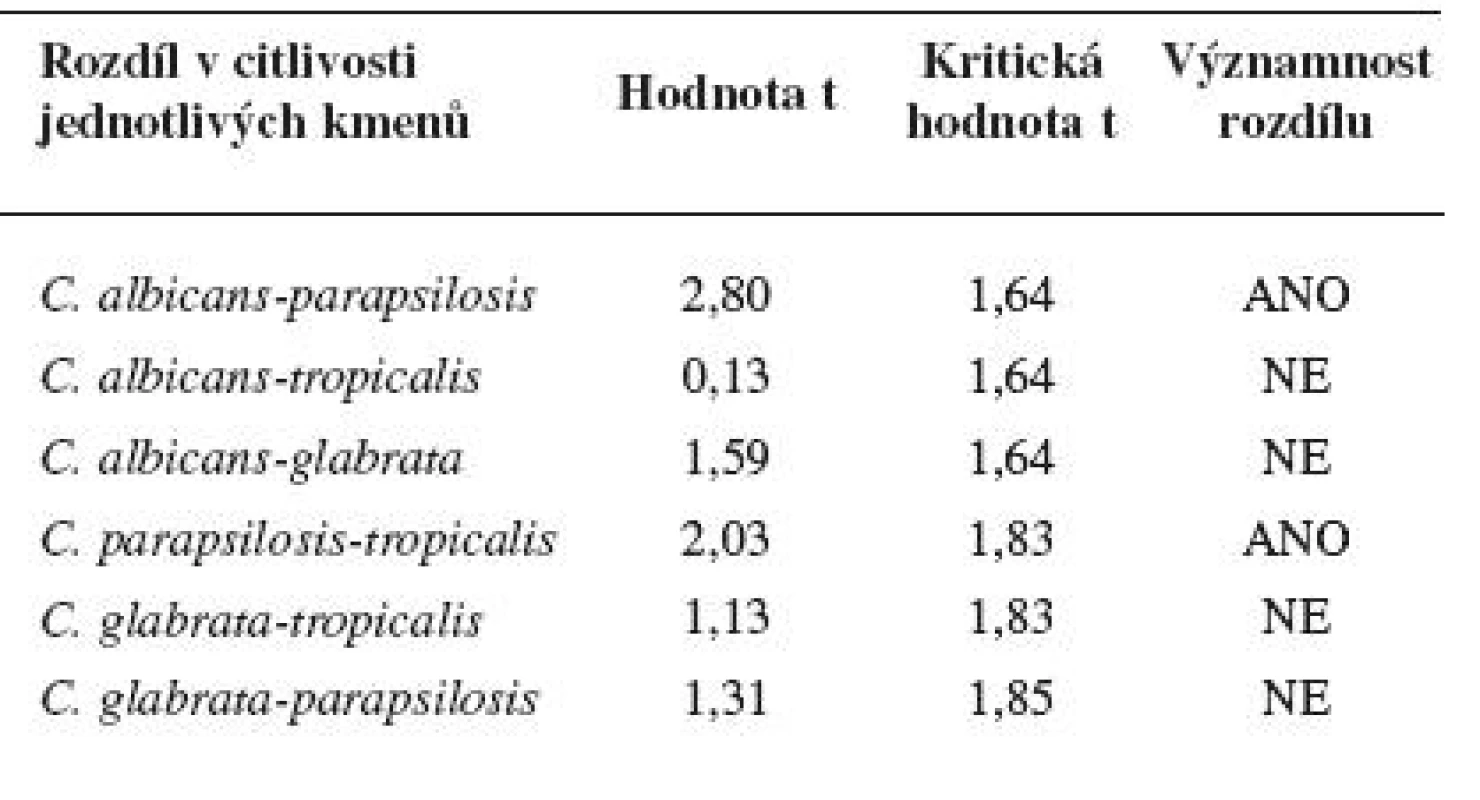
Obr. 5. Inhibiční zóny standardního disku s obsahem CP na izolovaných kvasinkách 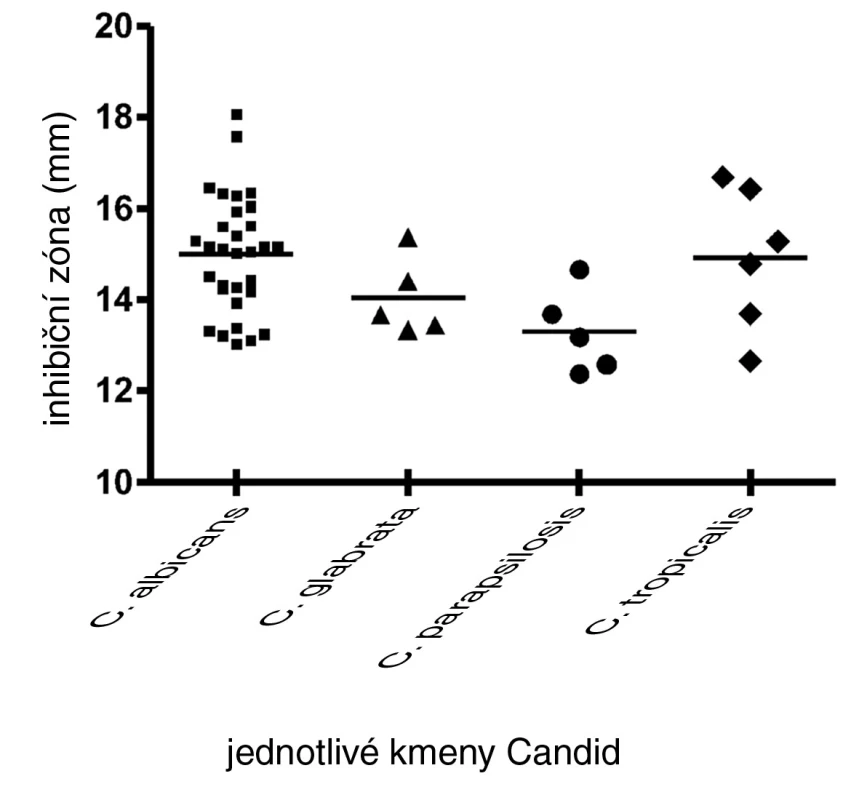
Na základě výsledků identifikace a stanovení MIC čtyř nejčastějších druhů Candid budou v následující fázi experimentu připraveny mukoadhezivní tablety pro lokální terapii kandidových infekcí dutiny ústní. Cílem této formulace je zajistit setrvání tablety na bukální sliznici po dobu 8–10 hodin a současně optimalizovat rychlost uvolňování léčiva z tablet tak, aby bylo po celou dobu jejich setrvání na sliznici zajištěno překročení MIC pro nejméně citlivý kmen kvasinek – Candida glabrata (minimálně 2 μg ciclopiroxolaminu/ml slin a rychlost uvolňování nejméně 0,24 mg za hodinu). Obsah léčivé látky v tabletě na základě zjištěných výsledků by měl být minimálně 2,5 mg. Je třeba však počítat s dostatečným koncentračním gradientem léčiva, který by zabezpečil jeho koncentraci trvale nad MIC po celou dobu působení lékové formy. Kromě denní produkce slin (120 ml/hod.30)) je třeba počítat s určitou ne nepodtatnou částí léčivé látky odstraněné s příjmem tekutin a potravy. Proto by se měl teoretický obsah ciclopiroxolaminu v tabletě pohybovat mezi 25 a 50 mg.
Závěr
Kultivací stěrů 536 pacientů na chromogenním agaru bylo zjištěno, že majoritní podíl na vzniku orálních kandidóz má kvasinka druhu Candida albicans. Ostatní tři identifikované druhy (C. tropicalis, C. glabrata, C. parapsilosis) se podílejí na rozvoji této infekce každá méně než 13 %. Moderní mikrodiluční metoda stanovení citlivosti jednotlivých kmenů kvasinek ukázala, že nejmenší citlivost na ciclopiroxolamin vykazuje kmen Candida glabrata (MIC ≥ 2 μg/ml). Tento údaj je důležitý pro formulaci lokálně antimykoticky působících mukoadhezivních tablet z důvodu optimalizace jejich disolučního profilu tak, aby po celou dobu setrvání tablety na bukální sliznici bylo dosaženo koncentrace léčiva ve slinách nad hladinou MIC pro sledované kvasinky.
Adresa pro korespondenci:
PharmDr. Jan Gajdziok
Ústav technologie léků FaF VFU Brno
Palackého 1–3, 612 42, Brno
e-mail: gajdziokj@vfu.cz
Zdroje
1. Dvořáčková, K.: Principy uvolňování léčiv z perorálních matricových tablet obsahujících hypromelosu. Chem. listy, 2009; 103, 66–72.
2. Dostálová, M., Rabišková, M.: Mukoadhezivní orální tablety – moderní léková forma s řízeným uvolňováním léčiva. Čes. slov. Farm., 2000; 2, 55–61.
3. Bajerová, M., Krejčová, K., Rabišková, M., Gajdziok, J., Masteiková, R.: Oxycellulose – significant characteristics in relation to its pharmaceutical and medici applications, Adv. Polym. Technol., 2009; 28, 199–208.
4. Niewerth, M., Kunze, D., Seibold, M.: Ciclopirox Olamine Treatment Affects the Expression Pattern of Candida albicans Genes Encoding Virulence Factors, Iron Metabolism Proteins, and Drug Resistance Factors. Antimicrob. Agents Chemother., 2003; 47, 1805–1817.
5. Český lékopis, Praha, Grada Publishing, 2005, 7348 s.
6. Hui, X., Wester, R. C., Barbadillo, S.: Ciclopirox Delivery into the Human Nail Plate. J. Pharm. Sci., 2004; 93, 2545–2548.
7. Martindale, The complete drug reference. In: Sweetman, S.C. eds., Pharmaceutical press, 2002; 33, 52-63.
8. Švihovec, J., Novotná, H.: Pharmindex Kompendium 2001. Český Těšín: MediMedia, 2001, 1802 s.
9. Gupta, A. K., Bluhm, R.: Ciclopirox (Loprox) gel for superficial fungal infections. Skin Ther. Lett., 2004; 9, 4–9.
10. Shilova, I. B., Guskova, T. A., Glushkov, R. G.: Modern drugs for treating dermatomycosis. Pharm. Chem. J., 2004; 38, 175–180.
11. Niewerth, M., Schiller, N.: Wirkungsweise von Ciclopiroxolamin auf Candida albicans. Mycoses, 2002; 45, 63–68.
12. Tarawneh, R. T., Imad, I.: Physicochemical studies on Ciclopiroxolamine complexes with divalent metal ions. Int. J. Pharm., 2005; 289, 179–187.
13. Polak, A., Jackel, A., Noack A.: Agar-Sublimations-Test zur In vitro-Bestimmung der antimykotischen Aktivität von Morpholin-Derivaten. Mycoses, 2004; 47, 184–192.
14. Cannon, R. D., Chaffin, W. L.: Oral colonization by Candida albicans. Crit. Rev. Oral. Biol. Med., 1999; 10, 359–383.
15. Cannon, R. D., Holmes, A. R., Mason, A. B., Monk, B. C.: Oral Candida: Clearance, Colonization, or Candidiasis? J. Dent. Result, 1995; 74, 1152–1161.
16. Figueiredo, V. T., Santos, D., Resende, M. A., Hamdan, J. S.: Identification and in vitro antifungal susceptibility testing of 200 clinical isolates of Candida spp. responsible for fingernail infection. Mycopathologia, 2007; 164, 27–33.
17. Jedličková, A.: Systémové mykózy. 1. vyd. Praha: Maxdorf 2006, 24–49.
18. Soysa, N. S., Samaranayake, L. P., Ellepola, A.: Antimicrobials as a contributory factor in oral candidosis – a brief overview. Oral Dis., 2008; 14, 138–143.
19. Haber, J.: Systémové mykózy a jejich léčba. Praha: Galén, 1995, 19–53.
20. http://www.ma.uni-heidelberg.de/inst/imh/myko_2/n_ myco1.html (20. 11. 2009).
21. Votava, M.: Lékařská mikrobiologie obecná. Praha: Neptun 2001, 163–164.
22. Karaca, N., Koc, N.: In vitro susceptibility testing of dermatohytes: comparison of disk diffusion and reference broth dilution methods. Diagn. Microbiol. Infect. Dis., 2004; 48, 259–264.
23. Messer, S. A., Diekema, D. J., Boyken, L., Tendolkar, S.: Activities of micafungin against 315 Invasive clinical isolates of fluconazole-resistant Candida spp. J. Clin. Microbiol., 2006; 44, 324–326.
24. Pfaller, M. A., Messer, S. A., Boyken, L.: In vitro activities of voriconazole, posaconazole, and fluconazole against 4,169 clinical isolates of Candida spp. and Cryptococcus neoformans collected during 2001 and 2002 in the ARTEMIS global antifungal surveillance program. Diagn. Microbiol. Infect. Dis., 2004; 48, 201–205.
25. Pfaller, M. A., Messer, S. A., Boyken, L., Rice, C., Tendolkar, S.: Use of fluconazole as a surrogate marker to predict susceptibility and resistance to voriconazole among 13,338 clinical isolates of Candida spp. tested by Clinical and Laboratory Standards Institute-Recommended broth microdilution methods. J. Clin. Microbiol., 2007; 45, 70–75.
26. Bille, J.: Biomic video reading of fluconazole agar disk diffusion susceptibility testing of Candida spp. Clinical izolates compared to NCCLS microbroth dilution. ICAAC poster J-120; S. Diego, CA, 1998.
27. Barry, A., Brown S.: Fluconazole Disk Diffusion Procedure for Determining Susceptibility of Candida Species. J. Clin. Microbiol., 1996; 34, 2154–2157.
28. Pfaller, M. A., Boyken, L., Messer, S. A., Tendolaker, S.: Comparison of results of voriconazol disk diffusion testing for Candida species with results from a Central Reference Laboratory in the ARTEMIS Global Antifungal Surveillance Program. J. Clin. Microbiol., 2005; 43, 5208–5213.
29. Pfaller, M. A., Hazen, K. C., Boyken, L., Messer, S. A., Tendolaker, S.: Comparison of results of fluconazol disk diffusion testing for Candida species with results from a Central Reference Laboratory in the ARTEMIS Global Antifungal Surveillance Program. J. Clin. Microbiol., 2004; 42, 3607–3612.
30. Shojaei, A. H.: Buccal mucosa as a route for systemic drug delivery: a review. Journal of Pharmacy and Pharmaceutical Sciences J. Pharm. Pharm. Sci., 1998; 1, 15–30.
Štítky
Farmácia Farmakológia
Článok vyšiel v časopiseČeská a slovenská farmacie

2010 Číslo 2-
Všetky články tohto čísla
- Výroba granulátů s obsahem silně účinných léčiv
- Studium lisovacího procesu a vlastností tablet ze dvou typů přímo lisovatelného sorbitolu
- Mikročástice na bázi oxycelulosy – vliv procesních proměnných na enkapsulační účinnost
- Zavedení radiofrekvenční identifikace (RFID) do procesu přípravy a aplikace léčiv – 2. část
- Identifikace a stanovení citlivosti kvasinek rodu Candida vzhledem k optimalizaci uvolňování ciclopiroxolaminu z mukoadhezivních orálních tablet
- Ze zasedání Výboru České farmaceutické společnosti
- Léčivé přípravky v českých lékárnách na konci 17. století
- 7. světový kongres farmaceutické technologie
- Doc. RNDr. Otto HELIA, CSc. – 70-ročný
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Identifikace a stanovení citlivosti kvasinek rodu Candida vzhledem k optimalizaci uvolňování ciclopiroxolaminu z mukoadhezivních orálních tablet
- Výroba granulátů s obsahem silně účinných léčiv
- Léčivé přípravky v českých lékárnách na konci 17. století
- Mikročástice na bázi oxycelulosy – vliv procesních proměnných na enkapsulační účinnost
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



