-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Inhibítory gamma-sekretázy v terapii Alzheimerovej choroby
Gamma-secretase inhibitors in Alzheimer’s disease therapy
Neuritic plaques, which are situated in the brain of Alzheimer’s disease (AD) patients, are composed mainly of peptides containing 40 or 42 amino acid residues known as ß-amyloid plaques (Aß). The Aß peptide is the result of the enzymatic cleavage of the amyloid precursor protein (APP). In the so-called amyloidogenic pathway, the ß-secretase enzyme releases a protein fragment (C99), which is subsequently metabolized by the enzyme γ-secretase. Monomer forms of Aß are turned into oligomer forms, which are the main cause of cellular neuronal death in AD patients. The following study is focused on γ-secretase inhibitors that can slow down the production or accumulation of pathologic Aß deposits. γ secretase inhibitors that reached different phases of clinical trials are particularly reported as well as other promising groups of these analogues.
Keywords:
Alzheimer’s disease, beta amyloid, secretase, inhibitor
Autoři: Katarína Špilovská; Jan Korábečný; Kamil Kuča; Kamil Musílek
Vyšlo v časopise: Čes. slov. Farm., 2012; 61, 93-100
Kategorie: Přehledy a odborná sdělení
Souhrn
Amyloidné plaky, ktoré sa nachádzajú v mozgu pacientov s Alzheimerovou chorobou (AD) sú zložené prevažne z peptidu so 40 alebo 42 aminokyselinovými zvyškami a sú označované ako beta-amyloidné plaky (Aß). Aß peptidy sú výsledkom enzymatického štiepenia beta amyloidného prekurzorového proteínu (APP). V tzv. amyloidogénnej ceste sa tohto štiepenia zúčastňuje enzým ß-sekretáza, ktorý poskytuje proteínový fragment (C99) a ten je následne metabolizovaný za účasti ďalšieho enzýmu γ-sekretázy. Z monomérnych jednotiek vzniknutého Aß vznikajú v ďalšej fáze oligomérne formy, ktoré sú príčinou smrti neuronálných buniek u pacientov s AD. Predkladaná práca je zameraná na inhibítory γ-sekretázy, ktoré tak môžu pozastaviť tvorbu a ukladanie patologických depozít Aß. Podrobne sú popísané inhibítory γ-sekretázy, ktoré dosiahli klinické štúdie, a taktiež sú predstavené ďalšie zaujímavé skupiny týchto zlúčenín.
Kľúčové slová:
Alzheimerova choroba, beta amyloid, sekretáza, inhibítorAlzheimerova choroba
Alzheimerova choroba (AD – Alzheimer’s disease) je neurodegeneratívne ochorenie charakterizované stratou kognitívnych funkcií a je sprevádzané zmenami v správaní. Je to najbežnejší typ demencie u starších ľudí. Pri veku nad 85 rokov trpí štatisticky jeden z dvoch ľudí AD. V roku 2000 malo okolo 5 miliónov ľudí AD na celom svete, napriek tomu väčšiny neboli diagnostikované a liečené. Do roku 2050 by sa mal počet ľudí trpiacich na AD v USA zvýšiť na 13 miliónov1).
Demencia je spôsobená degeneráciou neurónov v mozgovej kôre. Neuropatologické zmeny spájané s AD zahrňujú objavenie amyloidných plakov a neurofibrilárnych spletencov. Hlavnou zložkou amyloidných plakov je malý peptid (beta-amyloid; Aß), ktorý vzniká proteolytickým štiepením z ß-amyloidného prekurzorového proteínu (ß-APP) prostredníctvom aspartyl-proteázových enzýmov ß - a γ-sekretázy.
Aß je vo svojej monomérnej forme zložený zo 40 - alebo 42-aminokyselinového peptidu, ktorý spôsobuje atrofiu neurónov pri AD2, 3).
γ-sekretáza sprostredkuje aj vnútromolekulové štiepenie viacerých transmembránových proteínov. Spomedzi známych substrátov γ-sekretázy je významný Notch receptor. Proteolýzou je uvoľňovaná intracelulárna časť Notch receptora, známa ako intracelulárna Notch doména (NICD; z angl. Notch Intracellular Domain). NICD sa premiestňuje do jadra a je aktivátorom viacerých signálov pre transdukciu. Zistilo sa, že inhibítory γ-sekretázy, ktoré neovplyvňujú Notch, pôsobia v gastrointestinálnych a T bunkách a sú považované za terapeuticky významné. Za selektívne inhibítory γ-sekretázy považujeme také zlúčeniny, ktoré vykazujú viac ako 15-násobnú selektivitu pre inhibíciu APP voči Notch4).
Biochemická a genetická charakteristika γ-sekretázy
Dva enzýmy sa zúčastňujú uvoľňovania Aß z ß-APP. Sú to proteolytické enzýmy ß - a γ-sekretáza. Najprv dochádza ku štiepeniu N konca ß-sekretázou z ß-APP za uvoľnenia časti Aß označovanej ako C99, a potom dochádza ku štiepeniu C-konca γ-sekretázou. ß-sekretáza, označovaná aj ako BACE (z angl. ß-site cleaving enzyme), bola identifikovaná prostredníctvom biochemických a genetických metód ako aspartyl proteáza (Asp 2), čo je transmembránový proteín typu 1 kódovaný génom BACE1. γ sekretáza sa zúčastňuje proteolytického štiepenia C koncov Aß molekúl v oblasti ß-APP (obr. 1).
Obr. 1. ß-amyloidný prekurzorový proteín (ß-APP)<sup>5)</sup> 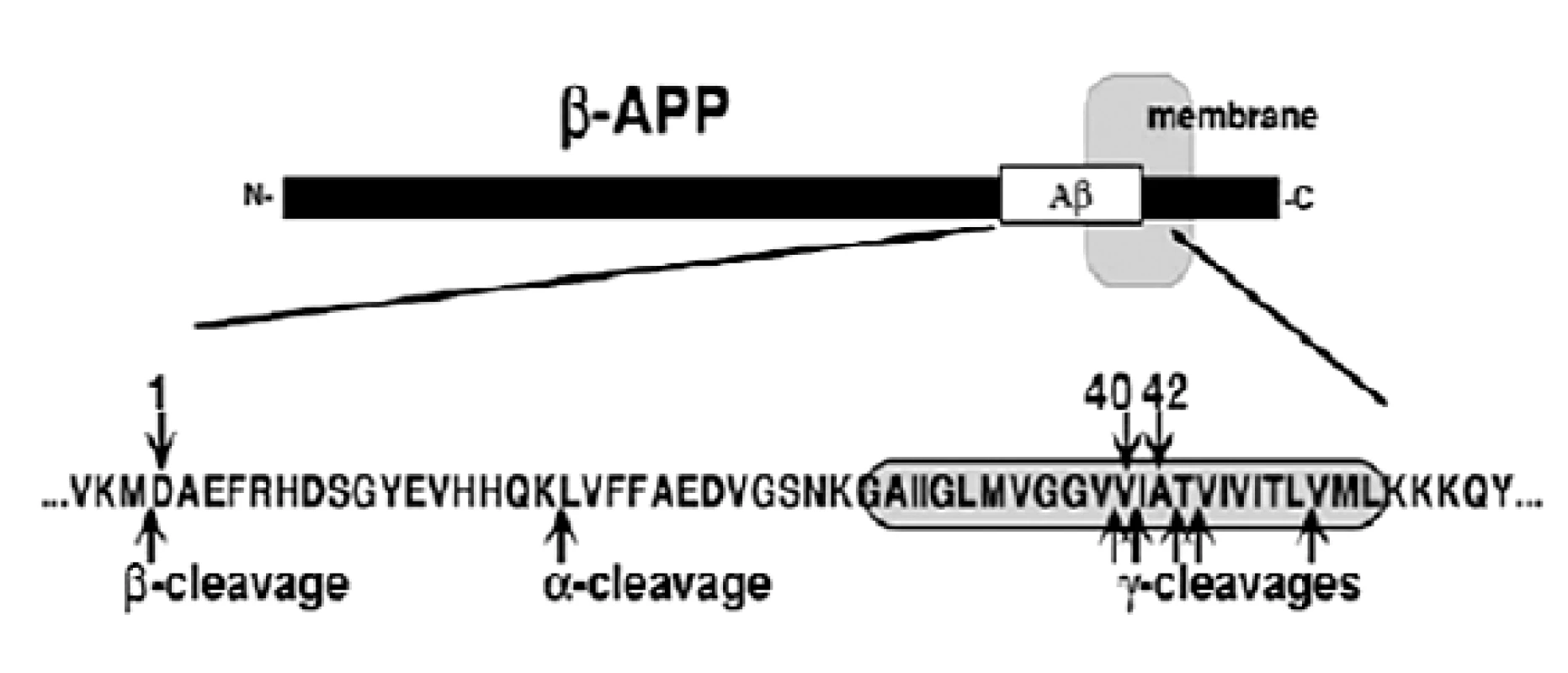
Na obrázku 1 je znázornený transmembránový proteín typu 1 zložený z 695-770 aminokyselín, ktoré sú kódované génmi na chromozóme 21. Oblasť molekuly vložená do membrány je zobrazená šedou. N-koniec z ß-APP je vylučovaný z buniek na základe štiepenia v α - alebo ß - mieste. Metaloproteázy ako napríklad ADAM-10 (z angl. A disintegrin and mettaloprotease) alebo TACE (z angl. TNF α-converting enzyme) sa štiepia na α-strane. Metaloproteázy sú proteolytické enzýmy obsahujúce kov. BACE sa zúčastňujú štiepenia na ß-strane. Produkty na C-konci, ktoré obsahujú celý alebo časť Aß peptidu a cytoplazmatický chvost, zostávajú v membráne a sú substrátmi pre γ-sekretázu. Hlavným miestom štiepenia sa zdá byť Val40, no boli objavené aj ďalšie strihy po Ala42, Thr43, Val39 a Leu49. Jedenásť odlišných mutácií nachádzajúcich sa blízko α-, ß - a γ - štiepiacich miestach spôsobujú patogenézu5).
γ-sekretáza je tvorená najmenej štyrmi proteínmi: presenilín (PS), nikastrín, anterior pharynx (Aph-1) a presenilín enhancer (Pen-2) (obr. 2). Presenilíny majú patofyziologický význam, pretože viac ako 150 autozomálnych dominantných mutácií je známych v týchto proteínoch, z ktorých všetky spôsobujú ranné štádium AD. Tieto mutácie majú za následok zvýšenú produkciu Aß1–42. Inhibícia presenilínu pomocou enzymatického komplexu γ-sekretázy sa zdá byť vhodnou stratégiou proti hromadeniu Aß v mozgu u pacientov s AD6). Avšak γ-sekretáza štiepi aj mnohé iné dôležité substráty než len ß-APP, z čoho vyplývajú aj možné nežiadúce účinky inhibítorov γ-sekretázy7).
Obr. 2. Proces štiepenia ß-APP (vľavo), γ-sekretázový komplex (vpravo)<sup>8)</sup> 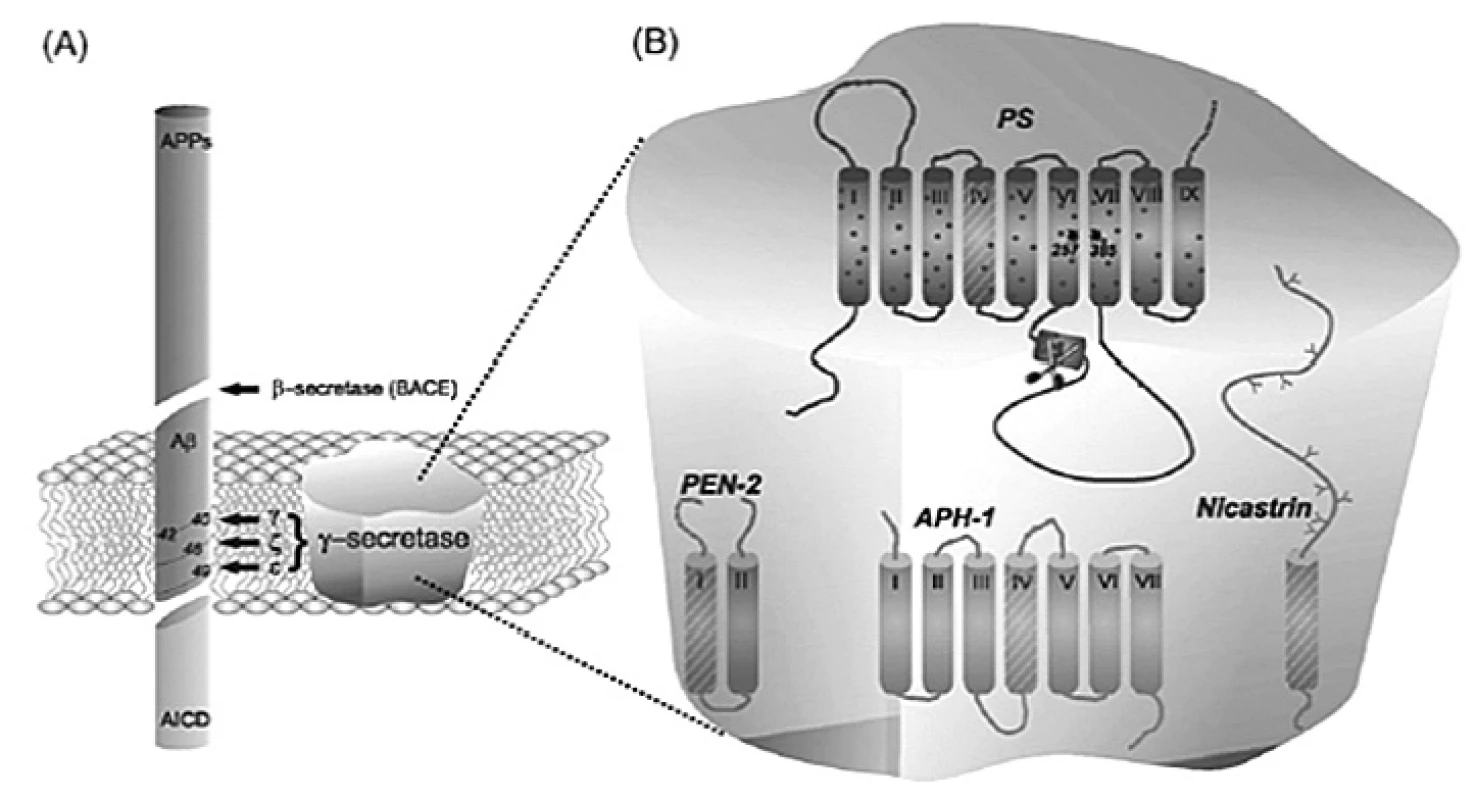
Obrázok vľavo predstavuje proces štiepenia ß-APP amyloidnou cestou. ß-sekretáza (BACE) uvoľňuje rozpustný proteínový fragment APPs (z angl. soluble APP) a následne γ-sekretáza uvoľňuje amyloidné peptidy Aß40 a Aß42. Na obrázku vpravo sú znázornené zložky γ-sekretázového komplexu8).
Zloženie γ-sekretázového komplexu
Presenilín
Presenilín-1 (PS-1) a presenilín-2 (PS-2) obsahujú katalytickú doménu. Ide o 476 - a 448-aminokyselinové proteíny, ktoré pozostávajú z 9 transmembránových domén (TMDs). Tieto domény sú endoproteolyticky štiepené na Aß molekuly z ß-APP, ktoré majú N - a C-konce. Každý z týchto koncov obsahuje aspartátové aktívne miesto. Štiepenie nastáva v cytoplazme medzi TMD6 a TMD7 vnútri krátkej hydrofóbnej domény, ktorá sa nachádza v membráne. Táto endoproteolýza predstavuje autoproteolytický jav9).
Nikastrín
Nikastrín bol objavený biochemicky afinitnou chromatografiou ako hlavný PS-interagujúci proteín. Je to 709-aminokyselinový glykoproteín typu 1 s veľkou ektodoménou, ktorá môže pôsobiť ako substrátový receptor γ-sekretázy. Existuje hypotéza, že voľný N-koniec substrátu γ-sekretázy sa ako prvý viaže na ektodoménu nikastrínu. Potom interaguje so spojovacím miestom presenilínu a premiestňuje sa do aktívneho miesta PS, kde je štiepený9).
Aph-1 a Pen-2
Aph-1 proteíny majú 7 TMDs s N - a C-koncami smerom k lumenu a cytozólu. Jeho úloha v aktivite γ-sekretázy nie je celkom jasná, ale je to najstabilnejšia zložka komplexu a mohla by s najväčšou pravdepodobnosťou slúžiť ako počiatok pre zhromaždenie tohto enzýmu. U ľudí existujú dva Aph-1 gény, Aph-1a a Aph-1b10). Pri génovej duplikácii hlodavcov z Aph-1b bol stanovený tretí gén, a to Aph-1c, ktorý vykazuje 96% podobnosť s Aph-1b na úrovni nukleotidov.
Pen-2 je najmenší membránový proteín γ-sekretázy s dvoma TMDs. Jeho úlohou je stabilizácia PS v γ-sekretázovom komplexe9).
Inhibítory γ-sekretázy v klinickom vývoji
γ-sekretáza je racionálny cieľ pre liečbu AD, lebo reguluje posledný krok pri vzniku a uvoľňovaní Aß. Doteraz bolo objavených niekoľko účinných inhibítorov tohto proteolytického komplexu. Štúdiá u transgénnych a netransgénnych zvierat naznačili, že inhibítory γ-sekretázy podané orálne alebo parenterálne sú schopné znižovať mozgovú hladinu Aß11).
Šesť zlúčenín (LY-450139, MK-0752, BMS-708163, PF-3084014, GSI-953 a ELND-006), ktoré sa nachádzajú v rôznych štádiách klinického testovania, je aktívne študovaných na ľuďoch s AD. Je charakterizovaný ich farmakodynamický profil, nielen podľa merania hladiny Aß v plazme a CSF v čase po podaní, ale aj stanovením účinnosti týchto zlúčenín na Aß9).
Historicky prvým inhibítorom γ-sekretázy, ktorý sa dostal do klinického testovania bol BMS-299897. Táto zlúčenina bola pripravená v biofarmaceutickej spoločnosti Bristol-Myers Squibb. Testovanie na ľuďoch začalo v roku 2001, ale klinické údaje neboli nikdy úplne publikované. Kvôli dlhotrvajúcim nedostatkom informácií v klinickom vývoji bolo testovanie ukončené12).
Najmenej 6 ďalších inhibítorov γ-sekretázy sa dostalo do klinického testovania. Ide o zlúčeniny s označením LY-450139, MK-0752, BMS-708163, PF-3084014, GSI-953 a ELND-006. Iba pre zlúčeninu LY-450139 boli klinické údaje úplne publikované (obr. 3)9).
Obr. 3. Inhibítory γ-sekretázy 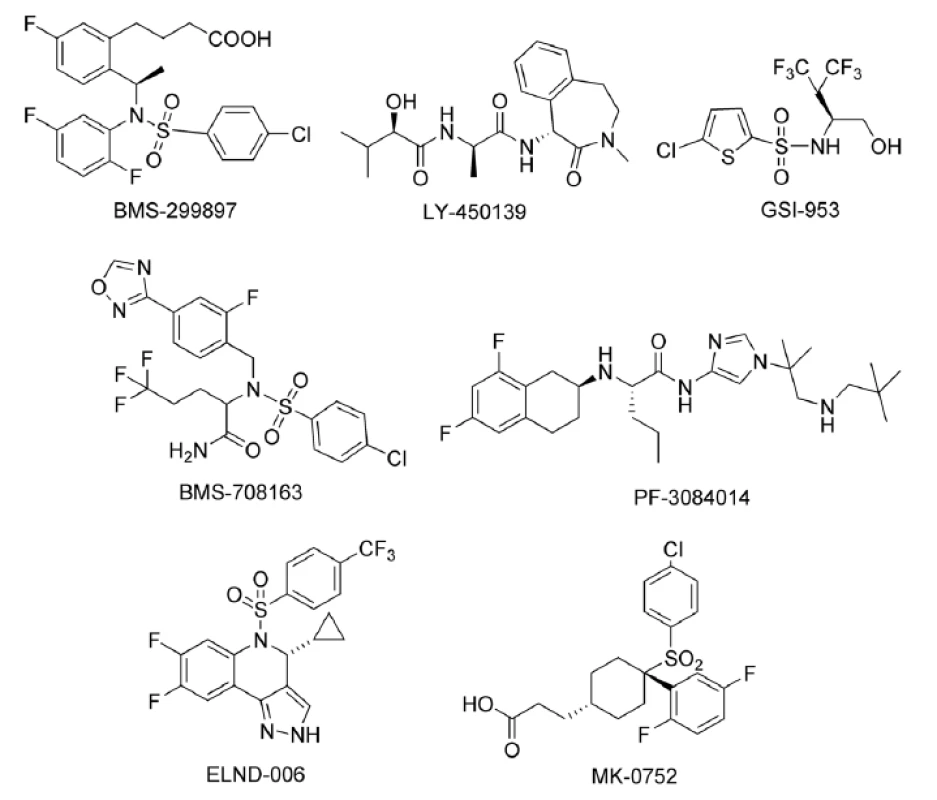
LY-450139 (Semagacestat)
Benzoazepinónový derivát LY-450139 je inhibítor γ sekretázy vyvinutý v spoločnosti Eli-Lilly. Je trojnásobne selektívny pri inhibícii štiepenia APP s ohľadom na Notch štiepenie (APP: IC50 = 15 nM, Notch: EC50 = 49 nM). IC50 je koncentrácia inhibítora, pri ktorej je inhibovaných 50 % enzýmu. EC50 označuje strednú efektívnu koncentráciu potrebnú na dosiahnutie 50% efektu. Ide o najlepšie zdokumentovaný inhibítor γ-sekretázy, ktorý dosiahol klinické testovanie (fáza I, II, III)13).
Pri testovaní na zvieratách bol u LY-450139 zistený vplyv na hladinu Aß v mozgu, CSF a plazme. Dobre pozorovaný bol predovšetkým u transgénnych a netransgénnych myší, morčiat a psoch. Liečivo však zlyhalo pri transgénnych myšiach. Bola u nich zistená neurotoxicita. K dispozícii nie sú ani žiadne údaje o behaviorálnych pochodoch u zvierat pri použití LY-45013914).
LY-450139 efektívne znižuje hladinu Aß v CSF u zdravých ľudí. Tento inhibítor dosiahol fázu III klinického testovania. Kvôli zhoršeným kognitívnym funkciám a zvyšovaniu výskytu rakoviny kože u ľudí trpiacich AD bolo testovanie prerušené15).
MK-0752
Spoločnosť Merck vyvinula inhibítor γ-sekretázy nesúci označenie MK-0752, ktorý je neselektívny k APP a Notch. Toto liečivo znižovalo hladinu Aß1–40 v CSF u zdravých dobrovoľníkov. Nevýhodou bolo inhibovanie Notch štiepenia a značná gastrointestinálna toxicita. Tento inhibítor dosiahol fázu I klinického testovania, no testovanie na AD bolo pozastavené16).
BMS-708163
Benzénový sulfonamid BMS-708163, v ktorom je oxadiazolylbenzylová skupina pripojená k sulfonamidovému dusíku, je účinný inhibítor γ-sekretázy vyvinutý v Bristol-Myers Squibb. In vitro testovania ukázali, že liečivo má 193-násobnú selektivitu k Notch štiepeniu (Aß1–40: IC50 = 0,3 nM a Notch: EC50 = 58 nM). Štúdie u potkanov ukázali znižovanie amyloidu Aß1–40 v mozgu a CSF bez Notch-súvisiacej gastrointestinálnej toxicity. Štúdie u psov preukázali znižovanie Aß1–40 hladiny v mozgu a CSF. Po perorálnom podaní došlo k znižovaniu hladín Aß o 75 % v CSF a 50 % v kortexe v priebehu 24 hodín. U zdravých dobrovoľníkov bolo pozorované znižovanie Aß hladiny v CSF. V súvislosti s týmto inhibítorom je však nedostatok údajov o ukladaní Aß plakov v mozku u transgénnych myší, ako aj o ich behaviorálnych pochodoch. Ľudia trpiaci AD vykazovali zlú toleranciu na liečivo obsahujúce túto látku. BMS-708163 dosiahol fázu I-klinického testovania, v súčasnosti prebieha II. fáza17).
PF-3084014
Nový aminotetralínový derivát PF-3084014 vyvinutý firmou Pfizer je účinný inhibítor γ-sekretázy, bez vplyvu na Notch. In vitro je to nekompetitívny, reverzibilný inhibítor γ-sekretázy s IC50 = 6,2 nM18). V tkanivových kultúrach je hodnota IC50 = 1915 nM a javí sa ako slabý inhibítor voči Notch. Výhodou je dobrý prienik cez hematoencefalickú bariéru, dlhotrvajúci efekt na redukcii hladiny Aß u zvierat a žiadny rebound fenomén pre plazmatický amyloid Aß. Podobne ako pri BSM-708163 je aj pre tento inhibítor nedostatok údajov o ukladaní Aß plakov v mozgu u transgénnych myší, ako aj o ich behaviorálnych pochodoch. Testovanie tohto inhibítora na AD bolo tiež prerušené.
GSI-953 (Begacestat)
Tiofénový sulfonamid je účinný inhibítor γ-sekretázy vyvinutý firmou WEYTH. Inhibuje produkciu Aß a jeho inhibičná koncentračná účinnosť sa prejavuje in vitro (IC50 = 8 nM) aj in vivo (Aß1–42: IC50 = 15 nM)19). Bunkové štúdie Notch štiepenia ukázali, že táto zlúčenina je 17-násobne selektívna pre inhibíciu štiepenia APP. (Notch EC50 = 208,5 nM). Pri Tg2576 myšiach spôsobili vysoké dávky zníženie Aß1–40 hladiny v mozgu (60% inhibícia), v CSF (90% inhibícia) a v plazme. Nižším dávkovaním sa tieto hladiny zredukovali len v mozgu a plazme. GSI-953 zlepšuje pamäť u transgénnych myší, no neznižuje Aß1–40 hladinu v CSF u ľudí s AD. Toto liečivo je v druhej fáze klinického testovania.
ELND-006
Je to inhibítor γ-sekretázy vyrobený spoločnosťou Elan Pharmaceuticals. U bunkových a enzymatických štúdiách ukazuje ELND-006 selektivitu pre APP, inhibíciu APP a štiepenie Notch s IC50 = 0.34 a 5,3 nM20). Výhodou tejto látky je to, že je bez Notch vplyvu, má dobrú mozgovú priechodnosť a znižuje hladiny Aß v mozgu u transgénnych myší. Nevýhodou je rebound fenomén v plazme u zvierat a nedostatok údajov o behaviorálnych pochodoch u AD modeloch zvierat. ELND 006 sa v súčasnosti nachádza v prvej fáze klinického testovania.
Vývoj ďalších potenciálne účinných inhibítorov γ sekretázy
K ďalším zaujímavým inhibítorom γ-sekretázy patria tricyklické sulfóny21). Ich inhibičná aktivita bola skúmaná in vitro stanovením agregácie Aß40 a niektoré deriváty boli vybrané pre in vivo testy na myšiach22, 23). Štruktúry tricyklických sulfónov, ktoré vykazovali najlepšiu aktivitu, sú znázornené na obrázku 4 a ich príslušné hodnoty IC50 sú zhrnuté v tabuľke 1.
Obr. 4. Tricyklické sulfóny ako inhibítory γ-sekretázy 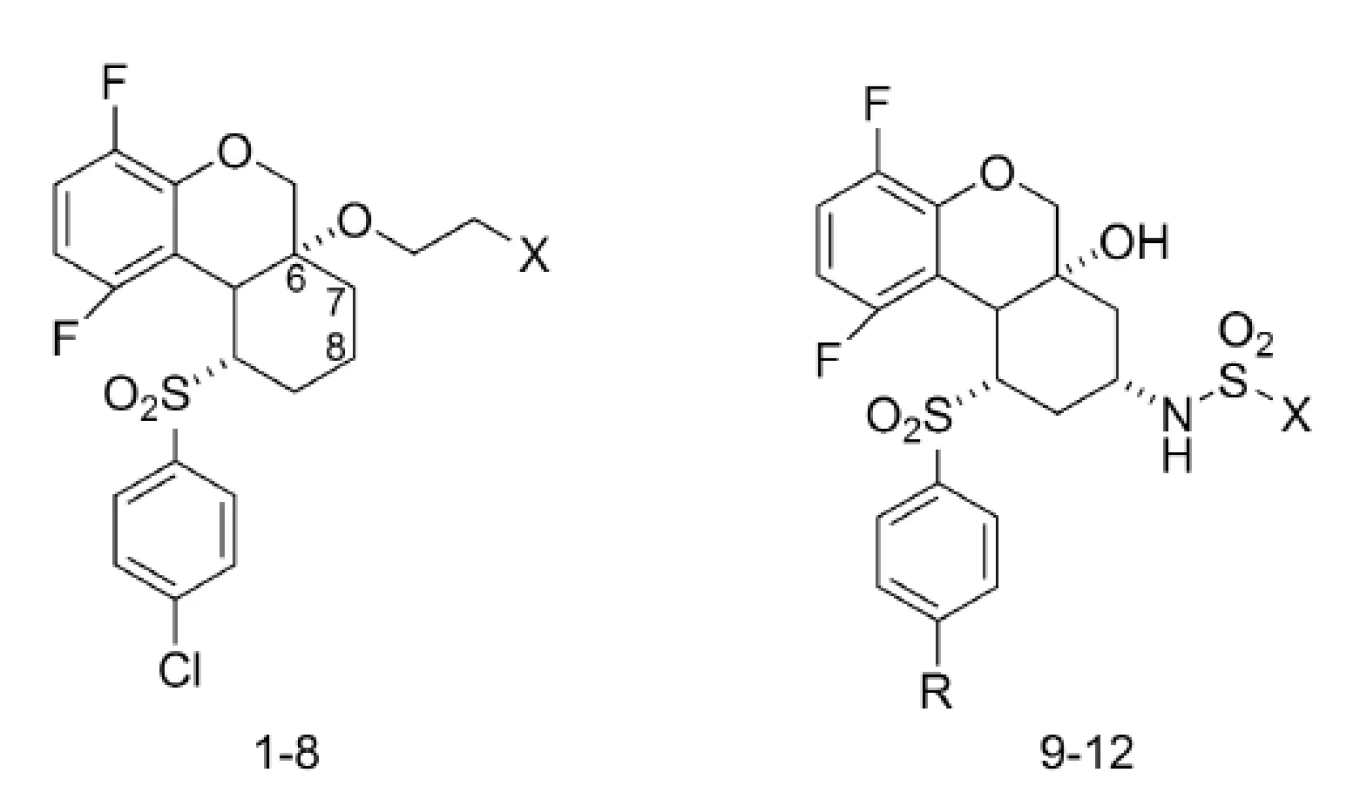
Tab. 1. Deriváty tricyklických sulfónov a ich inhibičné aktivity<sup>21)</sup> 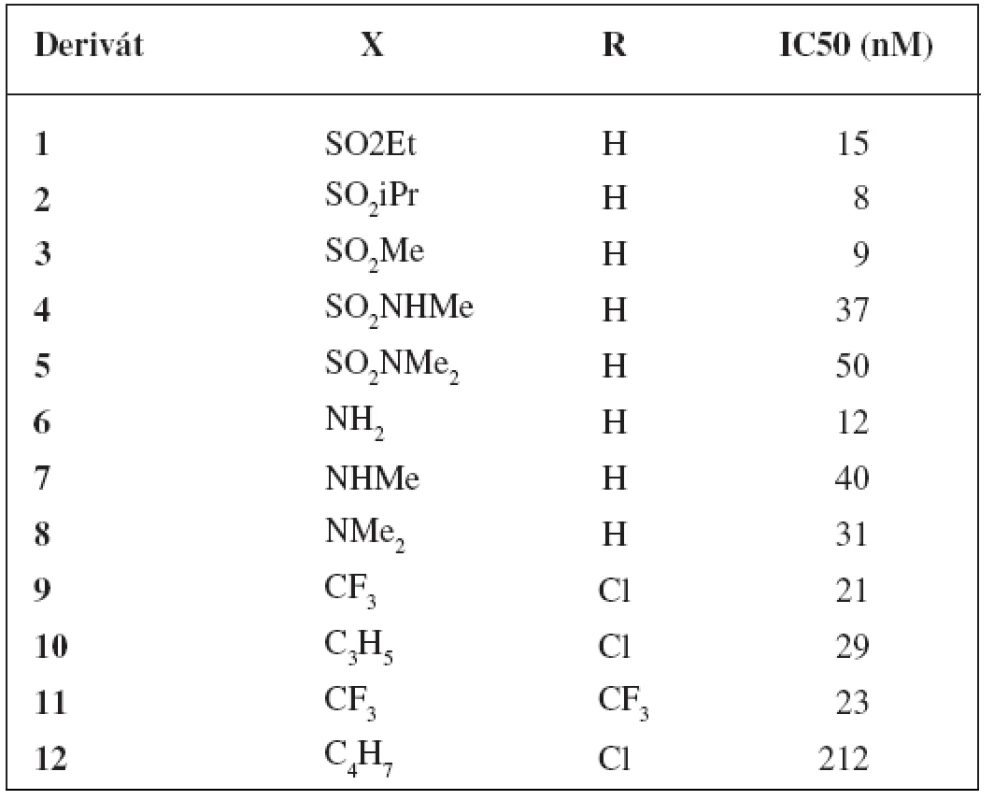
Pozoruhodné hodnoty IC50 vykazovali tricyklické sulfóny, ktoré mali naviazané substituenty v polohe C-6 alebo išlo o kombináciu hydroxy skupiny na uhlíku 6 a sulfonamidovej skupiny na uhlíku 8.
Z derivátov, ktoré mali naviazané substituenty v polohe C-6 boli najúčinnejšie deriváty 1–8 s hodnotami IC50 v rozmedzí 8–50 nM. Pri porovnaní týchto analógov sa zistilo, že sulfonamidové analógy 4 a 5 boli 5-násobne menej aktívne než ich sulfónové analógy 1–3. Aj aminoskupina má významú úlohu pre aktivitu. Primárny amín 6 mal IC50 = 12 nM, no sekundárny amín 7 a terciárny amín 8 boli 3-násobne menej aktívne.
Pri použití kombinácie hydroxy skupiny na uhlíku 6 a sulfonamidovej skupiny na uhlíku 8 bola pripravená séria tricyklických sulfónov, z ktorých 3 látky vykazovali hodnoty IC50 v nanomolárnej koncentrácii. Ide o deriváty 9 (IC50 = 21 nM), 10 (IC50 = 29 nM) a 11 (IC50 = 23 nM). Zistilo sa, že nahradením cyklopropylsulfonamidu u látky 10 za cyklobutylsulfonamid u látky 12 dôjde k 7-násobnému poklesu inhibičnej aktivity.
Aj napriek dobrým hodnotám IC50 u analógov substituovaných v polohe C-6, tieto neboli testované in vivo na myšiach. Zaujímavá kombinácia hydroxy skupiny na C 6 a sulfonamidovej skupiny na C-8 poskytla deriváty, ktoré boli vybrané pre in vivo testovanie. Výsledky sú znázornené v tabuľke 2. Najlepšie výsledky vykazovala molekula 10, ktorá inhibovala 77 % hladiny Aß40 v plazme a 71% hladiny Aß40 v kortexe 3 hodiny po orálnom aplikovaní myšiam (30 mg/kg) (tab. 2).
Tab. 2. Hodnoty inhibičných aktivít pri in vitro a in vivo testovaní<sup>21)</sup> 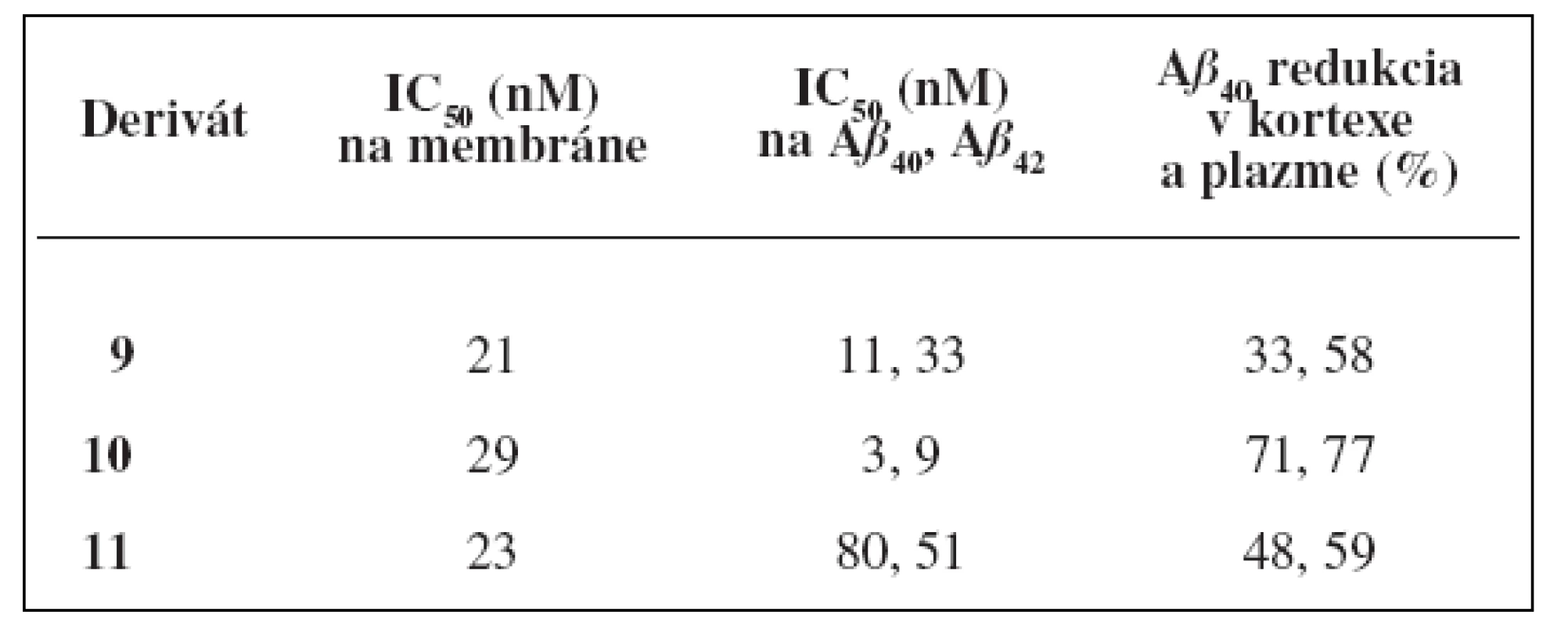
Ďalšiu skupinu nových inhibítorov γ-sekretázy predstavujú [3.3.1] bicyklické sulfonamidové pyrazoly24). Na obrázku 5 sú znázornené bicyklické sulfonamidové pyrazoly, ktoré vykazujú vysokú účinnosť, dobrú APP/Notch selektivitu a sú metabolicky stabilné. Hodnoty IC50, APP/Notch selektivita aj metabolická stabilita sú znázornené v tabuľke 3.
Obr. 5. Bicyklické sulfonamidové pyrazoly 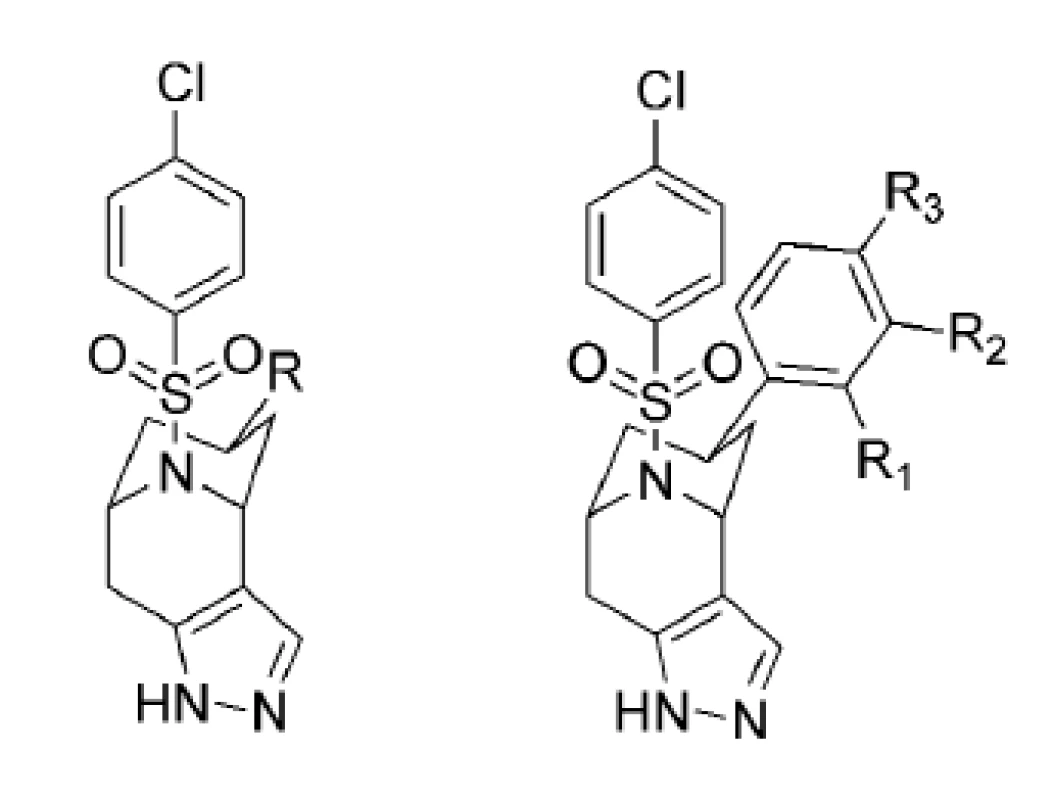
Tab. 3. Hodnoty IC<sub>50</sub>, APP/Notch selektivita a metabolická stabilita derivátov 13–20<sup>24)</sup> 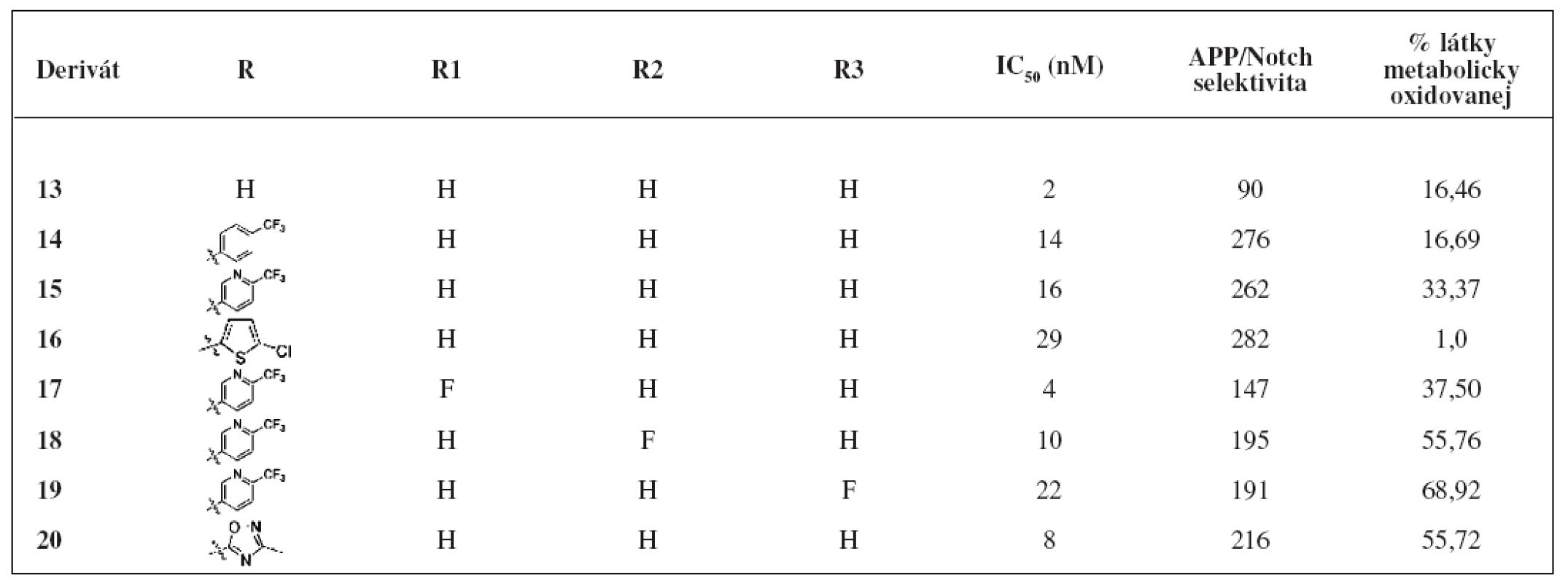
Jedným z derivátov, ktoré vykazujú vysokú in vitro účinnosť aj primeranú APP/Notch selektivitu je derivát 13. V in vivo testoch u myší dokázal zredukovať 36 % hladiny Aß40 v kortexe25). Testy in vivo s použitím potkaních a ľudských mikrozómov z pečene poukázali na metabolickú stabilitu tohto derivátu26).
Zavedenie lipofilnej elektronakceptornej skupiny v para polohe sulfonamidu poskytlo 3 deriváty bicyklických pyrazolov (14–16)27). Začlenenie fluóru na uhlík 6 fenylového jadra zohráva dôležitú úlohu pri aktivite resp. stabilite. Deriváty 17 a 18 majú vysoké hodnoty IC50 aj dobrú metabolickú stabilitu, no mierny pokles APP/Notch selektivity. Derivát 19 je najlepšou kombináciou účinnosti, oxidačnej stability aj APP/Notch selektivity.
U látky 20, pri ktorej bol do polohy 6 naviazaný heteroarylový substituent, bola zistená dobrá stabilita, účinnosť aj selektivita. Táto látka spolu s analógom 19 boli testované in vivo u myší. Zvieratám sa podávala perorálne dávka 10 mg/kg. Po 3 hodinách sa u látky 19 zistila 21% redukcia Aß40 a u látky 20 3% redukcia Aß40 v kortexe.
Do série ďalších potenciálne účinných inhibítorov γ sekretázy patria diamido-amino imidazoly28). DAPT (N-[N-(3,5-difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester), aktívny inhibítor γ-sekretázy, je zaujímavý pre svoju dobrú inhibičnú aktivitu (0,02 μM) a nízku molekulovú hmotnosť29). Na základe farmakokinetických vlastností sa však zistilo, že jeho terc-butyl esterová skupina je potenciálne nestabilná. Z tohto dôvodu boli pripravené nové deriváty DAPT, pri ktorých sa nahradila esterová skupina inými funkčnými skupinami. Ide o sériu inhibítorov, ktoré obsahujú ß amín na imidazole (obr. 6).
Obr. 6. Diamido-amino imidazoly 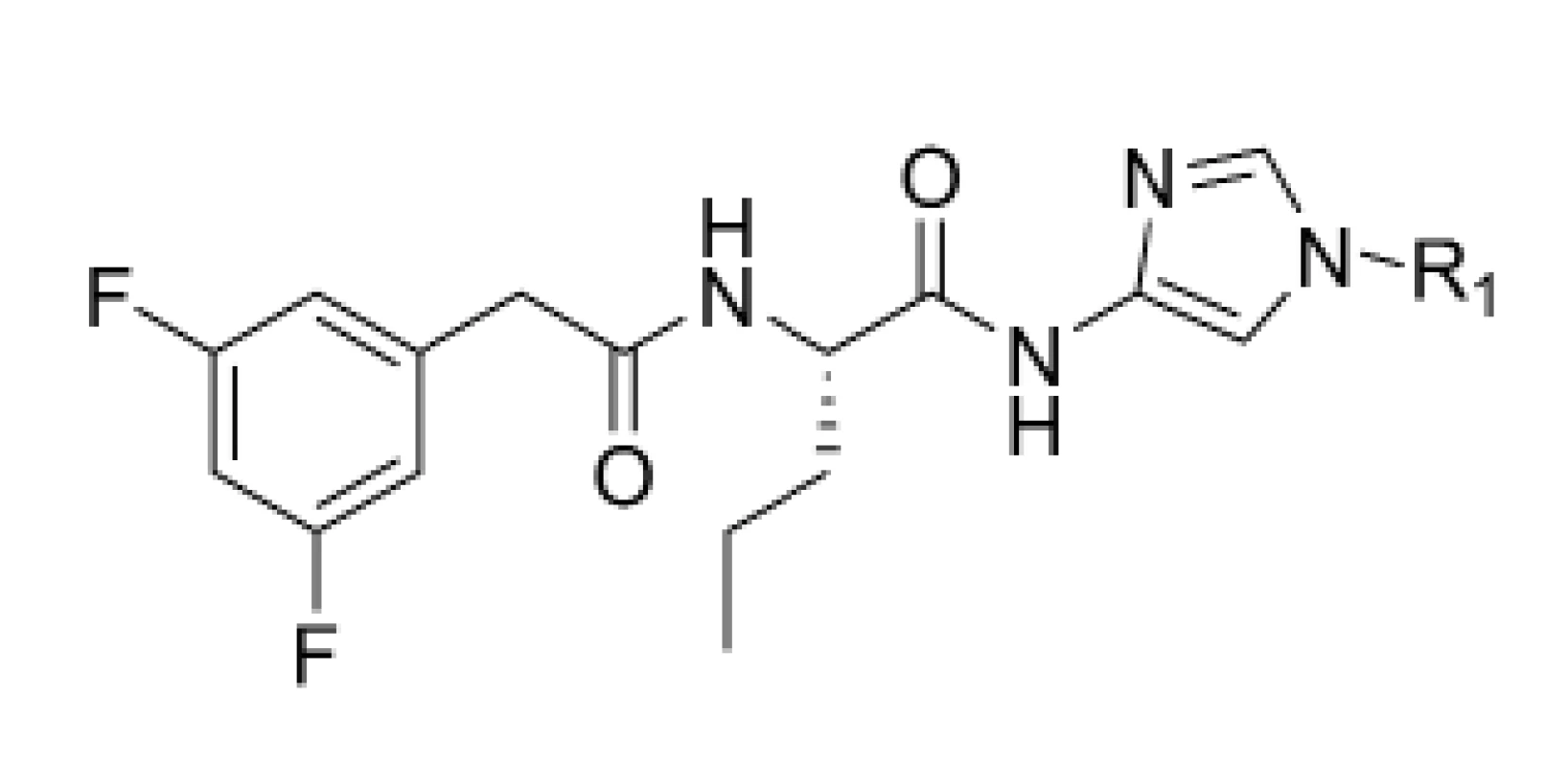
Tieto molekuly boli testované in vitro metódou na sledovanie ovplyvnenia hladiny Aß a aj in vivo metódou na morčatách14, 30). Zo série pripravených derivátov mali najlepšiu účinnosť deriváty 21, 22 a 23. Najlepšie hodnoty sú spájané s tým, že substituenty naviazané na molekule majú rozvetvený reťazec. Pri in vivo testovaní na morčatách v priebehu 3 hodín bola u derivátu 21 zaznamenaná 32% redukcia Aß40 a u pyrolidinového derivátu 22 to bola 43% redukcia Aß40 v mozgu. Pri naviazaní sekundárneho amínu mal najlepšiu hodnotu IC50 (1,1 nM) analóg 23. Pri tomto analógu sa zistila 60% redukcia amyloidu v plazme a 50% v kortexe (tab. 4). In vivo štúdia naznačili nutnosť ďalšej optimalizácie selektívneho profilu alebo distribučných vlastností na získanie terapeutického indexu.
Tab. 4. In vitro a in vivo hodnotenie diamido-amino imidazolov<sup>28)</sup> 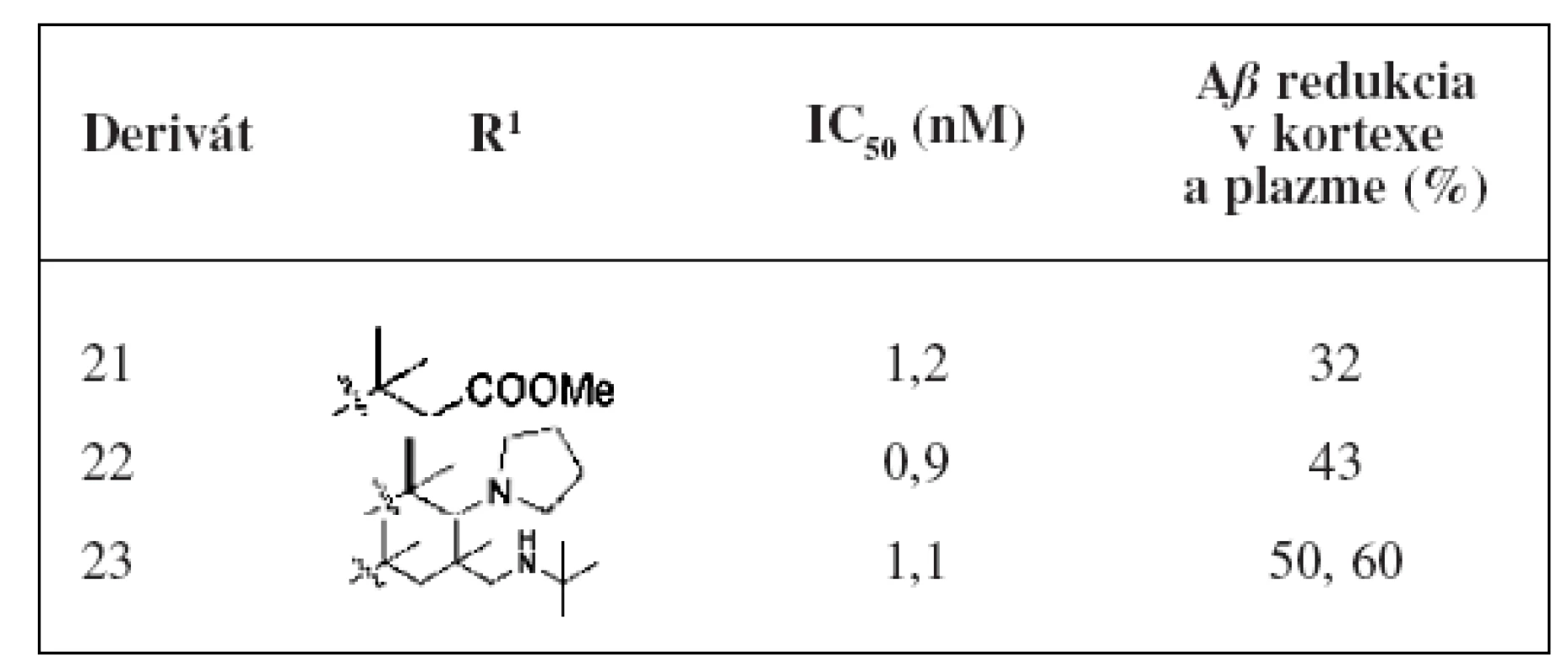
Analógy amino-kaprolaktámu predstavujú ďalšiu skupinu potenciálne účinných inhibítorov γ-sekretázy31). Tieto molekuly boli odvodené od amino-kaprolaktám-benzénsulfonamidu 24, ktorý mal priaznivú hodnotu IC50 (1,7 μM). Deriváty amino-kaprolaktámu, ktoré vykazovali priaznivé účinnosti, boli pripravené substitúciou benzylového kruhu u sulfonamidu 24 za inú funkčnú skupinu (obr. 7).
Obr. 7. Amino-kaprolaktámové inhibítory γ-sekretázy 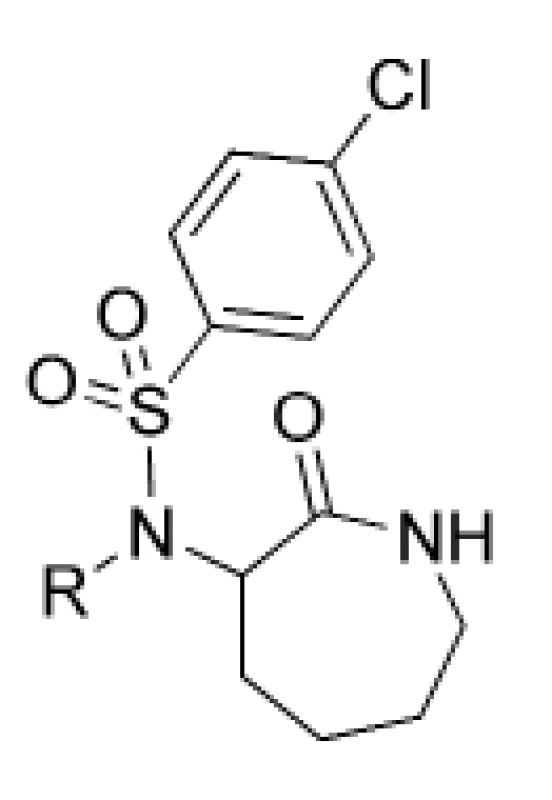
Najlepšie účinnosti dosiahli deriváty 25, 26 a 27. Kvôli priaznivým hodnotám IC50 boli pripravené aj analógy týchto troch derivátov. Substitúcia derivátu 25 poskytla analóg 28, ktorý ukazoval najlepšiu kombináciu účinnosti a selektivity, ale zaznamenal oxidačnú metabolickú nestabilitu. Benzylamid 29 má najlepšiu účinnosť (IC50 = 9 nM) a APP/Notch selektivitu. Tri analógy odvodené z derivátu 27 vykazovali nízku nanomolárnu účinnosť (tab. 5). Išlo o analógy 30, 31, 32 a boli poskytnuté na in vivo testovanie aj napriek svojej relatívnej APP/Notch selektivite.
Tab. 5. Hodnoty inhibiãnej aktivity a APP/Notch selektivity derivátov 24–32<sup>32)</sup> 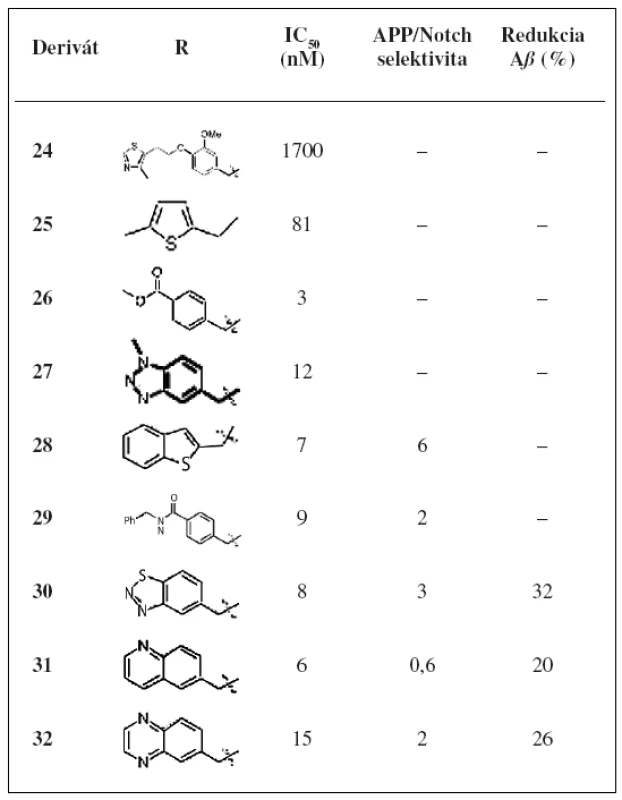
V tabuľke 5 sú tiež zobrazené 3 inhibítory γ-sekretázy, ktoré boli testované in vivo pre redukciu Aß40 v mozgu u myší. U všetkých troch inhibítoroch bola pozorovaná redukcia hladiny Aß40.
Táto séria inhibítorov γ-sekretáz dokázala, že okrem toho, že ide o látky, ktoré neovplyvňujú Notch, tak dokážu redukovať Aß v mozgu32).
Záver
Aß je vytváraný proteolytickými pochodmi z transmembránového peptidu APP. Tento peptid môže byť štiepený dvoma proteázami označovanými ako α a ß sekretázy. Dominantnú úlohu v priebehu AD preberá predovšetkým ß-sekretáza. Takéto štiepenie na N-konci vedie k tvorbe rozpustného fragmentu (sAPPß) a produktu spojeného s membránou, C-koncového fragmentu, ktorý následne podlieha hydrolýze za účasti γ-sekretázy vytvárajúcej Aß40 a Aß42. Účasť oboch enzýmov je pre patologický priebeh AD špecifická a vedie tak k tvorbe ß-amyloidných plakov. Z týchto dôvodov je venované značné úsilie k nájdeniu inhibítorov ß - s γ-sekretázy.
γ-sekretáza je nukleoproteínový komplex zložený zo 4 častí, presenilín (PS)-1 a (PS)-2 sa zdajú byť zodpovedné za enzymatické pochody zúčastňujúce sa štiepenia APP. Z predstavených látok dosiahlo 6 klinického testovania (LY-450139, MK-0752, BMS-708163, PF 3084014, GSI-953 a ELND-006) a ďalšie látky ako napr. amino-kaprolaktámové deriváty alebo bicyklické sulfónové pyrazoly sľubujú zaujímavý terapeutický profil. Napriek týmto faktom sa doteraz nepodarilo žiadny z inhibítorov γ-sekretázy zaviesť do klinickej praxe pre boj s AD.
Konflikt záujmu: žiadny.
Došlo 16. februára 2012 / Přijato 28. mája 2012
K. Špilovská, J. Korábečný, K. Kuča
Univerzita obrany Hradec Králové, Fakulta vojenského zdravotnictví, Katedra toxikologie
doc. Ing. Kamil Kuča, Ph.D.
Fakultní nemocnice Hradec Králové
Sokolská 581, 500 05 Hradec Králové, Česká republika
e-mail: kucakam@pmfhk.cz
K. Musílek
Univerzita Hradec Králové, Přírodovědecká fakulta, Katedra chemie
Zdroje
1. Alzheimer’s Association. 2011 Alzheimer’s disease facts and figures. Alzheimers Dement. 2011; 7, 208–244.
2. Lesne, S., Koh, M. T., Kotilinek, L., Kayed, R., Glabe, C. G., Yang, A., Gallagher, M., Ashe, K. H.: A specific amyloid-ß protein assembly in the brain impairs memory. Nature. 2006; 440, 352–357.
3. Shankar, G. M., Li, S., Mehta, T., Garcia-Munoz, A., Shepardson, N. E., Smith, I., Brett, F. M., Farrell, M. A., Rowan, M. J., Lemere, C. A., Regan, C. M., Walsh, D. M., Sabatini, B. L., Selkoe, D. J.: Amyloid-ß protein dimers isolated directly from Alzheimer’s brains impair synaptic plasticity and memory. Nat. Med. 2008; 14, 837–842.
4. Gordon, W. R., Arnett, K. L., Blacklow, S. C.: The molecular logic of Notch signaling - a structural and biochemical perspective. J. Cell. Sci. 2008; 121, 3109–3119.
5. Roberts S. B.: γ-Secretase inhibitors and Alzheimer’s disease. Adv. Drug. Deliver. Rev. 2002; 54, 1579–1588.
6. Imbimbo, B. P.: Therapeutic potential of γ-secretase inhibitors and modulators. Curr. Top. Med. Chem. 2008; 8, 54–61.
7. Lleo, A.: Activity of γ-secretase on substrates other than APP. Curr. Top. Med. Chem. 2008; 8, 9–16.
8. Tolia, A., De Strooper, B.: Structure and function of γ-secretase. Semin. Cell. Dev. Biol. 2009; 20, 211–218.
9. Imbimbo, B. P., Giarda, G. A. M.: γ-Secretase Inhibitors and Modulators for the Treatment of Alzheimer’s Disease: Disappointments and Hopes. Curr. Top. Med. Chem. 2011; 11, 1555–1570.
10. Serneels, L., Van Biervliet, J., Craessaerts, K., Dejaegere, T., Horre, K., Van Houtvin, T., Esselmann, H., Paul, S., Schafer, M. K., Berezovska, O., Hyman, B. T., Sprangers, B., Sciot, R., Moons, L., Jucker, M., Yang, Z., May, P. C., Karran, E., Wiltfang, J., D’hooge, R., De Strooper, B.: γ‑Secretase heterogeneity in the Aph1 subunit: relevance for Alzheimer’s disease. Science. 2009; 324, 639–642.
11. Guardia-laquarta, C., Pera, M., Lleo, A.: Gamma-secretase as a therapeutic target in Alzheimer’s disease. Curr. Drug. Targets. 2010; 11, 506–517.
12. Zheng, M., Wang, J., Lubinski, J., Flint, O. P., Krishna, R., Yao, M., Pursley, J. M., Thakur, A., Boulton, D. W., Santone, K. S., Barten, D. M., Anderson, J. J., Felsenstein, K. M., Hansel, S. B.: Studies on the pharmacokinetics and metabolism of a gamma-secretase inhibitor BMS-299897, and exploratory investigation of CYP entyme induction. Xenobiotica. 2009; 39, 544–555.
13. Henley, D. B., May, P. C., Dean, R. A., Siemers, E. R.: Development of semagacestat (LY450139), a functional gamma-secretase inhibitor, for the treatment of Alzheimer’s disease. Expert Opin Pharmaco. 2009; 10, 1657–1664.
14. Lanz, T. A., Karmilowicz, M. J., Wood, K. M., Pozdnyakov, N., Du, P., Piotrowski, M. A., Brown, T. M., Nolan, C. E., Richter, K. E., Finley, J. E., Fei, Q., Ebbinghaus, C. F., Chen, Y. L., Spracklin, D. K., Tate, B., Geoghegan, K. F., Lau, L. F., Auperin, D. D., Schachter, J. B.: Concentration-dependent modulation of Aß in vivo and in vitro using the γ-secretase inhibitor, LY-450139. J. Pharmacol. Exp. Ther. 2006; 319, 924–933.
15. Imbimbo, B. P., Peretto, I.: Semagacestat, a gamma-secretase inhibitor for the potential treatment of Alzheimer’s disease. Curr. Opin. Investig. D. 2009; 10, 721–730.
16. Bai, F., Tagen, M., Colotta, C., Miller, L., Fouladi, M., Stewart, C. F.: Determination of the γ-secretase inhibitor MK-0752 in human plasma by online extraction and electrospray tandem mass spectrometry (HTLC-ESI-MS/MS). J. Chromatogr. B. 2010; 878, 2348–2352.
17. Gillman, K. W., Starrett, J. E., Parker, M. F., Xie, K., Bronson, J. J., Marcin, L. R., McElhone, K. E., Bergstrom, C. P., Mate, R. A., Williams, R., Meredith Jr., J. E., Burton, C. R., Barten, D. M., Toyn, J. H., Roberts, S. B., Lents, K. A., Houston, J. G., Zaczek, R., Albright, C. F., Decicco, C. P., Macor, J. E., Olson, R. E.: Discovery and evaluation of BMS-708163, a potent, selective and orally bioavailable γ-secretase inhibitor. Med. Chem. Lett. 2010; 1, 120–124.
18. Lanz, T. A., Wood, K. M., Richter, K. E., Nolan, C. E., Becker, S. L., Pozdnyakov, N., Martin, B. A., Du, P., Oborski, C. E., Wood, D. E., Brown, T. M., Finley, J. E., Sokolowski, S. A., Hicks, C. D., Coffman, K. J., Geoghegan, K. F., Brodney, M. A., Liston, D., Tate, B.: Pharmacodynamics and pharmacokinetics of the γ-secretase inhibitor PF-3084014. J. Pharmacol. Exp. Ther. 2010; 334, 269–277.
19. Martone, R. L., Zhou, H., Atchison, K., Comery, T., Xu, J. Z., Huang, X., Gong, X., Jin, M., Kreft, A., Harrison, B., Mayer, S. C., Aschmies, S., Gonzales, C., Zaleska, M. M., Riddell, D. R., Wagner, E., Lu, P., Sun, S. C., Sonnenberg-Reines, J., Oganesian, A., Adkins, K., Leach, M. W., Clarke, D. W., Huryn, d., Abou-Gharbia, M., Magolda, R., Bard, J., Frick, G., Raje, S., Forlow, S. B., Balliet, C., Burczynski, M. E., Reinhart, P. H., Wan, H. I., Pangalos, M. N., Jacobsen, J. S.: Begacestat (GSI-953): a novel, selective thiophene sulfonamide inhibitor of amyloid precursor protein γ-secretase for the treatment of Alzheimer’s disease. J. Pharmacol. Exp. Ther. 2009; 331, 598–608.
20. Quinn, K., Gullapalli, R. P., Merisko-Liversidge, E., Goldbach, E., Wong, A., Liversidge, G. G., Hoffman, W., Sauer, J. M., Bullock, J., Tonn, G.: A formulation strategy for gamma secretase inhibitor ELND006, a BCS class II compound: Development of a nanosuspension formulation with improved oral bioavailability and reduced food effects in dogs. J. Pharmacol. Sci. 2012; 101, 1462–1474.
21. Su, J., Tang, H., McKittrick, B. A., Xu, R., Clader, J. W., Greenlee, W. J., Hyde, L., Zhang, L.: Synthesis and SAR study of tricyclic sulfones as γ-secretase inhibitors: C-6 and C-8 positions. Bioorg. Med. Chem. Lett. 2011; 21, 3447–3451.
22. Zhang, L., Song, L., Terracina, G., Liu, Y., Pramanik, B., Parker, E.: Biochemical characterization of the gamma-secretase activity that produces beta-amyloid peptides. Biochemistry. 2001; 40, 5049–5055.
23. Hyde, L. A., McHugh, N. A., Chen, J., Zhang, Q., Manfra, D., Nomeir, A. A., Josien, H., Bara, T., Clader, J. W., Zhang, L., Parker, E. M., Higgins, G. A.: Studies to investigate the in vivo therapeutic window of the gamma-secretase inhibitor N2-[(2S)-2-(3,5-difluorophenyl)-2-hydroxyethanoyl]-N1-[(7S)-5-methyl-6-oxo-6,7-dihydro-5H-dibenzo[b,d]azepin-7-yl]-L-alaninamide (LY411,575) in the CRND8 mouse. J. Pharmacol. Exp. Ther. 2006; 319, 1133–1143.
24. Aubele, D. L., Truong, A. P., Dressen, D. B., Probst, G. D., Bowers, S., Mattson, M. N., Semko, Ch. M., Sun, M., Garofalo, A. W., Konradi, A. W., Sham, H. L., Zmolek, W., Wong, K., Goldbach, E., Quinn, K. P., Sauer, J.-M., Brigham, E. F., Wallace, W., Nguyen, L., Bova, M. P., Hemphill, S. S., Basi, G.: Design, synthesis and structure-activity relationship of novel [3.3.1] bicyclic sulfonamide-pyrazoles as potent γ‑secretase inhibitors. Bioorg. Med. Chem. Lett. 2011; 21, 5791–5794.
25. Zhao, B., Yu, M., Neitzel, M., Marugg, J., Jagodzinski, J., Lee, M., Hu, K., Schenk, D., Yednock, T., Basi, G.: Identification of gamma-secretase inhibitor potency determinants on presenilin. J. Biol. Chem. 2008; 283, 2927–2938.
26. Truong, A. P., Aubele, D. L., Probst, G. D., Neitzel, M. L., Semko, C. M., Bowers, S., Dressen, D., Hom, R. K., Konradi, A. W., Sham, H. L., Garofalo, A. W., Keim, P. S., Wu, J., Dappen, M. S., Wong, K., Goldbach, E., Quinn, K. P., Sauer, J. –M., Brigham, E. F., Wallace, W., Nguyen, L., Hemphill, S. S., Bova, M. P., Basi, G.: Design, synthesis, and structure-activity relationship of novel orally efficacious pyrazole/sulfonamide based dihydroquinoline gamma-secretase inhibitors. Bioorg. Med. Chem. Lett. 2009; 19, 4920–4923.
27. Ye, X. M., Konradi, A. W., Smith, J., Aubele, D. L., Garofalo, A. W., Marugg, J., Neitzel, M. L., Semko, C. M., Sham, H. L., Sun, M., Truong, A. P., Wu, J., Zhang, H., Goldbach, E., Sauer, J.-M., Brigham, E. F., Bova, M., Basi, G. S.: Discovery of a novel sulfonamide-pyrazolopiperidine series as potent and efficacious gamma-secretase inhibitors (Part II). Bioorg. Med. Chem. Lett. 2010; 20, 3502–3506.
28. Brodney, M. A., Auperin, D. D., Becker, S. L., Bronk, B. S., Brown, T. M., Coffman, K. J., Finley, J. E., Hicks, C. D., Karmilowicz, M. J., Lanz, T. A., Liston, D., Liu, X., Martin, B. –A., Nelson, R. B., Nolan, Ch. E., Oborski, Ch. E., Parker, Ch. P., Richter, K. E. G., Pozdnyakov, N., Sahagan, B. G., Schachter, J. B., Sokolowski, Sh. A., Tate, B., Van Deusen, J. W., Wood, D. E., Wood, K. M.: Diamide amino-imidazoles: A novel series of γ-secretase inhibitors for the treatment of Alzheimer’s disease. Bioorg. Med. Chem. Lett. 2011; 21, 2631–2636.
29. May, P. C., Altstiel, L. D., Bender, M. H., Boggs, L. N., Britton, T. C., Clemens, J. C., Czilli, D. L., Dieckman-Mcginty, D. K., Droste, J. J., Fuson, K. S., Gitter, B. D., Hyslop, P. A., Johnstone, E. M., Li, W. Y., Little, S. P., Mabry, T. E., Miller, F. D., Ni, B., Nissen, J. S., Porter, W. J., Potts, B. D., Reel, J. K., Stephenson, D., Su, Y., Shipley, L. A., Whitesitt, C. A., Yin, T., Audia, J. E.: Functional gamma-secretase inhibitors reduce beta-amyloid peptide levels in brain. J. Neurochem. 2001; 76, 173–181.
30. Lanz, T. A., Salatto, C. T., Semproni, A. R., Marconi, M., Brown, T. M., Richter, K. E., Schmidt, K., Nelson, F. R., Schachter, J. B.: Peripheral elevation og IGF-1 fails to alter Abeta clearance in multiple in vivo models. Biochem. Pharmacol. 2008; 75, 1093–1103.
31. Thompson, L. A., Liauw, A. Y., Ramanjulu, M. M., Kasireddy-Polam, P., Mercer, S. E., Maduskuie, T. P., Glicksman, M., Roach, A. H., Meredith, J. E., Liu, R. –Q., Combs, A. P., Higaki, J. N., Cordell, B., Seiffert, D., Zaczek, R. C., Robertson, D. W., Olson, R. E.: Synthesis and evaluation of succinoyl-caprolactam gamma-secretase inhibitors. Bioorg. Med. Chem. Lett. 2006, 16, 2357–2363.
32. Neitzel, M. L., Aubele, D. L, Marugg, J. L., Jagodzinski, J. J., Konradi, A. W., Pleiss, M. A., Szoke, B., Zmolek, W., Goldbach, E., Quinn, K. P., Sauer, J. –M., Brigham E. F., Wallace, W., Bova, M. P., Hemphill, S., Basi, G.: Amino-caprolactam γ-secretase inhibitors showing potential for the treatment of Alzheimer’s disease. Bioorg. Med. Chem. Lett. 2011; 21, 3715–3720.
Štítky
Farmácia Farmakológia
Článok vyšiel v časopiseČeská a slovenská farmacie

2012 Číslo 3-
Všetky články tohto čísla
- Pod ochranou sv. Dymphny – LIV. sympozium z historie farmacie a veterinární medicíny
- Modulácia leukotriénovej cesty – potenciálne ciele
- Mikrobiálne sekundárne metabolity ako inhibítory farmaceuticky významných oxidoreduktáz a transferáz
- Fenotypizace enzymů podílejících se na metabolismu léčiv
- SOLUTIO 2011
- Vysoce účinné potenciální antimykobakteriální látky proti Mycobacterium avium
-
Štúdium lokálnych anestetík – časť 197*
Vplyv xylitolu na farmaceutickú dostupnosť lidokaínu a tokové vlastnosti hydrogélov - Prof. RNDr. J. Čižmárik, PhD. – doctor honoris causa
- Doc. RNDr. Ingrid Tumová, CSc., jubiluje
- Životné jubileum docenta RNDr. Jozefa Sokolíka, CSc.
- Polyméry s molekulovými odtlačkami
- Extruze tavenin
- Inhibítory gamma-sekretázy v terapii Alzheimerovej choroby
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Fenotypizace enzymů podílejících se na metabolismu léčiv
- Extruze tavenin
- Modulácia leukotriénovej cesty – potenciálne ciele
- Doc. RNDr. Ingrid Tumová, CSc., jubiluje
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



