-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vplyv abiotickej elicitácie na produkciu sanguinarínu a aktivitu polyfenoloxidázy v suspenznej kultúre Eschscholtzia californica CHAM.
Effect of abiotic elicitation on the sanguinarine production and polyphenol oxidase activity in the suspension culture of Eschscholtzia californica CHAM.
Elicitation of plant in vitro cultures represents a biotechnological tool to improve the production of secondary metabolites. In this study, the effect of AgNO3 and CdCl2 on the sanguinarine production by the suspension culture of Eschscholtzia californica CHAM. was investigated. Elicitors were added to the cultures at the 14th day of subcultivation and their effect on the sanguinarine production was evaluated after a 48 h exposure. AgNO3 at the concentration of 0.075 mmol.l-1 and CdCl2 at the concentration of 4 mmol.l-1 induced a ca. 5.2 - and 5.6-multiple increase in sanguinarine synthesis, respectively. This amount represents probably the maximal production, because a further increase in the elicitors concentrations did not increase sanguinarine production. Both abiotic elicitors induced a polyphenol oxidase specific activity increase. Polyphenol oxidase is probably involved in the biosynthesis of sanguinarine at the level of dopamine formation. Dopamine is a precursor of (S)-norcoclaurine, the first intermediate with the benzylisoquinoline structure.
Keywords:
Eschscholtzia californica CHAM. • suspension cultures • abiotic elicitation • sanguinarine • polyphenol oxidase
Autoři: František Bilka; Andrea Balážová; Andrea Bilková; Ivana Holková
Působiště autorů: Katedra bunkovej a molekulárnej biológie liečiv ; Univerzita Komenského v Bratislave, Farmaceutická fakulta
Vyšlo v časopise: Čes. slov. Farm., 2013; 62, 169-173
Kategorie: Původní práce
Souhrn
Elicitácia rastlinných in vitro kultúr predstavuje biotechnologický nástroj na zvýšenie produkcie sekundárnych metabolitov. V tejto práci bol sledovaný vplyv elicitácie dusičnanom strieborným a chloridom kademnatým na produkciu sanguinarínu suspenznou kultúrou slncovky kalifornskej. Elicitory boli ku kultúram pridané na 14. deň subkultivácie a ich vplyv na tvorbu sanguinarínu bol vyhodnotený po 48 h pôsobení. AgNO3 v koncentrácii 0,075 mmol.l-1 a CdCl2 v koncentrácii 4 mmol.l-1 indukovali približne 5,2-, resp. 5,6-násobné zvýšenie tvorby sanguinarínu. Toto zvýšenie pravdepodobne predstavuje maximálny nárast, pretože zvýšenie koncentrácie elicitorov už k ďalšiemu nárastu produkcie sanguinarínu neviedlo. Použitie obidvoch elicitorov viedlo k zvýšeniu špecifickej aktivity polyfenoloxidázy. Polyfenoloxidáza je pravdepodobne zapojená do biosyntézy sanguinarínu na úrovni tvorby dopamínu, ktorý je prekurzorom S-norkoklaurínu, prvého intermediátu s benzylizochinolínovou štruktúrou.
Kľúčové slová:
Eschscholtzia californica CHAM. • suspenzné kultúry • abiotická elicitácia • sanguinarín • polyfenoloxidázaÚvod
Slncovka kalifornská (Eschscholtzia californica CHAM.) patrí do čeľade Papaveraceae. Rastliny tejto čeľade sa vyznačujú schopnosťou tvorby benzylizochinolínových alkaloidov, a preto sú zaujímavé pre farmaceutický priemysel i výskum. Slncovka kalifornská produkuje alkaloidy benzofenantridínového typu, z ktorých pre antimikróbny, protizápalový a cytotoxický účinok sa pre farmáciu zdá byť najperspektívnejším sanguinarín1, 2). K opatrnosti v používaní sanguinarínu v praxi viedli výsledky Hakima a kol.3), ktorí predpokladali, že sanguinarín sa metabolizuje na toxický benzo[c]akridín. Novšie práce však metabolizáciu sanguinarínu cez benzo[c]akridín nepotvrdili1, 4), a tým ho v podstate „rehabilitovali“. Je pravdepodobné, že prípadné riziká použitia sanguinarínu ako liečiva budú prehodnotené a postupne si sanguinarín nájde širšie uplatnenie v praxi. Požiadavku jeho prípravy vo veľkých množstvách môže splniť produkcia in vitro kultúrami slncovky kalifornskej. Spomedzi kultúr rastlín čeľade Papaveraceae sa práve slncovka ukazuje ako najvýkonnejší producent sanguinarínu5). Využitie bunkových kultúr na produkciu sekundárnych metabolitov má všeobecne rad výhod: Produkcia prebieha riadene, bez vplyvov počasia a ročného obdobia, vylúčené sú biologické vplyvy (mikroorganizmy, hmyz a pod.), selekciou je možné dosiahnuť vyššiu produkciu, proces možno automatizovať, a tak dosiahnuť kontinuálnu produkciu6-8). Dosiahnuť vyššiu produkciu sekundárnych metabolitov in vitro kultúrami rastlín umožňuje elicitácia vychádzajúca z faktu, že akumulácia sekundárnych látok v rastlinách je súčasťou ich obrannej reakcie voči patogénom alebo vplyvom prostredia9). Slncovka kalifornská a in vitro kultúry z nej odvodené sú tiež vhodným objektom pri štúdiu enzýmov, zúčastňujúcich sa biosyntézy alkaloidov benzofenantridínového typu.
Pokusná časť
Príprava a kultivácia suspenzných kultúr slncovky kalifornskej
Kalusové kultúry sme odvodili zo stonkových častí vyklíčených klíčencov slncovky kalifornskej. Semená sme opláchli 70% etanolom a následne 15% roztokom prípravku Savo (20 min). Po viacnásobnom opláchnutí sterilizovanou redestilovanou vodou sme semená umiestnili na agarovú živnú pôdu podľa Murashigeho a Skooga (MS pôda)10). Po dosiahnutí primeranej veľkosti sme stonkovú časť klíčencov narezali na cca 5 mm rezky, ktoré sme použili na odvodenie kalusu. Tvorbu kalusov sme indukovali kultiváciou na MS pôde obohatenej o kinetín (0,3 mg.l-1) a kyselinu α-naftyloctovú (2,0 mg.l-1).
Suspenzné kultúry sme pripravili z kalusových kultúr, ktoré sme za aseptických podmienok preniesli do Erlenmayerovych baniek s 50 ml tekutej živnej MS pôdy s kinetínom a kyselinou α-naftyloctovou. Kultiváciu sme realizovali za stáleho premiešavania na rotačnej trepačke (150 kmitov.min-1)), pri teplote 24–26 °C, relatívnej vlhkosti 75–80 % a difúznom osvetlení. Pasážovanie sme vykonávali po troch týždňoch kultivácie.
Elicitácia suspenzných kultúr dusičnanom strieborným a chloridom kademnatým
Na elicitáciu sme použili suspenzné kultúry v 14. dni subkultivácie (7. pasáž od prevodu na suspenznú kultúru). Dusičnan strieborný sme použili vo výsledných koncentráciách Ag1 = 0,015 mmol.l-1); Ag2 = 0,075 mmol.l-1 a Ag3 = 0,150 mmol.l-1. Chlorid kademnatý sme použili v koncentráciách Cd1 = 2 mmol.l-1; Cd2 = 4 mmol.l-1 a Cd3 = 8 mmol.l-1. Po 48 h od pridania elicitorov sme filtráciou oddelili samotnú čerstvú hmotu kultúry a živnú pôdu. Z každej kultúry sme 1 g použili na prípravu sušiny.
Stanovenie obsahu sanguinarínu
Sanguinarín sme zo suspenzných kultúr a živných pôd izolovali a identifikovali postupom podľa Bilkovej a kol.11). Kvantitatívne stanovenie sanguinarínu spektrofluorimetrickou metódou sme uskutočnili podľa Balažovej a kol.12). Množstvo vyprodukovaného sanguinarínu sme prepočítali na 1 g sušiny, resp. sanguinarín uvoľnený do prostredia sme vztiahli na celý objem prefiltrovanej živnej pôdy.
Príprava vzoriek na stanovenie aktivity polyfenoloxidázy (PPO)
Zo suspenzných kultúr sme odobrali vzorky o objeme cca 5 ml. Po krátkej centrifugácii (1000 g; 2 min) a odobratí supernatantu (živná pôda) sme usadené bunky zhomogenizovali v trecej miske v prítomnosti 2,5 ml fosforečnanového tlmivého roztoku (50 mmol.l-1; pH 6,5) s prídavkom 1% Tritonu X-100. Po prenesení homogenátu do skúmavky sme vzorku opakovane zmrazili (–20 °C) a rozmrazili a vystavili na 30 s pôsobeniu ultrazvuku. Supernatant, získaný po 15 min centrifugácii pri 12 000g (4 °C), sme použili ako hrubý enzýmový roztok.
Stanovenie aktivity polyfenoloxidázy
Aktivitu PPO sme vo vzorkách stanovili spektrofotometricky pri 475 nm. Substráty (dopamín, dihydroxyfenylalanín, pyrokatechol, tyrozín, tyramín) sme použili v koncentrácii 2 mmol.l-1. Jednotku enzýmovej aktivity (1 U) sme definovali ako zmenu absorbancie o 1,0 za min13-14). Michaelisove konštanty sme stanovili podľa Lineweavera a Burka15) za použitia substrátov v rozsahu koncentrácií od 0,5 do 10 mmol.l-1. Špecifické aktivity sme vypočítali po stanovení bielkovín podľa Bradfordovej16)
Purifikácia polyfenoloxidázy
Na purifikáciu PPO sme použili iónovýmennú chromatografiu. Na stĺpec DEAE-sefarózy (12 cm ⋅ priemer 15 mm) sme naniesli 2 ml hrubého enzýmového roztoku, získaného po zlúčení enzýmových roztokov, pripravených z kontrolných vzoriek. Po vsiaknutí vzorky sme stĺpec premývali fosforečnanovými tlmivými roztokmi (50 mmol.l-1; pH 6,5; rýchlosť prietoku cca 25 ml.h-1) s postupne sa zvyšujúcimi koncentráciami NaCl (0; 0,25; 0,5; 0,75 a 1 mmol.l-1). Prítomnosť bielkovín v zachytených frakciách sme monitorovali meraním absorbancie pri 280 nm.
Výsledky a diskusia
Stimulácia biotickými elicitormi (najčastejšie hydrolyzátmi fytopatogénnych húb) vedie k výraznému zvýšeniu tvorby sekundárnych metabolitov, tvorených danou rastlinnou in vitro kultúrou. Príprava biotického elicitora je však pomerne komplikovaná a časovo náročná 5, 12). Preto sme v tejto práci otestovali možnosť zvýšenia produkcie sanguinarínu kultúrami slncovky kalifornskej použitím dvoch anorganických solí, dusičnanu strieborného a chloridu kademnatého. Tieto abiotické elicitory sme použili v podobných koncentráciách, ako Tůmová a Polívková17), ktoré AgNO3 použili na zvýšenie produkcie flavonoidov kultúrou Ononis arvensis; resp. Siatka a kol. CdCl2 na stimuláciu tvorby kumarínov v suspenznej kultúre Angelica archangelica18). Dusičnan strieborný a chlorid kademnatý sme pridali k suspenzným kultúram v 14. deň subkultivácie. Množstvo sanguinarínu sme v kultúrach stanovili 48 h po pridaní elicitorov, kedy podľa prác11) a 19) hladiny sanguinarínu v elicitovaných kultúrach kulminujú. Produkciu sanguinarínu sme prepočítali na 1 g sušiny (obr. 1), pričom priemerné množstvo sušiny, získané v skupine neelicitovaných kultúr bolo 0,533 ± 0,076 g; v skupinách Ag1 až Ag3 0,545 ± 0,089 g; 0,492 ± 0,094 g a 0,487 ± 0,097 g; v skupinách Cd1 až Cd3 0,451 ± 0,041 g; 0,447 ± 0,074 g a 0,433 ± 0,081 g. Množstvo sušiny získané v kultúrach elicitovaných chloridom kademnatým sa zdá byť nižšie v porovnaní s ostatnými skupinami, avšak po vyhodnotení Studentovym nepárovým t-testom v programe STABEX/EXCEL sa tento rozdiel ukázal nesignifikantným. Znamená to, že kultúry slncovky kalifornskej sú pomerne odolné voči toxickému pôsobeniu kademnatých iónov – u suspenznej kultúry Angelica archangelica Siatka a spol.18) pozorovali pokles čerstvej i suchej hmotnosti už pri koncentrácii 50 μmol.l-1.
Obr. 1. Obsah sanguinarínu v sušine suspenzných kultúr slncovky kalifornskej K = neelicitované vzorky; Ag = vzorky elicitované dusičnanom strieborným vo výsledných koncentráciách: Ag1 = 0,015 mmol.l<sup>-1</sup>; Ag2 = 0,075 mmol.l<sup>-1</sup> a Ag3 = 0,150 mmol.l<sup>-1</sup>. Cd = vzorky elicitované chloridom kademnatým vo výsledných koncentráciách Cd1 = 2 mmol.l<sup>-1</sup>; Cd2 = 4 mmol.l<sup>-1</sup> a Cd3 = 8 mmol.l<sup>-1</sup>. (Hodnoty sú priemery ± štandardné odchýlky z piatich paralelných vzoriek.) Štatistické vyhodnotenie v porovnaní s kontrolnými vzorkami: * p < 0,05; ** p < 0,01; *** p < 0,001). 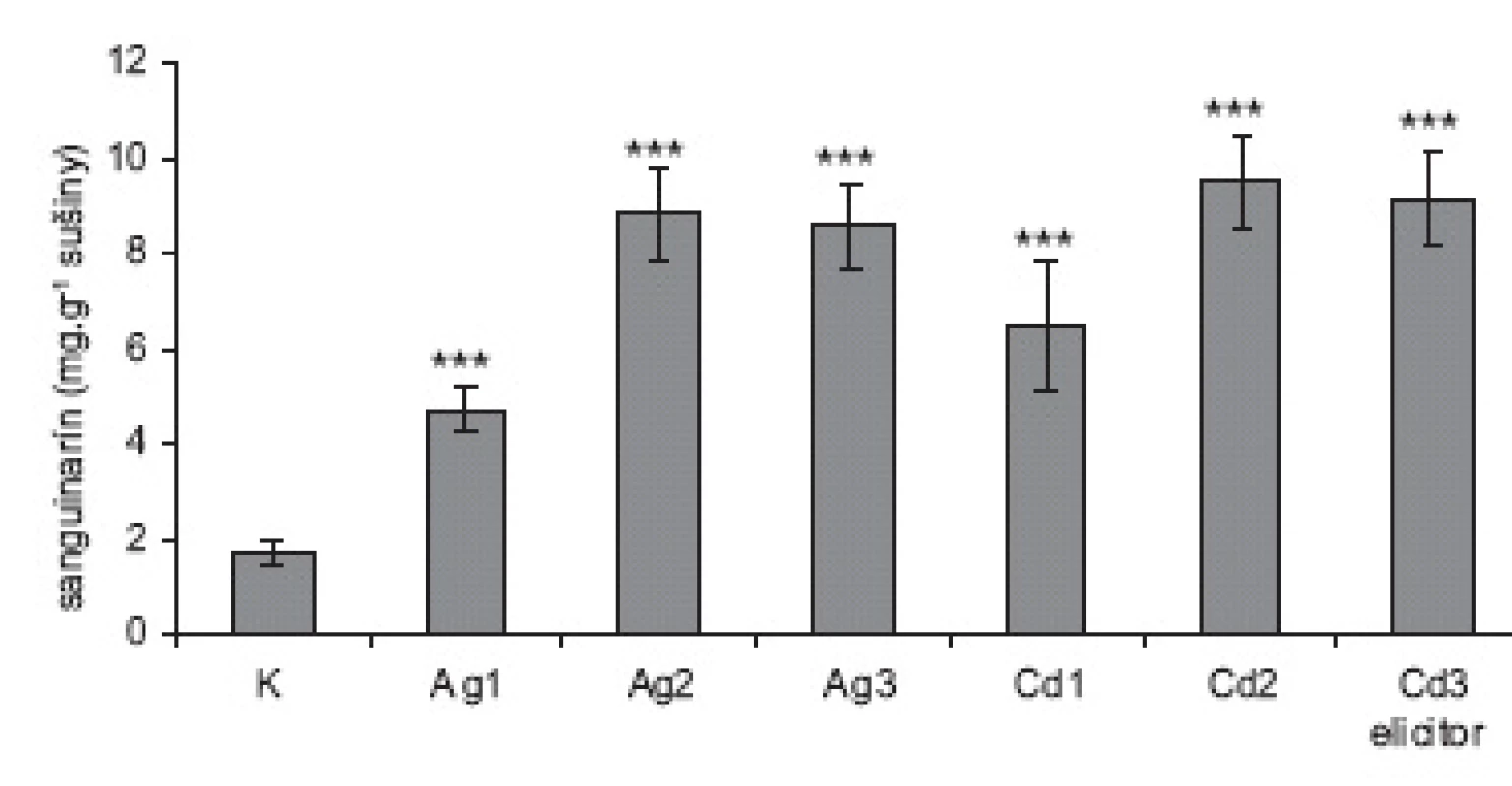
Obidva testované elicitory spôsobili výrazné zvýšenie syntézy sanguinarínu – vo vyšších koncentráciách bol tento nárast u oboch látok vyše päťnásobný (obr. 1). Chlorid kademnatý bol v koncentrácii 1 mmol.l-1. použitý na elicitáciu suspenznej kultúry maku siateho, avšak tvorba sanguinarínu sa zvýšila iba 2,3-násobne20). Ukázalo sa teda, že ani použitie štvor - a osemnásobne vyššej koncentrácie CdCl2 nemá toxický účinok na suspenzné kultúry, čo dokumentuje aj získané množstvo sušiny, ktoré sa signifikantne nelíši od neelicitovaných kultúr, ako aj množstvo sanguinarínu, uvoľneného do média (v kontrolných vzorkách 4,60 ± 0,32 μg; vo vzorkách Cd2 a Cd3 4,71 ± 0,51 μg, resp. 4,78 ± 0,49). Zvýšené uvoľňovanie sanguinarínu do média by naznačovalo zmeny v permeabilite membrán, resp. vo fyziológii bunkových kultúr. Použitie elicitorov v koncentráciách Ag3 a Cd3 už nevedie k zvýšeniu produkcie sanguinarínu v porovnaní s koncentráciami Ag2 a Cd2, skôr naznačuje mierny pokles, čo môže znamenať, že biosyntetická dráha je saturovaná a ďalšie zvyšovanie koncentrácie elicitora z hľadiska zvýšenia produkcie sanguinarínu nemá zmysel.
Slncovka kalifornská je rastlinou, ktorá sa využíva aj pri štúdiu enzýmov, zapojených do biosyntézy benzylizochinolínových, resp. benzofenantridínových alkaloidov. V roku 2000 Villegas a kol.19) publikovali prácu, v ktorej bola sledovaná korelácia medzi zvýšenou tvorbou benzofenantridínových alkaloidov a zvýšenou aktivitou tyrozíndekarboxylázy v kultúrach, elicitovaných vanadičnanom sodným. Elicitáciou indukované zvýšenie aktivity, resp. expresie pozorovali Hwa-Young a kol.21) aj u ďalších enzýmov, zapojených do tvorby benzylizochinolínov. Jedná sa konkrétne o (S)-norkoklaurín-6-O-methyltransferázu, (S)-koklaurín-N-methyltransferázu, 3´-hydroxy-(S) - N-methylkoklaurín-4´-O-methyltransferázu, berberín-premosťujúci enzým a dihydrobenzofenantridínoxidázu. V našej práci sme sa zamerali na sledovanie aktivity polyfenoloxidázy. Všeobecne sú rastlinné polyfenoloxidázy považované za enzýmy, zapojené do obranných mechanizmov. V intaktných rastlinách sú zodpovedné napr. za zacelenie rán – po poranení rastliny sa polyfenoloxidáza lokalizovaná v chloroplastoch dostane do kontaktu so substrátmi lokalizovanými vo vakuolách. Tento kontakt umožňuje vznik polyfenolov a od nich odvodených chinónov, ktoré sa spolupodieľajú na zacelení rany a zabránení vzniku sekundárnych infekcií22). U rastlín, ktoré produkujú benzylizochinolínové alkaloidy, je polyfenoloxidáza pravdepodobne zapojená do premeny tyramínu na dopamín. Zatiaľ nebol identifikovaný špecifický enzým, ktorý by katalyzoval túto reakciu. Dopamín ako aminokondenzačná jednotka následne reaguje so 4-hydroxyfenylacetaldehydom za tvorby norkoklaurínu, ktorý je prvým medziproduktom s benzylizochinolínovou štruktúrou23). Kultúry slncovky kalifornskej zareagovali na oba testované stresory zvýšením aktivity polyfenoloxidázy (obr. 2). Pri použití najnižších koncentrácií oboch stresorov (vzorky Ag1 a Cd1) sme v 24. h pozorovali zvýšenie špecifickej aktivity o 37 %, resp. 44 %; v 48. h je naznačený mierny nárast o ďalšie 3 %, resp. 7 %, avšak po štatistickom vyhodnotení sa tieto zvýšenia ukázali ako nesignifikantné. Použitie stresorov vo vyšších koncentráciách malo za následok výrazné zvýšenie špecifických aktivít PPO v oboch sledovaných časoch. Maximálny nárast aktivity sme zaznamenali vo vzorkách Ag2. Po 48 h pôsobenia stresora došlo k zvýšeniu aktivity oproti času 0 o 137 %. Toto zvýšenie aktivity pravdepodobne predstavuje hranicu, po ktorú je možné aktivitu PPO abiotickou elicitáciou zvýšiť, pretože pri najvyšších koncentráciách oboch stresorov sme nezaznamenali vyššie aktivity PPO.
Obr. 2. Vplyv abiotickej elicitácie na špecifickú aktivitu polyfenoloxidázy Vzorky boli odobraté pred pridaním elicitorov (čas 0) a v časoch 24 h a 48 h po pridaní elicitorov. K = neelicitované vzorky; Ag = vzorky elicitované dusičnanom strieborným vo výsledných koncentráciách: Ag1 = 0,015 mmol.l<sup>-1</sup>; Ag2 = 0,075 mmol.l<sup>-1</sup> a Ag3 = 0,150 mmol.l<sup>-1</sup>. Cd = vzorky elicitované chloridom kademnatým vo výsledných koncentráciách Cd1 = 2 mmol.l<sup>-1</sup>; Cd2 = 4 mmol.l<sup>-1</sup> a Cd3 = 8 mmol.l<sup>-1</sup>. Substrát: dopamín vo výslednej koncentrácii 2 mmol.l<sup>-1</sup>. (Hodnoty sú priemery ± štandardné odchýlky z piatich paralelných vzoriek). 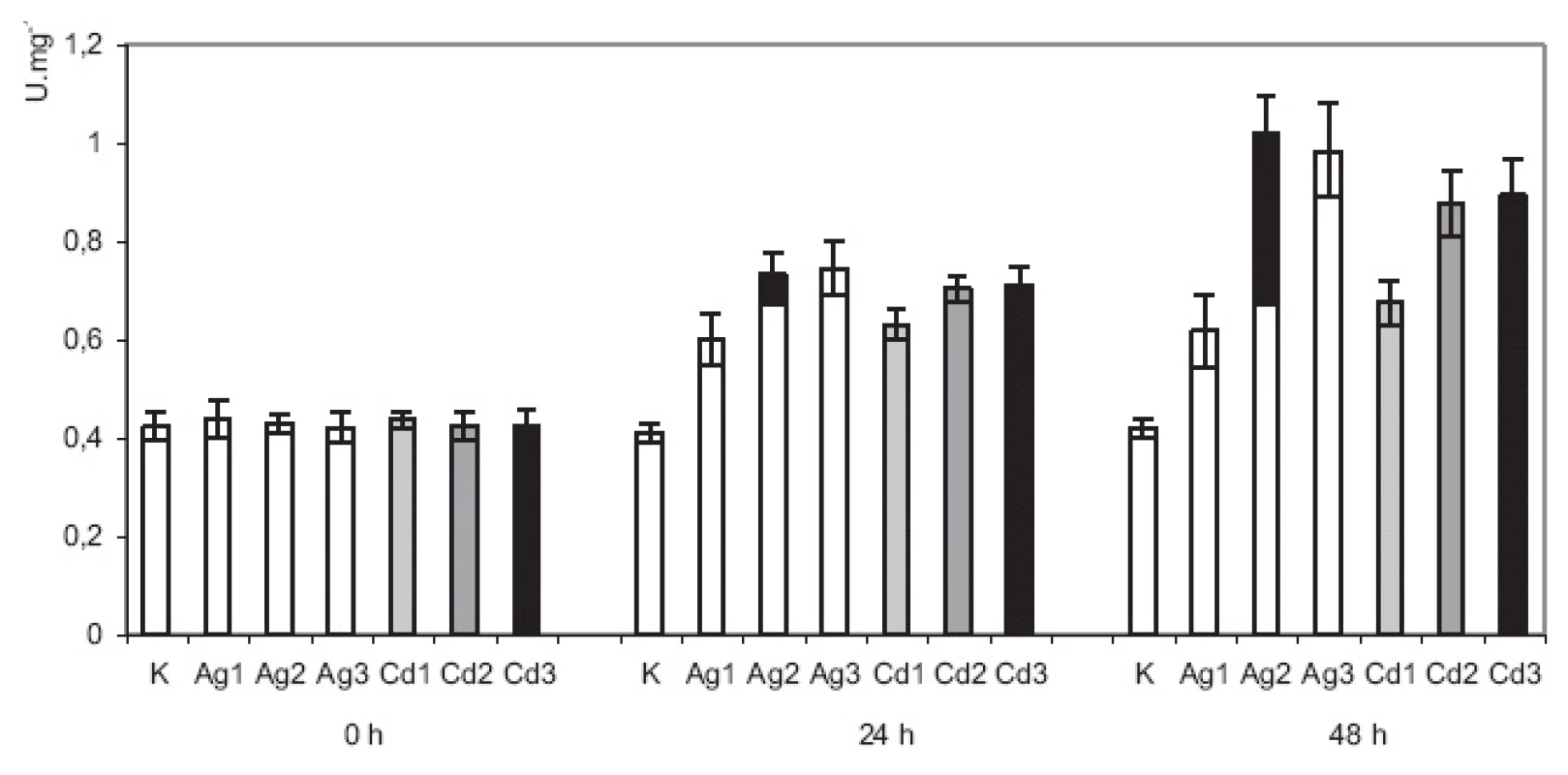
Iónovýmennou chromatografiou (obr. 3) sme v najprečistenejšej frakcii dosiahli 42-násobné zvýšenie špecifickej aktivity PPO (z 0,54 U.mg-1 bielkovín v hrubom homogenáte na 22,7 U.mg-1 vo frakcii č. 29). Prečistenú PPO sme použili na štúdium substrátovej špecifity. Ak aktivitu PPO 22,7 U.mg-1 so substrátom dopamínom považujeme za 100%, aktivita s dihydroxyfenylalanínom (14,5 U.mg-1) predstavuje 64 %, s pyrokatecholom (12,9 U.mg-1) 57 % a s tyramínom (3,2 U.mg-1) 14%. Aktivita PPO s tyrozínom bola veľmi nízka (0,35 U.mg-1) a predstavovala zhruba 1,5 % aktivity s dopamínom. Michaelisove konštanty, vypočítané podľa Lineweavera a Burka klesali v tomto poradí: pyrokatechol 15,8 mmol.l-1, tyrozín 14,2 mmol.l-1, dihydroxyfenylalanín 12,6 mmol.l-1, tyramín 9,8 mmol.l-1, dopamín 9,4 mmol.l-1.
Obr. 3. Purifikácia polyfenoloxidázy zo suspenzných kultúr slncovky kalifornskej na stĺpci DEAE-sefarózy Elúcia fosforečnanovými tlmivými roztokmi (50 mmol.l<sup>-1</sup>; pH 6,5) s postupne sa zvyšujúcimi koncentráciami NaCl (0; 0,25; 0,5; 0,75 a 1 mmol.l<sup>-1</sup>). Stĺpec: 12 cm × priemer 15 mm; rýchlosť prietoku cca 25 ml.h<sup>-1</sup>. Prítomnosť bielkovín v zachytených 2,5 ml frakciách monitorovaná meraním absorbancie pri 280 nm (A<sub>280</sub>); aktivita PPO meraná spektrofotometricky pri 475 nm (A<sub>475</sub>.min<sup>-1</sup>). Substrát: dopamín vo výslednej koncentrácii 2 mmol.l<sup>-1</sup> 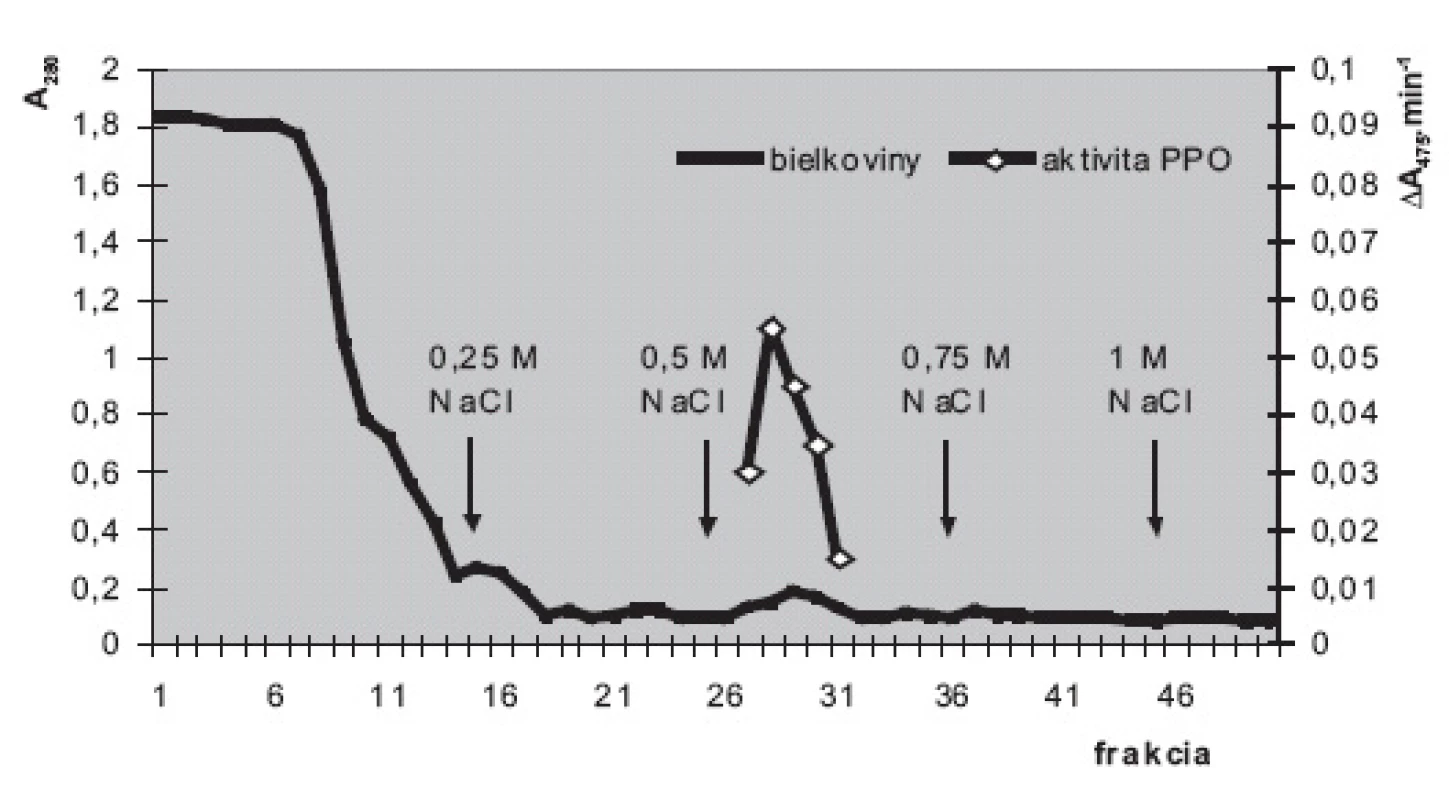
Stret záujmov: žiadny.
Došlo 8. dubna 2013
Přijato 9. května 2013
RNDr. František Bilka, PhD. (∗) • Andrea Balažová • Andrea Bilková • Ivana Holková
Univerzita Komenského v Bratislave, Farmaceutická fakulta
Katedra bunkovej a molekulárnej biológie liečiv
Kalinčiakova 8, 832 32 Bratislava, SR
e-mail: bilka@fpharm.uniba.sk
Zdroje
1. Zdařilová A., Malíková J., Dvořák Z., Ulrichová J., Šimánek V. Kvartérní isochinolinové alkaloidy sanguinarin a chelerythrin. Účinky in vitro a in vivo. Chem. Listy 2006; 100, 30–41.
2. Bilková A., Bilka F., Kiňová Sepová H., Balažová A. Testovanie potenciálne probiotických laktobacilov pre použitie vo výživových doplnkoch. Čes. slov. Farm. 2013; 62, 40–45.
3. Hakim S. A. E., Mijovič V., Walker J. Experimental transmission of sanguinarine in milk detection of a metabolic product. Nature 1961; 189, 201.
4. Dvořák Z., Šimánek V. Metabolism of sanguinarine: The facts and the myths. Current Drug Metabolism 2007; 8, 173–176.
5. Bilka F., Balažová A., Bilková A., Holková I. Porovnanie produkcie sanguinarínu suspenznými kultúrami rastlín čeľade Papaveraceae. Čes. slov. Farm. 2012; 61, 267–270.
6. Sikyta B., Dušek, J. Biotechnologie pro farmaceuty. 3. vyd. Praha: Univerzita Karlova – Nakladatelství Karolinum 2001; 125 s.
7. Collin H. A. Secondary product formation in plant tissue cultures. Plant Growth Reg. 2001; 34, 119–134.
8. Verpoorte R., Contin A., Memelink J. Biotecnology for the production of plant secondary metabolites. Phytochemistry Rev. 2002; 1, 13–25.
9. Radman R., Saez T., Bucke C., Keshavarz T. Elicitation of plants and microbial cell systems. Biotechnol. Appl. Biochem. 2003; 37, 91–102.
10. Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum 1962; 15, 473–497.
11. Bilková A., Bilka F., Blanáriková V., Bezáková L. Effect of excess of cupric sulfate on sanguinarine formation and activities of amine oxidase and polyphenol oxidase in cell suspension cultures of Papaver somniferum. Biologia 2005; 60, 661–664.
12. Balažová A., Bilka F., Blanáriková V., Pšenák M. Zmeny obsahu sanguinarínu a aktivity polyfenoloxidázy vplyvom fungálneho elicitora v suspenzných kultúrach maku siateho Papaver somniferum L. Čes. Slov. Farm. 2002; 51, 182–185.
13. Escribano J., Cabanes J., Chazarra S., Garcıa-Carmona F. Characterization of monophenolase activity of table beet polyphenoloxidase. Determination of kinetic parameters on the tyramine/dopamine pair. J. Agric. Food Chem. 1997; 45, 4209–4214.
14. Bilka F., Vanko M., Balažová A., Bilková A., Holková I.: Charakterizácia polyfenoloxidázy z latexu lastovičníka väčšieho (Chelidonium majus L.). Čes. Slov. Farm. 2007; 56, 90–94.
15. Lineweaver H., Burk D. The determination of enzyme dissociation constants. J. Amer. Chem. Soc. 1934; 56, 658–666.
16. Bradford M. M. A rapid and sensitive method for the quantication of microgram quantites of protein utiliting the principle of protein-dye binding. Anal. Biochem. 1976; 72, 248.
17. Tůmová L., Polívková D. Vliv AgNO3 na produkci flavonoidů kulturou Ononis arvensis L. in vitro. Čes. slov. Farm. 2006; 55, 186–188.
18. Siatka T., Kašparová M., Spilková J. Effects of zinc and cadmium ions on cell growth and production of coumarins in cell suspension cultures of Angelica archangelica L. Čes. slov. Farm. 2012; 61, 261–266.
19. Villegas M., Sommarin M., Brodelius P. E. Effects of sodium orthovanadate on benzophenanthridine alkaloid formation and distribution in cell suspension cultures of Eschscholtzia californica. Plant Physiol. Biochem. 2000; 38, 233–241.
20. Balažová A., Blanáriková V., Bilka F., Bilková A., Kiňová Sepová, H. Efekt troch rôznych elicitorov na produkciu sanguinarínu suspenznými kultúrami nízko-morfínovej odrody maku siateho (Papaver somniferum L.). Čes. slov. Farm. 2011; 60, 237–240.
21. Hwa-Young Ch., Rhee H. S., Yoon S. Y. H., Moon Park J. Differential induction of protein expression and benzophenanthridine alkaloid accumulation in Eschscholtzia californica suspension cultures by methyl jasmonate and yeast extract. J. Microbiol. Biotechnol. 2008; 18, 255–262.
22. Wahler D., Gronover Ch. S., Richter C., Foucu F., Twyman R. M., Moerschbacher B. M., Fischer R., Muth J., Prűfer D. Polyphenoloxidase silencing affects latex coagulation in Taraxacum species. Plant Physiol. 2009; 151, 334–346.
23. Bilková A., Bilka F., Bezáková L. Enzymológia tvorby benzylizochinolínových alkaloidov. Čes. slov. Farm. 2005; 54, 17–22.
Štítky
Farmácia Farmakológia
Článek Nové knihy
Článok vyšiel v časopiseČeská a slovenská farmacie

2013 Číslo 4-
Všetky články tohto čísla
- Vzácná onemocnění v Itálii: analýza nákladů a farmakoterapie
- Vývoj spoluúčasti pacienta na nákladech na farmakoterapii v letech 2008–2012
- Vplyv abiotickej elicitácie na produkciu sanguinarínu a aktivitu polyfenoloxidázy v suspenznej kultúre Eschscholtzia californica CHAM.
- Antioxidační aktivita extraktů a HPLC analýza flavonoidů Capsella bursa-pastoris (L.) Medik
- Obsahová stejnoměrnost směsí a tablet obsahujících warfarin
- Léky z barokní klášterní lékárny
-
XXXV. pracovní dny Radiofarmaceutické sekce
České společnosti nukleární medicíny ČLS JEP - Prof. RNDr. Ľudovít Krasnec – 100. výročie narodenia
- Prof. Ing. Jozef Lehotay, DrSc. – sedemdesiatnik
- Nové knihy
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Léky z barokní klášterní lékárny
- Obsahová stejnoměrnost směsí a tablet obsahujících warfarin
- Antioxidační aktivita extraktů a HPLC analýza flavonoidů Capsella bursa-pastoris (L.) Medik
- Vplyv abiotickej elicitácie na produkciu sanguinarínu a aktivitu polyfenoloxidázy v suspenznej kultúre Eschscholtzia californica CHAM.
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



